一种利用鱼罐头生产废弃液制备生物活性肽的方法与流程
本发明属于食品生物技术领域,具体涉及一种利用鱼罐头生产废弃液制备小分子量生物活性肽的方法。
背景技术:
抗氧化肽是一类具有抗氧化活性或还原活性的肽类总称,其可以清除机体产生的多余自由基,降低机体中过氧化物的含量和自氧化速率,有效防止由自由基累积造成的机体损伤。虽然从生物体内提取的天然抗氧化肽,如谷胱甘肽、肌肽和鹅肌肽等,可以直接被分离利用,但目前天然抗氧化多肽的提取远不能满足消费者对抗氧化剂的需求。
高血压是一种比较常见的心血管疾病,在全球尤其是发达地区每年都有20%左右的人被查出患有高血压,并且这一趋势还在逐年增长。当前,临床用药主要为:CCB(钙通道阻滞剂)、受体阻滞剂、利尿降压药剂等等,但是这些临床药物均带有一定程度的副作用,长期服用不利于人体健康。人体内的血压受多种因素作用,其中最重要的因素是降压系统-激肽释放酶-激肽系统(KKS)和升压系统-肾素-血管紧张素系统(RAS),血管紧张素转化酶(ACE)是调节上述2个系统的关键因素。ACE具有使血压增高的能力,如果能够抑制ACE的活性,那血压就能够降低。在30多年前,最早从天然蛇毒中发现具有ACE抑制活性的肽,而后从大豆蛋白、沙丁鱼、磷虾中陆续发现了能够抑制ACE活性的生物活性肽。
在鱼罐头生产过程中会产生大量蒸煮液,目前由于企业缺乏有效的技术手段,对富含蛋白质的鱼罐头加工蒸煮液利用很少,多数采用直接排放,这不仅造成资源的浪费,同时也对海洋和陆地环境造成严重的污染。
在此基础上,本发明以鱼罐头生产副产物——蒸煮液为原料,利用生物酶解技术制备生物活性肽,以实现鱼罐头生产废弃液的高值化利用,变废为宝,生产出各种农业、医药、食品等行业所需的活性肽类产品,且其可大大降低此类产品的生产成本,具有较高的经济、生态和社会效益。
技术实现要素:
本发明的目的在于提供一种利用鱼罐头生产废弃液制备小分子量生物活性肽的方法,以实现鱼罐头生产废弃液的高值化利用。
为实现上述目的,本发明采用如下技术方案:
一种利用鱼罐头生产废弃液制备生物活性肽的方法,是以鱼罐头生产废弃液为原料,采用复合酶(碱性蛋白酶和胰蛋白酶)对其进行水解,再经超滤膜分离,得到小分子量生物活性肽;
其具体是在鱼罐头生产废弃液中按7200~7500U/g的蛋白含量加入胰蛋白酶,于50~55℃、pH 7~8条件下反应4~5 h;再按6500~6800U/g的蛋白含量加入碱性蛋白酶,于55~60℃、pH 8~9条件下继续反应3~4h,所得酶解液采用超滤膜分离,得到分子量<1 KDa的生物活性肽。
所得生物活性肽具有抗氧化活性及ACE抑制活性,可用于制备抗氧化剂或ACE抑制剂。
本发明的显著优点在于:
(1)相比较于蛋白质和氨基酸,生物活性肽具有直接吸收、完全吸收、自主吸收等优点,具有很好的利用价值,尤其是分子量<1 KDa的小分子肽具有更强的生物活性。本发明以鱼罐头生产废弃液为原料,提供了一种利用碱性蛋白酶和胰蛋白酶复合水解鱼罐头蒸煮液蛋白的工艺方法,其不仅有利于实现鱼罐头生产废弃液的高值化利用,且可大大降低生物肽类产品的生产成本,具有较高的经济、生态和社会效益。
(2)本发明使用复合酶分段酶解,可大大提高制备生物活性肽的能力,且所得小分子肽段(MW<1 KDa)具有良好的抗氧化活性和ACE抑制活性。
附图说明
图1为不同复合酶反应体系对羟自由基抑制效果的影响。
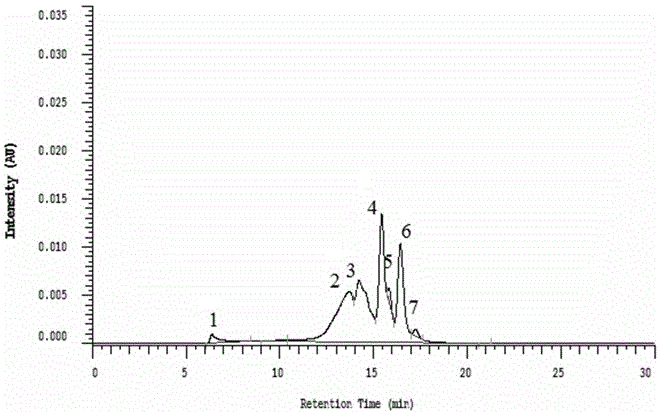
图2为复合酶酶解产物的高效液相色谱图。
图3为不同分子量组分对羟自由基的抑制效果随浓度变化的曲线。
图4为不同分子量组分对DPPH自由基的抑制效果随浓度变化的曲线。
图5为不同分子量组分的还原力随浓度变化的曲线。
图6为不同分子量组分对ABTS自由基的抑制效果随浓度变化的曲线。
图7为不同分子量组分对超氧阴离子自由基的抑制效果随浓度变化的曲线。
图8为不同分子量组分ACE抑制活性的高效液相色谱图,其中A为空白对照,B为加入P1组分,C为加入P2组分,D为加入P3组分。
图9为不同分子量组分的ACE抑制活性随浓度变化的曲线。
具体实施方式
以福州百洋海味食品有限公司提供的鱼罐头加工蒸煮液为原料;所用碱性蛋白酶(121847 U/g)、胰蛋白酶(125305 U/g)购自南宁庞博生物工程有限公司。
实施例1 复合酶反应体系的确定
碱性蛋白酶与胰蛋白酶复配的四种反应体系如表1所示,以羟自由基清除率为指标,考察不同反应体系的酶解效果,结果见图1。
表1 不同复合酶反应体系
如图1所示,体系4的效果最好,即先添加胰蛋白酶进行反应,反应温度为55 ℃,时间为4 h;再添加碱性蛋白酶进行反应,反应温度为60 ℃,时间为3 h,其对应的羟自由基抑制率高达61%,比碱性蛋白酶单酶水解结果(39.53%)提高了21.47%,比胰蛋白酶单酶水解结果(19.83%)提高了40.17%,并高于碱性蛋白酶和胰蛋白酶单酶酶解的效果叠加之和,说明使用此方案酶解制备的生物活性肽具有较好的抗氧化效果。
实施例2 复合酶酶解产物分子量分布
按7450 U/g的量在鱼罐头生产废弃液中加入胰蛋白酶,于55℃、pH 8条件下反应4 h;再按6755 U/g的量加入碱性蛋白酶,于60℃、pH 8条件下继续反应3h,使用TSK-gel G3000sw 色谱柱对酶解产物进行分子量大小分析,结果如图2、表2所示。
表2 复合酶酶解产物高效液相色谱分析结果
由表2可见,使用碱性蛋白酶和胰蛋白酶复合酶解后,产物中分子量<1 KDa的组分占50%,高于碱性蛋白酶单酶(30%)和胰蛋白酶单酶(28%)的酶解效果,说明使用分段复合酶解可大幅度提高小分子肽段的得率。
实施例3 复合酶酶解产物活性研究
采用不同截留量(10 KDa,3 KDa,1 KDa)的超滤膜对复合酶酶解产物进行分离,得到分子量<1 KDa(P1)、1 KDa-3 KDa(P2)、3 KDa-10 KDa(P3)的三个组分。
1. 抗氧化活性研究
1.1 羟自由基抑制实验
复合酶酶解产物中3个组分对羟自由基的抑制效果随浓度变化的曲线见图3。
由图3可见,3个组分对羟自由基均具有抑制效果,且其抑制率的增加与组分剂量呈现正相关性;其中,P1组分对羟自由基的抑制效果相对较好。
1.2 DPPH自由基抑制实验
复合酶酶解产物中3个组分对DPPH自由基的抑制效果随浓度变化的曲线见图4。
由图4可以看出,3个组分对DPPH自由基均具有抑制效果,且随着蛋白浓度增加,DPPH自由基抑制率也在不断的增大;当蛋白浓度达到3.5 mg/mL时,3个组分对DPPH自由基的抑制效果趋于稳定。
1.3 还原力测定实验
复合酶酶解产物中3个组分的还原力随浓度变化的曲线见图5。
如图5所示,在蛋白浓度达到3 mg/mL时,还原力对应吸光值增幅变缓慢趋于饱和,在4 mg/mL时对应的还原力值分别为P1:0.717,P2:0.599,P3:0.685,还原力效果为:P1>P3>P2。
1.4 ABTS自由基抑制实验
复合酶酶解产物中3个组分对ABTS自由基的抑制效果随浓度变化的曲线见图6。
由图6可以看出,3个组分对(ABTS+·)的抑制效果随蛋白浓度的增加而增加,在4 mg/mL时,P1组分的抑制率为27%,其次为P2组分为25%,P3组分为22%。
1.5 超氧阴离子自由基抑制实验
复合酶酶解产物中3个组分对超氧阴离子自由基的抑制效果随浓度变化的曲线见图7。
如图7所示,3个组分对超氧阴离子的抑制率随着浓度的增加基本呈线性增加,3个组分的抑制效果比较为:P1>P2>P3。
2. ACE抑制活性研究
测定原理为:HHL(马尿酰-组氨酰-亮氨酸)在ACE的催化下快速分解为马尿酸和一种二肽(HL,His-Leu),当加入具有抑制ACE活性的肽段时,ACE受到抑制,HHL分解受到抑制,导致马尿酸变少,故而可以通过使用高效液相色谱检测马尿酸的含量来评估活性肽对ACE活性的抑制效果,测定结果见图8。
从图8可以看出,空白对照的样品中主要成分为马尿酸,HHL的含量则很低,说明ACE未受到抑制;而加入不同组分活性肽后,ACE酶活性受到了不同程度的抑制,HHL反应生成的马尿酸含量明显下降。
图9为不同分子量组分的ACE抑制活性随浓度变化的曲线。
从图9可以看出,3个组分的ACE抑制活性随着浓度的增加而增加,且其对应的增长幅度越来越平缓,趋于饱和;对应抑制效果为:P1>P2>P3。
3. 小结
采用不同的方法分别测定复合酶酶解产物中3个组分的抗氧化活性和ACE抑制活性(以IC50表示),结果见表3。
表3 三种组分的IC50值(mg·mL-1)
由表3可以看出,本发明所获得小分子量生物活性肽具有良好的抗氧化活性和ACE抑制活性。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!