官能化发色聚合物点及其生物共轭体的制作方法
本申请要求2009年11月9日提交的美国临时申请第61/259,611号的权益,为所有目的明确通过参考完整地结合于此。
关于联邦资助下研究或开发所得发明的权利的声明
本发明是在美国政府支持下完成的,资助号为R21AG029574、R21CA147831和R01NS062725,由NIH授予。美国政府拥有本发明的一些权利。
关于在光盘上提交的“序列表”、表格或计算机程序清单附件的说明
无
发明背景
荧光探针在现代生物学和医学诊断中具有重要作用。小有机染料分子通常用于基于荧光的技术,如荧光显微法、流式细胞测量以及通用荧光分析和探测器。从历史上看,普通荧光团是荧光素、若丹明、香豆素和花青素等的衍生物。新生代荧光团如Alexa Fluor一般对光更稳定。但是,对于许多成像任务和超敏分析,它们的亮度和光稳定性无法提供足够的信号,以克服与细胞内的各种自发荧光和散射过程相关的背景。
其他因素如闪烁和饱和发射速率也会给高速、高通量荧光分析带来困难。
在理解生物系统方面的进步有赖于荧光显微法、流式细胞测量、通用细胞分析和生物探测器的应用(Pepperkok,R.;Ellenberg,J.Nat.Rev.Mol.Cell Biol.2006,7,690-696;Giepmans,B.N.G.;Adams,S.R.;Ellisman,M.H.;Tsien,R.Y.Science 2006,312,217-224)。这些实验方法大量使用有机染料分子作为探针。但是,常规染料的固有局限,如低吸收性和不佳的光稳定性,给进一步开发高灵敏成像技术和高通量分析带来困难(Resch-Genger,U.;Grabolle,M.;Cavaliere-Jaricot,S.;Nitschke,R.;Nann,T.Nat.Methods 2008,5,763-775;Fernandez-Suarez,M.;Ting,A.Y.Nat.Rev.Mol.Cell Biol.2008,9,929-943)。
因此,人们对开发亮度更高、光稳定性更好的荧光探针相当感兴趣。例如,无机半导体量子点(Q点)正处于活跃开发中,现在已能从生命技术公司(Life Technologies)[原英骏公司(Invitrogen)]购得。Q点是多重靶标检测的理想探针,因为它们具有宽激发带以及可调的窄发射峰。与常规有机染料相比,它们具有改进的亮度和光稳定性(Bruchez,M.;Moronne,M.;Gin,P.;Weiss,S.;Alivisatos,A.P.Science 1998,281,2013-2016;Chan,W.C.W.;Nie,S.M.Science 1998,281,2016-2018;Wu,X.Y.;Liu,H.J.;Liu,J.Q.;Haley,K.N.;Treadway,J.A.;Larson,J.P.;Ge,N.F.;Peale,F.;Bruchez,M.P.Nat.Biotechnol.2003,21,452-452;Michalet,X.;Pinaud,F.F.;Bentolila,L.A.;Tsay,J.M.;Doose,S.;Li,J.J.;Sundaresan,G.;Wu,A.M.;Gambhir,S.S.;Weiss,S.Science 2005,307,538-544)。但是,对于许多欠缺光子(photon-starved)的应用来说,Q点不够亮,因为它们的发射速率低,闪烁,非荧光点的比例大(Yao,J.;Larson,D.R.;Vishwasrao,H.D.;Zipfel,W.R.;Webb,W.W.Proc.Natl.Acad.Sci.USA 2005,102,14284-14289)。最近出现了开发无闪烁Q点的工作(Wang,X.Y.;Ren,X.F.;Kahen,K.;Hahn,M.A.;Rajeswaran,M.;Maccagnano-Zacher,S.;Silcox,J.;Cragg,G.E.;Efros,A.L.;Krauss,T.D.Nature 2009,459,686-689),但对于体内应用来说,重金属离子的析出给它们造成的毒性依然是严重的问题。
量子点是同一材料的无机半导体纳米晶体(例如CdSe/ZnS点),具有几纳米范围内的不同尺寸。由于量子约束效应,它们显示出范围可调的发光颜色。与常规染料相比,估计量子点的亮度高20倍,稳定性高100倍。但是,这些纳米粒子通常需要厚厚的包覆层,以达到所需水平的水溶性和生物相容性,因而对于粒度仅为3-6nm的活性荧光团粒子,纳米粒子的粒径约达15-30nm。包覆量子点的较大尺寸会显著改变生物分子的生物学功能和运输。量子点具有宽带吸收,且主吸收部分位于紫外区,这不适合多数基于激光的应用。量子点探针的另一个重要问题是它们因重金属Cd2+离子析出而具有毒性。紫外辐射能接近于CdSe纳米晶体的共价化学键能。因此,粒子会在公知的光解过程中溶解,将有毒的镉离子释放到细胞或亚细胞环境中。在为人的治疗目的而许可用于肿瘤或血管造影之前,必须对毒性问题严加审查。此外,低发射速率、闪烁和显著比例的非荧光点也带来潜在的问题,特别是对于单分子/粒子成像应用。
另一种荧光纳米粒子是掺染料的乳胶球,与单一荧光分子相比,它具有改进的亮度和光稳定性,因为每个粒子具有多个染料分子,并且具有保护性乳胶基体。(Wang,L.;Wang,K.M.;Santra,S.;Zhao,X.J.;Hilliard,L.R.;Smith,J.E.;Wu,J.R.;Tan,W.H.Anal.Chem.2006,78,646-654)但是,负载染料的珠粒也有很多局限,如自猝灭导致染料负载浓度有限(几个百分点),较大的粒度(>30nm)会将利用能量转移报告分析物浓度的探测方案排除在外。
从20年前被发现起,发光聚合物引起了广泛的兴趣。这些材料将聚合物的易加工性、突出的机械性能与半导体易调节的电学和光学性质结合起来,因而在发光二极管、场效应晶体管、光伏电池及其他光电子器件中具有广泛应用。在单光子和双光子激发之下,荧光聚合物点具有格外高的荧光亮度(Wu,C.;Szymanski,C.;Cain,Z.;McNeill,J.J.Am.Chem.Soc.2007,129,12904-12905.C.Wu,B.Bull,C.Szymanski,K.Christensen,J.McNeill,ACS Nano 2008,2,2415-2423)。在迄今为止的所有纳米粒子中,荧光聚合物点差不多具有最高的荧光亮度/体积比,因为半导体聚合物分子具有许多有利的特性,包括高吸收截面、高辐射率、高有效发色团密度和最低水平的聚集诱导荧光猝灭。用荧光聚合物点作为荧光探针还带来其他有用的优点,如没有可析入溶液的重金属离子。但是,要将这些探针用于生物成像或探测应用,还有一个重要问题需要解决,即表面官能化和生物共轭。
因此,仍然需要开发荧光聚合物点,使其表面上具有官能团,以便能够将探针用于生物系统。表面官能化应保持或提高疏水性聚合物点的荧光亮度或光稳定性,不改变聚合物点在水性环境中的尺寸和长期单分散性,使聚合物点能够进一步共轭连接到各种类型的分子上,防止或最大程度抑制聚合物点与其他生物分子的非特异性结合,使聚合物点能够在商业规模上低成本、高效地生产。通过提供稳定的官能化发色聚合物点(P点)和它们的生物共轭体及其他方面,本发明满足了上述及其他要求。
发明概述
本发明一方面涉及官能化发色聚合物点。上述官能化发色聚合物点具有发色聚合物核和带有一个或多个官能团的官能化试剂帽(cap)。
一方面,本发明提供了具有疏水性核和亲水性帽的官能化发色聚合物点。在一个实施方式中,官能化P点包含发色聚合物和两亲性分子,疏水性部分和亲水性部分连接到活性官能团上,其中发色聚合物嵌在P点的疏水性核内;一部分两亲性分子嵌在P点的核内,而活性官能团位于亲水性帽中。在一个优选的实施方式中,发色聚合物是半导体聚合物。
另一方面揭示了聚合物点的生物共轭体。所述生物共轭体通过将生物分子连接到发色聚合物点的一个或多个官能团上形成。所述连接可以是直接的,也可以是间接的。
又一方面揭示了制备官能化发色聚合物点的方法。所述方法包括将质子溶剂加入包含发色聚合物和官能化试剂(带有一个或多个官能团)的混合物的疏质子溶剂中。
一方面,本发明提供了制备官能化发色聚合物点的方法,所述方法包括以下步骤:(a)制备发色聚合物与连接到活性官能团上的两亲性分子在非质子溶剂中的混合物;(b)将全部或部分混合物注射到包含质子溶剂的溶液中,从而使发色聚合物和两亲性分子坍缩成纳米粒子;以及(c)从步骤(b)形成的混合物中除去非质子溶剂,从而形成官能化发色聚合物点的悬浮液,其中一部分两亲性分子嵌在纳米粒子核中,而活性官能团位于纳米粒子表面上。
另一方面,本发明提供了将生物分子共轭连接到官能化发色聚合物点上的方法,所述方法包括:在适合将生物分子共轭连接到官能化发色聚合物点上的条件下,在包含聚乙二醇的溶液中对官能化发色聚合物点和生物分子进行温育,其中溶液中聚乙二醇的存在减少了生物分子在聚合物点表面上的非特异性吸附。
又一方面,本发明提供了在生物样品中标记靶分子的方法,所述方法包括使生物样品接触发色聚合物点,所述发色聚合物点共轭连接到与靶分子特异性结合的靶向部分上。
在另一个实施方式中,本发明提供了对细胞靶标进行生物正交标记的方法,所述方法包括使细胞靶标接触发色聚合物点,所述细胞靶标具有能参与生物正交化学反应的第一表面外露官能团。在一个特定的实施方式中,生物正交反应是用P点进行的点击化学反应(click chemistry reaction),所述P点带有能参与这种反应的活性官能团。
在又一个实施方式中,本发明提供了具有红移发射峰(red-shifted emission peak)的发色聚合物点。在一个实施方式中,红移P点在远红区具有峰值发射。在其他实施方式中,红移P点在近红外区具有峰值发射。在一个实施方式中,红移P点包含PFTBT聚合物。在某些实施方式中,聚合物点包含两种或更多种不同发色聚合物的掺混物。例如,在一个实施方式中,P点包含PFBT和PFTBT聚合物的掺混物。
附图说明
图1显示了制备本发明的官能化发色聚合物点及其生物分子共轭体的示意图。该示意图中画出了普通发色聚合物PFBT和两亲性官能化聚合物PS-PEG-COOH的化学结构。
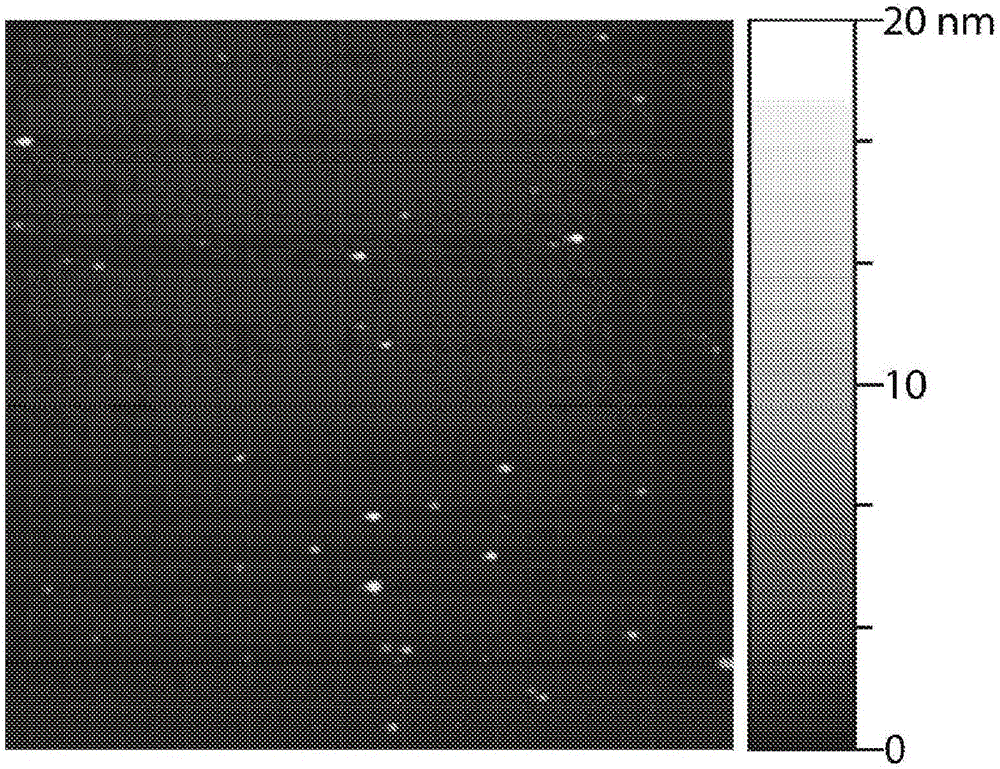
图2(A)显示了根据本发明方法制备的官能化发色PFBT点的原子力显微图(AFM)。(B)显示了从AFM图像得到的粒子高度柱状图。
图3显示了根据本发明方法制备的官能化发色PFBT点的吸收和发射光谱。
图4(A)显示了先用一级抗-EpCAM温育,然后用与二级抗小鼠IgG抗体共轭连接的发色PFBT点温育的SK-BR-3癌细胞的荧光共焦图像。(B)显示了用与二级抗小鼠IgG抗体共轭连接的发色PFBT点温育的SK-BR-3癌细胞的荧光共焦图像。在对照(B)中没有使用一级抗体。
图5(A)显示了先用抗微管蛋白生物素一级抗体温育,然后用与链霉亲和素共轭连接的发色PFBT点温育的MCF-7癌细胞的荧光共焦图像。(B)显示了先用生物素抗微管蛋白一级抗体温育,然后用裸PFBT点温育的MCF-7癌细胞的荧光共焦图像。用没有共轭连接链霉亲和素的PFBT点作为对照。
图6(A)显示了本发明的一般化CP点,其中核可以是半导体聚合物、含发色团的非半导体聚合物(如染料、金属络合物等)、含光学惰性聚合物或无机功能材料的半导体聚合物或者它们的组合;帽可以是带有官能团的小分子、带有官能团的表面活性剂、带有官能团的脂质或者带有官能团的聚合物。帽和核可通过化学键合或物理缔合的方式保持在一起。(B)显示了本发明的优选CP点,其中核可以是半导体聚合物、含发色团的非半导体聚合物(如染料、金属络合物等)、含光学惰性聚合物或无机功能材料的半导体聚合物或者它们的组合;帽包含具有疏水性部分和亲水性部分的两亲性聚合物。疏水性部分通过物理缔合或化学键合的方式嵌在核中,而拥有用于生物共轭连接的官能团的亲水性部分伸出来,以便进行生物共轭连接。
图7(A)官能化PFBT点的典型AFM图像。(B)从官能化PFBT点的AFM图像上得到的粒子高度的柱状图。(C)用生物素二氧化硅珠粒所做的试验,用来验证通过EDC催化共价偶联实现的生物共轭连接。(D)1×PBS缓冲液中的PFBT点-链霉亲和素生物共轭体在存放6个月之后的吸收和荧光谱图,内插图显示了P点-生物共轭体溶液在室光照射(左图)和紫外照射(右图)下的照片。
图8(A)PFBT点、(B)IgG-Alexa 488和(C)Q点565在相同激发条件下得到的单粒子荧光图。注意,IgG-Alexa和Q点565的色条必须设定为较低的值(8000个计数单位而不是60000个计数单位),因为它们明显比PFBT点暗。比例尺代表5μm。(D)在1mW的相同激发功率下观察,单P点跟单IgG-Alexa 488和单Q点的信号及背景对比。(E)在4mW的激发功率下,三种探针的单粒子荧光强度分布。P点约比IgG-Alexa 488或Q点亮约30倍。(F)单粒子光漂白轨迹。PFBT点(蓝色)未观察到闪烁,而Q点(红色)观察到频闪。
图9用P点生物共轭体标记的人乳癌细胞中细胞表面标记物(EpCAM)的荧光图像。(A)依次用抗EpCAM一级抗体和P点-IgG共轭体温育的活MCF-7细胞的图像。下方图片显示了单独用P点-IgG(无一级抗体)对细胞进行温育的对照样品。共焦荧光图像右侧显示了诺马斯基(Nomarski)(DIC)图像。比例尺代表20μm。(B)依次用抗EpCAM一级抗体、生物素化山羊抗小鼠IgG二级抗体和P点-链霉亲和素共轭体温育的活MCF-7细胞的图像。下方图片显示了用抗EpCAM抗体和P点-链霉亲和素(无二级抗体)对细胞进行温育的对照样品。共焦荧光图像右侧显示了诺马斯基(DIC)图像。比例尺代表20μm。
图10荧光标记癌细胞的流式检测。(A)使P点-链霉亲和素标记的MCF-7细胞流过微流控流式细胞仪得到的荧光强度分布;激光激发从0.1mW变化到0.5mW,再变化到1mW。(B)Q点565-链霉亲和素标记的MCF-7细胞在与(A)所用的相同实验条件下得到的荧光强度分布。(C)利用微流控流式细胞仪得到的用P点-链霉亲和素和Q点-链霉亲和素标记的细胞的平均荧光亮度对比。(D)利用P点-IgG和Alexa 488-IgG进行如(A-C)所述的相同实验和对比。
图11(A)通过使P点-IgG标记的MCF-7细胞流过微流控流式细胞仪得到的荧光强度分布;激光激发从0.1mW变化到0.5mW,再变化到1mW。(B)Alexa 488-IgG标记的MCF-7细胞在与(A)所用的相同实验条件下得到的荧光强度分布。
图12(A)Q点565-链霉亲和素标记的MCF-7细胞在低数值孔径宽场显微镜上得到的荧光图像。(B)P点-链霉亲和素标记的MCF-7细胞在与(A)所用的相同条件下得到的荧光图像。(C)P点标记的细胞与Q点标记的细胞的荧光强度分布对比。
图13通过TCSPC装置测量的PFBT点的荧光衰减寿命(0.6ns)。蓝线代表实验数据,绿线代表利用迭代反卷积法得到的拟合曲线。曲线下方显示了残差(红线)。
图14用于生物正交标记的荧光半导体聚合物通过点击化学法进行的官能化和共轭过程。共聚物PSMA与荧光半导体聚合物如PFBT(如绿线所示)共缩合,从而形成具有表面羧基的P点。羧基使表面能进一步共轭连接功能性分子,用于铜(I)催化的点击反应。官能化P点有选择地成为哺乳动物细胞中新合成的蛋白质或糖蛋白(蓝线)的靶标,所述哺乳动物细胞用生物正交化学报告子进行代谢标记。
图15羧基官能化PFBT点的吸收和荧光谱图。
图16 PFBT P点在pH为4-9的HEPES缓冲液中的荧光强度。未观察到明显的变化。
图17官能化P点的表征。(a)在铜(I)存在下,P点和Q点在紫外光照射下的荧光照片。(b)具有不同表面官能团的P点的迁移带(migration band)。(c)通过动态光散射测量的羧基官能化P点的流体力学直径;内插图显示了官能化P点的典型TEM图像。(d)利用炔-Alexa 594染料进行的荧光分析,证实P点成功地被叠氮基官能化。(e)通过点击反应偶联到叠氮基-P点上的炔-二氧化硅纳米粒子的单粒子荧光图像。比例尺代表50μm。
图18在经AHA处理并用P点-炔探针标识的MCF-7细胞中新合成的蛋白质的荧光图像。(a-d)在铜(I)存在下的正P点标记。(e-h)在与(a-d)相同的条件下进行对照样品中的P点标记,但不存在使铜(II)生成铜(I)的还原剂(抗坏血酸钠)。上排显示了荧光图像;绿色荧光来自P点,蓝色荧光来自核染色剂Hoechst 34580。下排显示了诺马斯基(DIC)图像以及DIC和荧光合并图像。比例尺代表20μm。
图19在与图18a-18d相同的条件下进行铜(I)催化的P点-炔标识,但在未接触AHA的细胞中进行。在此对照例中,未观察到细胞标记。上排显示了荧光图像;蓝色荧光来自核染色剂Hoechst 34580;未观察到来自P点的荧光(右上图)。下排显示了诺马斯基(DIC)图像(左下图)以及DIC和荧光合并图像(右下图)。比例尺代表20μm。
图20在用P点-叠氮化物标识的MCF-7细胞中新合成的蛋白质的荧光图。(a-d)在经HPG处理的细胞中进行的铜(I)催化的阳性P点标记。(e-h)在与(a-d)相同的条件下进行对照样品中的P点标记,但在未接触HPG的细胞中进行。上排显示了荧光图像;绿色荧光来自P点,蓝色荧光来自核染色剂Hoechst 34580。下排显示了诺马斯基(DIC)图像以及DIC和荧光合并图像。比例尺代表20μm。
图21在经GalNAz处理并用P点-炔探针标识的MCF-7细胞中的糖蛋白的荧光图像。(a-d)在铜(I)存在下进行的阳性P点标记。(e-h)在与(a-d)相同的条件下进行对照样品中的P点标记,但不存在铜(I)。上排显示了荧光图像;绿色荧光来自P点,蓝色荧光来自核染色剂Hoechst 34580。下排显示了诺马斯基(DIC)图像以及DIC和荧光组合图像。比例尺代表20μm。
图22通过点击化学法进行生物共轭的三种方案。
图23基于聚芴聚合物的多色半导体聚合物点。虽然发射颜色可调至深红区,但主吸收在紫外区,以维持高荧光量子产率。主紫外吸收缘于芴单元占多数。左侧显示了这些聚合物的化学结构。
图24捕光聚合物PFBT、发红光聚合物PF-0.1TBT和官能共聚物PSMA共缩合,形成具有表面羧基的强荧光PB点。羧基使表面能进一步共轭连接肿瘤特异性肽配体CTX。
图25(A)PFBT和PF-0.1TBT聚合物的化学结构。(B)包含捕光PFBT给体聚合物和发红光PF-0.1TBT受体聚合物的PB点依赖于浓度的吸收光谱(左图)和发射光谱(右图)。在掺混比为0.6(PF-0.1TBT与PFBT之比)时,PB点在可见光区显示出宽吸收,并显示来自PFTBT的高效深红发射。上面显示了PFBT和PF-0.1TBT的化学结构。(C)量子产量(QY)标准DCM染料和PB点的吸收光谱(左图)和荧光发射光谱(右图)。将水中的PB点和甲醇中DCM的吸收均调节至0.1。荧光光谱在相同的光谱仪条件下获得。
图26(a)PB点的吸收和发射光谱。内插图显示了水性PB点溶液在室光照射(左图)和紫外光照射(右图)下的照片。(b)Q点655纳米晶体的单粒子荧光图像。比例尺=4μm。(c)PB点的单粒子荧光图像。图像在与Q点655相同的激发条件下获得,但90%的发射光用中性密度滤光片(OD=1)挡住,以免检测器饱和。比例尺=4μm。(d)单粒子荧光强度分布。PB点约比Q点655探针亮约15倍。(e)羧基官能化PB点的TEM图像。比例尺=100nm。(f)官能化且生物共轭的PB点的凝胶电泳。与不同生物分子共轭连接的PB点在琼脂糖凝胶中显示出发生位移的迁移带,表明成功地实现了官能化和生物分子共轭。
图 27分别包含捕光PFPV给体聚合物和两种发红光聚合物PF-0.1DHTBT、PF-0.1TBT的PB点的吸收光谱(左侧)和发射光谱(右侧)。左边显示了聚合物的化学结构。
图28通过时间相关单光子计数仪(TCSPC)测量的PB点的荧光衰减寿命(3.5ns)。黑线代表实验数据,红线是拟合曲线。
图29通过动态光散射法[马尔文(Malvern)Zetasizer NanoZS粒度仪]测得的PFBT/PFTBT共混PB点的粒度分布。
图30 PFBT/PFTBT共混PB点在pH为4-9的HEPES缓冲液中的荧光强度。未观察到明显变化。
图31(a)依次用抗EpCAM一级抗体、生物素化山羊抗小鼠IgG二级抗体和PB点-链霉亲和素共轭体温育的活MCF-7细胞的共焦图像。(b)在不用生物素化二级抗体的情况下,用于PB点细胞标记的阴性对照。a和b均显示了相衬图像(左图)和组合荧光图像(右图)。红色荧光来自PB点,蓝色荧光来自核染色剂Hoechst 34580。比例尺=40μm。(c)从连续激光扫描20分钟得到的共焦荧光图像提取的光漂白曲线。(d)PB点对MilliQ水中生物相关离子和ROS的荧光稳定性。所示的Q点655纳米晶体用作参照。每种金属离子的浓度是500μM。对于ROS稳定性试验,H2O2和氯的浓度分别为1×10-3和4×10-5。为防止凝聚,溶液含PEG。
图32利用PS-COOH官能化的PFBT P点检测Cu2+和Fe2+的示意图。首先用作为鳌合基团的PS-COOH对PFBT P点进行官能化(A)。加入Cu2+和/或Fe2+,使P点发生凝聚和猝灭(B)。通过在溶液中加入EDTA,可使Cu2+诱导的凝聚发生逆转,但因结合Fe2+而凝聚的P点无法重新分散(C)。中间的内插图显示了各溶液在365nm灯下的照片。
图33 PS-COOH/PFBT共混P点在加入Cu2+之前(A)和之后(B)的TEM图像,显示了羧基官能化P点的Cu2+诱导凝聚。比例尺是200nm。(C)P点在加入Cu2+之前和之后以及加入EDTA之后的动态光散射测量结果。通过DLS测得的PFBT/PS-COOH共混P点在水中和在含Cu2+的溶液中以及向含Cu2+的溶液中加入EDTA之后的流体力学直径。
图34不同离子(20μM)对含PS-COOH/PFBT共混P点和PFBT/PFTBT共混P点的溶液的荧光强度的影响。上面的图片显示了365nm灯下的每个样品。
图35(A)各种浓度的Cu2+离子对含PS-COOH/PFBT共混P点和PFBT/PFTBT共混P点的溶液的荧光的影响。Cu2+的浓度范围是0-30μM:黑线:0,红线:100nM,粉红线:500nM,金色线:1μM,深紫线:5μM,绿线:10μM,橘色线:20μM,蓝线:30μM。(B)540nm峰(来自PS-COOH/PFBT共混P点)与623nm峰(PFBT/PFTBT共混P点)之比与Cu2+浓度之间的关系曲线。红线是对数据的线性拟合(R2=0.992)。(C)被Cu2+离子(30μM)猝灭之后的P点荧光强度可通过加入30μM EDTA来恢复。
图36(A)各种浓度的Fe2+对PS-COOH/PFBT共混P点在540nm的荧光的影响;溶液同样包含PFBT/PFTBT共混P点(发射中心在623nm)作为内标。Fe2+的浓度是0-40μM:黑线:0,红线:10μM,绿线:15μM,粉红线:20μM,橘色线:25μM,蓝线:40μM。(B)540nm峰(来自PS-COOH/PFBT共混P点)与623nm峰(PFBT/PFTBT共混P点)之比与Fe2+浓度之间的关系曲线。红线是对数据的线性拟合(R2=0.996)。
图37近红外(NIR)染料掺杂和官能化的CP点(可互换称作P点)的制备。发色聚合物PFBT、两亲性聚合物PS-PEG-COOH和NIR染料在THF中混合在一起,在声波作用下于水中共沉淀,形成NIR染料掺杂的P点。P点基体能吸收蓝光,并将能量转移给掺杂的NIR染料(绿色箭头所示),然后掺杂的NIR染料产生强NIR荧光(红色箭头所示)。
图38 NIR染料掺杂和官能化的CP点(可互换称作P点)的表征。(A)NIR染料掺杂的P点的TEM图像。CP点的直径是18nm。比例尺:50nm。(B)通过DLS测得的NIR染料掺杂的CP点的数均直径。(C)琼脂糖凝胶电泳。将裸PFBT点、羧基PFBT点和NIR染料掺杂的CP点装入含0.7%琼脂糖和0.2%PEG的琼脂糖凝胶中,在20mM HEPES中以10V/cm的力移动15分钟。由于缺少羧基表面,裸PFBT点移动更慢。羧基PFBT点和NIR掺杂的CP点均在表面上包含羧基,移动更快。
图39 PFBT点、NIR染料和NIR染料掺杂的CP点(可互换称作P点)的激发和发射光谱。上图显示了PFBT点(带阴影的黑色虚线)和NIR染料(带阴影的深黄色虚线)的激发光谱,以及PFBT点(蓝色实线)和NIR染料(红色实线)的发射光谱。下图显示了NIR染料掺杂的CP点的激发(带阴影的黑色虚线)和发射(红色实线)。
图40 NIR染料掺杂的CP点(可互换称作P点)的荧光性质。(A)经历不同的NIR染料掺杂的NIR染料掺杂CP点的荧光光谱。(B)PFBT点(给体)的归一化发射光谱与NIR染料(受体)的归一化吸收光谱的重叠;给体与受体对之间的计算福斯特(Forster)半径(R0)是3.7nm。(C)CP点的荧光寿命测量。裸CP点的寿命是2.4ns(实验数据:绿点,拟合:蓝色实线),掺杂NIR染料后缩短至1.2ns(实验数据:红点,拟合:红色实线)。黑色实线代表内参比(IRF)。(D)P点基体中NIR染料的外加猝灭影响。未经染料掺杂的初始CP点(F0)与NIR染料掺杂的CP点(F)的荧光强度比与掺杂剂的浓度成正比(带误差线的空心点)。数据用斯特恩-沃尔墨(Stern-Volmer)方程拟合(实线)。(E)通过控制掺杂剂浓度来操纵NIR染料掺杂CP点的NIR发射。染料浓度的增加导致NIR发射减弱(红色柱)。带星号的黑色柱表示未经染料掺杂的CP点在546nm处的发射。
图41 CP点基体(可互换称作P点)内NIR染料的荧光促进。(A)游离NIR染料和掺杂NIR染料在450nm(蓝色柱)和763nm(黑色图案柱)激发的归一化荧光峰强度。游离NIR染料的荧光在THF中测量,其余的在20mM HEPES缓冲液(pH 7.4)中测量。(B)荧光纳米材料在相同粒子浓度下的荧光发射。(C)通过粒子浓度归一化的荧光纳米材料的峰强度。
图42 NIR染料掺杂CP点的泄漏试验。利用778nm(受体)和546nm(给体)处的荧光发射峰值比的变化,可以监视NIR染料的泄露情况。(A)在室温下,在20mM HEPES缓冲液(pH 7.4)中检测的染料泄露结果。NIR发射在72小时内保持不变(蓝色空心三角形),72小时后受体-给体比稍降(红色空心方块)。(B)在37℃人血浆中检测的染料泄露结果。血浆中测得的数据(蓝色空心三角形)与20mM HEPES缓冲液中测得的数据(红色空心方块)相当。
图43制备CP点温度探测器的示意图。
图44 CP点温度探测器的TEM(A)和动态光散射(B)。
图45 CP点温度探测器的吸收和发射光谱。
图46 CP点PFBT-RhB(A)和PFPV-RhB(B)探测器在不同温度下的发射光谱。
图47 CP点温度探测器的强度-温度曲线及其线性拟合。
图48 CP点温度探测器的强度比-温度曲线及线性拟合。
图49制备基于PPE P点的pH探测器的三条路径的示意图。(A)先在水中制备PS-SH/PPE共混P点,然后使之与FITC分子上的异硫氰酸酯部分反应。(B)先通过胺-异硫氰酸酯反应将FITC共轭连接到PS-NH2聚合物上,然后将所得的经荧光标记的PS聚合物与PPE聚合物掺混,形成PS-NH2-FITC/PPE共混P点。(C)先按与(A)相同的方式制备PS-SH/PPE共混P点,但随后偶联到荧光-5-马来酰亚胺上。PPE:聚(2,5-二(3’,7’-二甲基辛基)亚苯基-1,4-亚乙炔基;PS:聚苯乙烯聚合物;FITC:荧光素异硫氰酸酯。
图50(A)PPE P点(深紫色虚线)和FITC(黑色虚线)在水中的紫外-可见光谱;PS-SH/PPE共聚物(红色实线)、PS-SH-FITC/PPE共聚物(蓝色实线)和PS-NH2-FITC/PPE共混P点在pH=7的HEPES缓冲液中的发射光谱。右上角的内插图显示了PS-SH/PPE共混P点(左)和PS-SH-FITC/PPE共混P点溶液(右)在365nm紫外灯下的照片。(B)CP点pH探测器的透射电子显微图。(C)CP点寿命对比。
图51(A)P点(A)、(B)P点(B)和(C)P点(C)在5-8之间的不同pH下的荧光谱图(黑线:pH=8,红线:pH=7.5,蓝线:pH=7,绿线:pH=6.5,金色线:pH=6,棕色线:pH=5.5,粉红线:pH=5)。激发波长为390nm。
图52三种荧光共轭P点的pH敏感性和可逆性。(A)P点(A)(●)、P点(B)(■)和P点(C)(▲)的发射比(I513nm/I440nm)与pH的比例pH校正曲线。蓝线、黑线和红线分别是对P点(A)(R2=0.995)、P点(B)(R2=0.991)和P点(C)(R2=0.994)的数据的线性拟合。P点(A)、P点(B)和P点(C)的斜率分别是0.37、0.18和0.29。(B)当pH在5.0与8.0之间反复来回变化时P点(C)的强度比(I513nm/I440nm),说明pH检测的可逆性和重现性。
图53给体(即PPE)发射与受体(即FITC)吸收之间光谱重叠的图示;以及它们的计算福斯特距离Ro。(A)PS-SH-FITC/PPE共混P点的发射光谱(浅绿色虚线)和pH从5到8时FITC的激发光谱。为了更容易观察光谱的重叠,曲线下方的区域填充了颜色。(B)根据(A)所示的重叠积分,绘制了PPE-FITC在不同pH下的相应福斯特距离。
图54用PPE P点(A-C)和PS-SH-FITC/PPE共混P点(E-G)标记的海拉(HeLa)细胞的共焦扫描显微图像;及其分别示于(D)和(H)中的相应明视场图像。图(A)和(E)所示的蓝色荧光通过对P点在433-444nm之间的光谱区积分得到,而图(B)和(F)所示的绿色荧光通过在507-518nm之间积分得到。图(C)和(G)是蓝色荧光与绿色荧光的重叠。
图55用P点(B)(A-C)和P点(C)(E-G)标记的海拉细胞在λ激发=405nm时的共焦显微图像;它们相应的明视场图像分别示于(D)和(H)。图(A)和(E)中所示的蓝色通道通过对433-444nm之间的光谱区积分得到,而图(B)和(F)中的绿色通道在507-518nm之间得到。(C)和(G)中的图像是蓝色和绿色通道的重叠。内插图显示了单个海拉细胞的放大图。比例尺是20μm。
具体实施方式
导言
由于包括发光二极管、场效应晶体管和光伏器件在内的各种光电子应用,半导体聚合物成为引人瞩目的材料(参见例如Friend,R.H.;Gymer,R.W.;Holmes,A.B.;Burroughes,J.H.;Marks,R.N.;Taliani,C.;Bradley,D.D.C.;Dos Santos,D.A.;Bredas,J.L.;Loglund,M.;Salaneck,W.R.Nature 1999,397,121;Gunes,S.;Neugebauer,H.;Sariciftci,N.S.Chem.Rev.2007,107,1324-1338,其内容为所有目的通过参考完整地结合于此。)它们的吸引力在于将半导体易调节的电学和光学性质与聚合物的易加工性结合起来。人们还证实,水溶性半导体聚合物是高度灵敏的生物探测器和化学探测器(参见例如Chen,L.;McBranch,D.W.;Wang,H.L.;Helgeson,R.;Wudl,F.;Whitten,D.G.Proc.Natl.Acad.Sci.USA 1999,96,12287-12292;Fan,C.H.;Wang,S.;Hong,J.W.;Bazan,G.C.;Plaxco,K.W.;Heeger,A.J.Proc.Natl.Acad.Sci.USA USA 2003,100,6297-6301;Thomas,S.W.;Joly,G.D.;Swager,T.M.Chem.Rev.2007,107,1339-1386,其内容为所有目的通过参考完整地结合于此)。
由于半导体聚合物纳米粒子早就得到证实(Szymanski,C.;Wu,C.;Hooper,J.;Salazar,M.A.;Perdomo,A.;Dukes,A.;McNeill,J.D.J.Phys.Chem.B 2005,109,8543-8546;Wu,C.;Szymanski,C.;McNeill,J.Langmuir2006,22,2956-2960,其内容为所有目的通过参考完整地结合于此),此领域进展迅速,包括其复杂光物理性质的表征(参见例如Palacios,R.E.;Fan,F.R.F.;Grey,J.K.;Suk,J.;Bard,A.J.;Barbara,P.F.Nat.Mater.2007,6,680-685;Wu,C.;Zheng,Y.;Szymanski,C.;McNeill,J.J.Phys.Chem.C 2008,112,1772-1781;Wu,C.;McNeill,J.Langmuir 2008,24,5855-5861;Collini,E.;Scholes,G.D.Science 2009,323,369-373,其内容为所有目的通过参考完整地结合于此)及其在生物成像和高分辨率单粒子示踪方面的发展[参见例如Wu,C.等,J.J.Am.Chem.Soc.2007,129,12904-12905;Wu,C.等,.J.ACS Nano 2008,2,2415-2423;Wu,C.;等,Chem.Int.Ed.2009,48,2741–2745;Moon,J.H.等,Chem.Int.Ed.2007,46,8223-8225;Baier,M.C.等,Am.Chem.Soc.2009,131,14267-14273;Abbel,R.;等,J.Chem.Commun.2009,1697-1699;Pu,K.Y.等,Chem.Mater.2009,21,3816-3822;Yu,J.等,J.Am.Chem.Soc.2009,131,18410–18414;Howes,P.等,J.Am.Chem.Soc.2010,132,3989-3996;and Kim,S.等,Chem.Commun.46,1617-1619(2010),其内容为所有目的通过参考完整地结合于此]。
本发明的各个方面涉及一类称作官能化发色聚合物点(官能化CP点或P点)的新型官能化荧光探针及其生物分子共轭体,用于各种应用,包括但不限于流式细胞测量、荧光激活分选、免疫荧光、免疫组织化学、荧光多路技术、单分子成像、单粒子示踪、蛋白质折叠、蛋白质转动力学、DNA和基因分析、蛋白质分析、代谢物分析、脂质分析、基于FRET的探测器、高通量筛选、细胞成像、体内成像、基于荧光的生物分析如免疫分析和基于酶的分析,以及生物分析和测量中的各种荧光技术。
官能化发色聚合物点的独特性质的基础在于但不限于个体粒子的高荧光亮度、大吸收截面、高荧光量子产率、快发射速率、高偏振荧光、优异的光稳定性和易储存性。与合适的生物分子共轭连接后,探针可用于许多领域,包括但不限于流式细胞测量、荧光激活分选、免疫荧光、免疫组织化学、荧光多路技术、单分子成像、单粒子示踪、蛋白质折叠、蛋白质转动力学、DNA和基因分析、蛋白质分析、代谢物分析、脂质分析、基于FRET的探测器、高通量筛选、细胞成像、体内成像、基于荧光的生物分析如免疫分析和基于酶的分析,以及生物分析和测量中的各种荧光技术。
本发明的其他优点和特征将在以下描述中指出,其中一部分通过该描述不难理解,或者可通过实施本发明而了解。我们做实验验证了本发明,下面将在描述和实施例中结合附图进行阐述。
P点在单光子和双光子激发下均表现出格外高的荧光亮度。它们的亮度来自半导体聚合物分子的许多有利特性,包括其大吸收截面、快发射速率和高荧光量子产率。最近的研究也表明,作为荧光探针的P点是光稳定的,并且在不同细胞分析中没有细胞毒性(参见例如Wu,C.;Bull,B.;Szymanski,C.;Christensen,K.;McNeill,J.ACS Nano 2008,2,2415-2423;Pu,K.Y.;Li,K.;Shi,J.B.;Liu,B.Chem.Mater.2009,21,3816-3822;Rahim,N.A.A.;McDaniel,W.;Bardon,K.;Srinivasan,S.;Vickerman,V.;So,P.T.C.;Moon,J.H.Adv.Mater.2009,21,3492-3496,其内容为所有目的通过参考完整地结合于此)。
但是,对于广泛的生物应用而言,P点尚有一个重要的问题没有解决,即如何控制其表面化学性质和共轭连接生物分子。虽然人们在努力研究二氧化硅或磷脂包封时已经得到具有表面官能团的复合粒子(参见例如Wu,C.;Szymanski,C.;McNeill,J.Langmuir 2006,22,2956-2960和Howes,P.;Green,M.;Levitt,J.;Suhling,K.;Hughes,M.J.Am.Chem.Soc.2010,132,3989-3996),但迄今为止,在用P点标记细胞方面报告的所有结果大概都基于内噬作用(参见例如Wu,C.;Bull,B.;Szymanski,C.;Christensen,K.;McNeill,J.ACS Nano 2008,2,2415-2423;Pu,K.Y.;Li,K.;Shi,J.B.;Liu,B.Chem.Mater.2009,21,3816-3822;Howes,P.;Green,M.;Levitt,J.;Suhling,K.;Hughes,M.J.Am.Chem.Soc.2010,132,3989-3996;和Rahim,N.A.A.;McDaniel,W.;Bardon,K.;Srinivasan,S.;Vickerman,V.;So,P.T.C.;Moon,J.H.Adv.Mater.2009,21,3492-3496),与为有机荧光团和Q点建立的标记方法相比,这是效果和特异性差很多的方法。现在仍不清楚能否使P点探针具有足够的特异性,以识别细胞靶标,用于有效标记。目前,这个问题严重阻碍了P点在生物应用领域的广泛使用。
有利的是,本发明为P点的生物共轭连接和特异性细胞寻靶的相关问题提供了解决方案。一方面,本发明提供了通过共价键将P点连接到生物分子上的新型共轭连接方法,用来通过特异性抗原-抗体或生物素-链霉亲和素相互作用标记细胞靶标。这种官能化和生物共轭策略可容易地应用于任何疏水性荧光半导体聚合物。如本文提供的实施例所示,通过本文提供的方法共轭连接的P点生物共轭体可用于单粒子成像、细胞成像和流式细胞测量实验,并且阐述了它们相对于常规有机荧光团和Q点探针的优点。因此,此项工作为在生物应用领域采用各种高荧光、光稳定和无毒性P点生物共轭体开辟了一条新的实用路径。
一方面,本发明基于对P点进行官能化的新策略,包括在纳米粒子形成过程中疏水相互作用的驱动下,将多相聚合物链捕集到单点中。少量带官能团的两亲性聚合物与半导体聚合物共缩合,对纳米粒子表面进行修饰和官能化,用于后面与生物分子如链霉亲和素和免疫球蛋白G(IgG)的共价键共轭连接。P点生物共轭体可通过特异性的方式有效标记细胞靶标,如人乳癌细胞中的细胞表面标记物,而不发生任何可检测到的非特异性结合。单粒子成像、细胞成像和流式细胞测量实验表明,P点的荧光亮度比Alexa染料和量子点探针的荧光亮度高得多。这些超亮纳米粒子的成功生物共轭连接为将通用半导体聚合物应用于现代生物和生物医药中的各种荧光测量提供了新机遇。
一方面,提供了带有官能团的高荧光半导体聚合物点,所述官能团可通过共价键共轭连接生物分子。使这些P点官能化的策略基于在纳米粒子形成过程中疏水相互作用的驱动下,将多相聚合物链捕集到单点中。本文显示,少量带官能团的两亲性聚合物可与半导体聚合物共缩合,从而对纳米粒子表面进行修饰和官能化。接下来,利用标准碳二亚胺偶联化学技术,进行对生物分子如链霉亲和素和抗体的共价共轭连接。这些P点生物共轭体通过特异性方式有效标记活细胞和固定细胞中的细胞表面受体和亚细胞结构,而不发生任何可检测到的非特异性结合。进行单粒子成像、细胞成像和流式细胞测量,通过实验评价P点的性能,证明它们相比于Alexa-IgG和Q点探针的高细胞标记亮度。这些结果带来一类新的高荧光纳米粒子生物共轭体,可广泛用于以荧光为基础的生物检测。
定义
本文所用的术语“发色纳米粒子”或“发色聚合物点”是指包含一种或多种发色聚合物、已经坍缩成稳定的亚微米尺寸的粒子的结构。本发明提供的发色纳米粒子可通过本领域已知的使聚合物坍缩的任何方法形成,包括但不限于依赖于沉淀的方法,依赖于形成乳液(例如细乳液或微乳液)的方法,以及依赖于缩合的方法。在一个优选的实施方式中,发色纳米粒子通过纳米沉淀形成。
本文所用的“聚合物”是由至少两个重复结构单元构成的分子,这些单元一般通过共价化学键连接。聚合物一般具有伸长的分子结构,包含任选含有侧基的主链。它包括线形聚合物和支化聚合物,如星形聚合物、梳形聚合物、刷形聚合物、梯形聚合物和树枝形聚合物。
本文所用的术语“发色聚合物”是至少有一部分包含发色单元的聚合物。术语“发色团”具有它在本领域的普通含义。发色团吸收从紫外到近红外区的某个波长的光,可发射光,也可不发射光。
本发明中的“发色单元”包括但不限于具有离域π电子的结构单元,小有机染料分子单元,以及金属络合物单元。相应地,发色聚合物的例子包括含有带离域π电子的结构单元的聚合物,如半导体聚合物,含有小有机染料分子单元的聚合物,含有金属络合物单元的聚合物,以及含有它们的组合单元的聚合物。
本文所用的术语“官能团”是指能例如通过任何稳定的物理或化学缔合方式连接到发色聚合物上,从而使发色聚合物点的表面可用于共轭连接的任何化学单元。官能团的非限制性例子包括羧酸、氨基、巯基、叠氮基、炔、醛、羟基、羰基、硫酸根(硫酸酯)、磺酸根(磺酸酯)、磷酸根(磷酸酯)、氰酸根(氰酸酯)、琥珀酰亚胺酯、炔、张力炔(strained alkyne)、叠氮化物、二烯、烯烃、环辛炔、膦基、它们的取代衍生物及其组合。
本文所用的术语“官能化试剂”是指能例如通过任何稳定的物理或化学缔合方式连接到发色聚合物点的核上,在聚合物点表面上提供官能团的任何分子。
本文所用的术语“亲水性官能团”是指具有亲水性的官能团,或者与亲水性侧链或亲水性部分连接的疏水性官能团,所述亲水性侧链或亲水性部分使疏水性官能团更具亲水性,有利于疏水性官能团排布在发色聚合物点粒子表面上,而不是被包埋在发色聚合物点的疏水性核内部。可通过连接亲水性侧链或部分而更具亲水性的疏水性官能团的例子包括但不限于炔、应变炔、叠氮化物、二烯、烯烃、环辛炔和膦基,(对于点击化学)它们连接到亲水性侧链如PEG(聚乙二醇)上,或者连接到其他任何亲水性侧链上。
本文所用的术语“生物正交反应”是指能在生物系统内通过与外来探针发生高选择性反应而得到修饰的非天然、无扰动化学把柄(non-native,non-perturbing chemical handle)之间的共轭。最广为人知的生物正交反应方案称作点击化学。对于生物正交反应方案的综述,参见例如,Best MD,Biochemistry.2009年7月21日;48(28):6571-84,其内容为所有目的通过参考完整地结合于此。
本文所用的术语“点击化学”是本领域所广为人知的,它描述一系列异常可靠的自导向有机反应,如最广为人知的铜催化叠氮化物-炔[3+2]环加成。点击化学反应的非限制性例子可参见例如H.C.Kolb,M.G.Finn,K.B.Sharpless,Angew.Chem.Int.Ed.2001,40,2004和E.M.Sletten,C.R.Bertozzi,Angew.Chem.Int.Ed.2009,48,6974,其内容为所有目的通过参考完整地结合于此。
本文所用的术语“交联剂”用来描述能在相似或不同分子上的分子基团之间形成化学键,从而使分子共价结合的化合物。常见交联剂的例子是本领域所熟知的。参见例如《生物共轭技术》(Bioconjugate Techniques)[美国纽约学术出版社(Academic Press),1996年及以后版本],其内容为所有目的通过参考完整地结合于此。通过使用“连接剂”分子,例如抗生物素蛋白、链霉亲和素、中性抗生物素蛋白、生物素或类似分子,可使生物分子直接连接到单价发色聚合物点上。
本文所用的“抗体”是指一种多肽,它包含来自免疫球蛋白基因或其片段的构架区,所述免疫球蛋白基因或其片段与抗原发生特异性结合并识别抗原。广为人知的免疫球蛋白基因包括κ、λ、α、γ、δ、ε和μ恒定区基因,以及众多的免疫球蛋白可变区基因。轻链归为κ或λ。重链归为γ、μ、α、δ或ε,它们反过来将免疫球蛋白种类分别限定为IgG、IgM、IgA、IgD和IgE。通常,抗体的抗原结合区在结合的特异性及亲和性方面是最关键的。抗体可以是多克隆或单克隆的,来自血清、杂交瘤,或者重组克隆,也可以是嵌合抗体、灵长源抗体或人源化抗体。
示例性免疫球蛋白(抗体)结构单元包含四聚体。每个四聚体由两对相同的多肽链组成,每对有一条“轻”链(约25kD)和一条“重”链(约50-70kD)。每条链的N端限定约有100-110个或更多个氨基酸的可变区,这些氨基酸主要负责识别抗原。术语可变轻链(VL)和可变重链(VH)分别指这些轻链和重链。
抗体以例如完整的免疫球蛋白存在,或者以利用各种蛋白酶消化产生的许多明确的片段存在。因此,例如,胃蛋白酶消化铰链区中二硫键下方的抗体,产生Fab的二聚体F(ab)’2,Fab本身是通过二硫键与VH-CH1连接的轻链。F(ab)’2可在温和条件下还原,断开铰链区中的二硫键,从而将F(ab)’2二聚体转化为F(ab)’单体。F(ab)’单体实质上是带部分铰链区的Fab[参见《基础免疫学》(Fundamental Immunology)(Paul主编,第3版,1993年)]。虽然各种抗体片段是通过完整抗体的消化来定义的,但技术人员不难认识到,这种片段可通过化学方法或者利用重组DNA技术从头合成。因此,本文所用的术语抗体也包括通过修饰完整抗体所产生的抗体片段,或者利用重组DNA技术从头合成的抗体片段(例如单链Fv),或者利用噬菌体展示库(phage display libraries)识别的抗体片段[参见例如McCafferty等,Nature,348:552-554(1990)]。
官能化发色聚合物点
一方面,本发明提供了官能化发色聚合物点,所述官能化发色聚合物点包含核和帽。“核”包含至少一种发色聚合物。“帽”包含官能化试剂。官能化试剂通过物理结合或化学键合的方式连接到发色聚合物核上,并在发色聚合物点上提供用于生物共轭连接的表面官能团。在另一个实施方式中,官能化发色聚合物点仅包含与促进生物共轭连接的官能团共价连接的核。
一方面,本发明提供了包含核和帽的官能化发色聚合物点(P点),所述帽包含带有一个或多个官能团的官能化试剂,前提是所述帽不全是有机硅酸盐/酯。在一个具体实施方式中,帽不含有机硅酸盐/酯。
在一个实施方式中,本发明提供了一种官能化发色聚合物点,所述官能化发色聚合物点包含大小约为1-1000nm的发色聚合物核和两亲性官能化层,其中疏水性部分通过疏水性相互作用永久地锚定在聚合物点核上,而亲水性官能团如羧酸在溶液里延伸,供进一步进行生物共轭连接。
在一个具体实施方式中,本发明提供了具有疏水性核和亲水性帽的官能化发色聚合物点(P点),所述P点包含:(a)发色聚合物;以及(b)具有疏水性部分和连接到活性官能团上的亲水性部分的两亲性分子,其中发色聚合物嵌在P点的疏水性核内;一部分两亲性分子嵌在P点的核内,而活性官能团位于亲水性帽中。在一个优选的实施方式中,发色聚合物是半导体聚合物。
在本发明提供的发色聚合物点的一个实施方式中,活性官能团选自羧基、氨基、巯基、叠氮基、炔、醛、羟基、羰基、硫酸根(硫酸酯)、磺酸根(磺酸酯)、磷酸根(磷酸酯)、氰酸根(氰酸酯)、琥珀酰亚胺酯及其衍生物。在一个具体实施方式中,活性官能团是包含炔的部分、包含叠氮基的部分或者其他能通过点击化学反应共轭连接到分子上的部分。
在一个实施方式中,发色聚合物是半导体均聚物。许多半导体均聚物是本领域已知的,包括但不限于芴聚合物、亚苯基亚乙烯基聚合物、亚苯基聚合物、亚苯基亚乙炔基聚合物、苯并噻唑聚合物、噻吩聚合物、咔唑芴聚合物、硼-二吡咯亚甲基聚合物及其衍生物。表1给出了常见半导体聚合物及其衍生物的列表。
表1.半导体聚合物的非限制性例子
在另一个实施方式中,发色聚合物是包含至少两种不同发色单元的半导体共聚物。例如,发色共聚物可包含以给定比例存在的芴和苯并噻唑单元。用来合成半导体共聚物的典型发色单元包括但不限于芴单元、亚苯基亚乙烯基单元、亚苯基单元、亚苯基亚乙炔基单元、苯并噻唑单元、噻吩单元、咔唑芴单元、硼-二吡咯亚甲基单元及其衍生单元。不同的发色单元可隔开,如同在嵌段共聚物中那样,或者可以混合。本文所用的发色共聚物通过写出主要发色物质的识别符号来表示。例如,PFBT是包含一定比例的芴和苯并噻唑单元的发色聚合物。在一些情况下,用连字符标出次要发色物质的百分数,然后是次要发色物质的识别符号。例如,PF-0.1BT是包含90%PF和10%BT的发色共聚物。
在其他实施方式中,发色聚合物点包含半导体聚合物的掺混物。所述掺混物包含发色均聚物、共聚物和低聚物的任意组合。为了调节所得聚合物点的性质,例如为了使聚合物点获得所需的激发或发射光谱,可对用来形成聚合物点的发色聚合物发色聚合物掺混物加以选择。
在本发明提供了的发色聚合物点的一个实施方式中,官能化试剂是两亲性分子。在一些实施方式中,两亲性分子是已用官能团修饰的发色聚合物。例如,在一个实施方式中,本发明提供了具有疏水性核和亲水性帽的官能化发色聚合物点(P点),所述P点包含:(a)第一半导体聚合物;以及(b)与活性官能团连接的第二半导体聚合物,其中第一半导体聚合物嵌在P点疏水性核中;第二半导体聚合物的一部分嵌在P点的核内,而活性官能团位于亲水性帽中(也就是在P点的表面上)。
在另一些实施方式中,两亲性分子是非发色分子,例如非发色聚合物、脂质、碳水化合物或其他用活性官能团修饰的非发色分子。例如,在一个实施方式中,本发明提供了具有疏水性核和亲水性帽的官能化发色聚合物点(P点),所述P点包含:(a)半导体聚合物;以及(b)具有疏水性部分和连接到活性官能团上的亲水性部分的两亲性分子,其中半导体聚合物嵌在P点的疏水性核内;一部分两亲性分子嵌在P点的核内,而活性官能团位于亲水性帽中(也就是在P点的表面上)。
在一个具体实施方式中,两亲性聚合物是两亲性梳形聚合物,例如基于聚苯乙烯的梳形两亲性聚合物或者基于聚甲基丙烯酸甲酯的梳形聚合物。在另一个具体实施方式中,两亲性聚合物是苯乙烯-马来酸酐共聚物(PSMA)。
在一个具体实施方式中,两亲性聚合物是基于聚苯乙烯的梳形聚合物。基于聚苯乙烯的梳形聚合物的非限制性例子包括聚苯乙烯接枝丙烯酸,用羧基官能化的聚苯乙烯接枝环氧乙烷,用胺官能化的聚苯乙烯接枝环氧乙烷,用硫醇官能化的聚苯乙烯接枝环氧乙烷,用琥珀酰亚胺酯官能化的聚苯乙烯接枝环氧乙烷,用叠氮化物官能化的聚苯乙烯接枝环氧乙烷,用炔官能化的聚苯乙烯接枝环氧乙烷,用环辛炔官能化的聚苯乙烯接枝环氧乙烷,用酯官能化的聚苯乙烯接枝环氧乙烷,膦,聚苯乙烯接枝丁基醇,等等。在一个具体实施方式中,两亲性聚合物是聚乙二醇接枝的聚苯乙烯。在一个更具体的实施方式中,两亲性聚合物的聚乙二醇部分连接到一个或多个羧基上。在另一个具体实施方式中,两亲性聚合物是苯乙烯-马来酸酐共聚物。
在另一个实施方式中,两亲性聚合物是基于聚甲基丙烯酸甲酯的梳形聚合物。基于聚甲基丙烯酸甲酯的梳形聚合物的非限制性例子包括聚甲基丙烯酸甲酯接枝丙烯酸,用羧基官能化的聚甲基丙烯酸甲酯接枝环氧乙烷,用胺官能化的聚甲基丙烯酸甲酯接枝环氧乙烷,用硫醇官能化的聚甲基丙烯酸甲酯接枝环氧乙烷,用琥珀酰亚胺酯官能化的聚甲基丙烯酸甲酯接枝环氧乙烷,用叠氮化物官能化的聚甲基丙烯酸甲酯接枝环氧乙烷,用炔官能化的聚甲基丙烯酸甲酯接枝环氧乙烷,用环辛炔官能化的聚甲基丙烯酸甲酯接枝环氧乙烷,用酯官能化的聚甲基丙烯酸甲酯接枝环氧乙烷,用膦官能化的聚甲基丙烯酸甲酯接枝环氧乙烷,等等。
在又一个实施方式中,两亲性聚合物是包含羧基、胺、硫醇、酯、琥珀酰亚胺酯、叠氮化物、炔、环辛炔和/或膦基的梳形聚合物。
在一些实施方式中,两亲性聚合物是两亲性共聚物,例如(1)基于聚(甲基)丙烯酸的共聚物,如:丙烯酸-丙烯酰胺嵌段共聚物、丙烯酸-甲基丙烯酸甲酯嵌段共聚物、丙烯酸-N-异丙基丙烯酰胺嵌段共聚物、丙烯酸正丁酯-丙烯酸嵌段共聚物、丙烯酸钠-甲基丙烯酸甲酯嵌段共聚物、丙烯酸-甲基丙烯酸新戊酯嵌段共聚物、甲基丙烯酸甲酯-丙烯酸嵌段共聚物、甲基丙烯酸甲酯-甲基丙烯酸嵌段共聚物、甲基丙烯酸甲酯-N,N-二甲基丙烯酰胺嵌段共聚物、甲基丙烯酸甲酯-丙烯酸钠嵌段共聚物、甲基丙烯酸甲酯-甲基丙烯酸钠嵌段共聚物、甲基丙烯酸新戊酯-甲基丙烯酸嵌段共聚物、甲基丙烯酸叔丁酯-环氧乙烷嵌段共聚物、2-丙烯酰胺基-2-甲基丙磺酸-丙烯酸嵌段共聚物;(2)基于聚二烯的共聚物,如:丁二烯(1,2加成)-环氧乙烷嵌段共聚物、丁二烯(1,2加成)-甲基丙烯酸嵌段共聚物、丁二烯(1,4加成)-丙烯酸嵌段共聚物、丁二烯(1,4加成)-环氧乙烷嵌段共聚物、丁二烯(1,4加成)-丙烯酸钠嵌段共聚物、丁二烯(1,4加成)-碘化N-甲基4-乙烯基吡啶嵌段共聚物、异戊二烯-环氧乙烷嵌段共聚物、异戊二烯-环氧乙烷嵌段共聚物和异戊二烯-碘化N-甲基2-乙烯基吡啶嵌段共聚物;(3)基于聚环氧乙烷的共聚物,如:环氧乙烷-丙烯酸嵌段共聚物、环氧乙烷-丙烯酰胺嵌段共聚物、环氧乙烷-环氧丁烷嵌段共聚物、环氧乙烷-ε-己内酯嵌段共聚物、环氧乙烷-丙交酯嵌段共聚物、环氧乙烷-丙交酯嵌段共聚物、环氧乙烷-甲基丙烯酸嵌段共聚物、环氧乙烷-甲基丙烯酸甲酯嵌段共聚物、环氧乙烷-N-异丙基丙烯酰胺嵌段共聚物、环氧乙烷-甲基丙烯酸甲酯嵌段共聚物、环氧乙烷-甲基丙烯酸硝基苯甲酯嵌段共聚物、环氧乙烷-甲基丙烯酸N,N-二甲基氨基乙酯嵌段共聚物、环氧乙烷-环氧丙烷嵌段共聚物、环氧乙烷-丙烯酸叔丁酯嵌段共聚物、环氧乙烷-甲基丙烯酸叔丁酯嵌段共聚物、环氧乙烷-甲基丙烯酸四氢糠酯嵌段共聚物、环氧乙烷-2-乙基噁唑啉嵌段共聚物、环氧乙烷-甲基丙烯酸2-羟基乙酯嵌段共聚物、环氧乙烷-2-甲基噁唑啉嵌段共聚物;(4)基于异丁烯的共聚物如异丁烯-丙烯酸嵌段共聚物、异丁烯-环氧乙烷嵌段共聚物、异丁烯-甲基丙烯酸嵌段共聚物;(5)基于聚苯乙烯的共聚物如苯乙烯-丙烯酰胺嵌段共聚物、苯乙烯-丙烯酸嵌段共聚物、苯乙烯-丙烯酸铯嵌段共聚物、苯乙烯-环氧乙烷嵌段共聚物、可在嵌段接点酸解离的苯乙烯-环氧乙烷嵌段共聚物、4-苯乙烯磺酸-环氧乙烷嵌段共聚物、苯乙烯磺酸-甲基丁烯嵌段共聚物、苯乙烯-N,N-二甲基丙烯酰胺嵌段共聚物、苯乙烯-N-异丙基丙烯酰胺嵌段共聚物、苯乙烯-碘化N-甲基2-乙烯基吡啶嵌段共聚物、苯乙烯-碘化N-甲基-4-乙烯基吡啶嵌段共聚物、苯乙烯-丙基丙烯酸嵌段共聚物、苯乙烯-丙烯酸钠嵌段共聚物、苯乙烯-甲基丙烯酸钠嵌段共聚物、p-氯甲基苯乙烯-丙烯酰胺嵌段共聚物、苯乙烯-共聚-p-氯甲基苯乙烯-嵌段-丙烯酰胺聚合物、苯乙烯-共聚-p-氯甲基苯乙烯-嵌段-丙烯酸聚合物、苯乙烯-嵌段-甲基丁烯-共聚-异戊二烯磺酸盐/酯聚合物;(6)基于聚硅氧烷的共聚物如二甲基硅氧烷-丙烯酸嵌段共聚物、二甲基硅氧烷-环氧乙烷嵌段共聚物、二甲基硅氧烷-甲基丙烯酸嵌段共聚物;(7)基于聚二茂铁基二甲基硅烷的共聚物如二茂铁基二甲基硅烷-环氧乙烷嵌段共聚物;(8)基于聚(2-乙烯基萘)的共聚物,2-乙烯基萘-丙烯酸嵌段共聚物;(9)基于聚(乙烯基吡啶-碘化N-甲基乙烯基吡啶)的共聚物如2-乙烯基吡啶-环氧乙烷嵌段共聚物、2-乙烯基吡啶-甲基丙烯酸嵌段共聚物、碘化N-甲基2-乙烯基吡啶-环氧乙烷嵌段共聚物、碘化N-甲基4-乙烯基吡啶-甲基丙烯酸甲酯嵌段共聚物、带PEO端部官能OH的4-乙烯基吡啶-环氧乙烷嵌段共聚物;(10)基于聚乙烯基吡咯烷酮的共聚物如乙烯基吡咯烷酮-D/L-丙交酯嵌段共聚物;等等。
在一个实施方式中,用来对发色聚合物点进行官能化的两亲性聚合物的亲水性部分是水溶性聚合物,如聚亚烷基二醇(例如PEG)、PEO、聚丙二醇、聚氧化烯、淀粉、聚碳水化合物、聚唾液酸等。在一个实施方式中,水溶性聚合物是聚亚烷基二醇。在一个更具体的实施方式中,水溶性部分是聚乙二醇(PEG)。
在一个实施方式中,用来对发色聚合物点进行官能化的两亲性聚合物的疏水性部分是是疏水性聚合物。可用的聚合物的非限制性例子包括但不限于聚(甲基)丙烯酸酯聚合物、聚丙烯酰胺聚合物、聚异丁烯、聚二烯、聚亚苯基、聚乙烯、聚乙二醇、聚丙交酯、聚苯乙烯、聚硅氧烷、聚乙烯基吡啶、聚乙烯基吡咯烷酮、聚氨酯、它们的嵌段共聚物、它们的无规或交替共聚物等。
基于许多因素,如所需的官能化程度、所需的光谱性质和目标用途,本文所提供的官能化发色聚合物点中两亲性分子与发色聚合物的重量比可约为0.01-50%。在优选的实施方式中,两亲性分子与发色聚合物的重量比约为5-20%。在又一个实施方式中,两亲性分子与发色聚合物的重量比不大于约1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,11%,12%,13%,14%,15%,16%,17%,18%,19%,20%,21%,22%,23%,24%,25%,26%,27%,28%,29%,30%,31%,32%,33%,34%,35%,36%,37%,38%,39%,40%,41%,42%,43%,44%,45%,46%,47%,48%,49%或约50%。在一个具体实施方式中,两亲性分子与发色聚合物的重量比不大于约25%。
在一个实施方式中,本发明提供的发色聚合物点还包含选自荧光染料、无机发光材料、磁性材料和金属的组分,它嵌在聚合物点的核内。
在又一个实施方式中,本发明提供的发色聚合物点可进一步共轭连接到一个或多个非活性化学基团上。在这种情况下,聚合物点表面上的非活性化学基团的存在会减弱和/或消除聚合物点表面与其他分子例如蛋白质之间的非特异性结合。在一个实施方式中,非活性化学基团是水溶性聚合物,如聚亚烷基二醇(例如PEG)、PEO、聚丙二醇、聚氧化烯、淀粉、聚碳水化合物、聚唾液酸等。在一个实施方式中,水溶性聚合物是聚亚烷基二醇。在一个更具体的实施方式中,水溶性部分是聚乙二醇(PEG)。
利用本文所述的官能化方案,已经成功实现了链霉亲和素和/或抗体与不同类型的P点,包括Wu等所述的五种P点(Wu,C.;Bull,B.;Szymanski,C.;Christensen,K.;McNeill,J.ACS Nano 2008,2,2415-2423)的共轭连接。
本发明提供了用于单粒子成像、细胞标记和流式细胞测量应用的官能化PFBT点及其他方面和实施方式。官能化PFBT点在约460nm处显示出较宽的吸收峰(图3),这是方便用于荧光显微技术和激光激发的波长区。来自直径约为10nm的PFBT点的吸收和荧光光谱分析显示,其峰值消光系数为1.5×107M-1cm-1,荧光量子产率为0.30。表2汇总了PFBT点的光学物理性质,以及购自英骏公司的两种广泛使用的探针Q点565和荧光IgG-Alexa 488(每IgG约6个染料分子)的性质。选择这两种商业探针的原因是它们能在与PFBT点类似的波长区发射光。重要的是需要指出,P点包含多个发射位,因此,尽管P点的寿命约比Q点短49/50,P点的发射速率可比Q点快三个数量级(见上)。
表2.PFBT点、IgG-Alexa 488和Q点565的光学物理性质。
表2中的Alexa 488和Q点565的数据是根据英骏公司提供的探针说明书给出的。Alexa 488的参数适用于单染料分子。IgG-Alexa 488探针具有12nm的流体力学直径,平均包含6个染料分子,但由于自猝灭,其亮度约相当于2-4个染料分子。PFBT点的荧光寿命通过TCSPC装置测量。还应指出,单PFBT点包含多个发射位,导致其光子发射速率高于仅根据荧光寿命预期的光子发射速率。
“核”
在一个实施方式中,发色聚合物点的核包含具有离域π电子的发光半导体聚合物。术语“半导体聚合物”是本领域公知的。典型的发光半导体聚合物包括但不限于芴聚合物、亚苯基亚乙烯基聚合物、亚苯基聚合物、亚苯基亚乙炔基聚合物、苯并噻唑聚合物、噻吩聚合物、咔唑芴聚合物、硼-二吡咯亚甲基聚合物、它们的聚合物衍生物以及包含其任意组合的共聚物。在一些实施方式中,发色聚合物可以是通过共价键与作为发射物质的小有机染料或金属络合物单元连接的半导体聚合物。这种发射单元可调节发射颜色,提高量子产率,改善发色聚合物点的光稳定性。
在优选的实施方式中,小有机染料或金属络合物可具有探测功能,因此给发色聚合物点添加了额外的功能性,如氧探测能力、离子探测能力、神经递质探测能力、药物探测能力、代谢物探测能力、蛋白质探测能力、葡萄糖探测能力、信号分子探测能力、毒素探测能力、DNA和RNA探测能力等。例如,卟啉铂可共价连接到半导体聚合物上,所得发色聚合物点可用作氧探测器。在另一个实施方式中,发色聚合物可以是通过共价键与光致变色染料单元连接的半导体聚合物。光致变色单元可用作能量转移受体。在适当波长的光辐照下,光致变色单元在两种具有不同吸收光谱的结构形式之间发生可逆转变。因此,光致变色聚合物点的发光情况可用另一波长的光调制,使光致变色聚合物点具有所需的光开关能力。光开关探针特别适用于超分辨率成像技术,如本领域公知的PALM、STORM等。
在一些实施方式中,发色聚合物点的核包含具有以下单元的聚合物:小有机染料分子、金属络合物、光致变色染料及其任意组合,例如,无光学活性的聚合物,如通过共价键与小有机染料、金属络合物、光致变色染料或其任意组合连接或接枝的聚苯乙烯。这些染料或金属络合物可具有探测功能,因此给发色聚合物点添加了额外的功能性,如氧探测能力、离子探测能力、葡萄糖探测能力、神经递质探测能力、药物探测能力、代谢物探测能力、蛋白质探测能力、信号分子探测能力、毒素探测能力、DNA和RNA探测能力等。
在相关的实施方式中,本发明提供的发色聚合物点可包括一种或多种pH敏感染料。例如,荧光素是众所周知的pH敏感染料,可共轭连接到本发明提供的聚合物点表面上。荧光素共轭连接到聚合物点上之后,即可与聚合物点的核中存在的发色聚合物一起参与荧光共振能量转移(FRET)。当溶液中存在荧光素共轭发色聚合物点的FRET发射时,所述FRET发射将依赖于溶液的pH。这将在本文提供的实施例31中阐述。
类似地,在一个实施方式中,本发明提供了测定溶液的pH的方法,所述方法包括以下步骤:使溶液接触发色聚合物点,所述发色聚合物点与pH敏感染料共轭连接,或者pH敏感染料嵌在聚合物点的核内,pH敏感染料能够与聚合物点的核中存在的发色单元一起参与FRET;激发聚合物点的核中的发色单元;以及检测pH敏感染料的FRET发射。
在另一相关的实施方式中,本发明提供的发色聚合物点可包括一种或多种温敏染料。例如,若丹明B是众所周知的温敏染料,它可嵌在发色聚合物点的核内,或者通过官能化作用连接到发色聚合物点的表面上。它嵌在聚合物点的疏水性核内之后,即可与聚合物点的核中存在的发色聚合物一起参与荧光共振能量转移(FRET)。当溶液中存在若丹明B共轭发色聚合物点的FRET发射时,所述FRET发射将依赖于溶液的温度。这将在本文提供的实施例30中阐述。
类似地,在一个实施方式中,本发明提供了测定溶液温度的方法,所述方法包括以下步骤:使溶液接触发色聚合物点,所述发色聚合物点与温敏染料共轭连接,或者温敏染料嵌在聚合物点的核内,温敏染料能够与聚合物点的核中存在的发色单元一起参与FRET;激发聚合物点的核中的发色单元;以及检测温敏染料的FRET发射。
核可以完全是由至少两个重复结构单元组成的半导体均聚物、半导体共聚物或半导体低聚物。核也可同时包含两种或更多种半导体均聚物、半导体共聚物和/或半导体低聚物。半导体聚合物或低聚物优选具有发光性质。典型的发光聚合物包括但不限于芴聚合物、亚苯基亚乙烯基聚合物、亚苯基聚合物、亚苯基亚乙炔基聚合物、苯并噻唑聚合物、噻吩聚合物、咔唑芴聚合物、硼-二吡咯亚甲基聚合物、它们的聚合物衍生物以及包含其任意组合的共聚物。
核还可包含作为活性荧光团的半导体聚合物,它与其他不具光学活性的聚合物如聚苯乙烯物理混合或化学交联,以获得所需的性质,如偏振发射。不具光学活性的聚合物可包含用于共轭连接所需生物分子的官能团,从而使发色聚合物点获得与所关注的生物分子结合的能力。
核还可包含与其他发色聚合物物理混合或化学交联的半导体聚合物,所述其他发色聚合物是例如与小有机染料、金属络合物、光致变色染料及其任意组合共价连接或接枝的不具光学活性的聚合物,以获得额外的功能性,如氧探测能力、离子探测能力、葡萄糖探测能力、神经递质探测能力、药物探测能力、代谢物探测能力、蛋白质探测能力、信号分子探测能力、毒素探测能力、DNA和RNA探测能力等。核还可包含与其他组分物理混合或化学交联的半导体聚合物,所述其他组分包括荧光染料、无机发光材料、磁性材料、金属材料,以调节发射颜色,提高量子产率和光稳定性,获得额外的功能性如磁性功能、等离子共振功能等。发色聚合物点的核的尺寸在约1-1000nm的范围内,并且可在此范围内调节。图1显示了由芴和苯并噻唑衍生得到的发色共聚物PFBT的化学结构。
“帽”
发色聚合物点的帽包含通过物理结合或化学键合与发色聚合物的核连接的官能化试剂,在发色聚合物点上提供用于生物共轭连接的表面官能团。较佳的是,所述官能化试剂是聚合物,可发色,也可不发色。例如,官能化可通过两亲性聚合物实现,所述两亲性聚合物包含疏水性部分和含有一个或多个官能团的亲水性部分。在一个实施方式中,疏水性部分通过疏水性相互作用,以物理方式嵌在发色聚合物点的核中,而含有官能团的亲水性部分延伸到溶液中,用于生物共轭连接。在另一个实施方式中,可优选使包含官能团的聚合物与预形成的发色聚合物发生化学结合,形成官能化发色聚合物点。化学结合可以是任何化学键合相互作用,如共价键、离子键、极性共价键、氢键或金属-配体键。
较佳的是,官能化试剂有助于维持发色聚合物点的水溶性和稳定性,在至少约一周内不会引起凝聚,更优选在溶液中过1个月、3个月、6个月、1年、3年和5年以上还是稳定的。
在一个实施方式中,官能化试剂通过化学结合形式如共价键、离子键、氢键等连接到发色聚合物的核上。官能化试剂可通过化学方式连接到发色聚合物的主链或侧链的活性位上。
在另一个实施方式中,官能化试剂通过物理结合形式锚定在发色聚合物点的核上。物理结合形式可源自各种力,包括但不限于范德华力、静电力、π堆积作用力、疏水作用力、熵力及其组合。在一个优选的实施方式中,官能化试剂包含疏水性部分和含有一个或多个官能团的亲水性部分。疏水性部分通过疏水相互作用,以物理方式嵌在发色聚合物点中,而含有官能团的亲水性部分延伸到溶液中,用于生物共轭连接。在一个特定的实施方式中,官能化试剂可以是任何包含生物素、叶酸、叶酸盐/酯、鬼笔环肽或多肽、核酸、碳水化合物等的分子,它可直接或间接地与生物实体结合。
在一些实施方式中,官能化试剂是小有机分子、表面活性剂、脂质分子,它们包含官能团,如羧酸或其盐、氨基、巯基、叠氮基、炔、醛、羟基、羰基、硫酸根(硫酸酯)、磺酸根(磺酸酯)、磷酸根(磷酸酯)、氰酸根(氰酸酯)、琥珀酰亚胺酯、它们的取代衍生物及其组合。一般地,可使用任何能用于生物共轭连接的官能团。本领域的普通技术人员可在例如《生物共轭技术》(美国纽约学术出版社,1996年及以后版本)中找到这种官能团。这些分子可通过化学或物理方式连接到发色聚合物点的核上,在发色聚合物点上提供用于生物共轭连接的表面官能团。
在另一个实施方式中,官能化试剂是包含官能团的聚合物,所述官能团是例如羧酸或其盐、氨基、巯基、叠氮基、炔、醛、羟基、羰基、硫酸根(硫酸酯)、磺酸根(磺酸酯)、磷酸根(磷酸酯)、氰酸根(氰酸酯)、琥珀酰亚胺酯、它们的取代衍生物及其组合。一般地,可使用任何能用于生物共轭连接的官能团。本领域的普通技术人员可在例如《生物共轭技术》(美国纽约学术出版社,1996年及以后版本)中找到这种官能团。官能化聚合物通过任何化学键合作用或物理作用力与发色聚合物点的核结合,在发色聚合物点上提供用于生物共轭连接的表面官能团。
在一个优选的实施方式中,官能化试剂是包含疏水性部分和含有一个或多个官能团的亲水性部分的两亲性聚合物。疏水性部分通过疏水相互作用,以物理方式嵌在发色聚合物点中,而含有官能团的亲水性部分延伸到溶液中,用于生物共轭连接。
在一些实施方式中,两亲性聚合物是已经用亲水性官能团修饰的疏水性发色聚合物。例如,在一个实施方式中,官能化发色聚合物点(P点)具有疏水性核和亲水性帽,所述P点包含:(a)第一疏水性半导体聚合物;以及(b)与活性官能团连接的第二两亲性半导体聚合物,其中第一疏水性半导体聚合物嵌在P点的疏水性核内;第二半导体聚合物的一部分嵌在P点的核内,而活性官能团位于亲水性帽中(也就是在P点表面上)。
在另一个实施方式中,官能化试剂是梳形两亲性聚合物,所述梳形两亲性聚合物包含多个疏水性部分的重复单元和多个亲水性部分的重复单元,使得官能化试剂通过强疏水作用力永久地锚定在聚合物点的核上,亲水性部分包含延伸到溶液中用于生物共轭连接的官能团。
两亲性聚合物的疏水性部分可以是烷基,更优选芳基,以增强与聚合物点的核的疏水性连接,所述聚合物点的核由许多芳环组成。合适的亲水性部分可以是聚亚烷基二醇,所述聚亚烷基二醇可利用羧酸或其盐、氨基、巯基、叠氮基、炔、醛、羟基、羰基、硫酸根(硫酸酯)、磺酸根(磺酸酯)、磷酸根(磷酸酯)、氰酸根(氰酸酯)、琥珀酰亚胺酯、它们的取代衍生物及其组合进行官能化。一般地,可使用任何能用于生物共轭连接的官能团。本领域的普通技术人员可在例如《生物共轭技术》(美国纽约学术出版社,1996年及以后版本)中找到这种官能团。较佳的是,本发明的官能化试剂是包含多个芳基单元和多个以下单元的两亲性聚合物:羧酸、氨基、巯基、叠氮基、炔、醛、琥珀酰亚胺酯或者连接到聚亚烷基二醇上的羟基。图1显示了一种这样的官能化试剂的化学结构,该官能化试剂是用羧酸封端的聚苯乙烯接枝环氧乙烷(PS-PEG-COOH)。
生物正交或可点击发色聚合物点
点击化学描述了一组威力强大的化学反应,这些反应速度快、选择性好、产率高(H.C.Kolb,M.G.Finn,K.B.Sharpless,Angew.Chem.Int.Ed.2001,40,2004)。这些反应中最广为人知的是铜(I)-催化的叠氮化物-炔环加成反应,它已被应用于许多领域,从材料科学(J.E.Moses,A.D.Moorhouse,Chem.Soc.Rev.2007,36,1249)到药物的发现(H.C.Kolb,K.B.Sharpless,Drug Discov.Today 2003,8,1128)和化学生物学(Q.Wang,T.R.Chan,R.Hilgraf,V.V.Fokin,K.B.Sharpless,M.G.Finn,J.Am.Chem.Soc.2003,125,3192;A.E.Speers,G.C.Adam,B.F.Cravatt,J.Am.Chem.Soc.2003,125,4686;J.A.Prescher,C.R.Bertozzi,Nat.Chem.Biol.2005,1,13;N.J.Agard,J.M.Baskin,J.A.Prescher,A.Lo,C.R.Bertozzi,ACS Chem.Biol.2006,1,644;E.M.Sletten,C.R.Bertozzi,Angew.Chem.Int.Ed.2009,48,6974)。
对于生物学应用,叠氮基和炔基均被视为生物正交化学报告子,因为它们不与任何天然生物官能团发生相互作用。结果,利用细胞的生物合成机构,可将这些生物正交报告子结合到目标生物分子中,提供化学把柄,随后可用外源性探针标识所述化学把柄。生物正交化学报告子与对基因编码标签如绿色荧光蛋白质(GFP)互补,为标识生物分子提供了一种不需要直接进行基因编码的途径。这些报告子为显现多类生物分子(不只是蛋白质,还有多聚糖、脂质和核酸)提供了强有力的方法(Prescher等,同上)。此外,与GFP不同,生物正交化学报告子基于小分子,这些小分子干扰细胞机能的可能性小。
虽然细胞环境复杂,但是利用点击化学技术的生物正交反应具有高度敏感性和低背景噪声。然而,在实践中,敏感性受到靶分子的丰度、化学报告子的标记效率和外源性探针的性能的限制。明亮且光稳定的探针几乎在所有情况下都是非常有利的,特别是对于低丰度生物分子的长期示踪和敏感检测。
近年来,荧光纳米粒子受到很大关注。相比于传统的荧光染料,流行的量子点(Q点)表现出改进的亮度和光稳定性。但在点击化学的背景下,铜催化剂不可逆地猝灭Q点荧光,妨碍它们在基于铜催化的点击化学的各种应用领域中的利用(S.Han,N.K.Devaraj,J.Lee,S.A.Hilderbrand,R.Weissleder,M.G.Bawendi,J.Am.Chem.Soc.2010,132,7838)。由于铜具有细胞毒性,人们为活细胞和体内应用开发了无铜生物正交方法,如施陶丁格连接反应(Staudinger ligation)和张力促进的叠氮化物-炔环加成反应(Agard等,同上),尽管这些反应有时因合成过程冗长而更难实施(Han等,同上)。在无铜方法中可采用Q点(A.Bernardin,A.Cazet,L.Guyon,P.Delannoy,F.Vinet,D.Bonnaffe,I.Texier,Bioconjug.Chem.2010,21,583),其中不存在铜导致Q点不稳定的问题。但是,重金属离子析出给Q点带来的固有毒性仍然是严重的问题。
半导体聚合物点(P点)代表一类新的超亮荧光探针,它们可克服基于点击化学的应用中的上述两个问题。先前的研究表明,P点在不同细胞分析中均无细胞毒性,使它们在活系统研究中十分诱人。一方面,本发明聚焦于P点涉及点击化学的生物应用。P点是比Q点亮得多的荧光探针;具有比Q点快上千倍的发射速率;光稳定且不“闪烁”。但对于生物应用,P点的突出问题是控制其表面化学性质以及与生物分子的共轭连接。这是一个突出的难题,妨碍生物研究中对P点的广泛采用。
一方面,本发明提供了通过在P点表面上产生官能团来克服此难题的一般方法。因为P点的形成受疏水相互作用驱动,一些带有亲水性官能团的两亲性聚合物可在纳米粒子形成过程中共缩合成单个的点。两亲性聚合物上的亲水性基团可用作把柄,用来使P点官能化,以便共轭连接到生物分子上。研究发现,一种普通共聚物——苯乙烯-马来酸酐共聚物(PSMA)——成功地使P点官能化,用于进一步的表面共轭连接(图14)。PSMA为P点官能化提供了优异的选项,因为市场上可购得分子量范围和马来酸酐含量范围较宽的PSMA。
如实施例17所示,用PSMA对由高荧光半导体聚合物——(9,9-二辛基芴-2,7-二基)-(1,4-苯并-{2,1’-3}-噻二唑)共聚物(PFBT)——制得的P点进行官能化,但该方法可应用于任何疏水性荧光半导体聚合物。在形成P点的过程中,PSMA分子的疏水性聚苯乙烯单元可能锚定在P点粒子内部,而马来酸酐单元位于P点表面并在水性环境中水解,在P点表面上产生羧基。如本文所示,羧基能进一步用于表面共轭连接。
如实施例21所示,生物标记应用中可采用非常低的P点浓度(约50nM),所述浓度可比一般用于小染料分子的浓度(通常在μM范围内)小几个数量级。这些结果还表明,通过点击化学技术进行P点标识具有高特异性,在所有对照样品中几乎都没有背景标记。此外,还用P点探针在另一种细胞系——3T3纤维原细胞——中检测糖蛋白和新合成的蛋白质。在所有这些情况下,P点还有效地对靶实现了特异性标记,表明该策略在不同细胞系中同样有效和成功。
因此,在一个实施方式中,本发明提供了一种共轭连接方法,该方法通过共价键形式将功能分子连接到P点上,用来对细胞靶标进行基于点击化学的生物正交标记。这些官能化P点可有选择地靶定例如哺乳动物细胞中新合成的蛋白质和糖蛋白,所述哺乳动物细胞已用生物正交化学报告子进行过代谢标记。利用P点和点击化学技术的高效、高特异性和高亮度蛋白质标记方法表明,此方法有潜力用于显现各种细胞过程。本文所述的方法和组合物使P点能广泛用于细胞研究和荧光应用领域。
在一个实施方式中,本发明提供了发色聚合物点共轭体,其中分子,优选生物分子,借助点击反应以化学键合形式连接到聚合物点上。为此,将能够参与点击化学反应的第一官能团设计成分子(例如生物分子)。例如,将叠氮化物装入生物分子的一条有吸引力的途径是基于代谢标记,通过这种途径,利用细胞的生物合成机构将含叠氮化物的生物合成前体结合到生物分子中。然后,将能够与第一官能团一起参与点击化学反应的第二互补官能团连接到如本发明所提供的发色聚合物点上。生物分子中的第一官能团与聚合物点上的互补官能团之间基于点击化学的反应形成聚合物点生物共轭体。
在一个实施方式中,用有机叠氮化物作为生物分子中连接或富集的官能团。作为互补官能团的端炔与聚合物点结合。如图22所示(反应i),以铜(I)为催化剂,叠氮化物与炔基之间的[3+2]环加成反应在聚合物点与生物分子之间形成稳定的三唑连接体。或者,炔可通过环张力活化。例如,环辛炔及其衍生物可在室温下于叠氮化物反应,不需要催化剂。借助张力促进的[3+2]环加成反应(图22,反应ii)的生物共轭连接不需要具有细胞毒性的铜,这特别适用于活细胞和体内应用。在另一个实施方式中,生物分子可通过施陶丁格连接反应共轭连接到聚合物点上(图22,反应iii)。术语“施陶丁格连接反应”是本领域广为人知的,描述了膦与叠氮化物之间形成酰胺键的选择性反应。官能膦基与聚合物点结合或共价连接。膦基与生物分子中的叠氮基的反应也会形成聚合物点生物共轭体,而不需要催化剂。可利用点击化学技术和施陶丁格连接反应将游离生物分子共轭连接到聚合物点上。也可利用通过叠氮化物、环辛炔和膦官能化的聚合物点在体外或体内对含叠氮化物的生物分子进行特异性靶定。
因此,在一个实施方式中,本发明提供了包含核和帽的官能化发色聚合物点(P点),其中所述核包含发色聚合物,所述帽包含带有一个或多个官能团的官能化试剂,所述官能团能够通过点击化学反应共轭连接到分子上,前提是所述帽不全是有机硅酸盐/酯。在一个具体实施方式中,官能团选自炔、张力炔、叠氮化物、二烯、烯烃、四嗪、张力烯烃(strained alkene)、环辛炔、膦基及其他用于点击反应和其他生物正交反应的基团。
在一个相关实施方式中,本发明提供了具有疏水性核和亲水性帽的官能化发色聚合物点(P点),所述P点包含:(a)半导体聚合物;以及(b)具有亲水性部分和疏水性部分的两亲性分子,所述两亲性分子与活性官能团连接,所述活性官能团能够通过点击化学反应共轭连接到分子上,其中半导体聚合物嵌在P点的疏水性核内;一部分两亲性分子嵌在P点的核内,活性官能团位于亲水性帽中。在一个具体实施方式中,官能团选自炔、张力炔、叠氮化物、二烯、烯烃、四嗪、张力烯烃、环辛炔、膦基及其他用于点击反应和其他生物正交反应的基团。
生物共轭发色聚合物点
另一方面,本发明提供了包含本文所述的官能化发色聚合物点和生物分子的生物共轭体,其中生物分子通过任何合适的方法直接或间接连接到聚合物点上。生物共轭体还包含上述官能化发色聚合物点,它通过物理或化学方式与生物粒子如病毒、细胞、生物小泡或合成小泡(如脂质体)连接。
术语“生物分子”用来描述合成或天然的蛋白质、糖蛋白、肽、氨基酸、代谢物、药物、毒素、核酸、核苷酸、碳水化合物、糖、脂质、脂肪酸等。生物分子可通过任何合适的方法,如通过稳定的物理或化学结合形式直接或间接连接到聚合物点上。较佳的是,生物分子通过一个或多个共价键连接到官能化聚合物点的亲水性官能团上。例如,若聚合物点的官能团是羧基,则蛋白质生物分子可通过羧基与蛋白质生物分子的氨基之间的交联直接连接到聚合物点上。
术语“交联剂”用来描述能在相似或不同分子上的分子基团之间形成化学键,从而使分子共价键合到一起的化合物。在本发明中,合适的交联剂是将羧基偶联到氨基上的交联剂,例如盐酸1-乙基-3-[3-二甲基氨基丙基]碳二亚胺(EDC)。常用交联剂的其他例子是本领域熟知的。参见例如《生物共轭技术》(美国纽约学术出版社,1996年及以后版本)。生物分子与发色聚合物点的间接连接可通过利用“连接剂”分子来实现,所述连接剂分子是例如抗生物素蛋白、链霉亲和素、中性抗生物素蛋白、生物素或类似的分子。
因此,在一个实施方式中,本发明提供了如本文所述的具有疏水性核和亲水性帽的官能化发色聚合物点,其中生物分子共轭连接到亲水性帽结构中(也就是在聚合物点表面上)存在的活性官能团上。
一般地,所关注的任何生物分子均可共轭连接到本发明提供的发色聚合物点上,包括但不限于靶向分子、效应分子、抑制剂分子、成像分子等。可共轭连接到本发明提供的发色聚合物点上的示例性生物分子包括合成或天然的蛋白质、糖蛋白、多肽、氨基酸、核酸、碳水化合物、脂质、脂肪酸及其组合。
在一个具体实施方式中,本发明提供了包含核和帽的官能化发色聚合物点(P点),其中所述核包含发色聚合物,所述帽包含带有一个或多个官能团的官能化试剂,所述官能团共轭连接到生物分子上,前提是所述帽不全是有机硅酸盐/酯。在一个实施方式中,生物分子选自合成蛋白质、天然蛋白质、糖蛋白、多肽、氨基酸、核酸、碳水化合物、脂质、脂肪酸及其组合。在一个具体实施方式中,生物分子是多肽。在一个实施方式中,多肽是抗体或其片段。在另一个具体实施方式中,生物分子是核酸。在一个实施方式中,生物分子是适配体。
在一个相关方面中,本发明提供了具有疏水性核和亲水性帽的官能化发色聚合物点(P点),所述P点包含:(a)半导体聚合物;以及(b)带有共轭连接到生物分子上的活性官能团的两亲性分子,其中半导体聚合物嵌在P点的疏水性核内;一部分两亲性分子嵌在P点的核内,活性官能团和共轭连接的生物分子位于亲水性帽中(也就是在聚合物点表面上)。
在一个实施方式中,用来将生物分子共轭连接到发色聚合物点上的活性官能团是能参与点击化学反应及其他生物正交反应的化学部分。在一个具体实施方式中,官能团选自含炔的部分、含叠氮基的部分和含膦的部分。
在一些实施方式中,发色聚合物点共轭连接到“效应部分”(effector moiety)上。效应部分可以是任何分子,包括标记部分如放射性标记或荧光标记;靶向部分如抗体、适配体、蛋白质、肽;或者可以是治疗部分。这种治疗部分包括但不限于抗肿瘤药、毒素、放射性试剂、细胞因子、抗体或酶。此外,本发明提供了这样一种实施方式,其中本发明的发色聚合物点连接到将前药转化为细胞毒剂的酶上。
在其他实施方式中,本发明所提供的官能化发色聚合物点共轭连接到超过一种类型的效应分子上。例如,在一个实施方式中,发色聚合物点同时共轭连接到靶向部分(例如抗体或适配体)和治疗部分(例如抗肿瘤药、毒素、放射性试剂、细胞因子、抗体或酶)上。因此,本发明提供的官能化发色聚合物点既可借助聚合物点本身的荧光用作诊断/成像工具,又可用作治疗部分。
用于体内应用的发色聚合物点
基于纳米粒子的诊断治疗剂引起相当大的兴趣,因为它们具有用于临床肿瘤学及其他生物医学研究的潜力。研究证明,许多纳米结构可用于体内应用,如脂质和聚合物纳米囊可用于药物递送,氧化铁纳米粒子可用于磁共振成像,金纳米粒子可用于X射线计算机断层成像,量子点(Q点)可用于荧光成像。其中基于有机分子的纳米囊为药物的包封和递送提供了灵活的载体。但是,它们很少提供成像对比,一般需要分子标签才能实现荧光的体内监视。相反,无机纳米粒子因独特的性质而用作主要的成像对比剂。在令人振奋的纳米技术中,Q点是过去10年转用于生物领域的一个代表。尺寸可调的发光特性使它们成为有吸引力的多色荧光团,用于生物标记、成像和探测。但是,对于体内应用,Q点的固有毒性是严重的问题,这可能阻碍它们最终的临床转化。
新近的标志性论文[Choi,H.S.等.Nature Biotechnol.25,1165-1170(2007)]提出了区分具有潜在临床实用性的纳米粒子的三条标准:(i)最终的流体力学直径(HD)<5.5nm,以便从肾快速清除;以及/或者(ii)与完全无毒组分形成制剂;以及/或者(iii)可生物降解成可清除的组分。虽然小HD(<5.5nm)能实现高效肾清除,以减轻毒性作用(同上),但这种尺寸限制对多数纳米粒子体系构成极大的挑战,特别是量子点[Choi,H.S.等Nature Nanotechnol.5,42-47(2010)],其发光效果依赖于尺寸,并且需要包封层来实现水溶性。因此,对于许多涉及人类疾病的诊断和治疗的体内应用,非常需要用生物友好材料设计亮荧光探针。
半导体聚合物综合了有机聚合物的特性和半导体的独特光学性质。将半导体聚合物改造成荧光纳米粒子标记的启示来自许多有益特性,如高个体粒子亮度、快发射速率和优异的光稳定性。此外,半导体聚合物点(P点)本性无害且具有生物相容性:在用高浓度纳米粒子温育数天的不同细胞系中没有观察到细胞毒性[Moon,J.H.等.,Angew.Chem.Int.Ed.46,8223-8225(2007);Pu,K.Y.等,Chemistry of Materials 21,3816-3822(2009)]。P点在其尚处于发展早期时即引起强烈的兴趣[参见例如Pecher,J.&Mecking,S.Chem.Rev.Article ASAP(2010);Kaeser,A.&Schenning,A.P.H.J.Adv.Mater.22,2985-2997(2010)]。
包括合成化学家在内的研究人员为生物医学研究开发了各种方法来提高纳米粒子的多样性和功能,如调节发射颜色[Abbel,R.,等,Chem.Commun.,1697-1699(2009),其内容为所有目的通过参考完整地结合于此],探索新制备方法[Baier,M.C.等,J.Am.Chem.Soc.131,14267-14273(2009),其内容为所有目的通过参考完整地结合于此],改造粒子表面[Howes,P.等,J.Am.Chem.Soc.132,3989-3996(2010),其内容为所有目的通过参考完整地结合于此],包封磁性材料[Howes,P.等J.Am.Chem.Soc.132,9833-9842(2010),其内容为所有目的通过参考完整地结合于此],前哨淋巴结定位的第一次体内实验[Kim,S.等.Chem.Commun.46,1617-1619(2010),其内容为所有目的通过参考完整地结合于此]。尽管取得了这些成果,但仍不清楚这些基于聚合物的新型探针能否以特异性方式靶定到体内恶性肿瘤上。特异性肿瘤靶定是任何更深入的临床考虑的第一个前提条件。一方面,本发明克服了几个难题,这些难题涉及用于体内应用的发色纳米粒子的配体共轭和探针性能。
如本文所述,可利用各种半导体聚合物制备小P点,作为荧光标记。特别是,聚芴(PF)及其衍生物具有高荧光量子产率以及优异的热稳定性和化学稳定性。通过在聚合物主链中引入窄带隙单体来将其发射颜色从蓝区调节至深红区获得了明显成功[参见Hou,Q.等,Macromol.37,6299-6305(2004);Yang,R.Q.等,Macromol.38,244-253(2005),其内容为所有目的通过参考完整地结合于此],在设计荧光探针方面显示出极大的灵活性。但是,随着窄带隙单体浓度增大,荧光量子产率显著下降,特别是在深红区(见上)。权衡下来,仅将少量窄带隙单体加入PF共聚物,以维持高荧光量子产率,这就使相关P点的吸收主要在紫外(UV)区(图23)。对于体内应用来说,这是一个严重的缺陷。
为了克服上述限制,本发明提供了由给体-受体聚合物掺混物组成的纳米粒子,它利用了P点中发生的高效粒内能量转移[参见例如Wu,C.等,J.Phys.Chem.C 112,1772-1781(2008);Wu,C.等,J.Phys.Chem.B 110,14148-14154(2006)]。用捕集可见光的聚合物(PFBT)作为给体,用高效深红发射聚合物(PF-0.1TBT)作为受体,制备聚合物掺混物点(“PB点”)(聚合物结构示于图24)。因为给体和受体聚合物紧密地挤在单个点中,粒内能量转移导致PFBT给体完全猝灭,伴有单独来自受体聚合物的有效荧光(图25B)。在给定的掺混比(PF-0.1TBT与PFBT的重量比)为0.6的情况下,PB点具有延伸至600nm的宽可见光吸收带和量子产率为0.52的650nm高效发射(图25C和26A)。
掺混策略还成功应用于由捕光聚合物PFPV和不同的发红光聚合物组成的其他聚合物给体-受体体系(图27),显示其调节P点性质的通用性。虽然体内成像更优选在近红外(NIR)区发射的P点,如实施例29所示,但在各种尺寸相近(直径约为15nm)的纳米粒子中,当前的PB点代表着深红区最亮的探针,它们可明显克服生物组织中的背景自发荧光和散射。
因此,在一个实施方式中,本发明提供了发射颜色向深红位移的发色聚合物点。在一个实施方式中,发色聚合物点包含聚芴聚合物(PF)和芴-苯并噻二唑-噻吩共聚物(PF-0.1TBT)的掺混物。窄带隙TBT单体是为了将发射颜色从蓝区调节至深红区而加入聚芴主链的。[参见Hou,Q.等,Macromol.37,6299-6305(2004);Yang,R.Q.等,Macromol.38,244-253(2005)]。TBT单体的浓度可从0.01变化到0.5。较佳的是,这些包含PFBT和PF-0.1TBT的聚合物掺混物使吸收主要在可见光区,得到深红荧光,而不会明显损失量子产率。一般地,掺混物包含约2-75%的PF-0.1TBT共聚物。在某些实施方式中,PF与PF-0.1TBT之比约不大于50:1,或者约不大于45:1,40:1,35:1,30:1,25:1,20:1,19:1,18:1,17:1,16:1,15:1,14:1,13:1,12:1,11:1,10:1,9:1,8:1,7:1,6:1,5:1,4:1,3:1,2:1,3:2,1:1,2:3,1:2或1:3。在一个具体实施方式中,聚合物掺混物包含PFBT和PF-0.1TBT。在另一个具体实施方式中,聚合物掺混物包含PFPV和PF-0.1TBT。在一个优选的实施方式中,聚合物点的表面上包含官能团。
在一个具体实施方式中,具有疏水性核和亲水性帽并向深红位移的聚合物点包含:(a)PFBT和PF-0.1TBT半导体聚合物的掺混物;以及(b)具有亲水性部分和疏水性部分并连有活性官能团的两亲性分子,其中半导体聚合物嵌在P点的疏水性核内;一部分两亲性分子嵌在P点的核内,活性官能团位于亲水性帽中(也就是位于聚合物点表面上)。在一些实施方式中,聚合物点进一步共轭连接到效应分子(例如靶向试剂)上。在一个实施方式中,红移聚合物点的峰值发射在约600-700nm之间(即位于深红区)。
在另一个实施方式中,具有疏水性核和亲水性帽并向深红位移的聚合物点包含:(a)PFBT聚合物;以及(b)PF-0.1TBT半导体聚合物,其中半导体聚合物的一个子群含有活性官能团,不含活性官能团的半导体聚合物嵌在P点的疏水性核内;含有活性官能团的半导体聚合物的一部分嵌在P点的核内,活性官能团位于亲水性帽中(也就是位于聚合物点表面上)。在一些实施方式中,聚合物点进一步共轭连接到效应分子(例如靶向试剂)上。
在相关的实施方式中,提供了向深红位移的聚合物点,它们共轭连接到效应分子例如靶向部分上。在一个实施方式中,生物共轭连接的发色聚合物点包含半导体聚合物(例如PF、PFBT、PFPV等)与PF-0.1TBT半导体聚合物的掺混物。一般地,掺混物包含约2-75%的PF-0.1TBT共聚物。在某些实施方式中,PF与PF-0.1TBT之比约不大于50:1,或者约不大于45:1,40:1,35:1,30:1,25:1,20:1,19:1,18:1,17:1,16:1,15:1,14:1,13:1,12:1,11:1,10:1,9:1,8:1,7:1,6:1,5:1,4:1,3:1,2:1,3:2,1:1,2:3,1:2或1:3。在一个具体实施方式中,聚合物掺混物包含PFBT和PF-0.1TBT。在另一个具体实施方式中,聚合物掺混物包含PFPV和PF-0.1TBT。
另一方面,本发明提供了具有近红外(NIR)荧光发射的发色聚合物点。本文所用的“近红外发射”是指波长在约700-1500nm之间的电磁辐射。如实施例29所示,NIR荧光发射可通过将NIR染料嵌入本发明提供的发色聚合物点的疏水性核中实现。许多NIR荧光染料是本领域熟知的,例如花青染料是最常用的近IR荧光染料。其他NIR染料系列包括噁嗪、若丹明和酞菁染料。为在激发之后实现NIR发射,NIR P点利用了P点包含的发色聚合物与嵌在该分子的疏水性核内的NIR染料之间的高效分子间FRET。因此,当选用NIR染料制备NIR P点时,必须谨慎挑选具有重叠的发射和激发光谱的发色团(即合适的发色聚合物FRET给体和NIR染料FRET受体)。在一个优选的实施方式中,NIR聚合物点还在其表面上经过官能化。
因此,在一个实施方式中,NIR聚合物点包含核和帽,其中所述核包含发色聚合物和NIR染料,所述帽包含带有一个或多个官能团的官能化试剂,前提是所述帽不全是有机硅酸盐/酯。在一个实施方式中,聚合物点进一步共轭连接到效应分子(例如靶向试剂)上。
在相关的实施方式中,具有疏水性核和亲水性帽的NIR聚合物点包含:(a)半导体聚合物;(b)NIR染料;以及(c)具有疏水性部分和连接到活性官能团上的亲水性部分的两亲性分子,其中半导体聚合物和NIR染料嵌在P点的疏水性核内;一部分两亲性分子嵌在P点的核内,活性官能团位于亲水性帽中。在一个实施方式中,聚合物点进一步共轭连接到效应分子(例如靶向试剂)上。
制备发色聚合物点的方法
一方面,本发明提供了对发色纳米粒子(即发色聚合物点或“P点”)的表面进行官能化的新方法。在一个实施方式中,所述方法基于这样一个思想,即纳米粒子形成过程中建立的疏水相互作用将多相聚合物链捕集到单P点中。少量两亲性聚合物与P点中的半导体聚合物共缩合,对纳米粒子表面进行修饰和官能化。
图1展示了这样一个例子,该例子采用带官能团的两亲性梳形聚苯乙烯聚合物PS-PEG-COOH,但也可采用带有不同官能团的其他两亲性聚合物。PS-PEG-COOH由疏水性聚苯乙烯主链和几个用羧酸封端的氧化乙烯亲水性侧链组成。在纳米粒子形成过程中,疏水性聚苯乙烯主链嵌在P点粒子内部,而亲水性PEG链和官能团向外延伸到水性环境中。因此,与物理吸附不同,这种方法应该是将PEG和官能团永久地锚定在P点表面上。PEG链提供了生物相容性层,该层最大程度减少了非特异性吸收。PEG链还起防止纳米粒子凝聚的立体屏障的作用,而羧基官能团容易利用成熟的方法共价连接到生物分子上(参见例如Xing,Y.;Chaudry,Q.;Shen,C.;Kong,K.Y.;Zhau,H.E.;WChung,L.;Petros,J.A.;O'Regan,R.M.;Yezhelyev,M.V.;Simons,J.W.;Wang,M.D.;Nie,S.Nature Protoc.2007,2,1152-1165,其内容为所有目的通过参考完整地结合于此)。
在一个优选的实施方式中,发色聚合物点通过沉淀法制备。此技术包括将发色聚合物稀溶液(例如将发色聚合物溶解在有机溶剂中)快速加入(例如辅以声波处理或剧烈搅拌)过量的非溶剂介质(但与有机溶剂混溶)如水或另一种生理水溶液中。例如,在一些实施方式中,先将疏水性发色聚合物溶解在溶解能力良好的有机溶剂(良溶剂)如THF(四氢呋喃)中,然后将溶解在THF中的聚合物加入过量的水或缓冲液中,水或缓冲液是疏水性发色聚合物的不良溶剂,但与良溶剂(THF)混溶。所得混合物经声波处理或剧烈搅拌,以帮助形成发色聚合物点,然后除去有机溶剂,留下分散良好的发色纳米粒子。在使用此程序时,发色聚合物必须具有足够的疏水性,以便溶解在有机溶剂(例如THF)中。
但是,也可采用其他的方法形成发色聚合物点,包括但不限于各种基于乳液(例如细乳液或微乳液)或沉淀或浓缩的方法。在一个实施方式中,可使疏水性官能团位于聚合物点表面上,使得它们可共轭连接到例如生物分子上。在一个方案中,可将疏水性活性官能团连接到亲水性连接剂上,该连接剂将该官能团带至聚合物点的亲水性外部,由此使该官能团位于P点的表面上。若使用既疏水又可点击(即包括在点击化学框架内的化学反应)的官能团,包括但不限于炔、张力炔、叠氮化物、二烯、烯烃、环辛炔和膦基,则后一种方法可能特别奏效。
因此,在一个优选的实施方式中,本发明提供了制备官能化发色聚合物点的方法,该方法将半导体聚合物和连接到活性官能团上的两亲性分子在非质子溶剂中溶剂化的混合物加入包含质子溶剂的溶液中。在一个实施方式中,所述方法还包括过滤悬浮液,分离出特定尺寸的聚合物点群(population)。
在一个具体实施方式中,所述制备官能化发色聚合物点的方法包括以下步骤:(a)制备半导体聚合物与连接到活性官能团上的两亲性分子在非质子溶剂中的混合物;(b)将全部或部分混合物加入(例如注射)到包含质子溶剂的溶液中,从而使半导体聚合物和两亲性分子坍缩成纳米粒子;以及(c)从步骤(b)形成的混合物中除去非质子溶剂,从而形成官能化发色聚合物点的悬浮液,其中一部分两亲性分子嵌在纳米粒子核中,而活性官能团位于纳米粒子表面上。在一个实施方式中,所述方法还包括过滤悬浮液,分离出特定尺寸的聚合物点群。
在一个具体实施方式中,在将混合物加入包含质子溶剂的溶液中之前,进一步通过活性官能团将两亲性分子共轭连接到效应分子上。这种方法对耐受非质子溶剂的分子有效,但对不耐受非质子溶剂的其他分子(例如蛋白质)的效果不佳。为说明这种策略的可行性,实施例31提供了一个案例,其中包含活性官能团的两亲性聚合物先共轭连接到对pH敏感的荧光素异硫氰酸酯染料上,然后与半导体聚合物掺混,形成共轭聚合物点。
有许多从包含疏质子溶剂和质子溶剂的混合物中除去疏质子溶剂的技术是本领域熟知的,包括但不限于蒸馏、氮气汽提和各种色谱技术[例如缓冲液交换色谱(buffer exchange chromatography)]。在一个优选的实施方式中,疏质子溶剂的沸点低于质子溶剂的沸点,此时通过氮气汽提从步骤(b)形成的混合物中除去疏质子溶剂。在一个优选的实施方式中,质子溶剂是水。
制备发色聚合物点生物共轭体的方法
如本文所述,本发明提供的官能化发色聚合物点可使生物分子易于共轭连接到稳定的无毒荧光探针(即P点)上,所述探针可用于许多诊断和实验分析。这样,通过吸附到聚合物点表面(例如借助静电或疏水相互作用)或者直接通过化学连接,可将分子(优选生物分子)连接到发色聚合物点上。
本文所用的“生物共轭CP点”或“生物共轭P点”是指通过任何稳定的物理或化学连接方式稳定地连有任何生物分子的发色聚合物点。在本申请中,“生物共轭连接”是指通过任何稳定的物理或化学连接方式将生物分子连接到发色聚合物点上的过程。
1.通过物理吸附实现生物共轭连接
生物分子通过物理吸附与发色聚合物点稳定地结合。物理吸附可源自各种力,包括但不限于范德华力、静电力、π堆积作用力、疏水作用力、熵力及其组合。物理吸附可借助于发色聚合物点上的帽结构和被吸附靶分子(例如生物分子)的物理和化学性质。这样,通过亲水性帽结构连接到聚合物点上的官能团将决定可被吸附到聚合物点上的分子类型。
因此,在一个实施方式中,本发明提供了包含疏水性核和亲水性帽的生物共轭发色聚合物点,其中所述核包含发色聚合物,所述帽包含带有一个或多个官能团的官能化试剂,所述官能团吸附有生物分子。
在一个实施方式中,生物共轭发色聚合物点通过以下步骤制备:将半导体聚合物和连接到活性官能团上的两亲性分子在非质子溶剂中溶剂化的混合物加入包含质子溶剂的溶液中,制备官能化发色聚合物点,然后将生物分子吸附到聚合物点表面上。在一个实施方式中,所述方法还包括在将生物分子吸附到聚合物点上之前过滤悬浮液,分离出特定尺寸的聚合物点群。
在一个具体实施方式中,所述制备生物共轭发色聚合物点的方法包括以下步骤:(a)制备半导体聚合物与连接到活性官能团上的两亲性分子在非质子溶剂中的混合物;(b)将全部或部分混合物加入(例如注射)到包含质子溶剂的溶液中,从而使半导体聚合物和两亲性分子坍缩成纳米粒子;(c)从步骤(b)形成的混合物中除去非质子溶剂,从而形成官能化发色聚合物点的悬浮液,其中一部分两亲性分子嵌在纳米粒子核中,而活性官能团位于纳米粒子表面上;以及(d)将所关注的分子吸附到该表面上。在一个实施方式中,所述方法还包括过滤悬浮液,分离出特定尺寸的聚合物点群。
2.通过化学键合实现生物共轭连接
在一个优选的实施方式中,通过化学键合将分子(例如生物分子)连接到聚合物点上,它要求聚合物点上有可用的官能团,如羧酸、氨基、巯基、叠氮基、炔、醛、羟基、羰基、醛、羟基、羰基、硫酸根(硫酸酯)、磺酸根(磺酸酯)、磷酸根(磷酸酯)、氰酸根(氰酸酯)、琥珀酰亚胺酯、它们的取代衍生物或其组合。一般地,可使用任何能用于生物共轭连接的官能团。本领域的普通技术人员可在例如《生物共轭技术》(美国纽约学术出版社,1996年或2008年第2版,其内容为所有目的通过参考完整地结合于此)中找到这种官能团。然后,可利用标准共轭连接技术完成生物共轭连接(同上)。
因此,在一个实施方式中,本发明提供了包含核和帽的生物共轭发色聚合物点,其中所述核包含发色聚合物,所述帽包含带有一个或多个官能团的官能化试剂,所述官能团共价连接到生物分子上。
在一个具体实施方式中,本发明提供了具有疏水性核和亲水性帽的生物共轭发色聚合物点,所述聚合物点包含:(a)发色聚合物;以及(b)通过活性官能团共轭连接到生物分子上的两亲性分子,其中发色聚合物嵌在P点的疏水性核内;一部分两亲性分子嵌在P点的核内,共轭生物分子位于亲水性帽中(也就是在聚合物点表面上)。在一个优选的实施方式中,发色聚合物是半导体聚合物。
2a.发色聚合物的共价修饰
一种制备官能化CP点的合成策略是两步法:第一步是合成带有官能团的发色聚合物,所述官能团是例如羧酸、氨基、巯基、叠氮基、炔、醛、羟基、羰基、硫酸根(硫酸酯)、磺酸根(磺酸酯)、磷酸根(磷酸酯)、氰酸根(氰酸酯)、琥珀酰亚胺酯、它们的取代衍生物或其组合。一般地,可使用任何能用于生物共轭连接的官能团。本领域的普通技术人员可在例如《生物共轭技术》(美国纽约学术出版社,1996年或2008年第2版)中找到这种官能团。官能团可通过共价键合到发色聚合物的主链或侧链上形成。这种化学修饰是本领域的技术人员熟知的。在第二步中,将官能化发色聚合物用作制备CP点(将具有可供生物共轭连接的官能团)的前体。由官能化发色聚合物制备CP点可采用本申请提供的基于两种可混溶溶剂的方法(实施例1)。由官能化发色聚合物制备CP点也可通过乳液法或细乳液法实现,它们基于包含两种不混溶液相(如水和另一种不混溶有机溶剂)的混合物在表面活性剂存在下的剪切。剪切过程如超声波处理得到在悬浮液中包含官能化发色聚合物的稳定液滴。除去有机溶剂后,得到官能化CP点,它们的尺寸通常为几纳米至亚微米。
因此,在一个实施方式中,本发明提供了制备生物共轭发色聚合物点的方法,所述方法包括形成具有疏水性核和亲水性帽的发色聚合物点,其中发色聚合物带有一个或多个活性官能团,活性官能团位于亲水性帽中(也就是位于聚合物点表面上);然后通过与活性官能团的连接,使生物分子共价连接到聚合物点上。
制备官能化CP点的另一种合成策略可体现在将发色聚合物的合成与纳米粒子的形成组合起来的方法中。一部分用于合成发色聚合物的单体单元和/或封端单元具有官能团,如羧酸、氨基、巯基、叠氮基、炔、醛、羟基、羰基、硫酸根(硫酸酯)、磺酸根(磺酸酯)、磷酸根(磷酸酯)、氰酸根(氰酸酯)、琥珀酰亚胺酯、它们的取代衍生物或其组合。一般地,可使用任何能用于生物共轭连接的官能团。本领域的普通技术人员可在例如《生物共轭技术》(美国纽约学术出版社,1996年及以后版本)中找到这种官能团。通过乳液或其他方法形成的液滴可起微型反应器或纳米反应器的作用,其中含有用来合成发色聚合物点的单体、功能单体和催化剂。通过这种方法得到的发色聚合物点预期具有控制得很好的纳米至微米大小的尺寸,并且具有表面官能团,如羧酸、氨基、巯基、叠氮基、炔、醛、羟基、羰基、硫酸根(硫酸酯)、磺酸根(磺酸酯)、磷酸根(磷酸酯)、氰酸根(氰酸酯)、琥珀酰亚胺酯、它们的取代衍生物或其组合。然后,可通过标准生物共轭技术完成生物共轭连接。[《生物共轭技术》,美国纽约学术出版社,1996年]
2b.官能化试剂的掺混
或者,官能化CP点可这样制备:在一种或多种含有官能团的两亲性官能化试剂存在下,使一种或多种发色聚合物(其中许多可商购)坍缩。官能化试剂的两亲特性使分子的疏水性部分能被锚定在坍缩聚合物点的疏水性核中,而分子中包含一个或多个官能团的亲水性部分位于聚合物点的亲水性帽上。在某些实施方式中,官能化试剂可以是已经官能化的发色聚合物。在其他实施方式中,官能化试剂可以是非发色分子。
可用来使本发明的发色聚合物点官能化的官能化试剂的非限制性例子包括小有机分子、脂质分子和聚合物分子,它们包含官能团,如羧酸或其盐、氨基、巯基、叠氮基、炔、醛、羟基、羰基、硫酸根(硫酸酯)、磺酸根(磺酸酯)、磷酸根(磷酸酯)、氰酸根(氰酸酯)、琥珀酰亚胺酯、它们的取代衍生物或其组合。一般地,可使用任何能用于生物共轭连接的官能团。本领域的普通技术人员可在例如《生物共轭技术》(美国纽约学术出版社,1996年或2008年第2版)中找到这种官能团。这些分子可通过任何化学键合作用或物理作用力与发色聚合物点的核结合,在发色聚合物点上提供用于生物共轭连接的表面官能团。
较佳的是,官能化试剂是两亲性聚合物,它包含疏水性部分和含官能团的亲水性部分。疏水性部分通过疏水相互作用以物理方式嵌在聚合物点中,而亲水性部分延伸到溶液中。若需要,可利用官能化试剂的疏水性部分与聚合物点之间的化学结合作用进一步促进疏水性部分在聚合物点中的这种物理嵌合。更佳的是,官能化试剂是梳形两亲性聚合物,所述梳形两亲性聚合物包含多个疏水性部分的重复单元和多个亲水性部分的重复单元,使得官能化试剂通过强疏水作用力永久地锚定在聚合物点的核上,亲水性部分包含延伸到溶液中用于生物共轭连接的官能团。
两亲性官能化分子的疏水性部分可以是例如烷基,优选芳基,用来增强与由许多芳环组成的发色聚合物点的疏水性连接。亲水性部分可以是例如聚亚烷基二醇,优选聚乙二醇,它们可进一步被以下基团取代:如羧酸、氨基、巯基、叠氮基、炔、醛、羟基、羰基、硫酸根(硫酸酯)、磺酸根(磺酸酯)、磷酸根(磷酸酯)、氰酸根(氰酸酯)、琥珀酰亚胺酯、它们的取代衍生物或其组合。一般地,可使用任何能用于生物共轭连接的官能团。本领域的普通技术人员可在例如《生物共轭技术》(美国纽约学术出版社,1996年或2008年第2版)中找到这种官能团。
可利用本申请提供的基于混合两种混溶溶剂的方法(实施例1),由发色聚合物和官能化试剂制备官能化CP点。也可通过乳液法或细乳液法从发色聚合物和官能化试剂制备官能化CP点,所述方法基于包含两种不混溶液相(如水和另一种不混溶有机溶剂)的混合物在表面活性剂存在下的剪切。剪切过程如超声波处理得到包含发色聚合物和官能化试剂的稳定液滴。除去有机溶剂后,得到官能化CP点,它们的尺寸通常为几纳米至亚微米。这些官能化CP点可进一步生物共轭连接。
因此,在一个实施方式中,本发明提供了通过以下步骤制备生物共轭发色聚合物点的方法:(i)形成具有疏水性核和亲水性帽的官能化发色聚合物点,所述P点包含:(a)发色聚合物;以及(b)具有疏水性部分和连接到活性官能团上的亲水性部分的两亲性分子,其中发色聚合物嵌在P点的疏水性核内;一部分两亲性分子嵌在P点的核内,活性官能团位于亲水性帽中;以及(ii)通过连接到活性官能团上,使生物分子共价连接到聚合物点上。在一个优选的实施方式中,发色聚合物是半导体聚合物。
2c.非特异性结合的减少
如实施例11所示,生物分子在官能化P点的表面上会发生明显的非特异性吸附。这种非特异性吸附会干扰靶定分子的共价结合,造成共轭反应产物不可用。有利的是,研究发现在共轭反应中加入游离聚乙二醇消除了所关注的生物分子与官能化P点之间的非特异性结合,使共轭反应可以完成。此项发现将在本文提供的实施例11中阐述。
相应地,在一个实施方式中,本发明提供了将生物分子共轭连接到官能化发色聚合物点上的方法,所述方法包括:在适合将生物分子共轭连接到官能化发色聚合物点上的条件下,在包含水溶性聚合物的溶液中对官能化发色聚合物点和生物分子进行温育,其中溶液中水溶性聚合物的存在减少了生物分子在聚合物点表面上的非特异性吸附。一般可采用能减少靶生物分子与聚合物点表面的非特异性结合的任何水溶性聚合物。水溶性聚合物的非限制性例子包括聚亚烷基二醇(例如PEG)、PEO、聚丙二醇、聚氧化烯、淀粉、聚碳水化合物、聚唾液酸等。在一个优选的实施方式中,水溶性聚合物是聚亚烷基二醇。在一个具体实施方式中,水溶性聚合物是聚乙二醇。
在一个实施方式中,官能化发色聚合物点包含:(a)半导体聚合物;以及(b)连接到活性官能团上的两亲性分子,其中一部分两亲性分子嵌在聚合物点的核内,活性官能团位于聚合物点表面上。
在一个实施方式中,本发明提供了将生物分子共轭连接到官能化发色聚合物点上的方法,所述方法包括:在适合将生物分子共轭连接到官能化发色聚合物点上的条件下,在包含屏蔽剂的溶液中用生物分子温育官能化发色聚合物点,其中溶液中屏蔽剂的存在减少了生物分子在聚合物点表面上的非特异性吸附。
一般地,屏蔽剂可以是能减少或者有效消除靶生物分子与聚合物点的非特异性结合,从而使适当的共轭连接得以进行的任何分子。在一个实施方式中,屏蔽剂是水溶性聚合物,例如聚亚烷基二醇(例如PEG)、PEO、聚丙二醇、聚氧化烯、淀粉、聚碳水化合物、聚唾液酸等。在另一个实施方式中,屏蔽剂是洗涤剂,如非离子型洗涤剂或表面活性剂。可用的洗涤剂的非限制性例子包括曲通(Triton)X-100、吐温(Tween)20、吐温80、布里杰(Brij)洗涤剂等。在又一个实施方式中,屏蔽剂是碳水化合物,例如葡聚糖、直链淀粉、肝糖等。
成像和分子标记的方法
如上所述,相比于目前在用的材料,包括Q点和掺杂乳胶粒子,用荧光聚合物进行体内成像和分子标记具有多种优点。例如,荧光聚合物点具有高荧光亮度/体积比,具有高吸收截面、高辐射速率、高有效发色团密度和最低水平的凝聚诱导荧光猝灭。用荧光聚合物点作为荧光探针还带来其他有用的优点,如没有可析入溶液的重金属离子。但是,要将这些探针用于生物成像或探测应用,还有几个重要问题需要解决,特别是表面化学特性和生物共轭。
如本文所述,本发明为提供有用的发色聚合物点表面化学特性、官能化和生物共轭连接提出了许多解决方案。相应地,本发明为体内成像和分子标记提供了改进的方法,包括使用本发明提供的官能化发色聚合物点。
在一个实施方式中,本发明提供了在生物样品中标记靶分子的方法,所述方法包括使生物样品接触生物共轭发色聚合物点,其中生物共轭发色聚合物点包含核和帽,所述核包含发色聚合物,所述帽包含通过活性官能团连接到靶向部分的官能化试剂,前提是所述帽不全是有机硅酸盐/酯。靶向剂可以是任何能够与所关注的靶分子发生特异性结合的分子。在优选的实施方式中,靶向剂是抗体或其片段。在另一个相关的实施方式中,靶向剂是适配体。
在相关的实施方式中,提供了一种在生物样品中标记靶分子的方法,所述方法包括使生物样品接触生物共轭发色聚合物点,其中生物共轭发色聚合物点包含:(a)半导体聚合物;以及(b)通过活性官能团连接到靶向部分上的两亲性分子,其中一部分两亲性分子嵌在聚合物点的核内,靶向部分位于聚合物点表面上。靶向剂可以是任何能够与所关注的靶分子发生特异性结合的分子。在优选的实施方式中,靶向剂是抗体或其片段。在另一个相关的实施方式中,靶向剂是适配体。
所关注的靶定分子可以是有机体内能找到的任何分子,例如具体的细胞、蛋白质、核酸、碳水化合物、脂质、代谢物等。在一个具体实施方式中,靶分子是存在于细胞例如癌细胞的表面上的分子。在一个具体实施方式中,官能团选自炔、张力炔、叠氮化物、二烯、烯烃、环辛炔和膦基。
在另一个实施方式中,本发明提供了对细胞靶标进行生物正交标记的方法,所述方法包括使具有能参与点击化学反应的第一表面外露官能团的细胞靶标接触可点击发色聚合物点,其中可点击发色聚合物点包含核和帽,所述核包含发色聚合物,所述帽包含连接到第二官能团上的官能化试剂,所述第二官能团能够在点击化学反应中与第一官能团反应,前提是所述帽不全是有机硅酸盐/酯。在一个具体实施方式中,官能团选自炔、张力炔、叠氮化物、二烯、烯烃、环辛炔和膦基。
在相关的实施方式中,本发明提供了对细胞靶标进行生物正交标记的方法,所述方法包括使细胞靶标接触可点击发色聚合物点,其中所述细胞靶标具有能参与点击化学反应的第一表面外露官能团,所述可点击发色聚合物点包含:(a)半导体聚合物;以及(b)连接到第二官能团上的两亲性分子,所述第二官能团能够在点击化学反应中与第一官能团反应,其中一部分两亲性分子嵌在聚合物点的核内,第二官能团位于聚合物点表面上。
如上所述,将能参与点击化学反应的第一官能团结合到所关注的分子中的方法是本领域熟知的。例如,将叠氮化物装入生物分子的一条有吸引力的途径是基于代谢标记,通过这种途径,利用细胞的生物合成机构将含叠氮化物的生物合成前体结合到生物分子中。
用发色聚合物点检测Cu2+和Fe2+离子的方法
铜离子和铁离子是人体内三种最丰富的过渡金属离子(包括锌)中的两种。对于正常成年人,铜和铁的推荐摄入量分别在0.8-0.9毫克/日和8-18毫克/日的范围内。但众所周知,铜或铁过量会导致肝硬化、急性中毒、酸毒症、凝血病和极性呼吸窘迫综合征。根据美国环境保护署(EPA)修订的饮用水标准和健康忠告,铜和铁的限量分别是1.0mg/L和0.3mg/L。因此,人们正在努力开发更好的探测器,用来检测铜和铁,因为它们在环境和生物系统中具有重要意义(Que E.L.,等,Chem.Rev.,2008,108,1517-1549)。过去10年,基于纳米粒子的离子探测器受到强烈关注,因为它们简单,灵敏性和选择性好,可靠性高,成本较低。然而,对基于半导体聚合物纳米粒子(P点)的荧光离子探测器的探索仍无人涉足。
因此,一方面,本发明提供了定量检测铜和铁离子的策略。这种策略基于羧基官能化P点凝聚引起的荧光猝灭。对这种方法的阐述可参见实施例27。
一方面,本发明提供了一种用来检测Cu2+和Fe2+离子的灵敏的比例方法,该方法基于借助螯合的P点探测器。Cu2+和Fe2+的线性检测范围处在生理浓度范围。不过,若需要,可通过调节PS-COOH密度和/或P点的尺寸进一步拓宽此线性范围。这种简单、灵敏和经济的技术利用半导体聚合物纳米粒子的高亮度和光学可调性,为生理或环境分析提供了快速测定Cu2+和Fe2+的方法。
因此,在一个实施方式中,提供了一种检测溶液中铜(II)和/或铁(II)的方法,所述方法包括以下步骤:(a)使溶液接触羧基官能化的半导体聚合物点;以及(b)检测溶液中来自聚合物点的荧光水平,其中与聚合物点在不含铜(II)或铁(II)的溶液里的荧光相比,上述溶液中荧光的减少表明该溶液包含铜(II)和/或铁(II)。
在一个实施方式中,所述方法还包括通过以下手段对溶液中铜(II)的含量进行定量分析的步骤:(c)向溶液中加入二价阳离子螯合剂;(d)检测溶液在加入二价阳离子螯合剂之后的荧光水平;以及(e)确定溶液中的聚合物点在加入二价螯合剂前后的荧光差值,其中溶液中铜(II)的含量通过与标样的荧光差值相比较来确定。
在另一个实施方式中,所述方法还包括通过以下手段对溶液中铁(II)的含量进行定量分析的步骤:(c)向溶液中加入二价阳离子螯合剂(d)检测溶液在加入二价阳离子螯合剂之后的荧光水平;以及(e)确定溶液中的聚合物点在加入二价螯合剂之后的荧光与聚合物点在不含铜(II)和/或铁(II)的溶液中的荧光的差值,其中溶液中铁(II)的含量通过与标样的荧光差值相比较来确定。
实施例
提供以下实施例以进一步描述本发明,这些实施例不应用来限制本发明的范围。
举例说明了一种制备官能化发色聚合物点的方法,其过程包括将质子溶剂跟发色聚合物和官能化试剂在疏质子溶液中的混合物相混合的步骤。本发明还提供了生物共轭体及其组合物,所述生物共轭体包含官能化发色聚合物点和生物分子,其中生物分子直接或间接地连接到官能团上。
实施例1:制备官能化发色聚合物点的方法
本实施例提供了获得一定量的官能化发色聚合物点,以供后续表征和生物分子共轭连接之用的方法。图1显示了制备官能化发色聚合物点及其生物分子共轭体的示意图。
水溶液中的官能化发色聚合物点制备如下。首先,通过在惰性气氛中搅拌,将发色聚合物例如PFBT溶解在四氢呋喃(THF)中,制备浓度为1mg/mL的备用液。将一定量的官能化试剂,例如PS-PEG-COOH的THF溶液,与PFBT的稀溶液混合,得到PFBT浓度为40μg/mL和PS-PEG-COOH浓度为4μg/mL的溶液混合物。搅拌混合物,形成均相溶液。将5mL溶液混合物快速加入10mL去离子水中,同时对混合物进行声波处理。通过氮气汽提除去THF,并通过在90℃热板上将溶液连续氮气汽提至4mL来浓缩溶液,然后用0.2μm过滤器过滤。所得纳米粒子分散液在数月内保持澄清而稳定,没有凝聚的迹象。
实施例2:对官能化发色聚合物点的AFM表征
对于根据实施例1所提供的方法制备的官能化发色聚合物点,利用AFM评价其尺寸、形貌和单分散性。为进行AFM测量,将一滴纳米粒子悬浮液置于刚刚剖开的云母基片上。水蒸发之后,用数字仪器公司(Digital Instruments)的多模AFM以轻敲方式扫描表面。图2A显示了官能化发色聚合物点的代表性AFM图像。从AFM图像得到的粒子高度柱状图显示,多数粒子的直径在10-20nm的范围内(图2B)。将针尖宽度考虑进去之后,横向尺寸也在10-20nm的范围内。上述形貌和尺寸与不用官能化聚合物制备的聚合物点的形貌和尺寸一致,表明少量两亲性聚合物的存在对粒度和形貌没有明显影响。按照实施例1的制备方法,通过调节发色聚合物的注射浓度,可以制备尺寸在2-1000nm范围内的官能化发色聚合物点。
实施例3:对官能化发色聚合物点的光学表征
对按照实施例1所提供的方法制备的官能化发色聚合物点进行了荧光性质评价。利用1cm石英比色皿,通过DU 720分光光度计记录紫外-可见光吸收光谱。利用1cm石英比色皿,通过Fluorolog-3荧光计获取荧光光谱。官能化发色聚合物点具有与裸发色聚合物点类似的吸收和发射光谱(图3),说明表面官能化不影响聚合物点的光学性质。依据发色聚合物的种类,发色聚合物点在350-550nm范围内显示吸收带,此波长范围方便荧光显微观察和激光激发。图3显示了官能化发色聚合物PFBT的吸收和发射光谱。在已知粒子浓度下的紫外-可见光吸收光谱分析表明,单粒子(直径约为15nm)的峰值吸收截面约为2×10-13cm2,大致是CdSe量子点在可见光和近紫外范围内的峰值吸收截面的10-100倍,也大致比典型有机荧光染料的峰值吸收截面大三个数量级。
用香豆素6在乙醇中的稀溶液作为标样,PFBT点的荧光量子产率经测定为30%。荧光亮度定义为吸收截面与量子产率结果的乘积。尽我们所知,发色聚合物点的荧光亮度超过其他任何相同尺寸的纳米粒子在典型条件下的荧光亮度。粒子尺寸似乎对吸收和荧光光谱的形状没有明显影响——粒度增大的主要影响是吸收截面和亮度增加。此性质有利于调节粒度和亮度,以满足特定应用的需要,这与胶体半导体量子点形成对照。
实施例4:生物分子与官能化发色聚合物点的共轭连接
此实施例说明,官能化发色聚合物点能共轭连接到生物分子上,以供后续细胞结构成像之用,或者用于其他任何基于荧光的生物检测。根据本发明的方法制备的官能化发色聚合物点可共轭连接到任何包含伯胺基官能团的生物分子上,如蛋白质和抗体。在一种碳二亚胺如EDC存在下,羧基可与N-羟基琥珀酰亚胺(NHS)反应,生成含羧酸酯基的胺活性酯,用于与伯胺基团交联。在典型的生物共轭反应中,将20μL EDC(5mg/mL,在MilliQ水中)和10μL NHS(5mg/mL,在MilliQ水中)加入1mL官能化发色聚合物点(40μg/mL,在MilliQ水中)。将上述混合物放在回转式摇床上30分钟,进行活化。然后加入20μL聚乙二醇(5%重量/体积PEG)和20μL浓HEPES缓冲液(1M),得到经活化的聚合物点在20mM HEPES缓冲液中的溶液,pH为7.3。最后,将40μL链霉亲和素或IgG抗体(1mg/mL)加入上述溶液,反应在室温持续4小时。利用Sephacryl HR-300作为介质,通过凝胶过滤从游离生物分子中分离所得的发色聚合物点生物共轭体。
实施例5:发色聚合物点-IgG共轭体在检测活细胞内肿瘤标志物中的应用
此实施例举例说明了用发色聚合物点生物共轭体检测人乳癌细胞中的肿瘤标志物。在补充了10%胎牛血清和1%青霉素/链霉素的McCoy's 5A培养基中培养乳癌细胞系SK-BR-3。从培养瓶收集1百万个细胞,洗涤,重新悬浮在100μL标记缓冲液(1×PBS,2mM EDTA,0.5%BSA)中。在黑暗处和室温下,在摇床上用一级抗人CD326(EpCAM)抗体将细胞悬浮液温育30分钟,然后用标记缓冲液进行两个洗涤步骤。然后,在黑暗处和室温下,在摇床上用发色聚合物点二级IgG共轭体将细胞温育30分钟,然后再进行两个洗涤步骤。将一滴细胞悬浮液接种于盖玻片上,用载玻片覆盖,立即在荧光共焦显微镜[蔡司(Zeiss)LSM 510]下成像。
如图4A所示,在人SK-BR-3乳癌细胞用一级抗EpCAM抗体温育之后,发色聚合物点-IgG探针成功地标记出细胞表面上的EpCAM受体。当不存在一级抗体,即细胞仅用聚合物点-IgG温育时,检测到很少的信号,或者没有检测到信号(图4B),表明聚合物点-IgG共轭体对靶标具有特异性。
实施例6:发色聚合物点-链霉亲和素共轭体在亚细胞成像中的应用
此实施例举例说明了用发色聚合物点生物共轭体检测亚细胞结构。在补充了10%胎牛血清和1%青霉素/链霉素的伊戈尔(Eagles)最低必需培养基中培养乳癌细胞系MCF-7。将1万个细胞接种在22×22mm盖玻片上,在六孔板中用上述培养基培养,直至密度达到50-70%(汇合度)。细胞用4%多聚甲醛固定15分钟,用PBS中的0.25%曲通-X 100(Triton-X 100)进行15分钟通透处理,在2%BSA(重量/体积)中进行30分钟封闭处理。为了标记微管,经固定和BSA-封闭的MCF-7细胞依次用生物素化单克隆抗-α-微管蛋白抗体温育1小时,用发色聚合物点-链霉亲和素共轭体温育30分钟。将装有染色细胞的盖玻片安装在盖玻片上,利用荧光共焦显微镜(蔡司LSM 510)成像。如图5A所示,用发色聚合物点-链霉亲和素清晰地标记出微管。当细胞仅用发色聚合物点-链霉亲和素温育时,检测到非常弱的信号,或者没有明显的信号(图5B),表明聚合物点-链霉亲和素共轭体用于标记时具有特异性。
实施例7:半导体聚合物点的官能化
荧光半导体聚合物(9,9-二辛基芴-2,7-二基)-(1,4-苯并-{2,1’,3}-噻二唑)共聚物(PFBT,分子量157000,多分散度3.0)购自ADS戴斯公司(ADS Dyes,Inc.)(加拿大魁北克)。用经羧基官能化的氧化乙烯接枝的聚苯乙烯梳形聚合物(PS-PEG-COOH,主链分子量8500,接枝链分子量1200,总链分子量21700,多分散度1.25)购自聚合物原料公司(Polymer Source Inc.)(加拿大魁北克)。其他所有试剂都是从西格玛-阿尔德里奇(Sigma-Aldrich Inc.)公司[美国密苏里州圣路易斯市(St.Louis,MO,USA)]购买的;除非另有说明,否则,所有实验均在室温下进行。
水溶液中的官能化P点用改进的纳米沉淀法制备。首先,将PFBT溶解在四氢呋喃(THF)中,制备浓度为1mg/mL的备用液。PS-PEG-COOH也溶解在THF中,并与PFBT的稀溶液混合,得到PFBT浓度为50μg/mL和PS-PEG-COOH浓度为0-10μg/mL的溶液混合物。对混合物进行声波处理,形成均相溶液。将5mL溶液混合物快速加入浴槽式声波处理器(bath sonicator)里的10mL MilliQ水中。通过氮气汽提除去THF,并通过在90℃热板上将溶液连续氮气汽提至5mL来浓缩溶液,然后用0.2μm过滤器过滤。所得官能化P点分散液在数月内保持澄清而稳定,没有凝聚的迹象。
实施例8:官能化半导体聚合物点的物理表征
用PFBT浓度恒定而PS-PEG-COOH/PFBT分数在0-20重量%范围内的前体溶液混合物制备官能化PFBT点。用原子力显微镜(AFM,图7A)表征官能化PFBT点的尺寸和形貌。从AFM图像得到的粒子高度柱状图显示,大多数PFBT点的直径在10±3nm的范围内(图7B)。与未官能化的P点相比,少量PS-PEG-COOH聚合物的存在(<20重量%)对粒度和形貌没有造成明显影响。P点的吸收和发射光谱不随尺寸变化(Wu,C.;Bull,B.;Szymanski,C.;Christensen,K.;McNeill,J.ACS Nano 2008,2,2415-2423),因此,P点的这种不依赖于尺寸的特征显著放松了纳米粒子制备中在尺寸控制方面的约束。不仅如此,这种不依赖于尺寸的特征可有利地获得用于某些应用的更亮的探针,因为更大的尺寸仅仅提高探针的亮度。应当指出,就荧光团密度而言,这种官能化策略可得到有效的纳米粒子探针;例如,超过80%的半导体聚合物纳米粒子可以是有效的荧光团。相比之下,对于Q点和负载染料的球粒,有效荧光团局限于百分之几的粒子体积或重量,因为存在厚厚的包封层(对于Q点)或自猝灭染料(对于掺杂染料的球粒)。
实施例9:生物共轭半导体聚合物点的光学表征
首先用微流控流式细胞仪对P点生物共轭体的细胞标记亮度以及市售Q点565-链霉亲和素和Alexa-IgG探针的细胞标记亮度进行定量测定。流通实验在配有20×NA 0.4物镜的倒置显微镜[尼康Eclipse TE 2000-U,美国纽约州梅尔维尔市(Melville,NY,USA)]上用微流控芯片进行,其中微流控芯片具有200μm宽和50μm高的直孔道。利用注射泵将初步标记的细胞悬浮液(10000个/毫升)加入矩形孔道,速度为50μL/min,时间最长达5分钟。将488nm蓝宝石激光[美国加利福尼亚州圣克拉拉市柯西伦特公司(Coherent,Santa Clara,CA)]导入显微镜,激发样品。每次取样之前,用功率计测量光路上的激光进入显微镜之前的功率。荧光信号用500nm长通滤光片[HQ500LP;美国佛蒙特州罗金汉姆市克罗马公司(Chroma,Rockingham,VT,USA)]过滤,用单光子计数模块[APD,美国马萨诸塞州萨勒姆市珀金埃尔默SPCM-QC9-QTY2(PerkinElmer SPCM-QC9-QTY2,Salem,MA,USA)]收集。利用个人计算机和LabView编码程序[美国德克萨斯州奥斯汀市国家仪器公司(National Instruments Corporation,Austin,TX,USA)]以10kHz的取样频率读取SPCM的信号。将每个样品的原始APD计数存储在文本文件中,通过用户编码的Maple 5.1程序[加拿大安大略省滑铁卢市梅普软件公司(MapleSoft,Waterloo,ON,Canada)]转换为频率曲线。
P点-链霉亲和素和Q点565-链霉亲和素探针的细胞标记亮度也通过分析经过标记的MCF-7细胞的荧光图像来进行定量分析。将一滴细胞悬浮液置于盖玻片上,用载玻片覆盖,在配有AZ-Plan Apo 4×NA 0.4目镜的直立显微镜(尼康AZ100,美国纽约州梅尔维尔市)上观察。激发光由光纤照明器(130W汞灯)提供,用带通滤光片[瑟姆洛克(Semrock)公司FF01-482/35-25,美国纽约州罗切斯特市(Rochester,NY USA)]过滤。荧光信号用520nm长通滤光片(HQ520LP;美国佛蒙特州罗金汉姆市克罗马公司)过滤,在CCD照相机[普罗西利卡公司(Prosilica)GC1380,美国马萨诸塞州纽伯里波特市(Newburyport,MA)]上成像。通过用户编码的Labview程序处理荧光图像,得到单细胞标记亮度的强度分布(图12)。
实施例10:PFBT P点的单粒子成像
通过峰值吸收截面与荧光量子产率的乘积对荧光亮度进行有用的估计。光物理数据表明,在典型的激光激发(488nm)下,直径约为10nm的PFBT点的亮度约为IgG-Alexa 488和Q点565探针的亮度的30倍。对亮度的平行比较将进一步提供P点具有超常亮度的证据。我们做了单粒子成像,通过实验评价和比较三种探针的亮度和光稳定性。
简单地说,荧光样品用Milli-Q水稀释,在干净的盖玻片上进行真空干燥,在荧光显微镜上成像。用实验室自制的光学转向装置将来自蓝宝石激光器(美国加利福尼亚州圣克拉拉市柯西伦特公司)的488nm激光束导入倒置显微镜(尼康TE2000U,美国纽约州梅尔维尔市)。在物镜前面的换镜转盘处测量激光激发功率。用于照明和收集光的物镜是1.45NA 60×TIRF物镜(尼康公司,美国纽约州梅尔维尔市)。荧光信号用500nm长通滤光片(HQ500LP;美国佛蒙特州罗金汉姆市克罗马公司)过滤,在EMCCD照相机[弗米公司(Photometrics)Cascade:512B,美国亚利桑那州塔克森市(Tucson,AZ USA)]上成像。因为在图8中观察到一些P点粒子出现检测器饱和现象,在对P点样品成像时,将中性密度滤光片(光密度为1.5)与发射滤光片放置在一起。根据衰减因数反算P点粒子的荧光强度。通过获取一系列连续帧,得到单粒子光漂白测量结果。对于给定的粒子,通过对荧光斑上的CCD信号积分,估计每帧发射的荧光强度。
图8A、8B和8C分别显示了PFBT点、IgG-Alexa 488和Q点565在相同的捕获和激光激发条件下得到的典型单粒子落射荧光图像。对于各个PFBT点,利用来自488nm激光器的较低激发功率(1mW),清楚观察到非常亮的近衍射极限光斑。一些P点几乎使检测器饱和(图8A),而IgG-Alexa 488和Q点所显示的强度水平低得多,在我们所用的低激发功率下,照相机几乎检测不出(图8B、8C)。与Q点565和IgG-Alexa 488相比,PFBT点的信号/背景比提高了一个数量级。这样突出的对比主要缘于P点的高个体粒子吸收截面,这将特别适合于需要低激发条件的荧光检测。为进一步比较探针的性能,我们将激光激发功率增至4mW,使照相机能充分检测到Q点565和IgG-488探针。因为对于P点粒子观察到检测器饱和现象,所以在对P点样品成像时,将中性密度滤光片(光密度为1.5,挡掉97%的发射荧光)与发射滤光片放置在一起,它们的荧光强度根据衰减因数反算。对所有三种探针均减去背景。几千个粒子的荧光强度分布显示,PFBT点的亮度约为IgG-Alexa 488和Q点565的30倍(图8E),与基于光物理参数的亮度比较一致。
单粒子光漂白测量结果显示了PFBT点的优异光稳定性(图8F)。对多条光漂白轨迹的统计分析表明,在光漂白之前每个P点发射超过109个光子,比各个Q点565和IgG-Alexa 488粒子发射的光子数大两个或三个数量级。此外,可以高捕获率从各个P点得到大量光子(每20ms曝光时间内,从每个P点检测到约200000个光子),因为它们的亮度高,荧光寿命短,每个粒子存在多个发射位。这个特征最近被利用来产生约1nm的粒子示踪不确定度(Yu,J.;Wu,C.;Sahu,S.;Fernando,L.;Szymanski,C.;McNeill,J.J.Am.Chem.Soc.2009,131,18410–18414),这使得P点在高速单粒子示踪实验中远优于常规荧光染料和Q点。值得指出,多数PFBT点表现出连续发射行为,没有任何明显的荧光闪烁,而多数Q点出现很明显的闪烁(图8F)。P点的这种无闪烁特征在单分子应用中特别有价值。
实施例11:消除对官能化P点表面的非特异性结合
在第一次尝试对P点进行官能化时选择链霉亲和素,因为多数生物标记分子如抗体可以容易地用生物素得来。然而,因为P点的较大表面积具有固有的疏水性,虽然表面修饰可以使它更加亲水,但有一个问题是,生物分子将以非特异性的方式吸附到P点表面上。这个问题在羧基官能化的P点身上得到证实。简单地说,在没有偶联剂将羧基连接到生物分子的胺基上的情况下,在缓冲液中分别使羧基官能化的P点与链霉亲和素混合以及不与链霉亲和素混合,然后用生物素二氧化硅珠粒温育。离心之后,已用链霉亲和素温育的P点清晰地保留在生物素二氧化硅珠粒中,而未用链霉亲和素温育的P点没有与珠粒结合(图7C),因此表明链霉亲和素在P点表面上发生严重的非特异性吸附。
为了克服这种非特异性吸附,使P点在含0.1重量%聚乙二醇(PEG)的缓冲液中与链霉亲和素混合。没有看到所得P点与生物素二氧化硅珠粒发生可检测到的结合,表明PEG的存在显著减少了非特异性吸附(图7C)。因此,在含PEG的缓冲液中成功地发生了共价生物共轭连接。利用碳二亚胺,如盐酸1-乙基-3-[3-二甲基氨基丙基]碳二亚胺(EDC),催化P点上的羧基与链霉亲和素的胺基之间的肽键的形成。清楚地看到EDC催化的P点-链霉亲和素共轭体结合到生物素二氧化硅珠粒上;而对于在没有EDC存在下得到的产物,则没有观察到结合(图7C)。在单独的对照例中,对未官能化的裸P点采用相同的生物共轭连接条件(即链霉亲和素和EDC在含PEG的缓冲液中)。在生物素珠粒上没有发生可检测到的结合,进一步证实链霉亲和素与P点的生物共轭连接是共价连接,链霉亲和素-P点对生物素珠粒的标记是特异性的,没有任何可检测到的非特异性结合。
P点可进一步用添加剂如牛血清白蛋白(BSA)钝化,所述添加剂能维持长期胶体稳定性,屏蔽疏水性表面,减少标记实验中的非特异性结合。我们发现,在HEPES、PBS、Tris和硼酸盐缓冲液中,经BSA钝化的P点生物共轭体可在生理pH下稳定数月。图7D的内插图显示了PFBT-链霉亲和素共轭体在1×PBS缓冲液中保存6个月后的两张照片。在紫外灯照射下(365nm),PFBT共轭体的悬浮液稳定、澄清(不浑浊),发出强荧光。
实施例12:生物分子与官能化P点的共轭连接
链霉亲和素和山羊抗小鼠IgG抗体购自英骏公司[美国俄勒冈州尤金市(Eugene,OR,USA)]。利用P点上的羧基与生物分子上的胺基之间的EDC催化反应进行生物共轭连接。在典型的生物共轭反应中,将20L聚乙二醇(5%重量/体积PEG,分子量3350)和20L HEPES浓缓冲液(1M)加入1mL官能化P点溶液(50μg/mL,在MilliQ水中)中,得到20mM HEPES缓冲液中的P点溶液,pH为7.3。然后,将40μL链霉亲和素或IgG抗体(1mg/mL)加入上述溶液,在涡流搅拌器中充分混合。最后,将20L新鲜制备的盐酸1-乙基-3-[3-二甲基氨基丙基]碳二亚胺(EDC)溶液(5mg/mL,在MilliQ水中)加入上述溶液,在室温下将上述混合物在回转式摇床上放置4小时。最后,利用Sephacryl HR-300凝胶介质,通过凝胶过滤从游离生物分子中分离出所得的P点生物共轭体。
实施例13:细胞培养
乳癌细胞系MCF-7和SK-BR-3订购自美国典型培养物保藏中心(American Type Culture Collection)(ATCC)[美国弗吉尼亚州马纳萨斯市(Manassas,VA,USA)]。在补充了10%胎牛血清(FBS)、50U/mL青霉素和50μg/mL链霉素的伊格尔最低必需培养基(用于MCF-7)或McCoy's5A培养基(用于SK-BR-3)中,在37℃和5%CO2的条件下培养细胞。在实验之前预培养细胞,直至达到汇合。通过用培养基简单清洗的方式从培养瓶中收集细胞,然后用胰蛋白酶-EDTA溶液(0.25重量/体积%胰蛋白酶,0.53mM EDTA)在37℃温育5-15分钟。完全分离之后,清洗细胞,离心,重新悬浮在标记缓冲液(1×PBS,2mM EDTA,1%BSA)中。借助显微镜,利用血细胞计数器测定细胞浓度。
实施例14:发色聚合物点-IgG共轭体在检测CD326和CD340细胞标志物中的应用
前面已经说明,大概可以通过内噬作用将裸P点送入经过培养的细胞。但是,当P点通过非特异性方式结合到细胞表面时,特异性细胞靶标未得到标记(参见例如Wu,C.;Bull,B.;Szymanski,C.;Christensen,K.;McNeill,J.ACS Nano 2008,2,2415-2423;Pu,K.Y.;Li,K.;Shi,J.B.;Liu,B.Chem.Mater.2009,21,3816-3822;Howes,P.;Green,M.;Levitt,J.;Suhling,K.;Hughes,M.J.Am.Chem.Soc.2010,132,3989-3996;Rahim,N.A.A.;McDaniel,W.;Bardon,K.;Srinivasan,S.;Vickerman,V.;So,P.T.C.;Moon,J.H.Adv.Mater.2009,21,3492-3496)。因此,从这些研究中看不出是否能使P点探针具有足够的识别细胞靶标的特异性,以便在实际应用中用于有效标记。
从英骏公司(美国俄勒冈州尤金市)购买Q点565-链霉亲和素、Alexa488-IgG和BlockAidTM封闭缓冲液,用于细胞标记实验。用上述方法合成P点生物共轭体。
为了用IgG共轭体标记细胞表面标志物,在黑暗处和室温下,在回转式摇床上,用5μg/mL一级抗人CD326抗体[抗EpCAM,美国加利福尼亚州圣迭戈市白乐津公司(Biolegend,San Diego,CA,USA)](用于MCF-7细胞)或5μg/L一级抗人CD340,(抗Her2,美国加利福尼亚州圣迭戈市白乐津公司)温育100μL标记缓冲液中的1百万个细胞30分钟,接着进行用标记缓冲液洗涤的步骤。然后,在黑暗处和室温下,在摇床上用5nM P点-IgG或Alexa 488-IgG共轭体温育细胞30分钟,接着再进行两个洗涤步骤。为了用链霉亲和素共轭体标记细胞表面标志物,依次用5μg/mL一级抗人CD326抗体、5μg/mL生物素化二级抗小鼠IgG(美国加利福尼亚州圣迭戈市白乐津公司)和5nM P点-链霉亲和素或Q点565-链霉亲和素(美国俄勒冈州尤金市英骏公司)温育100μL标记缓冲液中的1百万个MCF-7细胞各30分钟,接着再进行两个洗涤步骤。将一滴细胞悬浮液置于盖玻片上,用载玻片覆盖,立即在荧光共焦显微镜(蔡司LSM 510)下成像。
链霉亲和素和IgG广泛用于生物共轭连接,用来对细胞靶标进行免疫荧光标记。我们制作了P点-IgG和P点-链霉亲和素探针,研究了它们标记特异性细胞靶标EpCAM/CD326的能力,EpCAM/CD326是目前用来检测循环肿瘤细胞的上皮细胞表面标志物。图9A显示,活MCF-7人乳癌细胞用单克隆一级抗EpCAM抗体温育之后,P点-IgG探针成功地标记了所述细胞表面上的EpCAM受体。当不存在一级抗体而仅单独用P点-IgG温育细胞时,未检测到细胞标记现象(图9A,下图),表明P点-IgG共轭体对靶标具有高度的特异性。
接着,用P点-链霉亲和素共轭体作为另一种探针检测EpCAM。P点-链霉亲和素探针与一级抗-EpCAM抗体和生物素化山羊抗小鼠IgG二级抗体一起,也有效地标记了活MCF-7细胞表面上的EpCAM(图9B)。当不存在生物素抗小鼠IgG而用一级抗体和P点-链霉亲和素温育细胞时,在细胞表面上没有观察到荧光(图9B,下图),因此,再次说明了P点-链霉亲和素的高度特异性结合。缺少信号也表明在此生物素-链霉亲和素标记体系中不存在非特异性结合。
然后,用P点生物共轭体标记不同的细胞系SK-BR-3上的另一种细胞表面标志物Her2[抗乳癌药物赫赛汀(Heceptin)的靶]以及亚细胞结构,如固定MCF-7细胞中的微管(图5)。在两种情况下,P点生物共轭体以特异性方式有效标记了靶标,说明它们能综合应用于细胞标记。
实施例15:发色聚合物点-IgG共轭体在标记微管中的应用
为了进行微管标记,将1万个MCF-7细胞接种在22×22mm盖玻片上,培养至密度达到60-70%(汇合度)。细胞用4%多聚甲醛固定15分钟,用PBS中的0.25%曲通-X 100进行15分钟通透处理,在2%BSA(重量/体积)中进行30分钟封闭处理。经过固定和BSA封闭的MCF-7细胞依次用5μg/mL生物素化单克隆抗α-微管蛋白抗体(美国加利福尼亚州圣迭戈市白乐津公司)温育60分钟,用10nM P点-链霉亲和素共轭体温育30分钟。将染色细胞安装在载玻片上,利用荧光共焦显微镜(蔡司LSM 510)成像。
实施例16:发色聚合物点共轭体在流式细胞测量中的应用
除荧光成像外,流式细胞测量是探针亮度十分重要的另一个领域。利用微流控流式细胞仪比较了P点生物共轭体与市售Q点-链霉亲和素及Alexa-IgG探针的标记亮度。图10A显示了用P点-链霉亲和素标记的MCF-7细胞的流通检测。在所用的最低激发强度(0.1mW)下,经P点标记的细胞的规整强度峰出现在远高于背景的地方。相比之下,经Q点标记的细胞的峰与背景没有明确分开(图10B)。随着激发强度增大,P点的峰移向更高的强度,并在激光功率为0.5mW时开始使检测器饱和。在所有激发条件下,用P点-链霉亲和素标记的MCF-7细胞的强度水平都比用Q点标记且标记浓度与P点-链霉亲和素相同的细胞的结果高得多。P点探针能在低激发条件下提供明显高得多的信号水平,对于光学浑浊的介质如血液或厚组织中的生物检测,这是非常有用的优点。
借助微流控流式细胞仪,利用P点-IgG和Alexa 488-IgG探针进行了类似的强度比较(图11)。利用流式细胞测量数据进行的定量分析表明,经P点标记的细胞的平均强度约比经Q点标记的细胞的平均强度亮24倍(图10C),约比经Alexa-IgG标记的细胞的平均强度亮17倍(图10D)。我们还通过分析用P点-链霉亲和素或Q点-链霉亲和素标记的MCF-7细胞的荧光图像对标记亮度进行了定量分析。经P点标记的细胞约比经Q点标记的细胞亮19倍,与流式细胞测量数据一致(图12)。
这些细胞标记比较值稍低于通过单点成像获得的比较值。更低的数值可归因于几个因素,如探针聚集体的集体发射行为与单个粒子相比的差异;抗体或链霉亲和素在生物共轭连接时的结合常数的变化;或者发射速率随激发强度的变化(饱和)。还值得指出,细胞标记是按照Q点-链霉亲和素和Alexa-IgG探针的优化浓度进行的,这种浓度对P点探针而言可能不是最佳的。因此,本比较是对P点生物共轭体相对于传统染料和Q点生物共轭体所提供的优点的保守估计。对于这类新的基于P点的探针,需要更详细的工作来优化生物共轭反应条件以及标记条件。无论如何,目前的细胞成像和流式细胞测量结果清楚地显示,与市售Alexa-IgG和Q点探针相比,P点标记在信号水平方面提供了显著的改进。
实施例17:与点击化学应用相适应的叠氮基和炔P点的制备
荧光半导体聚合物(9,9-二辛基芴-2,7-二基)-(1,4-苯并-{2,1’,3}-噻二唑)共聚物(PFBT,平均分子量157000,多分散度3.0)购自ADS戴斯公司(加拿大魁北克)。苯乙烯-马来酸酐共聚物(PSMA,枯烯封端,平均分子量约为1700,苯乙烯含量为68%)购自西格玛-阿尔德里奇公司(美国密苏里州圣路易斯市)。用于制备纳米粒子的其他所有试剂都是从西格玛-阿尔德里奇公司(美国密苏里州圣路易斯市)购买的。
水溶液中的官能化P点用改进的纳米沉淀法制备。除非另有说明,否则,所有实验均在室温下进行。在典型的制备中,首先将荧光半导体聚合物PFBT溶解在四氢呋喃(THF)中,制备1mg/mL的备用液。将共聚物PSMA也溶解在THF中,与PFBT稀溶液混合,得到PFBT浓度为50μg/mL和PSMA浓度为20μg/mL的溶液混合物。对混合物进行声波处理,形成均相溶液。将5mL溶液混合物快速加入浴槽式声波处理器里的10mL MilliQ水中。通过氮气汽提除去THF。通过在90℃热板上将溶液连续氮气汽提至5mL来浓缩溶液,然后用0.2μm过滤器过滤。在纳米粒子的形成过程中,PSMA分子中的马来酸酐单元在水性环境中水解,在P点上产生羧基。P点分散液在数月内保持澄清而稳定,没有凝聚的迹象。
利用羧基P点与各含胺分子之间的EDC催化反应进行表面共轭连接。利用11-叠氮基-3,6,9-三氧杂十一烷-1-胺形成叠氮基P点。用炔丙胺生成炔P点。用胺封端的聚乙二醇形成PEG P点。在典型的生物共轭反应中,将60μL聚乙二醇(5%重量/体积PEG,分子量3350)和60μL HEPES浓缓冲液(1M)加入3mL羧基P点溶液(50μg/mL,在MilliQ水中)中,得到20mM HEPES缓冲液中的P点溶液,pH为7.3。然后,将30μL含胺的分子(1mg/mL)加入上述溶液,在涡动搅拌器上充分混合。最后,将60μL新鲜制备的EDC溶液(5mg/mL,在MilliQ水中)加入上述溶液,在室温下对上述混合物进行4小时的磁搅拌。最后,通过伯乐公司(Bio-Rad)的10DG柱[美国加利福尼亚州赫库斯市(Hercules,CA,USA)]从游离分子中分离所得的P点共轭体。
实施例18:可点击P点的表征
利用商业Fluorolog-3荧光计[美国新泽西州霍力巴乔宾伊冯公司(HORIBA Jobin Yvon,NJ USA)]得到荧光光谱。对直径约为15nm的PFBT点的吸收光谱进行的分析显示峰值消光系数为5.0×107M-1cm-1(图15)。用香豆素6在乙醇中的稀释液作为标样,官能化P点的荧光量子产率经测定为0.28。大消光系数和高量子产率表明其个体粒子亮度比其他荧光纳米粒子的亮度高得多。官能化P点的单粒子光漂白研究显示,在光漂白之前每个P点发射超过109个光子,与其优异的光稳定性一致(C.Wu,B.Bull,C.Szymanski,K.Christensen,J.McNeill,ACS Nano 2008,2,2415)。
用0.7%琼脂糖凝胶进行凝胶电泳,以表征不同官能团在P点表面上的形成(图17b)。与未官能化的裸P点相比,羧基官能化的P点在凝胶中的流动性明显增强。简单地说,用潜水电泳系统进行官能化P点的琼脂糖凝胶电泳。将P点(在30%甘油中)负载到含0.1%PEG的0.7%琼脂糖凝胶上。负载P点的凝胶在Tris-硼酸盐-EDTA(TBE)缓冲液中于135V下进行20分钟电泳,然后在柯达图像站440CF系统上成像。
动态光散射和透射电镜(TEM)测量结果显示,裸P点和官能化P点具有相近的粒度,平均直径约为15nm(图17c)。因此,PSMA官能化的P点的高流动性表明在P点表面上形成了带负电荷的羧基。进行TEM测量时,将一滴P点分散液置于碳包被铜网上。水蒸发之后,纳米粒子用透射电镜(FEI Tecnai F20)成像。使用1cm石英比色皿,通过DU 720扫描分光光度计[美国加利福尼亚州贝克曼考尔特公司(Beckman Coulter,Inc.,CA USA)]记录紫外-可见光吸收光谱。
用不同的含胺的分子[胺封端的聚乙二醇(PEG)、叠氮化物和炔]进行表面共轭连接。共轭P点的动态光散射显示粒度没有明显变化,因为共轭连接的是小分子。但是,由于与羧基官能化的P点相比,P点共轭体的电荷减少,所以它们在凝胶中的迁移带如所预期的那样表现出位移。这些结果清楚表明,P点的羧基官能化以及所有后续表面修饰均获得成功。
实施例19:官能化P点的稳定性
分析了P点荧光在生物应用中的pH和离子敏感性问题,特别是铜催化的点击化学。研究发现,包括铁、锌和铜这三种生物有机体中最丰富的离子在内,大多数与生物相关的离子不影响P点的荧光。在4-9的pH范围内,P点荧光对pH也没有依赖性(图16)。这个事实可归因于P点的疏水有机属性,使它们不易与离子物质发生任何化学相互作用。相比之下,铜和铁离子明显会使无机Q点猝灭(H.Y.Xie,H.G.Liang,Z.L.Zhang,Y.Liu,Z.K.He,D.W.Pang,Spectrochimica Acta Part A 2004,60,2527)。如图17a所示,在含1mM高浓度Cu+的MilliQ水中,PFBT点保持高荧光性,而Q点在1μM这样低得多的Cu+浓度下被完全猝灭(S.Han,N.K.Devaraj,J.Lee,S.A.Hilderbrand,R.Weissleder,M.G.Bawendi,J.Am.Chem.Soc.2010,132,7838)。在基于铜(I)催化的点击反应的各种研究中,这种性质为P点的应用提供了显著的优点。为防止P点在铜溶液中自发凝聚,我们在溶液中添加了PEG。
实施例20:可点击P点的反应活性
图17d显示了通过铜(I)催化的点击反应检验叠氮基-P点对端炔基的反应活性的荧光分析结果。叠氮基P点与铜溶液混合时,所显示的发射强度类似于纯P点,证实它们的荧光对铜离子不敏感。在P点与炔-Alexa 594[无Cu(I)]的混合物中观察到强度稍降,但这主要是因为内滤效应,而不是因为荧光共振能量转移(FRET)直接导致猝灭。相比之下,当在Cu(I)存在下直接连接到炔-Alexa 594上时,叠氮基-P点发生显著的荧光猝灭,并伴有来自Alexa染料的发射峰。这种光谱变化是从PFBT点到附近的Alexa染料发生了有效FRET的直接结果,表明发生了有效的叠氮化物-炔点击反应。此外,我们还将叠氮基-P点点击到炔官能化的二氧化硅纳米粒子上,将光学惰性的二氧化硅粒子转化为具有高荧光性的探针。即使在汞灯照明的低放大倍数(4×)荧光显微镜下,P点-二氧化硅共轭体也在单粒子水平上清晰可见(图17e)。
炔-Alexa 594染料购自英骏公司(美国俄勒冈州尤金市),用于与叠氮化物-P点的点击反应。在典型反应中,在1mM CuSO4和5mM抗坏血酸钠存在下,在含1%BSA的MilliQ水中的50nM叠氮基-P点与5μM炔-Alexa 594染料混合30分钟,然后进行光谱测量。按照标准斯托伯法制备二氧化硅胶体(直径约为200nm),用于叠氮基-P点到炔-二氧化硅粒子的点击反应。二氧化硅粒子的炔官能化进行如下:用无水乙醇洗涤80mg二氧化硅粒子,干燥、重新悬浮在4mL无水二甲基甲酰胺(DMF)中。将80μL O-(炔丙氧基)-N-(三甲氧基甲硅烷基丙基)氨基甲酸酯加入DMF悬浮液中的二氧化硅里,所得混合物在90℃热板上进行24小时的磁搅拌。用乙醇彻底洗涤炔官能化的二氧化硅纳米粒子,重新悬浮在MilliQ水中。对于典型的点击反应,在1mM CuSO4和5mM抗坏血酸钠存在下,0.5mL 50nM叠氮基-P点(在含1%BSA的MilliQ水中)与0.1mL炔-二氧化硅粒子(20mg/mL)混合2小时。然后用MilliQ水彻底洗涤P点修饰的二氧化硅粒子。将一滴P点修饰的二氧化硅粒子的稀溶液置于盖玻片上,以汞灯为激发源,在配有AZ-Plan Apo 4×物镜的直立显微镜(尼康AZ100,美国纽约州梅尔维尔市)上观察。
实施例21:用可点击P点进行的代谢标记
为了说明利用P点和点击化学技术进行细胞标记,考察了通过生物正交非规范性氨基酸标识(BONCAT)修饰的新合成蛋白质。在BONCAT技术中,细胞中新合成的蛋白质用带人工氨基酸的叠氮基(或炔)进行代谢标记。人工氨基酸赋予蛋白质独特的化学功能性,该功能性使蛋白质随后可用外源性探针标识,用于高选择性检测或分离(D.C.Dieterich,A.J.Link,J.Graumann,D.A.Tirrell,E.M.Schuman,Proc.Natl.Acad.Sci.USA 2006,103,9482)。叠氮基高丙氨酸(AHA)和高炔丙基甘氨酸(HPG)是此方法中常用的两种人工氨基酸。它们是必需氨基酸蛋氨酸的有效代用品;在不存在蛋氨酸的情况下,细胞合成机构径直将它们结合到蛋白质中。此方法在操作上类似于用放射性氨基酸35S-蛋氨酸进行的传统代谢标记。结合进去之后,AHA和HPG易用外源性探针标识,在此实施例中,所述外源性探针是进行原位成像的高荧光性P点。
首先,用P点-炔探针靶定经AHA标记的蛋白质。使MCF-7人乳癌细胞生长至汇合,然后将其送入缺少蛋氨酸的无血清培养基。在通过温育耗尽任何残余蛋氨酸之后,给细胞培养物补充4小时的AHA。然后,洗涤并固定细胞,再在CuSO4、还原剂(抗坏血酸钠)和三唑配体存在下,用炔-P点进行点击反应。立即在共焦荧光显微镜上观察经P点标识的细胞。用相同的装置获取经P点标记的细胞和阴性对照样的图像。
简单地说,从英骏公司(美国俄勒冈州尤金市)购买高炔丙基甘氨酸(HPG)和BlockAidTM封闭缓冲液,用来对新合成的蛋白质进行代谢标记。叠氮基高丙氨酸(AHA)购自医用化学原料公司(Medchem Source LLP)[美国华盛顿州费德勒尔韦市(Federal Way,WA,USA)]。使MCF-7细胞生长至汇合,然后将其送入缺少蛋氨酸的无血清培养基。在通过1小时的温育耗尽任何残余蛋氨酸之后,给培养物补充4小时的0.1mM AHA或HPG。用1X PBS洗涤细胞,用4%多聚甲醛/PBS固定,在BlockAidTM封闭缓冲液中封闭。用1mM CuSO4、5mM抗坏血酸钠、0.5mM三((1-苄基-1H-1,2,3-三唑-4-基)甲基)胺(TBTA,三唑配体)和50nM炔-P点(用于经AHA标记的细胞)或叠氮基-P点(用于经HPG标记的细胞)的混合物将经AHA或HPG标记的细胞温育1小时。然后,经P点标识的细胞用Hoechst 34580复染,并立即在荧光共焦显微镜(蔡司LSM 510)上成像。
图18显示了经P点标记的细胞和对照样品的共焦荧光图像和明视场图像。经AHA-标记的细胞用P点-炔通过点击反应标识之后,观察到非常亮的荧光(图18a-18d)。当温育细胞的其他条件相同,只是没有还原剂(抗坏血酸钠)使CuSO4形成铜(I)时,没有观察到P点对细胞的标记,表明P点-炔对铜(I)催化反应具有选择性(图18e-18h)。在另一个对照实验中,在与图18a-18d中相同的条件下进行铜(I)催化的P点-炔标识,但它是在未接触AHA的细胞中进行的。在此对照实验中,未观察到细胞标记(图19),表明P点-炔标识对所关注的细胞靶标具有高特异性。此外,用P点-叠氮化物检测用HPG温育的MCF-7细胞中新合成的蛋白质。在此情况中,P点-叠氮化物也以特异性的方式有效地标记了靶标(图20)。与P点-炔标记(经AHA处理的细胞)相比较,未观察到P点-叠氮化物标记(经HPG处理的细胞)在荧光亮度上的明显差异。这与文献结果一致,即HPG和AHA在哺乳动物细胞初生蛋白质的合成中具有非常类似的活性。
实施例22:用可点击P点进行的糖蛋白标记
用P点-炔有选择地靶定糖蛋白,所述糖蛋白是广泛参与各种生物功能的蛋白质亚组。先前已经开发出生物正交化学反应策略,用于探测培养的细胞上和各种活生物体中的多聚糖(参见例如J.A.Prescher,D.H.Dube,C.R.Bertozzi,Nature 2004,430,873;D.H.Dube,J.A.Prescher,C.N.Quang,C.R.Bertozzi,Proc.Natl.Acad.Sci.USA 2006,103,4819;S.T.Laughlin,C.R.Bertozzi,Proc.Natl.Acad.Sci.USA 2009,106,12;M.A.Breidenbach,J.E.G.Gallagher,D.S.King,B.P.Smart,P.Wu,C.R.Bertozzi,Proc.Natl.Acad.Sci.USA 2010,107,3988)。所述方法包括使用经叠氮基官能化的单糖前体对多聚糖进行代谢标记,然后用成像探针对叠氮基糖进行共价标识。用N-叠氮基乙酰基半乳糖胺(GalNAz)将MCF-7细胞温育三天,其目的是使O连接的糖蛋白具有丰富的叠氮基。用P点-炔通过点击反应对经GalNAz处理的细胞进行标识,随后在共焦显微镜上观察。对于用P点-炔进行阳性标识的细胞,观察到亮细胞表面标记(图21a-21d)。在阴性对照实验中,细胞在没有还原剂的情况下用P点-炔温育,结果没有观察到细胞标记(图21e-21h)。作为附加对照,在相同条件下进行P点标识,但细胞中缺乏叠氮化物;在此情况下,未观察到细胞标记,再次表明P点标记对所关注的细胞靶标具有高特异性。
简单地说,从英骏公司(美国俄勒冈州尤金市)购买N-叠氮基乙酰基半乳糖胺(GalNAz),用于糖蛋白的代谢标记。用含50μM N-叠氮基乙酰基半乳糖胺(GalNAz)的通用EMEM培养基将MCF-7细胞培养三天,其目的是使O连接的糖蛋白具有丰富的叠氮基。用1X PBS洗涤经GalNAz标记的细胞,用4%多聚甲醛/PBS固定,在BlockAidTM封闭缓冲液中封闭。然后,用1mM CuSO4、5mM抗坏血酸钠、0.5mM三((1-苄基-1H-1,2,3-三唑-4-基)甲基)胺(TBTA,三唑配体)和50nM炔-P点的混合物将经GalNaz标记的细胞温育1小时。然后,经P点标识的细胞用Hoechst 34580复染,并立即在荧光共焦显微镜(蔡司LSM 510)上成像。
实施例23:发红光PB点的制备和官能化
按照先前的报告合成和表征发红光的半导体聚合物PF-0.1TBT和PF-0.1DHTBT[Hou,Q.等,J.Mater.Chem.12,2887-2892(2002);Hou,Q.等,Macromol.37,6299-6305(2004)]。捕光半导体聚合物{9,9-二辛基-2,7-二亚乙烯基-亚芴基}-{2-甲氧基-5-(2-乙基己氧基)-1,4-亚苯基}交替共聚物(PFPV,分子量220000,多分散度3.1)和(9,9-二辛基芴-2,7-二基)-(1,4-苯并-{2,1’,3}-噻二唑)共聚物(PFBT,分子量157000,多分散度3.0)购自ADS戴斯公司(加拿大魁北克)。两亲性官能聚合物苯乙烯-马来酸酐共聚物(PSMA,枯烯封端,平均分子量约为1700,苯乙烯含量为68%)购自西格玛-阿尔德里奇公司(美国密苏里州圣路易斯市)。用于制备PB点的其他所有试剂都是从西格玛-阿尔德里奇公司(美国密苏里州圣路易斯市)购买的。
利用改进的纳米沉淀法制备水溶液中的官能化PB点[Wu,C.,Peng,H.,Jiang,Y.&McNeill,J.J.Phys.Chem.B 110,14148-14154(2006);Wu,C.,Bull,B.,Szymanski,C.,Christensen,K.&McNeill,J.ACS Nano 2,2415–2423(2008)]。除非另有说明,否则,所有实验均在室温下进行。在典型的制备过程中,首先分别将捕光聚合物PFBT、发红光聚合物PF-0.1TBT和两亲性官能PSMA溶解在四氢呋喃(THF)中,制备1mg/mL的备用液。在THF中稀释和混合三种聚合物溶液,得到PFBT浓度为50μg/mL、PF-0.1TBT浓度为30μg/mL和PSMA浓度为20μg/mL的溶液混合物。对混合物进行声波处理,形成均相溶液。将5mL溶液混合物快速加入浴槽式声波处理器里的10mL MilliQ水中。通过氮气汽提除去THF。通过在90℃热板上将溶液连续氮气汽提至5mL来浓缩溶液,然后用0.2μm过滤器过滤。在纳米粒子的形成过程中,PSMA分子中的马来酸酐单元在水性环境中水解,在PB点上产生羧基。PB点分散液在数月内保持澄清而稳定,没有凝聚的迹象。
实施例24:对羧基掺混聚合物点(PB点)表面生物共轭连接
从阿罗蒙实验室公司(Alomone Labs,Ltd.)(以色列耶路撒冷)购买肿瘤特异性肽配体氯毒素(CTX),用于生物分子共轭连接。链霉亲和素购自英骏公司(美国俄勒冈州尤金市)。1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)和胺封端的聚乙二醇(甲基-PEG8-NH2)购自瑟莫费什尔科学公司(Thermo Fisher Scientific)[美国伊利诺伊州罗克福德市(Rockford,IL,U.S.A)]。
利用羧基PB点与各含胺的生物分子(甲基-PEG8-NH2、氯毒素和链霉亲和素)之间的EDC催化反应进行生物共轭连接。在典型的共轭反应中,将60μL聚乙二醇(5%重量/体积PEG,分子量3350)和60μL HEPES浓缓冲液(1M)加入3mL羧基PB点溶液(50μg/mL,在MilliQ水中)中,得到20mM HEPES缓冲液中的PB点溶液,pH为7.3。然后,将30μL含胺的分子(1mg/mL)加入上述溶液,在涡动搅拌器上充分混合。最后,将60μL新鲜制备的EDC溶液(5mg/mL,在MilliQ水中)加入上述溶液,在室温下对上述混合物进行4小时的磁搅拌。最后,通过伯乐公司的10DG柱(美国加利福尼亚州赫库斯市)从游离分子中分离所得PB点-CTX和PB点-PEG。利用Sephacryl HR-300凝胶介质,通过凝胶过滤分离PB点-链霉亲和素生物共轭体。
实施例25:掺混聚合物点(PB点)的表征
进行单粒子成像,从而对PB点与在655nm处发光的Q点进行平行亮度比较,在655nm处发光的Q点是不同颜色的Q点探针中最亮的。当为了能够合理地检测Q点655(图26b)而采用488nm激光激发源时,在相同的捕获和激光条件下,大部分PB点实际上使检测器饱和。这种突出的对比缘于PB点的高摩尔消光系数(对于直径约为15nm的纳米粒子,在488nm处约为3.0×107cm-1M-1)。为避免检测器饱和,将中性密度滤光片(光密度为1,挡住90%的发射荧光)与发射滤光片放置在一起,得到PB点的单粒子荧光图像(图26c)。收集数千粒子,根据衰减因数反算其荧光强度。荧光强度分布显示,PB点的亮度约为Q点655纳米晶体的亮度的15倍(图26d),与基于体相光谱分析的亮度比较结果一致。通过TCSPC装置测得的PB点荧光寿命是3.5ns。值得指出,单PB点包含多个发射位,导致其光子发射速率高于仅根据荧光寿命预期的光子发射速率。
实施例26:共轭PB点的制备和表征
利用改进的纳米沉淀法制备水溶液中的官能化PB点[Veiseh,O.等,Cancer Res.69,6200-6207(2009);Choi,H.S.等,Nature Biotechnol.25,1165-1170(2007)]。在典型的制备过程中,将捕光聚合物PFBT、发红光聚合物PF-0.1TBT和官能聚合物PSMA溶解在四氢呋喃(THF)中,得到PFBT浓度为50μg/mL、PF-0.1TBT浓度为30μg/mL和PSMA浓度为20μg/mL的溶液混合物。对混合物进行声波处理,形成均相溶液。将5mL溶液混合物快速加入浴槽式声波处理器里的10mL MilliQ水中。通过氮气汽提除去THF。通过在90℃热板上将溶液连续氮气汽提至5mL来浓缩溶液,然后用0.2μm过滤器过滤。
将氯毒素(CTX),一种含36个氨基酸的肽,选作肿瘤靶向配体,因为它对神经外胚层来源的肿瘤具有强亲和性。研究显示,CTX与神经胶质瘤、髓母细胞瘤、前列腺癌、肉瘤和肠癌发生特异性结合。首先,用两亲性聚合物苯乙烯-马来酸酐共聚物(PSMA)对PB点进行官能化。将PSMA分子的疏水性聚苯乙烯单元锚定在PB点粒子内部,同时使马来酸酐单元位于PB点表面,并在水性环境中水解,产生羧基。羧基使其表面能够通过标准碳二亚胺化学技术发生共轭连接[Hermanson,G.T.,生物共轭技术(Bioconjugate Techniques)(学术出版社,圣迭戈,2008年)]。
除CTX外,可共轭连接聚乙二醇(PEG),以抑制蛋白质的吸附,限制免疫识别,从而增加体内纳米粒子浆液的半寿期。还在生物共轭连接中用链霉亲和素作为独立对照,以通过特异性细胞标记验证共轭连接策略。透射电镜(TEM)观察结果显示,裸PB点和官能化PB点具有相近的粒度(直径约为15nm)(图26d),与动态光散射结果一致(图29)。共轭连接到不同分子(PEG、CTX和链霉亲和素)上之后,凝胶电泳显示0.7%琼脂糖凝胶中PB点-共轭体的迁移带发生位移,因为表面电荷和粒度发生了变化。这些结果清楚表明羧基官能化和表面生物共轭连接获得成功。
利用羧基P点与各含胺的生物分子(氯毒素、甲基-PEG8-NH2或链霉亲和素)之间的EDC催化反应进行表面生物共轭连接。在典型的共轭反应中,将60μL聚乙二醇(5%重量/体积PEG,平均分子量3350)和60μL HEPES浓缓冲液(1M)加入3mL羧基PB点溶液(50μg/mL,在MilliQ水中)中,得到20mM HEPES缓冲液中的PB点溶液,pH为7.3。然后,将30μL含胺的分子(1mg/mL)加入上述溶液,在涡动搅拌器上充分混合。最后,将60μL新鲜制备的EDC溶液(5mg/mL,在MilliQ水中)加入上述溶液,在室温下对上述混合物进行4小时的磁搅拌。最后,通过伯乐公司的10DG柱(美国加利福尼亚州赫库斯市)从游离分子中分离所得的PB点-CTX和PB点-PEG。利用Sephacryl HR-300凝胶介质,通过凝胶过滤分离PB点-链霉亲和素生物共轭体。
对于体内探针的设计,长期走向和体内稳定性在临床上具有基础意义。纳米探针的完整性主要取决于它们在生物环境中对离子物质和活性氧物质(ROS)的化学活性。例如,由于存在生理浓度的铜离子和ROS,Q点发生严重的化学降解,导致荧光丧失并放出有毒的Cd离子。检验了PB点对pH、生物相关离子和ROS的敏感性。在4-9的生理pH范围内,PB点显示恒定的荧光(图30)。在试验中,PB点的荧光也不受任何生物相关离子的影响(图31),包括铁、锌和铜这三种生物有机体中最丰富的离子。此外,生理环境中两种常见而稳定的ROS,即次氯酸(HOCl)和过氧化氢(H2O2),对PB点的荧光没有显示任何影响。相比之下,在与PB点所用的浓度相同时,与链霉亲和素共轭连接、用聚合物包封的Q点655探针明显被H2O2和铁猝灭,并且完全被HOCl和铜离子猝灭。PB点的稳定荧光可归因于它们的疏水有机聚合物属性,这种属性使它不易与金属离子和ROS发生化学相互作用。这种性质为PB点用作体内探针提供了显著的优点。
实施例27:通过官能化P点检测Cu2+和Fe2+离子
一般将40μg PFBT和8μg PSMA溶解于5mL THF。然后,在强烈声波处理下,将此混合物快速注射到10mL水中。然后,在96℃热板上用氮气吹扫一小时,除去THF。通过0.2μm纤维素乙酸酯膜过滤器过滤所得的P点溶液,除去制备过程中形成的任何凝聚体。
采用高荧光半导体聚合物(9,9-二辛基芴-2,7-二基)-(1,4-苯并-{2,1’-3}-噻二唑)共聚物(PFBT),将PSMA聚合物(20%)加入PFBT基质,形成PS-COOH/PFBT共混P点。通过马来酸酐单元的水解在P点表面上产生羧基,同时聚苯乙烯部分倾向于锚定在PFBT聚合物的疏水性核内部。这些P点在水溶液中分散良好,羧基部分不经修饰将作为金属离子的选择性配位基团。研究发现,羧基官能化PFBT P点的荧光有选择地被Cu2+和Fe2+离子猝灭(图32)。
几种不同类型的聚合物,包括PFBT和聚[(4-(5-(7-甲基-9,9-二辛基-9H-芴-2-基)噻吩-2-基)-7-(5-甲基噻吩-2-基)苯并[c][1,2,5]噻二唑)](PFTBT)P点(不与PSMA掺混)对缓冲液中的各种离子表现出优异的稳定性(不发生凝聚和猝灭)(见下页),这说明未官能化的P点可在这些方法中用作良好的对照物。
P点的凝聚和自猝灭行为缘于P点表面上PS-COOH基团与溶液中Cu2+和Fe2+之间的螯合相互作用。我们要指出,在此实施例所述的实验中,我们没有在溶液里加入PEG,因为PEG会阻止P点的凝聚和自猝灭行为。在加入Cu2+前后进行的透射电镜(TEM)测量结果清楚地揭示了这个现象(图33A和B)。动态光散射(DLS)测量结果还显示,初步制备的P点的平均直径在加入Cu2+之前约为21nm,而在加入Cu2+之后增至约500nm(图33C)。
还研究了其他各种具有生理重要性的阳离子对PS-COOH/PFBT共混P点的荧光的影响。结果发现,与PS-COOH/PFBT共混P点在纯水中的发射强度(I空白)相比,它们的发射强度不受其他阳离子影响,或者受到极小(图34)的影响。
在此项研究中,用非官能化PFBT/PFTBT共混P点用作内标。PS-COOH/PFBT共混P点在490nm以下波长激发时于540nm处发射,而PFBT/PFTBT共混P点在相同波长下激发时于620nm处发射。这种发射波长的位移由PFBT向PFTBT的高效能量转移以及随后PFTBT的发射引起。用PFBT/PFTBT共混P点作内标,就可以应用基于两种荧光发射强度(540nm/623nm)的比例离子测定法(ratiometric ion determination),从而消除来自环境或仪器漂移带来的任何干扰。
图35A显示了包含PS-COOH/PFBT共混P点和PFBT/PFTBT共混P点的溶液随Cu2+浓度变化的发射光谱。显然,尽管包含PFTBT的P点的发射强度(623nm)保持恒定,包含PS-COOH的P点的强度(540nm)随Cu2+浓度逐渐增加至30μM而下降。在超过30μM的浓度下,没有观察到荧光强度的进一步减小,表明所有羧基都已被铜离子占据。对于这组实验,10次重复的空白信号的相对标准偏差为1.1%。在铜离子浓度为100nM时,可观察到约6%的猝灭信号。图35B显示了比例I540nm/I623nm与1-30μM范围内的Cu2+浓度之间的线性关系(R2=0.992)。
因为P点表面上的羧基部分与Cu2+之间形成2:1夹心络合物会引起凝聚诱导荧光猝灭,可预期强铜离子螯合剂乙二胺四乙酸(EDTA)能抢夺羧基,从而使凝聚体重新分散。为了验证此假设,将摩尔量与Cu2+离子相同的EDTA加入凝聚的P点溶液,发现PS-COOH/PFBT共混P点的荧光强度完全恢复(图35C)。
此外,在溶液中加入过量的EDTA不会使发射强度有任何进一步的增大,这表明EDTA不能螯合更多的铜离子。DLS实验也证实,加入EDTA之后,凝聚的P点重新分散(图33C)。
可以指出,此过程可重复许多次而相对信号损失极小,表明此程序可反复多次循环使用,而不是只能用一次的分析过程。在基于量子点(例如CdSe)的Cu2+离子探测器上没有观察到这种可逆性,因为Cu2+与Cd2+之间发生不可逆的阳离子交换过程(Y.-H.Chan Y.H.等,Anal.Chem.,2010,82,3671-3678;Sadtler B.等,J.Am.Chem.Soc.,2009,131,5285-5293)。值得指出,P点凝聚和重新分散的反应时间都很短(短于1分钟),荧光强度在反应之后数天保持不变。
如图36所示,在10-25μM的动态范围内探测Fe2+时,也观察到凝聚和自猝灭现象(R2=0.996)。Fe2+使PS-COOH/PFBT共混P点的荧光强度显著猝灭(多达70%),但这种猝灭不能通过加入EDTA逆转,这可能是因为EDTA与Fe2+的结合常数比与Cu2+的结合常数小得多。
为了尝试使羧基质子化,我们还调节了P点-Fe2+混合物的pH值,然后在溶液中加入过量的EDTA。但是,即使pH=1,发射强度也没有实质性恢复(小于10%)。此外,这些P点在低于2的pH下倾向于凝聚。因此,通过加入EDTA使荧光从Cu2+诱导的自猝灭中选择性恢复,我们就能够将对铜的探测和对铁的探测分开,并分别确定它们的浓度。
实施例28:通过官能化P点同时检测Cu2+和Fe2+离子
为了说明实施例26中所述的检测方法的应用,选择细胞培养基,因为它模拟了复杂的生理液,同时还用作控制良好的溶液。在这里制备测试样品时,分别将10μM铜离子和15μM铁离子加入含P点探测器的DME培养基(DMEM D-5921)。然后向溶液中加入EDTA,使Cu2+的浓度可根据恢复的P点发射强度计算。然后,我们通过与I空白比较来估计Fe2+的浓度。此测量显示,铜和铁的浓度分别是10.17±1.34μM和16.16±1.82μM,与加入量吻合得很好。此实验显示了利用这种基于P点的探测系统检测复杂样品中的铜和铁的可能性。
实施例29:具有近红外荧光的官能化发色聚合物点
本实施例说明,可将近红外(NIR)染料掺杂到官能化发色聚合物点(CP点或P点)中,调节发色聚合物点生物共轭体的荧光性质。我们在下面互换地使用CP点或P点描述发色聚合物点。
NIR染料掺杂的CP点的制备和表征。在典型的程序中,制备含50μg/mL PFBT、50μg/mL PS-PEG-COOH和0.2μg/mL NIR染料的THF溶液,所述NIR染料是2,3-萘酞菁双(三己基硅氧基)硅烷(NIR775)。然后,在剧烈搅拌下,将5mL混合物等分试样迅速分散到10mL水中。在氮气保护和升高的温度(低于100℃)下,蒸发多余的THF。通过0.2μm的纤维素膜过滤器过滤无THF的CP点溶液,将其调节至合适的浓度。利用透射电镜(FEI Tecnai F20,200kV)研究CP点的尺寸和形貌。还用动态光散射仪(马尔文Zetasizer NanoZS)测量了水溶液中CP点的尺寸。利用DU 720扫描分光光度计(美国加利福尼亚州贝克曼考尔特公司)记录了水中CP点和NIR染料的紫外-可见光吸收光谱。通过用马尔文Zetasizer NanoZS测量ζ电势,验证了CP点的羧基表面。具有羧基表面和不具有羧基表面的CP点均在凝胶电泳实验中测试。用0.7%正常熔点琼脂糖、0.2%PEG(平均分子量3350)和20mM HEPES缓冲液制备凝胶。采用潜水电泳系统,借助30%甘油将CP点样品装入电泳孔道,在20mM HEPES缓冲液(pH 7.4)中于10V/cm的电泳力作用下移动15分钟。然后,利用柯达图像站440CF系统对凝胶进行显影。利用Fluorolog-3荧光光度计(霍力巴乔宾伊冯公司)测量CP点和NIR染料的荧光光谱。利用时间相关单光子计数仪(TSCPC)得到NIR染料掺杂的CP点和PFBT点的荧光寿命。利用150W CW氙灯的457nm激发,通过积分球[C9920-02型,滨松光子学公司(Hamamatsu Photonics)]收集PFBT点和NIR染料掺杂的CP点的荧光量子产率。
具有NIR发射的官能化CP点。我们用三种功能不同的组分配制了NIR染料掺杂的CP点:绿光半导体聚合物(PFBT)、NIR染料(NIR775)和两亲性聚合物(PSPEG-COOH)(图37)。作为CP点的关键部分,半导体聚合物形成P点的疏水性基体,用作NIR染料的宿主。NIR775染料在疏水性溶剂中具有高荧光性,但在生理环境中,由于自发凝聚,其荧光性明显减小。将这些染料掺杂在P点基体内部时,凝聚现象可得以避免或者明显减少。在CP点内部,NIR染料用作受体,接收来自半导体聚合物基体的能量,产生强NIR荧光。为了荧光成像的目的,利用两亲性聚合物PS-PEG-COOH对CP点表面进行羧基修饰。这里,聚合物的疏水性部分带有P点基体,而亲水性部分向外伸入生理环境。用纳米沉淀法合成NIR染料掺杂的CP点,因为该方法用于制作P点和掺杂疏水性染料时简单、高效(图37)。先将所有CP点组分溶解和混合在无水THF中,然后在声波作用下,在水中快速沉淀。溶剂环境的突然改变和强声波作用力产生纳米尺寸的半导体聚合物粒子,同时将疏水性NIR染料(NIR755)捕集在CP点基体中。另外,随着两亲性聚合物组装在CP点与水的界面上,产生羧化表面。
TEM图像和DLS结果均表明,NIR染料掺杂的CP点是单分散粒子,平均直径为18nm(图38A和38B)。在这些粒子中,NIR染料被成功包封,如以下实验所证实。首先,用截留分子量为100K的离心膜过滤P点溶液,该离心膜仅允许游离NIR染料通过,而不允许掺杂的粒子通过。经紫外-可见光分光光度计监测,滤液不含NIR染料,而在过滤之后,在NIR染料掺杂的CP点的溶液中观察到NIR染料的吸收。此结果显示,NIR染料完全掺杂在CP点中。利用两亲性聚合物PSPEG-COOH,对CP点表面进行羧基官能化。此表面官能化显著降低了CP点的ζ电势,从-35.4mV(裸PFBT点)降至-46.0mV(含PS-PEG-COOH涂层的CP点)。凝胶电泳还显示,与尺寸相近的裸PFBT点相比,羧化CP点向正极的移动快得多(图38C)。NIR掺杂不影响羧化CP点的表面电势,表明NIR染料仅位于CP点内部,而不在表面上。
NIR染料掺杂的CP点中借助于能量转移的荧光。在457nm激发时,NIR染料掺杂的CP点具有两种荧光发射:一种是来自聚合物基体的可见光发射,一种是来自所掺杂的NIR染料的NIR发射(图39)。两种荧光发射通过控制P点内的NIR染料浓度来调节。即使在低浓度下,NIR染料也能高效地猝灭CP点荧光;通过在0.2-2%的范围内增加NIR染料的浓度,可降低聚合物的荧光(图40A)。CP点的NIR发射也通过控制染料掺杂浓度来调节。在CP点基体中掺杂更多的NIR染料导致NIR荧光下降,因为高浓度的NIR染料会在CP点中发生自猝灭(图40E)。因此,为了使NIR区内的荧光达到最大,存在最佳掺杂浓度。
从PFBT聚合物到NIR染料之间存在高效粒内能量转移。即使少量的NIR染料(0.2%重量/重量)也足以猝灭75%的聚合物荧光。当掺杂2%的NIR染料时,超过95%的聚合物荧光被猝灭。斯特恩-沃尔墨关系式很好地描述了猝灭结果(图40D)。从掺杂NIR染料前后CP点的荧光寿命的变化也能明显看出P点基体的猝灭。PFBT点的寿命开始为2.4ns,在P点基体中掺杂0.2%的NIR染料之后降至1.2ns。由于NIR染料的掺杂,540nm发射的荧光量子产率也从0.368降至0.08。NIR染料掺杂的CP点通过将能量从基体转移到NIR染料,可高效地将接收的能量转化为NIR发射。例如,掺杂0.2%的NIR染料的CP点具有强NIR发射,与未掺杂染料的CP点的540nm峰相当。此NIR发射的量子产率约为0.11,表明发生了高效能量转化。掺杂策略极大地提高了NIR染料的荧光强度。与在THF中于763nm激发的等量的游离NIR染料相比,掺杂NIR染料在水溶液中于457nm激发时,其荧光强39倍。
捕光效率是决定纳米粒子荧光亮度的一个关键参数。在CP点中掺杂NIR染料极大地提高了掺杂染料的捕光能力。比较了NIR染料掺杂的CP点和NIR量子点(购自英骏公司的Q点800)的亮度。与Q点800相比,在相同的粒子浓度下,NIR染料掺杂的CP点的强度约高出3倍,并且荧光发射窄得多(图41B和41C)。
染料泄露。为了检验染料泄露情况,在20mM HEPES缓冲液中对NIR染料掺杂的CP点的受体-给体荧光比进行72小时的监视。结果显示,72小时后,给体/受体比仅略降低85%,而NIR荧光没有变化(图42A)。此结果表明,疏水性NIR染料不可能泄露到水溶液中,NIR染料掺杂的CP点能将其荧光性质维持至少72小时,并且维持时间可能长得多。因为NIR染料掺杂的CP点适合体内应用,还在37℃的人血浆中进行了泄露试验。结果得到与前面在室温下进行的试验相似的数据,表明溶液条件的变化在72小时内无损于NIR染料掺杂的CP点的性能(图42B)。为了完全克服染料泄露,我们可将染料分子共价连接到发色聚合物基体上,形成CP点。
实施例30:用于比例温度探测器的官能化发色聚合物点
本实施例说明官能化发色点可用来形成比例温度纳米粒子温度探测器(ratiometric nanoparticle temperature sensor)。我们在下面互换地使用CP点或P点描述发色聚合物点。
CP点温度探测器的制备。首先,我们用官能聚合物如胺封端的聚苯乙烯聚合物与感温染料若丹明B(RhB)反应。因为若丹明B是水溶性染料,与疏水性官能聚合物反应能使染料疏水,因此它可被捕集到疏水性CP点内部。在10mL圆底烧瓶中,将200μL 10mg/mL的若丹明B-异硫氰酸酯的DMF(无水)溶液和1mg NaHCO3加入2mL 1mg/mL(在DMF中)的胺封端的聚苯乙烯(PS-NH2,分子量1000,多分散度1.1)中,进行NH2-异硫氰酸酯反应,如图43A所示。在N2保护下轻轻搅拌混合过夜。通过在75℃旋转蒸发除去DMF。然后,将所得红色固体溶解在1mL THF(无水)中。用200nm膜滤器滤除NaHCO3,因为它不溶于THF。然后,将所得的THF中的PS-RhB掺杂到发色聚合物中,制备CP点。
使用{9,9-二辛基-2,7-二亚乙烯基-亚芴基}-{2-甲氧基-5-(2-乙基己氧基)-1,4-亚苯基}交替共聚物(PFPV,分子量220000,多分散度3.1)和(9,9-二辛基芴-2,7-二基)-(1,4-苯并-{2,1’,3}-噻二唑)共聚物(PFBT,分子量150000,多分散度3.0)制备CP点温度探测器。通过在惰性气氛中搅拌过夜,将10mg上述聚合物溶解在10mL THF中。若丹明B掺杂的CP点制备如下:首先在5mL THF中混合200μL 1mg/mL(在THF中)的PFPV或PFBT和10μL 2mg/mL(在THF中)的PS-RhB,然后在声波处理条件下,将混合聚合物的THF溶液注射到10mL MilliQ水中。然后,通过部分真空蒸发除去THF,通过用0.2μm膜滤器过滤,除去小部分凝聚体。通过伯乐公司的10DG柱(美国加利福尼亚州赫库斯市)除去游离若丹明B。图43B呈现了CP点的制备以及纳米粒子内发色聚合物与RhB之间能量转移的图示。
CP点温度探测器的表征。通过动态光散射(DLS,马尔文Zetasizer NanoZS)表征本体溶液中P点的粒度。图44显示了P点的DLS数据。所得PFPV-RhB点的直径约为26nm,而PFBT-RhB点的平均直径为160nm。CP点的尺寸高度依赖于聚合物的分子量、聚合物主链结构以及PS-RhB与发色聚合物的浓度比。在PFBT-RhB体系中,20重量%或更高的PS-RhB浓度导致纳米粒子凝聚。我们发现,PFBT P点包含10%的PS-RhB时具有最佳的敏感度和较小的尺寸。在PFPV-RhB体系中得到非常小的P点。基于荧光强度和敏感度,10%的PS-RhB也被证实是最佳的掺杂量。
用DU 720分光光度计记录紫外-可见光吸收光谱。用Fluorolog-3荧光计收集荧光光谱。所有CP点均在450nm激发,因为PFPV和PFBT均在450nm左右显示吸收峰。图45A显示了PFBT点(黑线)和PFBT-RhB点(红线)在室温下的吸收光谱(虚线)和发射光谱(实线)。在吸收光谱中,在540nm出现额外的小吸收峰,伴随着PFBT吸收峰从450nm到460nm的10nm红移。540nm峰对应于RhB的吸收,而PFBT的红移起因于尺寸从纯PFBT点的约20nm增加到PFBT-RhB点的约160nm。PFBT-RhB点显示两个发射峰,一个540nm的较弱发射峰和一个573nm的强发射峰。后一个峰对应于RhB的发射。因为PFBT的发射(峰在540nm处)与RhB的吸收(峰在540nm处)重叠良好,并且PFBT聚合物链与若丹明B分子靠得很近,高效能量转移导致RhB的强荧光,而纯RhB染料在450nm的激发不佳。
图45B显示了PFPV和PFPV-RhB点在室温下的吸收和发射。在吸收光谱中,PFPV-RhB点在540nm显示若丹明B的小吸收峰,而PFPV峰在450nm没有明显的位移。发射光谱在510nm和540nm显示了PFPV点的两个峰,而PFPV-RhB点在573nm显示了另外的RhB峰。类似于PFBT-RhB,由于PFPV的发射(峰在540nm处)与RhB的吸收(峰在540nm处)之间存在良好的光谱重叠,并且聚合物链和RhB在纳米粒子内紧密堆积,PFPV与RhB之间发生强FRET。
荧光CP点感温。在与加热/冷却系统连接的Fluorolog-3荧光计中测量P点的温度依赖性荧光。将数字式温度计TM902C的温度探针插入溶液,测量P点溶液的绝对温度。在实验过程中轻轻搅拌该溶液,使冷却和加热均匀。图46分别显示了PFBT-RhB(A)和PFPV-RhB(B)在温度从10℃升至70℃和从10℃升至60℃的荧光光谱。右边虚线(红色)显示了RhB在573nm的发射峰,右边虚线在510nm,选作比例计算的内参比。图47显示了两种P点的荧光强度随温度的变化。对于PFBT-RhB点,荧光强度随温度升高而减小。更重要的是,强度显示出相对于温度变化的线性关系。与用作温度探针的游离若丹明B或其他纳米粒子相比,这些CP点探测器的独特性质在于比例测量。图48显示了PFBT-RhB点(A)和PFPV-RhB点(B)的I573nm/I510nm随温度变化的比例曲线。线性拟合很好地描述了感应特性,所以在实验中得到的给定的荧光强度比可以确定温度。
实施例31:用于比例pH探测器的官能化发色聚合物点
本实施例说明官能化发色点可用来形成比例纳米粒子pH探测器。我们在下面互换地使用CP点或P点描述发色聚合物点。
CP点pH探测器的制备。我们用发色聚合物聚(2,5-二(3',7'-二甲基辛基)亚苯基-1,4-亚乙炔基)(PPE)作为聚合物给体,用pH敏感染料荧光素作为受体,形成比例CP点pH探测器。用硫醇封端的聚苯乙烯(PS-SH)或氨基封端的聚苯乙烯(PS-NH2)将染料共价连接到CP点上。
硫醇官能化PPE点的制备。一般将40μg PPE和12μg PS-SH溶解于5mL THF。然后,在强烈声波处理下,将此混合物快速注射到10mL水中。然后,在96℃热板上用氮气吹扫一小时,除去THF。通过0.2μm纤维素乙酸酯膜滤器过滤所得的P点溶液,除去制备过程中形成的任何凝聚体。
荧光素共轭PPE点[P点(A)、P点(B)和P点(C)]的制备(图49)。对于P点(A),将溶解在无水DMSO中的0.2mg荧光素异硫氰酸酯(FITC)加入玻璃安瓿中的4mL PS-SH/PPE共混P点(20μg/mL)水溶液。在室温下将混合物搅拌12小时,然后通过伯乐公司的10DG柱(美国加利福尼亚州赫库斯市)提纯,与游离的FITC分子分离。对于P点(B)的制备,将5mg FITC和20mg PS-NH2溶解在1mL DMF中并混合。然后,将5mL三乙胺加入溶液。将混合物留在回转式摇床上过夜。将0.2mL PPE(1mg/1mL)的THF溶液和27μL PS-NH2-FITC共轭体溶液混合到5mL THF中。然后,在强烈声波处理下,将此混合物快速注射到10mL水中。然后,在96℃热板上用氮气吹扫一小时,除去THF。先通过0.2μm纤维素乙酸酯膜滤器过滤所得的P点(B)溶液,除去制备过程中形成的任何凝聚体,然后通过伯乐公司的10DG柱提纯,与游离的FITC分子分离。对于P点(C)的制备,将无水DMSO中的15μg荧光素-5-马来酰亚胺和60μL HEPES浓缓冲液(1M)加入在玻璃安瓿中新鲜制备的4mL PS-SH/PPE共混P点(20μg/mL)水溶液。在室温下将混合物搅拌12小时,然后通过伯乐公司的10DG柱提纯,与游离的FITC分子分离。
发色聚合物-荧光素对的选择和优化。为制作基于FRET并在单波长下激发的比例探测平台,第一步是选择合适的给体-受体对。在本发明中选择荧光素作为FRET受体,因为其吸收分布曲线和发射强度高度依赖于pH。荧光素的吸收分布曲线在不同pH的变化使我们能够调节给体(发色聚合物基体)与受体(荧光素分子)之间的FRET效率,而荧光强度对pH的响应提供了质子活度的反馈。为了优化FRET效率,根据光谱性质选择理想的给体聚合物十分重要。我们发现,PPE聚合物点通过几个共轭路径向荧光素进行大的能量转移。这种现象可用PPE聚合物的发射光谱与荧光素的激发光谱之间的实质性光谱重叠来解释,如图50A所示。
荧光素与PPE P点的共轭连接。用PPE P点作为聚合物基体,通过图49所示的三种不同路径将荧光素染料固定到PPE P点上。对于路径A和C,我们先制备硫醇官能化的PPE P点:将硫醇封端的聚苯乙烯掺混到PPE聚合物中,通过沉淀法形成PS-SH/PPE共混P点的水溶液。随后,使PS-SH/PPE共混P点与荧光素异硫氰酸酯(路径A)或荧光素-5-马来酰亚胺(路径C)反应,生成对pH敏感的P点-染料复合体。因为我们发现氨基官能化的PPE P点不稳定,我们设计了路径B,其中先在有机相中将荧光素异硫氰酸酯与氨基封端的聚苯乙烯(PS-NH2)偶联,然后与PPE聚合物掺混,再在水溶液中进行纳米粒子沉淀。然后,我们通过控制聚合物与染料之比,研究了每种体系的比例探测能力。例如,在路径A和C中,我们检验了PS-SH在PPE聚合物中的不同掺混百分数,发现在30%的PS-SH掺杂水平下,可得到低标准偏差下的高敏感度。在路径B的体系中也观察到类似的结果,其中60%的PS-NH2-荧光素掺混比例得到最佳的比例pH敏感度。
PPE与荧光素之间的FRET。一旦荧光素分子连接到奥PPE P点上,就容易观察到从PPE到荧光素的高效能量转移。这种有效的FRET部分归因于PS-SH/PPE共混P点的发射光谱(红色实线)与荧光素的吸收光谱(黑色虚线)之间相当大的光谱重叠,如图50A所示。以P点(A)为例,与相同浓度的裸PS-SH/PPE共混P点的荧光光谱(没有染料共轭,红色实线)相比,其染料发射(λ=513nm,蓝色实线)增强,同时PPE P点发射(λ=420-490nm,蓝色实线)受到抑制,清楚表明从P点到染料发生了FRET。应当注意,在相同的390nm波长下激发时,相同一浓度的未结合荧光素的发射强度非常弱,意味着荧光素的大部分发射强度来自能量转移而不是荧光本身。为了进一步证实FRET现象,针对对照样、PS-SH/PPE共混P点和P点-染料复合体P点(A),测量了PPE P点的时间分辨荧光衰减曲线(440±20nm)。P点对照样的荧光寿命是0.30ns,而P点(A)的寿命缩短至0.21ns,表明从PPE P点到荧光素发生了FRET。为了更好地理解P点-染料复合体的光谱性质,我们另外研究了FRET效率在不同pH下的计算,如下所述。除了光谱重叠之外,为了确保高效FRET性质,P点的尺寸具有重要作用,因为FRET依赖于分子间距的六次方的倒数。对于路径A、B和C,通过动态光散射(DLS)测得的P点-染料复合体的平均流体力学直径分别为26nm、25nm和26nm。P点(C)的典型透射电镜(TEM)图像如图50所示,与DLS测量结果一致。
pH敏感性和可逆性的测量。在每个体系中进行了荧光光谱测量,以研究它们对HEPES缓冲液中pH的比例响应。如图51所示,荧光素的发射峰随pH增加而增大,而PPE P点的荧光强度在全部三种体系中保持恒定。我们还检验了PPE P点单独对pH的响应,结果再次表明在pH=5.0-8.0的范围内,PPE P点对pH没有响应,使它成为比例pH检测的良好参比。图52显示,对这三种复合体,在5.0-8.0的pH范围内,荧光素(λ=513nm)与PPE(λ=440nm)的发射强度比随pH发生线性变化。在它们当中,P点(A)表现出最高的检测灵敏度,pH每改变1个单位,I513nm/I440nm改变0.37。这种高敏感性可能源自P点与染料之间的最短间距,促进了从PPE到荧光素的高效能量转移。但是,已知硫醇与异硫氰酸酯之间的氨基硫羰基单元在过量游离硫醇存在下倾向于逐渐分解,使P点(A)用于更复杂的生物应用的可能性降低。相反,P点(B)提供了P点与染料之间的稳定胺-异硫氰酸酯加合物,但PS-NH2的长侧链导致能量转移效率降低,所以pH敏感度较低,pH每改变1个单位,pH敏感度改变0.18个单位。为了克服上述障碍,P点(C)的目标是提供既有良好的pH敏感度,又有高结合稳定性的互补体系。对于P点(C)体系,pH每改变1个单位,I513nm/I440nm改变0.29。
这三种纳米探测器均显示良好的pH可逆性。以P点(C)为例,包含P点(C)纳米探测器的溶液的pH在pH=5与pH=8之间变化。荧光素与PPE的荧光发射比的良好重现性显示了这种基于P点的pH探测器的极大可逆性和耐用性(图52)。此外,由于P点尺寸小(即表面/体积比大),探测器的pH响应时间太快,用常规荧光分光光度计无法测量。图53显示了PPE与荧光素之间的光谱重叠,以及计算的福斯特距离与溶液pH的关系。
细胞内pH测量。为了说明这种基于FRET的比例P点纳米探测器在细胞内pH测量中的应用性,不用任何另外的试剂,通过内嗜过程将P点-荧光素纳米粒子引入活海拉细胞。摄取粒子之后,通过用大量PBS缓冲液洗涤来除去未结合进去的粒子。图54显示了海拉细胞在消化P点(A)之后的共焦荧光显微图像(E-G),而细胞中的裸PPE P点用作负对照(A-C)。通过对433-444nm的光谱区积分得到蓝色通道(A和E),通过对507-518nm的荧光信号积分得到绿色通道(B和F)。将507-518nm的平均荧光信号与433-444nm的平均荧光之比跟pH校正曲线作比较,确定细胞内pH。采用P点(A)体系,基于至少50个细胞的平均pH值预计为4.95±0.70,与报告的内噬作用酸性途径的pH范围吻合得很好,如初级内体(pH约为6.5)和溶酶体腔(pH=4.5-5.0)。用P点(B)和P点(C)探针测量的pH值分别为4.81±0.86和4.92±0.64(图55),再次说明了这些基于P点的纳米探测器用于细胞内pH测量的可能性。更重要的是,图55A-C右上角内插图所示的放大叠加图像清楚地揭示,PPE和荧光素的荧光具有完美的共同定位。这种共同定位表明海拉细胞是同时摄取PPE和荧光素的,而不是由于不稳定的键断裂而逐个摄取荧光团。
虽然在强调优选实施方式的基础上描述了本发明,但对本领域技术人员来说显而易见的是,在不背离本发明的范围或精神的前提下,可对本发明作出各种修改和改变。本领域的技术人员通过研究说明书和实施本文所述的本发明,将会明显看出本发明的其他实施方式。本说明书和实施例应仅仅视为示例,本发明真正的范围和精神由以下权利要求书来限定。
- 还没有人留言评论。精彩留言会获得点赞!