一种脐带血巨核祖细胞体外培养的方法与流程
本发明属于细胞技术领域,具体涉及一种脐带血巨核祖细胞体外培养的方法。
背景技术:
1989年世界上第一次进行脐带血造血干细胞移植并获得成功后,脐带血造血干细胞的临床应用便越来越广泛,经过20多年的发展,目前脐带血已经和骨髓、外周血一起成为造血干细胞的三大来源。
由于在造血干细胞移植前,受者通常要进行大剂量放疗/化疗以达到清髓效果,而放疗/化疗会使受者的造血系统严重受损,导致一段时间内血小板严重缺乏,容易出血甚至引起死亡,所以需要输注大量外源的血小板。相对于骨髓,脐带血移植后血小板的恢复速度稍慢一些,目前普遍认为原因是脐带血中的巨核祖细胞数量不充裕且分化成熟迟缓。因此,增加每份脐血巨核祖细胞的数量是解决问题的关键。巨核祖细胞体外扩增可以很好的解决细胞数量少的问题。只要给与足够的剂量,它们可以提供快速短期植入所需要足够数量的祖细胞,降低实现短期植入所需要的时间。当前,体外巨核祖细胞定向扩增的方法,普遍采用的细胞因子组合进行扩增,主要有IL-3,IL-6,SCF,TPO和FLT-3L等。现有技术虽然在巨核祖细胞体外扩增方面取得了一定的成效,但是在培养过程中巨核祖细胞的祖细胞特性并不能很好的维持,从而降低了巨核祖细胞远期分化为血小板的能力。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的目的在于提供一种脐带血巨核祖细胞体外培养的方法。利用该方法提高了脐带血巨核祖细胞数量和质量。该方法利用脐带血采集后去除血浆和红细胞,得到富含造血干细胞的总有核细胞(TNC)。通过CD34+磁珠分选可获得较纯的造血干细胞,将分选出的造血干细胞在无血清培养基中培养三到四天,从而获得造血干细胞培养上清。通过在培养体系中,添加造血干细胞培养上清来进行巨核祖细胞扩增方法,较传统方法减少了细胞因子的加入量的同时,获得的巨核祖细胞保持了更好的祖细胞特性,增加了获得巨核祖细胞的效率。
本发明的目的通过下述技术方案实现:
一种脐带血巨核祖细胞体外培养的方法,包含如下步骤:
将脐血细胞接种到特定巨核祖细胞培养基中进行培养。
所述的培养的时间为7~14天。
所述的特定巨核祖细胞培养基为含有造血干细胞培养上清、SCF和TPO的无血清培养基;
所述的SCF和TPO的终浓度分别为50±10ng/mL和50±10ng/mL;
所述的造血干细胞培养上清的添加体积分数为特定巨核祖细胞培养基的40~50%;优选为50%。
所述的造血干细胞培养上清的制备方法,包括如下步骤:
将造血干细胞接种至造血干细胞培养基中进行培养,离心沉淀方法收集造血干细胞培养上清。
所述的造血干细胞培养基为含有IL-6、IL-3、SCF、Flt-3L和TPO的无血清培养基。
所述的IL-6、IL-3、SCF、Flt-3L和TPO的终浓度分别为20ng/mL、20ng/mL、50ng/mL、50ng/mL和20ng/mL。
所述的培养的时间为3~4天。
所述的无血清培养基为Stemspan培养基(STEMCELL公司)。
所述的脐血细胞通过如下步骤分离获得:采集新鲜人脐带血,在新鲜健康的人脐带血中获取富含CD34+造血干细胞的单个核细胞层,加入细胞保护液,程控降温,冷冻于液氮中保存;巨核祖细胞扩增前,取脐血细胞解冻,加生理盐水重悬洗涤再离心收集,得到较纯净的脐血细胞;
所述的细胞保护液为含有体积百分比为55%二甲基亚砜(DMSO)和体积百分比为5%低分子右旋糖酐(Dextran)的注射用水溶液。
所述的培养条件优选为温度为37℃,二氧化碳浓度为5%。
所述的提高脐带血巨核祖细胞体外培养扩增的方法,具体包含如下步骤:
(1)造血干细胞培养上清的制备
从24小时内的新鲜健康人脐血中获取单个核细胞,然后经过免疫磁珠分选获取CD34+的造血干细胞,将分选后的造血干细胞加入Stem Span培养基培养扩增,同时还需要加入20ng/mL IL-6、20ng/mL IL-3、50ng/mL SCF、50ng/mL Flt-3L和20ng/mL TPO五种细胞因子,培养至第3~4天左右,收集造血干细胞培养上清;
具体过程如下:
1)采集健康人24小时内的新鲜脐血
2)生理盐水与新鲜脐血2:1的比例稀释,混合均匀后,加到淋巴细胞分离液上,进行单个核细胞的分离,离心时间25分钟,离心力500g,离心加速度1,减速度1,温度20℃;
3)离心结束后,取白膜层(白膜层在血浆层和分离液层之间)。加入3倍体积的生理盐水,洗涤一次,离心力800g,离心10min;
4)收集细胞沉淀,用含有EDTA和人血清白蛋白的PBS缓冲液再洗一次,离心力200g,离心时间10分钟;
5)离心完后,收集细胞沉淀,用含有EDTA和人血清白蛋白的PBS缓冲液重悬,MiniMACS免疫磁珠方法获取纯度高的CD34+造血干细胞;
6)将获得的造血干细胞接种在T25培养瓶中,加入适量培养基,同时添加细胞因子;培养3~4天收集细胞上清液,-20℃保存备用;
(2)特定巨核祖细胞培养基的配置
特定巨核祖细胞培养基为在无血清培养基中添加造血干细胞培养上清、人干细胞生长因子(Stem cell factor,SCF)和促血小板生成素(Thrombopoietin,TPO)的培养基;
(3)巨核祖细胞的扩增
将冻存后的脐血细胞接种到特定巨核祖细胞培养基中培养,接种时细胞密度为3×105个/mL,三天半量换液一次,培养至第7天和14天时倒置显微镜观察细胞状态,并细胞计数;流式细胞仪检测细胞CD41+和CD34+表面抗原的阳性率,培养至14天,收获细胞。
步骤(3)中所述的脐血细胞通过如下步骤分离获得:采集新鲜人脐带血,在新鲜健康的人脐带血中获取富含CD34+造血干细胞的单个核细胞层,加入细胞保护液,程控降温,冷冻于液氮中保存;巨核祖细胞扩增前,取脐血细胞解冻,加生理盐水重悬洗涤再离心收集,得到较纯净的脐血细胞;
所述的细胞保护液为含有体积百分比为55%二甲基亚砜(DMSO)和体积百分比为5%低分子右旋糖酐(Dextran)的注射用水溶液。
步骤(3)中所述的培养条件优选为温度为37℃,二氧化碳浓度为5%;
本发明相对于现有技术,具有如下的优点及效果:
(1)本发明有效提高了体外扩增的脐血巨核祖细胞的祖细胞特性。从而提高了巨核祖细胞分化为血小板的能力。
(2)本发明在巨核祖细胞扩增阶段,减少了添加细胞因子的用量,从而减少了材料消耗,降低了成本。
附图说明
图1是实施例1中实验组和对照组脐血巨核祖细胞在接种后第1、7、14天的细胞总数量的结果图。
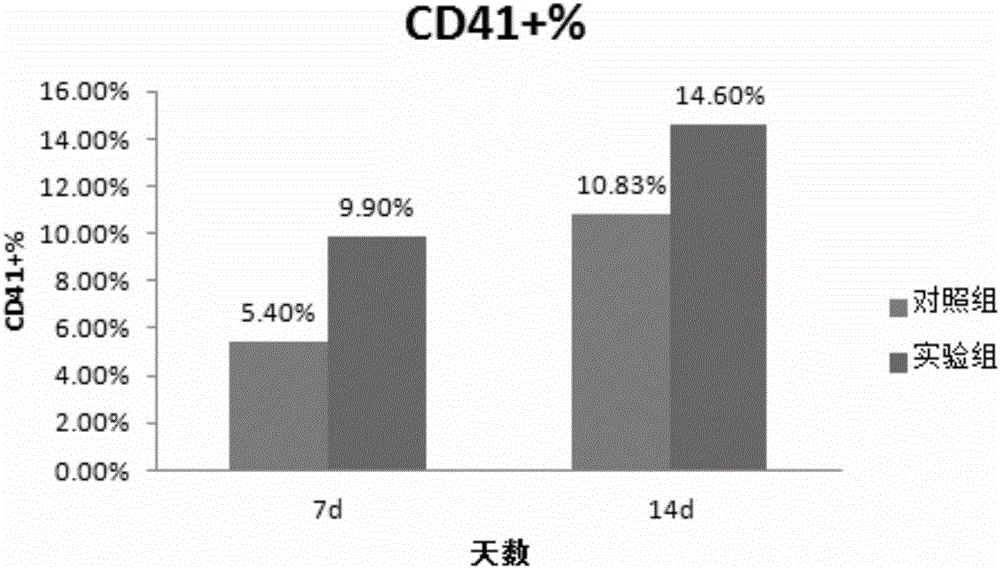
图2是实施例1中实验组和对照组脐血巨核祖细胞样本在接种后第7、14天的CD41+表面抗原表达情况的结果图。
图3是实施例1中实验组和对照组脐血巨核祖细胞样本在接种后第7、14天的CD34+细胞表面抗原表达情况的结果图。
图4是实施例1中实验组和对照组样本在接种后第2、7天的巨核祖细胞形态图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
细胞保护剂为含有体积百分比为55%DMSO和体积百分比为5%Dextran的注射用水溶液;
特定巨核祖细胞培养基:在STEMCELL公司的Stemspan培养基添加SCF(终浓度50ng/mL)和TPO(终浓度50ng/mL)细胞因子以及体积分数为50%的造血干细胞培养上清。
实施例1
脐带血采自健康产妇孕婴,经检测乙型肝炎、丙型肝炎、梅毒、艾滋、巨细胞病毒、支原体、衣原体、G-DPD和地贫均为阴性。标本自采集到运回血库的运输温度保持在4~8℃,24小时内运输到脐带血库。按以下方法进行巨核祖细胞扩增操作:
(1)造血干细胞培养上清的制备
从24小时内的新鲜健康人脐血中获取单个核细胞,然后经过免疫磁珠分选获取CD34+的造血干细胞,将分选后的造血干细胞加入Stem Span培养基培养扩增。同时还需要加入20ng/mL IL-6、20ng/mL IL-3、50ng/mL SCF、50ng/mL Flt-3L和20ng/mL TPO五种细胞因子。培养至第3天左右,收集造血干细胞培养上清。具体过程如下:
1.采集健康人24小时内的新鲜脐血
2.生理盐水与新鲜脐血2:1的比例稀释,混合均匀后,加到淋巴细胞分离液上,进行单个核细胞的分离,离心时间25分钟,离心力500g,离心加速度1,减速度1,温度20℃。
3.离心结束后,取白膜层(白膜层在血浆层和分离液层之间)。加入3倍体积的生理盐水,洗涤一次,离心力800g,离心10min。
4.收集细胞沉淀,用含有EDTA和人血清白蛋白的PBS缓冲液再洗一次,离心力200g,离心时间10分钟。
5.离心完后,收集细胞沉淀,用含有EDTA和人血清白蛋白的PBS缓冲液重悬,MiniMACS免疫磁珠方法获取纯度高的CD34+造血干细胞。
6.将获得的造血干细胞接种在T25培养瓶中,加入适量培养基,同时添加细胞因子。培养3~4天收集细胞上清液,-20℃保存备用。
(2)特定巨核祖细胞培养基的配置
特定巨核祖细胞培养基为在无血清培养基中添加造血干细胞培养上清、人干细胞生长因子(Stem cell factor,SCF)和促血小板生成素(Thrombopoietin,TPO)的培养基;
所述的造血干细胞培养上清的添加体积分数为特定巨核祖细胞培养基的50%。
所述的特定巨核祖细胞培养基中,SCF和TPO的终浓度分别为50ng/mL和50ng/mL;
所述的无血清培养基为Stemspan培养基(STEMCELL公司);
(3)巨核祖细胞的扩增
将冻存后的脐血细胞接种到特定培养基中培养,接种时细胞密度为3×105个/mL,三天半量换液一次,培养至第7天和14天时倒置显微镜观察细胞状态,并细胞计数。流式细胞仪检测细胞CD41+和CD34+表面抗原的阳性率,培养至14天,收获细胞。
步骤(3)中所述的脐血细胞通过如下步骤分离获得:采集新鲜人脐带血,在新鲜健康的人脐带血中获取富含CD34+造血干细胞的单个核细胞层,加入细胞保护液,程控降温,冷冻于液氮中保存;巨核祖细胞扩增前,取脐血细胞解冻,加生理盐水重悬洗涤再离心收集,得到较纯净的脐血细胞;所述的细胞保护液为含有体积百分比为55%二甲基亚砜(DMSO)和体积百分比为5%低分子右旋糖酐(Dextran)的注射用水溶液。
步骤(3)中所述的培养条件优选为温度为37℃,二氧化碳浓度为5%;
(4)巨核祖细胞的鉴定
巨核祖细胞的鉴定通过以下方法:
①巨核祖细胞的形态学分析及细胞计数:将培养的细胞在倒置显微镜观察细胞状态并拍照;
②流式细胞仪的表型测定:分别取培养后第7天,14天的细胞,进行CD41+和CD34+检测;
(5)巨核祖细胞鉴定结果及细胞活性分析
①倒置显微镜下观察接种后第2天的脐血细胞状态:倒置显微镜下观察接种后第2天的脐血细胞,细胞数量充足,呈分散状,形态比较单一,细胞胞体透亮且圆(图4A)。细胞计数结果,实验组和对照组细胞数量约为:3.4×105个(图1);
②倒置显微镜下观察接种后第7天的脐血细胞状态:与第1天相比,细胞数量略有变化,形态开始出现分化,当中的大部分为散状脐血细胞,小部分开始分化,聚集成簇,胞膜不清晰,排列紧密呈团块状(图4B)。细胞计数结果,实验组和对照组数量分别为:8.46×105个、7.6×105个(图1)。
流式细胞仪检测结果:在CD41+细胞比例方面,实验组和对照组的数值分别为:9.9%、5.4%(图2),CD34+细胞比例方面,实验组和对照组的数值分别为:8.47%、2.78%(图3)。
③倒置显微镜下观察接种后第14天的脐血巨核祖细胞增殖状况:与第7天相比,细胞数量增幅较为明显,形态也明显分化。细胞计数结果:实验组和对照组脐血细胞数量分别为27.5×105个/mL、24.6×105个/mL(图1)。
流式细胞仪检测结果:在CD41+细胞比例方面,实验组和对照组的数值分别为:14.6%、10.83%(图2),CD34+细胞比例方面,实验组和对照组的数值分别为:1.06%、0.55%(图3)。
经过14天培养后,细胞计数结果显示:实验组细胞数量比第7天时有明显上升,细胞总量略高于对照组;在流式结果方面,处理组CD41+和CD34+细胞比例都远高于对照组。
综上所述,在脐血巨核祖细胞扩增过程中,实验组在细胞数量略高于对照组情况下,CD41+%和CD34+%细胞比例明显高于对照组,极大地提高了脐血巨核祖细胞的扩增效率,从而增加了巨核祖细胞的生成量和更好的保持了巨核祖细胞的祖细胞潜能。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!