一种制备环内酰胺衍生物的方法与流程
本发明属有机化学技术领域,具体涉及一种制备环内酰胺衍生物的方法。
背景技术:
环内酰胺衍生物是一类具有应用广泛前景的合成中间体、溶剂。如N-甲基吡咯烷酮是一种已经商品化的优良溶剂。
环内酰胺衍生物可由生物质基平台化合物乙酰丙酸经还原胺化反应制备:非均相催化剂如Pd、Rh、Pt、Au都能催化乙酰丙酸与伯氨的还原胺化反应,但所需氢气压力高、反应温度高(US 32355562,1996;GB 1036694,1996;US 6743819,2004;US 2004192933,2003;Angew.Chem.,Int.Ed.2011,50,7815.);乙酰丙酸酯也可作为原料进行还原胺化反应(ACS Catal.2015,5,5812.),但乙酰丙酸酯需要由乙酰丙酸制备,增加了反应步骤;均相催化剂如Ru配合物可以催化乙酰丙酸与伯氨还原胺化制备环内酰胺衍生物,使用了甲酸作为还原剂(ChemSusChem2011,4,1578.);铱配合物可更高效的实现乙酰丙酸与伯氨还原胺化制备环内酰胺衍生物,使用了甲酸作为还原剂(Chem.Commun.2013,49,5408.);在无催化剂存在下,二甲基亚砜和三乙胺作用下,甲酸作为还原剂可实现乙酰丙酸与伯氨还原胺化制备环内酰胺衍生物,但是产物需要色谱柱分离,增加了分离成本;上述三例反应都使用了甲酸作为还原剂,虽然环内酰胺衍生物产率高,但是甲酸作为还原剂会产生大量的二氧化碳,增加了环保成本;也有报道用氢硅试剂作为还原剂,实现了乙酰丙酸与伯氨还原胺化制备环内酰胺衍生物,但是氢硅试剂成本高,难以进行大规模生产(Green Chem.2014,16,1093;Angew.Chem.,Int.Ed.2015,54,9042.)。
综上,对比非均相催化剂,均相催化剂的反应条件温和,但是均相催化体系使用氢气作为还原剂的反应为见报道。氢气作为还原剂具有廉价、原子经济性高、不产生副产物等优点。因此,开发均相催化剂为催化剂,氢气为还原剂的反应具有巨大价值。
技术实现要素:
针对现有的合成环内酰胺衍生物存在问题:多相催化条件苛刻,需要高温高压;均相催化条件温和,反应活性高,但使用了甲酸或氢硅试剂作为还原剂。本发明提供了一种以高活性铱配合物为催化剂水相中,以氢气为还原剂,实现了乙酰丙酸和伯氨还原胺化反应制备环内酰胺衍生物。
一种制备环内酰胺衍生物的方法,以羰基酸或羰基酯为原料,具体按照以下步骤进行:称取羰基酸或羰基酯、胺溶于溶剂,以金属配合物为均相催化剂、氢气为还原剂制备环内酰胺衍生物,羰基酸或羰基酯与胺物质的量的比为:0–10;金属配合物和胺物质的量的比为0.0001~0.01:1;羰基酸或羰基酯的浓度为0–100gL-1;氢气压力为0.5–5Mpa;反应温度为60–120℃,反应时间为:0–24h。
所述羰基酸结构式为:
n=0、1、2、3、4、5、6、7、8、9或10。
所述羰基酯结构式为:
n=0、1、2、3、4、5、6、7、8、9或10;m=0、1、2、3、4、5、6、7、8、9或10。
所述环内酰胺衍生物的结构式为:
n=0、1、2、3、4、5、6、7、8、9或10。
所述胺为氨、芳香伯胺、苄胺、或脂肪伯胺。
所述氨为氨水或液氨。
所述芳香伯胺结构式为:
R1为Me、Et、OMe、F、Cl、Br、I、CO22H、CO2Me、CO2Et、OEt、或CN,R取代基位置为胺基的邻位、间位或对位。
所述苄胺结构式为:
R1为Me、Et、OMe、F、Cl、Br、I、CO2H、CO2Me、CO2Et、OEt、或CN,R取代基位置为胺甲基的邻位、间位或对位。
脂肪伯胺结构式为:n=0-10。
所述金属配合物为铱配合物。
所述铱配合物阳离子的结构式为:L为双齿配体。
所述的双齿配体L的结构式为:R2是吡啶环邻位,间位或对位的H、F、Cl、Br、Me、OMe、OH、NH2或NMe2取代基;或
所述铱配合物阴离子为:三氟甲磺酸根(OTf)、硫酸根(SO4)、四氟硼酸根(BF4)、硝酸根(NO3)、六氟磷酸根(PF6)、二(三氟甲烷磺酰)亚胺(NTf2),对甲苯磺酸根(OTs)、高氯酸根(ClO4)、三氟乙酸根(TFA)或乙酸根(OAc)。
所述溶剂为:水或酸性水溶液。
所述酸性水溶液中含有的酸为:甲酸、乙酸、乙酰丙酸、硫酸、盐酸、硝酸、三氟甲磺酸、甲磺酸、二(三氟甲烷磺酰)亚胺。
所述酸性水溶液的pH范围为1-7。
本发明的有益效果为:铱配合物用量低,催化活性高,降低了生产成本。在水相中实现了乙酰丙酸和伯氨还原胺化反应制备环内酰胺衍生物,有利于环内酰胺衍生物分离和水溶性催化剂的循环使用。采用氢气为还原剂,廉价经济。
附图说明
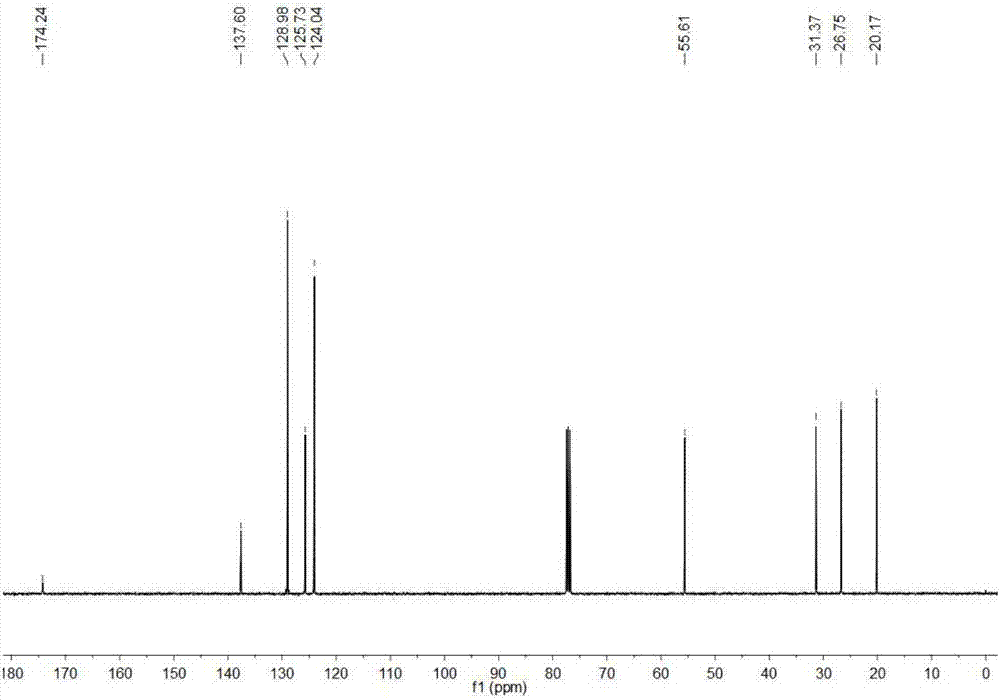
图1为5-methyl-1-phenylpyrrolidin-2-one的1H NMR谱图;
图2为5-methyl-1-phenylpyrrolidin-2-one的13C NMR谱图;
图3为5-methyl-1-(p-tolyl)pyrrolidin-2-one的1H NMR谱图;
图4为5-methyl-1-(p-tolyl)pyrrolidin-2-one的13C NMR谱图;
图5为1-(4-chlorophenyl)-5-methylpyrrolidin-2-one的1H NMR谱图;
图6为1-(4-chlorophenyl)-5-methylpyrrolidin-2-one的13C NMR谱图;
图7为ethyl 4-(2-methyl-5-oxopyrrolidin-1-yl)benzoate的1H NMR谱图;
图8为ethyl 4-(2-methyl-5-oxopyrrolidin-1-yl)benzoate的13C NMR谱图。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围不受实施例的限制,如果该领域的技术熟练人员根据上述本发明内容对本发明做出一些非本质的改进和调整,仍属于本发明的保护范围。
以乙酰丙酸为原料,具体按照以下步骤进行:称取乙酰丙酸、胺溶于溶剂,进行反应;其中铱配合物和伯氨物质的量的比为0.0001~0.0005:1;乙酰丙酸的浓度为50–100gL-1;氢气压力为1.0–2.5Mpa;反应温度为60–120℃,反应时间为:3–24h;乙酰丙酸结构式为:伯氨的结构式为:
所述铱配合物阳离子的结构式为:L为双齿配体。
所述的双齿配体L的结构式为:R1是吡啶环邻位,间位或对位的H、F、Cl、Br、Me、OMe、OH、NH2或NMe2取代基;或
所述铱配合物阴离子为:三氟甲磺酸根(OTf)、硫酸根(SO4)、四氟硼酸根(BF4)、硝酸根(NO3)、六氟磷酸根(PF6)、二(三氟甲烷磺酰)亚胺(NTf2),对甲苯磺酸根(OTs)、高氯酸根(ClO4)、三氟乙酸根(TFA)或乙酸根(OAc)。
所述溶剂为:水。
实施例1
乙酰丙酸与苯胺反应:称量取116.1mg乙酰丙酸,0.44mg催化剂:量取2.0mL水,称量取93.0mg苯胺。体系氢气压力为20bar,温度为80℃,反应时间为10h。反应结束后二氯甲烷萃取分离5-methyl-1-phenylpyrrolidin-2-one,并用二氧化硅柱层析分离产物,收率为75%。
产物5-methyl-1-phenylpyrrolidin-2-one的1H NMR谱图的核磁谱图如图1所示,13C NMR谱图如图2所示具体数据如下
1H NMR(400MHz,CDCl3,TMS)δ7.41–7.36(m,4H),7.22–7.18(m,1H),4.33–4.27(m,1H),2.68–2.49(m,1H),2.41–2.32(m,1H),1.79–1.70(m,1H),1.21–1.19(m,3H);13C NMR(100MHz,CDCl3)δ174.2,137.6,129.0,125.7,124.0,55.6,31.4,26.8,20.2.
产物的结构式为:
实施例2
乙酰丙酸与苯胺反应:称量取116.1mg乙酰丙酸,0.44mg催化剂:量取2.0mL水,称量取93.0mg苯胺。体系氢气压力为15bar,温度为80℃,反应时间为10h。反应结束后二氯甲烷萃取分离5-methyl-1-phenylpyrrolidin-2-one,并用二氧化硅柱层析分离产物,收率为60%。
实施例3
乙酰丙酸与苯胺反应:称量取116.1mg乙酰丙酸,0.44mg催化剂:量取2.0mL水,称量取93.0mg苯胺。体系氢气压力为25bar,温度为80℃,反应时间为10h。反应结束后二氯甲烷萃取分离5-methyl-1-phenylpyrrolidin-2-one,并用二氧化硅柱层析分离产物,收率为77%。
实施例4
乙酰丙酸与苯胺反应:称量取162.5mg乙酰丙酸,0.44mg催化剂:量取2.0mL水,称量取93.0mg苯胺。体系氢气压力为20bar,温度为80℃,反应时间为10h。反应结束后二氯甲烷萃取分离5-methyl-1-phenylpyrrolidin-2-one,并用二氧化硅柱层析分离产物,收率为95%。
实施例5
乙酰丙酸与苯胺反应:称量取162.5mg乙酰丙酸,0.44mg催化剂:量取2.0mL水,称量取93.0mg苯胺。体系氢气压力为20bar,温度为100℃,反应时间为10h。反应结束后二氯甲烷萃取分离5-methyl-1-phenylpyrrolidin-2-one,并用二氧化硅柱层析分离产物,收率为89%。
实施例6
乙酰丙酸与苯胺反应:称量取162.5mg乙酰丙酸,0.087mg催化剂:量取2.0mL水,称量取93.0mg苯胺。体系氢气压力为20bar,温度为80℃,反应时间为24h。反应结束后二氯甲烷萃取分离5-methyl-1-phenylpyrrolidin-2-one,并用二氧化硅柱层析分离产物,收率为88%。
实施例7
乙酰丙酸与对甲基苯胺反应:称量取162.5mg乙酰丙酸,0.44mg催化剂:量取2.0mL水,称量取107.1mg对甲基苯胺。体系氢气压力为20bar,温度为80℃,反应时间为7h。反应结束后二氯甲烷萃取分离5-methyl-1-(p-tolyl)pyrrolidin-2-one,并用二氧化硅柱层析分离产物,收率为95%。
产物5-methyl-1-(p-tolyl)pyrrolidin-2-one的1H NMR谱图如图3所示;13C NMR谱图如图4所示。具体数据如下:
1H NMR(400MHz,CDCl3,TMS)δ7.24–7.17(m,4H),4.27–4.19(m,1H),2.65–2.47(m,1H),2.40–2.30(m,4H),1.77–1.68(m,1H),1.19–1.17(m,3H);13C NMR(100MHz,CDCl3)δ174.2,135.6,135.0,129.6,124.2,55.8,31.3,26.8,21.0,20.2.
产物的结构式为:
实施例8
乙酰丙酸与对氯苯胺反应:称量取162.5mg乙酰丙酸,0.44mg催化剂:量取2.0mL水,称量取107.1mg对氯苯胺。体系氢气压力为20bar,温度为80℃,反应时间为16h。反应结束后二氯甲烷萃取分离1-(4-chlorophenyl)-5-methylpyrrolidin-2-one,并用二氧化硅柱层析分离产物,收率为89%。
产物1-(4-chlorophenyl)-5-methylpyrrolidin-2-one的1H NMR谱图如图5所示;13C NMR谱图如图6所示。具体数据如下:
1H NMR(400MHz,CDCl3,TMS)δ7.36–7.31(m,4H),4.30–4.22(m,1H),2.66–2.30(m,3H),1.78–1.69(m,1H),1.19(d,J=6.2,3H);13C NMR(100MHz,CDCl3)δ174.2,136.2,130.7,129.0,124.9,55.4,31.2,26.6,20.0.
产物的结构式为:
实施例9
乙酰丙酸与对氨基苯甲酸乙酯反应:称量取162.5mg乙酰丙酸,0.44mg催化剂:量取2.0mL水,称量取165.1mg对氨基苯甲酸乙酯。体系氢气压力为20bar,温度为80℃,反应时间为12h。反应结束后二氯甲烷萃取分离ethyl 4-(2-methyl-5-oxopyrrolidin-1-yl)benzoate,并用二氧化硅柱层析分离产物,收率为65%。
产物ethyl 4-(2-methyl-5-oxopyrrolidin-1-yl)benzoate的1H NMR谱图如图7所示,13C NMR谱图如图8所示。
1H NMR(400MHz,CDCl3,TMS)δ8.07–7.55(m,4H),4.43–4.34(m,3H),2.73–2.34(m,3H),1.88–1.74(m,1H),1.39(t,J=7.12,3H),1.26(d,J=6.2,3H);13C NMR(100MHz,CDCl3)δ174.3,166.1,141.9,130.4,126.8,122.0,60.9,55.0,31.4,26.4,19.8,14.3
产物的结构式为:
- 还没有人留言评论。精彩留言会获得点赞!