一种纯化耦合固定化腺苷酸环化酶的制备方法与流程
本发明属于生物工程技术领域,具体设计一种纯化耦合固定化腺苷酸环化酶的制备方法。
背景技术:
酶是一类具有催化功能的生物分子,它与人类的生产和生活密切相关,世上的所有生物离开酶都不能生存。酶的特点包括高效性、专一性、反应条件温和等。但游离酶稳定性差、易失活且不能重复使用,致使其难以应用到大规模的工业化生产中。为了解决这一难题,固定化酶技术应运而生。固定化酶较游离酶有很多优点,如稳定性高、可进行工艺加工、可重复使用。常用的酶的固定化方法包括吸附法、交联法、共价法和包埋法。其中吸附法和包埋法属于物理方法,交联法和共价法属于化学方法。
酶活是酶活力的度量单位,国际生化学会酶学委员会规定在最适反应条件(最适底物、最适pH、最适缓冲液的离子强度及25℃)下,每分钟催化一微摩尔底物转化为产物所需的酶量即为一个国际酶活力单位。酶活力是衡量固定化酶的一个重要指标。影响固定化酶酶活力的因素有很多,除了常见的温度、pH、抑制剂、激活剂等外,还有一些特殊的影响因素例如:
(1)载体的选择:载体选择直接关系到固定化能否成功以及固定化酶的活性。绝大多数的酶都是蛋白质,蛋白质的结构决定其功能,同理酶的结构决定其功能。在酶分子中并不是所有的部位都发挥作用,酶分子中只有一小部分区域的氨基酸残基能够与底物结合并催化底物产生产物,这一特殊区域即酶的活性中心,酶的活性中心是与酶活力直接相关的区域,酶活性部位的结构与酶的活力密切相关。在固定化的过程中,如果选择的载体不合适,可能会直接影响到酶的活性中心以及酶蛋白的高级结构,从而造成固定化酶酶活性低甚至失活。固定化酶载体的选择一般遵循以下几种原则:①载体中含有能与酶发生反应的官能团可以增强其与酶的结合能力,提高固定化酶的稳定性。②载体具有较大的比表面积和多孔结构易于与酶交联,提高固定化率。③载体应不溶于水,可防止酶失活。④载体应具有较好的机械刚性和稳定性,提高固定化酶的重复使用率⑤载体应尽量选择可重复使用的,可大大降低固定化成本⑥载体应无毒、可降解,对环境无影响。常用的载体包括有机和无机材料两大类。有机材料主要是离子交换树脂,用离子交换树脂作载体吸附酶的主要优点是操作方便、条件温和、能够获得较高的固定化酶活力以及载体经洗脱后可重复使用。
(2)固定的方向:酶的固定化有随意和定向之分。随意固定化是指酶通过酶分子上的赖氨酸残基随意固定在载体上,这种固定化会阻碍底物进入到酶的活性位点从而降低酶的活性,并且酶随意固定化在载体上时一般是多位点结合,会降低其固定量。酶的定向固定化则是将酶与载体在酶的特定部位连接起来,使酶在载体表面按一定的方向排列,这种固定化可使酶的活性位点暴露在外侧,方便底物进入活性部位,可提高固定化酶的活性。酶的定向固定化方法很多,包括酶和抗体的亲和连接、酶通过糖基部分固定化、酶和金属离子的连接以及分子生物学的方法。其中酶和金属离子的连接属于常用的一种定向固定化方法。金属Ni2+可将组氨酸标记的蛋白质定向的固定在载体上,实现目标蛋白的分离与纯化。
(3)固定化酶的通透性:研究表明酶固定后,由于酶与底物处于不同的相中,底物需经过水不溶网块和周围的扩散层才能和酶接触,所以固定化酶的反应动力学在很大程度上由固定化酶的通透性决定的。提高固定化酶通透性可以提高其酶活。大孔材料孔道宽,传质阻力小,能够明显的提高固定化酶的通透性。由于这些优点使其在有关固定化酶方面的研究越来越受到重视。
cAMP即环腺苷-3’,5’-磷酸,它是细胞内的第二信使,参与细胞内多种代谢反应如调节血糖平衡、促进脂肪水解产生ATP供能以及通过激活碳酸酐蛋白激酶使后者激活碳酸酐酶调节细胞的酸碱平衡。也有临床研究表明cAMP与多种疾病关系密切,例如高血压、冠心病、糖尿病等,由此开发以cAMP为基础的药物治疗这些疾病。在蛋白质的合成中,基因的转录和翻译都受到cAMP的影响。因此,医学实验和研究工作均需要大量的cAMP。传统的合成cAMP的方法主要是化学合成法,该方法多采用吡啶作溶剂,不仅会对环境造成污染,也严重影响工人的身体健康。现有技术中,生产cAMP主要包括两种方法,一种是在传统化学方法的基础上进行改进,减少污染。另一种则是利用腺苷酸环化酶催化ATP生产cAMP。目前,并无利用固定化腺苷酸环化酶产cAMP的技术。因此利用固定化腺苷酸环化酶产cAMP将会为cAMP的生产提供一个新的方向。
1975年,Porath首次利用固定化金属螯合亲和层析技术(IMAC)分离蛋白质,开始将金属离子作为一种亲和配基使用,开创蛋白质亲和技术的新领域。固定金属亲和吸附技术与传统的亲和技术相比具有成本低,吸附剂制备容易,分离过程简单等诸多优点。正因为这些优点,此技术越来越广泛的应用于酶的固定化上。IMAC中常见的吸附剂包括LX-1000IDA等。LX-1000IDA的载体为琼脂糖凝胶,亚氨基二乙酸(IDA)是其螯合基,它可通过形成五元环与金属形成稳定螯合物,把金属离子束缚在一定的空间区域内。IDA与二价镍的结合实际上是其上面的一个氮原子、两个氧原子与二价镍螯和。IDA具有很多优点,例如体积小、具有亲水性、与金属离子螯和后呈电中性。这些优点使吸附剂在与蛋白质结合时可以减少空间阻碍和非特异性吸附。当然,LX-1000IDA也有其缺点,IDA的价格相对于其它常用的树脂贵,这就增加了工业化生产的成本。同时,以IDA为螯和剂的吸附剂还存在一个不可忽视的问题,如果IDA与金属离子结合不牢固,会造成蛋白质的污染甚至变性。在分离一些治疗用的蛋白时,金属离子如Ni2+、Cu2+的泄露会对人体产生严重的危害。
技术实现要素:
本发明要解决的技术问题是,提供一种高效的丙酮丁醇梭菌生物膜中胞外多糖的分离提取方法。(提供一种高效、安全生产cAMP的方法)
为解决上述技术问题,本发明提供如下技术方案:
一种纯化耦合固定化腺苷酸环化酶的制备方法,包括如下步骤:
(1)制备亲和吸附介质:将5~100g的表面修饰亚氨基二乙酸的金属螯合树脂载体加入到10~200mL、0.01~1mol/L的NiCl2.6H2O溶液中,在25~30℃、150~200rpm条件下振荡2~4h,抽滤获得亲和吸附介质;
(2)酶的固定化:取0.1~1g步骤(1)得到的亲和吸附介质,加入1.5~15mL浓度为0.1~2mg/mL的腺苷酸环化酶溶液,所述腺苷酸环化酶上带有组氨酸标签,在25~30℃、150~200rpm条件下振荡2~4h,离心,得到固定化腺苷酸环化酶。
其中,所述的表面修饰亚氨基二乙酸的金属螯合树脂载体按照如下方法制备如下:
(1a)将琼脂糖按6%~12%溶于水中制成水相,趁热缓慢倾倒于油相中,搅拌均匀,所述的油相组成如下:甲苯、三氯甲烷、Span-80的体积比为72~80:28~40:1~2,将混合物于50~60℃条件下保温3~5min,筛选出粒径为60目的琼脂糖微球,洗净;
(2a)称取15~20g琼脂糖微球加入到30~40mL、2mol/L的NaOH水溶液中,加入100~110mg硼氢化钠、3~4mL环氧氯乙烷,30~35℃振荡,在10~12h内陆续滴加15~20mL NaOH和9~12mL环氧氯乙烷,再继续震荡反应10~12h,用水洗净载体;
(3a)将步骤(2a)中得到的载体加入到40~50mL、2mol/L的Na2CO3溶液中,加入4~5g的IDA于30~35℃摇床中振荡20~24h,用水冲洗干净,得到表面修饰亚氨基二乙酸的金属螯合树脂载体。
其中,所述的腺苷酸环化酶溶液按照如下方法制备:
(1)重组菌的构建:将来源于节杆菌CGMCC 3584的腺苷酸环化酶克隆到质粒上,将重组质粒转化大肠杆菌E.coli,得到重组菌。
(2)诱导表达:将重组菌接至5mL的LB液体培养基中,30℃、200r/min摇床培养12h得种子液,转接4mL的种子液于100mL的LB液体培养基中,30℃、200r/min摇床培养至OD 600达到0.8,加入终浓度为0.6mmol/L的IPTG诱导6h,诱导结束后,5000r/min离心10min收集发酵液,去上清,菌体零下20℃冻存备用。
(3)破碎菌体:取6g菌体加入到1.5L的0.1mol/L的Tris-HCl缓冲液,浓缩4倍,用匀质机将其破壁,破壁时的压强大约在500~900kPa,收集到的上清液即为腺苷酸环化酶溶液。
上述纯化耦合固定化腺苷酸环化酶的制备方法制备得到的固定化腺苷酸环化酶在本发明的保护范围之内。
上述固定化腺苷酸环化酶在催化合成环磷酸腺苷中的应用。
其中,催化反应体系如下:
腺苷酸环化酶9.85~10.23U/mg、ATP 29.8~30.2g/L、丙酮酸2.6~2.7g/L、MgCl2.6H2O15~16g/L,氨水调节PH8.0~8.5;
催化反应条件如下:25~30℃、150~200rpm反应8~12h。
有益效果:
现有技术中,生产cAMP主要包括两种方法,一种是在传统化学方法的基础上进行改进,虽然可以降低污染,但是生产过程较为复杂并且没有真正消除污染,另一种则是利用腺苷酸环化酶催化ATP生产cAMP,此方法虽然高效简便无污染,但是所用腺苷酸环化酶不能重新利用、酶活容易受损失。本发明中固定化腺苷酸环化酶产cAMP的技术不仅保留了上述方法的优点,还弥补这些方法中的不足。此方法的突出优势包括酶活高、能反复使用、酶活损失少。
附图说明
图1:酶液及吸附后酶液的电泳图,泳道1为纯化前的粗酶液,泳道2、3为纯化后的流出液,4为marker。
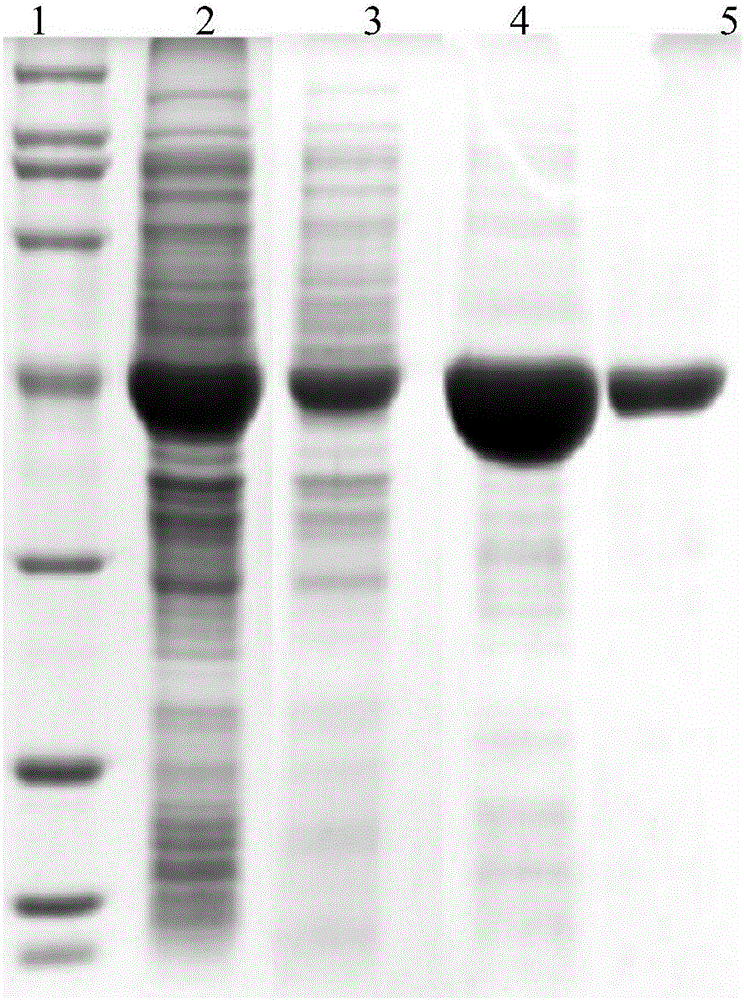
图2:纯化蛋白的电泳图,泳道1为marker,泳道2为固定前的粗酶液,泳道3为固定后剩余的酶液,泳道4为固定后未洗涤洗脱液,泳道5为固定后洗涤洗脱液。
图3:修饰IDA树脂载体微球形貌图。
图4:载体介质表面结构。
图5:载体内部结构剖面图。
图6:载体修饰Ni2+之后内部结构剖面图。
图7:固定化酶批次反应图。
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
实施例1:
表面修饰亚氨基二乙酸的金属螯合树脂载体按照如下方法制备如下:
(1a)将琼脂糖按6%~12%溶于水中制成水相,趁热缓慢倾倒于油相中,搅拌均匀,所述的油相组成如下:甲苯、三氯甲烷、Span-80的体积比为72~80:28~40:1~2,将混合物于50~60℃条件下保温3~5min,筛选出粒径为60目的琼脂糖微球,洗净;
(2a)称取15~20g琼脂糖微球30~40mL、2mol/L的NaOH水溶液中,加入100~110mg硼氢化钠、3~4mL环氧氯乙烷,30~35℃振荡,在10~12h内陆续滴加15~20mL NaOH和9~12mL环氧氯乙烷,再继续震荡反应10~12h,用水洗净载体;
(3a)将步骤(2a)中得到的载体加入到40~50mL、2mol/L的Na2CO3溶液中,加入4~5g的IDA于30~35℃摇床中振荡20~24h,用水冲洗干净,得到表面修饰亚氨基二乙酸的金属螯合树脂载体。
实施例2:Ni2+吸附量的测定
称取2.38g的NiCl2.6H2O定容至100mL的容量瓶中,溶液中Ni2+浓度为0.1mol/L。取5mL定容至500mL的容量瓶中,再从500mL溶液中取出10mL定容至200mL容量瓶中,此时溶液中Ni2+浓度为5×10-5mol/L,最后从200mL溶液中依次取出5mL、10mL、20mL、50mL各定容至100mL容量瓶中,相对应的Ni2+浓度为2.5×10-5mol/L、1×10-5mol/L、5×10-6mol/L和2.5×10-6mol/L。用丁二酮肟分光光度法测量溶液中Ni2+含量,将配制好的各浓度的Ni2+溶液各吸取10mL于25mL容量瓶中,空白对照吸取10mL纯水,加2mL柠檬酸铵溶液和1mL碘溶液于试料中,加水至20mL摇匀,加2mL丁二酮肟溶液,摇匀,加2mL的Na2-EDTA溶液,加水至标线,摇匀。用10mm比色皿,以水为参比液,在530nm波长下测量显色液的吸光度并减去空白试验的吸光度。以各浓度为横坐标,吸光度为纵坐标作图。
由标准曲线可以算出1g树脂吸附的Ni2+浓度为4.68×10-5mol/L,约为0.278mg。实施例3:酶蛋白吸附量的测定
先配制1g/L的标准蛋白质溶液,取7只试管分别标号,按如下表格加入各试剂,于595nm处测量吸光度,以A595为纵坐标,标准蛋白浓度为横坐标,在坐标轴上绘制标准曲线。用已经获得的亲和吸附介质吸附酶液,酶液用量15mL,于25℃、150r/min振荡2个小时,结束后依照上述操作,测出其A595nm,然后利用标准曲线求出蛋白含量。取原酶液、吸附完的上清液以及用500mmol咪唑洗脱固定化酶后的洗脱液进行凝胶电泳实验,结果如图1和图2。由标准曲线可以算出1g树脂可以吸附的蛋白量大约为2.623mg;图1中上清液在45KD处的条带变暗说明了制备的亲和吸附介质对于蛋白的纯化及吸附具有效果;图2中用咪唑洗脱得到的单一条带进一步表明制备的亲和吸附介质对于蛋白纯化及吸附具有良好的效果。
表1蛋白质浓度测定表
实施例4:载体及Ni2+修饰载体后的电镜扫描
将本发明的亚氨基二乙酸修饰的树脂微球载体进行电镜扫描,以及吸附Ni2+后的载体进行电镜扫描,得到图2。图2是修饰IDA树脂载体微球形貌图;图3是载体介质表面结构的电镜扫描图片;图4是载体内部结构剖面的电镜扫描图片;图5是载体修饰Ni2+之后内部结构剖面的电镜扫描图片。由图片可以看出,该载体表面及内部均有许多孔洞及凹坑,这种孔量丰富的结构更有利于酶的固定化。
实施例5:固定化酶使用稳定性的研究。
称取10g已制备好的固定化酶,于4℃下贮藏,定期测定其酶活。固定化酶的储存稳定性测试结果如图6所示,图6表明固定化酶的稳定性很好,经8批次的重复使用,固定化酶的相对酶活仍可达初始值的90%以上。固定化酶酶活为9.85~10.23U/mg,游离酶酶活为3.04~5.10U/mg。
- 还没有人留言评论。精彩留言会获得点赞!