纯化CNTF的方法和制备修饰型CNTF的方法与流程
本发明属于生物医药领域,具体而言,涉及一种从液体混合物中纯化重组人睫状神经营养因子的方法、以及一种制备经化学修饰的重组人睫状神经营养因子的方法。
背景技术:
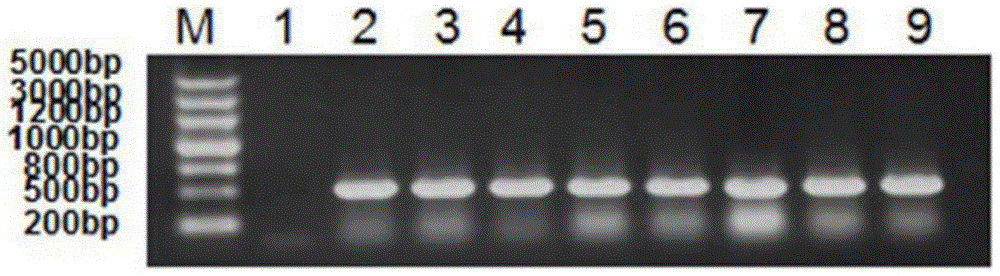
:人源睫状神经营养因子(Ciliaryneurotrophicfactor,简称为CNTF)是一种小分子蛋白,全长由200氨基酸组成,分子量在23KD左右。CNTF在体内以两个二聚体形式进行储存,经过酶解成单体后发生生物学作用。CNTF可以促进包括运动神经元、感觉神经元、交感神经元、海马神经元等多种神经细胞和神经胶质细胞的生长和分化。CNTF因为最初是从鸡的睫状体中提取出来,并可维持鸡副交感神经节的存活而得名。90年代,在将人源CNTF用于治疗肌肉萎缩性脊髓侧索硬化症(ALS)的实验研究中发现,对一组ALS患者进行临床研究发现病人的体重大大降低,使用药物组体重比安慰剂组明显降低。CNTF曾被用来治疗肌萎缩侧索硬化症(ALS),但因副反应太大及疗效不确切而终止了临床实验,但在实验中意外地发现用药者的体重都明显下降。后Regeneron公司根据这一发现,开发了重组人CNTF药物并已完成肥胖症的三期临床实验,并取得了统计学上具有显著性差异的结果。研究表明CNTF可通过激活位于下丘脑的受体而对机体的体重设定点进行调节,从而起到减少摄食、减轻体重的作用。针对这一结果进行在肥胖症领域进行实验,结果表明CNTF在体内可与下丘脑的特异性受体结合,激活抑制食欲的关键信号通路,抑制进食欲望且使机体不会产生饥饿感,从而使体重减轻。研究发现,CNTF具有多种功能,能促使多种神经细胞的存活、营养肌肉,促进糖、脂代谢和调节能量平衡以及摄食行为。在神经系统,肌肉系统,肥胖症 极其相关疾病的治疗中具有重要意义和广阔的临床前景。由于CNTF在治疗或预防肥胖症及其相关疾病中存在半衰期短,活性较低的缺陷,因此,为了开发出具有较高活性且疗效时间较长的CNTF药物,目前现有技术中已开发出了各种CNTF的突变体(或称变异体),并且使用聚乙二醇(PEG)或PEG类聚合物对CNTF进行修饰,由此提高药物的疗效,延长药物在体内作用的时间,并降低使用次数。然而,在采用基因工程技术由宿主细胞表达重组人睫状神经营养因子(RecombinantHumanCiliaryneurotrophicfactor,简称为rhCNTF)或其突变体时,从宿主细胞中纯化rhCNTF或其突变体的纯度往往对后续的修饰率具有重要的影响。而修饰率则对rhCNTF药物的工业化生产具有显著的影响。另外,更重要的是,从宿主细胞中纯化出来的目的蛋白中不可避免地具有残留的核酸和内毒素。生物制药的工业化生产需要严格控制终产品的核酸含量和内毒素含量。药典规定人用单次剂量应不高于10ng。因此,在制备rhCNTF的过程中,对表达产物的纯化是至关重要的。此外,对rhCNTF的修饰以及对修饰产物的纯化也是重要的。然而,在现有技术中,对CNTF细胞表达产物的纯化很难做到极其令人满意的效果,并且CNTF的修饰效果以及修饰产物的纯化效果也有待改善。技术实现要素:为解决上述现有技术中所存在的问题,本发明提供了一种从液体混合物中纯化重组人睫状神经营养因子的方法、以及一种制备经化学修饰的重组人睫状神经营养因子的方法。具体而言,本发明提供了:(1)一种从液体混合物中纯化重组人睫状神经营养因子的方法,所述液体混合物至少包含重组人睫状神经营养因子、核酸以及内毒素,该方法包括以下步骤:i)对所述液体混合物进行疏水层析,以获得疏水层析洗脱液, 其中所述疏水层析所采用的介质为丁基-琼脂糖;和ii)对所述疏水层析所得的洗脱液进行阴离子交换层析,以获得阴离子层析洗脱液,其中所述阴离子交换层析所采用的介质为QHP。(2)根据(1)所述的方法,其中所述阴离子交换层析在pH为7.4-7.7的条件下进行。(3)根据(1)所述的方法,还包括对所述阴离子交换层析所得的洗脱液进行超滤。(4)根据(1)所述的方法,其中所述液体混合物为能表达重组人睫状神经营养因子的细胞的裂解液的上清液。(5)根据(4)所述的方法,其中所述能表达重组人睫状神经营养因子的细胞为遗传工程化的原核宿主细胞。(6)根据(5)所述的方法,其中所述重组人睫状神经营养因子具有SEQIDNO:1所示的氨基酸序列。(7)根据(5)所述的方法,其中所述遗传工程化的原核宿主细胞为大肠杆菌CNTFnew/CC22,所述上清液是对该宿主细胞的裂解液进行离心而获得的。(8)一种制备经化学修饰的重组人睫状神经营养因子的方法,该方法包括以下步骤:a)利用化学修饰剂对重组人睫状神经营养因子进行修饰,从而获得包含修饰型重组人睫状神经营养因子的混合物,其中所述重组人睫状神经营养因子为根据权利要求1-7中任意一项所述方法纯化得到的。(9)根据(8)所述的方法,其中在步骤a)中,所述重组人睫状神经营养因子以浓度为1-4mg/ml,优选为2mg/ml的溶液使用,该重组人睫状神经营养因子与所述化学修饰剂的摩尔比为1:(1-4),优选为1:2。(10)根据(9)所述的方法,其中在所述步骤a)中,所进行的修饰不需要进行终止反应。(11)根据(8)所述的方法,其中所述化学修饰为聚乙二醇化修饰,所述修饰剂选自:聚乙二醇、甲氧基聚乙二醇、甲氧基聚乙二 醇-琥珀酰亚胺琥珀酸酯、甲氧基聚乙二醇-琥珀酰亚胺碳酸酯、甲氧基聚乙二醇三氟乙基磺酸酯、甲氧基聚乙二醇-丙醛、甲氧基聚乙二醇-琥珀酰亚胺丙酸酯、甲氧基聚乙二醇-琥珀酰亚胺α甲基丁酸酯、甲氧基聚乙二醇-N-羟基琥珀酰亚胺、甲氧基聚乙二醇-马来酰亚胺或甲氧基聚乙二醇-乙醛;优选为甲氧基聚乙二醇-马来酰亚胺。(12)根据(8)所述的方法,其中所述方法还包括:b)对所述包含修饰型重组人睫状神经营养因子的混合物进行阴离子交换层析,以获得阴离子层析洗脱液。(13)根据(12)所述的方法,其中所述阴离子交换层析所采用的介质为QHP。(14)根据(12)所述的方法,其中所述方法还包括:c)对所得阴离子层析洗脱液进行超滤。本发明与现有技术相比具有以下优点和积极效果:1.在从包含重组人睫状神经营养因子、核酸以及内毒素的混合物中纯化rhCNTF的过程中,本发明优化了疏水层析所用的介质,并且在疏水层析之后采用阴离子交换层析,并进一步对阴离子交换层析所用的介质进行了优化选择。这些优化方案的组合使得所得纯化样品的纯度得到了突破性的提高,在经过疏水层析和阴离子交换层析之后,所得目的蛋白的纯度可以达到98%,这使得后续对rhCNTF进行修饰的修饰率大大提高。不仅如此,采用阴离子交换介质还使纯化产物中的核酸和内毒素的残余量大大减少,由此能够使最终的rhCNTF药物符合药典的要求,具备生产放大的潜力。2.在以上优化的基础上,通过在纯化过程中增加超滤步骤,最终可以使从细胞中纯化rhCNTF的纯度提高到99%以上。3.在用化学修饰剂修饰rhCNTF的情况中,本发明优化了化学修饰剂与rhCNTF的修饰反应条件,即,优化了rhCNTF的使用浓度,及其与化学修饰剂的摩尔比。通过这样的优化,本发明极大地提高了rhCNTF与化学修饰剂的反应率,并且由此可以省去利用DTT的修饰终止反应。这样为后续纯化的质量控制带来了极大的方便,并且简化 了制备流程。4.本发明还优化了修饰产物的纯化过程,将阴离子交换介质由QFF改为QHP,由此提高了此步的纯化效果。此外,进一步增加了超滤步骤,由此可以进一步提高纯度,为后续的冻干操作做好准备。附图说明图1为rhCNTF突变体表达载体的构建示意图。图2为CNTFnew/CC22的编码序列PCR鉴定图,其中,M为DNA分子量标准(DNAMarker);1为阴性对照;2-9分别为随机挑选的8个CNTFnew/CC22工程菌的菌落的结果。图3为NedI和EcoRI双酶切鉴定的结果图,其中,M为DNA分子量标准;1-8分别为随机挑选的8个CNTFnew/CC22工程菌菌落的结果;9为阴性对照。图4为CNTFnewCC22的全基因序列测定结果图。图5为目的蛋白CNTFnew/CC22的表达结果图,其中,M为蛋白质分子量标准(ProteinMarker);1为阴性对照;2-9分别为随机挑选的8个CNTFnew/CC22工程菌菌落的结果。图6A为纯化后,CNTFnew/CC22蛋白的SDS-PAGE电泳图,其中左道为蛋白质分子量标准,右道为CNTFnew/CC22蛋白;图6B为纯化后,反相HPLC检测CNTFnew/CC22蛋白纯度的结果图。图7为SDS-PAGE电泳图,显示出不同疏水层析介质的纯化效果,其中1为采用辛基-琼脂糖介质的杂蛋白流穿;2为采用丁基-琼脂糖介质的杂蛋白流穿;3为采用苯基-琼脂糖介质的杂蛋白流穿;4为采用辛基-琼脂糖介质的目的蛋白收集峰;5为采用丁基-琼脂糖介质的目的蛋白收集峰;6为采用苯基-琼脂糖介质的目的蛋白收集峰。图8为CNTFnew/CC22蛋白的N端15个氨基酸序列的序列比对图。图9为纯化后,CNTFnew/CC22蛋白免疫印迹结果图,其中左道为蛋白质分子量标准,右道为CNTFnew/CC22蛋白。图10为CNTFnew/CC22蛋白与MAL-mPEG分子结合的示意图;图11为用Y-40K-MAL-mPEG修饰CNTFnew/CC22蛋白之后进行的SDS-PAGE电泳图,其中,M为蛋白质分子量标准(marker);1为用聚乙二醇Y-40K-MAL-mPEG修饰后的CNTFnew/CC22蛋白。图12为聚乙二醇修饰反应混合物经QHP纯化层析的结果图。图13为图12中所收集的各峰的SDS-PAGE电泳图,其中,1为蛋白质分子量标准;2为纯化前,含CNTFnew/CC22蛋白、聚乙二醇Y-40K-MAL-mPEG以及修饰型CNTFnew/CC22的修饰反应混合物;3为QHP纯化层析所收集的P0峰;4为QHP纯化层析所收集的P1峰;5为QHP纯化层析所收集的P2峰。图14为纯化后单修饰产物Y-40K-MAL-mPEG-CNTFnew/CC22的反相HPLC法纯度分析结果图。图15为蛋白样品用胰蛋白酶酶切后的反相HPLC分析图谱。其中,上图为Y-40K-MAL-mPEG-CNTFnew/CC22用胰蛋白酶酶切后的反相HPLC分析图谱,下图为原蛋白CNTFnew/CC22用胰蛋白酶酶切后的反相HPLC分析图谱。图16为Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22中m/z593的提取离子流图(分别为图中的1和2)和一级质谱图(分别为图中的3和4)。图17为分子排阻色谱法测定40KDY-MAL-PEG修饰不同纯度CNTFnew/CC22的修饰率。图A为99%纯度的CNTFnew/CC22的修饰率;图B为95%纯度的CNTFnew/CC22的修饰率。图18为Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22的大鼠体内血药浓度-时间曲线图。A为CNTFnew/CC22静脉注射结果;B为Y-40K-MAL-mPEG-CNTFnew/CC22静脉注射结果;C为CNTFnew/CC22皮下注射结果;D为Y-40K-MAL-mPEG-CNTFnew/CC22皮下注射结果。图19示出Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22对肥胖大鼠肝脏脂肪病变程度的改善结果。1为正常大鼠组;2为赋形剂组;3为饮食结构调整肥胖组;4为西布曲明处理 组;5、6、7分别为25、50、100μg/kgCNTFnew/CC22剂量组;8为200μg/kgY-40K-MAL-mPEG-CNTFnew/CC22食量配对组;9-13分别为25、50、100、200、400μg/kgY-40K-MAL-mPEG-CNTFnew/CC22剂量组。图20示出Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22对db/db模型鼠的短期降糖作用。图21示出Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22对db/db模型鼠口服葡萄糖耐量(OGTT)的改善。图22为Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22蛋白免疫印迹结果图,其中泳道1为蛋白质分子量标准,泳道2为Y-40K-MAL-mPEG-CNTFnew/CC22,泳道3为CNTFnew/CC22蛋白。图23为纯化后,反相HPLC检测CNTFnew/CC22蛋白纯度的结果图。具体实施方式以下通过具体实施方式的描述并参照附图对本发明作进一步说明,但这并非是对本发明的限制,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的范围之内。在从表达rhCNTF或其突变体的宿主细胞破碎上清中纯化rhCNTF或其突变体的过程中,本发明的发明人发现,利用现有技术中常规的实验操作进行纯化后,纯化洗脱液中仍然残留有较多的核酸和内毒素。此外,纯化后rhCNTF的纯度仍然有待提高。通过大量的实验研究,发明人惊奇地发现当选用丁基-琼脂糖介质进行疏水层析,并且选用QHP介质进行阴离子交换层析时,不仅提高了rhCNTF的纯度,还大大降低了纯化样品中的核酸和内毒素的残余量。基于以上发现,本发明一个方面提供了一种从液体混合物中纯化重组人睫状神经营养因子的方法,所述液体混合物至少包含重组人睫状神经营养因子、核酸以及内毒素,该方法包括以下步骤:i)对所述液体混合物进行疏水层析,以获得疏水层析洗脱液, 其中所述疏水层析所采用的介质为丁基-琼脂糖;和ii)对所述疏水层析所得的洗脱液进行阴离子交换层析,以获得阴离子层析洗脱液,其中所述阴离子交换层析所采用的介质为QHP。在本文中,术语“重组人睫状神经营养因子”属于重组DNA制品范畴,是采用遗传修饰,将编码人睫状神经营养因子DNA通过质粒或者病毒载体引入适宜的微生物活细胞系,DNA经过表达和翻译后,再经提取和纯化而制得重组人睫状神经营养因子。目前已经开发出多种多样的可用于疏水层析的介质,以及多种多样的可用于阴离子交换层析的介质,这些介质均是市售可得的。然而,在这些疏水层析介质和阴离子交换层析介质中,本发明的发明人惊奇地发现,丁基-琼脂糖介质对rhCNTF的选择性最佳,QHP介质具有优异的核酸和内毒素去除效果,并且当这两者组合使用时,rhCNTF的纯化效果格外突出,不仅纯度得到了突破性地提高,纯化样品中的核酸和内毒素的残余量也大大减少。rhCNTFnew/CC22在大肠杆菌细胞里是可溶形式表达的,破碎后获得的上清混合物中含有大量的宿主蛋白杂质,以及核酸,内毒素等,从中纯化出能达到药用级别纯度的rhCNTF/CC22是很大的技术挑战。在现有技术中,纯化所得rhCNTFnew/CC22蛋白的纯度能够达到98%已经达到了最好的水平,并且该纯度需要进行至少三种层析或其它复杂的操作才能够实现,进一步提高此纯度将是困难的。策略之一是增加层析的步骤,但这会大大降低收率,将工艺放大以适应工业生产的潜力差。进一步提高rhCNTF/CC22蛋白纯度(例如99%以上)将带来如下的好处:首先,可以提高化学修饰剂与rhCNTFnew/CC22反应的反应效率,此处的反应效率是指反应的专一性和反应的程度(修饰率)。99%以上的纯度已经极大地减少杂质蛋白对修饰反应的影响,其专一性的提高不言而喻。此外,由于杂质蛋白的大大减少,rhCNTFnew/CC22蛋白与修饰剂的反应减少了干扰因素,反应将进行得更加彻底,从而提高了rhCNTFnew/CC22与修饰剂反应基团的接近和碰撞,由此提高发生反应的几率,进而提高修饰率。另外,进一步 提高rhCNTF/CC22蛋白纯度有利于简化后续的rhCNTFnew/CC22修饰产物的纯化。以上优点使得本发明工艺在工业生产水平上能够有效地减少生产成本。丁基-琼脂糖介质(例如)可以采用美国GE(GEHealthcareLifeSciences)公司的ButylSepharoseHighPerformance和ButylSepharose4FastFlow。QHP介质(例如)可以购自GE公司。在本发明的方法中,所述疏水层析可以采用本领域已知的方法进行,例如,可以在pH为7.9-8.2的条件下进行,优选在pH为8.0的条件下进行。所述阴离子交换层析优选在pH为7.4-7.7的条件下进行,更优选在pH为7.5的条件下进行,缓冲液可以使用(例如)50mMTris-HCl。本领域技术人员可以理解的是,还可以使用其他本领域常用的缓冲液,只要pH满足上述范围即可。阴离子交换层析可以采用本领域已知的方法进行。优选的是,本发明所述的方法还包括对所述阴离子交换层析所得的洗脱液进行超滤。超滤可以采用本领域常规的方法进行,例如,可以使用50mMTris-HCl,pH8.0缓冲液,利用5K中空纤维柱(可以购自美国Spectrum公司)对所述洗脱液进行超滤。在本发明的一个具体实施方案中,本发明涉及从能表达重组人睫状神经营养因子的基因工程用细胞中纯化该重组人睫状神经营养因子。在该情况中,所述至少包含重组人睫状神经营养因子、核酸以及内毒素的液体混合物为能表达重组人睫状神经营养因子的细胞的裂解液的上清液。所述能表达重组人睫状神经营养因子的基因工程用细胞可以为遗传工程化的原核宿主细胞,也可以为遗传工程化的真核宿主细胞。所述上清液可以是对宿主细胞的裂解液进行离心而获得的,例如,通过高压匀浆破碎表达重组人睫状神经营养因子的工程菌体后进行离心而获得。优选的是,所述重组人睫状神经营养因子具有SEQIDNO:1所示的氨基酸序列。即,该重组人睫状神经营养因子是通过在重组人睫状神经营养因子的氨基酸序列的基础上,保留了第17位的半胱氨酸, 将第63位的谷氨酰胺突变为精氨酸,并且去除了C末端的15个氨基酸而得到的突变体。本发明将该突变体称为CNTFnew/CC22。CNTFnew/CC22的DNA序列如SEQIDNO:2所示。本发明中优选使用大肠杆菌CNTFnew/CC22工程菌。该工程菌是将编码CNTFnew/CC22的表达载体pET24a+/CNTFnew/CC22转化到BL21(DE3)感受态细胞中而制备得到。该工程菌经培养,诱导可表达CNTFnew/CC22。本领域技术人员已知,该过程属于基因工程领域的常规实验操作。术语“遗传工程化”是指通过遗传工程手段对宿主细胞进行操作,以使其能够表达目的蛋白。术语“疏水层析”是一种液相吸附层析,它是依据蛋白质分子之间的疏水性的差异来进行蛋白质分离的层析方法。术语“离子交换层析”是一种吸附层析,其根据蛋白质分子之间电荷的差异以及带电荷蛋白质分子和层析填料上相反电荷之间可逆的相互作用进行蛋白质分离。本发明另一个方面提供了一种制备经化学修饰的重组人睫状神经营养因子的方法,该方法包括以下步骤:a)利用化学修饰剂对重组人睫状神经营养因子进行修饰,从而获得包含修饰型重组人睫状神经营养因子的混合物,其中所述重组人睫状神经营养因子为根据本发明第一个方面所述的方法纯化得到的。发明人经过反复摸索,优化了所述步骤a)的反应条件。优选的是,在步骤a)中,所述重组人睫状神经营养因子以浓度为1-4mg/ml,更优选为2mg/ml的溶液使用,该重组人睫状神经营养因子与所述化学修饰剂的摩尔比为1:(1-4),更优选为1:2。这样的反应条件极大地提高了rhCNTF与化学修饰剂的反应率,并且由此使得所进行的修饰不需要进行终止反应,从而省略DTT的使用。这样为后续纯化的质量控制带来了极大的方便,并且简化了制备流程。当所述重组人睫状神经营养因子为上述具有SEQIDNO:1所示的氨基酸序列的重组人睫状神经营养因子突变体时,利用化学修饰剂对其进行的修饰为定点修饰。该定点修饰是通过在所述的第17位半 胱氨酸上结合化学修饰剂而实现的。定点修饰的方法可采用本领域已知的方法,例如张霖琳等,聚乙二醇单修饰重组人粒细胞集落刺激因子的研究,生物工程学报,2005,21(6)中公开的方法。优选的是,所述步骤a)在4℃下反应12-20小时。所述的化学修饰剂可以使用在蛋白质工程领域中常用的化学修饰剂(包括高分子、聚合物修饰剂等),只要能够与半胱氨酸的巯基相结合,获得均一的修饰后产物即可。在本文中,“均一”是指没有同分异构体,纯度在95%以上。优选的是,所述化学修饰剂为聚乙二醇(PEG)或聚乙二醇类聚合物。在本文中,所述的“聚乙二醇类聚合物”指的是聚乙二醇衍生物,在聚乙二醇的应用中,端基起着决定性的作用,不同端基的聚乙二醇具有不同的用途。在实际应用中聚乙二醇高分子链端不仅仅局限于带端羟基,其它反应性更强的功能化基团,如对甲苯磺酸酯基、氨基、羧基、醛基等亦可被引入到聚乙二醇链的两端。这些功能化基团的引入扩大了聚乙二醇的应用范围,使它在有机合成、多肽合成、高分子合成及药物的缓释控释、靶向施药等多方面均具有广阔的应用前景。更优选的是,本发明的用于修饰的聚乙二醇或聚乙二醇类聚合物的分子量为1kD~100kD。优选的是,所述化学修饰为聚乙二醇化修饰,所述修饰剂选自:聚乙二醇、甲氧基聚乙二醇、甲氧基聚乙二醇-琥珀酰亚胺琥珀酸酯、甲氧基聚乙二醇-琥珀酰亚胺碳酸酯、甲氧基聚乙二醇三氟乙基磺酸酯、甲氧基聚乙二醇-丙醛、甲氧基聚乙二醇-琥珀酰亚胺丙酸酯、甲氧基聚乙二醇-琥珀酰亚胺α甲基丁酸酯、甲氧基聚乙二醇-N-羟基琥珀酰亚胺、甲氧基聚乙二醇-马来酰亚胺或甲氧基聚乙二醇-乙醛;优选为甲氧基聚乙二醇-马来酰亚胺。此外,优选的是,所述方法还包括:b)对所述包含修饰型重组人睫状神经营养因子的混合物进行阴离子交换层析,以获得阴离子层 析洗脱液。所述阴离子交换层析所采用的介质优选为QHP,其可以进一步提高修饰型rhCNTF的纯度,为后续的冻干操作做好准备。阴离子交换层析可以采用本领域已知的方法进行。优选的是,所述方法还包括:c)对所得阴离子层析洗脱液进行超滤。超滤可以采用本领域常规的方法进行。以下通过例子的方式进一步解释或说明本
发明内容,但这些例子不应被理解为对本发明保护范围的限制。制备例1:CNTF突变体(CNTFnew/CC22)的全基因序列合成全基因序列合成重组人睫状神经营养因子的DNA序列SEQIDNO:2,其编码的氨基酸序列为SEQIDNO:1。其中,重组人睫状神经营养因子为保留原始人源CNTF氨基酸序列的第17位Cys,并将其中第63位谷氨酰胺突变成精氨酸,去除C末端的15个氨基酸形成新的CNTF突变体(CNTFnew/CC22)。CNTFnew/CC22的全基因序列合成可由上海捷瑞生物工程有限公司完成。制备例2:CNTFnew/CC22表达载体的构建与工程菌的鉴定全基因序列合成后,取合成片段5μL(20ng/μL),加入限制性内切酶NedI1μL(10U/μL)和EcorI1μL(15U/μL)(上述限制性内切酶购于TAKARA公司)。加入限制性内切酶缓冲液2μL,加双蒸水11μL,成为20μL体系。37℃水浴,酶切1小时。同时,取pET24a+质粒(购于Novagen公司)5μL(100ng/μL),加入相同的限制性内切酶NedI1μL(10U/μL)和EcorI1μL(15U/μL)(限制性内切酶购于TAKARA公司),加双蒸水11μL,成为20μL体系。37℃水浴,酶切1小时,以酶切载体pET24a+。酶切完成后,进行1%的琼脂糖凝胶电泳。切割下带有目的条带(CNTF条带约500bp)的胶,利用琼脂糖凝胶回收试剂盒(购于天根生化科技有限公司)对酶切后的目的片段和载体片段进行回收。取酶切后的合成目的片段5μL(10ng/μL)、酶切后的载体pET24a+5μL(50ng/μL),加入1μL用(350U/μL)T4DNA连接酶(购于TAKARA公司),加入10×连接酶缓冲液2μL(为混合液,TAKARA公司的配方,Tris-HCl(pH7.6)660mM,MgCl266mM,DTT100mM,ATP1mM),加入双蒸水7μL,成为20μL的连接反应体系。16℃连接过夜。连接成表达载体,命名为pET24a+/CNTFnew/CC22。图1示意性地示出了该CNTF突变体表达载体的构建过程。(2)将表达载体pET24a+/CNTFnew/CC22转化到感受态细胞BL21(DE3)中,制备出CNTFnew/CC22工程菌不含抗生素的LB液体培养基配方:胰蛋白胨(Tryptone)10g/L,酵母提取物(Yeastextract)5g/L,氯化钠(NaCl)10g/L。含50μg/ml卡那霉素的LB固体培养基:胰蛋白胨(Tryptone)10g/L,酵母提取物(Yeastextract)5g/L,氯化钠(NaCl)10g/L,卡那霉素50mg/L。具体步骤:取连接后的表达载体pET24a+/CNTFnew/CC22共2μL,加入到一支(100μl/支)感受态细胞BL21(DE3)(购于天根生化科技有限公司)中,轻敲后放置于冰上30分钟,42℃水浴热激60秒后,迅速置于冰上2分钟。加入不含抗生素的LB液体培养基300μL,至于摇床中,37℃、200转/分钟培养1小时。经过培养后的菌液涂于含50μg/ml卡那霉素的LB固体培养基平板上,于37℃培养箱中过夜培养,得到带有pET24a+/CNTFnew/CC22质粒的单个菌落。取单个菌落,接种到5mlLB液体培养基(含50μg/ml卡那霉素)中,37℃、200转/分钟过夜培养。得到工程菌,命名为CNTFnew/CC22工程菌。(3)经过PCR鉴定、双酶切鉴定、全基因序列测定三种方法确定CNTFnew/CC22工程菌中包含有目的蛋白CNTFnew/CC22的编码序列(SEQIDNO:2)。PCR鉴定过程:取过夜培养的CNTFnew/CC22工程菌的菌液1μL(OD3-4),加入引物1(序列为:ATGGCTTTCACAGAGCATTC)为1μL(10μM),引物2(序列为:GTCATGGATGGACCTTACTG) 为1μL(10μM),DNA聚合酶为1μL(2.5U/μL),2×PCR缓冲液10μL,双蒸水6μL,成为20μL的PCR反应体系。放入PCR仪中,温度循环为:第一步:94℃5分钟。第二步:94℃30秒、55℃30秒、72℃1分钟,共30个循环。第三步:72℃10分钟。第四步:4℃恒温后取出。PCR结束后对样品进行1%的琼脂糖凝胶电泳,观察结果。PCR鉴定的结果参见图2,其中,M为DNAMarker;1为阴性对照;2-9分别为随机挑选的8个CNTFnew/CC22工程菌的菌落的结果。PCR鉴定结果:随机挑取的8个工程菌菌落均为阳性菌落。双酶切鉴定过程:取过夜培养的CNTFnew/CC22工程菌的菌液5ml(OD3-3.5),利用质粒小量提取试剂盒(购于Axeygen公司)提取质粒。取提取的质粒5μL(100ng/μL),限制性内切酶NedI10U/μL和EcorI各1μL(15U/μL),限制性内切酶缓冲液2μL,双蒸水11μL,成为20μL的双酶切体系,于37℃水浴,酶切1小时,之后进行1%的琼脂糖凝胶电泳,观察结果。双酶切鉴定的结果参见图3,其中,M为DNAMarker;1-8分别为随机挑选的8个CNTFnew/CC22工程菌菌落的结果;9为阴性对照。双酶切鉴定结果:随机挑取的8个工程菌菌落均为阳性菌落。CNTFnewCC22的全基因序列测定由北京诺赛基因组研究中心完成。CNTFnewCC22的全基因序列测定结果见图4。全基因序列测定结果:与事先设计并合成的序列一致。制备例3:目的蛋白CNTFnew/CC22的表达1)制备LB琼脂平板:胰蛋白胨10g、酵母提取物5g、NaCl5g,琼脂10g、加水定容至1L,高温高压灭菌,当温度降到50℃左右时加入卡那霉素,至终浓度为50μg/ml,取20ml倒培养皿,凝固后即成LB琼脂平板。2)培养CNTFnew/CC22工程菌:将CNTFnew/CC22工程菌划线接种于LB琼脂平板,37℃培养过夜。从培养基过夜的LB平板上挑选生长状态良好的单个菌落,接种于含LB的试管中,37℃培养10h。 然后转种至含有200mlLB液体培养液(胰蛋白胨10g、酵母提取物5g、NaCl5g,加水定容至1L,高压灭菌,分装三角瓶,每瓶200ml)的三角瓶中,37℃培养过夜制得种子液。将种子液按1%比例接种于含30L2YT培养液的50L发酵罐中,发酵培养基为2YT(胰蛋白胨480g、酵母提取物300g、NaCl50g,加入蒸馏水溶解,5NNaOH调节PH至7.0,定容到30L,0.12Mpa、121℃、30min,高压灭菌)。控制发酵温度37℃、转速250-450r/min、通气量30-50L/min、pH7.3,培养至A600=1.2左右后,加入异丙基硫代-β-D-半乳糖苷(IPTG)至终浓度为1.0mM进行诱导。继续培养4.5小时,终止发酵,收集菌体,储存于-30℃冰箱中备用。取表达目的蛋白后的菌体,进行SDS-PAGE电泳,观察目的蛋白CNTFnew/CC22的表达结果见图5,其中,M为蛋白质marker;1为阴性对照;2-9分别为随机挑选的8个CNTFnew/CC22工程菌菌落的结果。实施例1:目的蛋白CNTFnew/CC22的纯化将按制备例3的方法得到的发酵菌体,按1:10比例加入50mMTris-HCl,pH8.0,高压匀浆破碎,操作条件:1000bar,温度控制在8℃以下。3次循环,10,000rpm,4℃离心30分钟,收集上清进行分离纯化。首先采用疏水层析,所选用的介质为丁基-琼脂糖介质(购自美国GE公司,ButylSepharoseHighPerformance),层析柱为XK50/10。选用50mMTris-HCl,pH8.0,1M(NH4)2SO4的缓冲液平衡层析柱,300ml(浓度为6.65mg/ml)的破碎上清中加入终浓度为1M硫酸铵后上样,用平衡缓冲液淋洗1个柱体积,随后采用梯度洗脱,5个柱体积内将缓冲液置换为50mMTris-HCl,pH8.0。收集洗脱峰,调pH7.5,用50mMTris-HCl,pH7.5缓冲液透析脱盐,脱盐后样品采用阴离子交换介质QHP(购自美国GE公司,QSepharoseHighPerformance),柱子为XK50/10,进行精制纯化,上样量为450ml(浓度为0.26mg/ml);平衡缓冲液A为50mMTris-HCl,pH7.5,洗脱液B为50mMTris-HCl,1MNaC,pH7.5,10%(体积)B梯度洗脱获得目的蛋白洗脱峰。所 得纯化样品进行超滤浓缩换液,使用5K中空纤维柱(购自美国Spectrum公司),缓冲液换为50mMTris-HCl,pH8.0。所得rhCNTF纯度可达99%以上。纯化结果见图6:A为CNTFnew/CC22蛋白SDS-PAGE电泳图,其中左道为蛋白质分子量标准,右道为CNTFnew/CC22蛋白;B为反相高效液相色谱(岛津LC20AT,资生堂C8柱,缓冲液A:0.1%TFA/水,缓冲液B0.1%TFA/乙腈,洗脱梯度为50%-60%,30分钟)检测CNTFnew/CC22蛋白纯度的结果,纯度均达到99%以上(峰面积归一法,反相HPLC检测数据如下表所示)。检测器ACh1220nm峰#保留时间面积高度面积%高度%111.8004216112810.1170.189214.8753600985067518299.74699.570319.0073138010070.0870.148420.05448371850.0130.027522.018133824410.0370.065总计36101609678096100.000100.000实施例2:目的蛋白CNTFnew/CC22的纯化将按制备例3的方法得到的发酵菌体,按1∶10比例加入50mMTris-HCl,pH8.0,高压匀浆破碎,操作条件:1000bar,温度控制在8℃以下。3次循环,10,000rpm,4℃离心30分钟,收集上清进行分离纯化。首先采用疏水层析,所选用的介质为丁基-琼脂糖介质(购自美国GE公司,ButylSepharoseHighPerformance),层析柱为XK50/10。选用50mMTris-HCl,pH8.0,1M(NH4)2SO4的缓冲液平衡层析柱,300ml(浓度为6.65mg/ml)破碎上清中加入终浓度为1M硫酸铵后上样,用平衡缓冲液淋洗1个柱体积,随后采用梯度洗脱,5个柱体积内将缓冲液置换为50mMTris-HCl,pH8.0。收集洗脱峰,调pH7.5,用50mMTris-HCl,pH7.5缓冲液透析脱盐,脱盐后样品采用阴离子交换介质QHP(购自美国GE公司,QSepharoseHighPerformance),柱子为XK50/10,进行精制纯化(具体操作同实施例1),上样量为450ml(浓度为0.26mg/ml)。所得rhCNTF样品,HPLC测定(岛津LC20AT,资生堂C8柱,缓冲液A:0.1%TFA/水,缓冲液B0.1%TFA/ 乙腈,洗脱梯度为50%-60%,30分钟)纯度达到98.3%。纯度检测结果见图23,数据表如下检测器ACh1220nm峰#保留时间面积高度面积%高度%111.5623844413300.1070.172213.7253718820960.1040.271314.6793518110275335898.31597.387416.19219137071230.5350.921516.69217888949870.5000.645618.809249447280.0700.094721.82413201139530.3690.511总计35783947773575100.000100.000对比例1:目的蛋白CNTFnew/CC22的纯化将按制备例3方法得到的发酵菌体,按1∶10比例加入50mMTris-HCl,pH8.0,高压匀浆破碎,操作条件:1000bar,温度控制在8℃以下。3次循环,10,000rpm,4℃离心30分钟,收集上清进行分离纯化。首先采用疏水层析,所选用的介质为辛基-琼脂糖介质(购自美国GE公司,OctylSepharose4fastflow,层析柱为XK50/10)。选用50mMTris-HCl,pH8.0,1M(NH4)2SO4的缓冲液平衡层析柱,600ml(浓度为6.34mg/ml)破碎上清中加入1M硫酸铵后上样,用平衡缓冲液淋洗1个柱体积,随后采用梯度洗脱,5个柱体积内将缓冲液置换为50mMTris-HCl,pH8.0。收集洗脱峰,调pH5.0,用50mM乙酸-乙酸钠,pH5.0缓冲液透析脱盐,脱盐后,460ml浓度为0.22mg/ml的样品采用阳离子交换介质CMFF(得自GE公司,CM4FastFlow),柱子为XK50/10进行精制纯化,平衡缓冲液A为50mMTris-HCl,pH8.0;洗脱缓冲液B为50mMTris-HCl,1MNaCl,pH8.0。10%(体积)B进行梯度洗脱。所得rhCNTFnew/CC22经HPLC(岛津LC20AT,资生堂C8柱,缓冲液A:0.1%TFA/水,缓冲液B0.1%TFA/乙腈,洗脱梯度为50%-60%,30分钟)测定纯度为95.4%。试验例1:不同疏水层析介质的纯化效果比较按照实施例1的方法破碎发酵菌体,然后利用辛基琼脂糖介质(购自美国GE公司,OctylSepharose4fastflow)丁基-琼脂糖介质 (购自美国GE公司,ButylSepharoseHighPerformance)和苯基-琼脂糖介质(购自GE公司,PhenylSepharoseHighPerformance)分别对破碎上清进行疏水层析纯化。疏水层析操作按照实施例1中所述的方法进行。具体而言:以50mMTris-HCl,pH8.0,1M(NH4)2SO4的缓冲液平衡层析柱,破碎上清中加入1M硫酸铵后上样,用平衡缓冲液淋洗1个柱体积,随后采用梯度洗脱,5个柱体积内将缓冲液置换为50mMTris-HCl,pH8.0,收集洗脱峰,在相同条件下进行SDS-PAGE分析。由图7可知,采用丁基-琼脂糖介质时,流穿的杂蛋白最多,辛基-琼脂糖介质和苯基-琼脂糖介质流穿的杂蛋白较少。这说明丁基-琼脂糖介质对目的蛋白CNTF/CC22new的选择性比辛基-和苯基-琼脂糖介质好。试验例2:阳离子交换层析CMFF介质与阴离子交换层析QHP介质、QFF介质的纯化效果比较按照实施例2的方法进行纯化,获得QHP纯化的样品;按照实施例2的方法进行纯化,只是将QHP介质换成QFF介质,获得QFF纯化样品;按照对比例1方法进行纯化,获得CMFF纯化样品。对以上三种纯化样品按照《中国药典》第三部2010版推荐的荧光染色法进行测定其核酸残余量,进而比较这三种介质对核酸残余的去除效果。方法简述如下:用TE缓冲液配制标准品溶液、CMFF纯化样品溶液,QHP纯化样品溶液和QFF纯化样品溶液,其中,标准品由荧光染料试剂盒(Quant-iTTMdsDNAAssayKit)提供。CMFF纯化样品中CNTFnew/CC22蛋白浓度为2.13mg/ml,反相高效液相色谱(岛津LC20AT,资生堂C8柱,缓冲液A:0.1%TFA/水,缓冲液B0.1%TFA/乙腈,洗脱梯度为50%-60%,30分钟)测定纯度为95.4%;QHP纯化样品CNTFnew/CC22浓度为2.96mg/ml,反相高效液相色谱(测定条件同上)测定纯度为98.3%,QFF纯化样品CNTFnew/CC22浓度为2.83mg/ml,反相高效液相色谱(测定条件同上)测定纯度为97.1%。将DNA标准品溶液、CMFF纯化样品溶液,QHP纯化样品溶液, 和QFF纯化样品溶液分别加入黑色96孔酶标板中,每孔125μl,每个样品做3个复孔。每孔再加入125μl新配制的双链DNA荧光染料(按试剂盒Quant-iTTMdsDNAAssayKit说明书配制),避光混匀后静置5分钟。用荧光酶标仪InfiniteM200pro(厂家:Tecan)在激发波长480nm、发射波长520nm处测定荧光强度。以TE缓冲液测得的荧光强度为本底,记算各孔的荧光强度。以标准品溶液的浓度对其相应的荧光强度作直线回归,求得直线回归方程(r2>0.99)。将供试品溶液的荧光强度代入直线回归方程,求出各供试品中的宿主细胞DNA残留量(单位:ng/ml),如下表。供试品平均核酸残余(ng/ml)QHP纯化样品8.25QFF纯化样品17.31CMFF纯化样品302.51由结果可以看出,阴离子交换层析QHP介质的核酸残余去除效果最好。试验例3:将按制备例3方法得到的发酵菌体,按1:10比例加入50mMTris-HCl,pH8.0,高压匀浆破碎,操作条件:1000bar,温度控制在8℃以下。3次循环,10,000rpm,4℃离心30分钟,收集上清进行分离纯化。首先采用疏水层析,所选用的介质为丁基-琼脂糖介质(购自美国GE公司,ButylSepharoseHighPerformance,层析柱为XK50/10)。选用50mMTris-HCl,pH8.0,1M(NH4)2SO4的缓冲液平衡层析柱,300ml(浓度为6.13mg/ml)破碎上清中加入1M硫酸铵后上样,用平衡缓冲液淋洗1个柱体积,随后采用梯度洗脱,5个柱体积内将缓冲液置换为50mMTris-HCl,pH8.0。收集洗脱峰,调pH5.0,用50mM乙酸-乙酸钠,pH5.0缓冲液透析脱盐,脱盐后,450ml浓度为0.25mg/ml的样品采用阳离子交换介质CMFF(得自GE公司,CM4FastFlow),柱子为XK50/10进行精制纯化(具体操作同实施例1),所得 rhCNTFnew/CC22经HPLC(岛津LC20AT,资生堂C8柱,缓冲液A:0.1%TFA/水,缓冲液B0.1%TFA/乙腈,洗脱梯度为50%-60%,30分钟)测定纯度为96.9%。试验例4:将按制备例3方法得到的发酵菌体,按1:10比例加入50mMTris-HCl,pH8.0,高压匀浆破碎,操作条件:1000bar,温度控制在8℃以下。3次循环,10,000rpm,4℃离心30分钟,收集上清进行分离纯化。首先采用疏水层析,所选用的介质为辛基-琼脂糖介质(购自美国GE公司,OctylSepharose4fastflow,层析柱为XK50/10)。选用50mMTris-HCl,pH8.0,1M(NH4)2SO4的缓冲液平衡层析柱,300ml(浓度为6.34mg/ml)破碎上清中加入1M硫酸铵后上样,用平衡缓冲液淋洗1个柱体积,随后采用梯度洗脱,5个柱体积内将缓冲液置换为50mMTris-HCl,pH8.0。收集洗脱峰,调pH7.5,用50mMTris-HCl,pH7.5缓冲液透析脱盐,脱盐后样品采用阴离子交换介质QHP(购自美国GE公司,QSepharoseHighPerformance),柱子为XK50/10,进行精制纯化(具体操作同实施例1),上样量为450ml(浓度为0.26mg/ml)。所得rhCNTF样品,HPLC测定(岛津LC20AT,资生堂C8柱,缓冲液A:0.1%TFA/水,缓冲液B0.1%TFA/乙腈,洗脱梯度为50%-60%,30分钟)纯度达到96.8%。试验例5:CNTFnew/CC22蛋白的N端15个氨基酸序列测定序列比对为将CNTFnew/CC22蛋白的N端15个氨基酸序列与人源CNTF的N端测序结果进行比对,测定结果见图8,结果说明CNTFnew/CC22蛋白的N端15个氨基酸序列的测序结果与预先设计完全相同。试验例6:CNTFnew/CC22蛋白的体外活性鉴定TF-1CN5a1细胞是一个依赖于GM-CSF的细胞系,其细胞表面具有rhCNTF高亲和力受体,所以CNTF能促进TF-1CN5a1细胞的 增殖。将不同浓度的CNTFnew/CC22加入TF-1CN5a1细胞培养物中,观察细胞的生长情况,以测定CNTFnew/CC22体外活性,具体方法如下:将TF-1CN5a1细胞(购自美国ATCC,货号为CRL-2512TM),常规培养于GM-CSF条件(100mlRPMI1640中含有500ng的GM-CSF)的培养液中,实验时收集对数生长期的细胞,用无血清的RPMI1640(购自invitrogen公司)洗液洗涤3遍,然后用10%小牛血清RPMI1640培养液调整细胞数为1.0×106,每孔加50μl细胞悬液,使用实施例1中获得的CNTFnew/CC22蛋白从初始浓度10μg/ml按4倍系列稀释后,每孔加入50μl。以50μl无血清RPMI1640培养基作为阴性对照,以CNTF标准品(购自英国国家生物制品检定所NIBSC,货号:94/684)为阳性对照,初始浓度为200ng/ml,进行4倍系列稀释后,每孔加入50μl。培养板在37℃、5%CO2条件下培养48h后,每孔加入50mg/ml的WST-8(购自碧云天生物技术研究所。货号:NIBSC94/684)溶液20μl,继续培养4h后,混匀后在酶标仪上比色,测定波长为570nm,参比波长为630nm。每个实验结果均重复3次,最后取3次实验的平均结果。结果:实施例1获得的CNTFnew/CC22蛋白的体外活性:5.43×106IU/mg。实验同时设置了未突变的重组人睫状神经营养因子对照组(购自sigma,C3710-10UG),实验结果证实未突变的重组人睫状神经营养因子的体外活性约为7.25×104IU/mg,经过定点突变的重组人睫状神经营养因子突变体的生物学活性高于未突变的天然分子。试验例7:CNTFnew/CC22在小鼠体内活性的测定实验用小鼠使用雄性昆明鼠(得自北京维通利华实验动物技术有限公司),体重18-22g。分为CNTF标准品阳性对照组、生理盐水阴性对照组和CNTFnew/CC22处理组,每组8只。阳性对照为用生理盐水溶解的CNTF标准品(购自英国国家生物制品检定所。货号:NIBSC94/684),处理组为CNTFnew/CC22纯品冻干粉剂(实施例1 所得蛋白进一步冻干所得),同样以生理盐水溶解并稀释为100μg/ml。以每只小鼠100μg/kg/天的量进行皮下注射。阴性对照即生理盐水。注射前分别称量每组每只小鼠的体重。连续五天给药,称量小鼠的体重并观察其变化。(1)流程如下表1:表1.CNTF对小鼠减重作用测定流程注:实验时间以给药前一天为-1天,首次给药当天为0天。△:根据前一操作完成情况,可提前或推后,但尽量保持每天在同一时间。(2)测量指标:体重变化率体重变化率=(某组给药后体重-某组给药前体重)/给药前体重×100%体重增长抑制率(%)=(对照组某日体重-对照组d0体重)-(受试组某日体重-该组d0体重)/(对照组某日体重-对照组d0体重)×100%小鼠体重变化结果见表2:表2小鼠体重变化表由表2可知:三组皮下注射后的小鼠,体重均有所增长,但是样品组的小鼠体重增长低于阴性对照组(p<0.05),同时低于阳性对照(p<0.05)(CNTF标准品)组。(2)小鼠体重增长抑制率见下表3:表3小鼠体重增长抑制率由表3可知CNTFnew/CC22体重增长抑制率高于阳性对照(CNTF标准品)的体重增长抑制率。试验例8:CNTFnew/CC22蛋白的免疫反应性以CNTF的单克隆抗体作为特异性抗体进行蛋白质免疫印迹实验,研究免疫反应性。用CNTF的单克隆抗体(购自Abcam公司)作为一抗,以辣根过氧化物酶标记的羊抗鼠IgG(购自abcam公司)作为酶标二抗。首先将实施例1获得的CNTFnew/CC22蛋白做SDS-PAGE电泳,分离胶浓度为12%,浓缩胶浓度为4%,上样量为15μl,恒压110V,电泳1.5小时,终止电泳,将凝胶转入硝酸纤维膜(NC膜)上,分别 与一抗和二抗孵育后显色。图9所示的CNTFnew/CC22蛋白免疫印迹电泳图结果显示CNTFnew/CC22蛋白能够与CNTF的单克隆抗体特异性结合,说明本发明的CNTFnew/CC22蛋白仍具有与天然CNTF相似的免疫反应性。本发明的修饰型CNTF蛋白在位点突变后没有改变蛋白与特异抗体结合的能力。实施例3:CNTFnew/CC22蛋白的修饰本实施例中利用支链Y-40K-MAL-mPEG对实施例1获得的CNTFnew/CC22蛋白进行修饰。1)Y-40K-MAL-mPEG修饰的CNTFnew/CC22蛋白的制备支链40KD的MAL-mPEG购于北京键凯科技有限公司。商品代号:Y-MAL-40K。分子式见下:CNTFnew/CC22蛋白与MAL-mPEG分子结合的示意图可以参考图10,具体方法如下:将纯化的CNTFnew/CC22蛋白浓度调整为2mg/ml,按蛋白:修饰剂为1:2的摩尔比加入分子量为40KD的支链马来酰亚胺-聚乙二醇修饰剂(即Y-40K-MAL-mPEG),4℃反应12小时。2)Y-40K-MAL-mPEG对CNTFnewCC22蛋白的修饰结果将上述方法获得的用Y-40K-MAL-mPEG修饰的修饰型CNTFnew/CC22蛋白进行SDS电泳,结果见图11,其中,M为蛋白质marker;1为用Y-40K-MAL-mPEG修饰后的CNTFnew/CC22蛋白,命名为Y-40K-MAL-mPEG-CNTFnew/CC22。试验例9:不同纯度CNTFnew/CC22蛋白进行Y-40K-MAL-mPEG修饰的修饰率比较以实施例1获得的纯度为99%的CNTFnew/CC22蛋白(反应1)和对比例1获得的纯度为95.4%的CNTFnew/CC22蛋白(反应2)分别按照实施例3所描述的方法进行修饰反应。反应后的修饰混合物使 用分子排阻层析测定修饰反应的修饰率:使用10/300GLSuperdex200分子排阻层析柱(购自GE公司),缓冲液为50mMTris-HCl,pH8.0。结果见图17以及表4。图17A为反应1的修饰率测定结果,图17B为反应2的修饰率测定结果。图17A中保留时间为11.83的峰以及图17B中保留时间为12.45的峰为修饰产物峰,图17A中保留时间为17.87的峰以及图17B中保留时间为18.05的峰为CNTFnew/CC22蛋白峰。修饰率的计算是由总峰面积减去CNTFnew/CC22蛋白峰面积所得(见下面的分子排阻色谱结果数据表)。表4为修饰率测定结果汇总。表4不同纯度CNTFnew/CC22对修饰率的影响修饰反应CNTFnew/CC22纯度修饰率199%93.9%295%87.6%实施例4-11:CNTFnew/CC22蛋白的修饰按照实施例3所述的方法对实施例1获得的CNTFnew/CC22蛋白进行修饰,不同之处在于:改变了所用的CNTFnew/CC22蛋白的浓度、以及蛋白:修饰剂的比例。按照试验例9的方法测定修饰率。修饰条件和修饰结果请参见表5。表5CNTFnew/CC22蛋白的修饰条件和修饰结果实施例12:Y-40K-MAL-mPEG-CNTFnew/CC22蛋白的纯化采用阴离子交换介质QHP(购自美国GE公司,型号:Hiprep16/10QHP)对实施例3获得的Y-40K-MAL-mPEG-CNTFnew/CC22进行纯化。所采用的平衡缓冲液为50mMTris-HCl,pH8.0,5个柱体积内用缓冲液B(50mMTris-HCl,pH8.0,1MNaCl)进行梯度洗脱,收集洗脱峰。所得洗脱峰收集液使用30K中空纤维柱(购自美国spectrum公司)进行超滤浓缩,缓冲液为50mMTris-HCl,pH8.0,从而获得最后的纯品。进行SDS-PAGE电泳以及使用反相高效液相色谱(岛津LC20AT,资生堂C8柱,缓冲液A:0.1%TFA/水,缓冲液B0.1%TFA/乙腈,洗脱梯度为50%-60%,30分钟)进行纯度分析。结果见图12-14。图12为修饰反应混合物经QHP纯化层析的结果图,其中,P0为修饰反应混合物的流穿峰;P1为修饰型CNTFnew/CC22的洗脱峰;P2为杂质洗脱峰。图13为图12中所收集的各峰的相同条件下的SDS-PAGE电泳图,其中,1为marker;2为纯化前,含修饰型CNTFnew/CC22的修饰反应混合物;3为QHP纯化层析所收集的P0峰;4为QHP纯化层析所收集的P1峰;5为QHP纯化层析所收集的P2峰。如图14所示,纯化的Y-40K-MAL-mPEG-CNTFnew/CC22经反相高效液相色谱检测其纯度约达到99%以上(峰面积归一化法,反相HPLC检测数据如下表所示)。检测器ACh1220nm峰#保留时间面积高度面积%高度%16.617244315600.0910.13728.9922676764440662599.90999.863总计26792075407184100.000100.000试验例10:Y-40K-MAL-mPEG-CNTFnew/CC22的免疫反应性以CNTF的单克隆抗体作为特异性抗体进行蛋白质免疫印迹实验,研究免疫反应性。用CNTF的单克隆抗体(购自Abcam公司)作为一抗,用辣根过氧化物酶标记的羊抗鼠IgG(购自abcam公司)作为酶标二抗。首先将实施例1获得的CNTFnew/CC22蛋白和实施例12获得的修饰物Y-40K-MAL-mPEG-CNTFnew/CC22进行SDS-PAGE电泳,分离胶浓度为12%,浓缩胶浓度为4%,上样量为10μg,恒压120V,电泳1.5小时,终止电泳,将凝胶转入硝酸纤维膜(NC膜)上,分别与一抗和二抗孵育后显色。结果如图22所示,泳道1为Marker,泳道2为Y-40K-MAL-mPEG-CNTFnew/CC22,泳道3为CNTFnew/CC22蛋白。结果显示Y-40K-MAL-mPEG-CNTFnew/CC22与CNTFnew/CC22蛋白均能够与CNTF的单克隆抗体特异性结合,说明本发明的CNTFnew/CC22蛋白及其修饰物Y-40K-MAL-mPEG-CNTFnew/CC22仍具有与天然CNTF相似的免疫反应性。本发明的修饰型CNTF蛋白在位点突变及mPEG修饰后没有改变蛋白与特异抗体结合的能力。试验例11:支链Y-40K-MAL-mPEG对CNTFnew/CC22蛋白进行修饰的修饰位点的确定对按实施例1方法得到的原蛋白CNTFnew/CC22、以及按实施例3的方法进行修饰并按实施例12的方法进行纯化而得到的Y-40K-MAL-mPEG-CNTFnew/CC22进行胰蛋白酶酶切,以确定修饰产物的修饰位点。用5mL脱盐柱(购自美国GE公司,型号HitrapDesalting),将原蛋白及修饰产物分别脱盐至含2M脲的50mMNH4HCO3缓冲液中,收取峰尖,按质量比1∶50加入胰蛋白酶(购自美国sigma公司),37℃反应过夜(12小时),加入1%TFA(三氟乙 酸)终止。酶切样品采用资生堂C18反相柱,洗脱梯度为5%-95%,60分钟,检测波长为214nm的条件下进行反相HPLC检测。酶切样品的反相图谱参见图15。上图为Y-40K-MAL-mPEG-CNTFnew/CC22酶切样品反相图谱,下图为CNTFnew/CC22酶切样品反相图谱。上下两图相比,上图多了PEG化多肽(PEGylationPeptide)峰,少了DLCSR肽段峰(DLCSR肽段由D,L,C,S,R这五种氨基酸残基组成,该肽段含有理论上的唯一修饰位点C,半胱氨酸),而下图情况相反,多了DLCSR峰,少了PEG化多肽峰。由此可以看出,原蛋白CNTFnew/CC22与Y-40K-MAL-mPEG-CNTFnew/CC22的反相图谱基本一致。原蛋白消失峰和修饰样品新出现峰的一级质谱图未能确认是否含C17的肽段。因此进一步通过离子流分析确定修饰发生的位点。根据原蛋白的氨基酸序列,得出理论上含C17的胰蛋白酶切片段为DLCSR(为蛋白分子从第15位到19位的氨基酸肽段),理论m/z=593。利用质谱分析软件,分别提取原蛋白和修饰样品的m/z593离子流图以及对应的一级质谱,其分别为图16所示的Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22中m/z593的提取离子流图(分别为图中的1和2)和一级质谱图(分别为图中的3和4)。可以看到,在原蛋白的酶切样品中,对应于m/z593肽段离子流的洗脱峰保留时间为8.25分钟,其一级质谱的分子量为593.2,与DLCSR的理论分子量一致,说明原蛋白中含有DLCSR的片段。在修饰样品中,无8.25分钟的洗脱峰,虽然对应m/z593肽段出现保留时间为29.7分钟的洗脱峰,但其一级质谱不能得出明确分子量(荷质比),表明该洗脱峰不是m/z593片段。据此对比,得出修饰反应发生在含DLCSR肽段上,根据马来酰亚胺修饰剂与半胱氨酸巯基发生特异性反应的特征,确定修饰反应发生在DLCSR肽段的C17上。试验例12:修饰后蛋白体外活性的测定TF-1CN5a1细胞是一个依赖于粒细胞-巨噬细胞集落刺激因子(GM-CSF)的细胞系,其细胞表面具有rhCNTF高亲和力受体,所 以CNTF能促进TF-1CN5a1细胞的增殖。将不同浓度的Y-40K-MAL-mPEG-CNTFnew/CC22加入TF-1CN5a1细胞培养物中,观察细胞的生长情况,以测定Y-40K-MAL-mPEG-CNTFnew/CC22体外活性,具体方法如下:将TF-1CN5a1细胞(购自美国ATCC,货号为CRL-2512TM)常规培养于GM-CSF条件(100mlRPMI1640中含有500ng的GM-CSF(购自PEPROTECH公司,货号300-03)的培养液中。实验时收集对数生长期的细胞,用无血清的RPMI1640(购自invitrogen公司)洗液洗涤3遍。然后用10%小牛血清RPMI1640培养液调整细胞数为1.0×106,96孔板的每孔加50μl细胞悬液。使用按实施例12方法得到的纯化的修饰型产物Y-40K-MAL-mPEG-CNTFnew/CC22,将其从10μg/ml按4倍系列稀释后,每孔加入50μl。以50μl无血清RPMI1640培养基作为阴性对照,以CNTF标准品(未进行突变和修饰,购自英国国家生物制品检定所NIBSC,货号:94/684)为阳性对照。CNTF标准品初始浓度为200ng/ml,进行4倍系列稀释后,每孔加入50μl。培养板在37℃、5%CO2条件下培养48h后,每孔加入50mg/ml的WST-8(购自碧云天生物技术研究所。货号:NIBSC94/684)溶液20μl,继续培养4h。混匀后在酶标仪上比色,测定波长为570nm,参比波长为630nm。每次实验结果均重复3次,最后结果取3次实验的平均结果。结果如下:用Y-40K-MAL-mPEG修饰的CNTFnew/CC22蛋白体外活性平均值为:3.57×106IU/mg。阳性对照CNTF的体外活性平均值为:0.8×106IU/mg。上述结果说明Y-40K-MAL-mPEG修饰后,经过定点突变的重组人睫状神经营养因子突变体的体外生物学活性一定程度的降低,修饰产物活性保留率为65.7%,但其体外活性均远高于阳性对照组(p<0.05)。试验例13:Y-40K-MAL-mPEG-CNTFnew/CC22和 CNTFnew/CC22的大鼠体内药代动力学测定实验使用Wistar大鼠(购自北京维通利华实验动物技术有限公司)体重200g,实施例12获得的Y-40K-MAL-mPEG-CNTFnew/CC22和实施例1获得的CNTFnew/CC22各自通过静脉注射和皮下注射两种方式给药,注射剂量均为200μg/kg。用双抗体夹心ELISA法测定大鼠血清中的血药浓度,用DAS药动学统计软件进行血药浓度-时间曲线拟合及药动学参数计算。结果见图18和表6。大鼠静脉注射200μg/kgCNTFnew/CC22或Y-40K-MAL-mPEG-CNTFnew/CC22的药动学特征均符合二室开放模型,CNTFnew/CC22的半衰期t1/2β为0.74±0.12小时,平均滞留时间MRT0-t(h)为0.44±0.02小时;而Y-40K-MAL-mPEG-CNTFnew/CC22的半衰期t1/2β为12.70±0.47小时,平均滞留时间MRT0-t(h)为16.63±0.57小时,这两项参数分别延长了17倍和38倍。大鼠皮下注射200μg/kgCNTFnew/CC22或Y-40K-MAL-mPEG-CNTFnew/CC22的药动学特征符合一室开放模型。与CNTFnew/CC22皮下注射的药代参数相比较,Y-40K-MAL-mPEG-CNTFnew/CC22的半衰期和平均滞留时间显著延长,分别增加了16倍和12倍左右。二者的半衰期分变为1.23±0.13h和19.59±0.31h,平均滞留时间分别为2.62±0.25h和30.21±0.17h。结果显示,CNTFnew/CC22进行Y-40K-MAL-mPEG修饰后,其半衰期显著延长。表6Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22的大鼠体内主要动力学参数试验例14:Y-40K-MAL-mPEG-CNTFnew/CC22在小鼠体内活性的测定实验用小鼠使用雄性昆明鼠(得自北京维通利华实验动物技术有限公司),体重18-22g。分为阳性对照组、阴性对照组和实验组,每组8只。阳性对照组为用生理盐水溶解的CNTF标准品(购自英国国家生物制品检定所,货号:NIBSC94/684);实验组样品为Y-40K-MAL-mPEG-CNTFnew/CC22纯品冻干粉剂(实施例12所得蛋白进一步冻干),以生理盐水溶解并稀释为0.5mg/ml。以每只小鼠100μg/kg/天的量进行皮下注射给药。阴性对照即生理盐水。注射前分别称量每组每只小鼠的体重。连续五天给药,称量小鼠的体重,观察小鼠的体重变化。另同时设置每周注射组,分为修饰样品组(实施例12所得蛋白冻干粉剂,浓度同上),未修饰样品组(实施例1所得蛋白冻干粉剂,浓度为0.5mg/ml),阳性对照组(同上)及阴性对照组,以每只小鼠200μg/kg/天的量进行皮下注射给药。阴性对照即生理盐水。注射前分别称量每组每只小鼠的体重。每周给药1次,称量小鼠的体重,观察小鼠的体重变化。(1)流程如下表7:表7.CNTF对小鼠减重作用测定流程(每天)注:实验时间以给药前一天为-1天,首次给药当天为0天。△:根据前一操作完成情况,可提前或推后,但尽量保持每天在 同一时间。表8.CNTF对小鼠减重作用测定流程(每周)注:实验时间以给药前一天为-1天,首次给药当天为0天。△:根据前一操作完成情况,可提前或推后,但尽量保持每天在同一时间。(2)测量指标:体重变化率体重变化率=(某组给药后体重-某组给药前体重)/给药前体重×100%;体重增长抑制率(%)=(对照组某日体重-对照组d0体重)-(受试组某日体重-该组d0体重)/(对照组某日体重-对照组d0体重)×100%小鼠体重变化结果见表9和表10:表9.小鼠体重变化表(连续5天给药)由表9可知:Y-40K-MAL-mPEG-CNTFnew/CC22, CNTFnew/CC22和CNTF标准品注射后的小鼠,体重均有所增长,但是Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22组的小鼠体重增长均小于阴性对照组(p<0.05),同时小于阳性对照(CNTF标准品)组(p<0.05)。表10.小鼠体重变化表(每周给药1次)由表10可知:对于每周1次给药组,三组注射后的小鼠,体重均有所增长,但是修饰样品组Y-40K-MAL-mPEG-CNTFnew/CC22的小鼠体重增长小于阴性对照组(p<0.05),同时小于阳性对照(CNTF标准品)组(p<0.05),研究证实PEG修饰药物与未修饰药物相比较具有长效作用。(3)小鼠体重增长抑制率见下表11:表11.小鼠体重增长抑制率(连续5天给药)由表11可知,Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22对小鼠的体重增长抑制率高于阳性对照(CNTF标准品)的体重增长抑制率(p<0.05)。表12.小鼠体重增长抑制率(每周给药1次)由表12可知Y-40K-MAL-mPEG-CNTFnew/CC22样品对小鼠的体重增长抑制率与对照组比较有显著差异(p<0.01),特别是Y-40K-MAL-mPEG-CNTFnew/CC22样品每周一次给药即可达到CNTFnew/CC22每天给药效果,而CNTFnew/CC22每周给药不能有效抑制小鼠体重的增长。试验例15:Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22对肥胖大鼠肝脏脂肪病变程度的改善大鼠(购自北京维通利华实验动物技术有限公司)通过高脂饲料喂养成肥胖大鼠,体重为290g。分别皮下注射Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22,Y-40K-MAL-mPEG-CNTFnew/CC22设立了25、50、100、200、400μg/kg五个剂量组,CNTFnew/CC22设立了25、50、100μg/kg三个剂量组,同时设立了正常大鼠组,赋形剂组,饮食结构调整肥胖组,西布曲明 处理组,200μg/kgY-40K-MAL-mPEG-CNTFnew/CC22食量配对组(食量控制组)这五组作为对照组。CNTFnew/CC22每天给药一次,Y-40K-MAL-mPEG-CNTFnew/CC22每周给药一次,共给药一个月。之后处死大鼠,取其肝脏做病理切片,显微镜下观察统计处理组和对照组肝脏细胞脂肪性病变的程度。肝脏脂肪病变程度分为四级,0级指肝细胞形态正常,肝细胞几乎无脂肪变性;I级指光镜下脂肪变性的肝细胞数<30%;II级指30%-60%的肝细胞脂肪变性;III级指有>60%的肝细胞脂肪变性。结果见图19。结果显示西布曲明和25、50、100、400μg/kgY-40K-MAL-mPEG-CNTFnew/CC22处理组均比赋形剂组有显著改善作用(*P<0.05),而50、100μg/kgCNTFnew/CC22和200μg/kgY-40K-MAL-mPEG-CNTFnew/CC22均较赋形剂组有极显著改善作用(**P<0.01)。有结果可知,Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22均能有效改善肥胖大鼠肝脏细胞脂肪病变。修饰后的CNTFnew/CC22能有效地延长药效,一周注射一次的效果相当于CNTFnew/CC22一天注射一次。试验例16:Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22对db/db模型鼠的短期降糖作用Db/db小鼠是常用的肥胖型II型糖尿病小鼠模型,其四号染色体的瘦素受体基因缺失,出生约一个月后逐渐出现肥胖、高血糖、高血脂、糖尿病等糖尿病症状。使用7-9周龄雌性db/db小鼠,以及7-9周龄雌性野生型C57BL/6J小鼠,SPF级,均购自上海斯莱克实验动物责任有限公司,所有动物均以标准饲料喂养。实验设立如下组别:db/db小鼠分为:赋形剂组(使用生理盐水溶解后,皮下给药,每4天给药一次;Y-40K-MAL-mPEG-CNTFnew/CC22100μg/kg组,每4天给药一次,只给药一次;Y-40K-MAL-mPEG-CNTFnew/CC22200μg/kg组,每4天给药一次,只给药一次;CNTFnew/CC22100μg/kg组,每天给药一次,共给药四天。所有药物均是皮下注射。在给药完成后的第0.5、2、 4、6、8、10、24、36、48、60、72、84、96小时,用采血针刺小鼠尾出血,用试纸片法用罗氏血糖仪(购自罗氏公司,ACCU-CHEKMobil)测血糖浓度。计算血糖变化率并作图,结果如图20所示。血糖变化率计算公式为:血糖变化率=(给药后血糖-给药前血糖)/给药前血糖×100%。结果显示,四天给药一次的Y-40K-MAL-mPEG-CNTFnew/CC22200μg/kg单针次降糖效果与CNTFnew/CC22100μg/kg每天给药一次的降糖效果的稳定性相当,但降糖效果更显著,显示出了长效的降糖作用。试验例17:Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22单体对db/db模型鼠口服葡萄糖耐量(OGTT)的改善使用7-9周龄雌性db/db小鼠,以及7-9周龄雌性野生型C57BL/6J小鼠,SPF级,均购自上海斯莱克实验动物责任有限公司,所有动物均以标准饲料喂养。实验设立如下组别:Db/db小鼠分为:赋形剂组,每4天给药一次;0.2mg/kg利拉鲁肽组,每天给药两次;0.4mg/kg利拉鲁肽组,每天给药1次,观察4天;0.1mg/kgCNTFnew/CC22组,每天给药1次;50μg/kgY-40K-MAL-mPEG-CNTFnew/CC22组,每4天给药一次;100μg/kgY-40K-MAL-mPEG-CNTFnew/CC22组,每4天给药一次;200μg/kgY-40K-MAL-mPEG-CNTFnew/CC22组,每4天给药一次;另外设置野生型C57BL/6J对照组。其中利拉鲁肽(购自诺华诺德公司)组是阳性对照组。共八组,均是皮下注射给药,共给药16天。在给药结束后的第0、0.5、1.0、1.5、2.0小时,小鼠尾用采血针针刺出血,用试纸片法用罗氏血糖仪(购自罗氏公司,ACCU-CHEKMobil)测血糖浓度,计算平均血糖,并作图,结果如图21所示。结果显示,相比赋形剂对照组,每四天给药一次的不同Y-40K-MAL-mPEG-CNTFnew/CC22剂量组均有改善OGTT的作用,与CNTFnew/CC22100μg/kg组相比,效果也较好,其显示出了长效 的降糖效果。其中,200μg/kg的Y-40K-MAL-mPEG-CNTFnew/CC22对小鼠OGTT的改善作用明显优于已上市产品利拉鲁肽。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1