一种新型双极性发光主体材料及其合成方法与应用与流程
本发明属于有机发光材料领域,具体涉及一种新型双极性发光主体材料及其合成方法与应用。
背景技术:
有机电致发光(EL)是由电能激发有机材料而发光的现象。1987年柯达公司的邓青云博士首先利用有机电致发光原理制造出有机发光二极管(OLED),有机电致发光EL显示器与传统显示器相比具有驱动电压低、发光亮度强、效率高、响应速度快、广视角、以及制作可挠曲显示面板等优点而倍受瞩目,是继液晶显示器和等离子显示器的下一代显示器。目前,有机电致发光材料的寿命和使用效率不能达到实际应用的要求,制约其发展。发光材料标杆CBP也存在电流效率低的缺陷。
中国专利201510109803.5公开了一种用菲啰啉与二苯胺进行反应得到的有机半导体发光材料,该材料的最大发光波长在蓝光范围,具有防止结晶的作用,但其电流效率有限。
1,10-菲啰啉结构,是典型的缺电子基团,具有良好的电子输运能力,而三亚苯结构是中等的富电子基团,具有空穴阻挡的能力,并且由于1,10-菲啰啉和三亚苯基团是刚性平面结构,基团运动困难,可以有效地提高化合物的玻璃态转变温度(Tg),有助于材料热稳定性的提高,在有机电致发光(EL)器件中有着广泛应用。但是,仍存在电流效率低,电压较高等问题,此类材料的效率并不高。在现有的有机电致发光器件中,单一的包含1,10-菲啰啉结构或三亚苯结构的化合物其电子输运速率和空穴输运速率是不平衡的,导致发光器件中载流子整体传输速率低下。
技术实现要素:
本发明的目的是提供一种新型双极性发光主体材料,具有较高的电流效率,同时提供该发光主体材料的合成方法和其在发光器件中的应用。
本发明是通过以下技术方案实现的。
一种新型双极性发光主体材料,其结构式如下所示:
,
其中,Q1为H原子、卤素原子、碳原子数为1-12的烷基、芳基、共轭杂环、烷氧基团或氰基团中的任意一种;Q2为H原子、卤素原子、碳原子数为1-12的烷基、芳基、共轭杂环、烷氧基团或氰基团中的任意一种。
优选地,Q1为H原子、F原子、甲基、苯基、共轭杂环、甲氧基或氰基中的任意一种;Q2为H原子、F原子、甲基、苯基、共轭杂环、甲氧基或氰基中的任意一种。
优选地,所述共轭杂环为、。
更优选地,Q1为H原子、F原子、甲基、苯基、甲氧基或氰基中的任意一种;Q2为H原子、甲基、苯基、、中的任意一种。
更优选地,Q1为H原子、F原子、甲氧基中的任意一种;Q2为H原子、甲基、、中的任意一种。
所述新型双极性发光主体材料结构式为下述结构式中任意一种:
、、
化合物V1 化合物V2
、、
化合物V3 化合物V4
、、
化合物V5 化合物V6
、、
化合物V7 化合物V8
、、
化合物V9 化合物V10
、
化合物V11 化合物V12
、、
化合物V13 化合物V14
、、
化合物V15 化合物V16
、、
化合物V17 化合物V18
、、
化合物V19 化合物V20
、、
化合物V21 化合物V22
、、
化合物V23 化合物V24
、、
化合物V25 化合物V26
、、
化合物V27 化合物V28
、
化合物V29 化合物V30。
一种上述新型双极性发光主体材料的合成方法,包括以下步骤:
(1)将溴代Q1取代基的三亚苯溶解在四氢呋喃中,在-78℃~-85℃的环境下,添加正丁基锂,保温0.5~1.5 h,然后添加硼酸三丁酯保温反应8~14 h,制备成得中间体I;
(2)将中间体I与2,5-二溴苯甲二腈溶解在甲苯、乙醇和水的混合溶液中,其中,甲苯、乙醇、水的体积比为1:1:1,再添加无水碳酸钾、四三苯基膦钯、四丁基溴化铵,在65℃~80℃之间进行Suzuki反应,回流反应6~12 h,得中间体II;
(3)将中间体II溶解在四氢呋喃中,在-78℃~-85℃的环境下,添加正丁基锂,保温0.5~1.5 h,再添加硼酸三丁酯保温反应8~14 h,制备得中间体III;
(4)将中间体III与Q2取代基的1,10-菲啰啉中间体溶解在甲苯、乙醇和水的混合液中,其中,甲苯、乙醇、水的体积比为1:1:1,再加入无水碳酸钾、四三苯基膦钯、四丁基溴化铵,在65℃~80℃的温度下进行Suzuki反应,回流6~12 h,制备得到所述的新型双极性发光主体材料,其结构式如下:
,
其中, Q1为H原子、卤素原子、碳原子数为1-12的烷基、芳基、共轭杂环、烷氧基团或氰基团中的任意一种;Q2为H原子、卤素原子、碳原子数为1-12的烷基、芳基、共轭杂环、烷氧基团或氰基团中的任意一种。
Suzuki反应为Suzuki偶联反应,零价钯配合物作为催化剂,芳基或烯基硼酸或硼酸酯与氯、溴、碘代芳烃或烯烃发生交叉偶联。
优选地,步骤(1)中,四氢呋喃的体积为溴代Q1取代基的三亚苯质量的8-15倍,溴代Q1取代基的三亚苯、正丁基锂、硼酸三丁酯的摩尔比为1:1.2:1.4。
步骤(2)中,甲苯、乙醇和水的混合液的体积为中间体I质量的6-10倍,中间体I、2,5-二溴苯甲二腈、无水碳酸钾、四三苯基膦钯、四丁基溴化铵的摩尔比为1:(1-1.1):2:0.005:0.5。
步骤(3)中,四氢呋喃的体积为中间体II质量的6~15倍,中间体II、正丁基锂、硼酸三丁酯的摩尔比为1:1.2:1.4。
步骤(4)中,甲苯、乙醇和水的混合液的体积为中间体III质量的5-10倍,中间体III、Q2取代基的1,10-菲啰啉中间体、无水碳酸钾、四三苯基膦钯、四丁基溴化铵的摩尔比为1:(1-1.1):2:0.005:0.5。
一种有机电致发光器件,包括阳极、发光层和阴极,所述发光层为新型双极性发光主体材料和发光层染料的混合物,其特征在于:所述新型双极性发光主体材料如上所述,具有如下结构式:
,
其中, Q1为H原子、卤素原子、碳原子数为1-12的烷基、芳基、共轭杂环、烷氧基团或氰基团中的任意一种;Q2为H原子、卤素原子、碳原子数为1-12的烷基、芳基、共轭杂环、烷氧基团或氰基团中的任意一种。
优选地,所述阳极和发光层之间设置第一有机功能层,所述发光层与所述阴极之间设置第二有机功能层;所述第一有机功能层为空穴注入层和空穴传输层,所述第二有机功能层为电子传输层和电子注入层。
优选地,所述发光层燃料为红色染料、绿色染料或蓝色染料中任意一种。
更优选地,所述红色染料为DCJ,所述绿色染料为Ir(ppy)3,所述蓝色染料为FIrpic。
该有机电致发光器件的阳极可采用无机材料或有机导电聚合物,无机材料为氧化铟锡(ITO)、氧化锌(ZnO)、氧化铟锌、金、铜或银中的任意一种,优选氧化铟锡(ITO)。
该有机电致发光器件的有机导电聚合物为聚乙烯基苯磺酸钠/聚噻吩(简称PSS/PEDOT)、聚苯胺(简称PANI)中的一种。
该有机电致发光器件的阴极为功函数较低的金属、功函数较低的金属与铜、金、银的合金、功函数较低的金属与功函数较低的金属氟化物交替形成的电极层中的任意一种,其中,功函数较低的金属为锂、镁、钙、锶、铝、铟中的任意一种。
优选地,该有机电致发光器件的阴极为LiF层和铝层,其中, LiF层在外侧。
空穴传输层材料为芳胺类或支聚类低分子材料,优选为NPB。
电子传输层的材料为有机金属配合物,如Alq3、Gaq3、BAlq或Ga(Saph-q),或者现有技术中的电子传输层的材料,如芳香稠环类或邻菲罗啉类化合物,优选Liq。
本发明的优点:
本发明提供的新型双极性发光主体材料兼具1,10-菲啰啉结构和三亚苯结构的特性,可以平衡电子输运速率与空穴输运,应用到发光器件中能提高空穴输运速率,进而提高发光器件的发光效率。同时,本发明提供的新型双极性发光主体材料的合成方法操作简单。
附图说明
图1为实施例1的中间体I的H1NMR谱图;
图2为实施例1的中间体II的H1NMR谱图;
图3为实施例1的中间体III的H1NMR谱图;
图4为实施例1的化合物V5的H1NMR谱图。
具体实施方式
下面结合具体实施例对本发明做进一步说明。
实施例1
1. 一种新型双极性发光主体材料,结构式如下:
,
其中,Q1为甲氧基-O-CH3,Q2为H,结构式如下:
,
称该新型双极性发光主体材料为化合物V5,
其合成方法包括如下步骤:
(1)制备中间体I:控制2-溴-7-甲氧基三亚苯、正丁基锂、硼酸三丁酯的摩尔比为1:1.2:1.4,称取33.7 g 2-溴-7-甲氧基三亚苯,溶解在320 ml 四氢呋喃,加入1 L三口烧瓶中反应,在机械搅拌下缓慢降温至-78℃~-85℃,控制温度缓慢滴加60 ml(2 mol/L)正丁基锂(n-BuLi),保温1 h后滴加硼酸三丁酯32.2 g,保温12h,停止反应,处理得190.3 g中间体I(4-溴-9-乙基咔唑), 收率62%,纯度98%,其化学反应式如下:
,
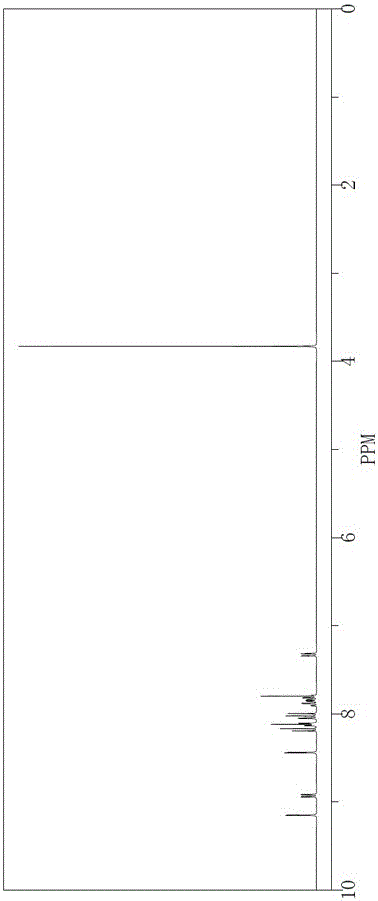
对中间体I(4-溴-9-乙基咔唑)通过核磁共振(Varian Mercury 400 兆核磁共振谱仪(13C:75.49 MHz))检测其在氘代氯仿中的H1NMR谱图,结果如图1所示,分析如下:
H1NMR(400M,CDCl3) δ(ppm):8.90 (d,1H), δ(ppm):8.44 (d,1H),
δ(ppm):8.12-8.10(d,2H), δ(ppm):8.01(d,1H), δ(ppm):7.88-7.82(m, 3H), δ(ppm): 7.33 (d, 1H), δ(ppm):3.83(m, 3H), δ(ppm): 2.00(s, 2H);
(2)制备中间体II:控制中间体I(4-溴-9-乙基咔唑)、2,5-二溴苯甲二腈、无水碳酸钾、四三苯基膦钯、四丁基溴化铵的摩尔比为1:(1-1.1):2:0.005:0.5,依次称取30.02 g中间体I,2,5-二溴对苯二甲腈28.6 g、溶解于240ml的甲苯、乙醇和水的体积比为1:1:1的混合液中,在1 L三口烧瓶中反应,在依次加入四三苯基膦钯 0.02 g、无水碳酸钾27.0 g、四丁基溴化铵13.5 g,在机械搅拌下缓慢升温至68℃,反应时间8小时,得中间体II 23.6 g,收率54%,纯度98%,其化学反应式如下:
,
对该步骤反应得到的产物通过核磁共振(Varian Mercury 400 兆核磁共振谱仪(13C:75.49 MHz))检测其在氘代氯仿中的H1NMR谱图,结果如图2所示,分析如下:
H1NMR (400M,CDCl3): δ(ppm):9.18 (d,1H), δ(ppm):8.93 (d,2H),
δ(ppm): 8.83(d,1H), δ(ppm):8.12-8.09 (m, 4H), δ(ppm):7.93-7.82(m,5H);
(3)制备中间体III:控制中间体II、正丁基锂、硼酸三丁酯的摩尔比为1:1.2:1.4,称取46.3 g 中间体II,溶解于320 ml 四氢呋喃中,的1 L的三口烧瓶中进行反应,在机械搅拌下缓慢降温至-78℃~-85℃,控制温度缓慢滴加60 ml(2 mol/L)正丁基锂,保温1 h后滴加硼酸三丁酯32.2 g,保温12 h,停止反应,处理得26.7 g中间体III, 收率67%,纯度98%,其化学反应式如下:
,
对该步骤反应得到的产物通过核磁共振(Varian Mercury 400 兆核磁共振谱仪(13C:75.49 MHz))检测其在氘代氯仿中的H1NMR谱图,结果如图3所示,分析如下:
H1NMR (400M,CDCl3): δ(ppm):9.18 (d,1H), δ(ppm):8.93 (d,2H),
δ(ppm): 8.83(d,1H), δ(ppm):8.12-8.09 (m, 4H), δ(ppm):7.93-7.82(m,5H), δ(ppm): 4.0-2.0(d, 2H);
(4)制备化合物V5:控制中间体III、Q2取代基的1,10-菲啰啉中间体、无水碳酸钾、四三苯基膦钯、四丁基溴化铵的摩尔比为1:(1-1.1):2:0.005:0.5,称取42.7 g 中间体III,25.8g 2-溴-1,10-菲啰啉,溶解于240 ml的甲苯、乙醇和水的体积比为1:1:1的混合液中,再加入四三苯基膦钯 0.02 g、无水碳酸钾27.0 g、四丁基溴化铵13.5 g,在机械搅拌下缓慢升温至68℃,进行Suzuki反应,反应10小时,终止反应,处理得化合物V5 40.5 g,收率72%,纯度99.5%,其化学反应式如下:
,
对反应得到的产物通过核磁共振(Varian Mercury 400 兆核磁共振谱仪(13C:75.49 MHz))检测其在氘代氯仿中的H1NMR谱图,结果如图4所示,分析如下:
H1NMR (400M,CDCl3): δ(ppm):9.18-9.15(d,2H),δ(ppm):8.93 (d,1H),
δ(ppm): 8.83(d,1H), δ(ppm):8.48(s,1H), δ(ppm):8.25-8.06(m,8H), δ(ppm): 7.88-7.81(m, 3H), δ(ppm):7(m, 1H), δ(ppm): 7.53-7.35(d, 2H);
由图1-4的H1NMR谱图及分析结果可以确认各步骤得到的中间体及最终产物均正确,最终合成的产物是2-(7-甲氧基三亚苯-2-基)-5-(1,10-菲啰啉-2-基)对苯二腈,兼具有三亚苯和1,10-菲啰啉的结构特性。
实施例2
合成方法同实施例1,仅替换Q1和Q2基团,合成新型双极性发光主体材料,具体如下。
仅替换Q1和Q2基团,Q1为H, Q2为H,合成方法同实施例1,其中,步骤(1)中,四氢呋喃的体积为溴代Q1取代基的三亚苯质量的8倍;步骤(2)中,甲苯、乙醇和水的混合液的体积为中间体I质量的6倍;步骤(3)中,四氢呋喃的体积为中间体II质量的6倍;步骤(4)中,甲苯、乙醇和水的混合液的体积为中间体III质量的5倍,其他同实施例1相同,制备得到新型双极性发光主体材料,称为化合物V1,结构式为:
。
仅替换Q1和Q2基团,Q1为F, Q2为H,合成方法同实施例1,其中,步骤(1)中,四氢呋喃的体积为溴代Q1取代基的三亚苯质量的15倍;步骤(2)中,甲苯、乙醇和水的混合液的体积为中间体I质量的10倍;步骤(3)中,四氢呋喃的体积为中间体II质量的15倍;步骤(4)中,甲苯、乙醇和水的混合液的体积为中间体III质量的10倍,其他同实施例1相同,制备得到新型双极性发光主体材料,称为化合物V2,结构式为:
。
仅替换Q1和Q2基团,Q1为甲基-CH3, Q2为H,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V3,结构式为:
。
仅替换Q1和Q2基团,Q1为苯基, Q2为H,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V4,结构式为:
。
仅替换Q1和Q2基团,Q1为氰基:-CN,Q2为H,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V6,结构式为:
。
仅替换Q1和Q2基团,Q1为氢原子H,Q2为甲基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V7,结构式为:
。
仅替换Q1和Q2基团,Q1为氟原子,Q2为甲基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V8,结构式为:
。
仅替换Q1和Q2基团,Q1为甲基,Q2为甲基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V9,结构式为:
。
仅替换Q1和Q2基团,Q1为苯基,Q2为甲基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V10,结构式为:
。
仅替换Q1和Q2基团,Q1为甲氧基,Q2为甲基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V11,结构式为:
。
仅替换Q1和Q2基团,Q1为氰基,Q2为甲基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V12,结构式为:
。
仅替换Q1和Q2基团,Q1为氢原子H,Q2为苯基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V13,结构式为:
。
仅替换Q1和Q2基团,Q1为氟原子F,Q2为苯基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V14,结构式为:
。
仅替换Q1和Q2基团,Q1为甲基:- CH3,Q2为苯基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V15,结构式为:
。
仅替换Q1和Q2基团,Q1、Q2均为苯基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V16,结构式为:
。
仅替换Q1和Q2基团,Q1为甲氧基:-O-CH3,Q2为苯基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V17,结构式为:
。
仅替换Q1和Q2基团,Q1为氰基:-CN,Q2为苯基,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V18,结构式为:
。
仅替换Q1和Q2基团,Q1为氢原子:H,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V19,结构式为:
。
仅替换Q1和Q2基团,Q1为氟原子:F,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V20,结构式为:
。
仅替换Q1和Q2基团,Q1为甲基:-CH3,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V21,结构式为:
。
仅替换Q1和Q2基团,Q1为苯基,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V22,结构式为:
。
仅替换Q1和Q2基团,Q1为甲氧基:-O-CH3,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V23,结构式为:
。
仅替换Q1和Q2基团,Q1为氰基:-CN,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V24,结构式为:
。
仅替换Q1和Q2基团,Q1为氢原子:H,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V25,结构式为:
。
仅替换Q1和Q2基团,Q1为氟原子:F,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V26,结构式为:
。
仅替换Q1和Q2基团,Q1为甲基:-CH3,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V27,结构式为:
。
仅替换Q1和Q2基团,Q1为苯基,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V28,结构式为:
。
仅替换Q1和Q2基团,Q1为甲氧基:-O-CH3,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V29,结构式为:
。
仅替换Q1和Q2基团,Q1为氰基:- CN,Q2为共轭杂环:,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V30,结构式为:
。
实施例3
合成方法同实施例1,仅替换Q1和Q2基团,四氢呋喃的体积有所调整,制备新型双极性发光主体材料,具体如下。
仅替换Q1和Q2基团,Q1为共轭杂环, Q2为共轭杂环,合成方法同实施例1,其中,步骤(1)中,四氢呋喃的体积为溴代Q1取代基的三亚苯质量的12倍;步骤(2)中,甲苯、乙醇和水的混合液的体积为中间体I质量的8倍;步骤(3)中,四氢呋喃的体积为中间体II质量的9倍;步骤(4)中,甲苯、乙醇和水的混合液的体积为中间体III质量的7倍,其他同实施例1相同,制备得到新型双极性发光主体材料,称为化合物V31,结构式为:
。
仅替换Q1和Q2基团,Q1为共轭杂环, Q2为氟原子:F,合成方法同实施例1,其中,步骤(1)中,四氢呋喃的体积为溴代Q1取代基的三亚苯质量的10倍;步骤(2)中,甲苯、乙醇和水的混合液的体积为中间体I质量的7.5倍;步骤(3)中,四氢呋喃的体积为中间体II质量的12倍;步骤(4)中,甲苯、乙醇和水的混合液的体积为中间体III质量的8倍,其他同实施例1相同,制备得到新型双极性发光主体材料,称为化合物V32,结构式为:
。
仅替换Q1和Q2基团,Q1为共轭杂环, Q2为氰基:-CN,合成方法同实施例1,其中,步骤(1)中,四氢呋喃的体积为溴代Q1取代基的三亚苯质量的13倍;步骤(2)中,甲苯、乙醇和水的混合液的体积为中间体I质量的10倍;步骤(3)中,四氢呋喃的体积为中间体II质量的15倍;步骤(4)中,甲苯、乙醇和水的混合液的体积为中间体III质量的5倍,其他同实施例1相同,制备得到新型双极性发光主体材料,称为化合物V33,结构式为:
。
仅替换Q1和Q2基团,Q1为共轭杂环,Q2为乙氧基:-O-CH2-CH3,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V34,结构式为:
。
仅替换Q1和Q2基团,Q1为卤素原子:Br, Q2为卤素原子:Cl,合成方法同实施例1,其中,步骤(1)中,四氢呋喃的体积为溴代Q1取代基的三亚苯质量的13倍;步骤(2)中,甲苯、乙醇和水的混合液的体积为中间体I质量的10倍;步骤(3)中,四氢呋喃的体积为中间体II质量的15倍;步骤(4)中,甲苯、乙醇和水的混合液的体积为中间体III质量的5倍,其他同实施例1相同,制备得到新型双极性发光主体材料,称为化合物V35,结构式为:
。
仅替换Q1和Q2基团,Q1为碳原子数为5的烷基:-C5H11,Q2为卤素原子:I,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V36,结构式为:
。
仅替换Q1和Q2基团,Q1为碳原子数为12的烷基:-C12H25,Q2为甲氧基:-O-CH3,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V37,结构式为:
。
仅替换Q1和Q2基团,Q1为碳原子数为8的烷基:-C8H17,Q2为乙氧基:-O-CH2-CH3,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V38,结构式为:
。
仅替换Q1和Q2基团,Q1为卤素原子:Br,Q2为氰基:-CN,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V39,结构式为:
。
仅替换Q1和Q2基团,Q1为乙氧基:-O-CH2-CH3,Q2为卤素原子:Cl,合成方法同实施例1,制备得到新型双极性发光主体材料,称为化合物V40,结构式为:
。
实施例4
一种有机电致发光器件,简称器件5,该器件结构为:ITO/NPB(35 nm)/TCTA(10 nm)/V5:3wt% DCJ(30 nm)/Bphen(40 nm)/LiF(8 nm)/Al,包括阳极、发光层和阴极,所述发光层为新型双极性发光主体材料和发光层染料的混合物,所述发光主体材料为实施例1制备的化合物5,结构式如下:
,
在阳极和发光层之间设置第一有机功能层,所述发光层与所述阴极之间设置第二有机功能层,所述发光层与所述阴极之间设置有第二有机功能层;第一有机功能层为空穴注入层和空穴传输层,所述第二有机功能层为电子传输层和电子注入层。所述发光层染料为红色染料DCJ。
该有机电致发光器件的阳极为氧化铟锡(ITO)。
该有机电致发光器件的有机导电聚合物为聚乙烯基苯磺酸钠/聚噻吩(简称PSS/PEDOT)。
该有机电致发光器件的阴极为LiF层和铝层,其中, LiF层在外侧。
空穴传输层材料为NPB。
电子传输层的材料为Liq。
实施例5
制备有机电致发光器件,制备方法及其结构同实施例4,区别仅在于发光层的发光主体材料不同,具体如下:
发光主体材料为实施例2中的化合物V1、V2、V3、V4、V6、V7、V8、V9、V10、V11、V12、V13、V14、V15、V16、V17、V18、V19、V20、V21、V22、V23、V24、V25、V26、V27、V28、V29、V30制备的有机电致发光器件,分别对应称为器件1、器件2、器件3、器件4、器件6、器件7、器件8、器件9、器件10、器件11、器件12、器件13、器件14、器件15、器件16、器件17、器件18、器件19、器件20、器件21、器件22、器件23、器件24、器件25、器件26、器件27、器件28、器件29、器件30,以及实施例3中的化合物V31、V32、V33、V34、V35、V36、V37、V38、V39、V40制备的有机电致发光器件,分别对应称为器件31、器件32、器件33、器件34、器件35、器件36、器件37、器件38、器件39、器件40。
对比例
对比例中的有机电致发光器件结构与对实施例3的器件5相同,区别仅在于发光层的发光主体材料为CBP,CBP为正咔唑衍生物,是发光材料标杆。
将实施例4和实施例5中的有机电致发光器件与对比例的有机电致发光器件的性能进行测试,结果见表1。
表1 有机电致发光器件的性能测试结果
接下表:
续表1,
从表1可知,以本发明提供的化合物为发光主体材料制备得到的有机致电发光器件的电流效率和流明效率均提高,尤其是以化合物1-30作为发光主体材料制备的有机电致发光器件1-30的电流效率比对比例以CBP制作的有机电致发光器件的电流效率提高约4~6倍,且驱动电压比对比例低,流明效率提高约7~11倍,在色坐标位置上更符合实际应用于有机电致发光器件,能更加的显示色域。在500 cd/m2亮度下,本发明提供的器件1-30性能稳定,且电流效率高于传统CBP制作的器件。
本发明提供的新型双极性发光主体材料兼具1,10-菲啰啉结构和三亚苯结构的特性,通过引入再平衡基团,可以平衡电子输运速率与空穴输运速率。
- 还没有人留言评论。精彩留言会获得点赞!