多糖悬浮液,其制备方法,和其用途与流程
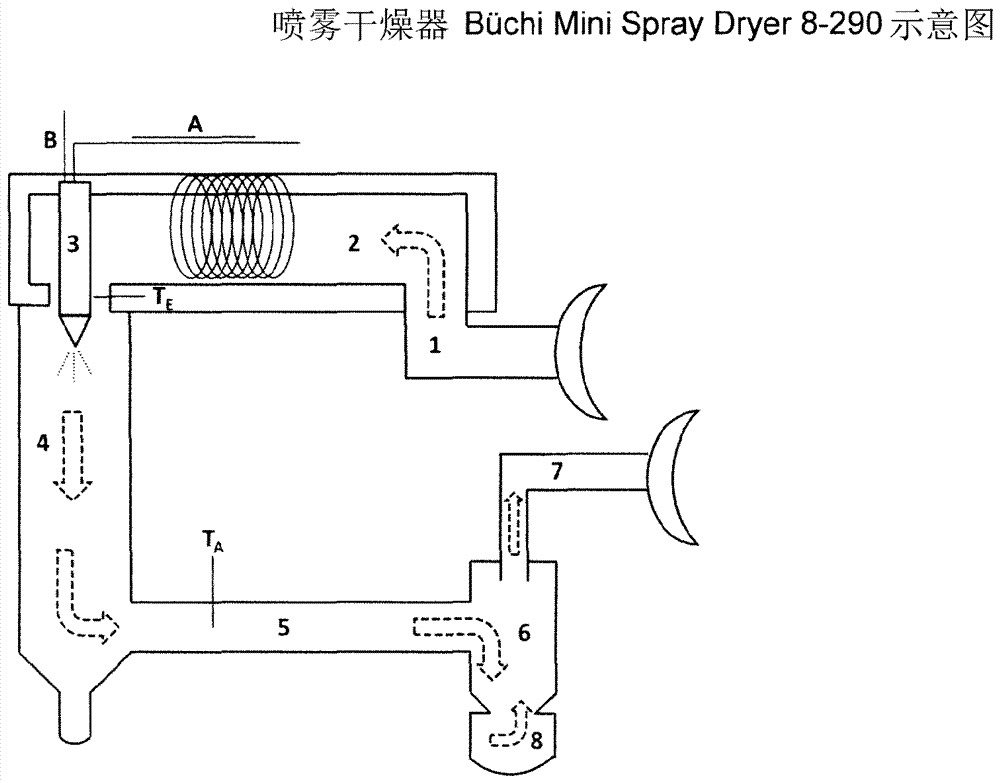
本发明涉及一种含有α(1→3)-葡聚糖的新型稳定的胶态多糖悬浮液,其有成本效益的制备方法,和这些多糖悬浮液的可能用途。此类悬浮液往往也被称为“凝胶”,并且在本发明中两个术语应理解为意义相同的。现有技术已知诸如黄原胶、褐藻胶、瓜尔树胶、淀粉等的天然多糖以及诸如羧甲基纤维素、羟甲基丙基纤维素的纤维素衍生物在水中溶解为胶体,并且在某些条件下具有凝胶化能力。由于它们的水溶性,上述物质不形成稳定的胶态悬浮液。纤维素是在全世界最常见的多糖。已知从具有纤维素i结构的纳米原纤化纤维素或纤维状纤维素凝胶来制备悬浮液。相应的专利和现有技术公开在wo2013/006876a1中提及。根据氧化胺方法来制备具有纤维素ii结构的纤维素凝胶描述于wo2013/006876a1中。同时发现,还可通过使用高压均化器来根据氧化胺方法从具有较高纤维素含量(例如13重量%的纤维素)的纺丝料制备具有0.1重量%与4.0重量%之间的纤维素浓度和500%至5000%的保水能力的相稳定的纤维素悬浮液。相比于微原纤化纤维素或其他类型的纳米纤维素,根据氧化胺方法(所用溶剂是氧化叔胺,优选n-甲基吗啉氧化物)制备的纤维素凝胶具有显著的产物优点:它们不再具有纯纤维状结构,而主要是各向同性的。颗粒高度溶胀并且形成3维网络。这些凝胶可通过以下来获得:从纺丝料中沉淀各种成形体,经过酶促处理削弱这些成形体,粗粉碎,以及在高压均化器中后续研磨。us7,000,000描述了通过纺制基本上由经由α(1→3)-糖苷键连接的己糖重复单元组成的多糖的溶液来获得的纤维。这些多糖可通过使蔗糖的水溶液与分离自唾液链球菌(streptococcussalivarius)的gtfj葡糖基转移酶接触来制备(simpson等人,microbiology,第41卷,第1451-1460页(1995))。在这种情况下,“基本上”意指在多糖链内可出现个别缺陷,在该处出现其他键构型。出于本发明的目的,这些多糖应被称为“α(1→3)-葡聚糖”。制备此类葡聚糖的公开可见于us6,284,479a1:其中描述的多糖混合物应含有呈未进一步详细阐明的比例的α(1→3)-、α(1→6)-、(1→2)-和(1→4)-连接的葡聚糖。这些产物应完全或部分地替代淀粉或乳胶在涂料中使用。us6,284,479a1在这点上并未提供进一步的细节。us7,000,000首先公开了从单糖酶促制备α(1→3)-葡聚糖的可行方法。以这种方式,相对较短链的多糖可在不损失单体结构单元的情况下制备,因为聚合物链是由单体结构单元构造的。不同于短链纤维素分子的制备,聚合物链越短,α(1→3)-葡聚糖的制备越成本有利,因为在这种情况下仅需要短的反应器中停留时间。从单糖酶促制备α(1→3)-葡聚糖的另一可行方法公开于wo2013/036968a1和wo2013/036918a2中。根据这种方法,可制备特别纯的α(1→3)-葡聚糖,而基本上不形成其他多糖。葡聚糖凝胶在文献中已知,但所发现的那些都不含有α(1→3)-葡聚糖。文献中发现的那些或是通过葡聚糖磷酸化酶制备(jp2006211989)并且通过溶解于碱性介质中和再沉淀加工成凝胶(us2003185863,wo2012073019a1)的α(1→4)-葡聚糖。或是可溶于水并且通过添加淀粉和增塑剂加工成凝胶(us2003185863)的β(1→3)-葡聚糖。不进行先前溶解和沉淀或其他化学预处理来直接制备此类凝胶是未知的。目的相比于现有技术,目的在于提供一种相稳定的胶态多糖悬浮液,其制备不需要多糖的化学或酶促预处理并且具有高能量效率。多糖原料应可便宜制备,并且制备悬浮液的方法应相比于现有方法简化。发明详述意料之外地,此目的可通过使用生物技术制备的和从未干燥的α(1→3)-葡聚糖来实现。从us7,000,000中和特别是wo2013/036968a1和wo2013/036918a2中所描述的多糖,只要它从未干燥,可通过仅机械处理来制备不具有原纤化结构并且形成3维网络的多糖悬浮液。α(1→3)-葡聚糖可通过使蔗糖的水溶液与分离自唾液链球菌的gtfj葡糖基转移酶接触来制备(simpson等人,microbiology,第41卷,第1451-1460页(1995))。因此,上述目的的解决方案在于提供一种相稳定的胶态多糖悬浮液,其特征在于:多糖至少部分由α(1→3)-葡聚糖组成,α(1→3)-葡聚糖在其制备期间从未干燥,悬浮液制备自具有4重量%与80重量%之间、优选15重量%与45重量%之间的多糖含量的压滤饼,以及悬浮液的多糖浓度在0.01重量%与50重量%之间、优选1.0重量%与20重量%之间。多糖的α(1→3)-葡聚糖含量可在1重量%与100重量%之间,更优选80重量%与100重量%之间。剩余多糖可尤其为纤维素凝胶,更优选根据氧化胺方法制备并且具有纤维素ii结构的此类多糖。例如,此类凝胶可根据wo2013/006876a1来制备。它们还可根据如已在上文中进一步描述的氧化胺方法,通过使用高压均化器从具有较高纤维素含量(例如,13重量%的纤维素)的纺丝料来制备,具有0.1重量%与4.0重量%之间的纤维素浓度。此外,剩余多糖可为本领域技术人员已知的凝胶化的多糖,诸如纤维素衍生物、例如羧甲基纤维素,或淀粉。此类混合物可例如有利地在造纸工业中使用。剩余多糖还可为其他葡聚糖,特别是α(1→6)-、(1→2)-和(1→4)-连接的葡聚糖。特别地,根据本发明的多糖悬浮液也是有利的,因为它不经过化学或酶促预处理,不利用高压和在粉碎期间不利用高剪切速率,以及不经过溶解或沉淀步骤来制备。在优选实施方案中,在从压滤饼制备多糖悬浮液期间使用相比于例如高压均化器而言产生低剪切速率的分散装置,例如ultraturrax®混合器或胶体磨。在该悬浮液制备期间,可优选将上述剩余多糖添加至α(1→3)-葡聚糖。根据本发明,除多糖材料之外,多糖悬浮液还可含有基于多糖量计1重量%至200重量%的掺合添加剂,所述添加剂选自颜料、氧化钛、尤其是亚化学计量的二氧化钛、硫酸钡、离子交换剂、聚乙烯、聚丙烯、聚酯、乳胶、活性碳、聚合物超级吸收剂和阻燃剂。在本发明方法的一个优选实施方案中,至少90%的α(1→3)-葡聚糖由己糖单元组成并且至少50%的己糖单元经由α(1→3)-糖苷键连接。它以其从未干燥的形式来使用。根据本发明的悬浮液基于含水、特别是初始湿润的、在其制备之后从未干燥的α(1→3)-葡聚糖。在水中,α(1→3)-葡聚糖并未溶解为胶体。如在文献中已知的葡聚糖凝胶所描述的溶解或后续沉淀步骤不是必需的。通常,对于纤维素凝胶的制备而言,使用削弱表面结构的预处理(酶处理、化学处理)和借助高压均化器的后续处理。对于本发明的多糖悬浮液的制备而言,上述制备步骤不是必需的;借助分散装置(例如,ultraturrax®或胶体磨)的研磨是足够的。相比于纤维素凝胶,这使总的耗费能量减少了许多倍。通过在制备本发明的悬浮液期间避免溶解步骤,阻止了将残余量的溶剂引入最终悬浮液,使得它特别适合于应用在敏感领域(食品、医药和化妆品)中。用作悬浮液的起始材料的多糖优选根据us7,000,000,并且尤其根据wo2013/036968a1和wo2013/036918a2来制备。根据本发明,它以其初始湿润状态来使用,即,它在制备悬浮液之前从未干燥。它至少部分由α(1→3)-葡聚糖组成。在其制备的最后的方法步骤中,将它压出至4重量%与80重量%之间(基于总压滤饼计)、优选15重量%至45重量%的固体含量。通过添加水,将所需多糖浓度设定在0.01重量%与50重量%之间(基于总悬浮液计),优选在1.0重量%与20重量%之间,并且通过使用合适的分散装置(例如,ultraturrax®,胶体磨,…)的后续粉碎来制备多糖悬浮液。对于形成这些多糖凝胶而言,削弱成形体的预处理和在高剪切(例如在高压均化器中)下的后续处理不是绝对必需的。这是相比于纤维素凝胶的一大优点。根据本发明的多糖悬浮液的固体含量应在0.01重量%与50重量%之间,优选在0.1重量%与20重量%之间,其中多糖必须在其制备期间从未被干燥。总的来说,用于制备多糖悬浮液的本发明方法特征在于:a)将初始湿润的多糖材料的压滤饼用作起始材料,所述多糖材料至少部分由α(1→3)-葡聚糖组成,b)压滤饼具有4重量%与80重量%之间(基于总压滤饼计)、优选15重量%至45重量%的固体含量,c)将所需多糖浓度(通常通过添加水)设定在0.01重量%与50重量%之间(基于总悬浮液计)、优选在1.0重量%与20重量%之间,以及d)随后,使用分散装置进行粉碎。通过使用作为研磨装置的高压均化器的另外处理,可在需要时进一步略微改进悬浮液的均质性。然而,一旦根据us7,000,000和特别是根据wo2013/036968a1和wo2013/036918a2制备的多糖已经在形成悬浮液之前干燥,即,如果它不再是初始湿润的,则在再次悬浮于水中时仅在有限程度上形成凝胶,所述凝胶仅展现低的悬浮液稳定性并且几乎不显示显著的粘度增加。表示为重均dpw的根据本发明的方法中所使用α(1→3)-葡聚糖的聚合度可在200与2,000之间;优选400与1,000之间的值。由于这些葡聚糖的酶促控制制备,其分子量分布非常窄。此类窄分布不在天然多糖中出现。取决于设定的悬浮液浓度,根据本发明的悬浮液展现成膜性质并且特别良好地适合于制备多糖层、尤其是其他体的薄膜或涂层,例如用于不同表面上的涂层。这包括例如纸和包装应用。如果根据本发明的悬浮液形成膜或层,则它们因其均匀和紧密结构而充当对许多物质的屏障。根据本发明的多糖悬浮液还适合作为对现有涂料混合物(例如,在造纸工业中)的添加剂。这些膜或层可通过刮除、喷涂或刷涂和/或通过蒸发含水相和/或通过诸如加热或压制的其他措施来形成。这些膜或层可与底衬牢固连接(尤其在这种底衬也含有多糖的情况下),或为分开的。出于成膜的目的,还可将耐湿剂或增塑剂添加至根据本发明的多糖悬浮液中。膜或层的交联也是可能。涂层可为连续的(geschlossen)或还可为间断(lückenhaft)的。作为间断的涂层可以考虑例如穿孔或还可以考虑艺术设计的图案或装饰的制作。除制备膜或涂层以外,还可能例如借助挤出或还通过使用合适的模具从根据本发明的多糖悬浮液制备其他成形体。对此,有利的是使用尽可能高浓度的根据本发明的多糖悬浮液或向它添加合适的添加剂。此外,根据本发明的悬浮液非常良好地适合于所有应用,在其中需要粘度调节剂以便产生最终产物的乳膏状稠度。溶胀的多糖颗粒能够结合大量的水并且因此在比根据现有技术制备的多糖悬浮液更低的浓度下就已经产生了增稠效应。根据本发明的多糖悬浮液可用作用于制备干燥多糖粉末的起始材料,这也是本发明的主题。通过本发明悬浮液的简单干燥,由于氢键的构建而形成附聚物和密实层,这解释了成膜性质。特殊的干燥方法(喷雾干燥、冷冻干燥)形成分开的颗粒和较少附聚物。喷雾干燥还提供了制备混合颗粒的可行方法。添加剂可在本发明悬浮液的制备期间混入或仅在干燥过程期间计量加入。另一干燥可行方法是超临界干燥。在这种情况下,含水相由合适的非极性溶剂替换。在借助超临界co2去除溶剂期间氢键的强度降低,并且凝胶的3维网络保持完整;形成所谓的气凝胶。在干燥步骤之前,还可将所谓的“间隔物”添加至本发明的悬浮液。间隔物可为例如无机盐、聚乙二醇、纤维素衍生物,或还可为在凝胶领域中已知为间隔物(英语“spacer”)的其他物质。这些间隔物积聚于多糖分子之间,并且由此阻止形成过强的氢键。即使在这种情况下形成附聚物,它们也可再分散。这些附聚物的形成可有利于配量应用。在下文中,将更详细描述喷雾干燥:将待干燥的基质,即根据本发明的多糖凝胶经由喷嘴雾化成细小液滴。液滴随分离旋风器中的热空气流一起排出,并且在此过程期间水被蒸发。诸如固体浓度、喷嘴尺寸或进气与排气流之间的温差的不同参数可用来影响颗粒结构。在此过程中获得的多糖颗粒具有小于1μm至最多5μm的平均直径。喷雾干燥的原理和示意图示于图8中,其中:a:多糖悬浮液的供给b:喷雾空气(=压缩空气)的供给te:对进气的温度测量结果ta:对排气的温度测量结果1:用于进气的进气开口2:电加热器3:喷嘴4:喷雾圆筒5:排气6:分离旋风器7:排气出口过滤器8:干燥颗粒的收集容器根据本发明的悬浮液具有剪切稀释性质,并且由于简单的涂覆方法(刷涂、喷涂等),还可用作其他材料的粘合剂,并且它们是足够液态的以便填充甚至小的间隙。在此类情况下,优选另一种材料以基于多糖的量计200重量%至1000重量%的比例存在。在干燥期间,形成氢键,并且由此实现相应的“粘合效应”。特别在用作粘合剂,例如用于非织造物或类似的敞开结构时,可涂覆根据本发明的多糖悬浮液以使得整个结构或仅其部分被悬浮液渗透或者产生表面涂层。由此发生相比于原始结构而言所得复合材料的强度的又一显著升高。在与水接触时,用含α(1→3)-葡聚糖的悬浮液强化的此类结构可再次分解,这使它们可应用于“可冲洗擦巾”、即可在废水流中纤化的擦巾领域。根据本发明,可通过均匀引入添加剂将另外的功能性引入多糖悬浮液中。可将各种有机(壳聚糖,…)和无机(纳米银,氧化锌,…)添加剂以及着色颜料引入悬浮液。在下文中,将借助实施例来描述本发明。然而,本发明明确不限于这些实施例,而是还包括基于相同的本发明设想的所有其他实施方案。实施例一般信息:除非另外指明,否则%-数据始终理解为重量%。实施例1:将含水、初始湿润的α(1→3)-葡聚糖(干物质含量(ts)=17.6重量%)的压滤饼悬浮于去离子水中,并且借助ikat50basic型号的ultraturrax®(“ut”)以6,000u/min粉碎4分钟长的时间。在该实验中,待粉碎的悬浮液含有3.05重量%的α(1→3)-葡聚糖(atro)。将以这种方式制备的悬浮液分成两个分量,并且将一个分量额外地经由工作压力1,000巴的geanirosoavins1001l-2k型号的高压均化器(hdh)循环泵送通过2次。然后,借助粘度和保水能力表征两种葡聚糖悬浮液。葡聚糖颗粒的保水能力(wrv)如下测定:将准确限定量的悬浮液引入特定的离心管(具有出水口)。然后,以3,000rpm进行离心分离15min,并且在此后立即称重湿润的葡聚糖。在105℃下将湿润的葡聚糖干燥过夜,并且然后测定干重。根据以下公式计算wrv:wrv[%]=(mf-mt)/mt*100(mf=湿润质量,mt=干燥质量)测定的干固体含量和wrv汇编于表1中。表1:葡聚糖悬浮液的干固体含量和wrv两种悬浮液的粘度展现剪切稀释行为并且其曲线无差异(图1)。在图1以及其它图中表示:“shearrate”=剪切速率,“viscosity”=粘度。借助具有锥板测量系统(cp4/40s0687ss)的malvernkinexus流变仪以范围为10-200s-1的剪切速率测定粘度。出于比较目的,利用干燥的葡聚糖进行实验。所用葡聚糖是具有不同聚合度(dpw1,000和dpw500)的线性葡聚糖以及支化葡聚糖。在所有三种情况下,形成的凝胶不均匀并且发生相分离。设定悬浮液的固体含量至2%-3%,通过在ultraturrax®(ut,ikat50basic,6,000u/min)中处理4min来预粉碎,并且然后以1,000巴的工作压力用高压均化器处理通过2次。在那之后,测定干固体含量和wrv(表2)。wrv远低于制备自初始湿润的葡聚糖的凝胶的值。此外,这些悬浮液在粘度上未展现增加。表2:来自干燥的葡聚糖的凝胶的干固体含量和wrv以这种方式处理的悬浮液溶胀过夜以便使表面更可及。在第二天,再次用hdh以1,000巴处理样品通过4次。表明所用的干燥的葡聚糖不适合于制备悬浮液:即使在hdh上通过6次之后仍发生相分离,并且颗粒可光学识别(图2)。实施例2:通过在基于中试装置的实验(technikumsversuch)中用胶体磨(型号ikacolloidmillmk2000/10)制备较大量的4重量%-葡聚糖-凝胶,应表明即使大量的多糖也可在不使用高压均化器的情况下加工成均质悬浮液。通过在胶体磨(ikacolloidmillmk2000/10)中研磨,从3.69kg从未干燥、初始湿润的α(1→3)-葡聚糖(ts=16.25%)和11.3kg水制备具有3.9%固体含量的葡聚糖凝胶。在以最大功率用0.1mm的间隙研磨15分钟之后,制成葡聚糖凝胶。随后,对它如下表征:粘度:在具有锥板测量系统(cp4/40s0687ss)的malvernkinexus流变仪上以范围为10-200s-1的剪切速率测量葡聚糖凝胶。根据本发明的悬浮液展现剪切稀释行为(图3)。显微术:将葡聚糖凝胶填充于两个载物片之间,借此形成薄层。该层经受显微镜检查。将胶粘带(scotch胶带,哑光,大约0.3mm)各粘附至下载物片的边缘以便实现均匀的层厚度。在具有50倍放大率和底部照明(unterlicht)的zeissdiscoveryv12立体显微镜上拍摄照片(图4)。可识别形成自悬浮液中的极小颗粒的附聚物。然而,当在手指间摩擦时不能感觉到这些附聚物,并且它们将在最轻微的剪切下再次分解。玻璃管法:将10g葡聚糖凝胶称重至配备有塞盖的玻璃管(长度=大约9.7cm,ø2.5cm)中,摇动,颠倒放置,并且在10秒后拍照。玻璃管置于黑色背景前并且从上方使用台灯照明(与底部的距离为约22cm)。使用canoneos450d数字照相机拍摄照片。再次,无颗粒可见(图5)。沿着玻璃壁形成均匀致密的膜。在不同表面上测试这些悬浮液的成膜性质。将实施例2的根据本发明的悬浮液刮涂或喷涂至聚酯(pes)薄膜或玻璃上。两种涂布方法导致易于粘附至底衬的连续均匀膜。图6示出此类膜在pes薄膜上的透明性:图片的右侧用涂布的pes薄膜覆盖;左侧未覆盖。对空气干燥的膜拍摄rem照片(hitachis-4000sem扫描电子显微镜);在此,可看同时具有大的内表面的致密层的结构(图7)。另外,对冻干的葡聚糖凝胶拍摄rem照片(图8)。在此,可注意到在葡聚糖凝胶中形成的3维海绵状网络,并且所述网络赋予本发明的悬浮液其独特性质。实施例3:以类似于实施例2的方式制备具有不同固体浓度的葡聚糖凝胶。在较高的固体含量下,悬浮液的粘度增加(图9),同时保水能力(wrv)降低。尽管具有3%和4%固体含量的悬浮液仍可用hdh加工,但具有5%固体含量的悬浮液仅可用具有较低剪切的仪器、诸如ultraturraxikat50basic(“ika”)粉碎,因为hdh不能再泵送此类高粘性悬浮液。表3示出随着固体含量增加,粘度增加,但同时wrv降低。表3:对粉碎后各种葡聚糖凝胶的粘度和wrv的比较处理hdh后ika后ut后ts[%]345wrv[%]15381504506粘度[50s-1]0.20090.85551.731实施例4:在以下实施例中,将来自实施例3的3%葡聚糖凝胶在实验室喷雾干燥器(büchiminispraydryer8-290,参见图10)中干燥。借助激光衍射(测量仪器helos公司)在异丙醇中测定粒度分布。参数:进气温度180℃和排气温度62℃;喷嘴尺寸1.4mm。粒度分布如下给出:x10=0.79µm;x50=2.2µm;x90=5.29µm;x99=8.27µm。实施例5:通过使用ika磨(ikamk2000/10胶体磨),由1.887kg从未干燥、初始湿润的α(1→3)-葡聚糖(ts=39.74%)和5.613kg水制备具有10%葡聚糖的悬浮液。在用0.1mm的间隙和以最大功率研磨20分钟之后,制成葡聚糖悬浮液。形成了稳定悬浮液,其在其粘度方面可与来自实施例2的4%葡聚糖悬浮液相比拟(图12)。此外,在实施例2中所述的条件下拍摄来自实施例5的凝胶的显微镜照片(图13)。再次,可注意到小颗粒,但其也不能在手指之间感觉到。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1