裂解性多糖单加氧酶的酶活性的制作方法
本发明处于用于(半)纤维素降解和/或改性的酶的领域,更具体是用于木聚糖的降解和/或改性的酶的领域。本发明基于一类溶解性多糖单加氧酶(LPMO)的新发现的酶活性,即除了纤维素的氧化裂解之外还具有木聚糖的氧化裂解活性。因此,本发明涉及一种用于对含木聚糖的底物中的木聚糖进行降解和/或改性的方法,一种用于由含木聚糖的底物制备产物的方法,部件试剂盒,液体、糊剂或固体配制品,以及包含所述LPMO的含木聚糖的组合物。本发明进一步涉及所述LPMO、所述部件试剂盒、所述配制品和/或所述组合物在本发明的方法中的用途。
背景技术:
将植物生物质有效降解为单糖需要各种水解酶和氧化酶,所述单糖是生物化学物质或生物燃料的有用结构单元。这样的酶优选地是耐热的,因为植物细胞壁的硬度需要热辅助性预处理作为增加细胞壁多糖的可及性的第一步(1)。用于植物细胞壁降解的商业酶混合物主要包括由丝状真菌如曲霉属(Aspergillus)、木霉属(Trichoderma)和踝节菌属(Talaromyces)菌株产生的酶。另外,可商购的真菌嗜热毁丝霉C1是用于生产耐热碳水化合物活性酶的良好候选物(2)。还有,酶驱动的生物炼制工艺的成功需要改进现有的酶混合物。
次级植物细胞壁由与半纤维素相互作用的纤维素原纤维的基质构成,并与酚木质素的网络胶合在一起(3-5)。大多数半纤维素由木聚糖、甘露聚糖和木糖-葡聚糖结构单元构成,这些结构单元分别具有β-(1→4)连接的木糖基残基、β-(1→4)连接的甘露糖基或β-(1→4)连接的葡萄糖基残基的骨架(6)。这种半纤维素经由氢键与纤维素,特别是与具有低取代基量或取代基的嵌段分布的那些纤维素强烈地缔合(3,5)。纤维素缔合半纤维素阻断纤维素酶到达它们的靶底物,这可能有助于植物对微生物侵袭的防御。此外,半纤维素通过商业酶(7,8)在可发酵单糖的形成中抑制植物多糖的解构。因此,这些纤维素缔合半纤维素的降解对于改善植物生物质的纤维素水解是必不可少的。由于木聚糖是半纤维素的主要成分,因此降解木聚糖的酶在半纤维素降解中起主要作用。
木聚糖降解和/或改性酶广泛应用于工业中,如动物饲料的升级、提高烘焙和酿造产品的质量、漂白和改性软和硬木牛皮纸浆、纸张回收、浸渍蔬菜和水果、净化谷物溶液和果汁、以及从农业和林业产生的残留物生产生物燃料和/或其他化学品。然而,在许多实际应用中,木聚糖降解和/或改性的酶的使用不是直接的;这些酶在使用它们的过程的温度和pH条件下必须是有活性的。例如,使用造粒、挤出或膨胀的商业饲料的配制通常包含涉及高温(70℃-180℃)的步骤,并且需要能经受这些条件的酶。此外,漂白过程,以及甚至是漂白过程中使用的步骤的顺序在不同的纸浆厂中是不同的,并且因此提供了对在这些方法中使用的酶的特定要求。由于植物木聚糖的异质性和复杂的化学性质以及应用的广泛和异源性质,因此对发现新的木聚糖降解和/或改性酶活性,优选在不同的温度和pH条件下的活性存在不断需求。
因此,本发明的目的是提供用于改性和/或降解木聚糖的新装置和方法。本发明提供了新发现的一类真菌酶,即耐热溶解性多糖单加氧酶(LPMO)的酶活性。本发明的LPMO是先前称为GH61酶的辅助活性家族9(AA9)LPMO。这些酶被描述为具有纤维素分解活性和纤维素分解增强活性(Morgenstern等人,2014,Fungal cellulose degradation by oxidative enzymes:from dysfunctional GH61family to powerful lytic polysaccharide monooxygenase family[通过氧化酶进行的真菌纤维素降解:从功能失调的GH61家族到强大的溶解性多糖单加氧酶家族],Briefings in Functional Genomics[功能基因组学简报],13(6):421-423)。发明人发现在氧化的木糖和葡糖低聚物形成时,本发明的LPMO不仅切割纤维素还切割木聚糖,例如,在纤维素缔合木聚糖中。此外,当与内切葡聚糖酶一起作用时,LPMO显示出协同效应。本发明进一步提供了在需要切割纤维素和/或木聚糖的各种应用中使用该新颖LPMO的方法。
技术实现要素:
定义
如本文所用,术语“木质素”、“lignen”、“糖化”、“可发酵糖”、“生物质”、“木质纤维素材料”、“农业生物质”、“能量作物”、“纤维素”和“半纤维素”在本文中被理解为如WO 2013/159005 A2中所定义的。
如本文所用,“氧化还原酶”、“氧化酶”、“单加氧酶”、“羟化酶”、“脱氢酶”、“纤维二糖脱氢酶”、“纤维二糖脱氢酶”、“纤维二糖氧化酶”、“糖酶”、“糖苷水解酶”、“糖基水解酶”、“糖苷酶”、“内切葡聚糖酶”、“纤维二糖水解酶”和“半纤维素酶”、“木聚糖酶”、“β-甘露聚糖酶”、“内切-1,4-β-甘露糖苷酶”、“甘露聚糖内切-1,6-α-甘露糖苷酶”、“β-甘露糖苷酶”、“半乳聚糖酶”、“内切-β-1,6-半乳聚糖酶”、“阿拉伯半乳聚糖内切-1,4-β-半乳糖苷酶”“葡糖淀粉酶”、“β-己糖胺酶”、“β-N-乙酰葡糖胺酶”、“α-L-阿拉伯呋喃糖苷酶”、“α-N-阿拉伯呋喃糖苷酶”、“α-阿拉伯呋喃糖苷酶”、“阿拉伯糖苷酶”、“阿拉伯呋喃糖苷酶”、“内切阿拉伯糖酶”、“外切阿拉伯糖酶”、“β-木糖苷酶”、“壳聚糖酶”、“外切多聚半乳糖醛酸酶”、“乙酰木聚糖酯酶”、“乙酰甘露聚糖酯酶”、“阿魏酯酶”、“阿魏酸酯酶”、“香豆酸酯酶”、“果胶酸裂解酶”、“果胶裂解酶”、“内切-1,3-β-葡聚糖酶”、“昆布多糖酶”、“地衣酶”、“糖苷酶”和“木质酶”在本文中将被理解为如在WO 2013/159005 A2中所定义的。
如本文所用,提及“酶”包括全长天然存在的或野生型酶或蛋白质(术语酶和蛋白质在本文中可互换使用)及其糖基化的形式或其他修饰形式、融合蛋白或任何片段或同源物,或这类酶或蛋白质的变体。优选地,酶是分离的酶或蛋白质。分离的酶或蛋白质在本文中将被理解为已经从其天然环境中去除(即,已经经过人类操作)的酶或蛋白质(包括多肽或肽),并且可以包括例如纯化的蛋白质、部分纯化的蛋白质、重组产生的蛋白质、合成产生的蛋白质、与脂质络合的蛋白质、可溶性蛋白质以及与其他蛋白质相关的分离的蛋白质。就此而言,“分离的”不反映蛋白质被纯化的程度。优选地,分离的蛋白质是重组产生的。另外,并且举例来说,“嗜热毁丝霉蛋白质”或“嗜热毁丝霉酶”是指来自嗜热毁丝霉的蛋白质(通常包括天然存在的蛋白质的同源物或变体)或另外已经从结构(例如,序列)知识产生的蛋白质,并且优选地是来自嗜热毁丝霉的天然存在的蛋白质的功能。换句话说,嗜热毁丝霉蛋白质包括与天然存在的嗜热毁丝霉蛋白质具有基本上相似的结构和功能的任何蛋白质,或者是如本文详细描述的来自嗜热毁丝霉的天然存在的蛋白质的生物活性(即具有生物学活性)同源物或变体。因此,嗜热毁丝霉蛋白质可以包括纯化的、部分纯化的、重组的、突变的/修饰的以及合成的蛋白质。
如本文所用,短语蛋白质的“生物活性”是指由蛋白质表现或执行的任何一种或多种功能,该蛋白质属于如在体外或体内测量或观察到的天然存在形式的蛋白质。蛋白质片段优选地包含蛋白质的结构域,该结构域具有全长酶的催化活性。蛋白质片段包括但不限于包含催化结构域(CD)和/或碳水化合物结合模块(CBM)的片段。例如,蛋白质片段可以包含蛋白质的CD而不包含该蛋白质的CBM,或可以包含蛋白质的CBM而不包含CD。类似地,可以组合来自不同蛋白质的结构域。包含本文披露的每种蛋白质的CD、CBM或其组合的蛋白质片段可以使用本领域已知的标准技术容易地生产。
酶或蛋白质(包括其生物活性同源物、变体或片段)具有野生型或天然存在的蛋白质的生物学活性的至少一个特征。如上所讨论,通常,蛋白质的生物学活性或生物学作用是指由蛋白质表现或执行的任何一种或多种功能,该蛋白质属于在体内(即,在蛋白质的天然生理环境中)或体外(即,在实验室条件下)测量或观察到的天然存在形式的蛋白质。如本文所披露的蛋白质的生物学活性可以包括酶(如催化氧化-还原反应的氧化酶、加氧酶、单加氧酶、贝耶尔维利格(Baeyer-Villiger)单加氧酶、双加氧酶、过氧化物酶、脱氢酶、还原酶)活性(催化活性和/或底物结合活性),或本文披露的任何其他活性。本文披露的蛋白质的具体生物学活性在本文中和实例中详细描述。检测和测量如本文所披露的蛋白质的生物学活性的方法包括但不限于下面实例部分中所述的测定。这样的测定包括但不限于酶活性(例如催化活性)的测量、底物结合的测量等。在美国专利申请60/806,876;60/970,876;11/487,547;11/775,777;11/833,133和12/205,694中发现了用于检查酶的活性的另外的测定和方法,并通过引用并入本文。
应注意,酶或蛋白质(包括同源物或变体)不需要具有生物活性,如催化活性。例如,蛋白质可以是截短的、突变的或无活性的蛋白质,或缺乏野生型酶的至少一种活性。无活性的蛋白质可以用于一些筛选测定中。测量蛋白质的蛋白表达水平的方法包括但不限于:蛋白质印迹法、免疫细胞化学、流式细胞术或其他基于免疫学的测定;基于蛋白质的性能的测定包括但不限于配体结合或与其他蛋白伴侣的相互作用。
蛋白质的修饰(如同源物或变体中的)可以产生与天然存在的蛋白质具有相同生物活性的蛋白质,或者与天然存在的蛋白质相比具有降低或增加的生物活性的蛋白质。导致蛋白质表达降低或蛋白质活性降低的修饰可以被称为蛋白质的失活(完全或部分)、下调或降低的作用。类似地,导致蛋白质表达增加或蛋白质活性增加的修饰可以被称为蛋白质的扩增、过量生产、活化、增强、上调或增加的作用。
如本文所用,关于本文所述的嗜热毁丝霉蛋白质(或核苷酸序列)的氨基酸序列的修饰/突变,术语“修饰”、“突变”和“变体”可以互换使用。
术语“修饰”还可以用于描述对蛋白质或肽的翻译后修饰,包括但不限于甲基化、法尼基化、羧甲基化、香叶基香叶基化、糖基化、磷酸化、乙酰化、肉豆蔻酰化、异戊烯化、棕榈酸化和/或酰胺化。修饰还可以包括信号肽、或甲硫氨酸、或需要切割以产生成熟肽的肽的其他部分的切割。
如本文所用,术语“同源物”或“变体”用于表示通过对天然存在的蛋白质或肽进行小的修饰而与天然存在的蛋白质或肽(即,“原型”或“野生型”蛋白质)不同的蛋白质或肽,但其保持天然存在形式的碱性蛋白质和侧链结构。这样的变化包括但不限于:一个或几个氨基酸侧链变化;改变一个或几个氨基酸,包括缺失(例如,截短形式的蛋白质或肽)、插入和/或取代;一个或几个原子的立体化学变化;和/或小的衍生,包括但不限于例如:甲基化、糖基化和磷酸化。与天然存在的蛋白质或肽相比,同源物或变体可以具有增强的、降低的或基本相似的性质。同源物或变体可以包括蛋白质的激动剂或蛋白质的拮抗剂。
同源物或变体可以是天然等位变异或天然突变的结果。编码蛋白质的核酸的天然存在的等位基因变体是存在于基因组中与编码这类蛋白质的基因基本同一的一个或多个基因座处的基因,但是由于例如突变或重组引起的自然变异,其具有相似但不同一的序列。同源还可以是基因重复和重排(导致不同的位置)的结果。等位基因变体通常编码和与其进行比较的基因编码的蛋白质具有相似活性的蛋白质。由于遗传密码的简并性,一类等位基因变体可以编码相同的蛋白质但具有不同的核苷酸序列。等位基因变体还可以包括基因的5'或3'非翻译区(例如在调节控制区域中)的改变。等位基因变体为本领域技术人员所熟知。
可以使用本领域已知的用于生产蛋白质的技术来生产同源物或变体,所述技术包括但不限于对天然存在的蛋白质的直接修饰、直接蛋白质合成或使用例如经典技术或重组DNA技术对编码蛋白质的核苷酸序列进行修饰来产生随机或定向诱变。
修饰的蛋白质还包括融合蛋白,该融合蛋白包括附接到一个或多个融合区段上的本文所披露的蛋白质的结构域(包括同源物或变体),所述融合区段通常与该蛋白质序列在顺序上是异源的(即不同于蛋白质序列)。修饰的蛋白质中适合的融合区段包括但不限于可以进行以下各项的区段:增强蛋白质的稳定性;提供其他理想的生物活性;和/或协助蛋白质的纯化(例如,通过亲和层析)。适合的融合区段可以是具有所希望功能(例如,赋予增加的稳定性、溶解性、作用或生物活性;和/或简化蛋白质的纯化)的任何大小的结构域。融合片区段可以连接到如本文所披露的蛋白质的结构域的氨基和/或羧基端,并且可以易于切割以使蛋白质能够直接回收。融合蛋白优选地通过培养用融合核酸分子转染的重组细胞而产生,所述融合核酸分子编码包含融合区段的蛋白质,该融合区段附接到如本文所披露的蛋白质的结构域的羧基和/或氨基末端。因此,如本文所披露的蛋白质还包括诱变处理的基因(如具有密码子修饰以增强基因转录和翻译的基因)和截短的基因(如除去膜结合模块以产生可溶形式的膜蛋白的基因,或者除去在特定重组宿主中耐受性差的信号序列的基因)的基因融合体(例如,用于过表达可溶性活性形式的重组蛋白)的表达产物。
修饰的蛋白质还包括如所披露的已经通过保守氨基酸取代被修饰的蛋白质。“保守氨基酸取代”是指具有相似侧链的残基的互换性。例如,具有脂族侧链的一组氨基酸是甘氨酸、丙氨酸、缬氨酸、亮氨酸、以及异亮氨酸;具有脂族-羟基侧链的一组氨基酸是丝氨酸和苏氨酸;具有含酰胺侧链的一组氨基酸是天冬酰胺和谷氨酰胺;具有芳族侧链的一组氨基酸是苯丙氨酸、酪氨酸、以及色氨酸;具有碱性侧链的一组氨基酸是赖氨酸、精氨酸、以及组氨酸;并且具有含硫侧链的一组氨基酸是半胱氨酸和甲硫氨酸。优选的保守氨基酸取代组是:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸、以及天冬酰胺-谷氨酰胺。本文披露的氨基酸序列的取代变体是其中所披露的序列中的至少一个残基已经被去除并且不同的残基插入其位置的那些。优选地,该氨基酸变化是保守的。对于每种天然存在的氨基酸的优选保守取代如下:Ala到Ser;Arg到Lys;Asn到Gln或His;Asp到Glu;Cys到Ser或Ala;Gln到Asn;Glu到Asp;Gly到Pro;His到Asn或Gln;Ile到Leu或Val;Leu到Ile或Val;Lys到Arg;Gln或Glu;Met到Leu或Ile;Phe到Met、Leu或Tyr;Ser到Thr;Thr到Ser;Trp到Tyr;Tyr到Trp或Phe;以及,Val到Ile或Leu。
被定义为“基本上由指定氨基酸序列组成”的蛋白质或多肽是本文所述的氨基酸序列,其由至少一个并且至多约20个侧翼于指定氨基酸序列的每个C-和/或N-末端的另外的异源氨基酸产生。异源氨基酸是指定氨基酸序列侧翼没有被天然发现(即在自然中、在体内没有被发现)的氨基酸序列,或是与指定氨基酸序列的功能无关的氨基酸序列,或是不由编码指定氨基酸序列的、天然存在的核苷酸序列侧翼的核苷酸编码的氨基酸序列(如果天然存在的序列中的这样的核苷酸使用给定氨基酸序列源自于其的生物体的标准密码子选择,则在该基因中发生翻译)。另外,并且仅举例来说,引用的来源于其的蛋白质源自特定生物体,例如如上文所定义的真菌。
本文披露的许多酶和蛋白质可以是本文所述方法中的修饰和使用的理想目标。已经就代表性野生型蛋白质的功能和氨基酸序列(和编码其的核苷酸序列)描述了这些蛋白质。涵盖的蛋白质的同源物或变体优选地包含以下氨基酸序列,基本上由其组成或由其组成,该氨基酸序列与本文披露的氨基酸序列至少35%、45%、55%、65%、70%、75%、80%、90%同一,并且更优选至少95%同一、96%、97%同一,并且最优选至少约99%同一,或35%至99%之间的以全整数(whole integer)计(即36%、37%等)的任何百分比同一性,本文披露的氨基酸序列表示本文披露的酶或蛋白质(包括全长蛋白质的生物活性结构域)的氨基酸序列。优选地,同源物或变体的氨基酸序列具有野生型或参考蛋白或其生物活性结构域(例如催化结构域)的生物活性。当表示突变位置时,通常使用野生型的氨基酸位置。野生型还可以称为“亲本”。另外,在讨论变体之前的任何一代都可以是亲本。
蛋白质和/或同源物、变体或片段的最小尺寸是足以具有生物活性,或者当蛋白质不需具有这样的活性时足以用于与本文所披露的蛋白质相关的另一目的(如用于产生结合天然存在的蛋白质的抗体)的尺寸。优选地,本文所披露的蛋白质的长度为至少20、25、30、40、50、60、70、80、90、100、125、150、175、200、250个氨基酸,并且至多为每个蛋白质的全长,并且包括在一个全整数(一个氨基酸)的增量之间的任何尺寸。对这类蛋白质的最大尺寸除了实际限制之外没有限制,因为所述蛋白质可以包括蛋白质的一部分或全长蛋白质,如果期望的话,加上另外的序列(例如,融合蛋白序列)。
如本文所用,除非另有说明,提及百分比(%)同一性是指使用以下方式进行的同源性评估:1)使用采用标准默认参数的针对氨基酸检索的blastp和针对核酸检索的blastn进行BLAST 2.0Basic BLAST同源性检索,其中对于低复杂度区域,查询序列被默认过滤(描述于Altschul,S.F.,Madden,T.L.,A.A.,Zhang,J.,Zhang,Z.,Miller,W.和Lipman,D.J.(1997)"Gapped BLAST and PSI-BLAST:a new generation of protein database search programs.[空位BLAST和PSI-BLAST:新一代蛋白质数据库检索程序]"Nucleic Acids Res.[核酸研究]25:3389-3402);2)BLAST 2比对(使用下面描述的参数);3)采用标准默认参数的PSI-BLAST(位置特异性迭代BLAST);和/或4)使用来自碳水化合物活性酶数据库的标准默认参数而确定的CAZy同源性(Coutinho,P.M.和Henrissat,B.(1999)Carbohydrate-active enzymes:an integrated database approach.[碳水化合物活性酶:综合数据库方法],在“Recent Advances in Carbohydrate Bioengineering[碳水化合物生物工程的最新进展]”中,H.J.Gilbert,G.Davies,B.Henrissat和B.Svensson编辑,The Royal Society of Chemistry[皇家化学学会],剑桥,第3-12页)和/或使用数据库如Foly数据库(网址:foly.esil.univ-mrs.fr)和PeroxiBase(网址:peroxibase.isb-sib.ch)而应用类似的策略。
应注意,由于BLAST 2.0Basic BLAST和BLAST 2之间的标准参数的一些差异,可以使用BLAST 2程序将两个特异序列识别为具有显著的同源性,而使用这两个序列中的一个作为查询序列在BLAST 2.0Basic BLAST中进行的检索可能不识别顶部匹配中的第二个序列。此外,PSI-BLAST提供了一个自动的、易于使用的“轮廓”检索版本,这是查找序列同源物或变体的敏感方法。该程序首先执行空位BLAST数据库检索。PSI-BLAST程序使用返回的任何重要比对的信息来构建特定位置的得分矩阵,该得分矩阵替换下一轮数据库检索的查询序列。因此,应当理解,通过使用这些程序中的任一个可以确定百分比同一性。
可以使用如在Tatusova和Madden,(1999),“Blast 2sequences-a new tool for comparing protein and nucleotide sequences[Blast 2序列-用于比较蛋白质和核苷酸序列的新工具]”,FEMS Microbiol Lett.[FEMS微生物通讯]174:247-250中描述的BLAST 2序列来将两个特异序列彼此比对。使用BLAST 2.0算法在blastp或blastn中进行BLAST 2序列比对,以在两个序列之间执行空位BLAST检索(BLAST 2.0),从而允许在所得比对中引入空位(缺失和插入)。本文出于清楚的目的,使用如下的标准默认参数进行BLAST 2序列比对。
对于blastn,使用0BLOSUM62矩阵:
匹配加分=1
错配罚分=-2
起始空位(5)和延伸空位(2)罚分
空位x_下降(50)期望(10)字号(11)过滤器(开)
对于blastp,使用0BLOSUM62矩阵:
起始空位(11)和延伸空位(1)罚分
空位x_下降(50)期望(10)字号(3)过滤(开)。
除非本文另有说明,否则与给定的SEQ ID NO的同一性表示基于所述序列的全长(即,其整个长度或整体)的同一性。
如本文所用,关于本文所述的核酸或氨基酸序列,术语“连续(contiguous或consecutive)”是指以不间断的顺序连接。例如,对于第一序列包含第二序列的30个连续(contiguous或consecutive)氨基酸意味着第一序列包括与第二序列中的30个氨基酸残基的不间断序列100%同一的30个氨基酸残基的不间断序列。类似地,对于第一序列与第二序列具有“100%同一性”或“100%同一”意味着第一序列与第二序列精确匹配,在核苷酸或氨基酸之间没有空位。包括同源物或变体的如本文所披露的蛋白质优选地包括具有与天然氨基酸序列足够相似的氨基酸序列的蛋白质,使得编码同源物或变体的核苷酸序列能够在中、高或非常高严格条件(如下所述)下杂交到(即,与下述杂交)编码天然蛋白质的核酸分子(即,杂交到编码天然氨基酸序列的核酸链的互补体)上。优选地,蛋白质的同源物或变体由以下核酸分子编码,该核酸分子包含在低、中或高严格条件下与编码蛋白质的核苷酸序列的互补体杂交的核苷酸序列,该蛋白质包含由SEQ ID NO 1-6中任一个表示的氨基酸序列,基本上由其组成或由其组成。这样的杂交条件在下面详细描述。
编码如本文所披露的蛋白质的核苷酸序列的核苷酸序列互补体是指与编码该蛋白质的链互补的核酸链的核苷酸序列。应当理解,编码给定氨基酸序列的双链DNA包含单链DNA及其互补链,该互补链具有与单链DNA互补的序列。像这样,核酸分子可以是双链或单链的,并且包括在严格杂交条件下与编码氨基酸序列的核苷酸序列(如SEQ ID NO 1-6的氨基酸序列或SEQ ID NO 7-9的核苷酸序列)形成稳定杂交体的那些核酸分子。推导互补序列的方法是本领域技术人员已知的。应当注意,由于核酸测序技术不是完全无错误的,因此本文中呈现的序列最多表示本文所披露的蛋白质的表观序列。
如本文所用,参考杂交条件是指在使用核酸分子鉴定相似的核酸分子情况下的标准杂交条件。例如在Sambrook等人,Molecular Cloning:A Laboratory Manual[分子克隆:实验室手册],Cold Spring Harbor Labs Press[冷泉港实验室出版社],1989,Sambrook等人,同上(具体参见第9.31-9.62页)中披露了这样的标准条件。此外,例如,在Meinkoth等人,1984,Anal.Biochem[生物化学年鉴].138,267-284;Meinkoth等人,同上中披露了计算适当的杂交和洗涤条件以实现允许不同程度的核苷酸错配的杂交的公式。
更具体地,如本文提到的中度严格杂交和洗涤条件是指允许与用于探测杂交反应的核酸分子具有至少约70%的核苷酸序列同一性的核酸分子分离的条件(即,允许约30%或更少的核苷酸错配的条件)。如本文提到的高严格杂交和洗涤条件是指允许与用于探测杂交反应的核酸分子具有至少约80%的核苷酸序列同一性的核酸分子分离的条件(即,允许约20%或更少的核苷酸错配的条件)。如本文提到的非常高严格杂交和洗涤条件是指允许与用于探测杂交反应的核酸分子具有至少约90%的核苷酸序列同一性的核酸分子分离的条件(即,允许约10%或更少的核苷酸错配的条件)。如上所讨论,本领域技术人员可以使用Meinkoth等人(同上)的公式来计算适当的杂交和洗涤条件以达到这些特定水平的核苷酸错配。这样的条件将会有所不同,这取决于是否正在形成DNA:RNA或DNA:DNA杂交体。DNA:DNA杂交体的计算的解链温度比DNA:RNA杂交体低10℃。优选地,DNA:DNA杂交体的严格杂交条件包括在6X SSC(0.9M Na+)的离子强度下,在约20℃至约35℃(较低严格)之间,更优选地在约28℃至约40℃(更严格)之间,并且甚至更优选地在约35℃至约45℃(甚至更严格)之间的温度下进行杂交,伴随适当的洗涤条件。优选地,DNA:RNA杂交体的严格杂交条件包括在6X SSC(0.9M Na+)的离子强度下,在约30℃至约45℃之间,更优选地在约38℃至约50℃之间,并且甚至更优选地在约45℃至约55℃之间的温度下进行杂交,伴随类似严格的洗涤条件。这些值基于对大于约100个核苷酸、0%甲酰胺和G+C含量约40%的分子的解链温度(Tm)的计算。可替代地,可以根据经验计算Tm,如在Sambrook等人,同上,第9.31至9.62页中所述。通常,洗涤条件应尽可能严格,并且应适合所选择的杂交条件。例如,杂交条件可以包括比特定杂交体的计算的Tm低约20℃-25℃的盐和温度条件的组合,并且洗涤条件通常包括比该特定杂交体的计算的Tm低约12℃-20℃的盐和温度条件的组合。适合与DNA:DNA杂交体一起使用的杂交条件的一个实例包括在约42℃下在6X SSC(50%甲酰胺)中杂交2-24小时,随后是洗涤步骤,其包括一次或多次在室温下在约2X SSC中洗涤,然后在较高温度和较低的离子强度下进行另外的洗涤(例如,在约37℃下在约0.1X-0.5X SSC中至少一次洗涤,然后在约68℃下在约0.1X-0.5X SSC中至少一次洗涤)。
核酸分子包括以下核酸分子,其包含编码本文所披露的任何酶或蛋白质的核苷酸序列,基本上由其组成或由其组成,所述核苷酸序列包括上述这些蛋白质的片段或同源物或变体。核酸分子可以包含编码不具有生物活性的蛋白质片段的核苷酸序列,并且还可以包括编码不是蛋白质编码区的一部分的蛋白质的基因或多核苷酸的部分(例如,内含子或编码该蛋白质的基因的调节区)。核酸分子可以包括可用作探针或引物(寡核苷酸序列)的核苷酸序列。优选地,核酸分子是分离的核酸分子。如本文所用,分离的核酸分子是已经从其天然环境中去除的核酸分子(多核苷酸)(即,已经经过人类操作),并且可以包括DNA、RNA或者DNA或RNA的衍生物(包括cDNA)。像这样,“分离的”不反映核酸分子被纯化的程度。虽然短语“核酸分子”主要是指物理核酸分子,并且短语“核苷酸序列”主要是指该核酸分子上的核苷酸序列,但这两个短语可以互换使用,特别是关于能够编码蛋白质的核酸分子或核苷酸序列。分离的核酸分子可以从其天然来源分离或使用重组DNA技术(例如,聚合酶链式反应(PCR)扩增、克隆)或化学合成来产生。核酸分子或分离的核酸分子可以包括例如基因,基因的天然等位基因变体,其编码区或其部分,以及以以下方式通过核苷酸插入、缺失、取代和/或倒位而修饰的编码和/或调节区,这种方式使得修饰基本上不干扰核酸分子编码蛋白质或在严格条件下与天然基因分离物形成稳定杂交体的能力。核酸分子可以包括简并性。如本文所用,核苷酸简并性是指一个氨基酸可以由不同的核苷酸密码子编码的现象。因此,编码本文所披露的蛋白质的核酸分子的核苷酸序列可以由于简并性而变化。应当注意,本文所披露的核酸分子不需要编码具有蛋白质活性的蛋白质。核酸分子可编码例如截短的、突变的或无活性的蛋白质。此外,本文所披露的核酸分子可用作用于鉴定、分离和/或纯化其他核酸分子的探针和引物。如果该核酸分子是寡核苷酸(如探针或引物),则该寡核苷酸的长度优选地在约5至约50或约500个核苷酸,更优选地约10至约40个核苷酸,并且最优选地约15至约40个核苷酸的范围内。
提及基因包括与天然(即野生型)基因相关的所有核苷酸序列,如控制由该基因编码的蛋白质的产生的调节区(例如但不限于转录、翻译或翻译后控制区域)以及编码区本身。基因可以是天然存在的等位基因变体,其包含与编码给定蛋白质的核苷酸序列相似但不完全同一的序列。以上已经描述了等位基因变体。基因可以包括或排除一个或多个内含子或其任何部分或任何其他序列,或者基因不包括在该蛋白质的cDNA中。当核酸分子包含如上所述的基因时,术语“核酸分子”和“基因”可以互换使用。
修饰的基因包括通过取代、插入和/或缺失单个或多个核苷酸序列而修饰的天然基因,这些修饰的基因可以存在于包括编码多肽的区域的外显子的编码序列内,或存在于侧翼区,如通常在上游(例如,启动子、增强子和相关序列)、下游(例如,转录终止和聚(A)信号)或者影响多肽或目的调节分子的转录、翻译和/或活化的内部区域(例如,内含子)的调节区域。例如,多肽的活化可以需要去除一个或多个N-末端、C-末端或内部多肽区域,和/或需要特定氨基酸残基的翻译后修饰,如通过可以改变酶的靶向、降解、催化活性的糖基化、酰胺化等。
优选地,使用重组DNA技术(例如,聚合酶链式反应(PCR)扩增、克隆等)或化学合成来产生如本文所披露的核酸分子。核酸分子包括作为本文所述基因的一部分和/或编码本文所述蛋白质的任何核酸分子及其同源物或变体,它们包括但不限于天然等位基因变体和经修饰的核酸分子(同源物或变体),其中核苷酸已经被插入、缺失、取代和/或倒位,这样的方式使得这类修饰对蛋白质生物活性或核酸分子活性提供了期望的效果。以上已经详细讨论了等位基因变体和蛋白质同源物或变体(例如,由核酸同源物或变体编码的蛋白质)。
核酸分子同源物或变体(即,编码本文所披露的蛋白质的同源物或变体)可以使用本领域技术人员已知的多种方法产生(参见例如,Sambrook等人)。例如,核酸分子可以使用多种技术来修饰,包括但不限于通过经典诱变和重组DNA技术(例如,定点诱变、化学处理、限制酶切割、核酸片段的连接和/或PCR扩增)、或寡核苷酸混合物的合成和混合物组的连接以“构建”核酸分子的混合物及其组合。用于修饰编码蛋白质的重组核酸分子的另一种方法是基因改组(即,分子育种)(参见例如,美国专利号5,605,793至Stemmer;Minshull和Stemmer;1999,Curr.Opin.Chem.Biol[化学生物学现行观点]3:284-290;Stemmer,1994,P.N.A.S.USA 91:10747-10751)。该技术可以用于有效地在该蛋白质中引入多个同时发生的变化。核酸分子同源物或变体可以通过与基因或多核苷酸杂交,或通过筛选由核酸分子编码的蛋白质的功能(即,生物活性)来选择。
如本文所披露的核酸分子的最小尺寸是足以编码具有生物活性的蛋白质(包括全长蛋白质的片段、同源物或变体)、足以编码包含与抗体结合的至少一个表位的蛋白质、或足以形成探针或寡核苷酸引物的尺寸,该探针或寡核苷酸引物能够与编码天然蛋白质的核酸分子的互补序列形成稳定杂交体(例如,在中度、高或高严格条件下)。像这样,编码这类蛋白质的核酸分子的大小可以取决于核酸组分、和核酸分子与互补序列之间的百分比同源性或百分比同一性以及杂交条件本身(例如,温度、盐浓度和甲酰胺浓度)。如果用作寡核苷酸引物或探针的核酸分子富含GC,那么其最小尺寸通常为至少约12至约15个核苷酸长,并且如果如果这些核酸分子富含AT,那么其最小尺寸为至少约15至约18个碱基长。对于如本文所披露的核酸分子的最大尺寸,除了实际限制之外没有限制,因为该核酸分子可以包括一部分蛋白质编码序列、编码全长蛋白质的核苷酸序列(包括基因)或多个基因或其部分,该编码全长蛋白质的核苷酸序列包括在约20个核苷酸和构成编码蛋白质的全长cDNA的核苷酸的数目之间(以全整数计,例如,20、21、22、23、24、25个核苷酸)的任何长度片段。当关于本文的核苷酸序列使用时,短语“基本上由...组成”是指编码特定氨基酸序列的核苷酸序列,其可以在编码特定氨基酸序列的核苷酸序列的5'端和/或3'端的每一个处侧翼有至少一个并且多至不下于约60个另外的异源核苷酸。异源核苷酸不被天然发现(即,在自然中、在体内没有发现)于编码特定氨基酸序列的核苷酸序列的侧翼,而这发生于天然基因中,或者异源核苷酸不编码赋予蛋白质任何附加功能的蛋白质或不编码改变具有特定氨基酸序列的蛋白质的功能的蛋白质。
如本文所披露的核酸分子可以是重组核酸分子,其包含与至少一个表达控制序列有效地连接地上述核酸分子。更具体地,重组核酸分子通常包含重组载体和如本文所述的任何一种或多种核酸分子。如本文所用,重组载体是工程化(即,人工产生的)核酸分子,其用作操纵所选择的核苷酸序列和/或将这种核苷酸序列引入宿主细胞的工具。因此,重组载体适合用于在克隆、测序和/或以其他方式操纵所选择的核苷酸序列中使用,如通过将所选择的核苷酸序列表达和/或递送到宿主细胞以形成重组细胞。这样的载体通常含有不被自然地发现与待克隆或递送的核苷酸序列相邻的核苷酸序列,尽管该载体还可以含有调节核苷酸序列(例如,启动子、非翻译区),这些调节核苷酸序列被自然地发现与本文所披露的核苷酸序列相邻或可用于本文所披露的核酸分子的表达(以下详细讨论)。该载体可以是原核或真核的RNA或DNA,并且通常是质粒。该载体可以作为染色体外元件(例如,质粒)被维持,或者它可以整合到重组宿主细胞的染色体中,尽管优选的是该载体与基因组保持分离。整个载体可以在宿主细胞内保留在适当位置,或者在某些条件下,可以缺失质粒DNA,留下本文所披露的核酸分子。整合的核酸分子可以处于染色体启动子控制下,天然或质粒启动子控制下或在若干个启动子控制的组合下。核酸分子的单拷贝或多拷贝可以整合到染色体中。本文所披露的重组载体可以含有至少一种选择性标记。
用于本文所披露的重组核酸分子中的重组载体可以是表达载体。如本文所用,短语“表达载体”用于指适合于产生编码产物(例如,目的蛋白质,如本文所披露的酶)的载体。可以将编码待生产的产物(例如,蛋白质或其同源物或变体)的核苷酸序列插入重组载体中以产生重组核酸分子。将编码待生产的蛋白质的核苷酸序列以有效地将该核苷酸序列与载体中的调节序列连接的方式插入载体中,这使得能够在重组宿主细胞内转录和翻译该核苷酸序列。通常,重组核酸分子包括与一个或多个表达控制序列(例如,转录控制序列或翻译控制序列)有效地连接的如本文所披露的至少一种核酸分子。如本文所用,短语“重组分子”或“重组核酸分子”主要是指有效地与转录控制序列连接的核酸分子或核苷酸序列,但当这样的核酸分子是如本文所讨论的重组分子时,其可以与短语“核酸分子”互换使用。如本文所用,术语“有效地连接”是指以一种方式将核酸分子与表达控制序列连接使得当被转染(即转化、转导、转染、共轭或煅烧)进宿主细胞时该分子能够被表达。转录控制序列是控制转录的起始、延伸或终止的序列。尤其重要的转录控制序列是控制转录起始的那些序列,如启动子、增强子、操纵子和抑制子序列。适合的转录控制序列包括可在向其引入重组核酸分子的宿主细胞或生物体中起作用的任何转录控制序列。转录控制序列还可以包括前述任一项中的一种或多种的任何组合。
重组核酸分子还可以含有另外的调节序列,如翻译调节序列、复制起点和与重组细胞相容的其他调节序列。重组分子,包括整合到宿主细胞染色体中的那些,优选地还包含分泌信号(即,信号区段核苷酸序列),以使表达的蛋白质能够从产生蛋白质的细胞分泌。适合的信号区段包括与待表达的蛋白质天然相关的信号区段或能够引导如本文所披露的蛋白质分泌的任何异源信号区段。重组分子可以包含前导序列,以使表达的蛋白质能够递送到并被插入到宿主细胞的膜中。适合的前导序列包括与该蛋白质天然相关的前导序列,或能够将蛋白质递送并插入到细胞膜的任何异源前导序列。
术语“转染”通常用于意指可以将外源核酸分子(即,重组核酸分子)插入到细胞中的任何方法。术语“转化”可以与术语“转染”互换使用,当该术语用于意指将核酸分子引入微生物细胞或植物中并描述由于由微生物获得外源核酸而导致的遗传变化时,其基本上与术语“转染”同义。转染技术包括但不限于转化、粒子轰击、电穿孔、显微注射、脂质转染、吸附、感染和原生质体融合。
一种或多种重组分子可用于产生本文披露的编码产物(例如,蛋白质)。可以通过在有效产生蛋白质的条件下通过表达如本文所述的核酸分子来产生编码产物。产生编码蛋白质的优选方法是通过用一种或多种重组分子转染宿主细胞以形成重组细胞。适合转染的宿主细胞包括但不限于可以被转染的任何细菌、真菌(例如丝状真菌或酵母或蘑菇)、藻类、植物、昆虫或动物细胞。宿主细胞可以是未转染的细胞或已经用至少一种其他重组核酸分子转染的细胞。优选地,宿主细胞是培养的细胞。
适合的细胞(例如,宿主细胞或生产生物)可以包括任何微生物(例如,细菌、原生生物、藻类、真菌或其他微生物),并且优选地是细菌、酵母或丝状真菌。适合的细菌属包括但不限于埃希氏菌属、芽孢杆菌属、乳酸杆菌属、假单胞菌属和链霉菌属。适合的细菌物种包括但不限于大肠杆菌、枯草芽孢杆菌、地衣芽孢杆菌、嗜热脂肪芽孢杆菌、短乳酸杆菌、铜绿假单胞菌和变铅青链霉菌。酵母的适合的属包括但不限于酵母属、裂殖酵母属、假丝酵母属、汉逊酵母属、毕赤酵母属、克鲁维酵母属和Phaffia属。适合的酵母物种包括但不限于酿酒酵母、粟酒裂殖酵母、白色念珠菌、多形汉逊酵母、巴斯德毕赤酵母、加拿大毕赤酵母、马克斯克鲁维酵母和红法夫酵母。
适合的真菌属包括但不限于金孢子菌属、梭孢壳属、脉孢菌属、短梗霉属、线黑粉菌科(Filibasidium)、梨囊鞭菌属、棒囊孢壳菌、隐球菌属、支顶孢属、弯颈霉属、柱顶孢霉属、裂褶菌属、侧孢霉属、青霉属、赤霉属、毁丝霉属、毛霉属、曲霉属、镰孢霉属、腐质霉属、以及木霉属、踝节菌属、Rasamsonia以及其无性型和有性型。适合的真菌物种包括但不限于黑曲霉、米曲霉、构巢曲霉、日本曲霉、蓝色犁头霉(Absidia coerulea)、米根霉、嗜热毁丝霉、粗糙脉孢菌、间型脉孢菌(Neurospora intermedia)、里氏木霉、长枝木霉、变灰青霉(Penicillium canescens)、离生青霉、绳状青霉、嗜热毁丝霉、亚拉巴马枝顶孢(Acremonium alabamense)、土生梭孢霉、嗜热侧孢霉(Sporotrichum thermophile)、Sporotrichum cellulophilum、球毛壳菌、Corynascus heterothallicus、埃默森篮状菌、Rasamsonia emersonii、以及黄色蠕形霉(Talaromyces flavus)。优选地,使用低纤维素菌株。优选地,该宿主细胞是菌株Cl(VKM F-3500D)或衍生自其的突变株的真菌细胞(例如,UV13-6(登录号VKM F-3632D)、NG7C-19(登录号VKM F-3633D)、UV18-25(VKM F-3631D)、W1L(CBS122189)、或W1L#100L(CBS122190))。优选地,该宿主菌株是蛋白酶和(半)纤维素酶表达降低,更优选地是不含蛋白酶和(半)纤维素酶表达的菌株。最优选地,该宿主菌株是W1L#100.lΔpyr5ΔAlp1,也称作LC菌株(27)。如在美国专利号6,015,707或美国专利号6,573,086中所述,称为Cl(登录号VKM F-3500D)的菌株分离自俄罗斯联邦远东索拉湖[Sola Lake,Far East of the Russian Federation]的森林碱性土壤样本。该菌株于1996年8月29日出于专利程序的目的,根据“布达佩斯条约”关于保藏微生物的国际规定的条款,被保藏在俄罗斯科学院所有俄罗斯微生物收藏馆(All-Russian Collection of Microorganisms of Russian Academy of Sciences(VKM)),Bakhurhina St.8,莫斯科,俄罗斯,113184(目前地址:俄罗斯,142290,莫斯科地区,普希诺(Pushchino),pr.Nauki,5,IBPM),称为卢克诺文思金孢子菌(Chrysosporium lucknowense)Garg 27K,VKM F-3500D(通过A.P.Sinitsyn,O.N.Okunev,I.V.Solov’eva,V.M.Chernoglasov,M.A.Emalfarb,
A.Ben-Bassat;“FermTech”LTD Acad.Kapitsky str.32-2,莫斯科,117647,俄罗斯)。已经生产了Cl的各种突变菌株,并且这些菌株于1998年9月2日出于专利程序的目的,根据“布达佩斯条约”关于保藏微生物的国际规定的条款,被保藏在俄罗斯科学院所有俄罗斯微生物收藏馆(All-Russian Collection of Microorganisms of Russian Academy of Sciences(VKM)),Bakhurhina St.8,莫斯科,俄罗斯,113184(通过O.N.Okunev,A.P.Sinitsyn,V.M.Chernoglasov,和M.A.Emalfarb;“FermTech”LTD,Acad.Kapitsy str.,32-2,莫斯科,117647,俄罗斯),或于2007年12月5日出于专利程序的目的被保藏在真菌菌种保藏中心(the Centraal Bureau voor Schimmelcultures(CBS)),Uppsalalaan 8,3584CT Utrecht,荷兰,(通过Dyadic Nederland B.V.,Nieuwe Kanaal 7s,6709PA瓦赫宁恩(Wageningen),荷兰)。例如,通过使菌株Cl经受紫外光而被诱变以产生菌株UV13-6(登录号VKM F-3632D;1998年9月2日保藏于VKM)。随后用N-甲基-N'-硝基-N-亚硝基胍进一步突变该菌株以产生菌株NG7C-19(登录号VKM F-3633D;1998年9月2日保藏于VKM)。后一种菌株依次通过紫外光进行突变,产生菌株UV18-25(登录号VKM F-3631D;1998年9月2日保藏于VKM)。再次将该菌株依次通过紫外线进行突变,产生菌株W1L(登录号CBS122189;2007年12月5日保藏于CBS),将该菌株W1L随后通过紫外光进行突变,产生菌株W1L#100L(登录号CBS122190;2007年12月5日保藏于CBS)。如在美国专利号6,015,707,美国专利号6,573,086和专利PCT/NL2010/000045中详细讨论的,根据该微生物的形态特征和生长特征,菌株Cl最初被分类为卢克诺文思金孢子菌。根据遗传测试,该Cl菌株随后被重新分类为嗜热毁丝霉。在该文献中,卢克诺文思金孢子菌也作为嗜热侧孢霉(Sporotrichum thermophile)出现。
宿主细胞可以是未转染的细胞或已经用至少一种其他重组核酸分子转染的细胞。所涵盖的还有本文所述的任何遗传修饰的细胞。适合的宿主细胞包括昆虫细胞(最特别地是黑腹果蝇细胞、草地贪夜蛾Sf9和Sf21细胞以及粉纹夜蛾高-五细胞)、线虫细胞(特别是秀丽隐杆线虫细胞)、禽类细胞、两栖动物细胞(特别是非洲爪蟾细胞)、爬行类动物细胞以及哺乳动物细胞(最特别是人、类人猿、犬、啮齿动物、牛或绵羊细胞,例如NIH3T3、CHO(中国仓鼠卵巢细胞)、COS、VERO、BHK、HEK及其他啮齿动物或人类细胞)。可以通过在有效产生蛋白质的条件下培养表达该蛋白质的细胞(即,重组细胞或重组宿主细胞)来产生本文所披露的核酸分子表达的一种或多种蛋白质。在一些情况下,可以回收该蛋白质,而在其他情况下,可以整体收获该细胞,该蛋白质和细胞中的任一种可以用于组合物中。在合适的发酵培养基中培养用于用作宿主细胞的微生物(包括重组宿主细胞或遗传修饰的微生物)。适合的或有效的发酵培养基是指以下任何培养基,其中当培养时,本文所披露的细胞,包括遗传修饰的微生物(如下所述),能够表达如本文所披露的酶和/或催化(氧化的)木糖低聚物和/或葡糖低聚物的产生。微生物可以通过任何发酵方法进行培养,其包括但不限于分批、补料分批、细胞再循环和连续发酵。通常,真菌菌株在发酵罐中生长,任选地被离心或过滤以除去生物质,并任选地被浓缩、配制并干燥以产生作为粗发酵产物的一种或多种酶或多酶组合物。用于培养丝状真菌的特别适合的条件描述于例如美国专利号6,015,707和美国专利号6,573,086中,同上。
根据用于生产的载体和宿主系统,所得的蛋白质可以保留在重组细胞内;分泌到培养基中;分泌到两个细胞膜之间的空间;或者保留在细胞膜的外表面上。术语“回收蛋白质”是指收集含有蛋白质的整个培养基,而不需要暗示另外的分离或纯化步骤。可以使用各种标准蛋白纯化技术来纯化产生的蛋白质,例如但不限于亲和层析、离子交换层析、过滤、电泳、疏水相互作用层析、凝胶过滤层析、反相色谱法、伴刀豆球蛋白A色谱法、聚焦色谱以及差异沉淀或增溶。蛋白质优选以“基本上纯的”形式回收、获得和/或使用。如本文所用,“基本上纯的”是指允许以根据本发明的任何方法有效使用该蛋白质的纯度。对于可用于本文所述的任何方法或利用本文所述类型的酶的任何方法中的蛋白质,其基本上不含污染物、其他蛋白质和/或化学品,它们可能干扰或干扰该蛋白质在本发明的方法中的使用(例如,可能干扰酶活性),或者当将该蛋白质在本发明的方法中使用时,它们至少不期望夹杂在本文所披露的蛋白质(包括同源物和变体)中(以下详细描述)。优选地,如本文所提及的“基本上纯的”蛋白质是可以通过任何方法(即,通过从天然来源直接纯化、重组地或合成地)产生的蛋白质,并且是已经从其他蛋白质组分纯化的蛋白质,使得该蛋白质在给定组合物中包含至少约80%重量/总蛋白重量(例如,目的蛋白质是溶液/组合物/缓冲液中的蛋白质的约80%),并且在给定的组合物中更优选至少约85%,并且更优选至少约90%,并且更优选至少约91%,并且更优选至少约92%,并且更优选至少约93%,并且更优选至少约94%,并且更优选至少约95%,并且更优选至少约96%,并且更优选至少约97%,并且更优选至少约98%,并且更优选至少约99%的重量/总蛋白重量。
本领域技术人员将理解,使用重组DNA技术可以通过操纵例如宿主细胞内的核酸分子的拷贝数、那些核酸分子被转录的效率、所得到的转录物被翻译的效率以及翻译后修饰的效率来改善对转染的核酸分子的表达的控制。此外,与天然启动子相比,该启动子序列可能被基因工程化以提高表达水平。有用于控制核酸分子表达的重组技术包括但不限于,将核酸分子整合到一个或多个宿主细胞染色体中,向质粒添加载体稳定性序列,转录控制信号的替换或修饰(例如,启动子、操纵子、增强子),翻译控制信号(例如,核糖体结合位点)的取代或修饰,对核酸分子进行修饰以对应于宿主细胞的密码子使用,以及使转录物不稳定的序列的缺失。
如本文定义的宿主细胞还可以是已经用本文披露的一种或多种核酸分子转染的经遗传修饰的微生物。如本文所用,遗传修饰的微生物可以包括遗传修饰的细菌、藻类、酵母、丝状真菌或其他微生物。这类遗传修饰的微生物具有从其正常(即,野生型或天然存在的)形式被修饰(即,突变或改变)的基因组,使得实现期望的结果(即增加的或修饰的活性和/或生产至少一种用于将木质纤维素材料转化成可发酵糖的酶或多酶组合物)。可以使用经典菌株开发和/或分子遗传技术来实现微生物的遗传修饰。
对于微生物的本领域已知的这类技术通常披露于例如,Sambrook等人,1989,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Labs Press[分子克隆:实验室手册,冷泉港实验室出版社]或Molecular Cloning:A Laboratory Manual,third edition[分子克隆:实验室手册,第三版](Sambrook和Russell,2001),(本文共同称为“Sambrook”)。遗传修饰的微生物可以包括其中核酸分子已经以一种方式被插入、缺失或修饰(即,突变,例如通过插入、缺失、取代和/或倒位核苷酸)的微生物,使得这样的修饰提供微生物中所希望的效果。遗传修饰的微生物可以内源地包含并表达酶或多酶组合物,并且遗传修饰可以是一种或多种这样的内源性酶的遗传修饰,由此所述修饰对由微生物的生物体产生的酶混合物的量和/或质量有一定影响(例如,通过引入启动子或其他表达控制序列增加蛋白质的表达,或通过同源重组修饰编码区以增加编码的蛋白质的活性)。
遗传修饰的微生物可以内源地包含并表达用于催化氧化还原反应的酶,并且遗传修饰可以是引入至少一种外源核苷酸序列(例如,重组核酸分子),其中该外源核苷酸序列编码至少一种可用于催化氧化还原反应的另外的酶和/或提高目标酶的效率的蛋白质。微生物还可以对包含其于催化氧化还原反应的一种或多种内源性酶的一种或多种基因或酶的至少一种修饰,以帮助木质纤维素材料的转化。
遗传修饰的微生物不一定内生地(天然地)含有用于催化氧化还原反应的酶,但其被遗传修饰以引入至少一种重组核酸分子,该重组核酸分子编码用于催化氧化还原反应的至少一种酶或多种酶。这样的微生物可以用于本发明的方法中,或用作粗发酵产物、部分纯化的重组酶和/或纯化的重组酶(然后其中任何一种可以用于本发明的方法中)的生产微生物。
一旦蛋白质(酶)在宿主细胞中表达,就可以产生含有待测活性的细胞提取物。例如,产生来自宿主细胞的裂解物,并收获含有该活性物的上清液和/或从裂解物中分离该活性物。在将酶分泌到培养基中的细胞的情况下,可以收获含有它们的培养基,和/或可以从培养基中纯化活性物。以这种方式制备的提取物/活性物可以使用本领域已知的测定法进行测试。
本发明不限于真菌,并且还考虑用本文披露的一种或多种核酸分子转化的遗传修饰的生物,如藻类、细菌和植物。植物可用于生产酶,和/或作为本发明的方法中用作底物的木质纤维素材料。生产重组植物的方法是本领域已知的。例如,已经开发了用于植物转化的许多方法,包括生物和物理转化方案。参见例如,Miki等人,"Procedures for Introducing Foreign DNA into Plants"in Methods in Plant Molecular Biology and Biotechnology[在植物分子生物学和生物技术的方法中“用于将外源DNA引入植物的程序”],Glick,B.R.和Thompson,J.E.编辑(CRC Press,Inc.[CRC出版公司],Boca Raton[波卡拉顿],1993)第67-88页。此外,用于植物细胞或组织转化和植物再生的载体以及体外培养方法是可用的。参见例如,Gruber等人,"Vectors for Plant Transformation"in Methods in Plant Molecular Biology and Biotechnology[在植物分子生物学和生物技术的方法中“用于植物转化的载体”],Glick,B.R.和Thompson,J.E.编辑(CRC Press,Inc.[CRC出版公司],Boca Raton[波卡拉顿],1993)第89-119页。
用于将表达载体引入植物的最广泛使用的方法是基于农杆菌属的天然转化系统。参见例如,Horsch等人,Science[科学]227:1229(1985)。用于农杆菌属介导的基因转移的农杆菌属载体系统和方法的描述由许多参考文献提供,包括Gruber等人,同上,Miki等人,同上,Moloney等人,Plant Cell Reports[植物细胞报告]8:238(1989),以及美国专利号4,940,838和5,464,763。
植物转化的另一种普遍适用的方法是微粒介导的转化,参见例如,Sanford等人,Part.Sci.Technol.[部分科学技术]5:27(1987);Sanford,J.C.,Trends Biotech.[生物技术趋势]6:299(1988);Sanford,J.C.,Physiol.Plant[植物生理学]79:206(1990);Klein等人,Biotechnology[生物技术]10:268(1992)。用于将DNA物理递送到植物的另一种方法是对靶细胞进行超声处理。Zhang等人,Bio/Technology[生物/技术]9:996(1991)。可替代地,脂质体或原生质球融合已被用于将表达载体引入植物中。Deshayes等人,EMBO J.[欧洲分子生物学组织杂志]4:2731(1985);Christou等人,Proc Natl.Acad.Sci.USA[美国国家科学院院刊]84:3962(1987)。还报道了使用CaCl2沉淀、聚乙烯醇或聚-L-鸟氨酸将DNA直接吸收到原生质体中。Hain等人,Mol.Gen.Genet.[分子遗传学和基因组学]199:161(1985)和Draper等人,Plant Cell Physiol.[植物细胞生理学]23:451(1982)。还描述了对原生质体以及全细胞和组织进行的电穿孔。Donn等人,In Abstracts of VIIth International Congress on Plant Cell and Tissue Culture IAPTC[第七届国际植物细胞和组织培养大会摘要],A2-38,第53页(1990);D'Halluin等人,Plant Cell[植物细胞]4:1495-1505(1992)以及Spencer等人,Plant Mol.Biol.[植物分子生物学]24:51-61(1994)。
本文所涵盖的是包含至少一种核酸分子的经遗传修饰的生物体,该核酸分子编码如本文所披露的至少一种酶,其中酶的活性被下调。所述下调可以例如通过引入酶活性的抑制剂(化学或生物学),通过操纵这些核酸分子被转录的效率、所得到的转录物被翻译的效率和翻译后修饰的效率,或通过“敲除”基因的内源性拷贝来实现。基因的“敲除”是指一种分子生物学技术,利用其使生物体中的基因不起作用,使得基因的表达大幅度降低或消除。可替代地,酶的活性可以被上调。本文还考虑下调一种或多种酶的活性,同时上调一种或多种酶的活性以实现期望的结果。
优选地,经遗传修饰的生物体是经修饰的真菌,其通过降低或消除引起纤维二糖内酯/纤维二糖酸和/或葡糖酸内酯/葡萄糖酸形成的酶活性而被修饰。引起纤维二糖内酯/纤维二糖酸和/或葡萄糖酸内酯/葡萄糖酸形成的酶包括:纤维二糖脱氢酶(CDH),但也可以包括:葡萄寡糖脱氢酶、葡萄糖脱氢酶、葡萄寡糖氧化酶、纤维二糖氧化酶、葡萄糖氧化酶以及铜依赖性多糖单加氧酶(或GH61或具有纤维素分解增强活性的多肽)。缺乏编码引起纤维二糖内酯/纤维二糖酸和/或葡萄糖酸内酯/葡萄糖酸形成的酶的功能基因的这类真菌菌株可以例如通过基因缺失、基因破坏、基因沉默或突变;或通过基因表达调节序列(如启动子序列、终止子序列、启动子激活序列和编码转录因子的序列)的缺失、破坏或突变;或通过对编码引起纤维二糖内酯/纤维二糖酸和/或葡萄糖酸内酯/葡萄糖酸形成的酶的基因进行随机或定点突变而产生。
优选地,修饰的真菌是以下经修饰的真菌,其中编码负责产生选自纤维二糖内酯、纤维二糖酸、葡萄糖酸内酯和葡萄糖酸的一种或多种产物的酶(编码纤维二糖脱氢酶(CDH))的一种或多种基因被缺失、破坏或突变。优选地,该一个或多个基因编码具有纤维二糖脱氢酶(CDH)的氨基酸序列的酶,所述酶选自与SEQ ID NO:4-6的任何多肽具有至少90%、95%或99%同源性的多肽的组。修饰的真菌可以是以下经修饰的真菌,其中编码纤维二糖脱氢酶(CDH)CDH1(SEQ ID NO:4)、CDH2(SEQ ID NO:5)或CDH3(SEQ ID NO:6)的基因被缺失、破坏或突变。优选地,修饰的真菌是以下真菌,其中当通过铁氰化物还原测定法测量时,CDH活性被降低约50%至约100%,或至少75%、90%或95%。优选地,敲除嗜热毁丝霉Cl中编码CDH1(SEQ ID NO:4)或编码CDH2(SEQ ID NO:5)的基因。更优选地,敲除嗜热毁丝霉Cl中的编码CDH1和CDH2的基因两者(双重敲除)。可以通过各种遗传方法(如基因缺失、基因破坏或突变)中的任何一种产生以下真菌菌株,其缺乏编码引起纤维二糖内酯、纤维二糖酸、葡萄糖酸内酯或葡萄糖酸形成的酶的功能基因。
“木糖低聚物”在本文中被定义为在木聚糖主链中的β-1,4键断裂后而产生的低聚物。优选地,木糖低聚物是任选取代的β-(1→4)-连接的木聚糖,其由2至50或2至30,或优选2至15或2至10,或最优选2至7个木聚糖残基组成。经取代的木糖低聚物可以是但不限于阿拉伯糖-、乙酰基-、葡糖醛酸-和/或甲基葡糖醛酸-取代的木糖低聚物。“氧化的木糖低聚物”是木糖低聚物的C1-和/或C4-碳原子被氧化的木糖低聚物。
“葡糖低聚物”在本文中被定义为在纤维素主链中的β-1,4键断裂后而产生的低聚物。优选地,葡糖低聚物是β-(1→4)-连接的葡聚糖,其由2至50或2至30,或优选2至15或2至10,或最优选2至6个葡聚糖残基组成。“氧化的葡糖低聚物”是葡糖低聚物的C1-和/或C4-碳原子被氧化的葡糖低聚物。
当与数值相关联地使用时(大约10、约10),词“大约(approximately)”或“约(about)”优选地意味着该值可以是值的或多或少10%的给定值。
在本文件及其权利要求中,动词“包含”及其词形变化在其非限制意义上被用来表示包括该词后面的项目,但不排除未明确提到的项目。另外,通过不定冠词“一个(a)”或“一种(an)”提及一种要素时不排除多于一种要素存在的可能性,除非上下文清楚地要求存在一种并仅有一种要素。不定冠词“一个”或“一种”因此通常意指“至少一种”。
在本说明书中引用的全部专利和参考文献通过引用以其全部内容结合在此。
具体实施方式
本发明涉及新发现的酶活性,即涉及通过溶解性多糖单加氧酶(LPMO)进行的对木聚糖的氧化裂解。诸位发明人发现LPMO显示木聚糖中的β-1,4糖基键在形成氧化的木糖低聚物时的断裂,同时在纤维素形成氧化的葡糖低聚物中同时切割β-1,4糖基单元。对于这一活性,LPMO需要分子氧和电子供体用于其活性。此外,LPMO显示出对由纤维素形成低聚物的与水解酶(如内切葡聚糖酶I)的较强的协同效应。LPMO的作用方式对于松动植物生物质中的刚性木聚糖纤维素多糖基质可以是重要的,从而增加其他酶对基质的可及性。这种松动还可以改善植物生物质的纤维素水解。
在第一方面,本发明提供了一种降解和/或改性含木聚糖的底物中的木聚糖的方法,其中所述方法包括使含木聚糖的底物与溶解性多糖单加氧酶(LPMO)进行接触的步骤。优选地,用于在本发明的方法中使用的LPMO是AA9家族的LPMO。优选地,LPMO属于PMO1亚组,其在由His1His68和Tyr153配位的活性位点中具有二价金属离子。此外,优选LPMO的位置38、126、156和208上的氨基酸是半胱氨酸。优选地,位置191处的氨基酸是天冬酰胺。优选地,N-末端组氨酸被甲基化。
优选地,LPMO可从毁丝霉属的真菌获得。优选地,该真菌属于嗜热毁丝霉物种。“可从……获得”在本文中将被理解为所述酶来源于指出的生物体,即由指出的生物体天然产生作为天然酶。更优选地,LPMO来源于嗜热毁丝霉C1真菌或其衍生物,如选自以下各项的嗜热毁丝霉C1真菌:Garg 27K(登录号VKM F-3500D)、UV13-6(登录号VKM F-3632D)、NG7C-19(登录号VKM F-3633D)、UV18-25(登录号VKM F-3631D)、菌株W1L(登录号CBS122189)或W1L#100L(登录号CBS122190),优选嗜热毁丝霉C1(登录号VKM F-3500D)。
优选地,用于在本发明的方法中使用的LPMO是如本文定义的具有SEQ ID NO:1的氨基酸序列的酶或蛋白质,其在本文中定义为MtLPMO9A。包括信号序列的MtLPMO9A的氨基酸序列由SEQ ID NO:2定义。还优选用于在本发明的方法中使用的是包含以下氨基酸序列或由其组成的LPMO,所述氨基酸序列与SEQ ID NO:1至少50%、60%、70%、80%,更优选至少90%、91%、92%、93%、94%,甚至更优选至少95%、96%、97%、98%,或至少99%同一。用于在本发明的方法中使用的LPMO可以是如本文所定义的MtLPMO9A的同源物、变体或片段。用于在本发明的方法中使用的LPMO可以是如本文所定义的修饰的MtLPMO9A。所述同源物或变体可以包括来自其他生物体的相关蛋白质或给定蛋白质的修饰形式。
优选地,用于在本发明的方法中使用的LPMO能够氧化具有β-1,4-连接的木聚糖主链的底物,该LPMO在本文中表示为具有木聚糖氧化活性。优选地,本发明的方法是用于木聚糖氧化,即优选地本发明的方法中的木聚糖降解和/或修饰是木聚糖氧化,优选导致生成氧化的木糖低聚物。
优选地,用于在本发明的方法中使用的LPMO具有至少10%、20%、30%、40%,优选地至少50%、60%、70%、80%,更优选地至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或最优选地至少100%的MtLPMO9A的木聚糖氧化活性,如通过本领域已知的用于评估木聚糖氧化活性的方法(优选地通过使用如本文例示的测定)而评估的。简言之,在所述测定中,在补料分批过程(pH 6.0;32℃)中的葡萄糖限制下产生的、需要评估其活性的LPMO在无蛋白酶/(半)纤维素酶的C1表达宿主(LC菌株)中表达,如前所述(27),产生富含LPMO的粗酶提取物,其中将LPMO从该粗酶提取物用如在SI(支持信息)材料和方法(SI(Supporting Information)Materials and Methods,在实施例部分中提供)中所述的三个连续色谱步骤进行纯化,然后分析获得的所有级分的蛋白质含量(SI材料和方法)。优选地,再生的无定形纤维素(RAC)被用作评估木聚糖氧化活性的底物。再生的无定形纤维素(RAC)由PH-101(西格玛-奥德里奇公司(Sigma-Aldrich);包含2%w/w木聚糖)通过以下方式制备:用0.6mL水润湿Avicel(100mg)并缓慢添加10mL的86.2%邻-磷酸,然后剧烈搅拌30分钟直到Avicel完全溶解。此后,在逐步添加40mL水期间,使溶解的纤维素沉淀。将通过离心(4000g,4℃下12min)得到的沉淀物用水洗涤两次并用2M碳酸钠中和。将沉淀物再次用水洗涤(三次),并将最终的沉淀物悬浮在水中,直到最终干物质含量为1.4±0.1g/100g RAC悬浮液。通过将RAC(1-2mg/mL)溶解在添加有抗坏血酸(终浓度为1mM)的50mM乙酸铵缓冲液(pH 5.0)中,来评估对该RAC的木聚糖氧化活性。添加LPMO(12.5μg/mg底物),并在50℃下在头尾旋转器中以1mL总体积分部分(旋转器,毕比科技有限公司(Bibby Scientific LTD),斯通(Stone),英国)在20rpm下孵育24小时。通过如SI材料和方法中所述的HPAEC和MALDI-TOF MS来评估氧化的木糖低聚物的量,并与通过用MtLPMO9A进行相同测定而产生的氧化的木糖低聚物的量进行比较,该MtLPMO9A在完全相同的条件下被表达、生产和纯化。
优选地,用于在本发明的方法中使用的LPMO是包含以下氨基酸序列或由其组成的酶或蛋白质,该氨基酸序列与SEQ ID NO:1至少50%、60%、70%、80%,更优选地至少90%、91%、92%、93%、94%,甚至更优选地至少95%、96%、97%、98%,或至少99%同一,具有至少10%、20%、30%、40%,优选的至少50%、60%、70%、80%,更优选地至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或最优选地至少100%的MtLPMO9A的木聚糖氧化活性。
本发明的方法优选在有氧条件下进行。“有氧条件(aerobic conditions)”或“有氧条件(oxic conditions)”在本文中被定义为在氧气存在下运行并且其中消耗氧(优选以至少0.5、1、2、5、10、20或50mmol/L/h的速率)的条件或过程,其中如本文所示的有机分子、还原剂和/或酶充当电子供体并且氧充当电子受体。
优选地,本发明的方法进一步包括使含木聚糖的底物与电子供体进行接触。优选地,该电子供体是还原剂或酶如纤维二糖脱氢酶(CDH)。涵盖在本发明的方法中的是以下方法,其中将LPMO和电子供体(即酶或还原剂)顺序地或同时地与含木聚糖的底物进行接触。优选地,在本发明的方法中,LPMO和电子供体同时地与含木聚糖的底物进行接触。还涵盖在本发明的方法中的是已经包含所述电子供体的含木聚糖的底物。用作电子供体的还原剂可以选自但不限于谷胱甘肽、抗坏血酸盐、氢化铝锂(LiAlH4)、新生(原子)氢、钠汞齐、乙硼烷、硼氢化钠(NaBH4)、含Sn2+离子的化合物如氯化锡(II)、亚硫酸盐化合物、肼(Wolff-Kishner还原)、锌汞齐(Zn(Hg))、二异丁基氢化铝(DIBAL-H)、林德拉(lindlar)催化剂、草酸(C2H2O4)、甲酸(HCOOH)、抗坏血酸(C6H8O6)、亚磷酸酯、次磷酸盐和亚磷酸、二硫苏糖醇(DTT)、含Fe2+离子的化合物如硫酸铁(II)、一氧化碳(CO)、碳(C)以及三(2-羧乙基)膦HCl(TCEP)。本发明的方法的还原剂还可以是不同还原剂的组合,优选如本文所示的还原剂的组合。
用于在本发明的方法中使用的电子供体的量应理解为取决于组合物中存在的LPMO的量。优选地,电子供体的量是足够的,以便不对LPMO对如本文定义的组合物的氧化活性进行速率限制。优选地,用于在本发明的方法中使用的电子供体的量是相当于0.1-20mM,优选相当于0.1-10mM,更优选相当于0.5-5mM,最优选相当于约1mM的抗坏血酸的量(“约”在本文中将理解为+/-10%)。“相当于”在这里被理解为具有可比较或相似的还原能力。
在一个实施例中,本发明的方法进一步包括使含木聚糖的底物与纤维素进行接触,其中优选所述纤维素经由氢键与木聚糖缔合或能够与木聚糖缔合,更优选所述纤维素是半纤维素缔合纤维素和/或无定形纤维素,任选地是再生的无定形纤维素(RAC)。优选地,用于在本发明的方法中使用的含木聚糖的底物进一步与导致所希望的木聚糖和/或葡聚糖降解和/或改性的量的所述纤维素进行接触,这可以使用如本文所述的测定来评估。优选地,本发明的方法包括在本发明的方法中的含木聚糖的底物是游离的或仅包含少量所述纤维素的情况下,使含木聚糖的底物与所述纤维素进行接触。在该实施例中,优选地,所述含木聚糖的底物包含能够与所述纤维素缔合(优选地形成氢键)的木聚糖。优选地,所述含木聚糖的底物包含由大的未取代的线性木聚糖链组成的木聚糖,优选例如存在于本文所示实例中使用的燕麦斯佩耳特木聚糖(oat spelt xylan)和桦木木聚糖中。优选地,所述含木聚糖的底物不仅仅由具有存在于β-1,4-木聚糖主链上的阿拉伯糖基取代基的木聚糖(例如存在于如本文所示实例中所使用的小麦阿拉伯木聚糖中的支链木聚糖)组成,或优选不主要包含它,或甚至更优选不包含它。优选地,在含木聚糖的底物中待降解和/或改性的木聚糖是由大的未取代的线性木聚糖链组成的木聚糖,优选例如存在于本文所示实例中使用的燕麦斯佩耳特木聚糖和桦木木聚糖中。优选地,在含木聚糖的底物中待降解和/或改性的木聚糖不是具有存在于β-1,4-木聚糖主链上的阿拉伯糖基取代基的木聚糖(例如存在于如本文所示实例中所使用的小麦阿拉伯木聚糖中的支链木聚糖)。
在另一个实施例中,用于在本发明的方法中使用的含木聚糖的底物包括与纤维素缔合(优选经由氢键)的木聚糖。优选地,所述含木聚糖的底物包含与半纤维素缔合的纤维素。优选地,所述含木聚糖的底物包含无定形纤维素,任选地是再生的无定形纤维素(RAC)。在一个优选的实施例中,在本发明的方法中待降解和/或改性并包含在如本文定义的含木聚糖的底物内的木聚糖与纤维素缔合,优选地经由氢键。优选地,所述木聚糖和与半纤维素缔合的纤维素和/或无定形纤维素(任选地是再生的无定形纤维素(RAC))缔合。优选地,所述木聚糖包含在再生的无定形纤维素(RAC)中,优选地其中所述RAC可按照本文进一步例示的而获得。优选地,用于在本发明的方法中使用的含木聚糖的所述底物包含一定量的纤维素、与如本文所示的纤维素缔合的木聚糖、与半纤维素缔合的纤维素和/或无定形纤维素(任选地是再生的无定形纤维素(RAC)),该量导致所希望的木聚糖和/或葡聚糖降解和/或改性,这可以使用如本文所述的测定来评估。
优选地,用于在本发明的方法中使用的含木聚糖的述底物包含或进一步与一定量的纤维素、与半纤维素缔合的纤维素和/或无定形纤维素(任选地是再生的无定形纤维素(RAC))进行接触,该量导致所希望的木聚糖和/或葡聚糖降解和/或改性,这可以使用如本文所述的测定来评估。
优选地,本发明的方法中的含木聚糖的底物包含如本文所定义的电子供体和/或纤维素或进一步与其进行接触。
优选地,本发明的方法进一步包括葡聚糖降解和/或改性。优选地,用于在本发明的方法中使用的LPMO除了氧化具有β-1,4-连接的木聚糖主链的底物之外,还氧化具有β-1,4-连接的葡聚糖的底物。氧化具有β-1,4-连接的葡聚糖底物在本文中表示为具有葡聚糖氧化活性。优选地,用于在本发明的方法中使用的LPMO具有至少10%、20%、30%、40%,优选地至少50%、60%、70%、80%,更优选地至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或最优选地至少100%的MtLPMO9A的葡聚糖氧化活性,通过使用本领域已知的用于评估葡聚糖氧化活性的方法进行评估,优选通过使用如本文例示的测定法,即与上述用于评估木聚糖氧化活性的相同测定法,其中通过如在SI材料和方法中所述的HPAEC和MALDI-TOF MS评估氧化的葡糖低聚物的量,并与通过用MtLPMO9A进行相同测定产生的氧化的葡糖低聚物的量进行比较,该MtLPMO9A在完全相同的条件下被表达、生产和纯化。
优选地,用于在本发明的方法中使用的LPMO是包含以下氨基酸序列或由其组成的酶或蛋白质,该氨基酸序列与SEQ ID NO:1至少50%、60%、70%、80%,更优选地至少90%、91%、92%、93%、94%,甚至更优选地至少95%、96%、97%、98%,或至少99%同一,具有至少10%、20%、30%、40%,优选地至少50%、60%、70%、80%,更优选地至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或最优选地至少100%的MtLPMO9A的葡聚糖氧化活性。
甚至更优选地,用于在本发明的方法中使用的LPMO是包含以下氨基酸序列或由其组成的酶或蛋白质,该氨基酸序列与SEQ ID NO:1至少50%、60%、70%、80%,更优选地至少90%、91%、92%、93%、94%,甚至更优选地至少95%、96%、97%、98%,或至少99%同一,具有至少10%、20%、30%、40%,优选地至少50%、60%、70%、80%,更优选地至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或最优选地至少100%的MtLPMO9A的木聚糖氧化活性以及至少10%、20%、30%、40%,优选地至少50%、60%、70%、80%,更优选地至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或最优选地至少100%的MtLPMO9A的葡聚糖氧化活性。
优选地,本发明的方法进一步包括使含木聚糖的底物与一种或多种另外的酶进行接触。涵盖在本发明的方法中的是以下方法,其中将LPMO和一种或多种另外的酶顺序地或同时地与含木聚糖的底物进行接触。在一个实施例中,LPMO和一种或多种另外的酶同时地与含木聚糖的底物进行接触。在另一个实施例中,LPMO和一种或多种另外的酶顺序地与含木聚糖的底物进行接触。优选地,在其中所述一种或多种另外的酶是辅酶和/或在预处理步骤中使用的酶的实施例中,在将含木聚糖的底物与LPMO接触之前将所述一种或多种另外的酶与含木聚糖的底物进行接触。还涵盖在本发明的方法中的是已经包含所述一种或多种另外的酶的含木聚糖的底物。
优选地,本发明的方法中的含木聚糖的底物包含本文所定义的电子供体和一种或多种另外的酶或进一步与其进行接触。优选地,本发明的方法中的含木聚糖的底物包含本文所定义的一种或多种另外的酶和纤维素或进一步与其进行接触。优选地,本发明的方法中的含木聚糖的底物包含本文所定义的电子供体、纤维素和一种或多种另外的酶或进一步与其进行接触。诸位发明人发现MtLPMO9A和源自绿色木霉的内切葡聚糖酶I对形成纤维素缔合半纤维素的低聚物形式具有较强的协同作用。因此,优选地,另外的酶或至少一种另外的酶是如本文所定义的糖基水解酶。优选地,所述糖基水解酶是如本文所定义的纤维素酶。更优选地,所述纤维素酶是如本文所定义的内切葡聚糖酶。优选地,所述内切葡聚糖酶可从选自下组的属的丝状真菌获得,该组由以下各项组成:金孢子菌属、梭孢壳属、Rasamsonia、脉孢菌属、短梗霉属、线黑粉菌科(Filibasidium)、梨囊鞭菌属、棒囊孢壳菌、隐球菌属、支顶孢属、弯颈霉属、柱顶孢霉属、裂褶菌属、侧孢霉属、青霉属、赤霉属、毁丝霉属、毛霉属、曲霉属、镰孢菌属、腐质霉属、木霉属、踝节菌属、以及Rasamsonia。优选地,所述内切葡聚糖酶是内切葡聚糖酶I。优选地,所述内切葡聚糖酶I来源于绿色木霉或嗜热毁丝霉,最优选地来自嗜热毁丝霉。优选地,用于在本发明的方法中使用的内切葡聚糖酶是具有SEQ ID NO:3的氨基酸序列的酶或蛋白质,其在本文中定义为TvEG I。还优选的是内切葡聚糖酶在本发明的方法中的使用,其中所述内切葡聚糖酶是包含以下氨基酸序列或由其组成的酶或蛋白质,所述氨基酸序列与SEQ ID NO:3至少50%、60%、70%、80%,更优选至少90%、91%、92%、93%、94%,甚至更优选至少95%、96%、97%、98%,或至少99%同一。
优选地,用于在本发明的方法中使用的内切葡聚糖酶是具有SEQ ID NO:10的氨基酸序列的酶或蛋白质,其在本文中定义为MtEG VIII。还优选的是内切葡聚糖酶在本发明的方法中的使用,其中所述内切葡聚糖酶是包含以下氨基酸序列或由其组成的酶或蛋白质,所述氨基酸序列与SEQ ID NO:10至少50%、60%、70%、80%,更优选至少90%、91%、92%、93%、94%,甚至更优选至少95%、96%、97%、98%,或至少99%同一。
优选地,用于在本发明的方法中使用的内切葡聚糖酶是具有SEQ ID NO:14(MtEG II)、SEQ ID NO:18(MtEG I)、SEQ ID NO:22(MtEG III)、SEQ ID NO:26(MtEG V)或SEQ ID NO:30(MtEG VI)的氨基酸序列的酶或蛋白质。还优选的是内切葡聚糖酶在本发明的方法中的使用,其中所述内切葡聚糖酶是包含以下氨基酸序列或由其组成的酶或蛋白质,所述氨基酸序列与SEQ ID NO:14、18、22、26或30至少50%、60%、70%、80%,更优选至少90%、91%、92%、93%、94%,甚至更优选至少95%、96%、97%、98%,或至少99%同一。SEQ ID NO:14、18、22、26和30是成熟酶(分别为MtEG II、MtEG I、MtEG III、MtEG V和MtEG VI)的氨基酸序列。包括信号序列的这些酶的氨基酸序列由MtEG II的SEQ ID NO:13、MtEG I的SEQ ID NO:17、MtEG III的SEQ ID NO:21、MtEG V的SEQ ID NO:25、以及MtEG VI的SEQ ID NO:19定义。
优选地,与仅使用相同量和/或浓度的如本文所定义的内切葡聚糖酶相比,包含如本文所定义的LPMO和内切葡聚糖酶两者的组合物导致葡聚糖降解活性,优选纤维素酶降解活性的增加。优选地,通过本领域已知的测定法,优选地通过如上文详述的用于评估葡聚糖氧化活性的测定法评估葡聚糖降解活性,其中通过如SI材料和方法中所述的HPAEC和MALDI-TOF MS来评估葡糖低聚物的量。将针对活性而使用LPMO和内切葡聚糖酶的组合时形成的葡糖低聚物的量与完全相同的条件下通过单独地用内切葡聚糖酶进行相同的测定而产生的葡糖低聚物的量进行比较,其中优选地单独地或在包含LPMO的组合物中的内切葡聚糖酶的量为100μg/g底物。优选地,与单独使用内切葡聚糖酶(100μg/g底物)相比,LPMO(10mg/g底物)和内切葡聚糖酶(100μg/g底物)的组合导致至少10%、20%、30%、40%,优选至少50%、60%、70%、80%,更优选至少90%、100%、110%、120%,或最优选至少130%、140%、150%或160%的葡糖低聚物生产的增加。
优选地,本发明的方法包括纤维素和/或与半纤维素缔合的纤维素的降解和/或改性。
用于在本发明的方法中使用的“一种或多种另外的酶”可以包含在多酶组合物中。本文将“多酶组合物”定义为包含至少另外一种适用于在如下文详述的本发明的方法中使用的酶。本文所披露的蛋白质的任何组合适用于在本发明的方法的多酶组合物中使用。应当理解,本文具体描述的任何酶可以与本文所述的任何一种或多种酶或任何其他可用且适合的酶进行组合以产生多酶组合物。本发明不局限或受限于下面列出的具体示例性组合。多酶组合物的一种或多种组分(本发明的蛋白质以外)可以从微生物、植物或其他来源或其组合获得或衍生,并且将含有能够进行氧化还原反应的酶。包括在本发明方法的多酶组合物中的酶的实例包括氧化酶、加氧酶、单加氧酶、贝耶尔维利格单加氧酶、双加氧酶、过氧化物酶、脱氢酶、催化氧化还原反应的还原酶。
该多酶组合物可以包含用于降解具有生物活性的木质纤维素和/或半纤维素材料或其片段的酶。在缺乏形成纤维二糖内酯/纤维二糖酸和/或葡萄糖酸内酯/葡萄糖酸的酶情况下,该多酶组合物可以进一步包含至少一种纤维二糖水解酶、至少一种木聚糖酶、至少一种内切葡聚糖酶、至少一种β-葡糖苷酶、至少一种β-木糖苷酶以及至少一种辅酶。在缺乏形成纤维二糖内酯/纤维二糖酸和/或葡萄糖酸内酯/葡萄糖酸的酶情况下,木聚糖酶可以选自下组,该组由以下各项组成:内切木聚糖酶、外切木聚糖酶和β-木糖苷酶。在缺乏形成纤维二糖内酯/纤维二糖酸和/或葡萄糖酸内酯/葡萄糖酸的酶情况下,辅酶包括选自下组的酶,该组由以下各项组成:纤维素酶、葡糖苷酶、铜依赖性多糖单加氧酶(或GH61或具有纤维素分解增强活性的多肽)、木聚糖酶、木糖苷酶、木质素酶、葡萄糖醛酸酶、阿拉伯呋喃糖苷酶、阿拉伯糖酶、阿拉伯半乳聚糖酶、阿魏酸酯酶、脂肪酶、果胶酶、葡甘聚糖酶、淀粉酶、昆布多糖酶、木葡聚糖酶、半乳聚糖酶、半乳糖苷酶、葡糖淀粉酶、果胶酸裂解酶、壳聚糖酶、外切-β-D-葡糖胺酶、纤维二糖脱氢酶以及乙酰木聚糖酯酶。该多酶组合物可以进一步包含至少一种半纤维素酶。半纤维素酶可以选自下组,该组由以下各项组成:木聚糖酶、阿拉伯呋喃糖苷酶、乙酰木聚糖酯酶、葡萄糖醛酸酶、内切半乳聚糖酶、甘露聚糖酶、内切阿拉伯糖酶、外切阿拉伯糖酶、外切半乳聚糖酶、阿魏酸酯酶、半乳甘露聚糖酶、木葡聚糖酶及其混合物。在缺乏形成纤维二糖内酯/纤维二糖酸和/或葡萄糖酸内酯/葡萄糖酸的酶情况下,木聚糖酶可以选自下组,该组由以下各项组成:内切木聚糖酶、外切木聚糖酶和β-木糖苷酶。该多酶组合物可以进一步包含至少一种纤维素酶。该多酶组合物可以是粗发酵产物。该多酶组合物可以是经过纯化步骤的粗发酵产物。该多酶组合物可以进一步包含一种或多种辅酶。辅酶可以包括至少一种选自下组的酶,该组由以下各项组成:纤维素酶、葡糖苷酶、铜依赖性多糖单加氧酶(或GH61或具有纤维素分解增强活性的多肽)、木聚糖酶、木糖苷酶、木质素酶、葡萄糖醛酸酶、阿拉伯呋喃糖苷酶、阿拉伯糖酶、阿拉伯半乳聚糖酶、阿魏酸酯酶、脂肪酶、果胶酶、葡甘聚糖酶、淀粉酶、昆布多糖酶、木葡聚糖酶、半乳聚糖酶、半乳糖苷酶、葡糖淀粉酶、果胶酸裂解酶、壳聚糖酶、外切-β-D-葡糖胺酶、纤维二糖脱氢酶、乙酰木聚糖酯酶以及乙酰酯酶。辅酶可以作为粗品或半纯化的酶混合物而被添加。在一些实施例中,通过在底物上培养至少一种生物体以产生酶来生产辅酶。该多酶组合物可以进一步包含用于降解含阿拉伯木聚糖的材料的至少一种蛋白质或其具有生物活性的片段。该多酶组合物可以进一步包含至少一种内切木聚糖酶、至少一种β-木糖苷酶和至少一种阿拉伯呋喃糖苷酶。阿拉伯呋喃糖苷酶可以包含对单取代的木糖残基具有特异性的阿拉伯呋喃糖苷酶、对双取代的木糖残基具有特异性的阿拉伯呋喃糖苷酶或其组合。
本发明的方法中的多酶组合物还可以包括纤维素酶、半纤维素酶(如木聚糖酶,包括内切木聚糖酶、外切木聚糖酶和β-木糖苷酶;甘露聚糖酶,包括内切甘露聚糖酶、外切甘露聚糖酶和β-甘露糖苷酶)、木质素酶、淀粉酶、葡萄糖醛酸酶、蛋白酶、酯酶(包括阿魏酸酯酶)、脂肪酶、葡糖苷酶(如β-葡糖苷酶)以及木葡聚糖酶。虽然该多酶组合物可以含有许多类型的酶,但是也考虑了包含使从生物质的糖释放增加或增强的酶的混合物,该混合物可以包括半纤维素酶。
在一个实施例中,半纤维素酶选自木聚糖酶、阿拉伯呋喃糖苷酶、乙酰木聚糖酯酶、葡萄糖醛酸酶、内切半乳聚糖酶、甘露聚糖酶、内切阿拉伯聚糖酶、外切阿拉伯糖酶、外切半乳聚糖酶、阿魏酸酯酶、半乳甘露聚糖酶、木葡聚糖酶,或这些中的任何一种的混合物。具体地,所述酶可以包括葡糖淀粉酶、β-木糖苷酶和/或β-葡糖苷酶。
还优选的是包含能够降解细胞壁并释放细胞内容物的酶的混合物。该多酶组合物中的酶可以由各种来源提供。在一个实施例中,可以通过生长天然地产生酶或通过遗传修饰以表达该一种或多种酶的生物体如细菌、藻类、真菌和植物来生产酶。在另一个实施例中,该多酶组合物中的至少一种酶是可商购的酶。在一些实施例中,该多酶组合物包含辅酶。辅酶可以具有与酶核心组中的一种或多种酶相同或相似的功能或不同的功能。这些酶已经在本文其他地方描述,并且通常可以包括例如纤维素酶、木聚糖酶、木质素酶、淀粉酶、脂质酶或葡萄糖醛酸酶。一些辅酶例如可以包括当在反应中与生物质接触时允许增加多酶组合物中酶(例如,半纤维素酶)活性的酶。辅酶或酶混合物可以由来自以下各项的酶构成:(1)商业供应商;(2)表达酶的克隆基因;(3)复合培养液(例如由培养基中的微生物菌株生长而产生的培养液,其中菌株将蛋白质和酶分泌到培养基中);(4)如(3)中生长的菌株的细胞裂解液;以及(5)表达能够降解木质纤维素的酶的植物材料。在一些实施例中,该辅酶是葡糖淀粉酶、果胶酶或木质素酶。
在一个实施例中,本发明的方法是由降解生物质和/或木质纤维素材料,优选如本文所定义的富含半纤维素的生物质获得可发酵产物,例如糖。优选地,所述木质纤维素材料是农业废物或由农业和林业生产的残余物。木质纤维素材料可部分或完全降解成可发酵糖。考虑到商业上可行的成本降低的经济水平。部分由于包含生物质和木质纤维素材料的许多组分,所以需要能够降解木聚糖、木质素、蛋白质和糖类的酶或酶的混合物来实现糖化。优选地,所述一种或多种另外的酶包括具有例如氧化还原酶、纤维二糖水解酶、内切葡聚糖酶、β-葡糖苷酶、木聚糖酶和其他半纤维素酶活性的酶或其组合物。在该实施例中,如本文所定义的,含木聚糖的底物优选地包含生物质或由其组成,优选富含半纤维素的生物质,优选纸浆。
优选地,本发明的方法是将纸浆溶解用于生产化学品,例如但不限于人造丝、玻璃纸以及若干化学品如纤维素酯(乙酸酯、硝酸酯、丙酸酯和丁酸酯)和纤维素醚(羧甲基纤维素以及甲基纤维素和乙基纤维素)以及乙醇(例如作为生物乙醇生物燃料)。还优选的是本发明的用于纸和纸浆漂白的方法。在该实施例中,含木聚糖的底物包含纸或纸浆或由其组成,优选软木浆和/或硬木浆。本发明的方法可用于改善纸浆和造纸工业中纸浆的漂白率。在漂白过程中使用木聚糖降解和/或改性酶来减少漂白化学品(如含氯化学品)的消耗,这导致对环境不利的有机氯化合物的形成减少。另外,作为木聚糖酶处理后的纸浆的漂白率更好的直接结果,可能的是生产具有高最终亮度的产品,否则这样的亮度将难以达到(例如使用过氧化物的完全无氯(TCF)漂白)。
在一个另外的实施例中,本发明提供了一种将干酒糟谷物(DDG)(优选但不限于来源于玉米的DDG)降解成糖的方法。该方法包括使DDG与如本文所定义的LPMO进行接触。在某些实施例中,至少10%的可发酵糖被释放。优选地,释放至少15%的糖,或释放至少20%的糖,或释放至少23%的糖,或释放至少24%的糖,或释放至少25%的糖,或释放至少26%的糖,或释放至少27%的糖,或释放至少28%的糖。在该实施例中,含木聚糖的底物优选地包含DDG或由其组成。
还提供了包括使木质纤维素材料与至少一种辅酶进一步接触的方法。本文其他地方已经描述了辅酶。辅酶或酶可以在本发明的方法进行时、之前或之后添加,或者可以在本发明的方法中使用的经遗传修饰的微生物中表达(内源性表达或过量表达)。当同时添加时,本发明的方法中的LPMO将与所选择的辅酶相容。当按照本发明的方法添加酶时,可以在添加辅酶之前、期间或之后将条件(如温度和pH)改变为辅酶的最佳条件。还涵盖多轮酶添加。作为遗传修饰植物的结果,辅酶也可以存在于木质纤维素材料本身中。用于发酵反应中的营养培养基还可以包含一种或多种辅酶。
在一些实施例中,本发明的方法包括预处理方法。通常,预处理方法将导致木质纤维素的组分更易于为下游应用(如通过酶的消化)所获得。预处理可以是化学、物理或生物预处理。如在DDG的情况下,木素纤维素可以预先已被处理以释放一些或全部糖。物理处理,如研磨、煮沸、冷冻、碾磨、真空浸润等也可以与本发明的方法一起使用。在一个实施例中,热处理包括将木质纤维素材料加热至121℃持续15分钟。物理处理如碾磨可以允许更高浓度的木质纤维素用于本发明的方法中。更高浓度是指约20%,至多约25%,至多约30%,至多约35%,至多约40%,至多约45%,或至多约50%的木质纤维素。木质纤维素还可以与金属离子、紫外线、臭氧等进行接触。另外的预处理方法是本领域技术人员已知的,并且可以包括例如有机溶剂处理、蒸汽闪爆处理、采用蒸汽闪爆处理的石灰浸渍、过氧化氢处理、过氧化氢/臭氧(过臭氧)处理、酸处理、稀释酸处理以及碱处理(包括氨纤维爆裂(AFEX)技术)。关于预处理技术和方法的细节可以在以下各项中找到:Wyman等人,Bioresource Tech.[生物资源技术]96:1959(2005);Wyman等人,Bioresource Tech.[生物资源技术]96:2026(2005);Hsu,"Pretreatment of biomass"In Handbook on Bioethanol:Production and Utilization[在生物乙醇:生产和利用手册中的生物质预处理],Wyman、Taylor和Francis编辑,第179-212页(1996);以及Mosier等人,Bioresource Tech.[生物资源技术]96:673(2005)。
在一些实施例中,这些方法可以全部或部分地执行一次或多次。也就是说,可以进行一次或多次预处理,随后用本发明的方法的组合物进行一个或多个反应。酶能以单一剂量添加,或者能以一系列小剂量添加。此外,整个过程可以根据需要重复一次或多次。因此,考虑到用热和酶进行一次或多次另外的处理。
上述方法导致可发酵糖的产生。在本发明的方法期间或之后,可发酵糖可以通过本领域已知的任何方法被回收和/或纯化。糖可以进行进一步处理;例如,它们还可以例如通过过滤来灭菌。
在一个另外的实施例中,本发明提供了一种用于生产有机物质的方法,其包括用有效量的、如本文定义的、用于本发明的方法的LPMO和/或一种或多种另外的酶糖化木质纤维素材料,发酵由一种或多种微生物获得的糖化的木质纤维素材料,并从发酵中回收有机物质。从生物质释放的糖可以转化为有用的发酵产物,包括但不限于氨基酸、维生素、药物制剂、动物饲料添加剂、专用化学品、化工原料、塑料、溶剂、燃料或其他有机聚合物、乳酸以及乙醇(包括燃料乙醇)。可以通过本发明的方法生产的具体产品包括但不限于生物燃料(包括乙醇);乳酸;塑料;专用化学品;有机酸,包括柠檬酸、琥珀酸、衣康酸和马来酸;溶剂;动物饲料添加剂;药物制剂;维生素;氨基酸,如赖氨酸、甲硫氨酸、色氨酸、苏氨酸和天冬氨酸;工业酶,如蛋白酶、纤维素酶、淀粉酶、葡聚糖酶、乳糖酶、脂肪酶、裂解酶、氧化还原酶和转移酶;以及化工原料。本发明的方法还可用于通过发酵微生物产生用于发酵的原料。在一个实施例中,该方法进一步包括添加至少一种发酵生物。如本文所用,“发酵生物”是指能够发酵的生物,如细菌和真菌(包括酵母)。这样的原料具有高于由释放的糖提供的营养价值的另外的营养价值。
用于在本发明的方法中使用的一种或多种另外的酶优选地还包含分解或改性木质素材料的酶组合,这减少或防止了施用的多酶组合物的其他组分的不期望的吸附。这样的酶组合或混合物可以包括多酶组合物,该多酶组合物含有宿主生物的至少一种蛋白质或来自其他微生物、植物或类似生物体的一种或多种酶或其他蛋白质。考虑了协同酶组合和相关方法。本发明包括确定用于降解每种木质素和木质纤维素材料的酶的最佳比例和组成的方法。这些方法需要测试以确定任何生物质底物有效转化成其组分糖的最佳酶组成和比例。下面的实例包括以下测定法,这些测定法可用于确定用于降解木质纤维素材料的酶的最佳比例和组成。
在另一个实施例中,本发明的方法用于澄清和/或提高过滤的速率和/或降低果汁和/或饮料(如酒和啤酒)的浑浊物形成。在该实施例中,含木聚糖的底物优选地包含来自水果或蔬菜的汁液(例如但不限于苹果汁、菠萝汁、橙汁和番茄汁、李子汁、蔓越莓汁)和/或谷物(例如但不限于大麦、玉米、小麦、黑麦、燕麦和玉蜀黍)或由其组成。在该实施例中,用于在本发明的方法中使用的一种或多种另外的酶进一步优选地包括果胶酶、羧甲基纤维素酶和/或淀粉酶。
在一个另外的实施例中,本发明的方法是用于浸渍蔬菜和/或水果。在该实施例中,含木聚糖的底物是水果和/或蔬菜。在该实施例中,用于在本发明的方法中使用的一种或多种另外的酶进一步优选地包括果胶酶、羧甲基纤维素酶和/或淀粉酶。
在另一个实施例中,本发明的方法是用于提取咖啡、植物油和淀粉。
在另一个实施例中,本发明的方法是用于木糖醇的生产,木糖醇是在药物制剂和食品工业中都有应用的有价值的甜味剂。
在另一个实施例中,本发明的方法是用于提高动物饲料或动物食品(例如但不限于农业青贮饲料和谷物饲料)的可消化性和/或营养特性。优选地,用于在本发明的方法中使用的LPMO可以存在于优选用于单胃动物(例如,家禽或猪)的饲料预混物和/或动物饲料中。所述动物饲料优选地含有谷类(例如大麦、小麦、玉蜀黍、黑麦或燕麦)或谷类副产物。优选地,该实施例中的含木聚糖的底物包含谷物和/或谷物溶液或由其组成。如本文所定义的本发明的方法中的组合物改善了植物细胞壁的分解,这导致动物更好地利用植物营养物。这导致了改善的生长率和饲料转化。同样,可以减小包含木聚糖的饲料的黏度。优选地,在该实施例中,含木聚糖的底物包含动物饲料(例如但不限于农业青贮饲料和谷物饲料,优选包括谷物)或由其组成。
在另一个实施例中,本发明的方法是提高烘焙产品的质量和/或改善烘焙产品(例如但不限于面包)的质地特征(破碎和切碎质量以及面包屑质量)。优选地,应用本发明的方法以增加烘焙产品(例如,高膨胀的和/或光面的全谷物面包)的体积。在该实施例中,用于在本发明的方法中使用的一种或多种另外的酶进一步优选地包括纤维素酶,例如β-葡聚糖酶、纤维素酶、纤维二糖水解酶和/或β-葡糖苷酶。优选地,该纤维素酶制剂是纤维素酶和/或半纤维素酶的复合物,其优选地从木霉属物种,更优选地从里氏木霉获得。还优选地是从曲霉属获得,优选地从黑曲霉获得的纤维素酶制剂。适合的纤维素酶组合物可以是CELLUCLASTTM(可得自诺维信公司)或者XU、XE、X-cell或W(全部可得自DSM公司)。用于在本发明的方法中使用的一种或多种另外的酶可以进一步包含另外的酶,例如葡糖淀粉酶、α-淀粉酶、木聚糖酶、蛋白酶、脂肪酶、磷脂酶,这些另外的酶可以与生面团或组合物中的LPMO一起使用。另外的酶可以具有任何来源,包括哺乳动物和植物,并且优选地具有来自微生物(细菌、酵母或真菌)来源。用于在本实施例中使用的葡糖淀粉酶还包括与黑曲霉G1或G2葡糖淀粉酶(Boel等人(1984),EMBO J.[欧洲分子生物学学会杂志]3(5),第1097-1102页)、披露于WO 84/02921中的泡盛酒曲霉葡糖淀粉酶或米曲霉葡糖淀粉酶(Agric.Biol.Chem.[农业与生物化学](1991)55(4),第941-949页)的氨基酸序列具有至少50%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性的葡糖淀粉酶。该淀粉酶可以是真菌或细菌性的,例如来自嗜热脂肪芽孢杆菌的麦芽α-淀粉酶或来自芽孢杆菌属(例如地衣芽孢杆菌或解淀粉芽孢杆菌)的α-淀粉酶,例如来自植物(例如大豆)或来自微生物来源(例如芽孢杆菌属)的β-淀粉酶,例如来自黑曲霉的葡糖淀粉酶,或例如来自米曲霉的真菌α-淀粉酶。适合的商业麦芽α-淀粉酶包括NOVAMYLO(诺维信公司)和(诺维信公司)。适合的商业真菌α-淀粉酶组合物包括例如BAKEZYME P 300(可得自DSM公司)和FUNGAMYL 2500 SG、FUNGAMYL 4000 BG、FUNGAMYL 800L、FUNGAMYL ULTRA BG以及FUNGAMYL ULTRA SG(可得自诺维信公司)。半纤维素酶可以是戊聚糖酶,例如可以具有微生物来源的木聚糖酶,例如源自细菌或真菌,如曲霉属的菌株(具体地是棘孢曲霉、黑曲霉、泡盛酒曲霉或塔宾曲霉),来自木霉属的菌株,例如里氏木霉,或来自腐质霉属的菌株,例如特异腐质霉。用于本发明的适合的可商购木聚糖酶制剂包括PENTOPAN MONO BG和PENTOPAN 500 BG(可得自诺维信公司)、GRINDAMYL POWERBAKE(可得自丹尼斯克公司(Danisco))、以及BAKEZYME BXP 5000和BAKEZYME BXP 5001(可得自DSM公司)。蛋白酶可以来自芽孢杆菌属,例如解淀粉芽孢杆菌。脂肪酶可以来源于嗜热丝孢菌属(腐质霉属)、根毛霉属、假丝酵母属、曲霉属、根霉属、或假单胞菌属的菌株,特别地来源于嗜热真菌(疏棉状腐质霉)、曼赫根毛霉、南极假丝酵母(C.antarctica)、黑曲霉、德氏根霉、少根根霉或洋葱假单胞菌。磷脂酶可以具有磷脂酶A1、A2、B、C、D或溶血磷脂酶活性;它可以具有或可以不具有脂肪酶活性。它可以具有动物来源,例如来自胰腺、蛇毒或蜂毒,或它可以具有微生物来源,例如来自丝状真菌、酵母或细菌,例如曲霉属或镰孢菌属,例如黑曲霉、米曲霉或尖孢镰孢菌。来自尖孢镰孢菌的优选的脂肪酶/磷脂酶披露于WO 98/26057中。而且,可以使用描述于WO 00/32758中的变体。另外的酶可以具有任何来源,包括哺乳动物和植物,并且优选具有微生物(细菌、酵母或真菌)来源,并且可以通过本领域常规使用的技术来获得。适合的磷脂酶组合物是LIPOPAN F和LIPOPAN XTRA(可得自诺维信公司)或PANAMORE GOLDEN和PANAMORE SPRING(可得自DSM公司)。在该实施例中,含木聚糖的底物优选地包含烘焙组合物或生面团(优选地包含面粉如全谷物粉)或由其组成。全谷物粉(whole meal flour)是可以通过研磨或淀粉糖化全谷物颗粒来获得的面粉。当用于烘焙时,通常将其添加到其他更精细的白色面粉中,以向成品提供营养物质(特别是纤维和蛋白质)、质地和主体。“全”一词是指以下事实:不仅将淀粉胚乳,还将麸和胚芽用于制造面粉中。
在另一个实施例中,本发明的方法用于生产可用于制药、农业和饲料产品中的木糖低聚物(XO)或氧化的木糖低聚物。已知XO具有益生效果,因为它们在上消化道中既不水解也不被吸收,并且它们通过选择性刺激结肠中一种或多种细菌的生长或活性来影响宿主,从而改善健康。此外,XO被认为可以降低胆固醇水平,维持胃肠道健康,并提高钙的生物利用度。此外,XO抑制淀粉凝沉,这改善了食物的营养和感官性质。如本文所定义的LPMO由于较低的外切木聚糖酶和/或β-木糖苷酶活性而高度适合于XO生产。这是有益的,因为外切木聚糖酶和/或β-木糖苷酶活性导致木糖的产生,这对XO产生具有抑制作用。
通常,用于在本发明的方法中使用的组合物中的LPMO的量将取决于待降解和/或改性的底物中存在的木聚糖和/或葡聚糖的量。在一些实施例中,酶(本文中应理解为LPMO和/或另外的酶)的量可以为从约0.1至约200mg酶或酶组合物/克木聚糖和/或葡聚糖;在其他实施例中,其从约3至约20mg酶或酶组合物/克木聚糖和/或葡聚糖。本发明涵盖以0.05mg(即,0.1mg、0.15mg、0.2mg……199.9mg、199.95mg、200mg)的增量使用在约0.1mg至约200mg LPMO/克木聚糖和/或葡聚糖之间的任何适合的或足够量的LPMO。
此外,用于在本发明的方法中使用的组合物中的LPMO的量可以在约0.5至约1000mg酶/kg含木聚糖的底物的干物质之间,或是0.5-100mg/kg,或0.5-100mg/kg或0.5-50mg/kg,或1-25mg/kg或1-15mg/kg,或2-10mg/kg酶/kg含木聚糖的底物的干物质。
本发明还涉及在商业过程中使用的方法,例如衣服或织物的洗涤或处理,洗涤剂方法,动物饲料、食品、烘焙、饮料、生物燃料、淀粉制备,液化,生物精制,纸张和纸浆的脱墨和生物漂白,油和垃圾分散以及废物流的处理。
用于在本发明的方法中使用的LPMO可以是如本文所定义的酶或蛋白质。用于在本发明的方法中使用的LPMO还可以是编码如本文所定义的所述LPMO的核酸分子,优选重组核酸分子和/或载体。在一个实施例中,用于在本发明的方法中使用的LPMO是无细胞组合物的一部分。在另一个实施例中,其中用于在本发明的方法中使用的LPMO是核酸分子,所述核酸分子是如本文所定义的宿主细胞的一部分,优选如本文所定义的遗传修饰的生物体,其优选地被修饰以重组表达用于在本发明的方法中使用的LPMO。优选地,编码如本文所定义的所述LPMO的核酸分子包含编码MtLPMO9A的核苷酸序列。还优选的是包含编码如本文所定义的LPMO的核苷酸序列的核酸分子,该LPMO具有以下氨基酸序列,所述氨基酸序列与SEQ ID NO:1至少50%、60%、70%、80%,更优选至少90%、91%、92%、93%、94%,甚至更优选至少95%、96%、97%、98%,或至少99%同一。优选地,所述核酸分子包含以下核苷酸序列或由其组成,该核苷酸序列与SEQ ID NO:7是至少50%、60%、70%、80%,更优选至少90%、91%、92%、93%、94%,甚至更优选至少95%、96%、97%、98%、99%或100%同一,其中SEQ ID NO:7代表编码MtLPMO9A的cDNA。优选地,所述核酸分子包含以下核苷酸序列或由其组成,该核苷酸序列与SEQ ID NO:8是至少50%、60%、70%、80%,更优选至少90%、91%、92%、93%、94%,甚至更优选至少95%、96%、97%、98%、99%或100%同一,其中SEQ ID NO:8代表编码MtLPMO9A的gDNA,其中该gDNA应理解为包含内含子序列。
优选地,在该实施例中,包含编码LPMO的核酸分子的组合物进一步包含在相同的核酸分子和/或载体内或在不同的核酸分子和/或载体上(如本文所定义)的一个或多个另外的核苷酸序列,其编码如本文所定义的一种或多种另外的酶。优选地,所述另外的核苷酸序列编码另外的酶,所述另外的酶具有SEQ ID NO:3(编码TvEG I)、SEQ ID NO:10(编码MtEG VIII)、SEQ ID NO:14(编码MtEG II)、SEQ ID NO:18(编码MtEG I)、SEQ ID NO:22(编码MtEG III)、SEQ ID NO:26(编码MtEG V)或SEQ ID NO:30(编码MtEG VI)的氨基酸序列。还优选的是编码如本文所定义的内切葡聚糖酶的另外的核苷酸序列,该内切葡聚糖酶具有以下氨基酸序列,该氨基酸序列与SEQ ID NO:3、SEQ ID NO:10、SEQ ID NO:14、SEQ ID NO:18、SEQ ID NO:22、SEQ ID NO:26或SEQ ID NO:30至少50%、60%、70%、80%,更优选至少90%、91%、92%、93%、94%,甚至更优选至少95%、96%、97%、98%,或至少99%同一。优选地,所述另外的核苷酸序列与SEQ ID NO:9至少50%、60%、70%、80%,更优选至少90%、91%、92%、93%、94%,甚至更优选至少95%、96%、97%、98%、99%或100%同一,其中SEQ ID NO:9代表编码如本文所定义的TvEG I的cDNA。优选地,所述另外的核苷酸序列与SEQ ID NO:9(编码TvEG I的cDNA)、SEQ ID NO:11(编码MtEG VIII的cDNA)、SEQ ID NO:15(编码MtEG II的cDNA)、SEQ ID NO:19(编码MtEG I的cDNA)、SEQ ID NO:23(编码MtEG III的cDNA)、SEQ ID NO:27(编码MtEG V的cDNA)、SEQ ID NO:31(编码MtEG VI的cDNA)至少50%、60%、70%、80%,更优选至少90%、91%、92%、93%、94%,甚至更优选至少95%、96%、97%、98%、99%或100%同一。优选地,所述另外的核苷酸序列与SEQ ID NO:12(编码MtEG VIII的gDNA)、SEQ ID NO:16(编码MtEG II的gDNA)、SEQ ID NO:20(编码MtEG I的gDNA)、SEQ ID NO:24(编码MtEG III的gDNA)、SEQ ID NO:28(编码MtEG V的gDNA)、SEQ ID NO:32(编码MtEG VI的gDNA)至少50%、60%、70%、80%,更优选至少90%、91%、92%、93%、94%,甚至更优选至少95%、96%、97%、98%、99%或100%同一。
在一个实施例中,本发明提供了一种用于对木聚糖进行降解和/或改性的方法,其包括在营养培养基中培养本发明的经遗传修饰的微生物,该营养培养基包含本发明的方法中的含木聚糖的底物。
在一些实施例中,多酶组合物包含微生物或微生物的粗发酵产物。粗发酵产物是指已经从微生物生物质分离(例如通过过滤)的发酵液。通常,微生物在发酵罐中生长,任选地被离心或过滤以除去生物质,并任选地被浓缩、配制并干燥以产生作为粗发酵产物的一种或多种酶或多酶组合物。在其他实施例中,将由微生物(包括如下所述的经遗传修饰的微生物)产生的一种或多种酶或多酶组合物进行一个或多个纯化步骤,如硫酸铵沉淀、色谱法和/或超滤,这些步骤导致部分纯化或纯化的该一种或多种酶。如果微生物已被遗传修饰以表达该一种或多种酶,则该一种或多种酶将包括重组酶。如果遗传修饰的微生物也天然表达用于木质纤维素糖化或本文提及的任何其他有用应用的一种或多种酶或其他酶,则该一种或多种酶可以包括天然存在的酶和重组酶两者。
优选地,用于在本发明的方法中使用的多酶组合物包含至少约500ng,并且优选至少约1μg,并且更优选至少约5μg,并且更优选至少约10μg,并且更优选至少约25μg,并且更优选至少约50μg,并且更优选至少约75μg,并且更优选至少约100μg,并且更优选至少约250μg,并且更优选至少约500μg,并且更优选至少约750μg,并且更优选至少约1mg,并且更优选至少约5mg的酶;包含本文所讨论的任何蛋白质的(分离的)蛋白质或其同源物、变体或片段。这样的多酶组合物可以包括通过蛋白质制备方法、蛋白质纯化方法或用于根据本发明的任何方法的蛋白质的制备而与蛋白质缔合的任何载体。例如,这样的载体可以包括适用于与本发明的蛋白质组合的任何适合的缓冲液、提取物或培养基,使得该蛋白质可以根据本发明用于本文所述的任何方法。
在本发明的一个实施例中,用于在本发明的方法中使用的一种或多种酶结合固体支持物,即固定化酶。如本文所用,固定化酶包括固定的分离的酶、含有本发明的一种或多种酶的固定的微生物细胞、产生本发明的一种或多种酶的其他稳定的完整细胞以及稳定的细胞/膜匀浆。稳定的完整细胞和稳定的细胞/膜匀浆包括来自表达本发明的酶的天然存在的微生物,并且优选来自如本文别处所披露的经遗传修饰的微生物的细胞和匀浆。因此,尽管下文讨论了用于固定酶的方法,但是应当理解,这样的方法同样适用于固定微生物细胞,并且在这样的实施例中,如果需要,细胞可以被裂解。在以下各项中披露了用于固定酶的各种方法:Industrial Enzymology 2nd Ed.[工业酶学,第二版],Godfrey,T.和West,S.编辑,Stockton Press[斯托克顿出版社],纽约,纽约州,1996,第267-272页;Immobilized Enzymes[固定化酶],Chibata,I.编辑,Halsted Press[霍尔斯特德出版社],纽约,纽约州,1978;Enzymes and Immobilized Cells in Biotechnology[生物技术中的酶和固定化细胞],Laskin,A.编辑,Benjamin/Cummings Publishing Co.,Inc.[本杰明和卡明斯出版有限公司],Menlo Park[门洛帕克],加利福尼亚州,1985;以及Applied Biochemistry and Bioengineering,Vol.4[应用生物化学和生物工程,第4卷],Chibata,I.和Wingard,Jr.,L.编辑,Academic Press[学术出版社],纽约,纽约州,1983。
在第二方面,本发明提供了一种从和/或包含含木聚糖的底物制备产物的方法,其中所述方法包括根据第一方面的方法,即包括本发明的第一方面的方法的至少一些步骤。涵盖在本发明中的是可从本发明的方法导出的,优选可直接导出的产物。优选地,在这方面,含木聚糖的底物包括生物质、烘焙组合物或生面团、动物饲料或饲料预混物、水果或蔬菜汁、谷物汁、木质纤维素材料、纸或纸浆、蔬菜、水果、谷物和/或谷物溶液或由其组成。其中示出了可以通过第一方面的方法形成的可能的产物,并且这些可能的产物可以是但不限于氧化的XO,氧化的GlcO,GlcO,可发酵的糖,有机化合物,生面团或烘焙组合物,面包改良剂,面粉处理剂,动物饲料或饲料预混物,水果汁、蔬菜汁和/或谷物汁,浸渍的水果或蔬菜,以及谷物溶液。从生物质释放的糖可以转化为有用的发酵产物,包括但不限于氨基酸、维生素、药物制剂、动物饲料添加剂、专用化学品、化工原料、塑料、溶剂、燃料或其他有机聚合物、乳酸以及乙醇(包括燃料乙醇)。可以通过本发明的方法生产的具体产品包括但不限于生物燃料(包括乙醇);乳酸;塑料;专用化学品;有机酸,包括柠檬酸、琥珀酸、衣康酸和马来酸;溶剂;动物饲料添加剂;药物制剂;维生素;氨基酸,如赖氨酸、甲硫氨酸、色氨酸、苏氨酸和天冬氨酸;木糖醇;工业酶,如蛋白酶、纤维素酶、淀粉酶、葡聚糖酶、乳糖酶、脂肪酶、裂解酶、氧化还原酶和转移酶;以及化工原料。本发明的方法还可以用于生产化学品,例如但不限于人造丝、玻璃纸以及若干化学品如纤维素酯(乙酸酯、硝酸酯、丙酸酯和丁酸酯)和纤维素醚(羧甲基纤维素以及甲基纤维素和乙基纤维素)以及乙醇(例如作为生物乙醇生物燃料)。
还涵盖在本发明中的是包括根据第一方面的方法的步骤的另外的方法。在一些实施例中,本发明包括但不限于另外的方法,其包括用于以下各项的根据第一方面的方法:诊断(分析)试剂盒;漂白棉;类固醇、药物制剂和其他精细化学品的不对称合成;生物催化;污染控制和碳氢化合物的氧化;工业废水的处理(排毒);土壤排毒;粘合剂的制造以及刺激免疫系统。上述这样的另外的方法的实例还可以在以下参考文献中找到:Trichoderma&Gliocladium,Volume 2,Enzymes,biological control and commercial applications[木霉属和胶枝霉属,第2卷,酶,生物防治和商业应用],编辑:Gary E.Harman、Christian P.Kubicek,Taylor&Francis Ltd.[泰勒和弗朗西斯股份有限公司]1998,393(具体地,第14、15和16章);Helmut Uhlig,Industrial enzymes and their applications[工业酶及其应用],由Elfriede M.Linsmaier-Bednar翻译并更新,John Wiley&Sons,Inc[约翰威利父子公司]1998,第454页(具体地,第5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.9、5.10、5.11、和5.13章)。对于糖化应用:Hahn-B.,Galbe,M.,Gorwa-Grauslund,M.F.Lidén,Zacchi,G.,Bio-ethanol-the fuel of tomorrow from the residues of today[生物乙醇-今天的残留物,明天的燃料],Trends in Biotechnology[生物技术趋势],2006,24(12),549-556;Mielenz,J.R.,Ethanol production from biomass:technology and commercialization status[自生物质生产乙醇的技术和商业化情况],Current Opinion in Microbiology[微生物学当前观点],2001,4,324-329;Himmel,M.E.,Ruth,M.F.,Wyman,C.E.,Cellulase for commodity products from cellulosic biomass[用于纤维素生物质商品的纤维素酶],Current Opinion in Biotechnology[微生物学当前观点],1999,10,358-364;Sheehan,J.,Himmel,M.,Enzymes,energy,and the environment:a strategic perspective on the U.S.Department of Energy's Research and Development Activities for Bioethanol[酶、能量和环境:美国能源部研究和开发生物乙醇活性的战略视角],Biotechnology Progress[生物技术进展],1999,15,817-827。对于纺织品加工应用:Galante,Y.M.,Formantici,C.,Enzyme applications in detergency and in manufacturing industries[酶在洗涤业和制造业中的应用],Current Organic Chemistry[当代有机化学],2003,7,1399-1422。对于纸浆和纸张应用:Bajpai,P.,Bajpai,P.K,Deinking with enzymes:a review.[利用酶的纸浆精化:综述],TAPPI Journal[纸浆与造纸工业技能协会志],1998,81(12),111-117;Viikari,L.,Pere,J.,A.,Oksanen,T.,Buchert,J.,Use of cellulases in pulp and paper applications.[纤维素酶在纸浆和纸张应用中的用途],在:"Carbohydrates from Trichoderma reesei and other microorganisms.Structure,Biochemistry,Genetics and Applications."[“来自里氏木霉和其他微生物的糖类,结构,生物化学,遗传与应用”]中,编辑:Mark Claessens,Wim Nerinckx和Kathleen Piens,The Royal Society of Chemistry[皇家化学学会]1998,245-254。对于食品和饮料应用:Roller,S.,Dea,I.C.M.Biotechnology in the production and modification of biopolymers for foods[食品生物聚合物的生产和修饰中的生物技术],Critical Reviews in Biotechnology[生物技术锐评],1992,12(3),261-277。另外的参考文献包括美国专利号5,529,926;美国专利号6,746,679;美国专利号7,732,178;美国专利号6,660,128;美国专利号6,093,436;美国专利号5,691,193;美国专利号5,785,811;美国专利号7,329,424。
在第三方面,本发明提供了用于或适用于在根据本发明的第一和/或第二方面的方法中的部件的试剂盒,其包含或由以下各项组成:
a)含有本发明的一方面所定义的LPMO的第一容器;以及以下各项中的至少一个,
b)含有电子供体的第二容器;和,
c)含有如第一方面所定义的一种或多种酶的第三容器。
还涵盖在本发明中的是其中包含另外的容器的部件试剂盒,这些另外的容器进一步含有一种或多种另外的酶。任选地,含有如本文所定义的LPMO的第一容器进一步包含如第一方面所定义的一种或多种另外的酶。处于单一容器中的酶组合的选择取决于这些组合的储存条件(如温度和/或储存制剂)的相容性。如果这些酶具有相容的储存条件要求,并且如果这些酶可以混合而不损失如本文所示的活性,则多种酶可以是单个容器的一部分。
在一个实施例中,第一容器包括含有根据本发明的第四方面的LPMO的液体、糊剂或固体配制品或由其组成。
优选地,第二容器的电子供体是如本发明的第一方面所定义的还原剂或酶。优选地,第三容器的一种或多种另外的酶是另外的酶,或者是如本发明的第一方面所定义的多酶组合物。优选地,至少一种另外的酶是糖基水解酶,优选如第一方面所定义的内切葡聚糖酶。
在一个优选的实施例中,所述部件试剂盒进一步包含第四容器或进一步由其组成,所述第四容器包含如本文所定义的纤维素,优选半纤维素缔合纤维素、无定形纤维素和/或再生的无定形纤维素(RAC)。
在一个实施例中,如本文所定义的用于在本发明的方法中使用的电子供体存在于如本文所定义的第一、第三和/或第四容器中。在一个另外的实施例中,如本文所定义的纤维素可以是如本文所定义的第一、第二和/或第四容器的一部分。在单个容器中具有如本文所定义的酶、电子供体和/或纤维素的组合的选择取决于这些组合的储存条件的相容性。如果如本文所示的组合的组分(即酶、电子供体和/或纤维素)具有相容的储存条件要求并且可以混合而不丧失其结构和/或生物活性,如酶活性和还原能力,则这些组合可以是单一容器的一部分。
优选的浓度和量进一步详述于第一方面中。优选地,将第一容器的LPMO、第二容器的电子供体和任选的第三容器的一种或多种另外的酶和/或第四容器的纤维素的量和浓度调谐为针对在本发明的方法中使用是最佳的,优选在单一应用中,即如果将所有容器的内容物与如本文所定义的特定量的含木聚糖的底物混合,则实现如本领域技术人员确定的最佳结果。
在一个实施例中,将部件试剂盒的每个容器的内容物单独地施用到含木聚糖的底物中。在一个替代性实施例中,第一和第二容器以及任选的第三和第四容器的内容物分开存储,并正好在施用前混合。优选地,“正好在之前”在本文中应理解为少于施用前120、60、30、15、5、4、3、2或1分钟,优选在少于施用前5分钟。所述第一、第二以及任选地第三和第四容器可以是适于储存容器的指示内容物的任何容器、瓶、管、安瓿、容器、烧瓶等。优选地,任何容器的体积至多为500mL,优选在0.1至500mL之间,优选在1至100mL之间,更优选为约5、10、50、20或100mL。
在第四方面,本发明提供了包含如本文所定义的LPMO的、用于或适用于根据本发明的第一和/或第二方面的方法的液体、糊剂或固体配制品。优选地,根据该方面的液体、糊剂或固体配制品进一步包含如第一方面所定义的电子供体、一种或多种另外的酶和/或纤维素。优选地,该固体配制品是具有颗粒或粉末的物理外观的固体配制品。优选的配制品是包含包衣或未包衣的颗粒或微粒或由其组成的配制品。该液体、糊剂或固体配制品可以根据本领域已知的方法配制,优选使用本领域已知的配制如本文所定义的酶和/或多酶组合物、原料、动物饲料、化工原料、饲料预混物、食品增补剂、面包改良剂、面粉处理剂和/或药用产品的方法。优选地,根据该方面的液体、糊剂或固体配制品是多酶组合物、原料、化工原料、动物饲料、饲料预混物、食品增补剂、面包改良剂、面粉处理剂和/或药用产品,其中优选地所述组合物包含一种或多种本领域已知的适用于这种组合物的另外的化合物。
待包括在根据本方面的液体、糊剂或固体配制品中的LPMO和/或一种或多种另外的酶可以根据本领域已知的方法进行稳定。例如,在该配制品中的LPMO是如本文所定义的蛋白质的情况下,通过添加抗氧化剂或还原剂来限制氧化来稳定组合物中的蛋白质,或者可以通过添加聚合物(如PVP、PVA、PEG或其他合适的已知有益于固体或液体组合物中多肽稳定性的聚合物)来稳定该组合物中的多肽。当配制包含LPMO和任选地另外的酶的组合物作为颗粒或团聚粉末时,颗粒特别地具有窄的粒度分布,其中大于95%(按重量计)的颗粒在从25至500p.m的范围内。颗粒和团聚粉末可以通过常规方法制备,例如通过在流化床造粒机中将LPMO和任选地另外的酶喷雾于一种载体上来制备。所述载体可由具有合适粒径的颗粒核心组成。该载体可以是可溶的或不溶的,例如盐(诸如NaCl或硫酸钠)、糖(诸如蔗糖或乳糖)、糖醇(诸如山梨糖醇)、淀粉、稻、玉米糁、或大豆。因此,本发明还提供了一种包含组合物的颗粒,该组合物包含如本文所定义的LPMO和任选地另外的酶。
配制品中的LPMO可以是如本文所定义的酶或蛋白质,例如,粗发酵产物,或已经使用本领域已知的蛋白质纯化方法纯化或部分纯化(例如,从微生物)的蛋白质制剂,或可合成(例如,化学合成,如通过肽合成)或重组生产的酶、蛋白质或肽。配制品中的LPMO还可以是如本文所定义的核酸分子,例如,编码如本文所定义的所述LPMO酶的重组核酸分子和/或载体和/或宿主细胞。包含LPMO的配制品可以是无细胞组合物或包含宿主细胞的组合物,该组合物包含编码如本文所定义的LPMO的核酸分子,该核酸分子优选能够表达如本文所定义的LPMO。相同的描述适用于提及本文所述的其他酶、蛋白质或肽以及这样的蛋白质或肽的其他微生物来源。
在第五方面,本发明提供了一种组合物,其包含如本发明的第一方面所定义的含木聚糖的底物和LPMO和/或含有根据本发明的第四方面的LPMO的液体、糊剂或固体配制品。优选地,含木聚糖的底物是如本发明的第一方面所定义的。优选地,该方面的组合物用于或适用于如本发明的第一方面所定义的方法。优选地,该组合物包含一定量或浓度的LPMO,该量或浓度适用于根据第一方面的方法或对于用于其是最佳的。该组合物可以包含如第一方面所定义的电子供体、一种或多种另外的酶和/或纤维素。
在一个实施例中,该方面的组合物包含如第一方面所定义的纤维素,即与半纤维素相互作用(优选经由氢键)的纤维素。优选地,所述纤维素是与半纤维素缔合的纤维素和/或无定形纤维素,任选地是再生的无定形纤维素(RAC)。包含在该方面的组合物中的纤维素可以是作为该方面的组合物中的含木聚糖的底物的一部分的纤维素。在一个替代性实施例中,除了含木聚糖之外,除了如本文所示的任选的另外的组分之外,还可以添加纤维素,以产生该方面的组合物。优选地,在本发明的方法中的含木聚糖的底物是游离的或仅包含少量的所述纤维素的情况下,另外并且除了含木聚糖的底物外,将如本文所定义的纤维素添加到该方面的组合物中。除了含木聚糖的底物之外,任选地添加的所述纤维素的量是导致所希望的木聚糖和/或葡聚糖降解和/或改性的量,该量可以使用如本文所述的测定法来评估。
优选地,任选地包含在多酶组合物内的所述一种或多种另外的酶是合适的(组合),用于在如第一方面所示和定义的本发明的方法中使用。优选地,该方面的组合物进一步包含具有氧化还原酶、纤维二糖水解酶、内切葡聚糖酶、β-葡糖苷酶、木聚糖酶和其他半纤维素酶活性的酶,优选如本文所定义的多酶组合物。
在这方面,含木聚糖的底物优选地包含生物质,生面团和/或烘焙组合物,动物食品,水果汁、蔬菜汁和/或谷物汁,木质纤维素材料,纸或纸浆,蔬菜,水果,谷物和/或谷物溶液或由其组成。优选地,含木聚糖的底物包含如本文所定义的生物质和/或木质纤维素材料和/或纸浆和/或DDG或由其组成,优选富含半纤维素,更优选富含纤维素缔合半纤维素。
在另一个优选的实施例中,含木聚糖的底物包含水果汁、谷物汁、饮料(如酒或啤酒)或由其组成。在该实施例中,含木聚糖的底物优选地包含水果和/或蔬菜(的汁液)(例如但不限于苹果、菠萝、橙子、番茄、葡萄、李子和/或蔓越莓)和/或谷物(例如但不限于大麦、玉米、小麦、黑麦、燕麦和玉蜀黍)或由其组成。优选地,该方面的组合物进一步包含果胶酶、羧甲基纤维素酶和/或淀粉酶。
在另一个优选的实施例中,该组合物包含含木聚糖的底物,该底物包含水果或蔬菜或由其组成。优选地,在该实施例中,该组合物进一步包含果胶酶、羧甲基纤维素酶和/或淀粉酶。
在另一个优选的实施例中,该含木聚糖的底物包含动物饲料或由其组成。优选地,所述动物饲料至少包含如本文所定义的谷物。所述动物饲料可以是但不限于包括干草、秸秆、青贮饲料、压缩和沉淀饲料、油和混合口粮、发芽谷物、豆类和饲料谷物的饲料,所述饲料谷物例如但不限于玉米、大豆和谷类、小麦、燕麦、大麦、以及稻。
在另一个优选的实施例中,含木聚糖的底物包含饲料添加剂组合物或由其组成,优选为家畜饲料添加剂组合物或饲料预混物。优选地,该(家畜)饲料添加剂组合物或饲料预混物通常含有所需的维生素、矿物质和任选的化学防腐剂、抗生素、发酵产品和/或家畜的另外的营养物。优选地,家畜饲料添加剂组合物由干谷物、所选择的营养补充剂和含水分的成分组成,如浓缩酒糟可溶物、玉米浆等。在一个特别优选的实施例中,家畜饲料添加剂组合物包含从约25%至约65%(按重量计)的干谷物;从约5%至约45%(按重量计)的所选择的营养补充剂的预混基料;以及从约20%至约45%(按重量计)的浓缩酒糟可溶物。在该实施例中,该混合物具有所选择的含水量以产生具有约18%至约30%的总水分含量的具有颗粒状、可成形稠度的非常可口的无脲混合物。优选地,所述干谷物以发酵的干谷物的形式被提供,并且更优选以发酵的酒糟可溶物的形式被提供。任选地,该家畜饲料添加剂组合物能以发酵湿谷物的形式被提供,该组合物包含约50%至约70%(按重量计)的该产品(其含水量为约20%至约40%)以及所选择的营养补充剂的预混基料。
在另一个实施例中,含木聚糖的底物包含烘焙组合物和/或生面团或由其组成。优选地,所述烘焙组合物或生面团至少包含面粉。优选地,该烘焙组合物和/或生面团包含全谷物粉。全谷物粉可以从谷物颗粒的研磨中得到,并且被定义为包含淀粉胚乳、胚芽和麸(以它们存在于完整谷物颗粒中的基本相同的相对比例)的成分的面粉。全谷物粉的生产可以包括颗粒成分的临时分离以用于稍后的重组。优选地,该生面团包含如以面粉总量的百分比确定的至少90%、至少80%、至少70%、至少60%、至少50%、至少40%、至少30%百分比的全谷物粉。因此,全谷物面包包含如以面粉总量的百分比确定的至少90%、至少80%、至少70%、至少60%、至少50%、至少40%、至少30%百分比的全谷物粉。全谷物粉可以源自任何谷物颗粒,包括小麦、大麦、黑麦、燕麦、玉米、高粱、稻和粟。在一个优选的实施例中,该全谷物粉源自小麦。在这样一个优选的实施例中,该生面团包含如以面粉总量的百分比确定的至少90%、至少80%、至少70%、至少60%、至少50%、至少40%、至少30%百分比的全小麦粉。因此,全谷物面包是包含如以面粉总量的百分比确定的至少90%、至少80%、至少70%、至少60%、至少50%、至少40%、至少30%百分比的全谷物粉的面包。此外,该生面团可以包括精制面粉或淀粉的种类,如小麦面粉、玉米面粉、玉米淀粉、黑麦面粉、燕麦面粉、大豆面粉、高粱面粉、马铃薯粉、马铃薯面粉或马铃薯淀粉。本发明的生面团可以是新鲜的、冷冻的或标准烘焙的。本发明的生面团通常是经发酵的生面团或将要经受发酵的生面团。该生面团可以各种方式来发酵,诸如通过添加化学膨松剂(例如碳酸氢钠)或通过添加发酵剂(发酵生面团),但优选的是通过添加适合的酵母培养物如酿酒酵母(面包酵母)的培养物(例如可商购的酿酒酵母菌株)来发酵该生面团。该生面团还可包含其他常规生面团成分,例如:蛋白质,如奶粉、面筋和大豆;鸡蛋(全蛋、蛋黄或蛋清);氧化剂如抗坏血酸、溴酸钾、碘酸钾、偶氮二甲酰胺(ADA)或过硫酸铵;氨基酸,如L-半胱氨酸;糖;盐,如氯化钠、乙酸钙、硫酸钠或硫酸钙。该生面团可以包括脂肪(甘油三酯)诸如颗粒状的脂肪或起酥油,但本发明同样适用于其中添加按重量计小于1%的脂肪(甘油三酯)的生面团,并且特别适用于未添加脂肪而制成的生面团。该生面团可以进一步包含乳化剂,如单或二甘油酯、单或二甘油酯的二乙酰酒石酸酯、脂肪酸的糖酯、脂肪酸的聚甘油酯、单酸甘油酯的乳酸酯、单酸甘油酯的乙酸酯、聚氧乙烯硬脂酸酯、或溶血卵磷脂。
在第六方面,本发明提供了如本文所定义的LPMO、根据第三方面的部件试剂盒、根据第四方面的糊剂或固体配制品、和/或根据本发明的第五方面的组合物在木聚糖降解和/或修饰中的用途,优选在根据本发明的第一和/或第二方面的方法中的用途。优选地,LPMO如第一方面所定义。优选地,LPMO用于以下各项的非限制名单中:降解纤维素缔合半纤维素,获得可发酵产品,获得生物燃料,溶解和/或漂白纸浆,降解DDG,澄清和/或提高过滤的速率,和/或降低果汁和/或饮料(如酒和啤酒)的浑浊物形成,浸渍水果,提取咖啡、植物油和淀粉,增加动物饲料的消化率和/或营养特性,提高烘焙产品的质量和/或提高烘焙产品的质地特征(破碎和切碎质量和面包屑质量),和/或生产木糖低聚物和/或葡糖低聚物,优选氧化的木糖低聚物和/或氧化的葡糖低聚物。此外,本发明的LPMO用于如本文所定义的多酶组合物(优选本文所示的适合用于本发明方法的多酶组合物)、饲料预混物、面包改良剂、面粉处理剂、药物组合物和/或食品增补剂中。
另外的方面:
提供了一种用于对含木聚糖的底物中的木聚糖进行降解和/或改性的方法,其中所述方法包括将含木聚糖的底物与家族AA9的溶解性多糖单加氧酶(LPMO)进行接触的步骤,其中该LPMO可以从毁丝霉属,优选从嗜热毁丝霉C1获得。该LPMO可以是包含与SEQ ID NO:1至少70%同一的氨基酸序列或由其组成的酶。该含木聚糖的底物可以包含电子供体和/或纤维素或进一步与其接触。该方法可以进一步包括葡聚糖降解和/或改性。该含木聚糖的底物可以包含一种或多种另外的酶或可以进一步与其接触,其中优选至少一种另外的酶是糖基水解酶,优选内切葡聚糖酶。该方法可以包括纤维素和/或与半纤维素缔合的纤维素的降解和/或改性。
本发明还涉及一种从含木聚糖的底物制备产品的方法,其中所述方法包括降解和/或改性如上文所定义的含木聚糖的底物中的木聚糖,并且其中所述含木聚糖的底物可以包含生物质、烘焙组合物或生面团、动物饲料或饲料预混物、水果汁或蔬菜汁、谷物汁、木质纤维素材料、纸或纸浆、蔬菜、水果、谷物和/或谷物溶液或由其组成。
还提供了用于在降解和/或改性如上文所定义的含木聚糖的底物中的木聚糖的方法中使用的部件试剂盒,其中所述试剂盒包含:
(i)含有如以上所定义的LPMO的第一容器;以及以下各项中的至少一个,
(ii)含有电子供体的第二容器;以及,
(iii)含有一种或多种另外的酶的第三容器,其中所述至少一种另外的酶可以是糖基水解酶,优选内切葡聚糖酶。
还提供了用于在降解和/或改性如上文所定义的含木聚糖的底物中的木聚糖的方法中使用的液体、糊剂或固体配制品,其中所述配制品包含如上所定义的LPMO,优选进一步包含电子供体和/或一种或多种另外的酶,其中优选所述一种或多种另外的酶中的至少一种是糖基水解酶,优选内切葡聚糖酶。该液体、糊剂或固体配制品可以是颗粒或粉末。
还提供了一种组合物,其包含如上所定义的含木聚糖的底物和LPMO,和/或如上所定义的液体、糊剂或固体配制品。该含木聚糖的底物可以至少包含面粉,并且所述组合物可以是烘焙组合物。此外该含木聚糖的底物可以至少包含纤维素缔合半纤维素,并且所述组合物可以是生物质或木质纤维素材料。该含木聚糖的底物还可以至少包含谷物,并且所述组合物可以是饲料或饲料预混物。
还提供了在如上所定义的LPMO,部件试剂盒,液体、糊剂或固体配制品,和/或组合物在用于对如上文所定义的含木聚糖的底物中的木聚糖进行降解和/或改性的方法中的用途。
附图说明
图1:通过使用ACQUITY UPLC分离系统和SYNAPT离子迁移率质谱仪的LC/UV/ESI-MS来分析纯化的MtLPMO9A。A-纯化的MtLPMO9A(UV 280nm)的色谱图。B和C-通过UV观察的主峰(B)和肩峰(C)的ESI MS光谱。主峰和肩峰显示同一的质谱,所述质谱对应于具有22765Da的m/z的相同蛋白质。这两个主峰一起占据在214nm的UV踪迹中测得的约99.5%的总面积和在总离子电流(TIC)质谱(参见材料和方法)中测得的94.7%的总面积。蓝色-MtLPMO9A的不同电荷态。
图2:A-贯穿本报告中使用的结构和命名法:XOSn和GlcOSn,未氧化的木糖低聚物和葡糖低聚物;XOSn#和GlcOSn#,在C1-碳原子处氧化的木糖低聚物和葡糖低聚物;XOSn*和GlcOSn*,在C4-碳原子处氧化的木糖低聚物和葡糖低聚物。B-用MtLPMO9A(5mg/g底物)孵育之前和之后的再生无定形纤维素(RAC)的HPAEC洗脱模式。将样品在添加有抗坏血酸(1mM)的50mM乙酸铵缓冲液(pH 5.0)中在52℃下孵育24小时。在抗坏血酸存在下,通过MtLPMO9A形成氧化的GlcOS(用#或*标记),通过MALDI-TOF MS进一步分析其中的团块。使用RAC作为底物,通过HPAEC检测到少量XOS。C-用MtLPMO9A与抗坏血酸一起孵育的RAC的MALDI-TOF质谱。氧化的GlcOS簇被确定为它们的锂(Li)加合物。插入物显示在通向酮基的C4处(*-2Da)或通向内酯的C1处(#-2Da)氧化的XOS和GlcOS的团块。δ-内酯在水中不稳定并被水解成相应的醛糖酸(#+16Da)。双Li-加合物(一个Li-加合物和在酸基上交换H的另外一个Li)是C1氧化产物(§)。
图3::在再生无定形纤维素(RAC;2mg/mL)存在下,在伴随抗坏血酸(1mM)的添加的、MtLPMO9A(10mg/g底物)的孵育后,桦木木聚糖(BiWX;A;2mg/mL)和燕麦斯佩耳特木聚糖(OSX;B;2mg/mL)的MALDI-TOF MS分析。BiWX和OSX(伴随RAC添加)的MtLPMO9A孵育释放了未氧化和氧化的XOS和GlcOS(*、#)。图A和B显示C4氧化的XOS(*)和在C1处氧化成醛糖酸(#+16Da)的XOS的存在。由于存在的XOS的丰度,未氧化的GlcOS和氧化的GlcOS较少可检测到。从BiWX还可以形成含有非氧化XOS的4-O-甲基葡萄糖醛酸(GlcAmeXOS)和含有一个4-O-甲基葡萄糖醛酸的氧化XOS(GlcAmeXOS*,#)。团块仅表示锂加合物。确定C1氧化产物的双Li-加合物(§+6Da)。在没有抗坏血酸的、MtLPMO9A孵育后,在存在RAC的情况下,BiWX和OSX的MALDI-TOF MS分析不释放可检测量的氧化产物(数据未显示)。
图4:A-使用来自土生梭孢霉(PDB-id:3eii)的PMO1的可用模板结构而生成的MtLPMO9A的结构模型(17)。平面上的二价金属离子(橙色)由两种组氨酸(His1和His68;蓝色)和一种酪氨酸(Tyr153,品红色)配位,这对于属于CAZy数据库的家族AA9的LPMO是典型的(18)。与TtPMO1相比,Tyr191在平面上被Asn191代替。两个二硫键Cys126-Cys208和Cys38-Cys156是保守的并且预期对于MtLPMO9A的耐热性至关重要。B-MtLPMO9A和TtPMO1(PDB-id:3eii)的序列比对,其在使用针对蛋白质数据库的MtLPMO9A序列的Blast检索中得分最高(75%氨基酸同一性)。
图5:使用MtLPMO9A(10mg/g底物)和来自绿色木霉的内切葡聚糖酶I(TvEG I,表示为EGI)(100μg/g底物)孵育前后的再生无定形纤维素(RAC,2mg/mL)的HPAEC洗脱模式。将样品在添加有抗坏血酸(1mM)的50mM乙酸铵缓冲液(pH 5.0)中在52℃下孵育24小时。在存在抗坏血酸的情况下,由来自RAC的MtLPMO9A形成主要氧化的GlcOS(用针对C1氧化的#或针对C4氧化的*进行标记)。将TvEG I添加到RAC中产生难以检测的GlcOS(DP2-5)。与仅用RAC孵育的TvEG I相比,TvEG I与MtLPMO9A组合添加导致了从RAC释放GlcOS高16倍(基于通过HPAEC测定的GlcOS2-4的AUC的比较)。
图6:来自嗜热毁丝霉C1的LPMO9A的纯化。A-含有表达的MtLPMO9A的粗酶提取物的AEC洗脱图(步骤1)。B-池AEC-I的SEC洗脱图(步骤2)。红色柱表示合并并浓缩用于进一步分析的含有MtLPMO9A的级分。C-粗酶提取物(泳道2)、池AEC-9A(泳道3)和(部分)纯的MtLPMO9A(泳道4)的SDS-PAGE。MtLPMO9A的蛋白质带由箭头指示。关于蛋白质纯化的更多细节,参见材料和方法,泳道1,标记物(Precision Plus ProteinTM,Bio-Rad)。
图7:A-用MtLPMO9A(12.5mg/g底物)孵育之前和之后的再生无定形纤维素(RAC;2mg/mL)的HPAEC洗脱模式。将样品在添加有或未添加抗坏血酸(1mM)的50mM乙酸铵缓冲液(pH=5)中在52℃下孵育24小时。在存在抗坏血酸的情况下,由来自RAC的MtLPMO9A形成氧化的GlcOS(用#或*进行标记)。B-用MtLPMO9A与抗坏血酸一起孵育的RAC的MALDI-TOF质谱。氧化的GlcOS簇被确定为它们的锂(Li)加合物。更多细节参见图3。
图8:MtLPMO9A(12.5mg/g底物)孵育后,小麦阿拉伯木聚糖(WAX;A)、桦木(BiWX;B)和燕麦斯佩耳特(OSX;C)木聚糖(2mg/mL)的MALDI-TOF MS分析。将样品在添加有抗坏血酸(1mM)的50mM乙酸铵缓冲液(pH 5.0)中在52℃下孵育24小时。在所有三个孵育中,MtLPMO9A均释放线性XOS。A-WAX与MtLPMO9A的孵育;形成线性XOS和痕量的乙酰化XOS(+42m/z)。B-BiWX与MtLPMO9A的孵育;形成线性XOS和用4-O-甲基-葡萄糖醛酸取代的XOS(+191m/z)。C-OSX与MtLPMO9A的孵育仅释放线性XOS。团块仅表示锂加合物。
图9:用MtLPMO9A(12.5mg/g底物)孵育之前和之后,小麦阿拉伯木聚糖(WAX)、桦木(BiWX)和燕麦斯佩耳特木聚糖(OSX)(2mg/mL)的HPAEC洗脱模式。将样品在添加有或未添加抗坏血酸(1mM)的50mM乙酸铵缓冲液(pH 5.0)中在52℃下孵育24小时。A-在用MtLPMO9A和抗坏血酸添加(1mM)孵育之前和之后的WAX、BiWX和OSX。用MtLPMO9A孵育导致形成非氧化的线性XOS,即单取代(黑色箭头)和多取代(黑色虚线箭头)。B-D-在存在或不存在再生无定形纤维素(RAC;2mg/mL)的情况下,用MtLPMO9A孵育后的WAX、BiWX和OSX。C-D-在抗坏血酸存在下,未氧化的GlcOS和XOS后,还检测到了许多产物(如果MtLPMO9A仅与木聚糖底物或RAC孵育,则其不存在)。通过MALDI-TOF MS(图4)进一步分析了团块。
图10:在用添加有1mM抗坏血酸或未添加抗坏血酸(0mM)的、部分纯化的MtLPMO9A(12.5mg/g底物)孵育之前和之后,燕麦斯佩耳特β-葡聚糖的HPAEC洗脱模式。A-在抗坏血酸存在下,通过MtLPMO9A形成氧化产物。B-在1mM抗坏血酸存在下,与燕麦斯佩耳特β-葡聚糖一起孵育的部分纯化的MtLPMO9A的MALDI-TOF质谱。测定氧化的GlcOS簇,并且插入物(C)显示在具有醛糖酸的C1处氧化的GlcOS(#)和在具有酮基的C4处氧化的GlcOS(*)的存在。团块仅表示锂加合物。
图11:A-在用部分纯化的MtLPMO9A(12.5mg/g底物)孵育后,来自罗望子种子的木葡聚糖(2mg/mL)的HPAEC洗脱模式。将样品在添加有或未添加抗坏血酸(1mM)的50mM乙酸铵缓冲液(pH 5.0)中在52℃下孵育24小时。如果将木葡聚糖用添加有或未添加抗坏血酸(1mM)的MtLPMO9A孵育,则会形成木葡聚糖衍生的低聚物的许多取代的未氧化的β-D-糖基残基。通过MALDI-TOF MS进一步分析团块。B-用MtLPMO9A(添加有1mM抗坏血酸)孵育的木葡聚糖的MALDI-TOF质谱。葡聚糖主链的水解切割需要至少一种未取代的葡萄糖分子。在抗坏血酸存在下,通过MtLPMO9A形成氧化产物。氧化的木葡聚糖低聚物的簇被确定为它们的锂(Li)加合物(C-B的扩大)。插入物显示在具有醛糖酸的C1处氧化的木葡聚糖低聚物(#)和在具有酮基的C4处氧化的木葡聚糖低聚物(*)的存在。团块仅表示锂加合物。
图12:Avicel与纤维素酶混合物(添加有或未添加部分纯化的MtLPMO9A)一起孵育的HPAEC洗脱模式。将MtLPMO9A添加到纤维素酶混合物中导致了葡糖低聚物释放高了60%(基于HPAEC-面积)。将样品在50mM乙酸盐缓冲液(pH 5.0)中在52℃下孵育,同时添加抗坏血酸(1mM)。纤维素酶混合物的浓度为5mg蛋白质/g Avicel,并且具有MtLPMO9A的纤维素酶混合物的浓度为2.5mg/g Avicel。
参考文献列表
1.Lynd LR(1996)Overview and evaluation of fuel ethanol from cellulosic biomass:Technology,Economics,the Environment,and Policy.Annual Review of Energy and the Environment 21(1):403-465.
2.Hinz SWA,et al.(2009)Hemicellulase production in Chrysosporium lucknowense C1.Special section:Enzymes in grain processing.Journal of Cereal Science 50(3):318-323.
3.Vincken JP,de Keizer A,Beldman G,&Voragen AGJ(1995)Fractionation of xyloglucan fragments and their interaction with cellulose.Plant Physiology 108(4):1579-1585.
4.Lam TBT,Kadoya K,&Iiyama K(2001)Bonding of hydroxycinnamic acids to lignin:ferulic and p-coumaric acids are predominantly linked at the benzyl position of lignin,not theβ-position,in grass cell walls.Phytochemistry 57(6):987-992.
5.Kabel MA,van den Borne H,Vincken J-P,Voragen AGJ,&Schols HA(2007)Structural differences of xylans affect their interaction with cellulose.Carbohydrate Polymers 69(1):94-105.
6.EbringerováA,HromádkováZ,&Heinze T(2005)Hemicellulose.Advance in Polymer Science 186:1-67.
7.Yang B&Wyman CE(2004)Effect of xylan and lignin removal by batch and flowthrough pretreatment on the enzymatic digestibility of corn stover cellulose.Biotechnology and Bioengineering 86(1):88-95.
8.Jeoh T,et al.(2007)Cellulase digestibility of pretreated biomass is limited by cellulose accessibility.Biotechnology and Bioengineering 98(1):112-122.
9.CAZy(2014)Glycoside Hydrolase family classification.(www.cazy.org).
10.Levasseur A,Drula E,Lombard V,Coutinho PM,&Henrissat B(2013)Expansion of the enzymatic repertoire of the CAZy database to integrate auxiliary redox enzymes.Biotechnology for Biofuels 6:41.
11.Vu VV,Beeson WT,Phillips CM,Cate JH,&Marletta MA(2014)Determinants of regioselective hydroxylation in the fungal polysaccharide monooxygenases.Journal of the American Chemical Society 136(2):562-565.
12.Isaksen T,et al.(2014)A C4-oxidizing lytic polysaccharide monooxygenase cleaving both cellulose and cello-oligosaccharides.The Journal of Biological Chemistry 289(5):2632-2642.
13.Agger JW,et al.(2014)Discovery of LPMO activity on hemicelluloses shows the importance of oxidative processes in plant cell wall degradation.Proceedings of the National Academy of Sciences of the United States of America 111(17):6287-6292.
14.Forsberg Z,et al.(2014)Comparative study of two chitin-active and two cellulose-active AA10-type lytic polysaccharide monooxygenases.Biochemistry 53(10):1647-1656.
15.Vu VV,Beeson WT,Span EA,Farquhar ER,&Marletta MA(2014)A family of starch-active polysaccharide monooxygenases.Proceedings of the National Academy of Sciences of the United States of America 111(38):13822-13827.
16.Westereng B,et al.(2011)The putative endoglucanase PcGH61D from Phanerochaete chrysosporium is a metal-dependent oxidative enzyme that cleaves cellulose.PloS one 6(11):e27807.
17.Harris PV,et al.(2010)Stimulation of lignocellulosic biomass hydrolysis by proteins of glycoside hydrolase family 61:structure and function of a large,enigmatic family.Biochemistry 49(15):3305-3316.
18.Hemsworth GR,Davies GJ,&Walton PH(2013)Recent insights into copper-containing lytic polysaccharide mono-oxygenases.Current Opinion in Structural Biology 23(5):660-668.
19.Phillips CM,Beeson WT,Cate JH,&Marletta MA(2011)Cellobiose dehydrogenase and a copper-dependent polysaccharide monooxygenase potentiate cellulose degradation by Neurospora crassa.ACS Chemical Biology 6(12):1399-1406.
20.Beeson WT,Phillips CM,Cate JH,&Marletta MA(2012)Oxidative cleavage of cellulose by fungal copper-dependent polysaccharide monooxygenases.Journal of the American Chemical Society 134(2):890-892.
21.Kim S,Stahlberg J,Sandgren M,Paton RS,&Beckham GT(2014)Quantum mechanical calculations suggest that lytic polysaccharide monooxygenases use a copper-oxyl,oxygen-rebound mechanism.Proceedings of the National Academy of Sciences of the United States of America 111(1):149-154.
22.Guillotin SE,Van Kampen J,Boulenguer P,Schols HA,&Voragen AGJ(2006)Degree of blockiness of amide groups as indicator for difference in physical behavior of amidated pectins.Biopolymers 82(1):29-37.
23.Van Gool MP(2012)Targeted discovery and functional characterisation of complex-xylan degrading enzymes.Wageningen University,Wageningen,The Netherlands.
24.Beldman G,Voragen AGJ,Rombouts FM,Searle-van Leeuwen MF,&Pilnik W(1987)Adsorption and kinetic behavior of purified endoglucanases and exoglucanases from Trichoderma viride.Biotechnology and Bioengineering 30(2):251-257.
25.Vincken J-P,Beldman G,&Voragen AGJ(1997)Substrate specificity of endoglucanases:what determines xyloglucanase activity?Carbohydrate Research 298(4):299-310.
26.Van Gool MP,et al.(2011)Screening for distinct xylan degrading enzymes in complex shake flask fermentation supernatants.Bioresource Technology 102(10):6039-6047.
27.Visser H,et al.(2011)Development of a mature fungal technology and production platform for industrial enzymes based on a Myceliophthora thermophila isolate,previously known as Chrysosporium lucknowense C1.Ind.Biotechnol.7:214-223.
28.Punt P,J,et al.(2010)WO/2010/107303.
29.Zhang YHP,Cui J,Lynd LR,&Kuang LR(2006)A transition from cellulose swelling to cellulose dissolution by o-phosphoric acid:Evidence from enzymatic hydrolysis and supramolecular structure.Biomacromolecules 7(2):644-648.
30.Sali A(1995)Comparative protein modeling by satisfaction of spatial restraints.Molecular Medicine Today 1(6):270-277.
31.Eswar N,et al.(2007)Comparative protein structure modeling using MODELLER.Current Protocols in Protein Science.Chapter 2:Unit 2 9.
在以下实例中进一步解释本发明。这些实例不限制本发明的范围,而仅用于阐明本发明。
实例
材料和方法
酶表达、生产和纯化。来自嗜热毁丝霉C1的MtLPMO9A(SEQ ID NO:1表示无信号序列的MtLPMO9A;SEQ ID NO:2表示具有信号序列的MtLPMO9A)在蛋白酶/(半)纤维素酶减少的C1表达宿主(LC菌株)中过表达(27,28)。在补料分批方法(pH 6.0;32℃)中在葡萄糖限制下进行酶生产,如前所述(27),并产生富含MtLPMO9A的粗酶提取物。将MtLPMO9A用如SI材料和方法中所述的三个连续色谱步骤进行纯化。分析获得的所有级分的蛋白质含量(SI材料和方法)。用如SI材料和方法中所述的胰蛋白酶消化物质的LC/MS、SDS-PAGE凝胶电泳和UPLC-Synapt MS确定MtLPMO9A的序列和纯度的确认。
用MtLPMO9A孵育的底物。从西格玛-奥德里奇公司获得燕麦斯佩耳特木聚糖、桦木木聚糖、Ph-101、木糖低聚物(DP1-5)和葡糖低聚物(DP1-5)。从麦格酶公司(Megazyme)(布雷(Bray),爱尔兰)购买小麦阿拉伯木聚糖(中等黏度)、来自大麦的β-葡聚糖(中等黏度)和来自燕麦斯佩耳特的β-葡聚糖(中等黏度)、以及半乳甘露聚糖(瓜尔豆,中等黏度)。从大日本住友药业公司(Dainippon Sumitomo Pharma)(日本大阪)获得木葡聚糖(XG;来自罗望子种子)。通过适应其他地方描述的方法,从Avicel制备再生无定形纤维素(RAC)(29)。简言之,将Avicel(100mg)用0.6mL水润湿,并缓慢添加10mL的86.2%正磷酸,随后剧烈搅拌30分钟直至Avicel完全溶解。溶解的纤维素在逐步添加40mL水期间沉淀。将通过离心(4000g,4℃下12min)得到的沉淀物用水洗涤两次并用2M碳酸钠中和。将沉淀物再次用水洗涤(三次),并将最终的沉淀物悬浮在水中,直到最终干物质含量为1.4±0.1g/100g RAC悬浮液。
MtLPMO9A活性测定。将底物(1-2mg/mL,见图示)溶于添加有或未添加抗坏血酸的50mM乙酸铵缓冲液(pH 5.0)中(终浓度为1mM)。添加MtLPMO9A(12.5μg/mg底物),并在50℃下在头尾旋转器中以1mL总体积分部分(旋转器,毕比科技有限公司(Bibby Scientific LTD),斯通(Stone),英国)在20rpm下孵育24小时。通过如SI材料和方法所述的HPAEC和MALDI-TOF MS来分析产物。
结构模化。将MtLPMO9A的氨基酸序列和来自土生梭孢霉的PMO1的氨基酸序列进行比对,该比对在使用针对蛋白质数据库的MtLPMO9A序列的Blast检索中得分最高(75%氨基酸同一性)。使用该比对和TtPMO1(PDB-id:3eii)的可用结构作为模板,使用Modeller程序9.14版,获得了MtLPMO9A的结构模型(30)。产生了30个比较模型,之后使用Pymol(Pymol,PyMOL分子图形系统(The PyMOL Molecular Graphics System),版本1.5.0.4,美国纽约薛定谔有限责任公司(LLC,NY,USA))选择具有最低相应DOPE评分的模型(31)用于图像生成。
结果
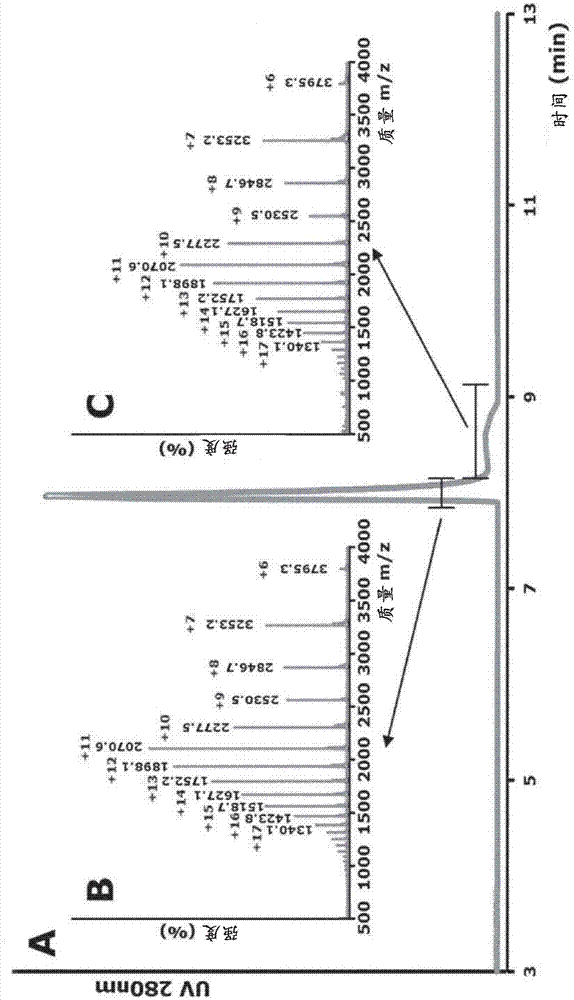
酶纯化。从嗜热毁丝霉C1基因组,预测蛋白质MtLPMO9A为属于家族AA9的LPMO(10)。已知将LPMO添加到纤维素酶混合物中可显著增加葡萄糖从纤维素的释放(16,17)。现在,本发明的发明人用Dyadic技术(27;Dyadic NL,瓦赫宁恩(Wageningen),荷兰)在无蛋白酶/(半)纤维素酶的嗜热毁丝霉C1菌株(27,28)中表达并产生了MtLPMO9A。使用多个色谱分离步骤将MtLPMO9A纯化至表观同质(详见材料和方法)。纯化的酶在SDS-PAGE中显示单个条带,其表观分子量为23±1kDa(图6),这与MtLPMO9A的预测质量(22.7kDa;无信号肽)高度一致。
为了进一步分析MtLPMO9A的质量和纯度,将该酶进行LC/UV/ESI质谱。洗脱模式(图1)显示了一个主峰,其包括在完全质量范围内基于UV(214nm)的±99.5%的总蛋白质和基于总离子电流(TIC)的94.7%的总含量。该峰的MS分析得到了22765.3±0.1Da的质量(m/z)。总之,MtLPMO9A以极其纯的形式获得,并适合用于分析其对各种多糖的作用方式。
MtLPMO9A对无定形纤维素的活性。在不存在和存在外部电子供体抗坏血酸的情况下,测定MtLPMO9A对再生无定形纤维素(RAC)的活性。从HPAEC和MALDI-TOF MS分析(图2)可以得出结论,在抗坏血酸存在下,RAC被MtLPMO9A降解,并且形成了C1和C4均氧化的葡糖低聚物(GlcOS)和未氧化的GlcOS。此外,在不存在抗坏血酸的情况下,没有发现氧化的和未氧化的低聚物,这表明不存在针对RAC的水解活性(图7A)。使用由来自粗糙脉孢菌的NCU01050或NCU08760而形成的C1-和C4-氧化的GlcOS的公开洗脱模式,通过HPAEC鉴定氧化的GlcOS(11,19)。此外,基于先前提出的LPMO切割机制(19-21),通过用MALDI-TOF MS鉴定的团块证实了氧化的GlcOS的形成。简言之,在吡喃糖环的C1处的氧化导致形成不稳定的δ-内酯,其在水存在下水解为醛糖酸。与未氧化的底物相比,内酯形成导致2Da的质量降低,而醛糖酸形成导致16Da的质量增加(图2B和2C,用#标记)。这些酸基中的一些可以交换H离子为Li离子,这产生对应于6Da附加质量的双Li-加合物(图2C,用§标记)。这样的双加合物在MALDI-TOF MS中还被描述为半乳糖醛酸低聚物(22)。类似地,在C4位置处的氧化产生4-酮醛糖,其相当稳定(图2C,用*标记),并且与未氧化的GlcOS相比,其相当于至降低2Da质量的内酯(12,20)。
除了氧化的GlcOS之外,还观察到大量氧化的木糖低聚物(XOS)(图2),尽管基于在Avicel中测定的木糖基残基的量,已知Avicel仅含有约2%(w/w)的木聚糖(23)。这个引人注目的观察结果表明,MtLPMO9A能够紧随纤维素氧化分解木聚糖。
MtLPMO9A对三种类型的木聚糖的活性。MtLPMO9A紧随氧化的GlcOS从RAC产生氧化的XOS,这一观察是新的,并且LPMO的这种作用尚未针对其他LPMO被描述。因此,在不存在或存在1mM抗坏血酸的情况下,将小麦阿拉伯木聚糖(WAX)、桦木葡糖醛酸木聚糖(BiWX)和相当线性的燕麦斯佩耳特木聚糖(OSX)用MtLPMO9A进行孵育。通过使用HPAEC和MALDI-TOF MS测定形成的产物(图8-9)。令人惊讶的是,在不存在和存在抗坏血酸的情况下,没有观察到氧化的XOS。然而,在所有测试的底物上释放了未氧化的XOS,这最有可能指出MtLPMO9A级分存在较少的木聚糖酶杂质。
MtLPMO9A对木聚糖与RAC的活性。由于MtLPMO9A紧随氧化的GlcOS从RAC产生氧化的XOS,但是如果单独使用木聚糖作为底物则不会如此,因此进一步研究了MtLPMO9A对木聚糖和富含木聚糖的纤维素植物生物质的作用方式。对此,将RAC与小麦阿拉伯木聚糖(WAX)、桦木葡糖醛酸木聚糖(BiWX)或燕麦斯佩耳特木聚糖(OSX)进行混合。在不存在和存在1mM抗坏血酸的情况下添加MtLPMO9A。使用HPAEC和MALDI-TOF MS测定产物(图3、图9)。在抗坏血酸存在下,用MtLPMO9A孵育的OSX-RAC组合和BiWX-RAC组合显示了氧化的XOS和氧化的GlcAme-XOS(与XOS附接的4-O-甲基葡萄糖醛酸)以及氧化的GlcOS的形成(图3)。此外,还观察到未氧化的XOS,这最有可能指出存在较少的木聚糖酶杂质。MALDI-TOF MS证实了在C4(*-2Da)和C1(#+16Da)处氧化的XOS的形成。在抗坏血酸存在下,从WAX-RAC组合没有观察到氧化的XOS。
MtLPMO9A的结构模型。基于来自土生梭孢霉的PMO1(蛋白质数据库条目:3eii)的可用结构,产生了MtLPMO9A的结构模型(17)。MtLPMO9A和TtPMO1具有75%的氨基酸序列同一性。该MtLPMO9A模型(图4)显示了高度保守的β-折叠核心,而环与报告的TtPMO1结构不同。预期保守的二硫键Cys126-Cys208和Cys38-Cys156对于MtLPMO9A的耐热性至关重要。活性位点中的二价金属离子由His1、His68和Tyr153配位,这对于AA9家族的PMO1亚群是典型的(18)。在提出形成TtPMO1底物结合位点的平坦区域的氨基酸中,只有一种酪氨酸被MtLPMO9A中的天冬酰胺(Asn191)取代。这种酪氨酸在蛋白质数据库中可用的其他LPMO结构中也不是保守的。基于MtLPMO9A的结构模型,并且将预测质量(无信号肽的氨基酸序列)与由ESI-MS测定的实际质量进行比较,预计MtLPMO9A含有甲基化的N-末端组氨酸。
与EG I的协同作用。图5中示出了MtLPMO9A与纯TvEG I(SEQ ID NO:3)(24,25)在降解RAC中的协同作用。在MtLPMO9A存在下,TvEG I释放的GlcOS比纯TvEG I的活性高约16倍(基于GlcOS2-4的总HPAEC面积)。以前没有报道过观察到的LPMO与水解酶作用于纤维素的强协同作用。
讨论
LPMO构成了一类新的氧化酶,预期其在甲壳质和木质纤维素生物质的降解中起关键作用。已知LPMO氧化纤维素、甲壳质、半纤维素的β-(1→4)-连接的取代和未取代的葡糖基单元以及淀粉中的α-(1→4)-葡糖基单元的β-(1→4)-葡糖基键(12-15)。我们从商业应用的真菌嗜热毁丝霉C1纯化了一种新的LPMO,并研究了其对广泛底物的降解能力(表1)。我们首次表明在电子供体抗坏血酸存在下,LPMO除了能够氧化具有β-(1-4)-连接的葡聚糖的底物之外,还能够氧化具有β-(1-4)-连接的木聚糖主链的底物。
除了RAC之外,还研究了在三种类型的木聚糖上,在不存在RAC或与RAC组合的情况下,(氧化的)XOS和(氧化的)GlcOS的形成。在存在RAC的情况下,发现被MtLPMO9A氧化的XOS的形成。我们考虑了MtLPMO9A引起的RAC的甘氨酰基中间体的形成(19,20)可能氧化木聚糖主链的想法。然而,MtLPMO9A还从单独的RAC形成氧化的XOS(图2C),这尚未关于任何其他LPMO进行报告。因此,我们假设MtLPMO9A在氧化相邻的木聚糖链时使用纤维素进行结合。通过观察到添加RAC对于通过用BiWX和OSX孵育的MtLPMO9A形成氧化的XOS是必需的,而如果将WAX添加到RAC中则不形成氧化的XOS,这一想法得到加强。BiWX是主要被4-O-甲基葡糖醛酸取代的线性β-1,4-木聚糖,并且OSX是具有相当低取代基量的线性β-1,4-木聚糖。与WAX不同,这两种木聚糖都由大的未取代的木聚糖链组成,这可以导致自缔合,自缔合解释了它们在水中相当低的溶解度(表1)。低量取代或取代基的嵌段分布(3,5)可能导致经由氢键与纤维素的强烈缔合。然而,由于存在于β-1,4-木聚糖主链上的阿拉伯糖基取代基的量和分布,WAX是完全水溶性的(26)。已经描述了线性木聚糖(如OSX和BiWX)更好地与纤维素原纤维缔合,并且因此与更多分支的木聚糖(如WAX)相比,线性木聚糖更接近相邻的纤维素链(5)。
最近发现,在毕赤氏酵母中表达的、来自粗糙脉孢菌的NcLPMO9D被描述为对半纤维素β-(1→4)-连接的葡聚糖具有活性(13)。我们发现MtLPMO9A对半纤维素木葡聚糖和β-葡聚糖显示出类似的作用方式(图10-11)。然而,到目前为止,氧化的XOS的形成仅对于MtLPMO9A被观察到。MtLPMO9A的蛋白质质量分析显示N-末端组氨酸的甲基化,而His1在NcLPMO9D中是非甲基化的。His1的翻译后修饰的作用尚不清楚,但可以假设引入的甲基基团在LPMO催化的氧化还原反应中起作用(18),或改变His1的灵活性。
最近,AA9类的LPMO基于它们在底物结合位点中的氨基酸进一步被分为PMOI、PMOII和PMOIII亚类(18)。MtLPMO9A显示与亚组PMOI最相似,并且与TtPMOI具有最高的氨基酸序列同一性(75%)。像TtPMOI一样,MtLPMO9A当添加到纤维素酶混合物中时显著增强了从纤维素的葡萄糖释放(60%)(17)。此外,MtLPMO9A显示与TvEG I对无定形纤维素的强烈的协同效应,如本研究所示。在酶纯化期间,将MtLPMO9A的氧化活性与对于纤维素的强水解活性进行分离。可能的是,MtLPMO9A和负责这种水解活性的酶在体内密切合作。已经表明,真菌当在木质纤维素生物质上生长时可以表达各种水解酶以及氧化酶。因此,可能的是,更多的氧化酶将与水解酶具有协同效应,以增强生物质的降解。可能的是,在真菌进化期间,含有氧化活性和与水解酶的协同作用的酶的开发使得更有效和更广泛的降解自然界中存在的底物成为可能。
SI材料和方法
酶产生和纯化。来自嗜热毁丝霉C1(SEQ ID NO:1表示无信号序列的MtLPMO9A;SEQ ID NO:2表示具有信号序列的MtLPMO9A)的MtLPMO9A在特别设计的C1表达宿主(LC菌株)中过表达(27)。使用含有葡萄糖和硫酸铵并富含必需盐的培养基,将C1菌株有氧生长在2-L发酵罐中(28)。接下来,在补料分批方法(pH=6.0;32℃)中,在葡萄糖限制下进行酶生产。如先前所述进行生长(28)并且递送了富含MtLPMO9A的粗酶提取物。将粗酶提取物用10mM磷酸钾缓冲液(pH 7.0)透析。使用AKTA-Explorer制备型色谱系统(GE医疗集团,瑞典乌普萨拉市(GE Healthcare,Uppsala,Sweden))纯化MtLPMO9A。作为第一步,将3g透析的粗酶混合物(50mg mL-1)经受在10mM磷酸钾缓冲液(pH 7.0)中预平衡的自包装的Source15Q柱(100mm×70mm内径,GE医疗集团)。应用蛋白质后,将该柱用3个体积的起始缓冲液洗涤。用在20mM磷酸钾缓冲液(pH 7.0)中的0-1M NaCl的线性梯度经5个柱体积进行洗脱。在220和280nm下监测洗脱。收集20mL的级分并立即储存在冰上。将峰级分合并,并在4℃下使用超滤(Ultra,3kDa的分子质量截止值,爱尔兰科克郡(Cork)默克密理博公司(Merck Millipore LTD))进行浓缩。将浓缩的合并物进行SDS-PAGE(图6)。为了进一步纯化(第二步),将含有MtLPMO9A的合并物装载在自包装的Superdex TM-75柱(100cm×30mm内径,GE医疗集团)上,并用含有150mM NaCl的10mM磷酸钾缓冲液(pH 7.0)洗脱。将5mL的级分立即储存在冰上。通过如上所述的超滤来浓缩合并的级分。
将如此获得的MtLPMO9A制剂进一步经受(第3步)在20mM磷酸钾缓冲液(pH 7.0)中预平衡的ResourceTMQ柱(30mm x 16mm内径,GE医疗集团)。应用蛋白质后,将该柱用10个柱体积的起始缓冲液洗涤。用在20mM磷酸钾缓冲液(pH 7.0)中的0-1M NaCl的线性梯度经20个柱体积进行洗脱。在220和280nm下监测洗脱。将3mL的级分立即储存在冰上。通过如上所述的超滤来浓缩合并的级分。
蛋白质含量分析。为了分析蛋白质含量,使用BCATM蛋白质测定试剂盒(美国伊利诺伊州罗克福德市赛默科技公司(Thermo Scientific,Rockford,IL,USA)),其中用牛血清白蛋白(BSA)作为校准。通过使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)测定蛋白质的相对亚基分子量。因此,将蛋白质用β-巯基乙醇还原,加热10分钟,并加载在12%聚丙烯酰胺凝胶(Mini-PROTEAN TGX凝胶,伯乐实验室公司(Bio-Rad Laboratories),亨佩尔亨普斯特德(Hempel Hempstead)英国)上。此外,加载蛋白质标记物(全蓝蛋白标准品,伯乐实验室股份有限公司(Bio-Rad Laboratories Ltd.))用于质量校准。将凝胶用EZBlueTM凝胶染色试剂(德国施泰因海姆市西格玛奥德里奇公司(Sigma Aldrich,Steinheim,Germany))染色。
LC/ESI-MS。使用ACQUITY分离系统(美国马塞诸塞州米尔福德的沃特斯公司(Waters,Milford,MA,USA)),通过液相色谱/电喷雾离子化-质谱(LC/ESI-MS)分析纯化的MtLPMO9A(2.5mg mL-1,在水中的0.1%(v/v)三氟乙酸(TFA)中),该ACQUITY分离系统配备有偶联到PLC LG 500光电二极管阵列检测器(沃特斯公司)和SYNAPT G2-Si高清晰度质谱仪(沃特斯公司)上的C4反相柱(BEH C4 1.7μm,2.1×100mm,沃特斯公司)。根据以下步骤进行洗脱剂A(H2O+1%(v/v)乙腈+0.1%(v/v)TFA)和洗脱剂B(乙腈+0.1%(v/v)TFA)的梯度洗脱:等度90%A从0至2分钟,从90%A至25%A的梯度从2至12分钟,从25%A至100%B的梯度从12至15分钟,等度100%B从12至15分钟,然后再平衡到初始条件。流速0.35mL/min。注入体积2μl。将光电二极管阵列检测器以200-400nm范围内的40点/秒的采样率进行操作,分辨率1.2nm。将SYNAPT质谱仪按照以下各项进行操作:阳离子模式(分辨率模式),毛细管电压3kV,采样锥30V,源温度150℃,去溶剂化温度500℃,锥孔气体流量(N2)200L/hr,去溶剂化气体流量(N2)800L/hr,全扫描模式采集,扫描时间0.3秒,内扫描时间0.015秒,采集范围150-4000m/z。
RAC制备。由Avicel通过将其在磷酸中溶胀而制备了RAC,该磷酸破坏了Avicel的原来的超分子结构,导致纤维状无序和高度无定形的底物(29)。
低聚物分析。通过具有脉冲安培检测(PAD)的高效阴离子交换色谱(HPAEC)分析低聚糖。将HPAEC系统(ICS-5000,美国加利福尼亚州森尼韦尔市戴安公司(Dionex,Sunnyvale,CA,USA))配备有CarboPac PA1保护柱(50mm x 2mm内径,戴安公司)和CarboPac PA1分析柱(250mm x 2mm内径,戴安公司)。流速是0.3mL/min(20℃)。将样品在自动进样器中保持在6℃,并且注射体积为10μL。通过使用两个流动相进行洗脱:在1M NaOAc中的0.1M NaOH和1M NaOH。梯度洗脱程序如下:0-30分钟,线性梯度0-400mM NaOAc;30-40分钟,线性梯度400-1000mM NaOAc;然后是清洗步骤和起始条件下的柱平衡(15分钟)。将可溶性GlcOS和XOS(聚合度1-5)以及葡糖醛酸和葡萄糖酸用作标准品(西格玛奥德里奇公司)。
MALDI-TOF MS。对于基质辅助激光解吸电离-飞行时间质谱法(MALDI-TOF MS),使用配备有337nm的氮激光器的flexControl 3.3(布鲁克道尔顿公司(Bruker Daltonics))的Ultraflex工作站。脉冲离子提取设置在80ns。离子被加速到25kV的动能,并在正向反射模式下用26kV的设置反射器电压进行检测。将所需的最低激光能量用于获得良好的信噪比。每次测量收集总共200个光谱。通过使用质量范围(m/z)为500-2500的麦芽糖糊精的混合物校准质谱仪。通过使用Flex分析软件3.3版(布鲁克道尔顿公司)处理峰光谱。在分析之前,通过添加50W-X8Resin(伯乐实验室公司(Bio-Rad Laboratories))将样品脱盐。为了获得锂(Li)-加合物,将上清液在氮气下干燥并重新悬浮于20mM LiCl中(16)。将每个1μL体积的富含锂的样品与1μL基质溶液(12mg/mL,2,5-二羟基-苯甲酸(布鲁克道尔顿公司)在30%(v/v)乙腈(在H2O中))进行混合,施加到MTP 384大规模靶板(布鲁克道尔顿公司)上并在热空气流下干燥。
表1:MtLPMO9A对各种多糖底物的氧化
1RAC、OSX、BiWX、WAX
2在H2O中的底物水溶性:完全可溶(+),部分可溶(+/-),不溶(-)
3葡糖低聚物[GlcOS],低聚木糖[XOS]
4半纤维素分离成β-(1-4)-连接的葡聚糖和木聚糖
5来自罗望子种子的木葡聚糖
6聚合度2-5
7β-(1-4)-连接的D-甘露糖基主链。
- 还没有人留言评论。精彩留言会获得点赞!