一种具有上转换圆偏振发光的三重态受体材料及其制备方法和应用与流程
本发明属于上转换材料领域,涉及一种三重态受体材料及其制备方法和应用,尤其涉及一种具有上转换圆偏振发光的三重态受体材料及其制备方法和应用。
背景技术:
自然光是由与其传播方向垂直的并在各个方向振动的射线组成,如果在光传播的方向上放置平面偏振片,则只有那些振动方向与偏振片轴平行的射线才能通过,这种通过的光叫做平面偏振光。平面偏振光是由两个振幅和速度相同而螺旋前进方向恰好相反的圆偏振光叠加而成。当光通过一种介质,如果这种介质能够使左右圆偏振光的振幅和速度不同,则会产生椭圆偏振光,这种现象成为圆二色现象。利用物质对左右圆偏振光的吸收不同而产生的光谱就是圆二色光谱(CD)。圆二色谱变现出了手性物质的基态的结构信息。在圆二色谱基础上,人们发现某些具有手性的物质发射出的左右圆偏振光强度不同,这种现象成为圆偏振发光(CPL),表现了物质激发态的结构特征。圆偏振发光在光信息的处理、显示和存储等方面具有重要的应用价值。
光子上转换是一种能够将低能量长波长的光转换成高能量短波长光的技术。能够实现光子上转换的方法一般有双光子吸收上转换,稀土材料上转换,以及近年来发展起来的三重态-三重态湮灭上转换。相对于前两者来说,三重态-三重态湮灭上转换所需光照强度低,上转换效率高,而且激发发射波长可调。因此三重态-三重态湮灭上转换在太阳能电池、光动力治疗、生物显像以及光催化的领域具有较大的应用价值。
CN105969336A公开了一种基于树枝形聚合物结构的三重态-三重态湮灭上转换发光材料,该上转换发光材料包含树枝形结构的湮灭剂,所述树枝形结构的湮灭剂是由9,10-二苯基蒽(DPA)共价修饰在芳醚树枝形聚合物的外围而形成的。本发明中的上转换发光材料,可于溶液和固体中实现低激发光功率密度条件下的上转换发光,然而其并不能实现圆偏振发光。
CN105693733A公开了一种具有高三重态能级的有机分子电子传输材料,同时引入吸电子的氮杂环、二苯基磷氧,将芳基或者稠环芳基连接两端的官能团,采用共轭程度较弱的位置连接。本发明的具有高三重态能级的有机分子电子传输材料,还具有易合成纯化,较高的玻璃化转变温度,较深的LUMO、HOMO能级,以及与金属或金属氧化物等阴极材料的强相互作用。然而其也未能实现圆偏振发光。
目前为止,光子上转换领域还没有实现圆偏振光发射的报道。因此,在本领域期望开发一种能够同时实现上转换和圆偏振光发射的三重态材料。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种三重态受体材料及其制备方法和应用,尤其涉及一种具有上转换圆偏振发光的三重态受体材料及其制备方法和应用。
为达到此发明目的,本发明采用以下技术方案:
一方面,本发明提供一种三重态受体材料,所述三重态受体材料具有如下式I或式II所示的手性结构化合物:
其中R1、R2、R3和R4独立地为取代的或未取代的具有并苯结构的基团或氢,并且R1与R2不同时为氢,R3和R4不同时为氢。
在本发明所述的式I或式II所示的手性结构化合物中,加黑加粗部分表示结构的构象是朝向面外。式I和式II所示的化合物如同实物与其镜中的映体,结构相同,但彼此不能重合,为手性化合物。
在本发明中所述具有并苯结构的基团是指具有至少两个并合在一起的苯环。优选地,所述具有并苯结构的基团为具有蒽环结构的基团、具有芘环结构的基团、具有苝环结构的基团、具有并四苯结构的基团或具有苝酰亚胺结构的基团。
优选地,所述取代的或未取代的具有并苯结构的基团为其中R独立地为氢、卤素、烷基、烯烃基、炔烃基、芳基、磺酰基、羟基、羧基、酯基或氨基中的任意一种;X为取代的或未取代的C2-C20的直链烷基或支链烷基、烯烃基、炔烃基、含氧或含氮的有机基团或者芳基中的任意一种。
优选地,所述卤素为氟、氯或溴。
优选地,所述烷基为C1-C8的直链烷基或支链烷基,例如C1、C2、C3、C4、C5、C6、C7或C8的直链烷基或支链烷基,例如甲基、乙基、丙基、异丙基、丁基、异丁基、戊基、异戊基、新戊基、己基、庚基或辛基等。
在本发明中,所述烯烃基是指含有碳碳双键的基团,例如乙烯基、烯丙基、丙烯基等。
在本发明中,所述炔烃基是指含有碳碳叁键的基团,例如乙炔基、炔丙基、丙炔基、丁炔基等。
优选地,所述芳基为苯基、邻甲苯基、对甲苯基、萘基、2,6-二叔丁基苯基或4-叔丁基苯基。
优选地,所述磺酰基为甲磺酰基、乙磺酰基或丙磺酰基。
优选地,所述酯基为甲酯基、乙酯基、丙酯基或丁酯基。
在本发明中,所述X为取代的或未取代的C2-C20的直链烷基或支链烷基是指X可以为取代的或未取代的C2、C3、C4、C5、C6、C7、C8、C9、C10、C11、C12、C13、C14、C15、C16、C17、C18、C19或C20的直链烷基或支链烷基,例如可以为乙基、丙基、异丙基、丁基、戊基、环戊基、异戊基、己基、环己基、庚基、辛基等。
优选地,所述含氧或含氮的有机基团为其中n为1-100的整数,例如n可以为1、3、5、8、10、20、30、40、50、60、70、80、90或100,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,优选1-20的整数。
即X为含氧有机基团是指X可以为具有乙二醇结构单位的基团,例如可以为X为含氮基团是指X可以为等含氮原子的基团。
X为芳基是指X可以为苯基、邻甲苯基、对甲苯基、萘基、2,6-二叔丁基苯基或4-叔丁基苯基。
优选地,所述三重态受体材料为具有如下式A-H所示结构的化合物中的任意一种:
进一步优选具有式A-D所示结构的化合物中的任意一种。
另一方面,本发明提供了如上所述的三重态受体材料的制备方法,所述方法为:在保护性气体保护下,手性1,1'-联-2-萘胺原料在有机溶剂中于催化剂催化下与具有并苯结构的卤代芳烃反应得到所述三重态受体材料。
优选地,所述保护性气体为氮气或氩气。
优选地,所述手性1,1'-联-2-萘胺原料为R-1,1'-联-2-萘胺或S-1,1'-联-2-萘胺。
优选地,所述有机溶剂为甲苯、邻二甲苯、间二甲苯或对二甲苯中的任意一种或至少两种的组合。
优选地,所述具有并苯结构的卤代芳烃为如下结构的卤代芳烃中的任意一种或至少两种的组合:其中R独立地为氢、卤素、烷基、烯烃基、炔烃基、芳基、磺酰基、羟基、羧基、酯基或氨基中的任意一种;X为取代的或未取代的C2-C20的直链烷基或支链烷基、烯烃基、炔烃基、含氧或含氮的有机基团或者芳基中的任意一种;R'为卤素。
优选地,所述手性1,1'-联-2-萘胺原料与具有并苯结构的卤代芳烃的摩尔比为(0.25-3):1,例如0.25:1、0.3:1、0.5:1、0.8:1、1:1、1.5:1、1.8:1、2:1、2.3:1、2.5:1、2.8:1或3:1,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
优选地,所述催化剂为氯化钯、醋酸钯、四(三苯基磷)钯或双(二亚芐基丙酮)钯中的任意一种或至少两种的组合。
优选地,所述催化剂与手性1,1'-联-2-萘胺原料的摩尔比为(0.01-0.35):1,例如0.01:1、0.03:1、0.05:1、0.07:1、0.09:1、0.1:1、0.12:1、0.13:1、0.15:1、0.18:1、0.2:1、0.23:1、0.25:1、0.28:1、0.3:1、0.33:1、0.35:1,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
优选地,所述反应在碱性物质和配体存在下进行。
优选地,所述碱性物质为三乙胺、碳酸钾、碳酸钠、碳酸铯、碳酸氢钠、磷酸二氢钾、甲醇钠或乙醇钠中的任意一种或至少两种的组合。
优选地,所述配体为三苯基膦、三环己基磷或1,1'-双(二苯基膦)二茂铁中的任意一种或至少两种的组合。
优选地,所述碱性物质与具有并苯结构的卤代芳烃的摩尔比为1:(1-4),例如1:1、1:1.1、1:1.2、1:1.3、1:1.4、1:1.5、1:1.6、1:1.7、1:1.8、1:1.9、1:2、1:2.3、1:2.5、1:2.8、1:3、1:3.3、1:3.5、1:3.8或1:4,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
优选地,所述配体与所述催化剂的摩尔比为1:(1-4),例如1:1、1:1.2、1:1.5、1:1.8、1:2、1:2.2、1:2.4、1:2.6、1:2.8、1:3、1:3.2、1:3.5、1:3.8或1:4,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
优选地,所述反应在回流下进行。即使得所述反应的温度达到相应溶剂的沸点温度,使溶剂产生回流。
优选地,所述反应的时间为24-36h,例如24h、26h、28h、30h、32h、34h或36h,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
另一方面,本发明提供了一种三重态-三重态湮灭上转换发光材料,所述三重态-三重态湮灭上转换发光材料包括能量给体(即光敏剂)以及如上所述的三重态受体材料(即湮灭剂)。
优选地,所述能量给体为如下式a-d所示的材料中的任意一种:
其中,式b和式c中M为钯或铂,式d中Bu为叔丁基。
优选地,当受体材料中具有并苯结构的基团为具有芘环结构的基团时,能量给体为式a所示的材料;当受体材料中具有并苯结构的基团为具有蒽环结构或苝环结构的基团时,能量给体为式b所示的材料;当受体材料中具有并苯结构的基团为具有并四苯结构的基团时,能量给体为式c或式d所示的材料;当受体材料中具有并苯结构的基团为具有苝酰亚胺结构的基团时,能量给体为式d所示的材料。
优选地,所述能量给体与所述三重态受体材料的摩尔比是1:100-1:400,例如1:100、1:110、1:130、1:150、1:180、1:200、1:230、1:250、1:280、1:300、1:320、1:340、1:360、1:380或1:400,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
另一方面,本发明提供了如上所述三重态-三重态湮灭上转换发光材料在三重态-三重态湮灭上转换中的应用。
优选地,将所述三重态受体材料和能量给体组成上转换对,在有机溶剂中配置成上转换溶液体系。所述的上转换溶液体系可以在实现光子上转换的同时发射上转换圆偏振光。
优选地,所述有机溶剂为二氯甲烷、氯仿、甲苯、苯腈、N,N-二甲基甲酰胺、四氢呋喃、甲基环己烷或二甲苯中的任意一种或至少两种的组合。
优选地,所述上转换溶液体系中三重态受体材料的浓度为0.1mM-20mM,例如0.1mM、0.5mM、1mM、4mM、4mM、6mM、8mM、10mM、12mM、15mM、18mM或20mM,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,优选0.1mM-10mM,进一步优选2-4mM。
另一方面,本发明提供了如上所述的三重态受体材料在手性光催化、生物显像以及光信息的处理、显示或存储上的应用。本发明的三重态受体材料具有良好的手性以及光学性能,在手性光催化、生物显像、光信息的处理、显示和存储等方面具有较大的应用价值。
相对于现有技术,本发明具有以下有益效果:
本发明的材料由于具有手性结构,并且在结构中含有并苯结构,能够用作三重态湮灭上转换体系的能量受体,可与能量给体配合实现光子上转换的同时发射圆偏振光,该三重态受体材料在手性光催化、生物显像、光信息的处理、显示和存储等方面具有较大的应用价值。
附图说明
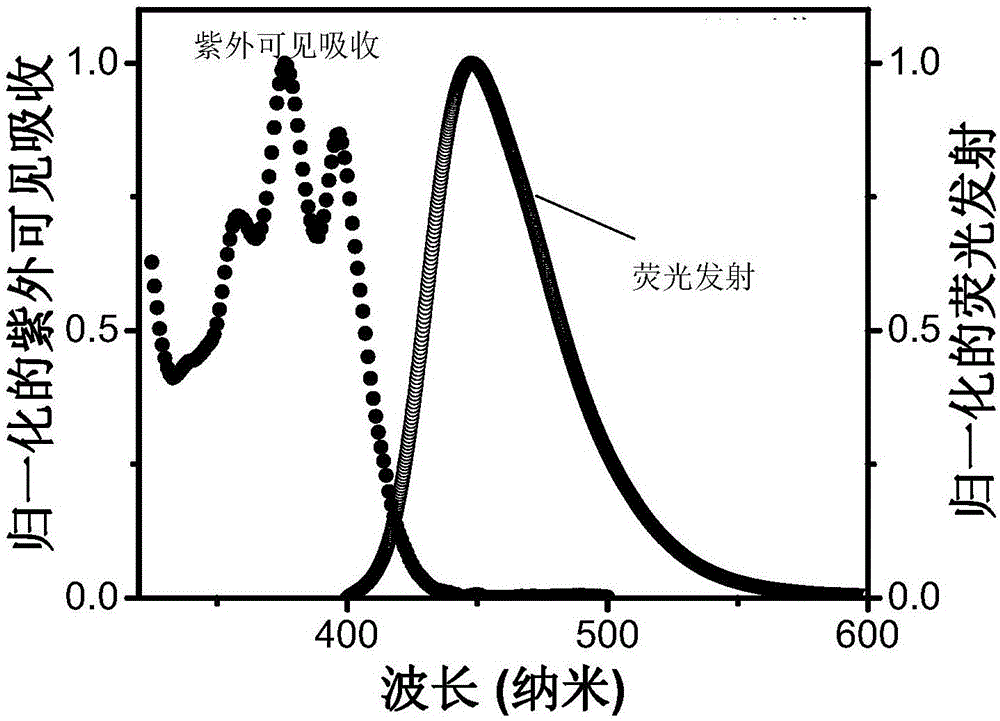
图1为化合物R-1的紫外-可见吸收吸收光谱和荧光发射光谱图;
图2为化合物S-1的紫外-可见吸收吸收光谱和荧光发射光谱图;
图3为化合物S-2的紫外-可见吸收吸收光谱和荧光发射光谱图;
图4为化合物R-2的紫外-可见吸收吸收光谱和荧光发射光谱图;
图5为化合物R-1与PtOEP组成的上转换体系在不同激光激发强度(5.9-60mW/cm2)下的上转换光谱图,其中沿着箭头的方向激光激发强度逐渐增强;
图6为化合物S-1与PtOEP组成的上转换体系在不同激光激发强度(27.4-98.7mW/cm2)下的上转换光谱图,其中沿着箭头的方向激光激发强度逐渐增强;
图7为化合物R-1与PtOEP成的上转换体系以及化合物S-1与PtOEP成的上转换体系的上转换圆偏振发光光谱图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1
在本实施例中通过以下方法来合成化合物R-1,合成流程如下:
合成方法为:
称取0.28g(R)-1,1'-联-2-萘胺,加入盛有15mL甲苯的反应管当中,加入30mg醋酸钯,50mg三苯基膦,200mg碳酸铯以及0.9g 9-(4-溴苯基)-10-苯基蒽,氩气保护下,加热回流,反应30小时后,通过TLC检测原料消失,即反应结束。降至室温,将反应液倒入100mL乙酸乙酯当中萃取,有机相使用无水硫酸镁干燥。旋干溶剂,通过柱色谱分离得到化合物R-1,产率93%。
核磁1H NMR(400MHz,甲苯-d8)δ7.99-7.88(m,6H),7.85-7.64(m,8H),7.44(d,J=8.4Hz,2H),7.34-7.23(m,8H),7.22-7.15(m,6H),7.14-6.96(m,12H),6.92(d,J=8.2Hz,4H),5.93(s,2H)。
质谱HR-MS(Maldi)计算值C72H48N2[M+]:940.3817,测试值:940.3813。
图1为R-1的紫外-可见吸收光谱以及荧光发射光谱(溶剂为甲苯,浓度为1×10-5M,荧光测试激发波长为365nm),由该图可以看出,R-1的荧光发射保留了蒽环特征发射,有可能作为三重态湮灭上转换当中的能量受体,实现三重态湮灭上转换。
实施例2
在本实施例中通过以下方法来合成化合物R-1,合成流程与实施例1中的合成流程相同,合成方法为:
称取0.28g(R)-1,1'-联-2-萘胺,加入盛有15mL甲苯的反应管当中,加入45.9mg氯化钯,50mg三苯基膦,318mg碳酸铯以及0.4g 9-(4-溴苯基)-10-苯基蒽,氩气保护下,加热回流,反应30小时后,通过TLC检测原料消失,即反应结束。降至室温,将反应液倒入100mL乙酸乙酯当中萃取,有机相使用无水硫酸镁干燥。旋干溶剂,通过柱色谱分离得到化合物R-1,产率90%。
核磁1H NMR(400MHz,甲苯-d8)δ7.99-7.88(m,6H),7.85-7.64(m,8H),7.44(d,J=8.4Hz,2H),7.34-7.23(m,8H),7.22-7.15(m,6H),7.14-6.96(m,12H),6.92(d,J=8.2Hz,4H),5.93(s,2H)。
质谱HR-MS(Maldi)计算值C72H48N2[M+]:940.3817,测试值:940.3810。
实施例3
在本实施例中通过以下方法来合成化合物S-1,合成流程如下:
称取0.28g(S)-1,1'-联-2-萘胺,加入盛有15mL二甲苯的反应管当中,加入45mg四(三苯基)磷钯,180mg碳酸氢钠以及0.9g 9-(4-溴苯基)-10-苯基蒽,氩气保护下,加热回流,反应24h后,通过TLC检测原料消失,即反应结束。降至室温,将反应液倒入100mL乙酸乙酯当中萃取,有机相使用无水硫酸镁干燥。旋干溶剂。通过柱色谱分离得到化合物S-1,产率75%。
核磁1H NMR(400MHz,甲苯-d8)δ7.99-7.88(m,6H),7.85-7.64(m,8H),7.44(d,J=8.4Hz,2H),7.34-7.23(m,8H),7.22-7.15(m,6H),7.14-6.96(m,12H),6.92(d,J=8.2Hz,4H),5.93(s,2H)。
质谱HR-MS(Maldi)计算值C72H48N2[M+]:940.3817,测试值:940.3816。
图2为S-1的紫外-可见吸收光谱以及荧光发射光谱(溶剂为甲苯,浓度为1x10-5M,荧光测试激发波长为365nm),由图2可知S-1的荧光发射保留了蒽环特征发射,有可能作为三重态湮灭上转换当中的能量受体,实现三重态湮灭上转换。
实施例4
在本实施例中通过以下方法来合成化合物S-1,合成流程与实施例3相同,其具体合成方法为:称取0.28g(S)-1,1'-联-2-萘胺,加入盛有15mL二甲苯的反应管当中,加入11.8mg四(三苯基)磷钯,14.3mg碳酸氢钠以及0.14g 9-(4-溴苯基)-10-苯基蒽,氩气保护下,加热回流,反应28h后,通过TLC检测原料消失,即反应结束。降至室温,将反应液倒入100mL乙酸乙酯当中萃取,有机相使用无水硫酸镁干燥。旋干溶剂。通过柱色谱分离得到化合物S-1,产率73%。
核磁1H NMR(400MHz,甲苯-d8)δ7.99-7.88(m,6H),7.85-7.64(m,8H),7.44(d,J=8.4Hz,2H),7.34-7.23(m,8H),7.22-7.15(m,6H),7.14-6.96(m,12H),6.92(d,J=8.2Hz,4H),5.93(s,2H)。
质谱HR-MS(Maldi)计算值C72H48N2[M+]:940.3817,测试值:940.3814。
实施例5
称取0.28g(S)-1,1'-联-2-萘胺,加入盛有25mL甲苯的反应管当中,加入20mg氯化钯,45mg三环基基膦,225mg碳酸铯以及0.65g 9-溴-10-苯基蒽,氩气保护下,加热回流,反应36小时,通过TLC检测原料消失,即反应结束。降至室温,将反应液倒入100mL二氯甲烷当中萃取,有机相使用无水硫酸镁干燥。旋干溶剂。通过柱色谱分离得到化合物S-2,产率75%。
核磁1H NMR(400MHz,氯仿-d)δ8.66(d,J=8.2Hz,2H),8.14(s,2H),7.86(d,J=8.1Hz,2H),7.79-7.52(m,24H),7.43-7.37(m,4H),7.19(d,J=6.8Hz,2H),6.79(d,J=9.0Hz,2H),6.46(s,2H)。
质谱HR-MS(Maldi)计算值C60H40N2[M+]:788.9940,测试值:788.9933。
图3为S-2的紫外-可见吸收光谱以及荧光发射光谱(溶剂为甲苯,浓度为1x10-5M,荧光测试激发波长为360nm),由图3可知S-2的荧光发射相对于蒽来说有所红移,但是具有的蒽环结构表明其有可能作为三重态湮灭上转换当中的能量受体,实现三重态湮灭上转换。
实施例6
称取0.28g(R)-1,1'-联-2-萘胺,加入盛有15mL二甲苯的反应管当中,加入45mg四(三苯基)磷钯,190mg乙醇钠以及0.7g 9-溴-10-苯基蒽,氩气保护下,加热回流,反应28小时,通过TLC检测原料消失,即反应结束。降至室温,将反应液倒入100mL二氯甲烷当中萃取,有机相使用无水硫酸镁干燥。旋干溶剂。通过柱色谱分离得到化合物R-2,产率68%。
核磁1H NMR(400MHz,Chloroform-d)δ8.66(d,J=8.2Hz,2H),8.14(s,2H),7.86(d,J=8.1Hz,2H),7.79-7.49(m,24H),7.43-7.37(m,4H),7.19(d,J=6.8Hz,2H),6.79(d,J=9.0Hz,2H),6.46(s,2H)。
质谱HR-MS(Maldi)计算值C60H40N2[M+]:788.9940,测试值:788.9944。
图4为R-2的紫外-可见吸收光谱以及荧光发射光谱(溶剂为甲苯,浓度为1x10-5M,荧光测试激发波长为360nm),由图4可知,R-2的荧光发射相对于蒽来说有所红移,但是具有的蒽环结构表明其有可能作为三重态湮灭上转换当中的能量受体,实现三重态湮灭上转换。
由以上实施例可知,R和S构型的邻二萘胺具有相当的反应活性,故对于前述给出的式E、F、G、H各结构只在以下实施例7-10中给出R构型的实施例。
实施例7
称取0.28g(R)-1,1'-联-2-萘胺,加入盛有25mL甲苯的反应管当中,加入55mg醋酸钯,40mg三苯基膦,210mg乙醇钠以及0.8g 1-溴芘,氩气保护下,加热回流,反应32小时,通过TLC检测原料消失,即反应结束。降至室温,将反应液倒入100mL二氯甲烷当中萃取,有机相使用无水硫酸镁干燥。旋干溶剂。通过柱色谱分离得到目标化合物R-3,产率88%。
核磁1H NMR(400MHz,氯仿-d)δ8.66-8.42(m,4H),7.51-8.12(m,22H),7.21-7.33(m,4H),6.45(S,2H)。
质谱HR-MS(Maldi)计算值C52H32N2[M+]:684.2565,测试值:684.2570。
实施例8
称取0.28g(R)-1,1'-联-2-萘胺,加入盛有30mL二甲苯的反应管当中,加入65mg氯化钯,90mg1,1'-双(二苯基膦)二茂铁,300mg甲醇钠以及1g 1-溴苝,氩气保护下,加热回流,反应36小时,通过TLC检测原料消失,即反应结束。降至室温,将反应液倒入100mL二氯甲烷当中萃取,有机相使用无水硫酸镁干燥。旋干溶剂。通过柱色谱分离得到目标化合物R-4,产率72%。
核磁1H NMR(400MHz,氯仿-d)δ8.86(m,2H),7.14-8.35(m,26H),7.15-7.32(m,6H),6.40(S,2H)。
质谱HR-MS(Maldi)计算值C60H36N2[M+]:784.2878,测试值:784.2872。
实施例9
称取0.28g(R)-1,1'-联-2-萘胺,加入盛有15mL二甲苯的反应管当中,加入45mg双(二亚芐基丙酮)钯,50mg三苯基膦,350mg磷酸二氢钾以及0.9g 5-溴并四苯,氩气保护下,加热回流,反应36小时,通过TLC检测原料消失,即反应结束。降至室温,将反应液倒入100mL二氯甲烷当中萃取,有机相使用无水硫酸镁干燥。旋干溶剂。通过柱色谱分离得到目标化合物R-5,产率66%。
核磁1H NMR(400MHz,氯仿-d)δ8.86-8.91(m,2H),8.45(s,4H),7.71-8.06(m,14H),7.41-7.60(m,18H),7.15-7.37(m,4H),6.65(S,2H)。
质谱HR-MS(Maldi)计算值C56H36N2[M+]:736.2878,测试值:736.2881。
实施例10
称取0.28g(R)-1,1'-联-2-萘胺,加入盛有15mL二甲苯的反应管当中,加入45mg四(三苯基)磷钯,300mg乙醇钠以及2.7g 6-溴苝酰亚胺,氩气保护下,加热回流,反应36小时,通过TLC检测原料消失,即反应结束。降至室温,将反应液倒入100mL二氯甲烷当中萃取,有机相使用无水硫酸镁干燥。旋干溶剂。通过柱色谱分离得到目标化合物R-6,产率45%。
核磁1H NMR(400MHz,氯仿-d)δ8.23-8.41(m,6H),7.56-7.81(m,14H),7.15-7.30(m,4H),5.34-5.13(m,4H),2.29(m,8H),1.91(m,8H),1.32(m,64H),0.87(m,24H).。
质谱HR-MS(Maldi)计算值C120H136N6O8[M+]:1789.0420,测试值:1789.0423。
对实施例7-10制备得到的化合物R-3、R-4、R-5和R-6进行了紫外-可见吸收光谱以及荧光发射光谱的测试(溶剂为甲苯,浓度为1x10-5M,荧光测试激发波长为360nm),结果表明,R-3、R-4、R-5和R-6的荧光发射保留了并苯结构的特征发射,即他们与并苯结构具有相近的三重态能级,与并苯结构一样有可能作为三重态湮灭上转换当中的能量受体,实现三重态湮灭上转换。
实施例11
由于八乙基卟啉铂(PtOEP,式b当M=Pt时)和八乙基卟啉钯(PdOEP,式b当M=Pd时)具有相近的三重态能级,它们在三重态湮灭上转换当中起着相同的作用,即使用PtOEP的体系也可以使用PdOEP,故在在本实施例中,将化合物R-1与PtOEP组成上转换体系,进行上转换发光测试,方法如下:
以PtOEP(八乙基卟啉铂,式b当M=Pt时)作为三重态能量给体即光敏剂,化合物R-1作为三重态受体材料即湮灭剂,配置得到上转换溶液体系。其中三重态光敏剂PtOEP的浓度为1×10-5mol L-1,三重态湮灭剂化合物R-1的浓度为2×10-3mol L-1,溶剂为甲苯。将上述体系经过三次冻融循环除氧后,充入高纯氩气,以532nm激光激发,测试其上转换发光光谱。
图5为化合物R-1与PtOEP组成的上转换体系在不同激光激发强度(5.9-60mW/cm2)下的上转换发光光谱,由图可知,使用532nm的绿光激发上述上转换体系,荧光发射的最大波长在450nm左右,实现了由绿光到蓝光的上转换。
实施例12
在本实施例中,将化合物S-1与PtOEP组成上转换体系,进行上转换发光测试,方法如下:
以PtOEP作为三重态能量给体即光敏剂,化合物S-1作为三重态受体材料即湮灭剂,配置得到上转换溶液体系。其中三重态光敏剂PtOEP的浓度为1×10-5mol L-1,三重态湮灭剂化合物S-1的浓度为4×10-3mol L-1,溶剂为甲苯。将上述体系经过三次冻融循环除氧后,充入高纯氩气,以532nm激光激发,测试其上转换发光光谱。
图6为化合物R-1与PtOEP组成的上转换体系在不同激光激发强度(27.4-98.7mW/cm2)下的上转换发光光谱,由该图可知,使用532nm的绿光激发上述上转换体系,荧光发射的最大波长在450nm左右,实现了由绿光到蓝光的上转换。
使用化合物R-2和S-2分别与式b结构能量给体组成的上转换体系,R-3与式a结构的能量给体、R-4与式b结构的能量给体、R-5与式c结构或式d结构的能量给体组成上转换体系、R-6与式d结构的能量给体组成上转换体系进行了相同的上转换发光测试,结果表明化合物R-2、S-2与式b结构能量给体以及R-3与式a结构、R-4与式b结构、R-5与式c结构、R-5和R-6与式d结构组成的体系同样能够实现光子的上转换。
实施例13
在本实施例中,将化合物R-1和S-1分别与PtOEP组成上转换体系,进行圆偏振发光测试,方法如下:
以PtOEP作为三重态能量给体即光敏剂,化合物S-1或化合物R-1作为三重态湮灭剂分别配置上转换溶液体系。其中三重态光敏剂PtOEP的浓度为1×10-5mol L-1,三重态湮灭剂化合物S-1或化合物R-1的浓度为4×10-3mol L-1,溶剂为甲苯。将上述体系经过三次冻融循环除氧后,充入高纯氩气,使用Jasco CPL200进行圆偏振发光测试,将532nm陷波滤光片放置于检测器前方入射光入口,将380nm-530nm短通滤光片放置于532nm陷波滤光片前方。其中激发光源为532nm激光,检测范围是420nm-540nm。
图7为化合物R-1和S-1分别与PtOEP组成的上转换体系的上转换圆偏振发光光谱,由该图可知,使用532nm的绿光激发上述上转换体系,实现了由绿光到蓝光的上转换,而且发出了圆偏振的光。
使用化合物R-2和S-2分别与式b结构能量给体组成的上转换体系,R-3与式a结构的能量给体、R-4与式b结构的能量给体、R-5与式c结构或式d结构的能量给体组成上转换体系、R-6与式d结构的能量给体组成上转换体系进行了相同的上转换圆偏振发光测试,结果表明化合物R-2或S-2与式b结构、R-3与式a结构、R-4与式b结构、R-5与式c结构、R-5和R-6与式d结构的能量给体组成的体系同样能够实现光子的上转换并且发射圆偏振光。
申请人声明,本发明通过上述实施例来说明本发明的具有上转换圆偏振发光的三重态受体材料及其制备方法和应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!