羊传染性脓疱病毒和绵羊肺炎支原体双重PCR专用引物的制作方法
本发明涉及羊传染性脓疱病毒和绵羊肺炎支原体双重PCR专用引物及双重PCR检测方法,属于预防兽医学领域。
背景技术:
羊传染性脓疱病(Contagious ecthyma,CE)俗称羊口疮(Orf),是由羊传染性脓疱病毒(Orf virus, ORFV)感染引起的山羊、绵羊和人的一种急性、接触性和嗜上皮性的人畜共患病。该病的发病率为4%-100%,死亡率为1%-59%。绵羊肺炎支原体(Mycoplasma ovipneumoniae,Mo) 是引起绵羊和山羊支原体性肺炎的主要病原体之一,羊支原体性肺炎临床症状表现为高热、咳嗽、喘气、渐进性消瘦、肺和胸膜发生浆液性和纤维素性炎症, 发病率为20%-60%,病死率一般为30%~50%, 有的高达80%。Mo结构复杂、培养困难,目前仍缺乏有效的生前诊断和防治措施,给养羊业造成巨大经济损失。我国羊病的发生已日趋复杂,多重感染较为普遍,给羊病防治造成很大困难。
当前确诊羊支原体性肺炎的方法主要是病原分离鉴定, 但是支原体的体外培养成本较高, 培养条件要求苛刻,生长缓慢, 尤其是绵羊肺炎支原体很难培养,临床病例确诊一般需要2-3周时间, 显然不能满足快速诊断的需要。,而PCR方法简单、快速、准确,已成为实验室诊断常用方法。国内外一些学者应用PCR技术对羊传染性脓疱病和山羊传染性胸膜肺炎进行了诊断和流行病学研究, 国内的屈勇刚等、李媛等、储岳峰等分别建立了绵羊肺炎支原体PCR 检测方法及绵羊肺炎支原体和丝状支原体山羊亚种二重PCR 检测方法, 颜新敏等建立了快速鉴别诊断羊痘病毒和羊口疮病毒的双重PCR方法, 但目前国内外尚无同时快速检测羊传染性脓疱病毒和绵羊肺炎支原体方法的报道。本发明提供快速、特异、灵敏的鉴别或同时检测羊传染性脓疱病毒和绵羊肺炎支原体的双重PCR 专用引物和双重PCR检测方法, 适用于临床快速检测和流行病学调查,有广阔的应用前景,具有重大的经济和社会效益。
技术实现要素:
本发明的目的在于提供一种羊传染性脓疱病毒和绵羊肺炎支原体双重PCR专用引物及其检测方法,具体为一种快速、特异、准确诊断羊传染性脓疱病毒和绵羊肺炎支原体专用引物及双重PCR检测方法。
为实现上述目的,本发明采用如下技术方案:
羊传染性脓疱病毒和绵羊肺炎支原体专用引物设计;羊传染性脓疱病毒和绵羊肺炎支原体双重PCR检测方法的建立;从待检羊的鼻拭子或鼻、唇等结痂处提取组织DNA,然后将获得的DNA模板以及针对羊传染性脓疱病毒B2L基因和绵羊肺炎支原体P80基因设计合成的两对引物加入到同一个反应体系中进行PCR扩增,PCR扩增产物经1%琼脂糖凝胶电泳鉴定;其中,PCR反应的专用引物序列分别为:
专用引物B2L 上游序列5’- AGGCGGGCGTCAACTACTACAA-3’,
专用引物B2L下游序列5’- TTCTTGGCGTTCTCGATGCGGT-3’。
用于扩增羊传染性脓疱病毒B2L基因,目的片段为402bp。
专用引物P80 上游序列5’-GCCTTGGGGTTGGAATTCCTTTGTCTTATTC-3’,
专用引物P80 下游序列5’-CATTTGATGCTGAGGTCGGATTTGGACTAAC-3’。
用于扩增绵羊肺炎支原体P80基因,目的片段为700bp。
PCR反应体系和扩增程序分别如下:
PCR反应体系:反应体系为20μL,Premix TaqTM Version 2.0 plus dye 10μL、B2L上下游引物各0.7μL、P80上下游引物各1.2μL、模板各1μL、无菌去离子水补足至20μL;
扩增程序:94℃预变性2min,从94℃变性30sec,58.5℃退火15sec,72℃延伸15sec 运行30个循环;72℃延伸10min。
本发明根据羊传染性脓疱病毒B2L基因和绵羊肺炎支原体P80基因序列,设计两对可特异性扩增B2L基因和P80基因的专用引物,建立了羊传染性脓疱病毒和绵羊肺炎支原体双重PCR检测方法。
本发明的优点在于:通过对引物浓度、退火温度等条件的优化,建立了快速检测羊传染性脓疱病毒和绵羊肺炎支原体双重PCR方法。电泳图中出现402bp的特异性片段为羊传染性脓疱病毒阳性;出现700bp的特异性片段为绵羊肺炎支原体阳性。本发明可实现同一反应体系中对羊传染性脓疱病毒和绵羊肺炎支原体进行检测,具有快速、特异、准确诊断病原等优点,为生产中这两种病原感染的鉴别诊断和流行病学调查提供了新的方法。
附图说明
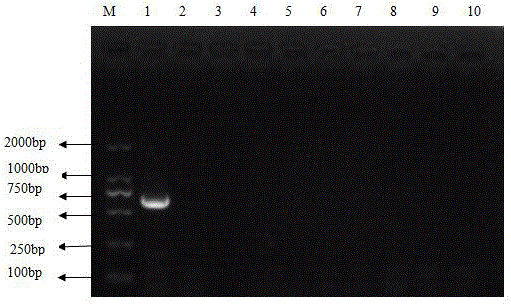
图1 为专用引物B2L对羊传染性脓疱病毒PCR扩增产物电泳图 ;其中M为Marker,泳道1 为羊传染性脓疱病毒的目标片段,泳道2绵羊肺炎支原体Y98、泳道3 山羊支原体山羊肺炎亚种F38、泳道4丝状支原体山羊亚种PG3、泳道5副猪嗜血杆菌、泳道6大肠杆菌、泳道7金黄色葡萄球菌、泳道8莱氏无胆甾原体、泳道9多杀性巴氏杆菌和泳道10空白对照均无条带。
图2 为专用引物Mo对绵羊肺炎支原体PCR扩增产物电泳图;其中M为Marker,泳道1为绵羊肺炎支原体目标片段,泳道2山羊支原体山羊肺炎亚种、泳道3羊传染性脓疱病毒、泳道4丝状支原体山羊亚种、泳道5副猪嗜血杆菌、泳道6大肠杆菌、泳道7莱氏无胆甾原体、泳道8金黄色葡萄球菌、泳道9多杀性巴氏杆菌和泳道10空白对照均无条带。
图3 为双重PCR方法特异性试验结果电泳图;其中M为Marker,泳道1 为羊传染性脓疱病毒和绵羊肺炎支原体的混合模板,泳道2为羊传染性脓疱病毒模板,泳道3为绵羊肺炎支原体模板,泳道4为丝状支原体山羊亚种模板、泳道5为副猪嗜血杆菌模板、泳道6为大肠杆菌模板、泳道7为莱氏无胆甾原体模板、泳道8为金黄色葡萄球菌模板、泳道9为多杀性巴氏杆菌模板、泳道10为山羊支原体山羊肺炎亚种和泳道11为空白对照均无条带。
图4 为双重PCR敏感性试验结果电泳图;图中:M 为Marker,泳道1至泳道9分别为10-1-10-9 10倍系列稀释的羊传染性脓疱病毒和绵羊肺炎支原体DNA的混合模板,泳道10为空白对照。
图5为 双重PCR重复性试验结果电泳图;其中M 为Marker,泳道9至泳道12为羊传染性脓疱病毒,泳道13和泳道18为绵羊肺炎支原体,泳道19为羊传染性脓疱病毒和绵羊肺炎支原体的混合模板;泳道1至泳道8分别为大肠杆菌、金黄色葡萄球菌、多杀性巴氏杆菌、莱氏无胆甾原体、丝状支原体山羊亚种、山羊支原体山羊肺炎亚种、副猪嗜血杆菌和空白对照无菌去离子水。
具体实施方式
以下结合实施例对本发明作进一步阐述,便于更好地理解本发明,但并不限制本发明。
以下实施例对羊传染性脓疱病毒和绵羊肺炎支原体用单重PCR及双重PCR方法进行阐述。
实施例1 本发明快速检测羊传染性脓疱病毒的专用引物B2L 的设计和用该对专用引物B2L采用单重PCR方法对羊传染性脓疱病毒的检测.
(1) 检测羊传染性脓疱病毒的专用引物B2L的设计与合成
检测羊传染性脓疱病毒的专用引物B2L是根据羊传染性脓疱病毒基因组中B2L基因片段,用Primer 6.0 引物设计软件,设计特异性引物,将其编号为专用引物B2L,它是由专用引物B2L上游引物和专用引物B2L下游引物组成,所述的专用引物B2L上游引物的碱基序列5’- AGGCGGGCGTCAACTACTACAA-3’,所述的专用引物B2L下游引物的碱基序列5’- TTCTTGGCGTTCTCGATGCGGT-3’,所述的检测羊传染性脓疱病毒的专用引物B2L的目标产物片段长度为402bp。
上述检测羊传染性脓疱病毒的专用引物B2L由宝生物工程(大连)有限公司合成。
(2) 用检测羊传染性脓疱病毒的专用引物B2L检测羊传染性脓疱病毒的单重方法,按以下步骤进行
①步骤(1) 所述检测羊传染性脓疱病毒的专用引物B2L由宝生物工程(大连)有限公司合成。
②羊传染性脓疱病毒的单重PCR 反应
以羊传染性脓疱病毒的DNA为模板,绵羊肺炎支原体的DNA、丝状支原体山羊亚种的DNA、山羊支原体山羊肺炎亚种的DNA、莱氏无胆甾原体的DNA、大肠杆菌的DNA、金黄色葡萄球菌的DNA、多杀性巴氏杆菌的NDA、副猪嗜血杆菌的DNA作阴性对照,灭菌去离子水作为空白对照,按表1 所述单重PCR反应体系进行PCR 扩增,
表1 单重PCR 反应体系:
表1 中:专用引物B2L的上游引物为检测羊传染性脓疱病毒的专用引物B2L的上游引物的简写;专用引物B2L的下游引物为检测羊传染性脓疱病毒的专用引物B2L的下游引物的简写。
PCR 反应条件为:
94℃预变性2min,从94℃变性30sec,58.5℃退火15sec,72℃延伸15sec 运行30个循环;72℃延伸10min。
③电泳检测
PCR 反应终止后,取5μL PCR产物,经1%琼脂糖电泳检测扩增结果。能够扩增出402bp 左右的片段即为羊传染性脓疱病毒,如图1。泳道1 为羊传染性脓疱病毒的目标片段,泳道2绵羊肺炎支原体Y98、泳道3山羊支原体山羊肺炎亚种F38、泳道4丝状支原体山羊亚种PG3、泳道5副猪嗜血杆菌、泳道6大肠杆菌、泳道7金黄色葡萄球菌、泳道8莱氏无胆甾原体、泳道9多杀性巴氏杆菌和泳道10空白对照均无条带。
④克隆和测序
用AxyPrep DNA凝胶回收试剂盒( 购于康宁生命科学(吴江)有限公司) 纯化PCR 扩增产物,与pMD-19T 载体( 购于TaRaKa公司) 连接,并通过Escherichia coli 细胞(DH5a, 购于TaRaKa公司) 转化,用标准生物学操作程序,由宝生物工程(大连)有限公司进行测序。
⑤序列比对
将获得的序列通过NCBI BLAST(http://www.ncbi.nlm.nih.gov/BLAST/) 比对分析,与GenBank 报道的羊传染性脓疱病毒B2L基因( 登录号KF703747.1) 的一致性为100%。证明本发明检测羊传染性脓疱病毒的专用引物B2L对于羊传染性脓疱病毒有良好的特异性。
实施例2 本发明快速检测绵羊肺炎支原体的专用引物P80的设计和用该对专用引物P80 采用单重PCR方法对绵羊肺炎支原体的检测。
(1) 检测绵羊肺炎支原体的专用引物P80的设计与合成
检测绵羊肺炎支原体的专用引物P80是根据绵羊肺炎支原体P80基因片段,用Primer 6.0 引物设计软件,设计特异性引物,将其编号为专用引物P80,它是由专用引物P80上游引物和专用引物P80下游引物组成,所述的专用引物P80上游引物的碱基序列为5’-GCCTTGGGGTTGGAATTCCTTTGTCTTATTC-3’,所述的专用引物P80下游引物的碱基序列为5’-CATTTGATGCTGAGGTCGGATTTGGACTAAC-3’,所述的检测绵羊肺炎支原体的专用引物P80的目标产物片段长度为700bp。
上述检测绵羊肺炎支原体的专用引物P80由宝生物工程(大连)有限公司合成。
(2) 用检测绵羊肺炎支原体的专用引物P80和检测绵羊肺炎支原体的单重PCR方法,以绵羊肺炎支原体Y98的DNA为模板,以羊传染性脓疱病毒的DNA、丝状支原体山羊亚种PG3、山羊支原体山羊肺炎亚种F38的DNA、大肠杆菌的DNA、金黄色葡萄球菌的DNA、巴氏杆菌的NDA、莱氏无胆甾原体的DNA、副猪嗜血杆菌的DNA作阴性对照,灭菌无离子水作为空白对照,除合成的专用引物和PCR 反应中使用的专用引物是上述检测绵羊肺炎支原体的专用引物P80外,其余操作步骤及其条件等与实施例1(2) 中②至④相同,不再赘述。
该PCR 反应终止后,取5μL PCR 产物,经1%琼脂糖电泳检测扩增结果,能够扩增出700bp 左右的片段即含有绵羊肺炎支原体的核酸,如图2, 泳道1为绵羊肺炎支原体目标片段,泳道2山羊支原体山羊肺炎亚种、泳道3羊传染性脓疱病毒、泳道4丝状支原体山羊亚种、泳道5副猪嗜血杆菌、泳道6大肠杆菌、泳道7莱氏无胆甾原体、泳道8金黄色葡萄球菌、泳道9多杀性巴氏杆菌和泳道10空白对照均无条带。
将获得的序列通过NCBI BLAST(http://www.ncbi.nlm.nih.gov/BLAST/) 比对分析,与GenBank 报道的丝状支原体绵羊肺炎支原体P80基因( 登录号为KM435069.1) 的一致性为100%。证明本发明检测绵羊肺炎支原体的专用引物P80对于绵羊肺炎支原体有良好的特异性。
实施例3 羊传染性脓疱病毒和绵羊肺炎支原体双重PCR 特异性试验
(1) 混合模板样品的PCR 反应。
分别以羊传染性脓疱病毒DNA、绵羊肺炎支原体DNA及羊传染性脓疱病毒DNA和绵羊肺炎支原体DNA混合样品为模板,以绵羊肺炎支原体DNA、丝状支原体山羊亚种DNA、副猪嗜血杆菌DNA、大肠杆菌DNA、莱氏无胆甾原体DNA、金黄色葡萄球菌DNA、多杀性巴氏杆菌DNA、山羊支原体山羊肺炎亚种DNA为阴性对照,以去离子水作空白对照,各样品模板分别用表2 所述的本发明最优反应体系进行PCR 扩增。
表2 所述的本发明最优反应体系进行PCR 扩增
反应条件为:94℃预变性2min;从94℃变性30sec,58.5℃退火15sec至72℃延伸15 sec 运行30个循环;72℃延伸10min。
③电泳检测及判断
PCR 反应终止后,分别取5μL PCR 产物,用1%琼脂糖电泳检测扩增结果,能够扩增得到402bp和700bp 的相应组合片段即可认为成功检测出羊传染性脓疱病毒核酸和绵羊肺炎支原体核酸,如图3,图中M为Marker,泳道1 为羊传染性脓疱病毒和绵羊肺炎支原体的混合模板,泳道2为羊传染性脓疱病毒模板,泳道3为绵羊肺炎支原体模板,泳道4为丝状支原体山羊亚种模板、泳道5为副猪嗜血杆菌模板、泳道6为大肠杆菌模板、泳道7为莱氏无胆甾原体模板、泳道8为金黄色葡萄球菌模板、泳道9为多杀性巴氏杆菌模板、泳道10为山羊支原体山羊肺炎亚种和泳道11为空白对照均无条带;泳道1中A位置的条带、泳道3中A位置的条带为绵羊肺炎支原体的目的条带,目的条带长度为700bp。泳道1中B 位置的条带、泳道2中B 位置的条带为羊传染性脓疱病毒的目的条带,目的条带长度为402bp。
从图3 可以看出,泳道1能够很清楚的看见长度为402bp 和700bp 的条带,泳道2和泳道3分别只见400bp和700bp左右条带,而泳道4至泳道10的阴性对照以及泳道11空白对照无明显条带,这说明本专利能成功检测出单一样品和混合样品中的羊传染性脓疱病毒和绵羊肺炎支原体。证明本专利同时检测羊传染性脓疱病毒和绵羊肺炎支原体的准确性高。
实施例4 羊传染性脓疱病毒和绵羊肺炎支原体混合模板的双重PCR敏感性试验
将羊传染性脓疱病毒和绵羊肺炎支原体DNA的混合模板(DNA浓度分别为 13.3ng/μL、24.7ng/μL)用无菌去离子水按10-1-10-9进行稀释,以去离子水作空白对照,各样品模板分别用实施例4中表2 所述的本发明最优反应体系进行PCR 扩增。
反应条件为:94℃预变性2min;从94℃变性30sec,58.5℃退火15sec 至72℃延伸15sec 运行30个循环;72℃延伸10min。
③电泳检测及判断
PCR 反应终止后,分别取5μL PCR 产物,经1%琼脂糖电泳检测扩增结果,能够扩增得到402bp和700bp组合片段的最高稀释度即为本专利检测羊传染性脓疱病毒和绵羊肺炎支原体的下限,如图4,图中M 为Marker,泳道1至泳道9 为羊传染性脓疱病毒和绵羊肺炎支原体混合模板的9个不同稀释度样品,泳道10为空白对照。
从图4 可以看出,泳道1至泳道6 能够很清楚的看见长度为402bp和700bp的条带,而泳道7至泳道10看不到任何条带,表明用本发明的双重PCR专用引物和双重PCR检测方法能同时检测出羊传染性脓疱病毒和绵羊肺炎支原体样品的最低含量分别为1.33×10-5ng/μL、2.47×10-5ng/μL。说明本专利同时检测羊传染性脓疱病毒和绵羊肺炎支原体的敏感性高。
实施例5 羊传染性脓疱病毒和绵羊肺炎支原体混合模板的双重PCR 重复性试验
以4份羊传染性脓疱病毒DNA样品和6份绵羊肺炎支原体DNA样品为阳性对照,以大肠杆菌、金黄色葡萄球菌、多杀性巴氏杆菌、莱氏无胆甾原体、丝状支原体山羊亚种、山羊支原体山羊肺炎亚种、副猪嗜血杆菌各1份作阴性对照、以无菌去离子水作空白对照,各样品模板分别用实施例4中表2 所述的本发明最优反应体系进行PCR 扩增。间隔3天检测1次,共重复3次。
反应条件为:94℃预变性2min;从94℃变性30sec,58.5℃退火15sec 至72℃延伸15sec运行30个循环;72℃延伸10min。
PCR 反应终止后,分别取5μL PCR 产物,经1%琼脂糖电泳检测扩增结果,如图5,图中M 为Marker,泳道9至泳道12为羊传染性脓疱病毒,泳道13和泳道18为绵羊肺炎支原体,泳道19为羊传染性脓疱病毒和绵羊肺炎支原体的混合模板,泳道1至泳道8分别为大肠杆菌、金黄色葡萄球菌、多杀性巴氏杆菌、莱氏无胆甾原体、丝状支原体山羊亚种、山羊支原体山羊肺炎亚种、副猪嗜血杆菌和空白对照无菌去离子水。
图5 中泳道9至泳道12能够很清楚的看见长度为402bp的条带 ,泳道13和泳道18能够清晰看见长度为700bp的条带,泳道19能够清晰看见长度为400bp和700bp左右的条带,而泳道1至泳道8的阴性对照无明显条带,且重复3次结果都一致。证明本专利检测羊传染性脓疱病毒和绵羊肺炎支原体的重复性好。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
SEQUENCE LISTING
<110> 福建省农科院畜牧兽医研究所
<120> 羊传染性脓疱病毒和绵羊肺炎支原体双重PCR专用引物
<130> 4
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 22
<212> DNA
<213> 人工序列
<400> 1
aggcgggcgt caactactac aa 22
<210> 2
<211> 22
<212> DNA
<213> 人工序列
<400> 2
ttcttggcgt tctcgatgcg gt 22
<210> 3
<211> 31
<212> DNA
<213> 人工序列
<400> 3
gccttggggt tggaattcct ttgtcttatt c 31
<210> 4
<211> 31
<212> DNA
<213> 人工序列
<400> 4
catttgatgc tgaggtcgga tttggactaa c 31
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于羊传染性脓疱病毒分离培养和增殖的细胞系及其制备方法和应用的制作方法
- 一种羊传染性脓疱病毒细胞弱毒疫苗及其制备方法和应用的制作方法
- 羊传染性脓疱病毒细胞弱毒疫苗耐热冻干保护剂及其制备方法和应用的制作方法
- 抗羊病毒性疾病卵黄抗体饲料添加剂和注射剂及制备方法
- 一种基于羊传染性脓疱病毒b2l基因的dna疫苗载体及其制备方法和应用的制作方法
- 用于局部使用1-氨基-烷基环己烷衍生物的凝胶制剂的制作方法
- 一种治疗羊传染性脓疱病毒的擦剂及其制备方法
- 一种用于检测羊传染性脓疱皮炎病毒的试剂盒及其检测方法
- 羊传染性脓疱病毒pcr诊断试剂盒的制作方法
- 一种羊口疮病毒蛋白orfv059单克隆抗体杂交瘤g3及单克隆抗体的制作方法