多功能的羟基吡啶酮衍生物及其水合物的制备法和用途的制作方法
本发明涉及一类羟基吡啶酮衍生物,该类化合物具有酪氨酸酶抑制活性、抗菌及抗氧化等多种生物活性。
背景技术:
酪氨酸酶(tyrosinase,ec.1.14.18.1)是一种含铜的金属酶,在动物、植物和微生物中广泛分布。它是生物体合成黑色素的关键酶,其不仅与果蔬的褐化、昆虫表皮的鞣化关系密切,还与人的色素性障碍等疾病的发生与治疗有重要关系。目前,酪氨酸酶抑制剂已被用于食品保鲜、农业中的杀虫剂的添加物和化妆品中的增白剂等。酪氨酸酶抑制剂在医学、药学、化学、农学和生物学等多个学科和领域作用重大,已经引起国内外专家和学者的广泛重视,目前,已经研究确认了很多类型的酪氨酸酶抑制剂。如:植物多酚(如:黄酮类、芪类、查尔酮类),高等植物中的一些醛类化合物;真菌代谢物(如:曲酸);人工合成的酪氨酸酶抑制剂(如:4-己基间苯二酚)等。其中曲酸不仅作为食品添加剂应用在食品的加工和生产中,而且还作为美白成分应用于化妆品中。然而,曲酸的结构不够稳定以及其活性不够理想。
羟基吡啶酮是一类对三价铁具有很强亲合性的螯合剂,在医药领域具有广泛的应用前景。其衍生物3-羟基-1,2-二甲基吡啶-4-酮(即去铁酮,deferiprone)是有口服活性的铁螯合剂,临床上用于治疗地中海贫血等铁过多的疾病。羟基吡啶酮由于对铜离子也有较强的螯合能力,故能通过夺取酪氨酸酶活性中心的铜离子而对酶具有抑制作用,但羟基吡啶酮环上的取代基及取代位置对其抑制酶活性具有很大影响。
目前现有的具有良好酪氨酸酶抑制活性的羟基吡啶酮衍生物的结构式为:
技术实现要素:
本发明要解决的技术问题是提供一种具有多种生物活性的羟基吡啶酮衍生物(及其水合物)及其制备方法,该类化合物具酪氨酸酶抑制活性、抗菌及抗氧化等活性,在食品工业中可用于食品的保鲜,在医药领域可用作抗菌剂。
为了解决上述技术问题,本发明提供一种多功能羟基吡啶酮衍生物及其水合物,多功能羟基吡啶酮衍生物为如下结构通式1,多功能羟基吡啶酮衍生物的水合物为如下结构通式1’;
结构通式1和结构通式1’中:r为h、cnh2n+1(n=1-12)、取代烃基。
作为本发明的多功能羟基吡啶酮衍生物及其水合物的改进:
多功能羟基吡啶酮衍生物的结构式为1f;多功能羟基吡啶酮衍生物的水合物的结构式为1f’;
本发明还同时提供了上述多功能羟基吡啶酮衍生物及其水合物的制备方法:
将曲酸的5位羟基苄基化,然后与氨水反应,再用mno2将其2位的羟甲基氧化成醛基,然后用三氯化硼将其5位的苄基脱去,再用稀盐酸回流(12h),干燥后得到羟基吡啶酮衍生物及其水合物的混合物。
注:由于多功能羟基吡啶酮衍生物(化合物1)易与水结合,得到的产物为多功能羟基吡啶酮衍生物及其水合物的混合物。.
本发明还同时提供了上述羟基吡啶酮衍生物及其水合物的用途:用作酪氨酸酶抑制剂。
作为本发明的羟基吡啶酮衍生物及其水合物的用途的改进:用于化妆品或食品的保鲜。
本发明的羟基吡啶酮衍生物及其水合物由于同时具有酪氨酸酶抑制活性、抗菌、抗氧化活性,因此能用于化妆品或食品的保鲜。
本发明的羟基吡啶酮衍生物用于化妆品时,具体用法和用量同曲酸。本发明的羟基吡啶酮衍生物作为食品(虾类)保鲜剂时,具体用法和用量同4-己基间苯二酚。
在发明过程中,为了制得具有高酪氨酸酶抑制活性的化合物,发明人从酪氨酸酶抑制机理着手考虑分子的设计。螯合剂能通过螯合酶活性中心铜离子而使酶活性受到抑制,由于羟基吡啶酮对铜离子的螯合能力强于曲酸,且稳定性好,因此选择了羟基吡啶酮衍生物。同时考虑到醛基可能可与酶活性中心的氨基酸残基形成席佛碱(schiff碱)从而阻止底物进入酶活性部位,因此设计了含有醛基的羟基吡啶酮分子,这种分子可望通过两种机理对酪氨酸酶起抑制作用;这两种作用机理可能可对酪氨酸酶的抑制产生协同效应,从而大大增强其酪氨酸酶抑制活性。同时羟基吡啶酮衍生物具有一定的抗菌活性和抗氧化活性。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
图1为南美白对虾在贮藏过程中感官评分的变化图;
图2为南美白对虾在贮藏过程中细菌总数的变化图;
图3为南美白对虾在贮藏过程中挥发性盐基氮的变化图。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1、化合物1的合成:
以曲酸为原料合成化合物1的路线如scheme1所示。
a.化合物3的合成
按文献报道方法合成(designandsynthesisofhydroxypyridinone-l-phenylalanineconjugatesaspotentialtyrosinaseinhibitors.journalofagriculturalandfoodchemistry2013,61(27),6597-6603)。
b.化合物4的合成
5-苄氧基-2-羟甲基吡啶-4(1h)-酮(4a):称取0.129mol(30g)化合物3于500ml的三口烧瓶中,然后加入50ml无水乙醇,加热搅拌回流,随后移取250ml的氨水(质量浓度25-28%)注入其中,用tlc点板法监测体系反应进程。于60℃反应约12h,原料才反应完全。反应结束后冷却至室温,烧瓶底部会有沉淀产生,过滤收集沉淀,乙醚结晶三次,干燥得到化合物4a。产率75.6%。1hnmr(500mhz,dmso-d6)δ:4.34(d,j=5.5hz,2h,ch2),5.01(s,2h,ch2),5.58(s,1h,吡啶酮环中c3-h),6.10(s,1h,吡啶酮环中c6-h),7.30-7.43(m,5h,ph).esi-ms:m/z232([m+h]+)。
4b-4g的合成:化合物4b-4g的合成按文献报道方法合成(designandsynthesisofhydroxypyridinone-l-phenylalanineconjugatesaspotentialtyrosinaseinhibitors.journalofagriculturalandfoodchemistry2013,61(27),6597-6603)。
c.化合物5的合成
分别称取0.05mol化合物4(4a-4g)于500ml圆底烧瓶中,加入0.4mol的mno2,185ml的三氯甲烷(chcl3),回流4-6天,用tlc点板法监测反应进程,反应结束后,抽滤除去二氧化锰(mno2),滤液用无水硫酸钠干燥,再次过滤,真空旋转蒸发除去溶剂,即可得化合物5(a-g)。
5-苄氧基-4-氧-1,4-二氢吡啶-2-甲醛(5a):产率60.6%。1hnmr(500mhz,dmso-d6)δ:5.31(s,2h,ch2),7.34-7.49(m,6h,ph和吡啶酮环中c3-h),8.42(s,1h,吡啶酮环中c6-h),9.25(s,1h,cho).esi-ms:m/z230(mh+)。
5-苄氧基-1-甲基-4-氧-1,4-二氢吡啶-2-甲醛(5b):产率72.3%。1hnmr(500mhz,dmso-d6)δ:2.49(s,3h,ch3),5.28(s,2h,ch2),7.00(s,2h,吡啶酮环中c-3h和c-6h),7.29-7.45(m,5h,ph),9.75(s,1h,cho).esi-ms:m/z244(mh+)。
5-苄氧基-1-乙基-4-氧-1,4-二氢吡啶-2-甲醛(5c):产率74.4%。1hnmr(500mhz,dmso-d6)δ:1.27(t,j=7.0hz,3h,ch3),4.24(q,j=7.0hz,2h,ch2),5.25(s,2h,ch2),7.00(s,2h,吡啶酮环中c-3h和c-6h),7.29-7.40(m,5h,ph),9.59(s,1h,cho)。esi-ms:m/z258(mh+)。
5-苄氧基-1-丁基-4-氧-1,4-二氢吡啶-2-甲醛(5d):产率75.8%。1hnmr(500mhz,dmso-d6)δ:0.86(t,j=7.5hz,3h,ch3),1.13-1.21(m,2h,ch2),1.51-1.57(m,2h,ch2),4.18(t,j=7.5hz,2h,ch2),5.25(s,2h,ch2),6.96(s,1h,吡啶酮环中c-3h),6.97(s,1h,吡啶酮环中c-6h),7.30-7.40(m,5h,ph),9.58(s,1h,cho)。esi-ms:m/z286(mh+)。
5-苄氧基-1-己基-4-氧-1,4-二氢吡啶-2-甲醛(5e):产率76.4%。1hnmr(500mhz,dmso-d6)δ:0.87(t,j=7.0hz,3h,ch3),1.23(m,6h,ch2),1.56(m,2h,ch2),4.17(t,j=7.0hz,2h,ch2),5.26(s,2h,ch2),6.97(s,1h,吡啶酮环中c3-h),6.99(s,1h,吡啶酮环中c6-h),7.30-7.41(m,5h,ph),9.58(s,1h,cho)。esi-ms:m/z314(mh+)。
5-苄氧基-1-辛基-4-氧-1,4-二氢吡啶-2-甲醛(5f):产率77.5%。1hnmr(500mhz,dmso-d6)δ:0.88(t,j=7.0hz,3h,ch3),1.17-1.28(m,10h,5ch2),1.56(m,2h,ch2),4.17(t,j=7.0hz,2h,ch2),5.26(s,2h,ch2),6.97(1h,吡啶酮环中c-3h),6.98(s,1h,吡啶酮环中c-6h),7.30-7.41(m,5h,ph),9.58(s,1h,cho)。esi-ms:m/z342(mh+)。
5-苄氧基-1-癸基-4-氧-1,4-二氢吡啶-2-甲醛(5g):产率78.1%。1hnmr(500mhz,dmso-d6)δ:0.88(t,j=7.5hz,3h,ch3),1.16-1.30(m,14h,7ch2),1.56(m,2h,ch2),4.17(t,j=7.5hz,2h,ch2),5.26(s,2h,ch2),6.97(1h,吡啶酮环中c-3h),6.98(s,1h,吡啶酮环中c-6h),7.29-7.41(m,5h,ph),9.58(s,1h,cho)。esi-ms:m/z370(mh+)。
d.化合物1合成
分别称取5mmol化合物5(5a-5g)于500ml三口烧瓶中,然后加入100ml无水ch2cl2,滴加15mlbcl3溶液(1mmol/ml,溶剂为ch2cl2),反应在氮气保护下进行。室温反应6h,往烧瓶中小心滴加适量(20ml)ch3oh,使产生的沉淀完全溶解,然后用旋转蒸发仪蒸干。将残留物溶于甲醇,用乙醚结晶,将得到的固体置于圆底烧瓶中,加入30ml的5mol/l的盐酸溶液,搅拌回流12h,80℃下用旋转蒸发仪蒸干,再在真空烘箱中40℃下干燥2天,得化合物1的盐酸盐。
注:由于化合物1易与水结合,得到的产物为化合物1及其水合物1’的混合物,两者的摩尔比可由核磁共振氢谱中的相关峰面积确定。后文中用于活性测试的化合物1(a-g)均为其每个化合物1与其相应水合物1’的混合物(即,为多功能羟基吡啶酮衍生物及其水合物的混合物)。
5-羟基-4-氧-1,4-二氢吡啶-2-甲醛(1a)及其水合物:产率85.3%(1a与水合物1a’的摩尔比为5.4:1)。1a:1hnmr(500mhz,dmso-d6)δ:7.77(s,1h,吡啶酮环中c3-h),8.31(s,1h,吡啶酮环中c6-h),9.86(s,1h,cho).esi-hrms:m/z,c6h5no3([m+h]+)计算值140.0342,实测值140.0345。1a’:1hnmr(500mhz,dmso-d6)δ:5.86(s,1h,ch),7.36(s,1h,吡啶酮环中c3-h),8.04(s,1h,吡啶酮环中c6-h).esi-hrms:m/z,c6h7no4([m+h]+)计算值158.1903,实测值158.01905。
5-羟基-1-甲基-4-氧-1,4-二氢吡啶-2-甲醛(1b)及其水合物:产率83.6%(1b与其水合物1b’的摩尔比为1.78:1)。1hnmr(500mhz,dmso-d6)δ:4.32(s,3h,ch3),7.81(s,1h,吡啶酮环中c3-h),8.40(s,1h,吡啶酮环中c6-h),10.02(s,1h,cho).esi-hrms:m/z,c7h7no3([m+h]+)计算值154.0499,实测值154.0494。1b’:1hnmr(500mhz,dmso-d6)δ:4.06(s,3h,ch3),5.95(s,1h,ch),7.61(s,1h,吡啶酮环中c3-h),8.26(s,1h,吡啶酮环中c6-h).esi-hrms:m/z,c7h9no4([m+h]+)计算值172.0617,实测值172.0615。
5-羟基-1-乙基-4-氧-1,4-二氢吡啶-2-甲醛(1c)及其水合物:产率84.7%(1c与其水合物1c’的摩尔比为1.16:1)。1hnmr(500mhz,dmso-d6)δ:1.42(t,j=7.5hz,3h,ch3),4.67(q,j=7.5hz,2h,ch2),7.77(s,1h,吡啶酮环中c3-h),8.41(s,1h,吡啶酮环中c6-h),9.99(s,1h,cho).esi-hrms:m/z,c8h9no3([m+h]+)计算值168.0655,实测值168.0652。1c’:1hnmr(500mhz,dmso-d6)δ:1.41(t,j=7.5hz,3h,ch3),4.42(q,j=7.5hz,2h,ch2),5.99(s,1h,ch),7.57(s,1h,吡啶酮环中c3-h),8.30(s,1h,吡啶酮环中c6-h).esi-hrms:m/z,c8h11no4([m+h]+)计算值186.0761,实测值168.0757。
5-羟基-1-丁基-4-氧-1,4-二氢吡啶-2-甲醛(1d)及其水合物:产率72.3%(1d与其水合物1d’的摩尔比为0.98:1)。1hnmr(500mhz,dmso-d6)δ:0.88(t,j=7.0hz,3h,ch3),1.68-1.70(m,4h,2ch2),4.60(t,j=7.0hz,2h,ch2),7.71(s,1h,吡啶酮环中c3-h),8.36(s,1h,吡啶酮环中c6-h),9.98(s,1h,cho).esi-hrms:m/z,c10h13no3([m+h]+)计算值196.0968,实测值196.0967。1d’:1hnmr(500mhz,dmso-d6)δ:0.87(t,j=7.0hz,3h,ch3),1.22-1.37(m,4h,2ch2),4.36(t,j=7.0hz,2h,ch2),5.98(s,1h,ch),7.62(s,1h,吡啶酮环中c3-h),8.34(s,1h,吡啶酮环中c6-h).esi-hrms:m/z,c10h15no4([m+h]+)计算值214.1074,实测值196.108。
5-羟基-1-己基-4-氧-1,4-二氢吡啶-2-甲醛(1e)及其水合物:产率64.5%(1e与其水合物1e’的摩尔比为1.69:1)。1hnmr(500mhz,dmso-d6)δ:0.85(t,j=7.5hz,3h,ch3),1.17-1.36(m,6h,3ch2),1.77(m,2h,ch2),4.63(t,j=7.5hz,2h,ch2),7.78(s,1h,吡啶酮环中c3-h),8.42(s,1h,吡啶酮环中c6-h),10.00(s,1h,cho)。esi-hrms:m/z,c12h17no3([m+h]+)计算值224.1281,实测值224.1286。1e’:1hnmr(500mhz,dmso-d6)δ:0.85(t,j=7.5hz,3h,ch3),1.17-1.36(m,6h,3ch2),1.77(m,2h,ch2),4.36(t,j=7.5hz,2h,ch2),5.97(s,1h,ch),7.55(s,1h,吡啶酮环中c3-h),8.30(s,1h,吡啶酮环中c6-h).esi-hrms:m/z,c12h19no4([m+h]+)计算值242.1387,实测值224.1374。
5-羟基-1-辛基-4-氧-1,4-二氢吡啶-2-甲醛(1f)及其水合物:产率63.2%(1f与其水合物1f’的摩尔比为1.85:1)。1hnmr(500mhz,dmso-d6)δ:0.85(t,j=7.5hz,3h,ch3),1.13-1.34(m,10h,5ch2),1.76(m,2h,ch2),4.57(t,j=7.5hz,2h,ch2),7.63(s,1h,吡啶酮环中c3-h),8.28(s,1h,吡啶酮环中c6-h),9.95(s,1h,cho).esi-hrms:m/z,c14h21no3([m+h]+)计算值252.1594,实测值252.1594。1f’:1hnmr(500mhz,dmso-d6)δ:0.84(t,j=7.5hz,3h,ch3),1.13-1.34(m,10h,5ch2),1.76(m,2h,ch2),4.36(t,j=7.5hz,2h,ch2),5.97(s,1h,ch),7.56(s,1h,吡啶酮环中c3-h),8.28(s,1h,吡啶酮环中c6-h).esi-hrms:m/z,c14h24no4([m+h]+)计算值270.1700,实测值270.1712。
5-羟基-1-癸基-4-氧-1,4-二氢吡啶-2-甲醛(1g)及其水合物:产率66.8%(1g与其水合物1g’的摩尔比为0.93:1)。1hnmr(500mhz,dmso-d6)δ:0.83(t,j=7.0hz,3h,ch3),1.14-1.35(m,14h,7ch2),1.76(m,2h,ch2),4.61(t,j=7.0hz,2h,ch2),7.74(s,1h,吡啶酮环中c3-h),8.38(s,1h,吡啶酮环中c6-h),9.98(s,1h,cho).esi-hrms:m/z,c16h25no3([m+h]+)计算值280.1907,实测值280.1908。1g’:1hnmr(500mhz,dmso-d6)δ:0.83(t,j=7.0hz,3h,ch3),1.14-1.35(m,14h,7ch2),1.76(m,2h,ch2),4.36(t,j=7.0hz,2h,ch2),5.97(s,1h,ch),7.60(s,1h,吡啶酮环中c3-h),8.32(s,1h,吡啶酮环中c6-h).esi-hrms:m/z,c16h27no4([m+h]+)计算值298.2013,实测值298.2010。
试验1、化合物1对蘑菇酪氨酸酶单酚酶抑制活性的测定
酶活力测定参考文献(designandsynthesisofhydroxypyridinone-l-phenylalanineconjugatesaspotentialtyrosinaseinhibitors.journalofagriculturalandfoodchemistry2013,61(27),6597-6603)的方法并稍加改进:酪氨酸酶的单酚酶活力测定是以2mmol/l酪氨酸为底物,在1.8ml0.05mol/l磷酸缓冲液(ph6.8)的测活体系中,先加入0.1ml含不同浓度的化合物1于比色杯中,再加进1ml预先在30℃恒温水浴保温的底物溶液,然后加入0.1ml蘑菇酪氨酸酶水溶液(1ml酶液活力为200u),立刻混匀,在30℃恒温条件下保温10min,迅速转移至比色皿中,于475nm处检测光密度值(od值)。不同组的反应体系的组成具体如表1。
表1、反应液体系
化合物对酪氨酸酶活性的抑制率按如下公式进行计算:
抑制率(%)=[1-(od3-od4)/(od1-od2)]×100%;
其中od1、od2、od3和od4分别为第一组到第四组溶液的光密度。
随着化合物浓度的增大,对酪氨酸酶活性的抑制增加。化合物对酪氨酸酶单酚酶活性的抑制率为50%时的化合物的浓度(ic50)见表2
表2、酪氨酸酶抑制活性
备注说明:a.测定7a活性时,测得曲酸对酪氨酸酶的半抑制浓度ic50为26.8μmol/l(designandsynthesisofhydroxypyridinone-l-phenylalanineconjugatesaspotentialtyrosinaseinhibitors.journalofagriculturalandfoodchemistry2013,61,6597-6603.);b.测定7b和7c活性时,测得曲酸对酪氨酸酶的ic50为12.50μmol/l(designandsynthesisofnovelhydroxypyridinonederivativesaspotentialtyrosinaseinhibitors.bioorganic&medicinalchemistryletters2016,26,3103-3108.);c.曲酸对蘑菇酪氨酸酶单酚酶抑制活性的测定法同上述试验1。
为了考察在羟基吡啶酮分子中引入醛基对酪氨酸酶活性的影响,我们也对化合物5f和6f(结构见下)的酪氨酸酶抑制活性。由表2可见,化合物5f的羟基被保护,但仍有一定活性,可见醛基起了作用;化合物6f中没有醛基,但也有一定活性,因此是通过螯合铜离子起作用;但5f和6f的活性都不强,分别是曲酸的1.21倍和0.83倍,而化合物1g的活性是曲酸的11.95倍;可见两种作用的协同大大增加了其酪氨酸酶抑制活性。
化合物6f(5-羟基-2-羟甲基-1-辛基吡啶-4-酮)的制备:将0.5g化合物4f溶于20ml甲醇,加入50mg钯碳(5%)、0.3ml浓盐酸,30pai氢气下反应3h。过滤,将滤液蒸干,重新溶于3ml甲醇,加入乙醚重结晶,干燥得化合物6f盐酸盐(产率92%)。1hnmr(500mhz,cdcl3)δ:0.85(t,j=7.0hz,3h,ch3),1.26(m,10h,ch2),1.74(m,2h,ch2),4.20(q,j=8.0hz,2h,ch2),4.65(s,2h,ch2),7.43(s,1h,吡啶酮环中c6-h),8.28(s,1h,吡啶酮环中c3-h)。esi-ms:m/z254(mh+)。
试验2、抗菌活性测定
分别以抑菌圈直径大小和最小抑菌浓度(mic)作为测试指标来测定化合物1的抗菌活性。抑菌圈试验采用牛津杯琼脂扩散法测定,最小抑菌浓度(mic)采用二倍比稀释法进行测定。
试验方法如下:
1).倒平皿:在经过紫外灭菌的无菌操作台中,取无菌培养皿放于台面,倒入已灭菌并冷却至50℃左右的固体营养琼脂培养基15ml作为底层,并置于水平台面上冷却凝固。
2).做标记,放牛津杯:待每个培养平皿都冷却凝固后,在培养皿底部作好相应的标记,用无菌镊子夹取已灭菌的牛津杯平放在培养皿中事先标记好的位置处,与培养基接触紧密,无空隙。
3).混菌液,取牛津杯,加样品:向已经放好牛津杯的平皿中加入105cfu/ml菌液适量,再倒入适量半固体培养基取,用手轻轻平动平皿,使菌液与半固体培养基混匀,并敞口放置于无菌操作台的水平台面上,等待琼脂的凝固。凝固后,再用无菌镊子轻轻的把牛津杯取出来,然后用移液枪吸取50μl10mg/ml的抑制剂溶液加入到牛津杯所形成的圆形孔洞内。
4).培养观察,测量结果:将处理好的培养平皿放在无菌操作台中一段时间,使1f溶液几乎完全渗透到琼脂中,再将其放置在37℃的恒温培养箱中培养20~24h。取出平皿,用游标卡尺测量每个平皿中抑菌圈的直径,并记录结果。
注:在整个试验过程中,无菌操作台的风机要保持正常通风,以免有杂菌飘进操作台污染试验。本试验中每组试验做三个平行,以无菌水和曲酸分别作为该试验的阴性对照和阳性对照。
1.抑菌圈试验
表3、化合物1f对5种细菌的抑菌圈直径
2.最低抑菌浓度(mic)的测定
结果见表4。
表4、化合物1f的最低抑菌浓度
由表3、表4可知,1f对五种供试菌种的抑制作用均明显强于曲酸。
试验3.抗氧化活性的测定
1.dpph自由基清除率的测定
参考文献(adaptationofdpphmethodforantioxidantdetermination[j].ecstransactions,2011,401-411.)的方法并加以改进。具体操作:1.先用移液枪取100μm的dpph溶液1.5ml于10ml的棕色具塞试管中,然后再取1.5ml一系列浓度梯度的1f溶液注入其中,迅速混匀,并放置于避光的恒温水浴锅中,保持水温恒定在37℃达30min。保温结束后,转移至比色杯中,在紫外分光光度计的波长为517nm处检测其吸光度值为ai;2.将无水乙醇取代dpph溶液,重复步骤1的操作,测得吸光度值为aj;3.将无水乙醇取代1f溶液,重复步骤1的操作,测得吸光度值为ac。同理,以vc作为阳性对照,测定方法按照步骤1、步骤2和步骤3的操作,其他条件不变。每组试验平行3次,最终结果求平均值,并计算清除率。自由基清除率计算公式如下:
dpph自由基的清除率(%)=[1-(ai-aj)/ac]×100%
其中:ai:样品溶液与dpph的吸光度;
aj:样品溶液自身的吸光度
ac:dpph自身的吸光度
化合物1f的浓度为5mg/ml时,dpph自由基清除率为42.2%。
2.羟基自由基清除率的测定
按照(chemicalanalysisandantioxidantactivityinvitroofaβ-d-glucanisolatedfromdictyophoraindusiata[j].internationaljournalofbiologicalmacromolecules,2012,51(1-2):70-75.)的方法,有所修改。具体操作:1.取2ml不同浓度的1f溶液于试管中,依次向各试管中加入1mlfeso4溶液,0.7ml的3%的h2o2溶液,摇匀后再加入0.3ml的水杨酸溶液,混匀,于37℃水浴30min,在517nm处测定其吸光度值为ai;2.将乙醇溶液取代水杨酸溶液,其他不变,重复步骤1的操作,测得吸光度值为aj;3.将蒸馏水取代1f溶液,其他不变,重复步骤1的操作,测得吸光度值为ac。同理,以vc作为阳性对照,测定方法按照步骤1、步骤2和步骤3的操作,其他条件不变。每组试验平行3次,最终结果求平均值,并计算清除率。
羟基自由基的清除率(%)=[1-(ai-aj)/ac]×100%
其中:ai:样品溶液与反应液的吸光度
aj:乙醇代替水杨酸后的吸光度
ac:蒸馏水代替样品溶液后的吸光度
化合物1f的浓度为5mg/ml时,羟基自由基清除率为50.3%。
3.超氧阴离子自由基清除率的测定
按照(effectsofhigh-pressuretreatmentontheextractionyield,phenoliccontentandantioxidantactivityoflitchi(litchichinensissonn.)fruitpericarp[j].internationaljournaloffoodscience&technology,2009,44(5):960–966.)的方法。操作如下:分别取1.5ml不同浓度的1f溶液于试管中,先向各试管中加入26mmol/l的met-pbs缓冲液(ph7.8,0.1m),再加入0.3ml的0.75mmol/l的nbt溶液,最后加入含1.0μmedta的20μm的核黄素溶液0.3ml,在3500lx光照下反应30min,于560nm处测量其吸光度值。不同浓度1f的吸光度值为ai,用蒸馏水代替核黄素时测得的吸光度值为aj,以蒸馏水代替1f溶液作为空白对照组测得其吸光度值为ac,以vc作为阳性对照,每组试验平行3次,最终结果求平均值,并计算清除率。
超氧阴离子自由基清除能力(%)=[1-(ai-aj)/ac]×100%
其中:ai:不同浓度样品的吸光度
aj:蒸馏水代替核黄素测得的吸光度
ac:蒸馏水代替样品测得的吸光度
试验结果显示,化合物1f对三种自由基都表现出一定的清除能力。
化合物1f的浓度为5mg/ml时,其超氧阴离子自由基清除率为40.5%。
由以上结果可知,化合物1f具有一定的自由基清除活性。
试验4.南美白对虾的保鲜实验
以化合物1f为例,并以曲酸以及4-己基间苯二酚(4-hr,为市售“虾鲜宝”的主要活性成分)作为阳性对照。南美白对虾的样品预处理:将鲜活对虾浸入到去离子水中30min,然后用生理盐水清洗3遍,挑选新鲜度较好的活的雌虾和雄虾作为样品,将样品随机分组备用。样品虾体平均长度10.0±1.0cm,体重10.0±1.0g。
南美白对虾的保鲜试验:将曲酸,4-hr和1f都配成1g/l的溶液,采用浸泡法将上述分组的虾按组分别浸入这三种溶液20min,然后捞出,虾体每侧各沥水5min,并装入保鲜袋于4℃冰箱中储藏。每个小组做三个平行,以无菌水处理组作为空白对照,每天在同一时间对各小组进行取样检测,检测时间持续两周。
(1).感官评定
根据虾的体表、肢节、眼球、肌肉、气味由20名经过专业训练的评定人员根据10分法的评分标准进行感官评分。若综合评分在5分以下,则表明虾已不具有食用价值。
由图1可见,随着贮藏时间的延长,四个小组样品的评分在逐渐下降,且空白对照组下降最快,1f试验组下降最慢,差异性越来越明显(p<0.05),数据分析可知,1f试验组评分明显高于曲酸组,具有显著性差异(p<0.05)。其中,空白对照组第5d评分为5.08分,勉强可以接受。观察其他小组发现,曲酸对照组到第6d时评分为5.75分,第7d为4.71分,人们难以接受。而4-hr对照组在第9d时评分为5.38分,勉强可以接受,表明4-hr有很好的保鲜效果,到第10d时为4.73分,人们已经无法接受。对于1f试验组,第11d时评分为5.08分,勉强可以接受,第12d时评分为4.04分,已经无法被接受。经过观察比较四个小组得出:在可以被接受的天数中,1f试验组最长为11d。经比较可知抑制剂1f具有比曲酸和4-己基间苯二酚更好的保鲜效果;也好于类似结构的化合物(即,7a~7c)中活性最好7b,用7b处理的试验组在第10d时评分为5.03分。
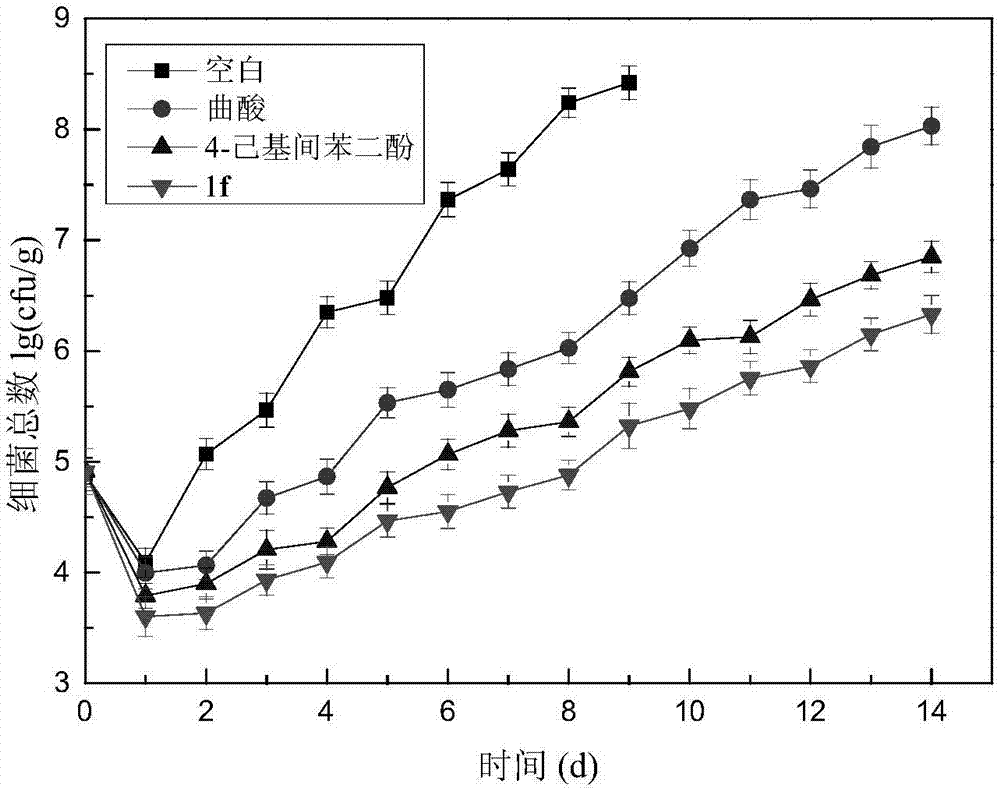
(2).细菌总数的测定
参照国标《食品微生物学检验菌落总数测定》gb4789.2-2010,利用平板计数法分别对空白组和实验组的样品在0-12天每天取样进行细菌菌落总数的测定。通常情况下,海虾细菌总数(cfu/g)≤105为一级鲜度,细菌总数≤5×105为二级鲜度,细菌总数达到106时,断定虾已经腐败变质,已不能食用,此时为货架期终点。图2反映了虾在4℃贮藏条件下细菌总数的变化情况。由图可知,每条曲线都是先下降后上升,且都是在第1d时达到了最小值。随着时间的延长,空白对照组到第4d时达到了货架期终点,而曲酸对照组、4-hr对照组和1f试验组分别在第8、11和13d达到货架期终点。由此可知,1f的抑菌能力较好于曲酸和4-hr,其保鲜效果稍优于4-hr,但却明显好于曲酸(p<0.05)。1f也略好于7b,用7b处理的试验组12d到达货架期终点。
(3).挥发性盐基氮(tvb-n)的测定
利用全自动凯氏定氮仪对虾样品中的挥发性盐基氮进行测定。具体方法如下:用无氮称量纸称取10g样品剪碎研磨均匀,置于750ml蒸馏管中,再往蒸馏管中加入50ml超纯水,摇晃混匀,然后加入1g氧化镁和3滴消泡剂(正辛醇)。然后将蒸馏管连接到蒸馏器上,设定1%硼酸接收液体积为30ml,蒸馏时间为300s;滴定管连接0.01mol/l的标准盐酸,启动仪器进行测定。对每批样品均做空白试验,tvb-n单位用mg/100g表示。
图3是几个不同处理组的虾在4℃贮藏条件下tvb-n的变化趋势图。tvb-n一般随着鲜度的下降而升高,根据gb2733-2005中规定,新鲜海虾的tvb-n≤30mg/100g。由图可知,所有小组在第一天时的tvb-n相差很小,随着时间的延长,空白对照组的tvb-n上升很快,其次是曲酸对照组,最后是4-hr对照组和1f试验组,且在前五天内,该两组的tvb-n值几乎相等。由图可知,空白对照组在第4d的tvb-n值为27.07mg/100g,第5d为34.3mg/100g,已经超过了30mg/100g;而曲酸对照组、4-hr对照组和1f试验组分别在第6、8和10d才超过30mg/100g。对比可知,1f试验组对于抑制虾的腐败明显强于4-hr和曲酸对照组(p<0.05),也略强于7b。7b实验组在第9d时tvb-n为30.19mg/100g,超过了这个可食用的临界值。
以上结果表明,化合物1f对南美白对虾具有良好的保鲜效果,在4℃下保存能显著延长其货架期。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!