一种京尼平的制备方法与流程
本发明属于生物工程技术领域,具体涉及一种京尼平的制备方法。
背景技术:
游离酶在酶反应的最适条件下进行催化,存在着容易失活、反应后不能回收等缺陷,且游离酶不易与产物分开,影响产品的提纯和质量。酶的固定化能有效地解决上述问题。固定化酶不仅具有酶的催化特性,而且反应后可用过滤或者离心的方式与反应液分离,可以反复使用。酶可以采用不同的载体和方法进行固定,酶在固定化后,酶学性质包括温度、pH、稳定性等与游离酶有很大的差别。纳米SiO2颗粒的粒径范围在1-100nm,具有分散性好、稳定性高、比表面积大、生物相容性高等优异的性质。
京尼平是栀子苷在β-葡萄糖苷酶的作用下的水解产物,是一种新型的生物交联剂,可与多种生物大分子进行交联,如明胶、壳聚糖、蛋白质、胶原蛋白等。京尼平的药效高于栀子苷,具有抗感染、肝脏保护等作用。目前,京尼平的生物制备主要依靠游离β-葡萄糖苷酶和微生物的反应来实现。在游离酶的反应体系中,京尼平容易与氨基酸或蛋白质生成可溶性的蓝色色素,因而影响了产品质量,降低了产率(Gong G H,et al.Purification and characterization of a β-glucosidase from Aspergillus niger and its application in the hydrolysis of geniposide to genipin[J].Journal of Microbiology and Biotechnology,2014,24(6):788-794.)。在微生物的反应体系中,虽不存在京尼平与大分子的交联反应,但反应速率较慢(Dong Y,et al.Biotransformation of geniposide in Gardenia jasminoides to genipin by Trichoderma harzianum CGMCC 2979[J].Chinese Journal of Catalysis,2014,35(9):1534-1546.)。常见的固定化载体有壳聚糖、海藻酸钙等,与纳米材料相比,存在固定化酶分散性差、载酶量低等问题(Yang Y S,et al.Transformation of geniposide into genipin by immobilized β-glucosidase in a two-phase aqueous-organic system[J].Molecules,2011,16(5):4295-4304.)。
技术实现要素:
本发明的目的是提供一种京尼平的制备方法,利用以纳米SiO2颗粒为载体,戊二醛为交联剂,与β-葡萄糖苷酶共价结合制备得到的纳米固定化酶,高效水解栀子苷,制备京尼平。
为实现上述目的,本发明的技术方案如下:
一种京尼平的制备方法,具体步骤如下:
步骤1,将氨基化修饰的纳米SiO2颗粒与戊二醛混合,得到Nano-SiO2@NH2@CHO,加入β-葡萄糖苷酶,在4℃下进行交联,交联结束后,离心收集纳米固定化酶;
步骤2,将栀子苷溶于pH为6.0的磷酸氢二钠-柠檬酸缓冲液中,加入纳米固定化酶,在50℃下反应1-3h,反应结束后离心,分离上清液得到京尼平,分离得到的纳米固定化酶重复使用。
优选地,步骤1中,交联时间为24h。
与常规载体制备的固定化酶相比,本发明的纳米固定化酶的载酶量更大、分散性更佳,对栀子苷的转化效率更高。本发明的纳米固定化酶不仅避免了京尼平和酶蛋白之间的交联反应,提高了产物的质量,而且能够重复使用,提高了酶的使用效率,降低了生产成本。
附图说明
图1为京尼平的生成量随反应时间的变化情况图。
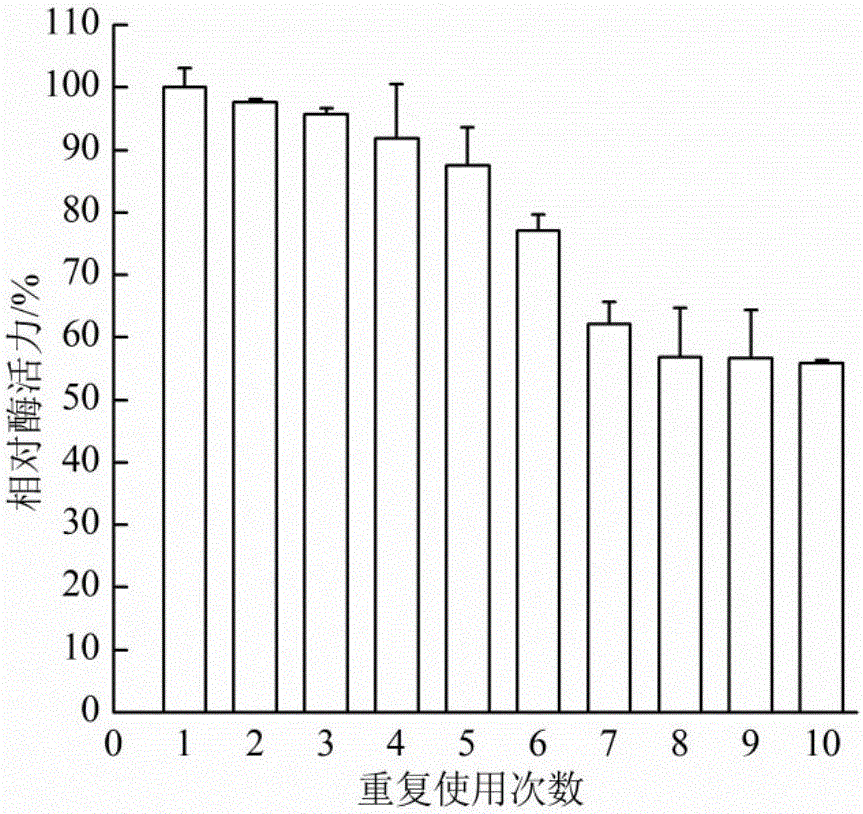
图2为纳米固定化酶的重复使用结果图。
具体实施方式
以下通过实施例和附图对本发明作进一步说明。
实施例中所用酶和药品均购自国药集团化学试剂有限公司。
实施例1
纳米SiO2颗粒的氨基化修饰可参考文献(Huang,J,et al.A new immobilized glucose oxidase using SiO2nanoparticles as carrier[J].Materials Science and Engineering C,2011,31(7):1374-1378.)。
将40mg纳米SiO2颗粒超声波分散在4mL无水乙醇中,加入80μL3-氨丙基三乙氧基硅烷(APTES),充分混匀,在30℃、120r/min摇床中反应24h,即完成纳米SiO2颗粒的氨基化过程,得到Nano-SiO2@NH2。反应结束后,将悬浊液在8000×g下离心3min,弃上清取沉淀,并将沉淀用蒸馏水洗涤5次。沉淀再用4mL磷酸缓冲液(10mM,pH 7.3)充分重悬后,加入1mL 25%的戊二醛溶液,在30℃、120r/min摇床中反应2h,即完成氨基化的载体与戊二醛的交联反应,得到Nano-SiO2@NH2@CHO。反应结束后,将悬浊液在8000×g下离心3min,弃上清取沉淀,同样将沉淀用蒸馏水洗涤5次后待用。将Nano-SiO2@NH2@CHO与过量的β-葡萄糖苷酶酶液混合,在4℃下偶联24h。反应结束后,将悬浊液在8000×g下离心3min,收集上清和纳米固定化酶,将纳米固定化酶用蒸馏水洗涤5次后待用。
在4.8mL磷酸氢二钠-柠檬酸缓冲液(50mM,pH 6.0)中加入200μL,1%(w/v)的栀子苷,再加入200μL纳米固定化酶(0.5U),在50℃水浴锅中反应1.5h,每隔10min进行取样,样品在8000×g下离心3min,利用高效液相色谱(HPLC)和薄层层析(TLC)测定上清中的栀子苷和京尼平的含量随反应时间的变化情况。反应结束后,离心回收纳米固定化酶,并进行第二个循环,测定上清中的栀子苷和京尼平的含量。重复10个循环,以第一个循环时京尼平的生成量为100%。
纳米固定化酶制备京尼平的结果如图1所示。从图中可以看出,反应速率很快,反应1h后,栀子苷的水解率为92.5%,反应1.5h后,栀子苷的水解率高达94%,京尼平的生成量为1.09mg。TLC的实验结果与HPLC的实验结果一致,随着反应时间的延长,栀子苷在纳米固定化酶的作用下逐渐生成京尼平,直到反应平衡。在文献报道的游离酶的催化反应体系中(Gong G,et al.Purification and characterization of a β-glucosidase from Aspergillus niger and its application in the hydrolysis of geniposide to genipin[J].Journal of Microbiology and Biotechnology,2014,24(6):788-794.),随着时间的延长,京尼平的产率会下降,这是由于京尼平与酶蛋白的交联反应,而纳米固定化酶在短时间内能够催化栀子苷生成京尼平,且纳米固定化酶容易与反应液分离,能有效解决该问题。
纳米固定化酶重复使用的结果如图2所示,利用纳米固定化酶制备京尼平的过程中,当重复使用5次时,残留酶活为87.5%,重复使用10次时,残留酶活仍为55.8%。重复使用次数是关系到纳米固定化酶能否实际应用的重要问题,本发明方法能够实现产物溶液中没有酶的残留,简化了提纯的工艺,另外,酶的使用效率也得到明显的提升,从而降低了生产成本。
- 还没有人留言评论。精彩留言会获得点赞!