新放线菌素A及其制备方法和用途与流程
本发明属于医药生物领域,涉及从海洋微生物获得新结构放线菌素衍生物新放线菌素A;及其制备方法和药物应用。
背景技术:
:
目前细菌耐药日益严重,研发新的抗生素迫在眉睫。放线菌素(英文名称:(Actinomycins)是一类色素肽类抗生素,由生色团母核吩噁嗪酮发色团通过酰胺键与两个五肽内酯环相连组成,具有抗肿瘤、抗菌、抗病毒和抗结核活性[袁薇,焦伟华,王颖,等.放线菌素生物合成研究进展[J].氨基酸和生物资源,2014,36(1):1-7;Anthony,B.M.;Helmut,L.The Actinomycins.In Anticancer Agents from Natural Products,Second Edition,CRC Press:2011;pp 363-382.]。近年来,本实验室从海洋微生物资源中研发出一系列具有生物活性的物质的放线菌素,其中发现新化合物、新天然产物以及该新型天然产物的半合成方法。
至今为止,自链霉菌属、小单孢菌属和类诺卡氏菌属等放线菌中发现了30多种天然放线菌素。放线菌素广泛分布链霉菌属各个种,比如抗生链霉菌(S.antibioticus),小链霉菌(S.parvulus),金羊毛链霉菌(S.chrysomallus),绿青链霉菌(S.iakyrus),弗氏链霉菌(S.fradiae),灰色链霉菌(S.griseus),稠李链霉菌东方变种(S.padanus)等。不仅在陆地上,分离自海绵的放线菌sh6004中也发现了放线菌素的存在[孙肇暘,杨秀萍.放线菌素研究进展[J].首都师范大学学报自然科学版,2011,32(1):54-59.]。
本发明从一株来源于海洋放线菌链霉菌IMB094(Streptomyces sp.IMB094)的发酵液活性成分中,分离获得新结构放线菌素衍生物,新放线菌素A(Neo-actinomycins A,化合物1,式I)。此外,以放线菌素D为原料,利用化学反应合成式I所示化合物1。体外抗菌活性表明,化合物1对包括MRSA(甲氧西林耐药金黄色葡萄球菌)、MRSE(甲氧西林耐药表皮葡萄球菌)、VRE(万古霉素耐药粪肠球菌、屎肠球菌)等多种耐药菌具有较好的抗菌活性。体外细胞毒性表明,化合物1对A549细胞(人肺腺癌细胞)和HCT116(人结肠癌细胞)和HepG2(人肝癌细胞)具有良好的细胞毒性。涉及化合物1的化学结构、制备方法、半合成方法、生物合成途径以及抗耐药菌和抗肿瘤活性,迄今为止,尚未见有关报道。
技术实现要素:
:
本发明目的之一是,提供一株产生放线菌素衍生物(新放线菌素A)的产生菌:海洋放线菌链霉菌,生物保藏编号为CGMCC 13680。
本发明目的之二是,提供一种放线菌素衍生物,新放线菌素A。
本发明从海洋放线菌IMB094(Streptomyces sp.IMB094)的发酵产物中发现的新放线菌素A,其结构如式Ⅰ所示。
化合物1:新放线菌素A(Neo-actinomycins A)
分子式C66H90N12O18,分子量1339。
本发明目的之三是,提供新放线菌素A的制备方法。
本发明所述的新放线菌素A的制备方法,包括以下步骤:
(1)将生物保藏编号为CGMCC 13680的海洋放线菌链霉菌IMB094菌种接种于配方为淀粉-葡萄糖-棉籽饼粉-蛋白胨-无机盐的发酵培养基,在摇瓶中,28℃,摇床培养120h;
(2)链霉菌(Streptomyces sp.)IMB094发酵液经固液分离后得到滤液和菌丝体;菌丝体用丙酮超声提取,得到菌丝体丙酮提取物;滤液经过大孔吸附树脂柱吸附,依次用水、丙酮洗脱;丙酮洗脱部分与菌丝体丙酮提取物合并,减压浓缩除去丙酮后得到发酵液浸膏;
(3)取发酵液浸膏,经正相硅胶柱色谱分离,依次用二氯甲烷-甲醇(50:1-0:100)梯度洗脱,得到10个组分(F1-F10);取馏分F5,F6和F7分别经过色谱柱色谱分离,用甲醇洗脱,然后经HPLC制备得到含有式Ⅰ所示化合物的混合物,混合物经过HPLC进行纯化得到式I所示化合物。
优选的,本发明所述的新放线菌素A的制备方法,包括以下步骤:
(1)将生物保藏编号为CGMCC 13680的海洋放线菌链霉菌IMB094菌种接种于配方为淀粉-葡萄糖-棉籽饼粉-蛋白胨-无机盐的发酵培养基,在摇瓶中,28℃,摇床培养120h;
(2)链霉菌(Streptomyces sp.)IMB094发酵液经固液分离后得到滤液和菌丝体;菌丝体用丙酮超声提取,得到菌丝体丙酮提取物;滤液经过XAD-7HP大孔吸附树脂柱吸附,依次用水、50%丙酮、90%丙酮洗脱;50%丙酮、90%丙酮洗脱部分与菌丝体丙酮提取物合并,减压浓缩除去丙酮后得到发酵液浸膏;
(3)取链霉菌(Streptomyces sp.)IMB094发酵液浸膏(25g),经正相硅胶柱色谱分离,依次用二氯甲烷-甲醇(50:1-0:100)梯度洗脱,得到10个组分(F1-F10);取馏分F5(20:1洗脱,0.36g),F6(9:1洗脱,0.54g),和F7(9:1洗脱,0.65g)分别经过Sephadex LH-20柱色谱柱色谱分离,用90%甲醇洗脱,然后经HPLC分离纯化得到混合物,将混合物在经过HPLC进行分离纯化,收集高分辨电喷雾质谱准分子离子峰m/z 1339.6542的峰得到式I所示化合物。
步骤3)中,馏分F4、F5为二氯甲烷-甲醇(20:1)分别依次洗脱4.0L得到,
馏分F6、F7为二氯甲烷-甲醇(9:1)依次洗脱4.5L得到。
其中,第1次HPLC分离纯化过程如下:
C-18色谱柱,5μm,20mm×250mm,75-100%甲醇线性梯度60min洗脱,10mL/min。
其中,第2次HPLC分离纯化过程如下:
C-18色谱柱,10mm×250mm,58%MeCN含0.5%甲酸洗脱,2mL/min。
58%MeCN含0.5%甲酸:浓度为58%的乙腈溶液中,含有浓度为0.5%的甲酸。
其中,制备方法中使用的链霉菌,优选为链霉菌(Streptomyces sp.)IMB094,系分离自中国大连黄海黑石礁海湾深度约40m的海底沉积物,该细胞株已经保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号:CGMCC No. 13680,保藏日期2017年2月24日,分类命名:链霉菌,地址:北京市朝阳区北辰西路1号院3号)。链霉菌(Streptomyces sp.)IMB094 16S rDNA基因序列如SEQ ID NO.1所示,提交NCBI,GenBank编号为KY111376。
本发明从海洋放线菌链霉菌(Streptomyces sp.)IMB094的发酵产物中,还发现式II所示化合物2、放线菌素D和X2。化合物2曾有文献报道通过化学合成得到[Sengupta,S.K.et al.J.Med.Chem.1983,26,1631;Sengupta,S.K.Anticancer actinomycin D analogs.US4562176A,1985]。文献中报道了该化合物的化学结构、紫外光谱和分子式信息,没有氢谱、碳谱等核磁共振波谱数据。由于化合物2作为天然产物是首次发现,因此命名为新放线菌素B。
化合物2:新放线菌素B(Neo-actinomycins B)
分子式C64H88N12O16,分子量1281。
本发明目的之四是,提供新放线菌素A的化学合成方法。
本发明所述的合成方法,是以放线菌素D(式II)为原料,合成新放线菌素A。
具体包括以下步骤:将放线菌素D(式III)与α-酮戊二酸(α-KG)分别溶解在水、DMSO或甲醇、乙醇等碳链≤4的醇类溶剂中,以水或含水量大于10%的混合溶剂为反应介质,经一步反应得到式Ⅰ所示的化合物。
优选的,本发明的合成方法,包括以下步骤:
储备液配置:将放线菌素D(4mg)溶解于0.5-1mL水、DMSO或甲醇、乙醇等碳链≤4的醇类溶剂中,配成6.4-12.8mM的溶液1;
将α-酮戊二酸(46.7mg)溶解于0.5-1mL水、DMSO或甲醇、乙醇等碳链≤4的醇类溶剂中,配成640-1280mM的溶液2。
合成方法:分别取50ul溶液1和溶液2,加入200ul反应溶剂,于磁力器上加热搅拌进行反应,即得。
其中,反应溶剂选自:水、含水量大于10%以上的混合溶剂,包括但不限于丙酮水溶液、碳链≤4的醇溶液、乙腈水溶液。
其中,放线菌素D是为已知化合物,可以在市场上购买到。
本发明目的之五是,提供新放线菌素A或以其为活性成分的药物组合物在制备抗耐药菌中的应用。
所述耐药菌包括:MRSA(耐甲氧西林金黄色葡萄球菌)、MRSE(耐甲氧西林表皮葡萄球菌)、VRE(耐万古霉素粪肠球菌、屎肠球菌)。
本发明目的之六是,提供新放线菌素A或以其为活性成分的药物组合物在抗肿瘤药物中的应用。
其中,所述肿瘤包括:肺癌、结肠癌、肝癌。
本发明采用琼脂稀释法测试了所述新放线菌素A对包括MRSA、MRSE、VRE在内多种耐药菌的最小抑菌浓度(MIC)。采用磺酰罗丹明(SRB)染色法测试了所述新放线菌素A对包括A549细胞(人肺腺癌细胞)、HCT116(人结肠癌细胞)和HepG2(人肝癌细胞)进行抗肿瘤活性测定。实验结果显示这些化合物对所试验的耐药菌株具有较好的抗菌活性,对所试验的肿瘤细胞具有较强的抑制作用。表明所述放线菌素衍生物可用于制备抗耐药菌和抗肿瘤的药物。
而以所述衍生物作为活性成分,与药学上可接受的一种或多种载体、赋形剂或辅料配伍,可制成抗耐药菌感染和抗肿瘤的药物组合物。所述药物及药物组合物可用于耐药菌感染和抗肿瘤的临床治疗。所述化合物也可与已知药物组成复方制剂用于耐药菌感染的治疗。
本发明中经微生物发酵制备式Ⅰ所示新放线菌素A的方法,可适用于其他能产生此类化合物的任何微生物。
本发明的目的之七在于,提供以放线菌素衍生物A为活性成分的药物组合物。
本发明的药物组合物,包括放线菌素衍生物A,以及药学上可接受的载体。
其中,药学上可接受的载体以重量计是药物组合物总重量的0.1-99.9%。
其中,药学上可接受的载体包括甘露醇、山梨醇、山梨酸或钾盐、焦亚硫酸钠、亚硫酸氢钠、硫代硫酸钠、盐酸半胱氨酸、巯基乙酸、蛋氨酸、维生素A、维生素C、维生素E、维生素D、氮酮、EDTA二钠、EDTA钙钠,一价碱金属的碳酸盐、醋酸盐、磷酸盐或其水溶液、盐酸、醋酸、硫酸、磷酸、氨基酸、氯化钠、氯化钾、乳酸钠、木糖醇、麦芽糖、葡萄糖、果糖、右旋糖苷、甘氨酸、淀粉、蔗糖、乳糖、甘露糖醇、硅衍生物、纤维素及其衍生物、藻酸盐、明胶、聚乙烯吡咯烷酮、甘油、丙二醇、乙醇、土温60-80、司班-80、蜂蜡、羊毛脂、液体石蜡、十六醇、没食子酸酯类、琼脂、三乙醇胺、碱性氨基酸、尿素、尿囊素、碳酸钙、碳酸氢钙、表面活性剂、聚乙二醇、环糊精、β-环糊精、磷脂类材料、高岭土、滑石粉、硬脂酸钙、硬脂酸镁、微晶中一种或以上;优选所述的载体为微晶纤维素、乳糖、淀粉、羧甲基纤维素钠、低取代羟丙基纤维素、滑石粉中一种或以上。
本发明的药物组合物,可以制备成任何要用剂型。所述的制剂为片剂、糖衣片剂、薄膜衣片剂、肠溶衣片剂、胶囊剂、硬胶囊剂、软胶囊剂、口服液、口含剂、颗粒剂、丸剂、散剂、膏剂、丹剂、混悬剂、溶液剂、注射剂、栓剂、软膏剂、硬膏剂、霜剂、喷雾剂、贴剂任意一种;优选所述的制剂为胶囊剂、颗粒剂或片剂。
发明效果:
本发明从来源于海洋放线菌IMB094(Streptomyces sp.IMB094)的发酵产物中,获得如式Ⅰ所示的放线菌素衍生物:新放线菌素A。以放线菌素D为原料,通过化学合成式Ⅰ所示化合物。体外抗菌活性表明,式Ⅰ所示化合物对包括MRSA(耐甲氧西林金黄色葡萄球菌)、MRSE(耐甲氧西林表皮葡萄球菌)、VRE(耐万古霉素粪肠球菌、屎肠球菌)等多种耐药菌具有较好的抗菌活性。体外细胞毒性表明,式Ⅰ所示化合物对A549细胞(人肺腺癌细胞)、HCT116(人结肠癌细胞)、HepG2(人肝癌细胞)具有较强的抗肿瘤细胞活性,有望开发成为临床上抗耐药菌和抗肿瘤的新型药物。
附图说明:
图1:链霉菌(Streptomyces sp.)IMB094的16S rRNA基因序列的系统发育进化树分析
图2:化合物1的高分辨电喷雾质谱
图3:化合物1的1H NMR谱
图4:化合物1的13C NMR谱
具体实施方式:
本发明实施方案适用于从任何微生物,而不限于从链霉菌发酵液制备放线菌素及其衍生物。以下所列实施例是为帮助本领域技术人员更好的理解本发明,但不以任何方式限制本发明。
<实施例1>链霉菌(Streptomyces sp.)IMB094的鉴定
a)菌株来源:链霉菌(Streptomyces sp.)IMB094由本实验室从中国大连黄海黑石礁海湾(38°49'N,121°34'E)深度约40m的海洋沉积物中分离获得。
b)菌株鉴定:根据16S rRNA基因序列在微生物种属中的保守性,对链霉菌(Streptomyces sp.)IMB094进行鉴定。提取链霉菌(Streptomyces sp.)IMB094的基因组,PCR扩增其16S rRNA基因并进行测序,提交到NCBI GenBank数据库获得登陆号为KY111376,其序列如SEQ ID NO.1所示。系统发育进化树如图1所示。
SEQ ID NO.1
表明,该菌属于链霉菌科链霉菌属中的一种,据此将该菌命名为链霉菌(Streptomyces sp.)IMB094,并于2017年2月24日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:CGMCC 13680。
<实施例2>链霉菌(Streptomyces sp.)IMB094的发酵
取活化的链霉菌(Streptomyces sp.)IMB094平板,挑取约1cm2菌苔接种于100mL发酵培养基[配方为:淀粉1.0g,葡萄糖2.5g,棉籽饼粉1.0g,蛋白胨0.3g,无机盐如KH2PO40.01g,MgSO4 0.01g,NaCl 0.5g,CaCO3 0.5g等,去离子水100mL],在500mL摇瓶中,28℃,200r/min摇床培养120h。
<实施例3>发酵液的提取与浸膏的获得
链霉菌(Streptomyces sp.)IMB094发酵液经固液分离后得到滤液和菌丝体;菌丝体用丙酮超声提取,得到菌丝体丙酮提取物;滤液经过XAD-7HP大孔吸附树脂柱吸附,依次用水、50%、90%丙酮洗脱;50%、90%丙酮洗脱部分与菌丝体丙酮提取物合并,减压浓缩除去丙酮后得到发酵液浸膏。
<实施例4>化合物1的分离、制备及结构鉴定
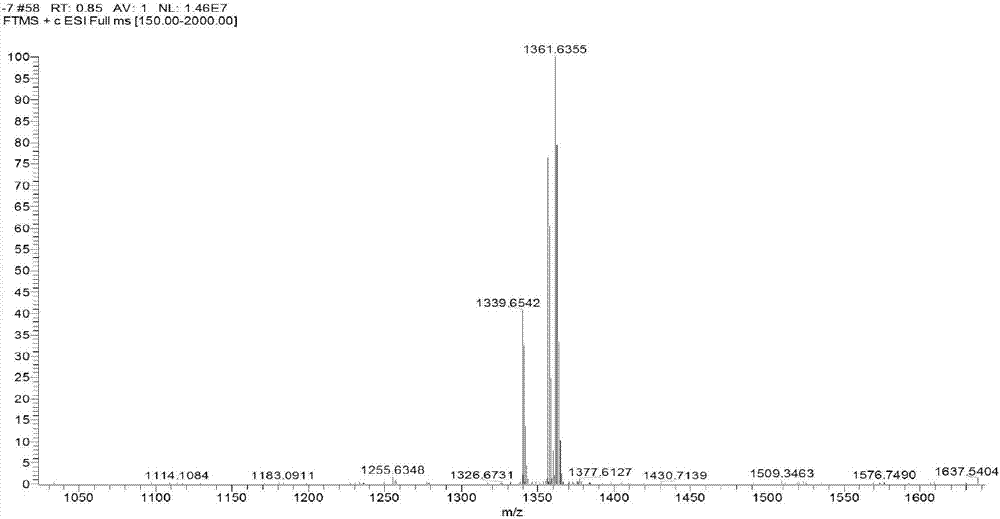
取链霉菌(Streptomyces sp.)IMB094发酵液浸膏(25g),经正相硅胶柱色谱分离,依次用二氯甲烷-甲醇(50:1-0:100)梯度洗脱,得到10个组分(F1-F10);其中,馏分F1-F3为二氯甲烷-甲醇(50:1)分别洗脱3L得到,馏分F4-F5为二氯甲烷-甲醇(20:1)分别依次洗脱4.0L得到,馏分F6-F7为二氯甲烷-甲醇(9:1)依次洗脱4.5L得到。取馏分F5(20:1,0.36g),F6(9:1,0.54g),和F7(9:1,0.65g)分别经过Sephadex LH-20柱色谱柱用90%甲醇洗脱,经过HPLC制备(Capcell MGII 5μm,20mm×250mm,75-100%MeOH线性梯度60min,10mL/min)分别得到混合物1(tR:23.96-30.60min)和混合物2(tR:34.25-41.26)。混合物1经HPLC进行再次纯化(10mm×250mm C-18column,58%MeCN含0.5%甲酸),收集高分辨电喷雾质谱(HRESIMS)准分子离子峰m/z 1339.6542的峰得到新放线菌素A;混合物2经HPLC进行再次纯化(10mm×250mm C-18column,75%MeCN含0.5%甲酸),收集HRESIMS准分子离子峰m/z 1281.6512得到新放线菌素B。
式Ⅰ所示化合物1:新放线菌素A结构鉴定
化合物1为红色粉末,易溶于甲醇、丙酮、氯仿、DMSO,略溶于水。高分辨电子喷雾质谱(HRESIMS)显示出准分子离子峰m/z 1339.6542[M+H]+(图2),结合核磁共振波谱(NMR)数据,确定其分子式为C66H90N12O18,提示分子中有28个不饱和键。根据化合物1的红外光谱,提示结构中含有羰基碳(1743cm-1),酰胺键(1647cm-1)和芳香环(1505cm-1)。氢谱(1H NMR,图3)显示出多肽类化合物的特征信号,包括5个氨基NH质子(δH 7.2-11.7),12氨基酸α-质子(δH 3.2-6.3),和2个酯键质子(δH 5.14和5.24)。此外,氢谱中观察到两个邻位取代的芳香质子[δH 6.62(d,H-8)和7.11(d,H-7)],4个氮甲基NMe质子[δH 2.75(s,6H)和3.19(s,6H)]以及另外12个甲基信号(δH 0.7-2.3)。化合物1的碳谱(13C NMR,图4)和DEPT谱,显示出13个羰基碳信号(δc 165-173),10个α-氨基酸碳(δc 51-70),提示化合物1为多肽类化合物。碳谱中的其它碳信号还包括16个甲基,8个亚甲基,2个sp2次甲基,6个sp3次甲基,和11个sp2季碳信号(δc 100-165),这些信号与已知放线菌素类化合物特征相同[Bitzer,J.;Streibel,M.;Langer,H.-J.;Grond,S.Org.Biomol.Chem.2009,7,444;Sengupta,S.K.;Madhavarao,M.S.;Kelly,C.;Blondin,J.J.Med.Chem.1983,26,1631.]。将化合物1和放线菌素D的氢谱和碳谱数据对比发现,两个化合物肽内酯环上的氢、碳原子化学位移基本一致,但是在生色基团的氢、碳谱数据有显著区别,提示化合物1的生色基团母核发生了改变。化合物1的紫外(UV)光谱最大吸收峰(410nm)较放线菌素D发生红移的佐证了上述推测。
全面分析二维核磁共振波谱数据(HSQC,COSY,HMBC),揭示化合物1中含有10个氨基酸残基:2个苏氨酸残基(Thr),2个缬氨酸残基(Val),2脯氨酸残基(Pro),2个氮甲基甘氨酸(Sar),2个氮甲基缬氨酸残基(MeVal)。经过HMBC谱相关信号分析,表明这些氨基酸残基的连接顺序与放线菌素D完全一致。HSQC谱显示,两个芳香质子H-7和H-8与两个重叠的碳信号δC 122.0(C-7和C-8)相关。在HMBC光谱中,H-8与C-6(δC 113.4)、C-9a(δC 140.7)和甲基碳C-12(δC 14.8)在相关信号,,而H-7与C-5a(δC 131.3),C-6,C-9(δC 127.5)和羰基碳C-14(δC 166.6)存在相关峰。δH 11.74处的氨基NH活泼氢质子与C-4(δC 100.2),C-4a,C-6,C-9a和C-10a(δC 139.5)有相关信号,δH 2.27(s,H3-13)与C-10a,C-11(δC 111.8)和C-11a有相关信号。根据这些HMBC相关信号,结合质子和碳的化学位移,可以确定分子中存在9,11-二甲基-5H-吩噁嗪结构。根据C-11a(δC 143.5)的化学位移,表明该sp2杂化碳与氧原通过C-O单键相连,而不是在经典的放线菌素结构中的C=O双键。此外,C-18的化学位移(δC 173.1)表明该碳原子为游离羧基碳。从相互偶合的亚甲基质子H2-16(δH 3.17)和H2-17(δH 2.89)与C-18和另一个季碳δC 165.8(C-2)均存在相关峰,揭示了分子中存在N=CCH2CH2COOH结构单元。该结构单元,与之前确定的两个肽链单元以及11a-O-9,11-二甲基-5H-吩恶嗪,共有27个不饱和度。根据分子式确定的28个不饱和度,说明化合物1还存在一个环,提示季碳C-2分别经氮原子和氧原子与C-3和C-11相连,形成一个噁唑环,从而最终确定了化合物1的平面结构。
化合物1中氨基酸的绝对构型经酸水解后利用高级Marfey法得到确定,与放线菌素D中的氨基酸残基构型一致。通过比较水解产物与L-和D/L-FDLA形成的衍生物的HPLC保留时间,表明除缬氨酸为D-构型外,基余氨基酸为L-构型。因此,化合物1的结构确定为如式I所示,该化合物未见文献报道,为新结构化合物,命名为新放线菌素A(Neo-actinomycin A)。
新放线菌素A(1)的理化数据:红色无定形粉末;[α]20D-97.7(c 0.35,MeOH);UV(MeOH)λmax(logε)251(4.50),410(4.12)nm;ECD(c 1.89×10-4M,MeOH)λmax(Δε)210(-27.4),242(+1.1),277(-7.0),405(-2.0)nm;IR vmax 3397,2922,1743,1647,1505,1467,1259,1194,1098cm-1;1H NMR(DMSO-d6,600MHz,图2)和13C NMR(DMSO-d6,150MHz,图3)数据,见表1;HRESIMS m/z 1339.6542[M+H]+(计算值C66H91N12O18,1339.6569),1361.6355[M+Na]+(计算值C66H90N12O18Na,1361.6388)。
表1.新放线菌素A的1H和13C NMR数据(DMSO-d6)
a1H and 13C NMR data were recorded at 600and 150MHz,respectively.
<实施例5>化合物1的抗菌活性试验
1、实验材料
检定菌株:Staphylococcus aureus ATCC29213(甲氧西林敏感金黄色葡萄球菌);Staphylococcus aureus 15(甲氧西林敏感金黄色葡萄球菌);Staphylococcus aureus ATCC33591(甲氧西林耐药金黄色葡萄球菌);Staphylococcus aureus 13-17(甲氧西林敏感金黄色葡萄球菌);Staphylococcus aureus 13-18(甲氧西林耐药金黄色葡萄球菌);Staphylcoccus epidermidis ATCC12228(甲氧西林敏感表皮葡萄球菌);Staphylococcus epidermidis 13-1(甲氧西林敏感表皮葡萄球菌);Staphylococcus epidermidis 13-3(甲氧西林敏感表皮葡萄球菌);Enterococcus faecalis ATCC29212(万古霉素敏感粪肠球菌);Enterococcus faecalis 13-4(万古霉素敏感粪肠球菌);Enterococcus faecalis ATCC51299(万古霉素耐药粪肠球菌);Enterococcus faecalis ATCC51575(万古霉素耐药粪肠球菌);Enterococcus faecalis ATCC700221(万古霉素耐药屎肠球菌);Enterococcus faecalis 12-1(万古霉素耐药屎肠球菌);Enterococcus faecium 13-71(万古霉素敏感屎肠球菌);Escherichia coli ATCC 25922(大肠埃希菌);Escherichia coli 1515(大肠埃希菌);Escherichia coli 14-10(大肠埃希菌);Escherichia coli 14-11(ESBLsg耐药大肠埃希菌);Klebsiella pneumoniae ATCC 700603(ESBLs耐药肺炎克雷伯杆菌);Klebsiella pneumoniae 7(肺炎克雷伯杆菌);Klebsiella pneumoniae ATCC BAA-2146(产NDM-1肺炎克雷伯杆菌);Klebsiella pneumoniae 14-4(肺炎克雷伯杆菌);Klebsiella pneumoniae 14-15(产ESBLs肺炎克雷伯杆菌);Pseudomonas aeruginosa ATCC 27853(铜绿假单胞菌);Pseudomonas aeruginosa PAO1(铜绿假单胞菌);Pseudomonas aeruginosa 13-46(铜绿假单胞菌);Acinetobacter calcoacetious ATCC 19606(鲍曼不动杆菌);Enterobacter cloacae ATCC 43560(阴沟肠杆菌);Enterobacter aerogenes ATCC 13048(产气肠杆菌);Serratia marcescens ATCC 21074(粘质沙雷氏菌);Morganella morganii ATCC 25830(摩氏摩根菌);Providentia rettgeri(雷极普鲁菲登杆菌)ATCC 31052;Proteus vulgaris ATCC 29905(普通变形杆菌);Proteus mirabilis 13-1(奇异变形杆菌);Stenotrophomonas maltophilia ATCC 13636(嗜麦芽假单孢菌);Citrobacter freundii ATCC 43864(弗劳地枸橼酸菌)。以上菌株由中国医学科学院医药生物技术研究所药理室保存。
LB肉汤培养基:酵母提取物0.5g,胰蛋白胨1.0g,NaCl 0.5g,蒸馏水100mL,pH 7.4~7.6。
LB琼脂培养基:酵母提取物0.5g,胰蛋白胨1.0g,NaCl 0.5g,蒸馏水100mL,琼脂2.0g,pH 7.4~7.6。
Mueller-Hinton肉汤培养基:牛肉膏0.2g,可溶性淀粉0.15g,酸水解酪蛋白1.75g,蒸馏水100mL,pH值7.4±0.2。
Mueller-Hinton琼脂培养基:牛肉膏0.2g,可溶性淀粉0.15g,酸水解酪蛋白1.75g,蒸馏水100mL,琼脂2.0g,pH值7.4±0.2。
CM0984VRE BROTH BASE培养基(购自OXOID公司)。
CM0984VRE AGAR BASE培养基:每100mL CM0984VRE BROTH BASE中加入2.0g琼脂。
对照样品:左氧沙星(购自中国食品药品检定院)。
2、实验方法
采用琼脂稀释法测定样品对各株检定菌的MIC值,具体如下:
a)样品配置:精确称取适量左氧沙星,溶于纯水中,配置成一定终浓度溶液,然后用纯水按倍比稀释成所需浓度溶液,供活性测试用;精确称取适量的化合物1样品以及其他化合物样品,溶于二甲基亚砜(DMSO)中,配置成一定终浓度溶液,然后用DMSO按倍比稀释成所需浓度溶液,供活性测试用。
b)含药琼脂平板制备:将已倍比稀释的不同浓度的样品分别加入已加热溶解,并在45~50℃水浴中平衡的Mueller-Hinton琼脂培养基(或LB琼脂培养基、CM0984VRE AGAR BASE培养基)中,充分混匀倾倒灭菌平皿,琼脂厚度3~4mm;按1∶9比例配制药物琼脂平板;各含药琼脂平板的样品终浓度分别为0.25、0.5、1.0、2.0、4.0、8.0、16、32、64、128、256μg/mL。
c)接种物制备与接种:取各检定菌甘油管按1%(v/v)接种于约3mL液体Mueller-Hinton肉汤培养基;接种后于37℃,200rpm振摇培养过夜;菌液根据菌浓稀释,以多点接种器吸取制备好菌液(约1~2μl)接种于琼脂平板表面,各检定菌使用与制备菌液相同的培养基制备琼脂平板。每点菌数约为104CFU(菌落形成单位),形成直径为5~8mm的菌斑,接种好后置35℃孵育18h。
d)结果判断:将平板置于暗色、无反光物体表面上判断试验终点,以肉眼可见的抑制细菌生长的最低加药浓度为最低抑菌浓度(MIC)。
3、实验结果:式I、II、III所示新放线菌素A以及对照样品对20株检定菌的MIC值见表5。
实验结果表明,新放线菌素A对包括MRSA和VRE在内的15株检定菌,显示出这些化合物具有良好的抗菌活性,绝大部分的MIC值在1~64μg/mL;式I所示新放线菌素A可用作抗耐药菌感染的药物,或以其为活性成分,与药学上可接受的一种或多种载体、赋形剂或辅料配伍,制成抗耐药菌感染的药物组合物。
表3.放线菌素衍生物体外抗菌活性结果(MIC,单位ug/mL)
<实施例6>新放线菌素A抗肿瘤活性试验
1、实验材料
检定细胞株:A549细胞(人肺腺癌细胞)、HCT116(人结肠癌细胞)和HepG2(人肝癌细胞)。
所需试剂:三羟甲基氨基甲烷(Tris)、醋酸、三氯醋酸(TCA)、磺酰罗丹明(SRB,sigma S9012)、96孔板、10mM Tris溶液(pH10.5)、1%醋酸、50%三氯醋酸(TCA)、SRB溶液(0.4%SRB和1%醋酸)。
实验仪器:细胞培养设备2、酶联免疫检测仪(检测波长490nm、515nm)。
2、实验方法
2.1给药
根据肿瘤细胞生长速率,将处于对数生长期的贴壁肿瘤细胞以200μL/孔接种于96孔培养板,贴壁生长24h后加药,每个浓度设3复孔。并设相应浓度的生理盐水溶媒对照及无细胞调零孔。肿瘤细胞在37℃、5%CO2条件下培养72h。
2.2固定
取出培养板,每孔加入50%(m/v)的三氯乙酸(TCA)50uL固定细胞,4℃放置lh。若培养的是悬浮细胞。则加80%的冷TCA50uL,TCA的终浓度为16%,先静置5min,再放入4℃冰箱中1h。
2.3洗涤
弃固定液,用蒸馏水洗涤5次,空气中自然干燥。
2.4染色
在空气中干燥后,每孔加SRB溶液100uL,室温下放置10-30min。
2.5洗涤
去上清液,用1%醋酸洗涤5次,空气干燥。
2.6溶解
最后加入150μL/孔的Tris溶液,在平板振荡器上振荡5min。
2.7测量
在酶联免疫检测仪测定OD值,用空白对照调零,所用波长为515nm。
2.8计算
按以下公式计算肿瘤细胞生长的抑制率:抑制率=[(OD515对照孔-OD515给药孔)/OD515对照孔]×100%。
根据各浓度抑制率,采用Logit法计算半数抑制浓度IC50。以上每个实验重复2~3次,求出2~3次实验的平均IC50。值作为最终指标。
2、实验结果
结果显示,新放线菌素A(1)对A549、HCT116和HePG2均具有较强的细胞毒活性,IC50在纳摩尔水平(见表4)。
表4放线菌素衍生物体外细胞毒活性结果(IC50,单位:nM)
<实施例7>新放线菌素A的前体添加原位合成试验
向500ml锥形瓶中加入100ml M8培养基,接种链霉菌(Streptomyces sp.)IMB094的孢子悬浮液。28℃恒温培养4天后,向培养基中分别加入1mg/ml的α-酮戊二酸和丙酮酸,继续在28℃恒温200rpm摇床培养1天。
后处理:将处理过发酵液和未经任何处理的阴性对照发酵液,离心取上清,上清液用乙酸乙酯萃取。将乙酸乙酯萃取液用HPLC-MS进行液质分析。
分析条件:Capcell MGII C-18 3μM,3.0mm×150mm;流动相A(0.1%甲酸水溶液),流动相B(乙腈加入0.1%甲酸);线性梯度:0-30min,35-80%流动相B;流速,0.5mL/min。
实验结果:与未添加前体的阴性对照相比,加入α-酮戊二酸后发酵液中新放线菌素A含量明显提高。
<实施例8>新放线菌素A的化学合成试验
储备液配置:将放线菌素D(4mg)溶解于0.5mL水、DMSO或甲醇、乙醇等碳链≤4的醇类溶剂中,配成6.4mM的溶液1;
将α-酮戊二酸(46.7mg)溶解于0.5mL水、DMSO或甲醇、乙醇等碳链≤4的醇类溶剂中,配成640mM的溶液2。
合成方法:分别取50ul溶液1和溶液2,加入反应溶剂200ul水中,于磁力器上加热搅拌进行反应,36小时然后进行HPLC-MS检测,结果表明新线菌素A的反应产率为10%左右。若使用甲醇作为反应溶剂,反应无法进行。
其中,反应溶剂选自:水、含水量大于10%以上的混合溶剂,包括但不限于丙酮水溶液、碳链≤4的醇溶液、乙腈水溶液。
序 列 表
<110> 中国医学科学院医药生物技术研究所
<120> 新放线菌素A及其制备方法和用途
<160> 1
<210> 1
<211> 1424
<212> DNA
<213> Streptomyces sp. IMB094
<220>
<223> 16SrDNA
<400>
1 cgggtcaacc ttcgacagct ccctcccaca aggggttggg ccaccggctt cgggtgttac
61 cgactttcgt gacgtgacgg gcggtgtgta caaggcccgg gaacgtattc accgcagcaa
121 tgctgatctg cgattactag caactccgac ttcatggggt cgagttgcag accccaatcc
181 gaactgagac cggctttttg agattcgctc cacctcacgg tatcgctgct ctttgtaccg
241 gccattgtag cacgtgtgca gcccaagaca taaggggcat gatgacttga cgtcgtcccc
301 accttcctcc gagttgaccc cggcggtctc ctgtgagtcc ccatcatccc gaaggacatg
361 ctggcaacac agaacaaggg ttgcgctcgt tgcgggactt aacccaacat ctcacgacac
421 gagctgacga cagccatgca ccacctgtac accgaccaca agggggcgac catctctggc
481 cgtttccggt gtatgtcaag ccttggtaag gttcttcgcg ttgcgtcgaa ttaagccaca
541 tgctccgctg cttgtgcggg cccccgtcaa ttcctttgag ttttagcctt gcggccgtac
601 tccccaggcg gggaacttaa tgcgttagct gcggcaccga cgacgtggaa tgtcgccaac
661 acctagttcc caccgtttac ggcgtggact accagggtat ctaatcctgt tcgctcccca
721 cgctttcgct cctcagcgtc agtaatggcc cagagatccg ccttcgccac cggtgttcct
781 cctgatatct gcgcatttca ccgctacacc aggaattccg atctccccta ccacactcta
841 gctagcccgt atcgaatgca gacccggggt taagccccgg gctttcacac ccgacgtgac
901 aagccgccta cgagctcttt acgcccaata attccggaca acgcttgcgc cctacgtatt
961 accgcggctg ctggcacgta gttagccggc gcttcttctg caggtaccgt cactttcgct
1021 tcttccctgc tgaaagaggt ttacaacccg aaggccgtca tccctcacgc ggcgtcgctg
1081 catcaggctt tcgcccattg tgcaatattc cccactgctg cctcccgtag gagtctgggc
1141 cgtgtctcag tcccagtgtg gccggtcgcc ctctcaggcc ggctacccgt cgtcgccttg
1201 gtgagccatt acctcaccaa caagctgata ggccgcgggc tcatcctgca ccgccggagc
1261 tttcgaccct cacagatgcc tgcaagagtg atatccggta ttagaccccg tttccagggc
1321 ttgtcccaga gtgcagggca gattgcccac gtgttactca cccgttcgcc actaatccac
1381 cccgaagggc ttcatcgttc gacttgcatg tgtaagcacc cgcc
- 还没有人留言评论。精彩留言会获得点赞!