制备植物来源的VLP的方法与流程
本申请是中国专利申请cn201080042333.0的分案申请,原申请是国际申请号pct/ca2010/001488于2012年3月22日进入中国国家阶段的申请。本发明涉及制备植物来源的病毒样颗粒(viruslikeparticle,vlp)的方法。
背景技术:
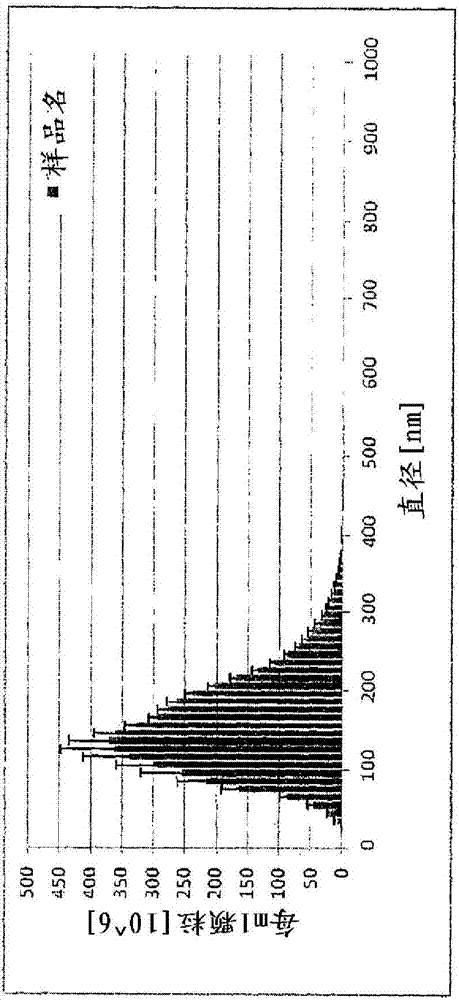
:目前宿主细胞(如大肠杆菌、昆虫细胞培养物和哺乳动物细胞培养物)中的重组表达策略在培养基中以非常高的水平表达和分泌蛋白质。使用这些系统获得了高水平表达、正确蛋白质折叠和蛋白质翻译后修饰。此外,由于可以容易地将细胞内蛋白质与其他组分(dna、囊泡、膜、色素等)分离,所表达蛋白质的纯化得以简化。对于植物或酵母表达系统,细胞壁阻止表达的蛋白质分泌到培养基中。对抗病毒感染的一种主要方法是通过免疫接种。应对流行爆发或满足季节性需求(例如,每年秋季发生的“流感季”或最近全球爆发的“猪流感”)的疫苗生产需要在获知后短时间内生产足量的疫苗。在面对全球流感大流行时,目前全球的流感疫苗产量可能不足。此外,主导(dominant)流感毒株每年变化,因此在一年中的低需求时间中储备是不实际的。经济、大规模地生产有效的流感疫苗有显著价值。病毒样颗粒(vlp)可用于制备流感疫苗。超结构(suprastructure)(如vlp)模拟病毒衣壳结构,但缺少基因组,从而不能复制或提供再次感染。vlp刺激强免疫应答,为分离(可溶)的重组抗原提供了替代方法。vlp在特定病毒蛋白表达后进行组装并具有类似于其同类病毒的外表面,但不同于真的病毒颗粒,遗传物质不会整合到其中。与天然病毒类似的颗粒状多价结构抗原的呈递引发具有均衡的体液和细胞成分的增强的免疫应答刺激。认为优于分离抗原产生之刺激的这种改进对于包膜病毒尤其适用,因为包膜vlp以其天然膜结合状态呈递表面抗原(grgacic和anderson,2006年,methods40,60-65)。此外,已证明与重组血凝素(ha)(即单体ha,或组成花环的ha;3-8个三聚体的ha组装物)相比,拥有纳米颗粒组织结构的流感vlp是更佳的候选疫苗,并且他们能激活体液和细胞免疫应答。(bright,r.a.,等,2007,vaccine25,3871-3878)。目前市场上的绝大部分流感疫苗由从蛋中培养之病毒粒获得的病毒颗粒或病毒抗原构成。来源于蛋的疫苗的生产依赖于在具有胚胎的鸡蛋中培养活病毒。在用去污剂化学灭活和破坏纯化的病毒粒后获得裂解流感疫苗。作为大流行性疫苗产品,重组流感抗原是病毒来源抗原的有效替代品。一旦可获得新毒株的遗传构成信息,可以使用该信息生产重组抗原,并且其允许快速启动生产过程。但是,与灭活的裂解流感疫苗相比,纯化的重组ha亚基表现出更低的效力,并且需要更高的抗原含量来产生强免疫应答(treanor等,2007,j.am.med.assoc.297,1577-1582)。已通过在培养的哺乳动物细胞中共表达全部10种流感病毒蛋白获得流感vlp(mena等,1996年,j.virol.70,5016-5024)。几种病毒蛋白对于vlp的生产是可缺省的,而且在疫苗发展中已通过共表达2种主要抗原性包膜蛋白(ha和na)以及m1或者仅共表达ha和m1生产流感vlp(kang等,2009年,virusres.143,140-146)。chen等(2007年,j.virol.81,7111-7123)证实单独的ha可以驱动vlp形成和出芽,在他们的系统中可以省去m1共表达。但是,由于发现ha与产生vlp的哺乳动物细胞表面的唾液酸化糖蛋白结合,所以共表达了病毒唾液酸酶以使vlp在出芽后从生产细胞中释放。期望有更简单的vlp生产系统(例如依赖于表达仅一种或几种病毒蛋白质而不需要表达非结构病毒蛋白的生产系统)以加快疫苗的开发。在植物系统中生产病毒抗原(包括vlp)提供了这样的生产优势,既它们可以在温室或田间培养,不需要无菌组织培养法和处理。pct公开wo2006/119516(williamson和rybicki)公开了在植物中表达流感病毒a/越南/1194/2004的全长和截短的人密码子优化h5ha。截短的构建体缺少膜锚定结构域。通过靶向er的构建体获得最高的ha蛋白积累。缺少膜靶向结构域的构建体没有产生可检测的ha。没有报道vlp的生产情况。之前wo2009/009876和wo2009/076778的发明人已描述了包含脂质包膜的流感havlp的生产(d'aoust等;两者均通过引用并入本文)。对于包膜病毒,病毒保留脂质层或膜可以是有利的。不同系统的脂质构成可以有所不同(例如植物生成的包膜病毒会在包膜中包含植物脂质或植物甾醇),这可有助于增强免疫应答。mason等描述了表达hbv表面抗原(hbsag)的转基因烟草中包膜vlp的组装(1992年,proc.natl.acad.sci.usa89,11745-11749)。已证明植物生成的hbvvlp在肠胃外施用时在小鼠中显示出诱导强b和t细胞免疫应答((huang等,2005年,vaccine23,1851-1858),但饲喂实验的口服免疫仅诱导了中度的免疫应答(smith等,2003年,vaccine21,4011-4021)。greco(2007年,vaccine25,8228-8240)证明与hbsag融合的人免疫缺陷病毒(hiv)表位在转基因烟草和拟南芥(arabidopsis)中表达时累积为vlp,产生了二价vlp疫苗。在转基因烟草和马铃薯植株中表达病毒衣壳蛋白(nvcp)导致无包膜vlp的组装(mason等,1996年,proc.natl.acad.sci.usa93,5335-5340)。已在农杆菌浸润的本塞姆氏烟草(n.benthamiana)叶中产生了nvcpvlp(huang等2009年,biotechnol.bioeng.103,706-714),并且在小鼠中证实了其口服施用后的免疫原性(santi等,2008年,vaccine26,1846-1854)。给健康成人志愿者施用含有215-751μgvlp形式的nvcp的2或3剂量生马铃薯在95%的免疫志愿者中产生免疫应答(tacket等2000年,j.infect.dis.182,302-305)。还由hbv核心抗原(hbcag;huang等,2009年,biotechnol.bioeng.103,706-714)、人乳头状瘤病毒(hpv)主要衣壳蛋白l1(varsani等,2003年,arch.virol.148,1771-1786)的表达获得了无包膜vlp。可期望在将vlp用于疫苗制备之前从植物或植物物质中存在的一些或全部蛋白质、碳水化合物等中分离vlp。pct公开wo00/09725(turpen等)描述了一种从植物的细胞间隙提取蛋白质的方法,包括真空和离心处理以提供包含目的蛋白质的间质液(interstitialfluid)提取物。该方法适于能在真空和离心条件下通过孔的小蛋白质(50kda或更小),但不适于较大超级结构蛋白(superstructureprotein)或蛋白复合物如vlp。1999年mccormick等(procnatlacadsciusa96:703-708)公开了使用与单链fv(scfv)表位融合的大米淀粉酶信号肽将表达的蛋白质靶向到细胞外部分(compartment),随后通过对叶和茎组织进行真空过滤来回收scfv多肽。2008年moehnke等(biotechnollett30:1259-1264)描述了使用mccormick的真空过滤法通过质外体提取从烟草中获得重组植物过敏原。pct公开wo2003/025124(zhang等)公开了在植物中表达scfv免疫球蛋白,其通过鼠信号序列靶向质外体空间。考虑到vlp和生产它们的植物组织的复杂性,期望有这样的vlp制备方法,其中vlp基本上不含植物蛋白质或容易与其分离,但仍保留包膜病毒的结构和免疫原特性。技术实现要素:本发明涉及制备植物来源的病毒样颗粒(vlp)的方法。更具体地,本发明涉及制备包含流感抗原的vlp的方法。本发明的一个目的是提供制备植物来源的病毒样颗粒的改进方法。本发明提供了制备植物来源之vlp的方法(a),包括获取定位于质外体(apoplast)中的包含植物来源之vlp的植物或植物物质;产生原生质体(protoplast)和质外体级分,质外体级分包含植物来源的vlp;回收质外体级分。该方法还可包括从质外体级分纯化植物来源之vlp的步骤。植物来源之vlp可以是嵌合的植物来源vlp。植物来源的vlp可选自以下组:病毒包膜蛋白(viralenvelopeprotein)、病毒结构蛋白、病毒衣壳蛋白和病毒外壳蛋白(viralcoatprotein)。植物来源的vlp可以包含流感血凝素。质外体和原生质体级分可以通过用酶组合物处理植物或植物物质来产生。酶组合物可以包括一种或多于一种果胶酶、一种或多于一种纤维素酶,或者一种或多于一种果胶酶和一种或多于一种纤维素酶。此外,如期望,酶组合物不包括脂肪酶或蛋白酶,或该组合物不包括添加的脂肪酶或蛋白酶。植物或植物物质可以通过种植、收集或者种植并收集植物来获得。植物物质可以包括一部分或整株植物、植物细胞、叶、茎、根或培养的植物细胞中的一种或多于一种。本发明提供了如上所述(方法a)制备植物来源之vlp的方法,其中编码vlp的核酸以瞬时方式引入植物,所述vlp选自病毒包膜蛋白、病毒结构蛋白、病毒衣壳蛋白和病毒外壳蛋白的组。或者,核酸稳定地整合进植物基因组。本发明提供如上所述(方法a)制备植物来源的vlp的方法,其还包括从质外体级分纯化植物来源的vlp的步骤。纯化步骤可以包括通过深层过滤(depthfiltration)来过滤所述质外体级分以产生澄清的提取物,然后用阳离子交换树脂来层析所述澄清的提取物。不希望被理论所约束,从质外体获取的蛋白质较为均一,因为翻译后修饰蛋白的中间形式或包含在多种细胞内部分进行之其他类型的加工的蛋白质没有被共提取。重组蛋白均一性水平更高通常使得包含该蛋白质的制剂的质量更高,并可生成具有更高的效力、更长的半衰期或更好的免疫力的有益特性的产品。例如,与含有复合糖基化的蛋白质相比,含有高度甘露糖糖基化的血液蛋白在血液循环中被更快地被清除。产生于质外体级分的糖基化蛋白表现出更复合类型的糖基化。因此,使用本文所述方法(其涉及细胞壁消化)制备的质外体来源蛋白表现出,例如在循环中更长的半衰期。本发明还提供了制备包含植物来源之脂质包膜的植物来源vlp的方法(b),所述方法包括获取包含位于质外体之vlp的植物或植物物质;用酶组合物处理植物或植物物质以产生原生质体级分和一种或多于一种质外体蛋白组合物;将所述一种或多于一种质外体蛋白复合物与所述原生质体级分分离,其中所述一种或多于一种质外体蛋白复合物包含vlp。所述酶组合物可以包含一种或多于一种果胶酶、一种或多于一种纤维素酶,或者一种或多于一种果胶酶和一种或多于一种纤维素酶。此外,如期望,酶组合物不包含脂肪酶或蛋白酶,或该组合物不包含添加的脂肪酶或蛋白酶。植物来源的vlp可以是嵌合的植物来源vlp。植物来源的vlp可以选自病毒包膜蛋白、病毒结构蛋白、病毒衣壳蛋白和病毒外壳蛋白的组。植物来源的vlp可以包含流感血凝素。本发明提供了如上所述(方法b)制备植物来源之vlp的方法,其中编码vlp(选自病毒包膜蛋白、病毒结构蛋白、病毒衣壳蛋白和病毒外壳蛋白的组)的核酸以瞬时方式引入植物。或者,核酸稳定地整合进植物基因组。本发明提供如上所述(方法b)的制备植物来源的vlp的方法,其还包括从质外体级分中纯化植物来源的vlp的步骤。所述纯化步骤可以包括使用深层过滤来过滤质外体级分以产生澄清的提取物,然后用阳离子交换树脂层析所述澄清的提取物。植物来源vlp可以包含一种或更多种流感ha多肽。流感ha多肽还可以是嵌合ha多肽。植物来源的vlp还可以包含凝血活性。植物或植物物质可以通过培养、收集或者培养并收集植物来获得。所述植物物质可以包括部分或全部植物或者植物细胞、叶、茎、根或培养的细胞中的一种或多于一种。本发明还提供了制备植物来源的vlp的方法(c),包括获取包含植物来源的vlp的植物或植物物质,用细胞壁降解酶组合物消化所述植物物质以产生消化级分,过滤所述消化级分以产生过滤级分,从所述过滤级分中回收植物来源的vlp。所述酶组合物可以包含一种或多于一种果胶酶,一种或多于一种纤维素酶,或者一种或多于一种果胶酶和一种或多于一种纤维素酶。此外,如期望,酶组合物不包含脂肪酶或蛋白酶,或该组合物不包含添加的脂肪酶或蛋白酶。植物来源的vlp可以是嵌合的植物来源vlp。植物来源的vlp可以选自病毒包膜蛋白、病毒结构蛋白、病毒衣壳蛋白和病毒外壳蛋白的组。植物来源的vlp可以包含流感血凝素。本发明提供了如上所述(方法c)制备植物来源之vlp的方法,其中编码vlp(选自病毒包膜蛋白、病毒结构蛋白、病毒衣壳蛋白和病毒外壳蛋白的组)的核酸以瞬时方式引入植物。或者,核酸稳定地整合进植物基因组。本发明提供如上所述(方法c)的制备植物来源的vlp的方法,其还包括将过滤级分中的vlp与细胞碎片和不溶物质分离的步骤。分离步骤可以通过离心、深层过滤或者离心并深层过滤来进行以产生澄清的级分。植物来源的vlp可以通过层析来进一步纯化,例如,澄清的提取物可以使用阳离子交换树脂来纯化。植物来源vlp可以包括包含一种或更多种流感ha多肽的vlp。流感ha多肽还可以是嵌合ha多肽。植物来源的vlp还可以包含凝血活性。植物或植物物质可以通过培养、收集或者培养并收集植物来获得。所述植物物质可以包括部分或全部植物或者植物细胞、叶、茎、根或培养的细胞中的一种或多于一种。不希望被理论所约束,包含植物来源脂质的植物制得的vlp可以诱导比用其他生产系统制得的vlp更强的免疫反应,并且这些植物制得的vlp诱导的该免疫反应比活或减毒全病毒疫苗所诱导的免疫反应更强。从宿主细胞获得的蛋白提取物成分是复杂的,并且往往包含与待分离的目的蛋白质或超结构一起的细胞外和细胞内成分。制备质外体级分随后进行分离细胞内蛋白质和成分的步骤是有利的,因为目的蛋白质或超结构可以在制造过程中被富集和提高效力。包括更少有效步骤的更简单过程可以显著增加产量并且降低成本。还发现用细胞壁降解酶消化细胞壁的过程提高vlp蛋白的产量,即使在原生质体在提取过程中不保持完整的情况下也是如此。不希望被理论所约束,细胞壁消化步骤可松动细胞壁的多聚成分,并有助于使vlp释放而非结合在细胞壁中。该方案还可以将细胞内成分对vlp的污染降到最低。消化植物细胞壁的方法是已知的,并且消化细胞壁的酶混合物(enzymecocktailmixture)可以有所不同。本发明并不受所用的细胞壁消化方法限制。与使用匀浆、搅拌(blending)或研磨来制备植物来源之vlp的方法相比,本文所述方法使植物来源的vlp提取物受到更少的破坏和污染。本文所述方法提供植物组织的质外体级分并且可以保持原生质体及其成分的完整性。本文所述方法即使在原生质体或原生质体的一部分失去其完整性而不再完整的情况下也能有效纯化vlp。与涉及标准组织破碎技术(例如,匀浆、搅拌或研磨)的vlp提取方法相比,这些方法提供更高的vlp产量。更高的产量可以部分归因于破坏vlp和/或脂质包膜之结构完整性的剪切力的减少。从质外体级分制备vlp可以是有利的,因为质外体级分具有显著降低的细胞质蛋白或不含细胞质蛋白。因此,在质外体级分中将其他蛋白质和物质(包括ha单体、三聚体或ha片段)与vlp分离可以被容易地实施。但是,即使原生质体制备物或部分原生质体制备物是不完整的,vlp的产量增加也可以通过本文所述方法来实现。与通过标准组织破碎技术获得的vlp相比,本发明的vlp的特征还在于显示出更高的凝血活性。这种改进的凝血活性可归因于完整vlp产量更高(溶液中游离的ha单体或三聚体更少)、具有完整脂质包膜的完整vlp产量更高,或其组合。与用全病毒制成的疫苗相比,用vlp制成的疫苗的优势在于它们是无感染性的。因此,不用考虑生物防护并且这在生产中也是不需要的。植物制备的vlp提供的另外一个优势是允许在温室或田间培养表达系统,从而显著地更加经济并适于扩大规模。此外,植物不包含参与向蛋白质合成或添加唾液酸残基的酶。vlp可以在没有神经氨酸酶(na)的情况下产生,并且不需要共表达na或用唾液酸酶(神经氨酸酶)处理生产细胞或提取以确保植物中的vlp生产。本发明的该概述并不必然描述本发明的所有特征。附图说明本发明的这些和其他特征将从以下描述中显而易见,其中参照了以下附图:图1显示了表达h5a/印度尼西亚/5/05血凝素的基于cpmvht的表达盒(构建体685)。图2显示了a)表达h5/indo(构建体编号685)的构建体的部分(从paci(35s启动子上游)到asci(紧邻nos终止子的下游))核酸序列(seqidno.1)。来自a/印度尼西亚/5/2005的h5的编码序列以下划线表示。图2b显示了构建体编号685编码的h5a/印度尼西亚/5/05的氨基酸序列(seqidno.2)。图3显示了用体积排阻层析(sec)表征的包含血凝素(ha)的结构。离心经消化的植物提取物之后,重悬沉淀并通过sec分离。图3a显示了每个级分的总可溶性蛋白质含量(实心三角形;左侧y-轴,最大值%;用bradford法测定)。还显示了所收集级分(实心柱;右侧y-轴)的凝血活性。图3b显示了sec洗脱级分的sds-page分析结果。通过丙酮沉淀级分并在分析前用1/40体积的还原性样品上样缓冲液重悬。用0.1%的考马斯r-250溶液对凝胶染色。纯化的vlp用作跑胶对照。对应于ha0单体的带用箭头表示。mw一分子量标准(kda);c一纯化的vlp(对照);泳道7至10和14至16对应于图3a所示的sec分析洗脱的级分编号。图4显示了酶消化和通过comitroltm匀浆器机械匀浆所获得的蛋白谱对比。用变性样品上样缓冲液处理样品,通过洗脱级分的sds-page分析分离蛋白质。用0.1%的考马斯r-250溶液对凝胶染色。mw--分子量标准(kda);泳道1-25μl酶混合物;泳道2-25μl植物组织酶消化物,泳道3一通过comitrol匀浆器获得的5μl提取物。图5显示了ha表达盒的核酸序列(seqidno:9),其包括苜蓿质体蓝素启动子和5’utr、a/印度尼西亚/5/2005(构建体号660)的h5的血凝素编码序列、苜蓿质体蓝素3’utr和终止子序列。图6显示了阳离子交换树脂捕获的直接来自质外体级分的ha-vlp分离物的ha-vlp。样品用非还原变性样品上样缓冲液处理,通过sds-page分离蛋白质。用0.1%考马斯r-250溶液对凝胶染色。泳道1:离心后的质外体级分;泳道2-3:连续微过滤后的质外体级分;泳道4:阳离子交换的上样物;泳道5:阳离子交换的流出级分。泳道6;阳离子交换的洗脱物,浓缩10倍;泳道7:分子量标准(kda)。图7显示了h5/indovlp(a)、澄清之后没有向消化缓冲液中添加nacl的h1/calvlp(b)和进行了该添加的h1/calvlp(c)的纳米颗粒跟踪分析(nanoparticletrackinganalysis,nta)谱。nta实验是用nanosightlm20(nanosight,amesbury,uk)进行的。该装置配备了蓝激光(405nm)、样品室和viton氟橡胶o型圈。室温下记录视频并用nta2.0软件分析。样品记录60秒。手动选择快门和增益(gain)以获得最优粒子分辨率。图8显示了用不同缓冲液酶消化产生的h3/布里斯班vlp提取物的western印迹结果。泳道1)纯重组ha标准(5μg,immunetechnologycorp.it-003-0042p),泳道2-5包含7μl如下缓冲液中进行的离心酶提取物:泳道2)600mm甘露糖醇+125m柠檬酸盐+75mmnapo4+25mmedta+0.04%亚硫酸氢盐(ph6.2),泳道3)600mm甘露糖醇+125mm柠檬酸盐+75mmnapo4+50mmedta+0.04%亚硫酸氢盐(ph6.2),泳道4)200mm甘露糖醇+125mm柠檬酸盐+75mmnapo4+25mmedta+0.03%亚硫酸氢盐(ph6.2),泳道5)200mm甘露糖醇+125mm柠檬酸盐+75mmnapo4+50mmedta+0.03%亚硫酸氢盐(ph6.2)。箭头代表ha0的免疫检测信号。具体实施方式本发明涉及制备植物来源的病毒样颗粒(vlp)的方法。更具体地,本发明涉及制备包含流感血凝素(ha)的vlp的方法。以下描述是一个优选的实施方案。本发明提供了获取目的蛋白质或蛋白超结构的方法。目的蛋白质可以存在于质外体或细胞外部分(compartment)中(对应于除原生质体/原生质球(spheroplast)部分之外的植物细胞部分)。该方法包括去除、消化或者消化并去除包围植物细胞的纤维素植物细胞壁。通过消化细胞壁,细胞壁的聚合成分松动,目的蛋白质或蛋白超结构可以更容易地释放。通过使用该方法,目的蛋白质或蛋白质超结构被富集,这是由于包含的主要宿主细胞蛋白和成分的原生质体/原生质球部分与质外体分离。如下所述,如果在过程中原生质体/原生质球部分失去完整性,如果原生质体/原生质球部分是不完整的,如果来自原生质体/原生质球部分的部分宿主细胞蛋白和成分存在于质外体级分中,本文提供的方法在获得目的蛋白质或蛋白超结构方面仍然有效。蛋白超结构的实例是由2个或更多个多肽构成的结构;所述多肽可以是相同或不同的;如果是不同的,它们的存在比例可以为约1∶1至约10∶1或更高。蛋白超结构还可以包含一种或更多种脂质、磷脂、核酸、膜等。2个或更多个多肽可以通过共价键、二硫键、电荷相互作用、疏水吸引力、范德华力、氢键等连接。蛋白超结构的例子是病毒样颗粒(vlp),其可以是包膜或非包膜的,例如病毒包膜蛋白、病毒结构蛋白、病毒衣壳蛋白或病毒外壳蛋白。本发明还提供了制备植物来源的病毒样颗粒(vlp)的方法。该方法包括获取包含定位于质外体中的植物来源vlp的植物或植物物质;由植物物质产生原生质体/原生质球级分和质外体级分,质外体级分包含植物来源的vlp,以及回收质外体级分。如期望的话,可从质外体级分中纯化植物来源的vlp。本发明还提供了制备包含植物来源的脂质包膜的vlp的方法。该方法包括获取包含vlp的植物或植物物质,用酶组合物处理植物或植物物质以产生一种或多于一种质外体蛋白复合物和原生质体/原生质球级分,将一种或多于一种质外体蛋白复合物与原生质体级分分离。所述一种或多于一种质外体蛋白复合物包含含有植物来源的脂质包膜的vlp。本发明还提供了制备植物来源的vlp的方法,其包括获取包含植物来源的vlp的植物或植物物质,用细胞壁降解酶组合物消化植物物质以产生消化级分,过滤消化级分以产生过滤级分,和从过滤级分回收植物来源的vlp。在这个方法中,原生质体的完整性可以不是必需的。原生质体是完全或部分去除细胞壁的植物细胞。原生质球可以部分去除细胞壁。原生质体、原生质球或原生质体和原生质球(原生质体/原生质球)均如本文所述使用,并且本文使用的这些术语是可以互换的。可以通过机械方式(例如通过匀浆、搅拌)破碎和去除细胞壁,可全部或部分地酶消化细胞壁,或可以通过机械和酶联合的方法去除细胞壁,例如匀浆之后用酶处理以消化细胞壁。原生质体也可以从培养的植物细胞获取,例如从液体培养的植物细胞或固体培养的植物细胞。给出植物组织培养物、培养的植物细胞和原生质体、原生质球生产等的一般原则的标准参考文献包括:introductiontoplanttissueculture,mkrazdan著,第二版(sciencepublishers,2003年;通过引用并入本文),或例如参见下述url:molecular-plant-biotechnology.info/plant-tissue-culture/protoplast-isolation.htm。与原生质体(或原生质球)的生产和操作相关的方法和技术综述于,例如,daveymr等,2005(biotechnologyadvances23:131-171;通过引用并入本文)。给出蛋白生物化学、分子生物学等的一般方法与原则的标准参考文献包括,例如ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork(1998年和2001年的增刊;通过引用并入本文);sambrook等,molecularcloning:alaboratorymanual,第二版,coldspringharborlaboratorypress,plainview,newyork,1989(通过引用并入本文);kaufman等编.,handbookofmolecularandcellularmethodsinbiologyandmedicine,crcpress,bocaraton,1995(通过引用并入本文);mcpherson编,directedmutagenesis:apracticalapproach,irlpress,oxford,1991(通过引用并入本文)。消化或降解细胞壁以释放原生质体或原生质球的酶是本领域技术人员已知的,可以包括纤维素酶(ec3.2.1.4)、果胶酶(ec3.2.1.15)、木聚糖酶(ec3.2.1.8)、几丁质酶(ec3.2.1.14)、半纤维素酶或其组合。合适的酶的非限制性实例包括多组分酶的混合物,其包含纤维素酶、半纤维素酶和果胶酶,例如macerozymetm(约含:纤维素酶:0.1u/mg,半纤维素酶:0.25u/mg,和果胶酶:0.5u/mg)。另一些商业化酶、酶混合物的例子和供应商列于表1(参见:introductiontoplanttissueculture,mkrazdan第二版,sciencepublishers,2003年)。替代性的纤维素酶的名称和种类包括内-1,4-β-d-葡聚糖酶;β-1,4-葡聚糖酶;β-1,4-葡聚糖内切水解酶;纤维素酶a;cellulosinap;葡聚糖内切酶d,碱性纤维素酶;纤维素酶a3;纤维素糊精酶(celludextrinase);9.5纤维素酶;微晶纤维素酶;pancellasess和1,4-(1,3;1,4)-β-d-葡聚糖4-葡聚糖水解酶。替代性的果胶酶(多聚半乳糖醛酸酶)的名称和种类包括果胶去聚合酶;果胶酶;多聚半乳糖醛酸内切酶;果胶酶(pectolase);果胶水解酶;果胶多聚半乳糖醛酸酶;多聚半乳糖醛酸内切酶;多聚-α-1,4-半乳糖醛酸聚糖水解酶;半乳糖醛酸内切酶;内-d-半乳糖醛酸酶和多聚(1,4-α-d-半乳糖醛酸)聚糖水解酶。替代性的木聚糖酶的名称和种类包括半纤维素酶,内-(1→4)-β-木聚糖4-木聚糖水解酶;内-1,4-木聚糖酶;木聚糖酶;β-1,4-木聚糖酶;内-1,4-木聚糖酶;内-β-1,4-木聚糖酶;内-1,4-β-d-木聚糖酶;1,4-β-木聚糖木聚糖水解酶;β-木聚糖酶;β-1,4-木聚糖木聚糖水解酶;内-1,4-β-木聚糖酶;β-d-木聚糖酶。替代性的几丁质酶的名称和种类包括几丁质糊精酶;1,4-β-多聚-n-乙酰氨基葡糖苷酶;多聚-β-氨基葡糖苷酶;β-1,4-多聚-n-乙酰氨基葡糖苷酶;多聚[1,4-(n-乙酰-β-d-氨基葡糖苷酶)]聚糖水解酶。表1:用于原生质体分离的市售酶的非限制性实例特定的酶或酶组合以及浓度和反应条件的选择可取决于用于获取原生质体和包含vlp的质外体级分的植物组织的类型。使用纤维素酶、半纤维素酶和果胶酶的混合物(例如,果胶酶macerozymetm或multifect)的浓度范围可以是0.01%至2.5%(v/v),例如0.01、0.02、0.04、0.06、0.08、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4或2.5%(v/v)或其间任意值。macerozymetm或multifect可以单独使用,或与其他酶(例如纤维素酶、果胶酶、半纤维素酶或其组合)联合使用。使用纤维素酶的浓度范围可以是0.1%至5%,例如0.1、0.25、0.5、0.75、1.0、1.25、1.5、1.75、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75、5.0%(w/v)或其间任意值。酶溶液(或称为细胞壁降解组合物,消化溶液)通常包含缓冲剂或缓冲体系、渗压剂和一种或多于一种盐、二价阳离子或其他添加剂。选择缓冲剂或缓冲体系将ph维持在适于酶活性和蛋白或vlp稳定性的范围内,以在例如在约ph5.0至约8.0或其间任意值的范围内纯化。所选的ph可以根据待回收的vlp而异,例如ph可以是5.0、5.2、5.4、5.6、5.8、6.0、6.2、6.4、6.6、6.8、7.0、7.2、7.4、7.6、7.8、8.0或其间任意ph。缓冲剂或缓冲体系的例子包括但不限于mes、磷酸盐、柠檬酸盐等。一种或更多种缓冲剂或缓冲体系可以与酶溶液(消化溶液)组合;一种或更多种缓冲剂存在的浓度可以是0mm至约200mm或其间任意值,例如10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180或190mm或其间任意值。根据适用程度,如期望的话可以添加渗压剂成分。选择渗压剂及其浓度以提高酶溶液的渗透强度。渗压剂的例子包括甘露糖醇、山梨醇或其他糖醇,聚合物长度不同的聚乙二醇(peg)等。渗压剂的浓度范围根据植物物种、使用的渗压剂类型和所选植物组织类型(来源的物种或组织,例如叶或茎)而异——通常范围为0m至约0.8m,例如0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.5、0.6、0.7或0.75m或其间任意值,例如0、50、100、150、200、250、300、350、400、450、500、550、600nm甘露糖醇或其间任意值。渗压剂的浓度也可用百分比(w/v)表示。对于某些植物或组织类型,采用稍高渗的制剂可以是有利的,这可以促进植物细胞的质膜与细胞壁分离。在消化过程中也可以省略渗压剂。另一个为植物消化设置的参数是温度。如期望的话,可以在消化过程中控制温度。有用的温度范围应在4℃至40℃之间或其间任意温度,例如约4℃至约15℃或其间任意值,或约4℃至约22℃或其间任意温度。根据选择的温度,可以调整其他消化实验参数以保持最佳的提取条件。可以添加阳离子、盐或二者以提高质膜稳定性,例如浓度为0.5-50mm或其间任意值的二价阳离子(如ca2+或mg2+),约0至约750mm或其间任意值(例如10、20、30、40、50、100、200、300、400、500、600、700或750mm)的盐(如cacl2、nacl、cuso4、kno3等)。可以添加的其他添加剂包括螯合剂(例如但不限于,约0至约200mm或其间任意值(例如5、10、15、20、25、50、75、100、125、150、175、200mm或其间任意值)的edta、egta),防止氧化的还原剂(例如但不限于,0.005-0.4%或其间任意值(例如0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.15、0.2、0,25、0.3、0.35、0.4%或其间任意值)的亚硫酸氢钠或抗坏血酸),特定的酶抑制剂(参见下文)以及(如期望的话)叶老化抑制剂,例如环己酰亚胺、激动素或一种或更多种聚胺。消化溶液还可以包含一种或更多种约0至约600mm的甘露糖醇、约0至约500mm的nacl、约0至约50mm的edta、约1%至约2%v/v的纤维素酶、约0至约1%v/v的果胶酶、约0.03至约0.04%的焦亚硫酸钠、约0至约125mm的柠檬酸盐或约0至75mm的napo4。可以处理植物物质以提高酶或酶组合物对植物细胞壁的接近程度。例如,在用酶组合物处理之前可将叶的表皮去除或“剥离”。可以将植物物质切成小块(手工地,或用粉碎或切削装置如urschel切片机);切碎的植物物质可以在部分真空下进一步用酶组合物渗透(nishimura和beevers1978年,plantphysiol62:40-43;newell等,1998年,j.expbotany49:817-827)。在酶组合物处理之前或过程中可以对植物组织施加机械扰动(giridhar等,1989年.protoplasma151:151-157)。另外,可以使用培养的细胞(无论是液体培养物还是固体培养物)制备原生质体或原生质球。期望使用缺少脂肪酶或蛋白酶或者含有灭活的脂肪酶或蛋白酶的酶组合物。在一些实施方案中,酶组合物中可以包含一种或更多种蛋白酶或脂肪酶抑制剂。脂肪酶抑制剂的例子包括rhc80267(sigmaaldrich);蛋白酶抑制剂的例子包括e-64、na2edta、胃酶抑素(pepstatin),抑肽酶(aprotinin)、pmsf,pefabloc、亮抑蛋白酶肽(leupeptin),bestatin等。可使用混合或搅拌酶组合物中植物物质的任何适合方法。例如,植物物质可以在碟或盘上或通过旋转摇荡器轻轻地转动或摇动,在旋转或摆动的圆桶中翻滚。在将原生质体(和/或原生质球)从消化液中移出之前应小心处理,以将对它们的损伤降低到最低。应相应地选择消化容器。作为一个非限制性的例子,可以使用在500mm甘露糖醇、10mcacl2和5mmmes(ph5.6)中包含1.5%纤维素酶(onozukar-10)和0.375%的macerozymetm的酶组合物来从一些烟草(nicotiana)组织制备原生质体(或原生质球)。如本文所述,甘露糖醇的浓度也可以为约0至约500mm或其间任意值不等。本领域普通技术人员在知晓本文公开的信息后,可以针对烟草或用于制备vlp的其他物种的年龄和株系决定合适的酶组合物。破碎细胞壁或部分消化细胞壁后,获得原生质体级分(包含原生质体和/或原生质球)和“质外体级分”。或者,可以获得“消化级分”。如下所述,对于本文所述的蛋白质高产量制备,原生质体级分的完整性可以不是必需的,因此,可使用质外体级分或消化级分提取蛋白质,例如但不限于vlp、病毒包膜蛋白、病毒结构蛋白、病毒衣壳蛋白、病毒外壳蛋白。“质外体级分”是指在渗压剂和/或其他可用于协助保持原生质体完整性的成分的存在下,使用细胞壁降解酶酶消化或部分酶消化植物物质后获得的级分。质外体级分可以包含破碎的原生质体(或原生质球)产生的一些成分。例如,质外体级分可以包含约0至约50%(v/v)或其间任意量的原生质体级分的成分,或0、0.1、0.5、1、5、10、15、20、25、30、35、40、45、或50%(v/v)或其间任意量的原生质体级分的成分。“消化级分”是指使用细胞壁降解酶酶消化或部分酶消化植物物质后剩余的级分,但是,原生质体的完整性不是必需的,消化级分可以包含完整的、破碎的或者完整的和破碎的原生质体。用于产生消化级分的包含细胞壁降解酶的组合物可以包含渗压剂,或者渗压剂存在的量可以比用于获得原生质体的标准方法中使用的量少,或组合物中不存在渗压剂。消化级分包含质外体级分和原生质体/原生质球级分,但原生质体/原生质球级分可以是或不是完整的。消化级分包含细胞内成分和细胞外成分。如果使用渗压剂来保持原生质体/原生质球的完整性,则可发现细胞内成分为原生质体/原生质球形式。如果消化溶液中没有渗压剂,则原生质体/原生质球可能被破坏并且消化级分中细胞内和细胞外成分可能合并在一起。如本文所述,可以通过任何合适的技术从消化级分的成分中分离vlp。不希望被理论所约束,细胞壁消化步骤可松动细胞壁的多聚成分并协助释放vlp,使它们不会被约束在细胞壁内。该方案也可以最大限度地减少细胞内成分对vlp的污染。可以在酶消化之后用低速离心然后过滤、深层过滤、沉降、沉淀(例如但不限于硫酸铵沉淀)或其组合来将vlp与细胞碎片分离,以获得包含目的蛋白质或超结构蛋白的分离级分。如果采用渗压剂,则可以用任何合适的技术(例如但不限于离心、过滤、深层过滤、沉降、沉淀或其组合)将原生质体/原生质球级分或包含原生质体的级分与质外体级分分离,来获得包含vlp和/或包含含有vlp之原生质体/原生质球的分离级分。可以使用任何合适的技术(例如但不限于离心、过滤、深层过滤、沉降、沉淀或其组合)将原生质体(和原生质球)级分或包含原生质体的级分与质外体级分分离,以获得分离的级分。分离级分可以是例如上清液(如果是离心、沉降或沉淀的话)或滤液(如果是过滤的话),并且富含vlp。分离级分可被进一步处理,以通过例如另外的离心步骤、沉淀、层析步骤(例如体积排阻、离子交换层析)、切向流过滤或其组合来分离、纯化、浓缩(或其组合)vlp。纯化的vlp的存在可通过例如非变性page或sds-page、使用合适的检测抗体的western分析、毛细管电泳或本领域技术人员显而易见的其他方法证实。质外体是质膜外的植物细胞部分,并且包含细胞壁和植物的细胞间隙。虽然优选在消化和进一步处理过程中保持原生质体(和/或原生质球)的完整性,但对于富集vlp来说,保持原生质体完整不是必需的。在合成过程中,vlp被排出到质膜外。vlp的平均大小为约20nm至1μm或其间任意量,例如60、65、70、75、80、85、90、95、100、105、110、120、130、140、150、160、170、180、190或200nm,或其间任意量,例如100nm,并且可包含脂质膜。由于它们的大小,一旦合成,vlp可能被困于质膜和细胞壁之间,可能无法使用用于获得植物蛋白质的标准机械方法进行分离或进一步纯化。为了将产量最大化,有利的可以是将细胞蛋白质对vlp级分的污染最小化,保持vlp和(在一些实施方案中)结合的脂质包膜或膜的完整性,将对原生质体(和/或原生质球)的机械损伤最小化的破坏细胞壁释放vlp的方法,例如本文所述的酶法。但是,在处理过程中保持所有的原生质体的完整性不是必需的。根据本发明的一些方面在植物中产生的vlp可以与植物来源的脂质复合。vlp可以包含ha0前体形式,或者ha1或ha2结构域通过二硫桥保持在一起的形式。植物来源的脂质可以是脂双层的形式,并且还可以包含围绕vlp的包膜。植物来源的脂质可包括产生vlp之植物的质膜脂质成分,包括但不限于磷脂酰胆碱(pc)、磷脂酰乙醇胺(pe)、鞘糖脂、植物甾醇或其组合。植物来源的脂质可互换地称为‘植物脂质’。植物甾醇的例子在本领域已知,包括例如豆甾醇、谷甾醇、24-甲基胆固醇和胆固醇(mongrand等,2004年,j.biolchem279:36277-86)。对于vlp的组装,期望病毒结构蛋白(如ha)正确折叠并且形成ha三聚体。向对象施用时,相对于施用结构蛋白质单体,vlp(尤其是包含植物来源的脂质包膜的vlp)可以提供更优的免疫应答。在一些实施方案中,可以将多肽的表达靶向植物的任意细胞内或细胞外空间、细胞器或组织。为了将表达的多肽定位到特定位置,编码多肽的核酸可以与编码信号肽的核酸序列相连。信号肽也可称为转运肽或信号序列。引导表达的多肽定位于质外体的信号肽或肽序列包括但不限于大米淀粉酶信号肽(mccormick1999年,procnatlacadsciusa96:703-708)、氨基酸序列如下的蛋白二硫键异构酶信号肽(pdi):maknvaifgllfsllllvpsqifaee;seqidno.10,植物发病相关蛋白(plantpathogenesisrelatedprotein,prp;szyperski等pnas95:2262-2262)例如烟草植物发病相关蛋白2(prp)、人单克隆抗体信号肽(sp)或任何天然血凝素信号肽。在一些例子中,例如多肽在没有信号肽或转运肽的情况下表达并分泌时,表达的多肽可以在特定的细胞内或细胞外空间(如质外体)、细胞器或组织中累积。术语“病毒样颗粒”或“vlp”(virus-likeparticle)是指自组装并且包含病毒表面蛋白(例如流感ha蛋白或嵌合流感ha蛋白)的结构。vlp和嵌合vlp通常在形态和抗原性上类似于感染中产生的病毒粒,但缺乏足以进行复制的遗传信息,从而不具备感染性。可以在适合的宿主细胞(包括植物宿主细胞)中生产vlp和嵌合vlp,如期望进行进一步纯化。尽管本文中示例了流感vlp和嵌合流感vlp,本文所述方法可用于定位于或分泌到质外体的任何植物来源的vlp。“嵌合蛋白”或“嵌合多肽”是指包含两种或多于两种来源(例如但不限于融合为单个多肽的两种或更多种流感类型或亚型)的氨基酸序列的蛋白或多肽。嵌合蛋白或多肽可以包含与多肽或蛋白的其余部分相同来源(即天然)或异源的信号肽。嵌合蛋白或嵌合多肽可作为嵌合核苷酸序列的转录本产生并保持完整,或如果需要的话,嵌合蛋白或嵌合多肽可以在合成后被切割。完整的嵌合蛋白或嵌合蛋白之经切割部分可以结合形成多聚体蛋白。嵌合蛋白或嵌合多肽还可以包括含有经二硫桥连接之亚基的蛋白质或多肽(即多聚蛋白)。例如,包含两种或多于两种来源的氨基酸序列的嵌合多肽可被加工成亚基,并且所述亚基通过二硫桥相连来形成嵌合蛋白或嵌合多肽。多肽可以是流感血凝素(ha),并且构成多肽的两种或多于两种氨基酸序列中的每个均可获得自不同的ha,从而产生嵌合ha或嵌合流感ha。嵌合ha还可以包含含有异源信号肽(其在合成后被切割)的氨基酸序列(嵌合ha前体蛋白)。可用于本发明的ha蛋白的例子可参见wo2009/009876;wo2009/076778;wo2010/003225(通过引用并入本文)。编码嵌合多肽的核酸可称为“嵌合核酸”或“嵌合核苷酸序列”。由嵌合ha构成的病毒样颗粒可称为“嵌合vlp”。嵌合vlp还在pct申请号pct/ca2010/000983(于2010年6月25日提交)和美国临时申请号61/220,161(于2009年6月24日提交;通过引用并入本文)中描述。vlp可从天然或嵌合ha的表达获得。按照本发明提供方法制备的vlp的ha包括已被开发或鉴定的已知序列和变体ha序列。另外,如本文所述制备的vlp不包含神经氨酸酶(na)或其他如m1(m蛋白)、m2、ns等的成分。但是,如果期望获得包含ha和na的vlp,可以将na和m1与ha共表达。通常,术语“脂质”指脂溶性(亲脂)天然分子。按照本发明的某些方面在植物中产生的嵌合vlp可以与植物来源的脂质复合。植物来源的脂质可以是脂双层的形式,并且还可以包含围绕vlp的包膜。植物来源的脂质可包括生成vlp的植物的质膜脂质成分,包括磷脂,三、二和单酸甘油酯以及脂溶性甾醇或包含甾醇的代谢物。例子包括磷脂酰胆碱(pc)、磷脂酰乙醇胺(pe)、磷脂酰肌醇、磷脂酰丝氨酸、鞘糖脂、植物甾醇或其组合。或者植物来源的脂质可称为“植物脂质”。植物甾醇的例子包括菜油甾醇、豆甾醇、麦角甾醇、菜子甾醇、δ-7-豆甾醇、δ-7-燕麦甾醇、daunosterol、谷甾醇、24-甲基胆固醇、胆固醇或β-谷甾醇(mongrand等,2004年,j.biolchem279:36277-86)。如本领域技术人员易于理解的,细胞质膜的脂质构成可随获得细胞的细胞或有机体或物种的培养或生长条件而异。细胞膜通常包含脂双层以及多种功能的蛋白质。可以在脂双层中发现特定脂质的局部聚集,称为‘脂质筏‘。这些脂质筏微结构域可以富含鞘脂和甾醇。不希望被理论所约束,脂质筏可以在胞吞和胞吐、病毒或其他感染物的进出、细胞间信号转导、与细胞或有机体的其他结构成分(如细胞内和细胞外基质)的相互作用中起重要作用。之前wo2009/009876;wo2009/076778和wo2010/003225(通过引用并入本文)已描述了包含脂质包膜的vlp。对于流感病毒,本文所用术语“血凝素”或“ha”指流感病毒颗粒的结构糖蛋白。本发明的ha可从任何亚型获得。例如,ha可以是亚型h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15或h16,或乙型或丙型流感。本发明的重组ha还可以包含基于任何血凝素序列的氨基酸序列。已很好地研究了流感血凝素的结构,并证明在二级、三级和四级结构上高度保守。甚至可以在氨基酸序列改变的情况下发现这种结构保守性(参见例如,skehel和wiley,2000年annrevbiochem69:531-69;vaccaro等2005年;通过引用并入本文)。编码ha的核苷酸序列是公知的并且可获得,例如从生物防御和公众健康数据库(biodefenseandpublichealthdatabase)(现为流感研究数据库;squires等,2008年nucleicacidsresearch36:d497-d503)例如url为:biohealthbase.org/gsearch/home.do?decorator=influenza)或由国家生物技术信息中心维护的数据库(ncbi;例如url为:ncbi.nlm.nih.gov/sites/entrez?db=nuccore&cmd=search&term=influenza),两者均通过引用并入本文。本发明还涉及制备、分离或者制备并分离vlp的方法,所述vlp包括感染人或宿主动物(例如灵长类动物、马、猪、鸟、绵羊、鸟类水禽、候鸟、鹌鹑、鸭、鹅、家禽、鸡、骆驼、犬科动物、狗、猫科动物、猫、虎、豹、麝猫、貂、石貂、雪貂、家养宠物、牲畜、小鼠、大鼠、海豹、鲸等)的病毒的流感vlp。一些流感病毒可以感染多于一种宿主动物。流感病毒血凝素可以耐受氨基酸变化。这种变化提供了不断被鉴定出的新毒株。新毒株之间感染力可不同。然而,随后形成vlp的血凝素三聚体的形成被保留。本发明还包括制备任何植物来源的vlp(无论ha亚型或序列或者形成vlp的嵌合ha或者物种来源为何)的方法。血凝素的正确折叠对于蛋白质的稳定性、多聚体的形成、vlp的形成和ha的功能(凝血能力)以及其他流感血凝素特性可以是重要的。蛋白质的折叠可被一个或更多个因素影响,包括但不限于蛋白质序列,蛋白质的相对丰度,细胞内拥挤的程度,可以结合折叠、部分折叠或未折叠蛋白质或与其短暂相关联的辅因子的可利用性,一种或更多种伴侣蛋白的存在等。热休克蛋白(hsp)或应激蛋白是伴侣蛋白的例子,它可参与多种细胞过程,包括蛋白质合成、细胞内转运、防止错误折叠、防止蛋白质聚集、蛋白复合物的组装和解组装、蛋白质折叠和蛋白质解聚。这种伴侣蛋白的例子包括但不限于hsp60、hsp65、hsp70、hsp90、hsp100、hsp20-30、hsp10、hsp100-200、hsp100、hsp90、lon、tf55、fkbp、亲环素、clpp、grpe、泛素、钙联蛋白和蛋白质二硫键异构酶(参见例如,macario,a.j.l.,coldspringharborlaboratoryres.25:59-70.1995年;parsell,d.a.&lindquist,s.ann.rev.genet.27:437-496(1993);美国专利号5,232,833)。伴侣蛋白(例如但不限于hsp40和hsp70)可用于保证嵌合ha的折叠(pct申请号pct/ca2010/000983,于2010年6月25日提交,美国临时申请号61/220,161,于2009年6月24日提交;wo2009/009876和wo2009/076778,以上均通过引用并入本文)。还可以使用蛋白质二硫键异构酶(pdi;登录号z11499)。回收后,可通过例如但不限于电子显微镜、光散射、体积排阻层析、hplc、western印迹分析或电泳来评估vlp的结构、大小效力或活性。用于评价vlp的大小、浓度、活性和构成的这些和其他评估方法是本领域公知的。对于制备型体积排阻层析,可通过本文所述方法获得包含vlp的制备物,并且通过离心去除不溶性物质。用peg沉淀也可以是有益的。回收的蛋白质可通过常规方法(例如,bradford测定、bca)定量,提取物流经体积排阻柱(例如使用sephacryltm、sephadextm或类似基质),并且收集级分。可以用bluedextran2000或合适蛋白质作为校正标准。还可以将提取物通过阳离子交换柱并且收集活性成分。层析后,可根据期望通过蛋白质电泳、免疫印迹或两者来进一步分析级分,以确认级分中vlp和蛋白质补充物的存在。可通过本领域公知的方法,使用凝血测定评估包含vlp之级分的凝血活性。不希望被理论所约束,ha结合不同动物来源的rbc的能力被ha对唾液酸α2,3或α2,3的亲和力和rbc表面上这些唾液酸的存在所驱动。马类和禽类的流感病毒ha凝集所有几种物种(包括火鸡、鸡、鸭、豚鼠、人、绵羊、马和牛)的红细胞,;而人ha结合火鸡、鸡、鸭、豚鼠、人和绵羊的红细胞(itot.等,1997年,virology,227:493-499;medeirosr等,2001年.virology289:74-85)。凝血抑制(hi或hai)测定也可用于证实疫苗或疫苗组合物(包含嵌合ha或可通过重组ha抑制红细胞(rbc)凝集的嵌合vlp)所诱导的抗体的效力。可通过微滴定hai(aymard等1973年)评价血清样品的凝血抑制性抗体效价。可以使用几种物种(例如马、火鸡、鸡等)中任意一种的红细胞。该测定给出vlp表面ha三聚体组装的间接信息,以确认ha上抗原性位点的正确呈递。也可使用交叉反应性hai效价证明对与疫苗亚型相关的其他病毒株的免疫应答效力。例如,用包含含有第一流感类型或亚型之hdc的嵌合血凝素的疫苗组合物免疫的对象的血清可用在用第二株完整病毒或病毒颗粒进行的hai测试中,并且测定hai效价。包含vlp的转基因植物、植物细胞、植物物质或种子的转化和再生方法已在本领域中建立并为本领域技术人员所知。获得转化和再生植物的方法并非本发明的关键。“转化”是指表现为基因型、表型或两者兼有的遗传信息(核苷酸序列)在种间的转移。遗传信息从嵌合构建体到宿主的种间转移可以是可遗传的(即整合到宿主的基因组中),并且认为遗传信息的转移是稳定的,或者转移可以是瞬时的而且该遗传信息的转移是不可遗传的。术语“植物物质”是指来源于植物的任何材料。植物物质可以包括整个植物、组织、细胞或任何其部分。此外,植物物质可以包括细胞内植物成分、细胞外植物成分,植物的液体或固体提取物或其组合。另外,植物物质可以包括来自植物的叶、茎、果实、根或其组合的植物、植物细胞、组织、液体提取物或其组合。植物物质可以包括没有经受任何处理步骤的植物或其部分。植物部分可以包括植物物质。植物或植物物质可以通过任何方法收集或获得,例如,可使用整个植株或者特别地移取以用于所述方法的叶或其他组织。表达和分泌vlp的转基因植物也可以作为本文所述方法的原料使用。本发明的构建体可通过ti质粒、ri质粒、植物病毒载体、直接dna转化、显微注射、电穿孔、渗入等引入植物细胞。此类技术的综述参见例如weissbach和weissbach,methodsforplantmolecularbiology,academypress,newyorkviii,421-463页(1988年);geierson和corey,plantmolecularbiology,第二版(1988);miki和iyer,fundamentalsofgenetransferinplants,plantmetabolism,第二版.dt.dennis,dhturpin,ddlefebrve,dblayzell编,addison-wesley,langmansltd.london,pp.561-579(1997)。其他方法包括直接dna摄取、使用脂质体、电穿孔例如用原生质体、显微注射、微弹(microprojectile)或晶须(whisker)和真空渗入。参见例如,bilang等(gene100:247-250(1991年),scheid等(mol.gen.genet.228:104-112,1991年),guerche等(plantscience52:111-116,1987年),neuhause等(theor.applgenet.75:30-36,1987年),klein等,nature327:70-73(1987年);howell等(science208:1265,1980年),horsch等(science227:1229-1231,1985年),deblock等,plantphysiology91:694-701,1989年),methodsforplantmolecularbiology(weissbach和weissbach,eds.,academicpressinc.,1988),methodsinplantmolecularbiology(schuler和zielinski编,academicpressinc.,1989年),liu和lomonossoff(j.virolmeth,105:343-348,2002年),美国专利号4,945,050;5,036,006;5,100,792;6,403,865;5,625,136,均通过引用并入本文。可以使用瞬时表达法表达本发明的构建体(参见liu和lomonossoff,2002,journalofvirologicalmethods,105:343-348;通过引用并入本文)。或者,可以使用基于真空的瞬时表达方法(描述于pct公开wo00/063400、wo00/037663(通过引用并入本文))。这些方法可以包括,例如但不限于农杆菌接种或农杆菌渗入法,但是,还可使用如上所述的其他瞬时方法。对于农杆菌接种或农杆菌渗入,包含期望核酸的农杆菌(agrobacteria)混合物进入组织(例如叶、植物的地上部分(包括茎、叶和花)、植物的其他部分(茎、根、花))或整个植株的细胞间隙。穿过表皮后,农杆菌侵染并将t-dna拷贝传递进细胞。t-dna被附加转录并且mrna被翻译,使得所侵染细胞产生目的蛋白质,但t-dna在细胞核内的传代是瞬时的。通过本发明方法制备的流感vlp可与现有流感疫苗联合使用,以补充该疫苗使其更为有效或者降低所需的施用剂量。如本领域技术人员已知的,疫苗可针对一种或多于一种的流感病毒。合适疫苗的例子包括但不限于,从sanofi-pasteur、idbiomedical、merial、sinovac、chiron、roche、medimmune、glaxosmithkline、novartis、sanofi-aventis、serono、shirepharmaceuticals等购得的那些。如期望的话,本发明的vlp可以与本领域技术人员已知的合适佐剂相混合。此外,vlp可用于疫苗组合物中,该组合物包含用于治疗上述目标生物的有效剂量的vlp。另外,根据本发明生产的vlp可与其他蛋白成分共表达或与其他vlp或流感蛋白质成分(例如神经氨酸酶(na)、m1和m2)重组。它也可以与其他疫苗蛋白(例如疟疾抗原、hiv抗原、呼吸道合胞体病毒(rsv)抗原等)制得的vlp共表达或重组。本文所述的序列总结如下。本发明将在下面实施例中进一步说明。然而,应理解这些实施例仅用于说明目的,不应以任何方式用于限制本发明的范围。表达盒的组装可用于生成vlp的构建体描述于美国临时申请号61/220,161(于2009年6月24日提交)、wo2009/009876、wo2009/076778和wo2010/003225,它们均通过引用并入本文。构建体还可以包括表2所列的那些。这些构建体的组装描述于wo2009/009876、wo2009/076778、wo2010/003225和us61/220,161。但还可以将包含已知ha的其他构建体(包括但不限于表2提供的那些)与相似或不同调控元件和启动子相组合使用来生成本文所述的vlp。表2:可用于生成血凝素的构建体的非限制性实例。cpmv-ht表达盒包含35s启动子以控制包含目的编码序列的mrna的表达,该编码序列的5’端来自豇豆花叶病毒(cpmv)rna2的核苷酸1-512,其中在115和161位有突变的atg,3’端为来自cpmvrna2(对应于3’utr)的核苷酸3330-3481,其后为nos终止子。用质粒pbd-c5-1lc(sainsbury等2008年;plantbiotechnologyjournal6:82-92和pct公开wo2007/135480)组装基于cpmv-ht的血凝素表达盒。用darveau等(methodsinneuroscience26:77-85(1995))提供的基于pcr的连接方法进行cpmvrna2的115和161位atg突变。用pbd-c5-1lc作为模板进行两个独立的pcr。第一扩增的引物是pbinplus.2613c(seqidno:3)和mut-atg115.r(seqidno:4)。第二扩增的引物是mut-atg161.c(seqidno:5)和lc-c5-1.110r(seqidno:6)。然后将两个片段混合并作为第三扩增的模板,其使用pbinplus.2613c(seqidno:3)和lc-c5-1.110r(seqidno:6)作为引物。用paci和apai消化所得片段并克隆到用同样的酶消化的pbd-c5-1lc。生成的表达盒命名为828。cpmv-ht表达盒中的h5a/印度尼西亚/5/2005(构建体号685)的组装该表达盒的组装描述于wo2009/009876、wo2009/076778和wo2010/003325,其通过引用并入本文。简言之,如下将来自a/印度尼西亚/5/2005的h5编码序列克隆到cpmv-ht中:用构建体号660(d'aoust等,plantbiotechnologyjournal6:930-940(2008))作为模板,以apai-h5(a-indo).1c(seqidno:7)和h5(a-indo)-stui.1707r(seqidno:8)为引物进行pcr扩增,以将限制性位点apai(紧邻起始atg的上游)和stui(紧邻终止密码子的下游)添加到血凝素编码序列。构建体660包括苜蓿质体蓝素启动子和5'utr、来自a/印度尼西亚/5/2005的h5血凝素编码序列(构建体号660)、苜蓿质体蓝素3'utr和终止子序列(seqidno:9;图5)。用apai和stui限制性酶消化所得片段并克隆到预先用同样的酶消化的构建体号828中。所得表达盒命名为构建体号685(图1、2)。沉默抑制子。转录后基因沉默(ptgs)可参与限制植物中转基因的表达,共表达马铃薯y病毒的沉默抑制子(hcpro)可用于对抗转基因mrna的特异性降解(brigneti等,1998年)。替代的沉默抑制子是本领域公知的,并且可如本文所述使用(chiba等,2006年,virology346:7-14;通过引用并入本文),它们例如但不限于tev-p1/hc-pro(烟草蚀纹病毒(tobaccoetchvirus)-p1/hc-pro)、byv-p21、番茄丛矮病毒(tomatobushystuntvirus)的p19(tbsvp19)、番茄皱缩病毒(tomatocrinklevirus)的衣壳蛋白(tcv-cp)、黄瓜花叶病毒(cucumbermosaicvirus)的2b;cmv-2b)、马铃薯x病毒(potatovirusx)的p25(pvx-p25)、马铃薯m病毒(potatovirusm)的p11(pvm-p11)、马铃薯s病毒(potatoviruss)的p11(pvs-p11)、蓝莓焦枯病毒(blueberryscorchvirus)的p16(bscv-p16)、柑橘腐根病毒(citrustristezavirus)的p23(ctv-p23)、葡萄卷叶相关病毒2(grapevineleafroll-associatedvirus-2)的p24(glrav-2p24)、葡萄a病毒(grapevinevirusa)的p10(gva-p10)、葡萄b病毒(grapevinevirusb)的p14(gvb-p14)、独活潜伏病毒(heracleumlatentvirus)的p10(hlv-p10)或大蒜普通潜伏病毒(garliccommonlatentvirus)的p16(gclv-p16)。因此,沉默抑制子(例如但不限于hcpro、tev-p1/hc-pro、byv-p21、tbsvp19、tcv-cp、cmv-2b、pvx-p25、pvm-p11、pvs-p11、bscv-p16、ctv-p23、glrav-2p24、gbv-p14、hlv-p10、gclv-p16或gva-p10)可与编码目的蛋白质的核酸序列一起共表达以进一步确保在植物中高水平地生产蛋白质。p19的构建描述于wo2010/0003225(通过引用并入本文)。简言之,通过darveau等(methodsinneuroscience26:77-85(1995))提供的基于pcr的连接法将番茄丛矮病毒(tbsv)p19蛋白的编码序列连到苜蓿质体蓝素表达盒。在第一轮pcr中,用构建体660(描述于wo2010/0003225,通过引用并入本文)作为模板,用引物plasto-443c:gtattagtaattagaatttggtgtc(seqidno:11)和supp19-plasto.rccttgtatagctcgttccattttctctcaagatg(seqidno:12)扩增质体蓝素启动子区段。平行地,用引物supp19-1catggaacgagctatacaagg(seqidno:13)和supp19-saci.ragtcgagctcttactcgctttctttttcgaag(seqidno:14),使用voinnet等(theplantjournal33:949-956(2003年))描述的构建体35s:p19作为模板扩增包含p19编码序列的另一片段。然后混合扩增产物并作为第二轮扩增(组装反应)的模板,其中使用引物plasto-443c和supp19-saci.r。用bamhi(在质体蓝素启动子中)和saci(p19编码序列末端)消化所得片段并克隆到预先用同样的限制性酶消化的构建体号660中,以得到构建体号r472。通过电穿孔(mattanovich等,1989)用质粒转化根癌农杆菌(agrobacteiumtumefaciens)(agl1;atcc,manassas,va20108,usa)。通过限制性图谱确认所有根癌农杆菌菌株的完整性。包含r472的根癌农杆菌菌株被命名为“agl1/r472”。按照hamilton等(2002)所述制备hcpro构建体(35hcpro)。测序所有克隆以确认构建体的完整性。通过电穿孔(mattanovich等,1989)用质粒转化根癌农杆菌(agl1;atcc,manassas,va20108,usa)。通过限制性图谱确认所有根癌农杆菌株的完整性。植物生物质的制备,接种,农杆菌渗入和收集在填充有市售泥炭藓培养基的平地(flat)中从种子培育本塞姆氏烟草(nicotianabenthamiana)植株。以16/8的光周期和白天25℃/夜晚20℃的温度方案在温室中培育植株。播种后三周,挑选出单个苗,移植到花盆里并在相同环境条件下的温室中再培育三周。六周后,植株的平均重量为80g,平均高度为30cm。通过d'aoust等2008(plantbiotechnologyjournal6:930-940)描述的方法,用如下所述的构建体转染(电穿孔)农杆菌菌株agl1。在补充有10mm2-(n-吗啉代)乙磺酸(mes)、20μm乙酰丁香酮、50μg/ml卡那霉素和25μg/ml羧苄青霉素的yeb培养基(ph5.6)中培养转染的农杆菌,至od600为0.6至1.6。在使用前离心农杆菌悬液并用渗入介质(10mmmgcl2和10mmmesph5.6)重悬。通过d'aoust等(同上)描述的农杆菌渗入法处理植株。简言之,对于真空渗入,离心根癌农杆菌悬液,在渗入介质中重悬,在4℃储存过夜。在渗入当天,用2.5倍培养体积稀释培养批次并在使用前温热。将整个本塞姆氏烟草植株倒置在20-40托真空下的气密不锈钢罐的细菌悬液中2分钟。除另外指出,所有的渗入均为与r472转化细菌(agl1/r472株)以1∶1的比例共同渗入。真空渗入后,将植株被送回温室孵育4-6天直到收集。叶的取样和总蛋白质提取(机械匀浆)孵育4、5、6、7和8天后,收集植株的地上部分并立即使用。在3倍体积的含有1%tritonx-100和0.004%焦亚硫酸钠的冷50mmtrisph8.0,0.15mnacl中通过匀浆植物组织提取总可溶性蛋白。用polytrontm通过杵臼研磨,或在1体积冷50mmtrisph8,0.15mnacl中用comitroltm对植物组织进行机械匀浆。comitroltm使用的缓冲液也包含0.04%焦亚硫酸钠。匀浆后,在4℃下以5,000g离心地上植物材料的浆液5分钟,保留粗提物(上清液)进行分析。用牛血清白蛋白作为参照标准,通过bradford测定(bio-rad,hercules,ca)检测澄清粗提物的总蛋白质含量。通过细胞壁消化提取vlp从本塞姆氏烟草植株收集叶组织并切成~1cm2的片。在室温(rt)下将叶片浸没于500mm甘露糖醇中30分钟。然后去除甘露糖醇溶液并换成酶混合物(原生质体化溶液(500mm甘露糖醇,10mmcacl2和5mmmes/koh(ph5.6)中的来自绿色木霉的纤维素酶混合物(onozukar-10;3%v/v)和来自根霉属的果胶酶混合物(macerozymetm;0.75%v/v;均购自yakultpharmaceuticals))。使用的比例为每100ml溶液20g叶片。将该制备物均匀分散到浅容器(~11×18cm)中并用旋转摇床以40rpm和26℃孵育16小时。或者,vlp提取可按如下方法进行:用agl1/#685按照实施例1所述对植株进行农杆菌渗入。在渗入后第6天从本塞姆氏烟草植株收集叶并切成~1cm2的片。以1∶2.5(w/v)的新鲜生物质∶消化缓冲液的比例,将multifect果胶酶fe、multifectcxcg和multifectcxb(genencor)(每个1.0%(v/v))添加到600mm甘露糖醇,75mm柠檬酸盐,0.04%亚硫酸氢钠缓冲液(ph6.0)中。在室温下用轨道摇床消化生物质15小时。孵育后,通过过滤(250或400μm目的尼龙滤器)去除叶碎片。如下收集悬液中的原生质体:以200×g(15分钟)离心,然后以5000×g(15分钟)离心上清液以进一步澄清上清液。或者,可进行5000×g、15分钟的单个离心步骤。然后以70,000×g离心70ml上清液30分钟。所得沉淀用1.7mlpbs重悬并立即分析或冻存。蛋白质分析h5的凝血测定基于nayak和reichl(2004)描述的方法。简言之,在含有100μlpbs的v形底96孔微滴定板中对测试样品(100μl)进行系列两倍稀释,每孔留下100μl稀释的样品。向每孔加入100μl0.25%火鸡红细胞悬液(biolinkinc.,syracuse,ny),在室温孵育板2小时。将显示完全凝血的最高稀释度的倒数记录为凝血活性。平行地,用pbs稀释重组ha5标准(a/越南/1203/2004h5n1)(proteinsciencecorporation,meriden,ct),并在每个板中作为对照。elisa用破碎(用1%tritonx-100处理,随后在tissuelysertm(qiagen)机械搅拌1分钟)的纯化病毒样颗粒制备ha5标准。在4℃用50mm碳酸盐-碳酸氢盐包被缓冲液(ph9.6)中的10μg/ml捕获抗体(immunetechnologycorporation,#it-003-005i)包被u形底96孔微滴定板16-18小时。用含有0.1%tween-20的0.01mpbs(磷酸盐缓冲盐水)(ph7.4)进行所有洗涤。孵育后,洗涤微滴定板三次并在37℃下用pbs中的1%酪蛋白封闭1小时。封闭步骤后,洗涤板三次。用模拟提取物(制备自用单独的agl1/r472渗入的叶组织)稀释ha5标准以获得500至50ng/ml的标准曲线。在加入微孔板之前用1%tritonx-100处理待定量的样品。在37℃下再孵育板1小时。洗涤后,加入1∶1000稀释的针对ha5(cber/fda)的绵羊多克隆抗体,在37℃下孵育板1小时。洗涤后,加入1∶1000稀释的辣根过氧化物酶缀合的兔抗绵羊抗体,在37℃下孵育板1小时。最后一次洗涤后,在室温下用surebluetmb过氧化物酶底物(kpl)孵育板20分钟。加入1nhcl终止反应,用multiskanascent读板器(thermoscientific)测量a450值。实施例1:酶法提取植物组织释放相对活性提高的高产量ha。将用本发明酶提取法获得之ha的量和相对活性与普通机械提取法获得之ha的数量和相对活性进行比较。用agl1/685渗入本塞姆氏烟草植株,5-6天的孵育期后收集叶。如下制备叶匀浆:用polytron匀浆器将2g叶匀浆;用杵臼研磨4g叶;以及用comitroltm处理机(urschellaboratories)在提取缓冲液(50mmtris,150mmnaclph8.0,比例1∶1w/v)中对25kg叶进行匀浆。酶提取如下进行:用上述macerozyme果胶酶和onozukar-10纤维素酶消化20g收集的叶。消化后,通过过滤(250μm目的尼龙滤器)去除叶碎片。通过以下去除悬液中的原生质体:200×g(15分钟)离心,然后通过5000×g(15分钟)离心进一步澄清上清液。每个这些植物提取物中的ha的量和相对活性见表3。与用机械方法相比,酶提取法获得的ha的量显著较多。表3:机械和酶提取植物叶获得的ha的相比的量和相对活性。所有的数据均被调整以计入每个提取方法添加的液体体积差异。为了本发明的比较性分析,选择comitroltm提取法作为标准值。提取方法相对活性量*comitroltm提取物100%100%polytron提取物50%150%臼提取物100%220%消化提取物440%570%*通过elisa分析对量进行评测实施例2:用酶消化植物组织所释放的ha组成vlp用差速离心和体积排阻层析(sec)的组合证实通过本文所述的酶提取法获得的ha组成vlp。如实施例1中所述用agl1/685对本塞姆氏烟草植株进行农杆菌渗入。如实施例1中所述渗入6天后从植株收集叶并切成~1cm2的片,然后消化、粗滤并离心。然后以70,000×g离心澄清样品以分离vlp。在上样到sec柱之前,将包含vlp的离心沉淀小心重悬于1/50体积的磷酸盐缓冲盐水(pbs;0.1m磷酸钠,0.15mnaclph7.2)中。用平衡/洗脱缓冲液(50mmtris,150mmnacl,ph8)准备32mlsephacryltms-500高分辨率珠(s-500hr:gehealthcare,uppsala,sweden,cat.no.17-0613-10)的sec柱。将1.5mlvlp样品上样到平衡好的柱并用45ml平衡/洗脱缓冲液洗脱来进行sec层析。洗脱液收集于1.7ml的级分中,通过将10μl洗脱级分与200μl稀释的bio-rad蛋白染色剂(bio-rad,hercules,ca)混合来评估每个级分的蛋白含量。每次分离之前均用bluedextran2000(gehealthcarebio-sciencecorp.,piscataway,nj,usa)进行校准。对于每次分离都比较bluedextran2000和宿主蛋白质两者的洗脱谱,以确保分离的一致性。sec洗脱级分的蛋白质分析以牛血清白蛋白作为参照标准,用bradford测定(bio-rad,hercules,ca)检测澄清粗提物的总蛋白含量。用丙酮沉淀存在于sec洗脱级分中的蛋白质(bollag等,1996),用0.25体积或0.05体积的变性上样缓冲液(0.1mtrisph6.8,0.05%溴酚蓝,12.5%甘油,4%sds和5%β-巯基乙醇)重悬以分别进行sds-page分析或免疫印迹分析。在还原条件下通过sds-page进行分离,用考马斯亮蓝r-250对蛋白染色。h5的凝血测定基于nayak和reichl(2004)描述的方法。简言之,在含有100μlpbs的v形底96孔微滴定板中对测试样品(100μl)进行系列双倍稀释,每孔留下100μl稀释的样品。向每孔加入100μl0.25%火鸡红细胞悬液(biolinkinc.,syracuse,ny),在室温孵育板2小时。将显示完全凝血的最高稀释度的倒数记录为凝血活性。平行地,用pbs稀释重组h5标准(a/越南/1203/2004h5n1)(proteinsciencecorporation,meriden,ct),并在每个板中作为对照。图3a显示凝血活性集中在对应于柱空隙体积的级分,证明凝血活性来源于高分子量结构组织。sds-page分析(图3b)表明那些相同的空隙体积级分(级分7-10)也存在最高的ha含量,其中对应于ha0单体的条带在约75kda处可检测到。实施例3:植物组织的酶消化释放具有更少污染物的ha-vlp如实施例1中所述以agl1/685对本塞姆氏烟草植株进行农杆菌渗入。如实施例1中所述在渗入后第6天收集叶并切成~1cm2的片,然后消化、粗滤并离心。叶的受控酶消化去除(至少部分地)细胞壁,从而允许存在于细胞壁和质膜间的间隙中的蛋白质和成分释放入提取基质。由于大多数细胞内蛋白质和成分仍未被破坏并包含在几乎完整的原生质体中,初始的离心步骤可以去除它们,从而提供包含细胞壁降解酶以及细胞外植物蛋白质和成分(质外体级分)的图4所示的所得溶液。图4显示了上述的叶组织受控酶消化后所获得的溶液的sds-page分析,其中泳道1显示所用的酶混合物,泳道2显示酶消化后所得的溶液。泳道3提供从comitroltm得到的粗提物的蛋白质含量以供比较。生物质:缓冲液的比例对于泳道2的提取物是1∶5(w/v),对于泳道3是1∶1(w/v)。因此泳道2和3各自包含源自等量起始原料的蛋白。对于大约相同的缓冲液:植物比例,机械植物提取物包含浓度约3.5-4mg/ml的蛋白质,而根据本发明方法获得的酶植物提取物的蛋白质浓度约为1mg/ml。发现泳道3中存在的主要污染物是rubisco(核酮糖-1,5-二磷酸羧化酶加氧酶),它由两种蛋白亚基形成:大链(l,约55kda)和小链(s,约13kda)。通常总共八条大链二聚体和八条小链彼此之间组装成较大复合物rubisco540kda。尽管在源自机械提取法的植物提取物中发现大量的该植物蛋白污染物(如图4箭头所示),它几乎在本文所述酶消化法所获得的植物提取物中不存在。因此,本方法允许在处理的早期去除该主要的植物蛋白污染物以及其他污染物。实施例4:植物组织的酶消化在可以直接用阳离子交换树脂捕获ha-vlp的条件下释放ha-vlp。按照实施例1中所述用agl1/685对本塞姆氏烟草植株进行农杆菌渗入。在渗入后第6天收集叶,切成~1cm2的片,用轨道摇床室温消化15小时。消化缓冲液包含1.0%(v/v)multifect果胶酶fe,1.0%(v/v)multifectcxcg或和1.0%(v/v)multifectcxb(均购自genencor),每个均在600mm甘露糖醇,75mm柠檬酸盐,0.04%亚硫酸氢钠缓冲液(ph6.0)中,使用1∶2.5(w/v)的生物质∶消化缓冲液比例。消化后,将质外体级分用400μm尼龙滤器过滤,以去除粗的未消化的植物组织(<5%的起始生物质)。然后在室温下以5000×g离心经过滤提取物15分钟,以去除原生质体和细胞内污染物(蛋白质、dna、膜、囊泡、色素等)。然后在进行层析之前,用0.65μm玻璃纤维滤器(sartopore2/sartoriusstedim)和0.45/0.2μm滤器深层过滤上清液(以澄清)。将澄清的质外体级分上样到用平衡/洗脱缓冲液(50mmnapo4,100mmnacl,0.005%tween80ph6.0)平衡好的阳离子交换柱(poroshsappliedbiosystems)。uv回归到0后,用包含升高浓度的nacl(500mm)的平衡/洗脱缓冲液分步洗脱提取物。必要时,使用装配有10kdamwco的amicontm装置将层析级分浓缩10倍。蛋白分析按照之前实施例所述进行。在上述条件下,大多数酶和植物蛋白质不与阳离子交换树脂结合而ha-vlp结合,从而在洗脱级分中提供ha-vlp的可观富集(图6)。此外,如图6所示,在ph在7以下时泳道4和5的纤维素酶和果胶酶不与阳离子交换柱结合。因此,根据ha凝血活性,ha-vlp的回收在上样至阳离子交换柱前为92%,在洗脱级分中为66%。在阳离子交换树脂的洗脱级分中检测到纯化因子为194。实施例5:向消化缓冲液中添加nacl按照实施例1所述用携带表达目的血凝素的构建体(h1/calwt,b/flo,h5/indo或h1/calx179a)的农杆菌株agl1对本塞姆氏烟草植株进行农杆菌渗入。在渗入后第6天收集叶,切成~1cm2的片并按照实施例4所述消化(除非以下特别注明)。按照实施例4所述进行过滤、离心和澄清。向消化缓冲液中添加nacl以评估其对ha-vlp回收率的潜在作用。所猜测的优点是可能能够阻止ha非特异性地与澄清过程中去除的植物细胞或悬液颗粒相关联,以及可对获得和/或维持和/或提高ha-vlp的胶体稳定性有潜在作用。向消化缓冲液中加入500mmnacl使得在通过离心去除原生质体和细胞碎片之后,每克生物质的ha-vlp回收得率提高。但是,该提高只见于h1/calwt和b/flo株,而通过这种方法h5的回收得率并没有显著提高(表4)。表4:在消化步骤中添加nacl对ha-vlp回收得率的作用(通过凝血活性单位测量,dil:稀释度的倒数)1有nacl时的得率(dil/g)除以无nacl时的得率(dil/g)对h1/calwt和h1/calx-179a两毒株,在消化过程中添加500mmnacl进一步使消化过程中ha-vlp释放增加,这继而导致澄清后的回收得率提高(表5),但对h5/indo株不是如此。表5:在澄清步骤之后向消化步骤添加nacl对ha-vlp回收得率的作用(通过凝血活性单位测量)1回收率表示为深层过滤后获得的凝血活性占离心消化提取物的活性的百分比。在酶消化过程中添加和不添加nacl时,用纳米颗粒追踪分析法(nta)对h5/indo和h1/calwt的ha-vlp的结合状态进行了分析(分别见图7a和7b)。在无nacl时进行消化对于h5观察到颗粒的单分散制备物,而h1/cal制备物显示颗粒类型更大的阵列。如图7c中良好的单分散颗粒分布所示,向消化缓冲液中添加nacl降低h1/calha-vlp的自结合。通过向消化缓冲液中添加500mmnacl,150nm的h1/calwt-vlp颗粒数增加(约5倍)。实施例6:色素的控制释放按照实施例1所述用携带表达目的血凝素的构建体(h5/indo)的农杆菌株agl1对本塞姆氏烟草植株进行农杆菌渗入。在渗入后第6天收集叶,切成~1cm2的片,并按照实施例4所述进行消化,其中向消化缓冲液中添加500mmnacl或500mmnacl和25mmedta。按照实施例4所述进行过滤、离心和澄清。酶消化步骤中释放的绿色成分使纯化的vlp制备物呈浅绿色。因此研究并调整细胞壁消化溶液的成分以获得绿色减少的vlp纯化制备物,从而获得增加的纯度。不希望被理论所约束,由于ca2+在将细胞壁的中间片层成分保持在一起中起关键作用,并且考虑到植物细胞壁通常具有高浓度的ca2+这一事实,添加ca2+-螯合剂edta可促进细胞壁的酶促解聚,从而保留完整的细胞内细胞器(例如叶绿体),并防止绿色素成分的释放。见表6,如通过测量制备物吸光度(od672nm-od650nm)差异所评估的,向消化缓冲液中添加25mmedta使纯化的h5-vlp制备物的绿色减少。当绿色成分大量释放或未被适当去除时,vlp制备物表现出的δod>0.040。表6:添加25mmedta至消化缓冲液对h5-vlp产物中的绿色的影响。实施例7:替代性的消化缓冲液成分按照实施例1所述用携带表达目的血凝素的构建体(h5/indo)的农杆菌株agl1对本塞姆氏烟草植株进行农杆菌渗入。在渗入后第6天收集叶,切成~1cm2的片并按照实施例4所述进行消化,其中将消化缓冲液改变为包含0%、0.25%、0.5%、0.75%或1%v/vmultifect果胶酶fe、multifectcx-cg纤维素酶和multifectcxb纤维素酶(如表7-9所示)。按照实施例4所述进行过滤、离心和澄清。如下表7和8所示,证实果胶酶在消化缓冲液中不是必需的。在存在或不存在果胶酶的情况下,可以提取到相似水平的h5/indo或h1/calwtvlp。此外,发现与之前实施例相比,降低纤维素酶浓度与对提取质量没有显著的影响(表9)。表7:消化本塞姆氏烟草叶后h5/indovlp的释放。所有的条件均重复测试。(ha-vlp浓度通过凝血活性测量,dil:稀释度的倒数)*multifectcxgc表8:消化本塞姆氏烟草叶后h1/calwtvlp的释放。所有的条件均重复测试。(ha-vlp浓度通过凝血活性测量,dil:稀释度的倒数)*multifectcxgc和multifectcxb每个1%表9:消化本塞姆氏烟草叶后h1/calwtvlp的释放。所有的条件均进行重复测试。(ha-vlp浓度通过凝血活性检测,dil:稀释度的倒数)*multifectcxgc实施例8:接近中性ph条件下的酶消化控制消化过程中的ph对于某些vlp的提取可以是关键的。考虑到消化步骤中发生的细胞壁的解聚可以释放酸性糖,这在适当缓冲液溶液的存在下会使溶液酸化(即ph6至5),并且已证实某些vlp(如包含h3/bris和b/floha的那些)对轻度酸性环境有很强的敏感性,所以研究了这种可能的酸化对vlp产率的影响。按照实施例1所述用携带表达目的血凝素的构建体(b/flo、h5/indo、h3/bris)的农杆菌株agl1对本塞姆氏烟草植株进行农杆菌渗入。在渗入后第6天收集叶,切成~1cm2的片并按照实施例4所述进行消化,其中将消化条件改变为包含500mmnacl;25或50mmedta;0.03或0.04%硫酸氢钠;0、100、200或600mm甘露糖醇,75、125或150mm柠檬酸盐;和/或75mmnapo4;消化缓冲液ph的调整如表10-14所示。按照实施例4所述进行过滤、离心和澄清。测试不同的消化缓冲液成分是否在酶消化结束时达到约5.5的ph,包括增加的柠檬酸盐浓度(缓冲能力在ph3.0至5.4之间)和添加磷酸钠(缓冲能力在ph6.0以上)。表10显示在消化后ph接近ph6.0时,来自b株的vlp能够被更有效地提取。表10:消化缓冲液成分对b/flovlp提取率的影响。1所有缓冲液包含600mm甘露糖醇,焦亚硫酸钠0.04%然后,检测了为使最终ph值接近ph6.0而在更高ph起始消化的影响。如表11所示,在这种近中性条件下消化植物细胞壁是可以的,并未减少h5/indovlp的提取率。表11:消化缓冲液起始ph对h5/indovlp提取率的影响。1所有消化缓冲液包含600mm甘露糖醇,焦亚硫酸钠0.04%,125mm柠檬酸盐+75mmnapo4+500mmnacl+25mmedta还表明调整消化溶液的其他成分对vlp的提取率没有不利影响。表12显示了可以对消化溶液进行调整以提高b/flovlp的提取率同时获得5.4-5.7的消化后ph。这种调整包括提高柠檬酸盐的浓度和添加po4缓冲液。发现提高edta浓度通常导致更加酸化的提取物和更低的vlp提取率。表12:不同消化缓冲液成分对b/flovlp提取率的影响。1所有缓冲液包含500mmnacl,焦亚硫酸钠0.04%。进一步调整缓冲液成分以提高h3/布里斯班vlp的提取率(表13)表13:消化溶液中甘露糖醇和亚硫酸钠浓度对h3/brisvlp提取率的影响。1所有缓冲液包含125mm柠檬酸盐,75mmnapo4,500mmnacl,如表12和13所示,甘露糖醇浓度可降至200mm而不显著影响vlp提取率。进一步降低甘露糖醇浓度到100mm甚至完全不将甘露糖醇添加至消化溶液不会显著影响获得的ha-vlp水平(表14)。表14:甘露糖醇浓度不同的缓冲液消化生物质所释放的h5/indovlp1所有缓冲液包含75mm柠檬酸盐ph6.0+焦亚硫酸钠0.04%。2在不含甘露糖醇(实验1)和含100mm甘露糖醇(实验2)的情况下进行2个相比于600mm甘露糖醇的实验以比较vlp的提取率。实施例9:酶消化对多种ha-vlp的适用性本文所述的植物生物质酶消化法有可能被应用到多种ha-vlp的提取中。除了提取之前实施例所示的包含h5/indo、h1/calwtvlp、h3/bris和b/flo的ha-vlp之外,本文所述方法还适用于季节性的h1/bris和h1/nc的ha-vlp的提取,如表15所示。表15:消化农杆菌渗入的本塞姆氏烟草叶所释放的季节性h1/bris和h1/ncvlp。(ha浓度通过凝血活性测量,dil:稀释度的倒数)所有引用文献通过引用并入本文,就像指名每个独立出版物专门并单独地通过引用并入本文并在本文中给出全文那样。本文引用的参考文献不应理解为或视为承认这些参考文献是本发明的现有技术。已通过示例方式描述了一个或多个目前优选的本发明实施方案。本发明包括基本如上所述并且参照实施例和附图的所有实施方案、改变和变化。对本领域技术人员来说显而易见的是,大量的变化和改变可在不偏离本发明权利要求所限定范围的情况下获得。这些修改的例子包括用已知的等同方案替换本发明的任何方面以实质相同的方式获得同样的结果。以下部分对应于母案申请的原始权利要求书:1.制备植物来源的vlp的方法,其包括:a.获取包含定位于质外体的vlp的植物或植物物质,b.产生原生质体/原生质球级分和质外体级分;和,c.回收所述质外体级分,所述质外体级分包含所述植物来源的vlp。2.项1的方法,其中在所述产生步骤(步骤b)中,通过用细胞壁降解酶组合物处理所述植物或植物物质来产生所述质外体级分和原生质体级分。3.项2的方法,其中所述细胞壁降解酶组合物包含一种或多于一种果胶酶、一种或多于一种纤维素酶,或者一种或多于一种果胶酶和一种或多于一种纤维素酶。4.项3的方法,其中所述细胞壁降解酶组合物不包含脂肪酶、蛋白酶或果胶酶中的一种或更多种。5.项1的方法,其中在所述获取步骤(步骤a)中,用编码选自以下组的蛋白质的核酸序列转化所述植物:病毒包膜蛋白、病毒结构蛋白、病毒衣壳蛋白和病毒外壳蛋白,以及收集所述植物或植物物质。6.项5的方法,其中所述核酸以瞬时方式引入所述植物中。7.项5的方法,其中所述核酸稳定整合进所述植物的基因组。8.项1的方法,其中在所述获取步骤(步骤a)中,培养所述植物并收集所述植物或植物物质。9.项5的方法,其中所述核酸编码流感血凝素。10.项1的方法,其中所述植物来源的vlp不包含神经氨酸酶或m蛋白。11.项1的方法,其中所述植物物质选自叶和培养的植物细胞的组。12.项1的方法,其还包括步骤d)从所述质外体级分中纯化所述植物来源的vlp。13.项12的方法,其中所述纯化步骤包括利用深层过滤来过滤所述质外体级分以产生澄清的提取物,然后用阳离子交换树脂来层析所述澄清的提取物。14.制备包含植物来源之脂质包膜的植物来源vlp的方法,其包括:a.获取包含定位于质外体的vlp的植物或植物物质,b.用酶组合物处理所述植物或植物物质,以产生原生质体/原生质球级分和一种或多于一种包含所述vlp的质外体蛋白复合物;以及c.将所述一种或多于一种质外体蛋白复合物与所述原生质体级分分离。15.项14的方法,其中所述酶组合物包含一种或多于一种果胶酶、一种或多于一种纤维素酶,或者一种或多于一种果胶酶和一种或多于一种纤维素酶。16.项14的方法,其中所述酶组合物不包含脂肪酶、蛋白酶或果胶酶中的一种或更多种。17.项14的方法,其还包括步骤d)从所述质外体级分中纯化所述植物来源的vlp。18.项17的方法,其中所述纯化步骤包括利用深层过滤来过滤所述质外体级分以产生澄清的提取物,然后用阳离子交换树脂来层析所述澄清的提取物。19.项14的方法,其中在所述获取步骤(步骤a)中,用编码选自以下组的蛋白质的核酸序列转化所述植物:病毒包膜蛋白、病毒结构蛋白、病毒衣壳蛋白和病毒外壳蛋白,以及收集所述植物或植物物质。20.项19的方法,其中所述核酸以瞬时方式引入所述植物中。21.项19的方法,其中所述核酸稳定整合进所述植物的基因组。22.项14的方法,其中在所述获取步骤(步骤a)中,培养所述植物并收集所述植物或植物物质。23.项19的方法,其中所述vlp包含流感血凝素。24.项14的方法,其中所述植物物质选自叶和培养的植物细胞的组。25.项14的方法,其中所述vlp不包含神经氨酸酶或m蛋白。26.制备植物来源的vlp的方法,其包括:a.获取包含植物来源的vlp的植物或植物物质;b.用细胞壁降解酶组合物消化所述植物物质以产生消化级分;c.过滤所述消化级分以产生过滤级分,从所述过滤级分中回收所述植物来源的vlp。27.项26的方法,其中所述细胞壁降解酶组合物包含一种或多于一种果胶酶、一种或多于一种纤维素酶,或者一种或多于一种果胶酶和一种或多于一种纤维素酶。28.项27的方法,其中所述细胞壁降解酶组合物包含一种或多于一种果胶酶、一种或多于一种纤维素酶,或者一种或多于一种果胶酶和一种或多于一种纤维素酶。29.项27的方法,其中在所述获取步骤(步骤a)中,用编码选自以下组的蛋白质的核酸序列转化所述植物:病毒包膜蛋白、病毒结构蛋白、病毒衣壳蛋白和病毒外壳蛋白,以及收集所述植物或植物物质。30.项29的方法,其中所述核酸以瞬时方式引入所述植物中。31.项29的方法,其中所述核酸稳定整合进所述植物的基因组。32.项29的方法,其中所述植物来源的vlp包含流感血凝素。33.项27的方法,其中所述植物物质选自叶和培养的植物细胞的组。34.项26的方法,其还包括步骤d)将所述过滤级分中的vlp与细胞碎片和不溶物质分离开。35.项34的方法,其中所述分离步骤通过离心进行。36.项34的方法,其中所述分离步骤通过深层过滤进行。37.项27的方法,其还包括步骤d)从所述过滤级分中纯化所述植物来源的vlp。38.项34的方法,其中所述纯化步骤包括深层过滤所述过滤级分以产生澄清的提取物,然后用阳离子交换树脂来层析所述澄清的提取物。<110>medicagoinc.vezina,louis-philippedargis,michelecouture,manonpaquet,danyd'aoust,marc-andre<120>制备植物来源的vlp的方法<130>v82324wo<150>61/244,786<151>2009-09-22<160>14<170>patentinversion3.5<210>1<211>3067<212>dna<213>人工序列<220><223>合成的构建体685<400>1ttaattaagaattcgagctccaccgcggaaacctcctcggattccattgcccagctatct60gtcactttattgagaagatagtggaaaaggaaggtggctcctacaaatgccatcattgcg120ataaaggaaaggccatcgttgaagatgcctctgccgacagtggtcccaaagatggacccc180cacccacgaggagcatcgtggaaaaagaagacgttccaaccacgtcttcaaagcaagtgg240attgatgtgatatctccactgacgtaagggatgacgcacaatcccactatccttcgcaag300acccttcctctatataaggaagttcatttcatttggagaggtattaaaatcttaataggt360tttgataaaagcgaacgtggggaaacccgaaccaaaccttcttctaaactctctctcatc420tctcttaaagcaaacttctctcttgtctttcttgcgtgagcgatcttcaacgttgtcaga480tcgtgcttcggcaccagtacaacgttttctttcactgaagcgaaatcaaagatctctttg540tggacacgtagtgcggcgccattaaataacgtgtacttgtcctattcttgtcggtgtggt600cttgggaaaagaaagcttgctggaggctgctgttcagccccatacattacttgttacgat660tctgctgactttcggcgggtgcaatatctctacttctgcttgacgaggtattgttgcctg720tacttctttcttcttcttcttgctgattggttctataagaaatctagtattttctttgaa780acagagttttcccgtggttttcgaacttggagaaagattgttaagcttctgtatattctg840cccaaatttgtcgggcccatggagaaaatagtgcttcttcttgcaatagtcagtcttgtt900aaaagtgatcagatttgcattggttaccatgcaaacaattcaacagagcaggttgacaca960atcatggaaaagaacgttactgttacacatgcccaagacatactggaaaagacacacaac1020gggaagctctgcgatctagatggagtgaagcctctaattttaagagattgtagtgtagct1080ggatggctcctcgggaacccaatgtgtgacgaattcatcaatgtaccggaatggtcttac1140atagtggagaaggccaatccaaccaatgacctctgttacccagggagtttcaacgactat1200gaagaactgaaacacctattgagcagaataaaccattttgagaaaattcaaatcatcccc1260aaaagttcttggtccgatcatgaagcctcatcaggagttagctcagcatgtccatacctg1320ggaagtccctccttttttagaaatgtggtatggcttatcaaaaagaacagtacataccca1380acaataaagaaaagctacaataataccaaccaagaggatcttttggtactgtggggaatt1440caccatcctaatgatgcggcagagcagacaaggctatatcaaaacccaaccacctatatt1500tccattgggacatcaacactaaaccagagattggtaccaaaaatagctactagatccaaa1560gtaaacgggcaaagtggaaggatggagttcttctggacaattttaaaacctaatgatgca1620atcaacttcgagagtaatggaaatttcattgctccagaatatgcatacaaaattgtcaag1680aaaggggactcagcaattatgaaaagtgaattggaatatggtaactgcaacaccaagtgt1740caaactccaatgggggcgataaactctagtatgccattccacaacatacaccctctcacc1800atcggggaatgccccaaatatgtgaaatcaaacagattagtccttgcaacagggctcaga1860aatagccctcaaagagagagcagaagaaaaaagagaggactatttggagctatagcaggt1920tttatagagggaggatggcagggaatggtagatggttggtatgggtaccaccatagcaat1980gagcaggggagtgggtacgctgcagacaaagaatccactcaaaaggcaatagatggagtc2040accaataaggtcaactcaatcattgacaaaatgaacactcagtttgaggccgttggaagg2100gaatttaataacttagaaaggagaatagagaatttaaacaagaagatggaagacgggttt2160ctagatgtctggacttataatgccgaacttctggttctcatggaaaatgagagaactcta2220gactttcatgactcaaatgttaagaacctctacgacaaggtccgactacagcttagggat2280aatgcaaaggagctgggtaacggttgtttcgagttctatcacaaatgtgataatgaatgt2340atggaaagtataagaaacggaacgtacaactatccgcagtattcagaagaagcaagatta2400aaaagagaggaaataagtggggtaaaattggaatcaataggaacttaccaaatactgtca2460atttattcaacagtggcgagttccctagcactggcaatcatgatggctggtctatcttta2520tggatgtgctccaatggatcgttacaatgcagaatttgcatttaaaggcctattttcttt2580agtttgaatttactgttattcggtgtgcatttctatgtttggtgagcggttttctgtgct2640cagagtgtgtttattttatgtaatttaatttctttgtgagctcctgtttagcaggtcgtc2700ccttcagcaaggacacaaaaagattttaattttattaaaaaaaaaaaaaaaaaagaccgg2760gaattcgatatcaagcttatcgacctgcagatcgttcaaacatttggcaataaagtttct2820taagattgaatcctgttgccggtcttgcgatgattatcatataatttctgttgaattacg2880ttaagcatgtaataattaacatgtaatgcatgacgttatttatgagatgggtttttatga2940ttagagtcccgcaattatacatttaatacgcgatagaaaacaaaatatagcgcgcaaact3000aggataaattatcgcgcgcggtgtcatctatgttactagattctagagtctcaagcttcg3060gcgcgcc3067<210>2<211>568<212>prt<213>人工序列<220><223>由seqidno:1编码的合成的氨基酸<400>2metglulysilevalleuleuleualailevalserleuvallysser151015aspglnilecysileglytyrhisalaasnasnserthrgluglnval202530aspthrilemetglulysasnvalthrvalthrhisalaglnaspile354045leuglulysthrhisasnglylysleucysaspleuaspglyvallys505560proleuileleuargaspcysservalalaglytrpleuleuglyasn65707580prometcysaspglupheileasnvalproglutrpsertyrileval859095glulysalaasnprothrasnaspleucystyrproglyserpheasn100105110asptyrglugluleulyshisleuleuserargileasnhispheglu115120125lysileglnileileprolyssersertrpserasphisglualaser130135140serglyvalserseralacysprotyrleuglyserproserphephe145150155160argasnvalvaltrpleuilelyslysasnserthrtyrprothrile165170175lyslyssertyrasnasnthrasnglngluaspleuleuvalleutrp180185190glyilehishisproasnaspalaalagluglnthrargleutyrgln195200205asnprothrthrtyrileserileglythrserthrleuasnglnarg210215220leuvalprolysilealathrargserlysvalasnglyglnsergly225230235240argmetgluphephetrpthrileleulysproasnaspalaileasn245250255phegluserasnglyasnpheilealaproglutyralatyrlysile260265270vallyslysglyaspseralailemetlyssergluleuglutyrgly275280285asncysasnthrlyscysglnthrprometglyalaileasnserser290295300metprophehisasnilehisproleuthrileglyglucysprolys305310315320tyrvallysserasnargleuvalleualathrglyleuargasnser325330335proglnarggluserargarglyslysargglyleupheglyalaile340345350alaglypheilegluglyglytrpglnglymetvalaspglytrptyr355360365glytyrhishisserasngluglnglyserglytyralaalaasplys370375380gluserthrglnlysalaileaspglyvalthrasnlysvalasnser385390395400ileileasplysmetasnthrglnpheglualavalglyarggluphe405410415asnasnleugluargargilegluasnleuasnlyslysmetgluasp420425430glypheleuaspvaltrpthrtyrasnalagluleuleuvalleumet435440445gluasngluargthrleuaspphehisaspserasnvallysasnleu450455460tyrasplysvalargleuglnleuargaspasnalalysgluleugly465470475480asnglycysphegluphetyrhislyscysaspasnglucysmetglu485490495serileargasnglythrtyrasntyrproglntyrserglugluala500505510argleulysargglugluileserglyvallysleugluserilegly515520525thrtyrglnileleuseriletyrserthrvalalaserserleuala530535540leualailemetmetalaglyleuserleutrpmetcysserasngly545550555560serleuglncysargilecysile565<210>3<211>24<212>dna<213>人工序列<220><223>合成的寡核苷酸pbinplus.2613c<400>3aggaagggaagaaagcgaaaggag24<210>4<211>56<212>dna<213>人工序列<220><223>合成的寡核苷酸mut-atg115.r<400>4gtgccgaagcacgatctgacaacgttgaagatcgctcacgcaagaaagacaagaga56<210>5<211>52<212>dna<213>人工序列<220><223>合成的寡核苷酸mut-atg161.c<400>5gttgtcagatcgtgcttcggcaccagtacaacgttttctttcactgaagcga52<210>6<211>25<212>dna<213>人工序列<220><223>合成的寡核苷酸lc-c5-1.110r<400>6tctcctggagtcacagacagggtgg25<210>7<211>39<212>dna<213>人工序列<220><223>合成的寡核苷酸apai-h5(a-indo).1c<400>7tgtcgggcccatggagaaaatagtgcttcttcttgcaat39<210>8<211>37<212>dna<213>人工序列<220><223>合成的寡核苷酸h5(a-indo)-stui.1707r<400>8aaataggcctttaaatgcaaattctgcattgtaacga37<210>9<211>3111<212>dna<213>人工序列<220><223>合成的寡核苷酸构建体660<400>9agaggtaccccgggctggtatatttatatgttgtcaaataactcaaaaaccataaaagtt60taagttagcaagtgtgtacatttttacttgaacaaaaatattcacctactactgttataa120atcattattaaacattagagtaaagaaatatggatgataagaacaagagtagtgatattt180tgacaacaattttgttgcaacatttgagaaaattttgttgttctctcttttcattggtca240aaaacaatagagagagaaaaaggaagagggagaataaaaacataatgtgagtatgagaga300gaaagttgtacaaaagttgtaccaaaatagttgtacaaatatcattgaggaatttgacaa360aagctacacaaataagggttaattgctgtaaataaataaggatgacgcattagagagatg420taccattagagaatttttggcaagtcattaaaaagaaagaataaattatttttaaaatta480aaagttgagtcatttgattaaacatgtgattatttaatgaattgatgaaagagttggatt540aaagttgtattagtaattagaatttggtgtcaaatttaatttgacatttgatcttttcct600atatattgccccatagagtcagttaactcatttttatatttcatagatcaaataagagaa660ataacggtatattaatccctccaaaaaaaaaaaacggtatatttactaaaaaatctaagc720cacgtaggaggataacaggatccccgtaggaggataacatccaatccaaccaatcacaac780aatcctgatgagataacccactttaagcccacgcatctgtggcacatctacattatctaa840atcacacattcttccacacatctgagccacacaaaaaccaatccacatctttatcaccca900ttctataaaaaatcacactttgtgagtctacactttgattcccttcaaacacatacaaag960agaagagactaattaattaattaatcatcttgagagaaaatggagaaaatagtgcttctt1020cttgcaatagtcagtcttgttaaaagtgatcagatttgcattggttaccatgcaaacaat1080tcaacagagcaggttgacacaatcatggaaaagaacgttactgttacacatgcccaagac1140atactggaaaagacacacaacgggaagctctgcgatctagatggagtgaagcctctaatt1200ttaagagattgtagtgtagctggatggctcctcgggaacccaatgtgtgacgaattcatc1260aatgtaccggaatggtcttacatagtggagaaggccaatccaaccaatgacctctgttac1320ccagggagtttcaacgactatgaagaactgaaacacctattgagcagaataaaccatttt1380gagaaaattcaaatcatccccaaaagttcttggtccgatcatgaagcctcatcaggagtt1440agctcagcatgtccatacctgggaagtccctccttttttagaaatgtggtatggcttatc1500aaaaagaacagtacatacccaacaataaagaaaagctacaataataccaaccaagaggat1560cttttggtactgtggggaattcaccatcctaatgatgcggcagagcagacaaggctatat1620caaaacccaaccacctatatttccattgggacatcaacactaaaccagagattggtacca1680aaaatagctactagatccaaagtaaacgggcaaagtggaaggatggagttcttctggaca1740attttaaaacctaatgatgcaatcaacttcgagagtaatggaaatttcattgctccagaa1800tatgcatacaaaattgtcaagaaaggggactcagcaattatgaaaagtgaattggaatat1860ggtaactgcaacaccaagtgtcaaactccaatgggggcgataaactctagtatgccattc1920cacaacatacaccctctcaccatcggggaatgccccaaatatgtgaaatcaaacagatta1980gtccttgcaacagggctcagaaatagccctcaaagagagagcagaagaaaaaagagagga2040ctatttggagctatagcaggttttatagagggaggatggcagggaatggtagatggttgg2100tatgggtaccaccatagcaatgagcaggggagtgggtacgctgcagacaaagaatccact2160caaaaggcaatagatggagtcaccaataaggtcaactcaatcattgacaaaatgaacact2220cagtttgaggccgttggaagggaatttaataacttagaaaggagaatagagaatttaaac2280aagaagatggaagacgggtttctagatgtctggacttataatgccgaacttctggttctc2340atggaaaatgagagaactctagactttcatgactcaaatgttaagaacctctacgacaag2400gtccgactacagcttagggataatgcaaaggagctgggtaacggttgtttcgagttctat2460cacaaatgtgataatgaatgtatggaaagtataagaaacggaacgtacaactatccgcag2520tattcagaagaagcaagattaaaaagagaggaaataagtggggtaaaattggaatcaata2580ggaacttaccaaatactgtcaatttattcaacagtggcgagttccctagcactggcaatc2640atgatggctggtctatctttatggatgtgctccaatggatcgttacaatgcagaatttgc2700atttaagagctctaagttaaaatgcttcttcgtctcctatttataatatggtttgttatt2760gttaattttgttcttgtagaagagcttaattaatcgttgttgttatgaaatactatttgt2820atgagatgaactggtgtaatgtaattcatttacataagtggagtcagaatcagaatgttt2880cctccataactaactagacatgaagacctgccgcgtacaattgtcttatatttgaacaac2940taaaattgaacatcttttgccacaactttataagtggttaatatagctcaaatatatggt3000caagttcaatagattaataatggaaatatcagttatcgaaattcattaacaatcaactta3060acgttattaactactaattttatatcatcccctttgataaatgatagtaca3111<210>10<211>26<212>prt<213>紫花苜蓿(medicagosativa)<400>10metalalysasnvalalailepheglyleuleupheserleuleuleu151015leuvalproserglnilephealagluglu2025<210>11<211>25<212>dna<213>人工序列<220><223>合成的寡核苷酸plasto-443c<400>11gtattagtaattagaatttggtgtc25<210>12<211>34<212>dna<213>人工序列<220><223>合成的寡核苷酸supp19-plasto.r<400>12ccttgtatagctcgttccattttctctcaagatg34<210>13<211>20<212>dna<213>人工序列<220><223>合成的寡核苷酸supp19-1c<400>13atggaacgagctatacaagg20<210>14<211>32<212>dna<213>人工序列<220><223>合成的寡核苷酸supp19-saci.r<400>14agtcgagctcttactcgctttctttttcgaag32当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1