高效的小体积核酸合成的制作方法
本申请是申请日为2012年9月26日、申请号为201280057089.4、发明名称为“高效的小体积核酸合成”的发明专利申请的分案申请。
发明领域
总体而言,本公开内容涉及用于产生核酸分子的组合物和方法。在一些方面,本发明允许核酸分子的微量产生,任选地随后为这些核酸分子装配成更大的分子。在一些方面,本发明允许核酸分子(例如,大核酸分子例如基因组)的有效产生。
发明背景
核酸分子的产生可以是相当简单或复杂的,这取决于诸如待产生的核酸分子的类型等的因素。例如,历史上,短的单链核酸分子例如引物典型地通过化学合成来产生(参见例如,u.s.专利号5,837,858,其公开内容通过提及而并入本文)。进一步地,更长的核酸分子典型地通过聚合酶链式反应(pcr)来产生。pcr的一个缺点是通常需要模板核酸。
许多核酸合成方法对于从头产生大的核酸分子具有有限的能力。本公开内容的一个方面是解决该限制。
发明概述
本发明部分地涉及用于合成核酸分子的组合物和方法。本发明还涉及用于装配核酸分子从而形成诸如质粒、染色体和基因组之类的分子的组合物和方法。
在一些方面,本发明涉及用于核酸分子的非模板指导的合成的多孔平板。在一些实施方案中,所述平板包含位于所述平板的众多孔的每个孔中的珠粒(例如,磁性珠粒)和存在于所述众多孔的一个或多个孔中的以电化学方式产生的酸(ega)。代替在一个或多个孔中具有ega或者除了在一个或多个孔中具有ega,所述平板的孔可以包含有在别处陈述的与核酸分子的合成相关的其他试剂。
在本发明的实践中使用的珠粒大小可以广泛地变化,但是包括具有下列直径的珠粒:0.01μm至100μm、0.005μm至100μm、0.005μm至10μm、0.01μm至100μm、0.01μm至1,000μm、1.0μm至2.0μm、1.0μm至100μm、2.0μm至100μm、3.0μm至100μm、0.5μm至50μm、0.5μm至20μm、1.0μm至10μm、1.0μm至20μm、1.0μm至30μm、10μm至40μm、10μm至60μm、10μm至80μm或0.5μm至10μm。正如本领域技术人员将会认识到的,当固体颗粒降到一个特定的大小水平之下时,它们开始看上去获得了流体的属性(例如,形成胶体悬浮液的等价物)。因此,在一些情况下(例如,在使用直径低于大约500nm的珠粒时),可以期望将所述珠粒作为流体对待。这可以意味着从磁性尖端上移除珠粒,例如,通过搅拌、洗涤,或通过使用表面活性剂。
在本发明的特别的实施方案中,可以依赖于孔的大小来选择珠粒大小,以允许仅一个单珠粒占据孔。在其他实施方案中,多于一个的珠粒(或其他形状的核酸合成基质)可以在所述孔的一些或所有中。在一些情况下,珠粒数目/孔可以为二至二十,二至三十,二至十,四至二十,四至十,四至五十,等等。
孔的数目也可以广泛地变化,并且受到诸如待产生的核酸的量之类的因素以及诸如可制造性和与使用有关的机械因素(例如,磁性珠粒提取器的大小下限)之类的技术因素限制。在任何情况下,孔的数目可以总计为例如为10至10,000,000、10至5,000,000、10至2,000,000、10至1,000,000、10至800,000、10至650,000、10至500,000、500至500,000、10至50,000、1,000至500,000、10,000至500,000、20,000至500,000或1,000至50,000。进一步地,制备了多孔表面,其具有数目在1千万范围内的孔。因此,在一些情况下,孔的数目可以少于5百万、1千万、2千万等。
每个孔的总体积是可以变化的另一个项目,并且可以例如为1.0×10-9μl至50μl、1.0×10-9μl至10μl、1.0×10-9μl至1.0μl、1.0×10-9μl至0.1μl、1.0×10-9μl至1.0×10-2μl、1.0×10-9μl至1.0×10-3μl、1.0×10-9μl至1.0×10-4μl、1.0×10-9μl至50μl、1.0×10-5μl至1.0×10-6μl、1.0×10-9μl至1.0×10-7μl、2.5×10-9μl至1.0×10-2μl、2.5×10-9μl至1.0×10-3μl、2.5×10-9μl至1.0×10-4μl、2.5×10-9μl至1.0×10-5μl、2.5×10-9μl至1.0×10-6μl、1.0×10-8μl至1.0×10-6μl、1.0×10-8μl至1.0×10-5μl、1.0×10-7μl至1.0×10-5μl、1.0×10-7μl至1.0×10-4μl、1.0×10-7μl至1.0×10-3μl、1.0×10-7μl至1.0×10-2μl、0.1μl至50μl、0.01μl至50μl、0.01μl至25μl、0.01μl至15μl、0.01μl至10μl、0.001μl至50μl、0.001μl至5μl、0.001μl至1μl、0.001μl至0.01μl或0.001μl至1μl。
在许多情况下,将会将本发明的多孔平板或适合用于本发明的多孔平板可操作地与一个电极或一套(例如,一对或数对)电极相连接。如在本文别处所讨论的,这些电极可以用于产生与一个或多个化学反应的催化相关的微环境(例如,用于核苷酸去保护的ega)。
在一些实施方案中,将会将本发明的多孔平板或适合用于本发明的多孔平板与用于引入和移除试剂的微观流体通道相连接。这允许试剂的有效和自动化的控制。
本发明还提供了用于产生从更小的化学合成的核酸分子形成的经装配的核酸分子的方法。在一些实施方案中,这样的方法可以包括一个或多个下列步骤:
(a)合成众多核酸分子,其中在平板的孔中以微量制备每个核酸分子;
(b)将在(a)中产生的核酸分子或其一部分进行合并,从而产生汇集物;
(c)将一些或所有存在于在(b)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;
(d)从在(c)中形成的所述众多更大的核酸分子中去除包含序列错误的核酸分子,从而产生校正了错误的核酸分子汇集物;和
(e)将在所述校正了错误的核酸分子汇集物中的核酸分子进行装配,从而形成经装配的核酸分子。
在一些实施方案中,存在于汇集物中的核酸分子的连接将由聚合酶链式反应(pcr)来介导。
在一些实施方案中,步骤(b)可以进一步包括将在(a)中产生的核酸分子与通过其他方式获得的核酸分子进行合并,从而形成汇集物,其中所述其他方式包括pcr、限制酶消化或核酸外切酶处理。在一些情况下,可以将在(c)和/或(e)中产生的经装配的核酸分子进行装配并引入到载体(例如,克隆载体、目的载体,等等)中。
通过本发明的方法进行装配的核酸分子的数目可以变化,并且在合适时将会与经汇集的核酸分子的数目相关联。在任何情况下,在本发明的方法中装配的核酸分子可以由至少五个其他(例如,更小的)核酸分子(例如,大约五个至大约五千个,大约五个至大约两万个,大约五个至大约十万个,大约五十个至大约五千个,大约五十个至大约两万个,大约五十个至大约十万个,大约一百个至大约五千个,大约一百个至大约十万个,大约五百个至大约五千个,大约五百个至大约十万个等的核酸分子)组成。
通过本发明的方法进行装配的核酸分子可以很大地变化,并且包括至少20千碱基(例如,大约0.5千碱基至大约10兆碱基、大约0.5千碱基至大约5兆碱基、大约0.5千碱基至大约1兆碱基、大约0.5千碱基至大约500千碱基、大约0.5千碱基至大约100千碱基、大约0.5千碱基至大约10兆碱基、大约0.5千碱基至大约1千碱基、大约1千碱基至大约10兆碱基、大约10千碱基至大约5兆碱基、大约1千碱基至大约5兆碱基、大约1千碱基至大约2兆碱基、大约1千碱基至大约1兆碱基、大约1千碱基至大约500千碱基、大约10千碱基至大约1兆碱基、大约10千碱基至大约500千碱基、大约10千碱基至大约100千碱基,等等)的分子。
通过本发明的方法进行装配的核酸分子可以例如是单链的、部分单链的或双链的,闭合的,环状的(例如,质粒);带切口的,环状的;或线性的(例如,质粒、染色体等)。进一步地,可以如此地施行本发明的方法,从而在相同的反应混合物中同时形成两个或更多个(例如,两个、三个、四个、五个、六个、十个、二十个等)经装配的核酸分子。
本发明还提供了用于产生产物核酸分子的方法。在一些情况下,这样的方法包括:
(a)设计大小为10千碱基至500千碱基(例如,500碱基至500千碱基、500碱基至100千碱基、500碱基至1千碱基、500碱基至800碱基,2千碱基至100千碱基、2千碱基至50千碱基、2千碱基至5千碱基、10千碱基至500千碱基、10千碱基至300千碱基、10千碱基至200千碱基、10千碱基至100千碱基、10千碱基至50千碱基,等等)的产物核酸分子,其中所述产物核酸分子通过核苷酸序列来进行定义;
(b)合成众多在核苷酸序列方面不同的独个核酸分子,其中合成每个独个核酸分子以制备1,000至1.0×109个拷贝的数量,并且其中所述独个核酸分子能够与一个或多个其他独个核酸分子杂交;
(c)在一定的条件下将在(b)中合成的独个核酸分子进行合并,所述条件允许所述独个核酸分子在允许形成至少一个更大的核酸分子的条件下进行杂交;和
(d)将在(c)中形成的所述至少一个更大的核酸分子与一个或多个另外的核酸分子进行合并,从而形成产物核酸分子,其中所述产物核酸分子包含少于一个的序列错误/千碱基。
在许多情况下,在产生产物核酸分子过程中采用错误校正程序。在上面的工作流程中可以施行错误校正程序的一个地方是在步骤(b)之后。错误校正程序在本文别处进行描述,并且将会经常包括使用一种或多种错配修复核酸内切酶。
作为产物核酸分子的制备的一部分而合成的独个核酸分子的数目可以很大地变化,但是包括1,000至1.0×109个拷贝、1,000至1.0×108个拷贝、1,000至1.0×107个拷贝、1,000至1.0×106个拷贝、1,000至1.0×105个拷贝、2.0×107至1.0×109个拷贝、5.0×107至1.0×109个拷贝、7.0×107至1.0×109个拷贝、2.0×107至8.0×108个拷贝、2.0×107至5.0×108个拷贝、5.0×104至1.0×109个拷贝、1.0×106至1.0×109个拷贝、1.0×107至1.0×108个拷贝,等等。
在许多情况下,可以使用聚合酶链式反应来扩增在上面的产物核酸分子制备方法中在步骤(c)中形成的所述至少一个更大的核酸分子。
用于合成核酸分子的平板形式在本文别处进行描述,并且它们可以用在上面的产物核酸分子制备方法中。进一步地,当在珠粒上合成独个核酸分子时,其中每个珠粒可以包含在孔中。进一步地,在本发明的该方面以及本发明的其他方面中使用的珠粒可以例如具有诸如下列的大小:1μm至100μm的直径、5μm至50μm的直径、3μm至100μm的直径、5μm至100μm的直径、20μm至100μm的直径、5μm至60μm的直径、10μm至100μm的直径,等等。在一些实施方案中,珠粒可以具有大约30μm的直径(例如,28至32μm)的大小。
本发明还包括用于以小的量和以高的序列保真度产生核酸分子的方法。在一些方面,本发明包括用于产生核酸分子的方法,所述方法包括以3.0×106至4.0×108个分子的总量合成核酸分子,其中序列错误的数目为1/100至1/500。
因此,本发明包括用于产生核酸分子集合的方法,囊括了包括下列步骤的方法:
(a)合成众多核酸分子,其中以微量制备每个核酸分子;
(b)将一些或所有存在于在(a)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的的核酸分子;和
(c)将所述众多更大的核酸分子进行装配,从而形成核酸分子集合,其中从生物信息学信息方面,所述核酸分子集合选自下列:
(1)互补dna(cdna)文库,其仅包含与信使rna(mrna)分子相对应的dna;
(2)部分cdna文库,其包含与小于在所述生物信息学信息所来自的细胞类型中发现的mrna分子的完全互补物相对应的dna分子;和
(3)核酸分子集合,其中一些或所有的所述核酸分子为在所述生物信息学信息所来自的细胞类型中发现的核酸分子的密码子经改变的变体。
本发明还提供了用于产生从更小的化学合成的核酸分子形成的自我复制性核酸分子的方法。在一些实施方案中,这样的方法可以包括一个或多个下列步骤:
(a)合成众多核酸分子,其中在平板中以微量制备每个核酸分子;
(b)将一些或所有存在于在(a)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;和
(c)将所述众多更大的核酸分子进行装配,从而形成自我复制性核酸分子。
通过本发明的方法制备的自我复制性核酸分子包括染色体、人工染色体(例如,bac或yac)、质粒和基因组(例如,诸如下列的基因组:病毒基因组、核基因组、原核生物(例如,细菌、藻类等)基因组、叶绿体基因组或线粒体基因组)。
本发明还包括用于合成和装配编码多于一种的表达产物的核酸分子的方法,所述方法包括:
(a)合成众多核酸分子,其中以微量制备每个核酸分子;
(b)将一些或所有存在于在(a)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;和
(c)将所述众多更大的核酸分子进行装配,从而形成编码多于一种的表达产物的核酸分子。
在本发明的各种不同的方面,所述多于一种的表达产物可以为在相同的生物学途径中所牵涉的蛋白质。在更特别的方面,所述多于一种的表达产物可以为在相同的生物学途径中所牵涉的蛋白质,所述在相同的生物学途径中所牵涉的蛋白质为催化在该生物学途径中的一系列化学反应的酶。进一步地,此类在相同的生物学途径中的化学反应可以为顺次反应,其意义为:一个化学反应跟随另一个化学反应,直接地(直接顺次的)或者在一个或多个插入反应发生之后。
本文所指的生物学途径包括导致产生选自下列的终产物的那些:(a)生物燃料前体;(b)抗生素或抗生素前体;(c)食物组分;(d)化学中间体(例如,1,4-丁二醇、2,3-丁二醇、苯、丁二烯、2-丁醇、3-羟基丙酸、丙烯酸、己二酸、氨基己酸、己内酰胺、乙炔、正丁醇、环己酮、富马酸、4-羟基丁酸、gbl/bdo、六亚甲基二胺、异丁醇、异丙醇、正丙醇、长链醇、甲基丙烯酸/甲基丙烯酸甲酯、甲基·乙基酮、丙烯、腐胺、粘康酸、对甲苯甲酸、对苯二酸、乙酸、葡糖二酸);(d)工业酶;和(e)天然产物。生物燃料前体包括选自下列的醇:(a)丁醇;(b)戊醇;(c)己醇;(d)庚醇;和(e)辛醇。食物组分包括牲畜饲料组分,其包括选自下列的氨基酸:(a)l-赖氨酸;(b)l-苏氨酸;(c)l-甲硫氨酸;(d)l-亮氨酸;(e)l-异亮氨酸;(f)l-缬氨酸;和(g)高丝氨酸。
可以将经装配的核酸分子引入到许多细胞(包括原核细胞和真核细胞)中。此类细胞的例子包括下列成员:棒杆菌属(corynebacterium)(例如,谷氨酸棒杆菌(corynebacteriumglutamicum))、假单胞菌属物种(pseudomonassp.)(铜绿假单胞菌(pseudomonasaeruginosa))、酿酒酵母(saccharomycescerevisiae)、芽孢杆菌属物种(bacillussp.)(迟缓芽孢杆菌(bacilluslentus)、凝结芽孢杆菌(bacilluscoagulans)、枯草芽孢杆菌(bacillussubtilis))、曲霉属物种(aspergillussp.)(土曲霉(aspergillusterreus)、黑曲霉(a.niger)、杂色曲霉(aspergillusversicolor))、链霉菌属物种(streptomycetesspp.)(灰色链霉菌(streptomycesgriseus)、紫色链霉菌(streptomycesviolaceans)、吸水链霉菌(streptomyceshygroscopicus)、八孢链霉菌(streptomycesoctosporus))、梭菌属(clostridium)(梭菌)、热纤维梭菌(clostridiumthermocellum)、丙酮丁醇梭菌(clostridiumacetobutylicum)、拜氏梭菌(clostridiumbeijerinckii)、丁酸梭菌(clostridiumbutyricum)、扬氏梭菌(clostridiumljungdahlii)、醋酸梭菌(clostridiumaceticum)、糖丁醇梭菌(clostridiumsaccharobutylicum)、糖多丁基丙酮梭菌(clostridiumsaccharoperbutylacetonicum)、里氏木霉(trichodermareesei)(红褐肉座菌(hypocreajecorina))、(乳酸)克鲁维酵母(kluyveromyces(lactis))、粗糙脉孢菌(neurosporacrassa)、解脂耶氏酵母(yarrowialipolitica)、腐质霉属(humicola)(灰腐质霉(humicolagrisea))、多形汉逊酵母(hansenulapolymorpha)(狭小毕赤酵母(pichiaangusta))、醋杆菌属(acetobacters)、发酵单胞菌属(zymomonas)、金孢属(chrysosporium)、热厌氧杆菌属(thermoanaerobacter)、树干毕赤酵母(pichiastipitis)、粘细菌属(myxobacteria)、深黄被孢霉(mortierellaisabellina)、产琥珀酸放线杆菌(actinobacillussuccinogenes)、产琥珀酸厌氧螺菌(anaerobiospirillumsucciniciproducens)、库德毕赤酵母(pichiakudriavzevii)/东方伊萨酵母(issatchenkiaorientalis)(酵母)(克鲁斯假丝酵母(candidakrusei))、双歧杆菌属(bifidobacterium)、凝结芽孢杆菌gbi-30、动物双歧杆菌乳酸亚种(bifidobacteriumanimalissubsp.lactis)bb-12、长双歧杆菌婴儿亚种(bifidobacteriumlongumsubsp.infantis)35624、嗜酸乳杆菌(lactobacillusacidophilus)ncfm、类干酪乳杆菌(lactobacillusparacasei)、约氏乳杆菌(lactobacillusjohnsonii)la1、植物乳杆菌(lactobacillusplantarum)、路氏乳杆菌(lactobacillusreuteri)、布拉氏糖酵母(saccharomycesboulardii)、鼠李糖乳杆菌(lactobacillusrhamnosus)、嗜酸乳杆菌ncfm、双歧双歧杆菌(bifidobacteriumbifidum)bb-12、干酪乳杆菌(lactobacilluscasei)、植物乳杆菌、黄单胞菌属(xanthomonas)(野油菜黄单胞菌(x.campestris))、古细菌(archea)(盐杆菌属物种(halobacteriumsp.)nrc-1、东大硫化叶菌(sulfolobustokodaii)、东大硫化叶菌(sulfolobustokodaii)、詹氏甲烷热球菌(methanocaldococcusjannaschii)、嗜酸热原体(thermoplasmaacidophilum)和火山热原体(thermoplasmavolcanium))、类球红细菌(rhodobactersphaeroides)、富养罗尔斯通氏菌(ralstoniaeutropha)、鼠孢菌属物种(sporomusaspecies)、扬氏梭菌、醋酸梭菌、热醋穆尔氏菌(moorellathermoacetica)、地杆菌属物种(geobacterspecies)、希瓦氏菌属物种(shewanellasp.)、光滑假丝酵母(candidaglabrata)、索诺拉假丝酵母(candidasonorensis)、热带假丝酵母(candidatropicalis)、多形汉逊酵母、东方伊萨酵母、乳酸克鲁维酵母(kluyveromyceslactis)、马克斯克鲁维酵母(kluyveromycesmarxianus)、耐热克鲁维酵母(kluyveromycesthermotolerans)、树干毕赤酵母、贝糖酵母(saccharomycesbayanus)、博伊丁糖酵母(saccharomycesbulderi)、葡萄汁糖酵母(saccharomycesuvarum)、酿酒酵母、粟酒裂殖酵母(schizosaccharomycespombe)、解脂耶氏酵母(yarrowialipolytica)、拜耳接合酵母(zygosaccharomycesbailii)、生物降解(aromatoleumaromaticum、芳香脱氯单胞菌(dechloromonasaromatica)、哈夫尼脱亚硫酸菌(desulfitobacteriumhafniense)、金属还原地杆菌(geobactermetallireducens)、博尔库姆岛食烷菌(alcanivoraxborkumensis)、结核分枝杆菌(mycobacteriumtuberculosis))、耐放射异常球菌(deinococcusradiodurans)、规则游动放线菌(actinoplanesregularis)、东方诺卡氏菌(nocardiaorientalis)、actinocorruliaregularis、膨大弯颈霉(tolypocladiuminflatum)、红色红曲(monascusruber)、淤泥两面神菌(janibacterlimonus)、马杜拉放线菌属物种(actinomadurasp.)、疣孢菌属物种(verucosisporasp.)、muscodaralbus和粗糙脉孢菌。
正如本领域技术人员将会理解的,本发明的许多方面很好地适合于自动化。自动化系统常常由可以实施重复任务的软件来进行驱动,尤其是当与为组分和试剂流的微量操作而设计的硬件相整合时。因此,根据本文所描述的各种不同的实施方案,装配和合成核酸的方法可以在计算机系统上施行。进一步地,根据本文所描述的各种不同的实施方案,用于装配和合成核酸的处理器可执行的指令。因此,在一些方面,本发明包括用通过处理器可执行的指令进行编码的、非暂时性的、计算机可读的存储介质,其用于产生经装配的核酸分子,所述指令包括用于下列步骤的指令:
(a)合成众多核酸分子,其中在平板的孔中以微量制备每个核酸分子;
(b)将在(a)中产生的核酸分子进行合并,从而产生汇集物;
(c)将一些或所有存在于在(b)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;
(d)从在(c)中形成的所述众多更大的核酸分子中去除包含序列错误的核酸分子,从而产生校正了错误的核酸分子汇集物;和
(e)将在所述校正了错误的核酸分子汇集物中的核酸分子进行装配,从而形成经装配的核酸分子。
本发明还包括用于产生经装配的核酸分子的系统,所述系统包括:
-处理器;和
-用由处理器可执行的指令进行编码的存储器,所述指令用于下列步骤:
(a)合成众多核酸分子,其中在平板的孔中以微量制备每个核酸分子;
(b)将在(a)中产生的核酸分子进行合并,从而产生汇集物;
(c)将一些或所有存在于在(b)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;
(d)从在(c)中形成的所述众多更大的核酸分子中去除包含序列错误的核酸分子,从而产生校正了错误的核酸分子汇集物;和
(e)将在所述校正了错误的核酸分子汇集物中的核酸分子进行装配,从而形成经装配的核酸分子。
附图简述
图1是本发明的工作流程的方面的总体描述。该工作流程被切分为四个部分,为了描述的容易而将这些部分称作“模块”。该工作流程在该图的右侧显示出在本发明的方法的一些方面中包括的一些特殊步骤。
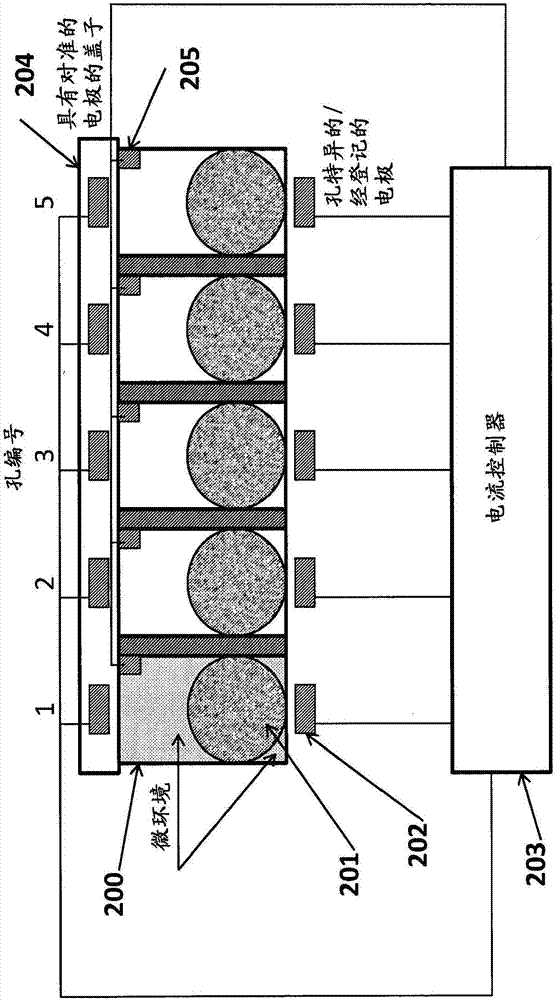
图2a-2b是根据本发明的一个实施方案的一行孔的示意性图示。孔1中的较暗区域指明了存在有在给定的时间处在其他孔中不存在的试剂(例如,ega)。
图3显示了核酸装配流程方案。在该图的底部显示的经装配的核酸分子上的粗末端表示通过外部引物(也称为末端引物)而添加的区域。
图4显示了第二种核酸装配流程方案。具有箭头的点线显示了基于pcr的合成方向和区域。
图5显示了通过使用缝合性核酸分子来将两个不共享有任何同源性的dna片段装配到载体中。在该图的下面部分中以粗体显示的69碱基对双链缝合性核酸分子与每个相邻片段(片段1和2)共享有30-bp同源性。这些缝合性核酸分子用于在所述相邻片段的接合点处插入9bp。插入碱基显示为具有下划线。
图6是用于合成最小化了错误的核酸分子的示例性过程的流程图。
图7是用于合成最小化了错误的核酸分子的示例性过程的工作流程图。双链核酸分子的不同链通过较粗和较细的线条来表示。“mme”是指错配核酸内切酶。小的圆形物表示序列错误。
图8总体性地图解说明了用于在酵母中装配和克隆核酸区段的方法。在本发明的一些实施方案中,将许多核酸区段(其中之一为载体)与片段共转化到酵母宿主细胞中,在那里它们通过同源重组而装配形成例如闭合的环状核酸分子。
图9是可以在本发明的实践中使用的电线圈的图画。
图10是适合用于本发明的流体试剂递送系统的一个实施方案的横截面视图。
图11显示了通过本发明的方法产生的线性核酸分子的文库(上部)和被设计用于接受文库成员的载体(下部)。该图的上面部分显示了代表所述文库的四个成员的一系列线条。下面的开放环线表示载体。在所述核酸分子的每个末端处的块状物表示促进连接的核酸区段(例如,
图12显示了可以通过本发明的方法制备的一系列变体核酸分子以及其所编码的氨基酸序列。图12a显示了编码不同的氨基酸序列的变体核酸分子。图12b显示了使用不同的密码子但编码相同的氨基酸序列的变体核酸分子。
图13显示了用于合成平台的微孔平板实施方案的两种不同的流体移除选项。
图14显示了被设计用于在每行(1401)中产生相同的核酸分子的核酸分子合成平台的两个不同的视图。图14a是顶视图,和图14b是侧视图。在该图中显示了流体通道(1401),与每个通道相关联的两个电极/行孔(1402),和一系列包含位于孔中的核酸合成基质(例如,独个珠粒)的孔(1400)。在一些实施方案中,所述孔将会相隔300μm,并且将会在形状上是圆柱形的(具有40μm的直径和35μm的深度)。
图15是图解说明计算机系统的方框图,本教导的实施方案可在所述计算机系统上实施。
图16是用于施行本发明的方法的自动化系统的示意图。
图17是通道“芯片”的顶视示意图。
发明详述
定义:
固体支持物:如本文中所使用的,术语“固体支持物”是指可以在其上可以合成和/或固定聚合物例如核酸分子的多孔或无孔材料。如本文中所使用的,“多孔(的)”意味着所述材料包含可以具有不均一或均一的直径(例如在nm范围内)的孔。多孔材料包括纸张、合成滤纸,等等。在这样的多孔材料中,反应可以在孔内发生。固体支持物可以具有许多形状中的任一种,例如针状、条状、片状、盘状、棒状、纤维状、弯曲状、圆柱体结构、平面表面、凹或凸表面或者毛细管或柱子。固体支持物可以是颗粒,包括珠粒、微颗粒、纳米颗粒等。固体支持物可以是具有类似大小的非珠粒类型的颗粒(例如,纤丝)。支持物可以具有可变的宽度和大小。例如,可以在本发明的实施中使用的珠粒(例如,磁性珠粒)的大小描述在本文别处。支持物可以是亲水的或可能被变成亲水的,并且包括无机粉末例如二氧化硅、硫酸镁和氧化铝;天然的聚合材料,特别是纤维素材料;和源自纤维素的材料,例如包含纤维的纸张,例如滤纸、色谱纸等。
在一些实施方案中,固体支持物可以是可碎片化的。固体材料可以是合成的或经修饰的天然出现的聚合物,例如硝化纤维素、碳、乙酸纤维素、聚氯乙烯、聚丙烯酰胺、交联葡聚糖、琼脂糖、聚丙烯酸酯、聚乙烯、聚丙烯、聚(4-甲基丁烯)、聚苯乙烯、聚甲基丙烯酸酯、聚(对苯二甲酸乙二酯)、尼龙、聚(丁酸乙烯酯)、聚偏二氟乙烯(pvdf)膜、玻璃、受控孔径玻璃、磁性受控孔径玻璃、磁性珠粒、陶瓷、金属等;其要么单独地进行使用,要么与其他材料一同进行使用
在一些实施方案中,支持物可以是芯片、阵列、微阵列或微孔平板形式。在许多情况下,通过本发明的方法产生的支持物将会是这样的支持物,在所述支持物中,独个核酸分子在分开的或不连续的区域上合成从而在所述支持物上产生特征部位(features)(即,包含独个核酸分子的位置)。
在一些实施方案中,选择所定义的特征部位的大小以允许在所述特征部位上形成微体积小滴或反应体积,其中每个小滴或反应体积互相保持分开。如本文所描述的,特征部位,通常地,但并不需要,被特征部位间(interfeature)空间分开,从而确保小滴或反应体积或者两个相邻特征部位之间不融合。通常地,特征部位间空间在其表面上将不携带任何核酸分子,并且将会相应于惰性空间。在一些实施方案中,特征部位和特征部位间空间可以因其亲水性或疏水性特性而不同。在一些实施方案中,特征部位和特征部位间空间可以包含改性剂。在本发明的一个实施方案中,所述特征部位是孔或微孔或凹槽。
可以将核酸分子共价或非共价地附着至表面或者沉积在表面上。
在本发明的一个实施方案中,模块1可以涉及使用多于一个的固体支持物。在一些实施方案中,可以在平板上布置两个或更多个固体支持物。可以采用固体支持物的任何布置,例如行或列或其组合。例如,行可以是对齐的和/或列可以是对齐的。在其他实施方案中,行和/或列是相等地间隔和交错的。在行之间和/或在列之间的间距可以是可变的。包含在例如平板中的固体支持物的数目可以是可变的。在一些实施方案中,平板可以包含多达1536个(或更多个)固体支持物。
核酸分子:如本文中所使用的,术语“核酸分子”是指核苷酸或碱基(例如,核糖核苷酸,对于rna;和脱氧核糖核苷酸,对于dna;但还包括dna/rna杂合体,其中dna在分开的链中或在相同的链中)的共价连接的序列,其中一个核苷酸的戊糖的3’位置通过磷酸二酯键而连接至下一个核苷酸的戊糖的5’位置。核酸分子可以是单链或双链的或者部分双链的。核酸分子可以以线性或环化形式(在用平头或粘性末端进行的超螺旋的或松弛的形成中)出现,并且可以包含“切口”。核酸分子可以由完全互补的单链或者形成至少一个碱基错配的部分互补的单链组成。核酸分子可以进一步包含两个自我互补的序列,其可以形成双链茎区,所述双链茎区任选地在一个末端处通过环序列而分开。包含双链茎区的核酸分子的两个区域基本上是相互互补的,这导致自我杂交。然而,茎可以包括一个或多个错配、插入或缺失。
核酸分子可以包含经以化学、酶促或代谢方式进行修饰的形式的核酸分子或其组合。化学合成的核酸分子可以是指长度通常少于或等于150个核苷酸(例如,长度为5至150,10至100,15至50个核苷酸)的核酸,而酶促合成的核酸分子可以包括更小的以及更大的核酸分子(如在本申请中别处所描述的)。核酸分子的酶促合成可以包括使用酶(例如,聚合酶、连接酶、核酸外切酶、核酸内切酶等,或其组合)的分步过程。因此,本发明部分地提供了涉及化学合成的核酸分子的酶促装配的组合物和联合方法。
核酸分子也指短的核酸分子,其常常被称为例如引物或探针。引物常常被称为用于酶促装配反应的单链起动核酸分子,而探针通常可以用于检测至少部分互补的核酸分子。核酸分子具有“5’-末端”和“3’-末端”,因为核酸分子磷酸二酯键出现在取代的单核苷酸的戊糖环的5’碳和3’碳之间。在其处新的键将会至5’碳的核酸分子的末端为其5’末端核苷酸。在其处新的键将会至3’碳的核酸分子的末端为其3’末端核苷酸。如本文中所使用的,末端核苷酸或碱基是在3’-或5’-末端的末端位置处的核苷酸。核酸分子序列,即使在更大的核酸分子的内部(例如,在核酸分子内的序列区域),也可以说是具有5’-和3’-末端。
概览:
本发明部分地涉及用于制备核酸分子的组合物和方法。尽管本发明具有许多方面和与之相关的变化形式,但这些方面和变化形式中的一些以概要形式呈现在图1中。
本发明的一个优点是,对于许多应用,小量的合成的核酸适合于达到所想要的目的(例如,制备微阵列,构建包含选择标记的质粒,等等)。在一些情况下,小量的核酸适合于用来进行工作,由于诸如酶促的(例如,pcr)和细胞内的扩增之类的因素。
图1的左侧显示了四个总的“模块”,其代表了本发明的一些实施方案的不同部分。这样,在一些方面,本发明涉及下列中的一个或多个:(1)核酸分子合成,(2)核酸分子的汇集,(3)众多核酸分子的装配,和/或(4)经装配的核酸的转移(例如,转移至细胞)。
关于本发明的更特别的实施方案,图1的右侧显示了与在该图的左侧中所显示的模块相关的额外细节。在许多文本块上方是以粗体表示的术语,例如“酶促的”和“细胞的”。这些术语指明了示例性的一般性手段,通过所述手段可以施行所提及的过程。正如本领域技术人员将会理解的,一些过程可以例如以化学方式、以酶促方式或在细胞中来施行。
如在图1中所显示的,模块1是指被称为“微量平行核酸分子合成”的单个过程。如在本文别处所陈述的,该过程通常将会涉及几个步骤,这些步骤将会随如何实施该过程而变化。在许多实施方案中,模块1的总体功能将会是产生众多核酸分子。可以将这些核酸分子作为组进行设计,该组待进行连接从而形成一个或多个更大的核酸分子或当与另外的核酸分子(例如,“缝合性核酸分子”)相接触时形成一个或多个更大的核酸分子。
如在图1中所显示的,模块2是指被称为“固体支持物的汇集”、“核酸分子切割”和“去保护”的过程。模块2的总体功能将会是制备用于参与一个或多个在模块3中所指出的过程的核酸分子。这常常将会意味将在序列上不同的核酸分子进行合并,并且去除对于实施一个或多个在模块3中所指出的过程来说非必需的或不希望的任何化学基团。
使用模块2作为例子,正如本领域技术人员将会认识到的,图1显示了本发明的一般性实施方案。更特别地,模块2是指固体支持物的汇集。这些支持物通常将会包含核酸分子。在一些实施方案中,可以以没有固体支持物的形式获得核酸分子,然后进行汇集。
如在图1中所显示的,模块3是指被称为“片段扩增和装配”、“错误校正”和“最终的装配”的过程。模块3的过程的总体功能是产生与所寻求产生的核酸分子的序列相比较而言具有高的序列保真度的经装配的核酸分子。
如在图1中所显示的,模块4是指被称为“受者细胞插入”的过程。正如本领域技术人员将会理解的,将通过本发明的方法产生的核酸分子引入到细胞中仅是一种应用。在大多数情况下,根据本发明的方法进行装配的核酸分子将会被设计用于特殊的应用。应用广泛地变化,并且包括生物燃料生产、生物除污和化学前体生产。
在一些实施方案中,可以使用具有聚乙烯基骨架的包含氨基基团的支持基体作为固体支持物。例如,可以在本发明的实践中使用通过在u.s.专利号6,335,438(其公开内容通过提及而并入本文)中所描述的方法而获得的单分散颗粒。
模块1
在本发明中,可以将核酸分子附着至固体支持物,例如颗粒或珠粒(例如,受控孔径玻璃珠)。在一个实施方案中,使用磁性微珠粒作为固体支持物。在许多情况下,可以在本发明中使用具有大的“表面/体积”比的单活化的多孔的1μm大小微珠粒。这样的单分散颗粒的均一性质通常提供了均一的反应速率,这特别适合于在自动化学合成仪(例如,核酸分子合成仪)中的合成。最初,可以给珠粒提供反应性基团。例如,在本发明的一些实施方案中,可以使用
磁性珠粒技术描述在u.s.专利号5,512,439(其在此通过提及而并入本文)中。
除了由cpg或磁性材料组成的那些之外的其他合成基质也可以用于本发明,并且包括由聚苯乙烯(例如,聚苯乙烯-1%二乙烯基苯、大孔聚苯乙烯和聚(乙二醇)-聚苯乙烯(peg-ps))、聚酰胺(例如,聚酰胺粘合的硅胶)、硅胶和纤维素组成的那些。这些基质中的一些可以树脂形式得到。在许多情况下,可以将为树脂的基质置于孔中(代替珠粒或与珠粒一同),并且可以用于核酸合成。
本领域已知其他的核酸连接方法,以及采用它们的阵列。例如,已知使用经氨或过氧化物(其朝向醚桥)活化的表面的方法。如本文别处所指明的,对于本领域中的ega方法,已描述了羟基基团并将其用于将核酸连接至二氧化硅磁性珠粒表面。本发明包括这样的连接方法和包含它们的组合物。
在一些情况下,也可能希望使用具有凝胶样或粘性稠度或基体的半固体支持物以代替固体支持物。本发明考虑了这点,并且在合适的情况下,在此当提及固体支持物时,可以使用非固体支持物。
决定可以合成的核酸的量的因素包括,在其上发生合成的颗粒的表面面积和大小。因此,在某种程度上,可以调整支持物(例如,珠粒)参数以改变所合成的核酸的量。可在本发明的实践中使用的珠粒可以在大小方面广泛地变化,包括下列大小范围:平均直径为大约0.01μm至大约1,000μm、大约0.1μm至大约1,000μm、大约1.0μm至大约1,000μm、大约0.01μm至大约400μm、大约0.01μm至大约200μm、大约0.01μm至大约100μm、大约0.1μm至大约100μm、大约0.1μm至大约50μm、大约1.0μm至大约600μm、大约1.0μm至大约400μm、大约1.0μm至大约200μm、大约1.0μm至大约100μm、大约2.0μm至大约400μm、大约2.0μm至大约200μm、大约5.0μm至大约500μm,等等。
进一步地,可以使用这样的珠粒,其允许以下列量的待产生的核酸的平均量:大约0.001纳摩尔至大约1,000纳摩尔、大约0.1纳摩尔至大约1,000纳摩尔、大约1.0纳摩尔至大约1,000纳摩尔、大约5.0纳摩尔至大约1,000纳摩尔、大约10纳摩尔至大约1,000纳摩尔、大约30纳摩尔至大约1,000纳摩尔、大约50纳摩尔至大约1,000纳摩尔、大约200纳摩尔至大约1,000纳摩尔、大约1.0纳摩尔至大约500纳摩尔、大约1.0纳摩尔至大约250纳摩尔、大约10纳摩尔至大约500纳摩尔,等等。
在许多情况下,一旦已达到某个大小,化学合成的核酸分子的产量就下降。在本发明的许多实施方案中,化学合成的核酸分子将会处于下列范围内:大约8至大约100个核苷酸、大约8至大约35个核苷酸、大约8至大约40个核苷酸、大约8至大约50个核苷酸、大约8至大约100个核苷酸、大约15至大约100个核苷酸、大约15至大约75个核苷酸、大约15至大约50个核苷酸、大约20至大约60个核苷酸、大约40至大约400个核苷酸、大约40至大约300个核苷酸、大约40至大约200个核苷酸、大约40至大约100个核苷酸、大约40至大约90个核苷酸、大约50至大约400个核苷酸、大约50至大约300个核苷酸、大约50至大约200个核苷酸、大约50至大约100个核苷酸、大约50至大约90个核苷酸、大约50至大约80个核苷酸、大约75至大约400个核苷酸、大约75至大约300个核苷酸或大约75至大约200个核苷酸。
正如本领域技术人员将会认识到的,需要产生的核酸的量将会随例如应用和所使用的装配方法的效率而变化。当产生可复制的分子(例如,通过pcr,插入到细胞中,等等)时,需要产生理论上仅一个经装配的核酸分子。如果所产生的核酸分子的数目降低到其中产生理论上仅一个完全经装配的核酸分子这样的点,那么一半时间将会没有完全经装配的核酸分子产生。因此,对于待使用本发明的方法来产生的核酸的量来说的一个下限基于可以产生的完全经装配的核酸分子的数目。该数目常常将会随必须进行合并以形成最终构建体的合成的核酸分子的数目而变化。典型地,本发明的方法将会被设计成产生下列数目的经装配的核酸分子:大约1至大约500,000、大约10至大约500,000、大约100至大约500,000、大约500至大约500,000、大约1至大约1,000、大约1至大约500、大约10至大约1,000、大约10至大约500、大约100至大约1,000、大约100至大约500、大约100至大约5,000、大约100至大约50,000、大约100至大约250,000、大约1,000至大约50,000,等等。
正如本领域技术人员将会理解的,核酸合成基质面积直接反映了可以在那基质上合成的核酸分子的数目。下面的表2显示了珠粒大小、表面面积计算值和估计的可以在指定的珠粒上产生的核酸分子的数目。
在一些实施方案中,将会在平板中使用2.8μm珠粒来进行寡核苷酸合成,其中每个孔一个珠粒。进一步地,可以将孔设计为4μm和3μm深的圆柱形的洞或小室。当使用100μm的孔间距时,10mm2芯片可以容纳10,000个孔。在许多情况下,当通过蚀刻来制备平板时,孔将会具有非圆柱状的形状,并且可能是棱锥状、圆锥状或四方形状的。在一些情况下,孔可以是以颠倒的、截短的圆锥状的形状。
所产生的独个核酸分子的数目还将会随应用而变化。尽管可以通过试剂使用减少来达到节约成本,但是通常将会希望产生对于例如有效装配来说所需的足够的核酸分子。进一步地,所产生的具有特定核苷酸序列的核酸分子的数目通常将会反映出合成基质的“携带能力”。例如,典型地,30微米的珠粒可以用于产生大约1,000,000个核酸分子。例如,在许多情况下,当珠粒大小降低时,那么在每个珠粒上可以产生的核酸分子的数目将会降低。
本发明的方法可以用于产生下列数目的被设计成具有相同核苷酸序列的核酸分子:大约100至大约20,000,000、大约1,000至大约20,000,000、大约10,000至大约20,000,000、大约100至大约5,000,000、大约1,000至大约5,000,000、大约10,000至大约5,000,000、大约100至大约1,000,000、大约1,000至大约1,000,000、大约10,000至大约10,000,000、大约100至大约500,000、大约1,000至大约500,000、大约10,000至大约500,000,等等。
核酸分子合成位点(例如,孔)的数目可以很大地变化,并且将会由许多因素决定,所述因素包括:(1)工程和核酸分子合成硬件的限制;和(2)所希望的核酸的量(参见本文别处对于该因素的讨论)。例如,在本发明的实施中所使用的合成平台中核酸分子合成位点(例如,孔)的数目可以在下列总数范围内变化:9至200,000、9至100,000、9至20,000、9至1,000、9至500、1,000至200,000、1,000至400,000、1,000至500,000、1,000至1,00,000、1,000至10,000,000、20,000至1,000,000、50,000至10,000,000、10,000至5,000,000、1,000至100,000、2,000至100,000、5,000至100,000、10,000至100,000、20,000至100,000、30,000至100,000、1,000至80,000、1,000至70,000、1,000至50,000、1,000至40,000、1,000至30,000、1,000至20,000、1,000至10,000、1,000至8,000、1,000至5,000、5,000至50,000、10,000至50,000、5,000至35,000,等等。另外,每mm2的核酸分子合成位点(例如,孔)的数目可以在下列范围内变化:1,000至5,000、1,000至10,000、1,000至20,000、1,000至30,000、2,000至5,000、2,000至10,000、4,000至15,000、100至1,000、100至3,000、100至5,000、250至5,000,等等。
每个核酸分子合成位点(例如,孔)的试剂空间的量将会随孔的大小和形状,特别是能够接受试剂的空间的面积而变化。这将会随诸如下列的因素而变化:核酸分子合成位点是否是平坦的表面(例如,依赖于保持试剂位于合成位点或空穴(例如,孔)之上的表面张力)。此外,所应用的试剂的量可以由对于覆盖合成位点,递送必需量的反应物,和/或稀释、移除或洗去在合成位点处存在的试剂来说所需的试剂的量来决定。所应用的试剂的量(当所述试剂为液体时)和在合成位点处的试剂空间的量可以很大地变化,包括0.001×10-15l(飞升)至100μl、0.01×10-15l(飞升)至100μl、0.1×10-15l(飞升)至100μl、1.0×10-15l(飞升)至100μl、0.1×10-15l(飞升)至1μl、0.1×10-15l(飞升)至500nl、0.1×10-15l(飞升)至100nl、0.1×10-15l(飞升)至1nl、0.1×10-15l(飞升)至500pl(皮升)、0.1×10-15l(飞升)至100pl、0.1×10-15l(飞升)至10pl、0.1×10-15l(飞升)至1pl、0.001×10-15l(飞升)至1pl、0.001×10-15l(飞升)至1.0×10-15l(飞升)、0.001×10-15l(飞升)至100×10-15l(飞升)、1.0×10-15l(飞升)至500×10-15l(飞升),等等。
为了制备适合于核酸分子合成的固体支持物材料,可以将非核苷连接体或核苷琥珀酸酯共价附着至反应性氨基基团。然而,如果需要,可以使用其他表面官能团(例如,羧基)来附着携带羟基基团或备选地3’-附着的核苷酸的连接体。
连接体,当存在时,可以是将核酸分子的3’-o附着至固体支持物的化学实体(例如,固体支持物上的官能团)。在大多数情况下,连接体对于在核酸分子合成过程中所使用的所有试剂将会是稳定的,但在合成过程结束时在特定的条件下是可切割的。在核酸分子合成中通常使用的一个连接体是琥珀酰基连接体。具有不同特性的不同的连接体是本领域技术人员已知的,并且可以由技术人员依据下游过程要求来进行选择。
在核酸分子合成中广泛地使用核苷固体支持物(例如,用碱基预衍生化的支持物)。这样的支持物的一个例子是其中3’-末端核苷残基的3’-羟基基团通过3’-o-琥珀酰基臂而附着至固体支持物的支持物。核苷固体支持物的使用需要使用不同类型的珠粒(对于每个碱基一个)。然而,核苷固体支持物必须以序列特异性方式进行选择(按照对于每个核酸分子所需的第一个碱基)的事实降低了整个合成过程的通量,这归因于附着至特定起动碱基的珠粒的费力的预选择和至独个微孔的分配。
更方便的用于合成的方法用其中将非核苷连接体附着至固体支持物材料的通用支持物来开始。该方法的优点是,可以使用相同的固体支持物,而不论待合成的核酸分子的序列为何。可以在本发明中使用的通用支持物的一个例子描述在u.s.专利号7,202,264(其公开内容通过提及而并入本文)中。然而,本领域技术人员已知的其他通用连接体可以同样适合于实施本发明。为了从经装配的核酸分子上完全去除连接体和3’-末端磷酸,本领域中已知的通用固体支持物中的一些需要气态氨、含水氢氧化铵、含水甲胺或其混合物。
已知许多用于合成核酸的方法。这些方法中的许多遵循一系列基本步骤,例如下列的那些,具有使用例如乙腈、乙酸乙酯或其他适合于实践本发明的洗涤试剂来进行的合适的洗涤步骤:
a)将第一个核苷酸(其已在5’位置处进行了保护)衍生化至固体支持物(通常是受控孔径玻璃(cpg))上,或者以预衍生化的形式获得;
b)使用例如在二氯甲烷中的三氯乙酸来使第一个核苷酸的糖基团去保护(例如,通过脱三苯甲基作用)(常常被称为“去保护”的过程),其导致可以就反应进程而进行监测的有色产物;
c)将第二个核苷酸(其具有经保护的磷、糖和碱基基团)添加至正在生长的链,通常在催化剂例如四唑或4,5-二氰基咪唑存在下(常常被称为“偶联”的过程);
d)使用例如乙酸酐和n-甲基咪唑来给未反应的第一个核苷酸加帽以避免缺失积累(常常被称为“加帽”的过程);
e)通常使用例如碘试剂来将亚磷酸三酯氧化以形成更稳定的磷酸三酯(常常被称为“氧化”的过程);
f)取决于所希望的核酸分子长度,在需要时,重复该过程;和
g)通常在升高的温度下使用氨水或气态氨来进行从固体支持物上的切割。本领域技术人员将会认识到,在本发明的某些实施方案中,步骤的顺序可以变化,或者一些步骤(包括洗涤步骤)可以根据所使用的实验方案在适当时进行重复。
在本发明中,亚磷酰胺合成化学这一技术的状态通过修饰上面实验方案的特定步骤而进一步得到改进。在一个实施方案中,可以使用有机催化剂来改善例如偶联步骤的效率。有机催化剂和此类催化剂的一些用途陈述在avenier和hollfelder,combiningmediumeffectsandcofactorcatalysis:metal-coordinatedsynzymesacceleratephosphatetransferby108chem.eur.j.15:12371-12380(2009),和jordan等人,asymmetricphosphorylationthroughcatalyticp(iii)phosphoramiditetransfer:enantioselectivesynthesisofd-myo-inositol-6-phosphate,proc.nat.acad.sci.usa,107:20620-20624(2010)中。
在一些实施方案中,本发明利用了通过产生以电化学方式产生的酸(ega)的局部化学反应。作为例子,可寻址的电信号可用于以允许二甲氧基三苯甲基(dmt)保护基团从表面上去保护的足够浓度产生酸(maurer等人,“electrochemicallygeneratedacidanditscontainmentto100micronreactionareasfortheproductionofdnamicroarrays”plos,第1期,e34(2006年12月))。
关于作为在表面(例如,微表面)上的核酸分子合成实验方案的一部分的ega产生的一个问题是“溅出”至相邻区域。“溅出”(其包括扩散)可以导致在非计划中的位置处出现的反应(例如,由于ega扩散而引起的)。尽管当一个反应发生时此类效应可能是相当地小的,但是当多个反应相继地发生时,多个反应循环的“溅出”效应可以导致许多错掺入的碱基。该问题可以以几种方式来解决。一种方式是用足够中和所述酸的缓冲液(例如,包含有机碱的缓冲液)覆盖反应区域,如果它移动自局部环境。另一种方式是通过物理封闭或区室化。例如,如果ega在孔中产生并在那个孔中催化反应,那么所述孔可以具有足够的大小以防止酸出来。因此,封闭在孔内是孔的大小和所产生的酸的量的一个因素。在一些反应形式中,一些酸将会总是跑出到孔外。这应当不是问题,除非足够催化反应的数量到达了其中未设想发生反应的另一个孔中。如上面所指明的,可以采用使用覆盖缓冲液来使此类反应最小化。
在本发明的实践中可以使用的平板包括在u.s.专利公开号2010/0137143a1(其公开内容通过提及而并入本文,并且显示了这样的代表性平板形式)中所描述的平板的改进形式。
图2a-2b是根据本发明的一个实施方案的一行孔(200)的示意性图示。图2a-2b的实施方案图解说明了五个孔,每个孔在底部包含磁性珠粒(201)。在每个孔之下是电极(202),其可以递送电流至与其相关联的孔。每个电极与调节至该电极的电流的电流控制器(203)相连通。磁性珠粒可以包含与初始构件块相关联的连接体。作为例子,珠粒可以包含第一个核苷酸(具有a、t、c、g或u碱基,或者经修饰的碱基,取决于在待合成的核酸分子中所希望的第一个碱基)。第一个碱基可以作为合成过程的一部分进行添加(例如,用具有经保护的羟基基团的珠粒)或者可以在插入孔中之前进行预衍生化。在任一个事件中,在大多数情况下,保护基团将会存在(例如,在5’位置处),其必须在可以作为核酸分子链的一部分共价地连接另一个碱基之前去除。
可以包括微观流体通道(未在图2a中显示)用于从孔中有效地添加和移除试剂。因此,部分地,本发明包括微观流体平板,其被设计成与用于从平板的孔中添加和移除流体的微观流体系统相交接。在相似的平板中使用的微观流体通道描述在u.s.专利公开号2010/0137143a1(其公开内容通过提及而并入本文作为背景信息)中。
在图2a中所显示的平板的盖子(204)包含对准的电极,其连接至电流控制器。在该盖子中可以包括更大的的电极(例如,延伸出所有孔的顶部的电极)以“闭合该电路”。因此,所述盖子可以包含一个与每个对于其寻求进行电化学反应的孔对准的电极,一个与平板的所有孔可操作地连接的电极,或多个其中的一些或所有与两个或更多个孔可操作地连接的电极。在一个备选的实施方案中,将关于每个孔的盖子电极用一个或多个沿着每个孔的一个或多个侧壁嵌入或放置的电极替代。因此,将电极放置在盖子中不是关键的。事实上,在许多情况下,将会希望的是(例如,易于制造),将电极置于除了盖子之外的其他地方。
还可以包括参考电极(re)(205)以提供稳定的且预先确定的电位。为了在工作电极(we)上施加特定的电位,可以测量针对re的电位而言的we的电位。下一步,可以调节在反电极(ce)和we之间的电位直至在re和ce之间的电位具有正确的值。
一种用于去保护的方法可以采用在we上将氢醌氧化成苯醌(氧化还原系统)以便产生质子。为了在孔中设置特定的ph,可以在指定的时间段内施加恒定的电流。在不太活泼的we的情况下,将会出现we电位的强烈增加。这可以导致非计划中的反应(例如,在高电位下,溶剂的氧化或we材料的损坏)。为了避免该效应,可以控制we的电位。
电流控制器(可互换地,控制器)可以是微处理器或处理器,例如在图15中所显示的。控制器(未显示)可以包含常规的电流控制系统,包括例如与存储电路相连通的微处理器电路。存储电路可以包括用于指导微处理器电路给一个或多个所述电极供能(例如,给与孔1或众多孔相关联的电极供能)的指令。任选地,存储电路可以包括用于激活一对电极之一(例如,激活与孔1相关联的底部电极)的指令。在另外一个实施方案中,存储电路可以包括用于逐步地增加/降低对于电极的偏压以便减少在孔中的突然电涌的可能性的指令。
在另一个实施方案中,电流控制器与外部处理器电路例如恒电位器电路、输入/输出(“i/o”)设备和显示器相连通。所述电路或电路板使装置的控制成为可能,并且还可以用于与其他设备(例如,pc、ipad等)相连通。
在图2a的实施方案的变化形式中,可以将两个电极(正极和负极)放置在孔的底部。这允许电流在孔的底部附近产生,由此在紧邻珠粒的区域中产生局部化的ega。取决于通过其将试剂添加至孔和/或从孔中移除的方法和其他因素,可以使用这样的构造来限制孔之间的串扰、干扰或非计划中的ega污染。
在图2b中显示了一个相关的实施方案。在此,盖子包含对准的电极(205),其延伸入孔的试剂部分中。将排液管(206)置于每个孔的底部。这些排液管提供数种功能。一种功能是在化学反应步骤(例如,碱基添加、洗涤、去保护等)完成时移除试剂。另一种功能是降低用于去保护步骤的流体水平。换言之,可以将流体添加至所有孔,然后可以在给孔加偏压之前通过排液管降低流体水平。降低孔的流体水平减少了孔之间的交叉溢出并增加了合成保真度。降低的流体水平还降低了电位串扰和相邻孔之间的污染。这也适用于通过孔的瓶形体的一般性流体移除。这是如此的,因为ega的孔间交叉污染可以导致不正确的碱基掺入。甚至由ega所产生的碱基错掺入以在相邻的孔中正被合成的核酸分子的0.5%出现,净结果粗略地可以是碱基错掺入的加倍。因此,拉低孔中的流体水平和孔底部排液导致增加的合成保真度。
用于从孔中移除流体的一种手段是从孔的顶部。这可以通过许多手段来进行,包括使用移液管尖端或引入吸收材料。在任一种情况下,目标将会是从每个孔中移除足够的流体以使“溅出”最小化。在一些情况下,唯一的其中流体水平将会被降低的孔将会是经历反应(例如,ega的产生,导致去保护)的那些。换言之,流体水平降低可以仅在其中产生一种或多种反应物的孔中施行。
孔的建造可以通过常规的制造方法来完成,包括例如cmos和vlsi技术。可以在半导体或聚合物基质中形成孔。在一个示例性的实施方案中,通过使用常规的蚀刻和钻孔技术在半导体基质中使孔成形。孔的内表面可以用绝缘材料进行包被以减少相邻孔之间的串扰。在随之而推论出的实施方案中,可以包被孔表面以增加传导性,由此更均一地产生ega。孔表面可以用不同的层进行包被以减少串扰,而同时增加孔内的导电性和导热性。因此,壁可以包含不同材料的复合物,其在减少孔之间的串扰同时,将会增加每个孔内的传导性以用于快速的ega产生。
还可以包被孔的顶部表面(相邻孔之间的跨距)以提供试剂排斥表面。作为例子,可以用疏水性组合物包被顶部表面以抵制交叉污染。用于减少孔至孔的交叉污染的方法陈述在u.s.专利号6,444,111(其公开内容通过提及而并入本文)中。
最后,可以将孔的形状塑造成用于减少交叉污染,而同时增加反应速度。例如,可以可以将孔塑造成具有圆柱状、桶状或圆锥状的形状。
在使用例如图2a-2b的平板构造的许多方法中,第一个核苷酸的糖基团通过激活(激发)由电信号(或脉冲)起动的化学反应来去保护。如在本文别处所指明的,用于做此事的一种方法是通过产生以电化学方式产生的酸(ega)。在许多情况下,将会希望的是控制所制备的化学反应物(例如,ega)的量,以便有效地催化去保护反应,而同时限制反应物交叉污染的可能性。
图17显示了具有三个电极的通道芯片设计的顶视图。反电极元件(1700)和(1702)位于两个侧通道的顶部并且越过流动通道(1701)的底部。还存在有围绕具有工作电极(1704)的两个孔的参考电极(1703)。
为了限制质子流,可以采取一系列步骤,包括:(1)使用在少量质子存在下防止显著的ph移动的缓冲液,(2)使用醌氧化还原系统,和(3)设计孔和通道的尺寸以保持它们之间的实质的距离(例如,使用为通道体积的1/150的孔体积)。
例如,为了举例说明的目的使用图17中所显示的示意图,工作电极(1704)与反电极元件(1700)和(1702)之间的距离可以是大约200μm。进一步地,可以使用通过碱基分子拦截质子来降低到达其他孔的质子的数目。此外,还可以使用在具有与反电极元件(1700)和(1702)相同的电位的孔之间的参考电极条(1703)来产生碱基分子,和进一步可以防止质子“串扰”。除了本文所陈述的其他方法之外,诸如这些的方法和组分提供了高保真度核酸分子合成。
为了举例说明的目的,可以将经预衍生化的珠粒(例如,磁性珠粒)置于图2a-2b的孔1至5中,其中在孔1和5中为“a”珠粒,在孔2中为“c’珠粒,在孔3中为“u”珠粒,和在孔4中为“g”珠粒。然后,可以给所有五个孔填充以ega试剂(例如,包含甲醇、乙腈、氢醌、蒽醌、对甲苯磺酸四乙铵和2,6-卢剔啶的试剂)。待添加至链上的的下一个碱基是g,并且在位置2处包含g的待产生的分子的唯一的核酸分子在孔1中。因此,仅对孔1施加电流。该电流产生了酸性微环境,其导致仅在孔1中核苷酸的5’位置的去保护。在固定的(或可变的)反应时间后,洗涤所有五个孔。在催化剂(例如,四唑催化剂)存在下,向所有的所述孔添加具有磷、糖和碱基(在该情况下,t)的核苷酸。在预先确定的反应时间后,洗涤所有五个孔,并且可以通过使用例如乙酸酐和n-甲基咪唑来给未反应的第一个核苷酸加帽以避免缺失的积累。再次,在预定的反应时间后,洗涤所有五个孔,并且可以通过使用例如含碘的试剂来氧化经化学反应而形成的亚磷酸三酯以形成更稳定的磷酸三酯。然后,重复该过程直至已添加上了该核酸分子的最终的碱基。之后,可以从固体支持物上切割下合成的核酸分子。这可以例如通过使用氨水或气态氨在加热下来进行。但是,切割方法可以随着诸如所使用的连接体之类的因素而变化。
给每个孔施加的电流的量和其持续时间将会随诸如待产生的试剂的量和孔的大小之类的参数而变化。所施加的电流可以是具有变化的形状和/或幅度的脉冲。所述脉冲可以限定一系列具有变化的振幅或逐渐增加/减小的振幅的脉冲(频率)。可以调整所述脉冲的振幅和持续时间以为了试剂的最佳产生。作为例子,可以调整施加至孔的电流一个特定的时间段,以产生特定的ega量。意欲产生的ega的量将会通常地至少足以完全催化所存在的核酸分子的去保护。
在本发明的一些方面,可以采用“电润湿(electrowetting)”。其中电润湿可以是特别有用的本发明的两个方面是为了混合用于(1)核酸合成和汇集(模块1和2)以及(2)装配(模块3)的试剂。
简而言之,电润湿涉及使用电压来改变在固体表面上的液体的表面张力。可以改变电场(例如,交流的或直流的)的施加,流体和表面之间的接触角。例如,通过施加电压,疏水表面的润湿特性可以变成渐增地亲水的并因此是可润湿的。电润湿原理基于在包含电极阵列的表面上操纵小滴和使用电压来改变界面张力。在一些实施方案中,电极阵列不与流体直接接触。在另外的实施方案中,可以如此布置电极阵列,从而所述支持物具有亲水侧和疏水侧。受电压影响的小滴将会移向亲水侧。在一些实施方案中,电极的阵列或图式可以是高密度图式。当与亚磷酰胺化学(以及其他试剂)一同使用时,电极阵列应当能够移动1pl(和更小)至10pl的小滴体积。因此,本发明的方面涉及高电压互补半导体微观流体控制器。在一些实施方案中,高电压互补半导体设备(hv-cmos)具有有着高密度电极图式和高电压电子器件的集成电路。在一些实施方案中,所施加的电压为15v至30v。电润湿方法陈述在u.s.专利公开号2012/0220497a1(其公开内容通过提及而并入本文)中。
通过使用电压,电润湿进行工作从而改变液滴的形状。在一些情况下,电润湿涉及被置于包被有电介质的电极上的固着的液滴。当施加电流时,所述液滴变平并流出至旁侧,因此使另外的表面润湿。当移除电流时,所述液滴复原至其原始形状并且从在电流施加时所覆盖的区域缩回。电润湿陈述在处于下面的url处的论文中:http://www.ll.mit.edu/publications/journal/pdf/vol17_no2/17_2_4berry.pdf。
在本发明的一些实施方案中,核酸合成位点可以具有邻近其的一系列试剂,所述一系列试剂在当向正确的试剂位置施加电流时流入和退出合成位点。因此,本发明包括用于合成核酸分子的方法,该方法通过经从邻近的试剂加上和移除电流而诱导的从合成位点处的试剂的添加和移除。在一些情况下,邻近核酸合成位点的试剂的数目可以为大约2至大约10、大约3至大约10、大约4至大约10、大约5至大约10、大约6至大约10,等等。
电润湿方法也可以用于片段装配和错误校正(模块3)。因此,本发明包括用于通过使用电润湿来混合试剂以为了核酸分子的装配和错误校正的方法。在本发明的这些方面可以与核酸分子相接触的试剂包括核酸外切酶、错配修复核酸内切酶(mme)、连接酶、缓冲液、edta溶液等。
关于电润湿方法的一个问题是“溅出”,其可以在混合区域之间发生,并且还因为,在许多情况下,使用了平面的或半平面的表面。因此,除非采用微观流体排液通道等,否则在试剂变换过程中存在混合区域的“溅出”污染的可能性。
用于使该混合最小化的两种手段是通过使用微观流体通道和屏障。可以放置屏障(例如,物理屏障,例如高起的区域)以防止试剂从一个混合区域移动至另一个混合区域。在所希望的反应结束后,移除屏障。不同的反应可以在混合区域的不同的和/或重叠的亚组处顺次地进行。
如上面所提及的,核酸合成的方法可以在根据本文所描述的各种不同实施方案的系统中通过处理器或计算机系统(例如,图15中所描绘的示例性计算机系统)来实施和进行控制。例如,根据本教导的各种不同的实施方案,向所选择的孔施加电流(脉冲或连续波)从而产生特定数量的ega以完全催化去保护可以通过执行处理器可执行的指令的计算机系统来控制。
通过使用氧化还原系统还可以发生解封闭(deblocking)。此类系统的例子包括氢醌/蒽醌;ph缓冲液例如2,6-卢剔啶,用于减少在活动的孔和不活动的邻近孔之间的质子串扰。
核酸分子的有效产生可能要求,使核酸合成步骤适应于正在构建的分子。考虑了被设计用于构建具有60/40的cg/at比的病毒基因组的核酸分子的构建的例子。这样的基因组的核酸分子构件块将会不变地具有比a和t更多的c和g。在这样的情况下,可以希望具有比a和t更多的添加c和g的反应。作为例子,碱基添加的顺序可以是atcgcatgcg的重复。因此,本发明进一步地包括适应于指定的核酸分子的有效产生的化学合成方法。在一个方面,这需要在化学合成过程中以反映或紧密地接近在那些核酸分子中的碱基流行率的方式将碱基添加至核酸分子。
本发明包括例如,导致核酸分子的高保真度的微量产生的方法。因此,本发明包括这样的方法,通过所述方法以下列参数产生核酸分子:以1个碱基/100至1个碱基/500的平均的碱基错掺入数目,产生1×105至1.5×109个拷贝的核酸分子。本发明包括具有在表3中所展示的参数的类似方法。
根据本发明制备和使用的核酸分子可以包含经修饰的核酸分子,包括锁定核酸(lna)、肽核酸(pna)等。pna是聚酰胺类型的dna类似物,并且关于a、g、t、u和c的单体单元是商购可得的。此外,本发明的核酸分子可以包含一个或多个经修饰的碱基,所述经修饰的碱基选自但不限于下列:5-氟尿嘧啶、5-溴尿嘧啶、5-氯尿嘧啶、5-碘尿嘧啶、次黄嘌呤、黄嘌呤、4-乙酰胞嘧啶、5-(羧羟甲基)尿嘧啶、5-羧甲基氨甲基-2-硫尿苷、5-羧甲基氨甲基尿嘧啶、二氢尿嘧啶、β-d-半乳糖基辫苷、肌苷、n6-异戊烯基腺嘌呤、1-甲基鸟嘌呤、1-甲基肌苷、2,2-二甲基鸟嘌呤、2-甲基腺嘌呤、2-甲基鸟嘌呤、3-甲基胞嘧啶、5-甲基胞嘧啶、n6-腺嘌呤、7-甲基鸟嘌呤、8-氮鸟嘌呤、5-甲基氨甲基尿嘧啶、5-甲氧基氨甲基-2-硫尿嘧啶、β-d-甘露糖基辫苷、5’-甲氧基羧甲基尿嘧啶、5-甲氧基尿嘧啶、2-甲硫基-n6-异戊烯基腺嘌呤、尿嘧啶-5-氧基乙酸、wybutoxosine、假尿嘧啶、辫苷、肌苷、2-硫胞嘧啶、5-甲基-2-硫尿嘧啶、2-硫尿嘧啶、4-硫尿嘧啶、5-甲基尿嘧啶、尿嘧啶-5-氧基乙酸甲基酯、5-甲基-2-硫尿嘧啶、3-(3-氨基-3-n-2-羧丙基)尿嘧啶和2,6-二氨基嘌呤。后面的那种经修饰的碱基在当与dt进行碱基配对时可以形成三个氢键,并且可以增加短核酸分子的tm差不多1-2℃/插入。但是,该效应是复杂的并且取决于序列背景。
在核酸分子中,2-氨基嘌呤可以替代da。它是天然地发荧光的碱基,其对于局部环境敏感,这使得它对于监测dna发夹的结构和动力学和对于检测双链体的碱基堆叠状态是有用的。2-氨基嘌呤可以是致去稳定化的并且稍微降低tm。5-溴-脱氧尿苷是光反应性卤代碱基,其可以掺入到核酸分子中以在暴露于uv光的情况下将所述核酸分子交联至dna、rna或蛋白质。在核酸分子的3’-末端处可以掺入其他经修饰的碱基例如反向的dt,这导致3’-3’连接,其抑制通过3’核酸外切酶进行的降解和通过dna聚合酶进行的延伸。在本发明的另一个实施方案中,可以在核酸分子的5’末端处放置反向的双脱氧-t以防止不希望的5’连接。可以使用双脱氧-c(ddc)3’链终止剂来防止通过dna聚合酶进行的3’延伸。当5-甲基-脱氧-c替代dc时,将会增加tm差不多0.5℃/插入。在一个实施方案中,可以使用天然出现的碱基脱氧肌苷,其致去稳定化效应比牵涉四种标准碱基的错配更小。因此,本发明部分地提供了涉及合成具有新特性和/或功能的经修饰的核酸分子的组合物和方法。
图2中所显示的平板形式的一种修饰是给孔使用“液体盖子”。可以实施此的一种方式是,对于孔来说包含双层。例如,包含固体支持物的孔的底部部分可以包含ega。在此上面可以是密度更低的、任选地不相混合的流体。该密度更低的流体层将会阻止或延迟酸扩散出所希望的孔和扩散至不希望的孔。进一步地,可以放置该密度更低的流体以实现与上面的电极的传导性接触。商购可得的“液体盖片”的一个例子由ventanamedicalsystems,inc(目录编号650-010)进行销售。该产品是作为在含水试剂和空气之间的屏障进行使用的溶液,其防止蒸发,并且被设计用于为诸如免疫组织化学和原位杂交反应之类的应用提供稳定的水性环境。
用于实践本发明的方法的一个示例性实验方案如下。通过受控的或脉冲的流而向芯片表面添加具有1微米的均一直径的多孔的经硅烷包被的磁性珠粒(myonebeads,dynal),以确保珠粒在芯片上的所有微孔(大约1.3μm直径)范围内的均匀分布和确保最大数目的孔加载有一个珠粒。通过能够描绘在空的孔和包含导电性磁性珠粒的孔之间的电阻差异的合成前电流检查来鉴别未包含珠粒的孔。
在珠粒表面的准备中,各种各样的化学都是可能的。例如,可以产生许多硅烷层以给予珠粒以更大的功能性表面面积。如此地制备硅烷涂层,从而使得存在羟基官能团的稳定附着;通常,通过三甲氧基或三乙氧基硅烷连接体将硅烷核心偶联至裸露的二氧化硅珠粒表面,以在最初的亚酰胺(amidite)合成步骤结束时暴露伯羟基基团。用于在dna合成中的起始和偶联的、为平面阵列表面电极而开发的基础化学可以在maurer等人,electrochemicallygeneratedacidanditscontainmentto100micronreactionareasfortheproductionofdnamicroarrays,plosone1(1):e34.doi:10.1371/journal.pone.0000034(2006)中找到。
芯片的制造:在就高导电率以及在合成、试剂添加和解封闭条件下的化学稳定性而选择出的经氧化的高电阻率硅上产生电极材料,例如至多50nm厚的铱金属。通过超声粘合将电极连接至印刷电路板,以提供数字控制的模拟集成开关电路,其激活被选择用于解封闭给定的孔的电极。将印刷电路板仔细地对准并且粘合至规则的微孔结构,从而产生合成芯片。将提供和密封用于试剂的内部体积的盖板以及普通的互补电路电极粘合在周边处和在微孔结构的上表面上,从而完成闭合的合成芯片。
可以使用常规的半导体或聚合物材料来形成孔(200)。例如,可以使用cmos技术来形成半导体材料(例如,sio或sio2)的具有所希望的形状或大小的孔。取决于所希望的应用,电极(202)可以与孔(200)一起进行制造或分开进行制造。
向芯片施加核酸合成(例如,dna合成)试剂可以通过许多手段来进行。例如,一旦珠粒被加载到芯片中,计算机系统就控制一系列的试剂添加,并且可以进行洗涤,以影响在位于芯片的微孔中的珠粒的表面上的亚磷酰胺dna合成。可以采用处理器可执行的指令,其决定,对于任何给定的dna序列群体,相关于试剂的体积/成本和合成运行的时间来说最佳的dna合成试剂添加的次序以及试剂添加和洗涤步骤的顺序。此外,如上面所提及的,给予在芯片上的特定孔的由控制器或处理器控制的电流决定了在哪些孔中可以产生以电化学方式产生的酸,并且可以以化学方式准备用于激活在孔中的珠粒上的正在生长的核酸分子的去保护,以偶联下一个被添加到反应容器中的亚酰胺碱基。通过经优化的开发过程,用于施加合成试剂和用于确保精确且受控的流体施加的许多特定的仪器和组件构造是可能的。使用ega来影响去保护的亚磷酰胺dna合成步骤、条件和试剂可以在例如maurer等人,electrochemicallygeneratedacidanditscontainmentto100micronreactionareasfortheproductionofdnamicroarrays,plosone1(1):e34.doi:10.1371/journal.pone.0000034(2006)以及egeland和southern,electrochemicallydirectedsynthesisofoligonucleotidesfordnamicroarrayfabrication,nucleicacidsresearch,33(14):e125(2005)中找到。
ega组分的组成和浓度:ega试剂的确切组成和浓度受到电极和微孔的精确的传导、结构和几何特性以及与施加电流以将ega转化为其酸形式相关的参数(电流、电压和时间)的影响。一般地,用于影响去保护的ega产生的体积越小,所需要的电流强度和/或电流施加时间越小。由于在这样的微量系统中产生的核酸分子的量低于可以直接且准确地测量的阈值,因而对于核酸分子合成和偶联效率,通常需要作为替代品的测定法,例如杂交或在靶扩增后的产物富集。将ega试剂(包括氢醌和苯醌)与六氟磷酸四丁基铵(在无水乙腈中)一起用于通过阳极氧化来产生电化学酸以影响去保护。以至多25mm的浓度制备上述ega试剂,并且在施加电流之前将其施加至芯片以影响去保护。在最佳参数的确定中,通常将会希望避免由于因dna过度暴露于酸造成的脱嘌呤作用而引起的碱基损伤。
施加电流以影响基于ega的dmt去保护:可以恒定地施加至多2μa的电流,并且将至多2v的电压施加至在受控电路中的电极,至多30秒的时间段。还可以在1至60秒的时间期间以10至2000ms的脉冲持续时间施加电流。还可以以各种不同的脉冲(例如,大约2至大约10,000个、大约10至大约10,000个、大约50至大约10,000个、大约100至大约10,000个、大约1,000至大约10,000个、大约10至大约500个等的脉冲)施加至多2μa(例如,大约0.02na至大约20,000na、大约0.2na至大约20,000na、大约0.2na至大约5,000na、大约0.2na至大约2,000na、大约0.2na至大约1,000na、大约0.2na至大约5000na、大约2.0na至大约20,000na、大约2.0na至大约10,000na、大约2.0na至大约5,000na、大约2.0na至大约2,000na、大约5.0na至大约20,000na、大约5.0na至大约8,000na、大约10na至大约20,000na、大约10na至大约8,000na、大约10na至大约5,000na、大约20na至大约20,000na、大约20na至大约8,000na、大约50na至大约20,000na、大约50na至大约10,000na、大约50na至大约5,000na、大约100na至大约10,000na、大约500na至大约20,000na、大约500na至大约10,000na、大约500na至大约5,000na、大约1,000na至大约20,000na、大约1,000na至大约10,000na等)的电流。在一些情况下,将会大致使电流脉冲大约1秒至大约30秒、大约2秒至大约30秒、大约4秒至大约30秒、大约5秒至大约30秒、大约5秒至大约20秒、大约5秒至大约15秒、大约5秒至大约10秒等。当然,必须确定有效的去保护和核酸分子合成,因为ega试剂的确切组成和浓度受到电极和微孔的精确的传导、结构和几何特性以及与施加电流相关的参数(电流、电压和时间)的影响。
在本发明的某些实施方案中,可以使核酸分子或其部分在合成之前经历序列优化过程。各种不同的用于序列修饰的计算方法是本领域中已知的,并且可以用于在下列方面优化给定的核苷酸序列:1)有效的装配,和/或2)经改善的在给定宿主中的性能。为了设计用于最佳装配的核苷酸序列,可以借助于考虑了参数(例如,解链温度、重叠区域、自我杂交、不存在或存在克隆位点,等等)的算法来将全长序列拆散成确定数目的具有最佳杂交特性的更小的片段。在本发明的某些方面,所希望的核酸序列的至少一部分可以编码多肽或蛋白质。在这样的情况下,可以希望的是优化开放阅读框以为了经改善的在给定的同源或异源宿主中的性能,例如表达产量或可溶性。可以例如通过下列方式来取得基因表达的增加:用偏爱的密码子代替非偏爱的或较不偏爱的密码子,或者增加开放阅读框中的cpg二核苷酸的数目,其例如描述在u.s.专利号5,786,464和6,114,148以及u.s.专利公开号2009/0324546aa(其公开内容通过提及而并入本文)中。
在一个特别的实施方案中,可以将经优化的开放阅读框与算法相组合以将秘密信息加密编码到开放阅读框中,如在u.s.专利公开号2011/0119778aa中所描述的。这样的信息可以允许某些合成的核酸分子的鉴定或追踪。在本发明的某些方面,可以希望使用同时考虑了多个不同参数(包括与装配相关的以及与表达相关的序列特性)的优化策略。可以为经优化的序列设计而在本发明中使用的综合的多参数方法的一个例子是在u.s.专利公开号2007/0141557aa(其公开内容通过提及而并入本文)中所描述的
模块2
在模块1上的合成运行完成后,可以使与支持物相关联的(例如,与珠粒相关联的)核酸分子经历在模块2中的后加工。在模块2中进行的过程可以手工地或者通过由计算机指导的自动化控制步骤(例如,从合成微孔阵列中拣取和汇集珠粒(例如,磁性珠粒),以及气相切割和去保护)来实施,以制备用于后续装配步骤(在适当时)的核酸分子。
为了暴露与珠粒相附着的核酸分子的微孔阵列,可以移除合成孔的盖子,当存在时。在一个实施方案中,以由计算机控制的方式通过自动手段来移除盖子。
可以给珠粒拣取器具(包括,例如精密控制的电微磁体)进行编程并对其进行控制,以提取和汇集含有合成的核酸分子的独个珠粒。取决于应用和待装配的核酸分子的数目,可以汇集微孔阵列的所有的珠粒或仅所述珠粒的亚组。当仅汇集珠粒的亚组时或当珠粒的总数受到限制时,所汇集的珠粒的数目可以广泛地变化,并且包括大约10至大约50个、大约50至大约100个、大约100至大约1000个、大约50至大约10,000个、大约100至大约10,000个或大约500至大约10,000个独个珠粒。可以将这些珠粒存放在任何合适的容器中。容器的一个例子是微孔平板的孔(例如,1536微孔平板的孔)。
适合用于本发明的自动化包括:精密控制的电微磁体拣起第一个珠粒并将它存放到汇集孔(即,包含用于收集寻求组合地进行使用的核酸分子的多个珠粒的孔)中。备选地,可以使用这样的精密控制的电微磁体,其拣起第一个珠粒并然后在x-y方向上移动至下一个位置,在z方向上降低以拣起第二个珠粒,在z方向上回升以离开磁场范围,在x-y方向上移动至第三个孔,等等。因此,让磁体处于“开”的状态,并且作为珠粒串来拣起和搬运珠粒组(例如,大约2至大约50个、大约10至大约50个、大约2至大约100个、大约10至大约100个、大约20至大约80个等)。当收集到一组珠粒时,那么就将该组同时存放到汇集孔中。当然,可以收集多个珠粒组并存放在单个汇集孔中。
在一些情况下,可以使用例如在u.s.专利公开号2008/0281466aa或2008/0113361aa中或者在u.s.专利号6,887,431、7,347,975或7,384,606(其公开内容通过提及而并入本文)中所描述的系统来提取和汇集珠粒。在本发明的其他实施方案中,可以使用具有至少一个集成的精密控制的电微磁体的珠粒拣取器具。这样的拣取器具可以通过控制单元来进行控制,可以给所述控制单元进行编程以控制微磁体移动至与特定的微孔对准。在进一步的实施方案中,所述控制单元可以提供用于控制微磁体和微孔之间的距离的调整的手段。在一个特别的实施方案中,可以通过电手段来控制和激活微磁体以允许提取携带特定核酸序列的单个磁性珠粒。
在本发明中所使用的电微磁体可以是中空的磁体或是针状的,并且常常将会具有使磁场聚焦在其尖端从而允许特异地靶向独个珠粒的大小和尺寸。在一个特别的实施方案中,所述微磁体可以由电磁体和永磁体组成,其中永磁体的活性可以受电磁体控制。用于本发明的电微磁体可以以任何数目或形式,并且可以例如包含单个磁体或与其他微磁体一起排列成行。
在本发明的某些实施方案中,可以使用电微磁体来提取和汇集在在单个阵列的微孔中所包含的所有磁性珠粒。为了该目的,可以将电微磁体分配至每个微孔以便以预先确定的或随机的次序逐步地提取与珠粒相附着的核酸分子。在一个实施方案中,可以在单个阵列上合成对于全长构建体的装配来说所需要的所有核酸分子。根据对于构筑全长构建体来说所需要的核酸分子的量,可以使用具有不同大小和尺寸的阵列。
在另一个实施方案中,可以给电微磁体进行编程以便仅靶向特定阵列的一部分微孔以提取和汇集与珠粒相附着的核酸分子的预先确定的选择。可以给电微磁体进行编程以从两个或更多个不同的平板的微孔中提取和汇集珠粒。所述拣取可以将第一个平板的所有珠粒的完全提取与从第二个平板获得的部分珠粒的选择性提取相组合。第一个平板和第二个平板可以在大小和尺寸方面变化。
然后,可以将由微磁体提取的每个磁性珠粒通过拣取器具的可移动机构转移至汇集站。在一个实施方案中,所述汇集站可以包含具有微孔平板的小室。在一个实施方案中,所述微孔平板可以为1536微孔平板。然而,具有其他大小和尺寸的微孔平板(例如,标准的96-孔平板)是本领域中已知的,并且可以在本发明中使用。可以将确定级分的核酸分子汇集在微孔平板的独个孔中,其中一个经汇集的级分包含对于装配全长构建体的至少一个确定的片段来说所需要的所有核酸分子。在一个实施方案中,独个核酸分子汇集物可以包含对于装配全长构建体来说所需要的所有核酸分子。可以通过使用布置在微孔平板上的机器可读的鉴别器来进一步鉴别出分配至每个孔的不同核酸分子汇集物。
还可以使用静电力来从合成平台中移除珠粒和其他基质。使用图2a-2b为了举例说明的目的,寡核苷酸合成基质(在该情况下为珠粒)可以是带静电电荷的,并且可以通过使用相反的电荷而从与表面或孔的联系中分开。例如,如果图2a-2b中所显示的一个或多个珠粒具有正电荷,那么可以将下面的电极用于产生正电荷以排斥珠粒并迫使它离开孔。还可以使用磁荷来达到相同的目的。还可以采用剩磁。本质上,剩磁是在暴露于磁力之后余留在材料中的磁性。在许多情况下,磁性基质将会具有小的大小。因此,此类基质的吸引通常将会不需要强的磁场。剩磁可以存在于基质、用于结合至基质的选择探针或两者之中。进一步地,可以使用电荷来从合成平台中选择性地移除合成基质的亚组。
可以容易地计算出对于从合成平台中移除珠粒和其他基质来说所需要的静电力。下面的表4假定,存在相对均匀的电场并且每个珠粒作为单个电荷点起作用。核酸分子在其上携带有当使用电荷来从孔中逐出珠粒时应当考虑的电荷。进一步地,仅需要向包含具有所希望的核酸分子(例如,用于装配成更大的核酸分子的核酸分子)的基质的孔施加电荷。
表4
在另一个实施方案中,合成平台可以包含一系列与合成平台的其他区域分开的区域。例如,合成平台可以以正方形的10×10排列包含100行的合成区域。进一步地,可以如此地设计合成平台,从而使得它可分开成十行的十个合成区域。为了举例说明的目的,假定寻求产生八个不同的经装配的核酸分子,并且这些经装配的核酸分子被设计成从下列数目的寡核苷酸的装配中形成:
表5
表5指明了各种不同的经装配的核酸分子的数字标号,将会用于装配所述经装配的核酸分子的寡核苷酸的数目,和其中合成寡核苷酸的行。在该实施方案中,第1-5行中的每个将会具有至少一个其中将不会产生寡核苷酸的合成区域。
在合成完成后,可以分开可分开的行,并且收集/加工和装配所合成的核酸分子,例如,如本文别处所描述的那样。
还可以使用其他方法来收集核酸合成基质,包括:(1)“抓取”,例如通过使用镊子样装置,其基于机械的(例如,真实的抓取)、光学的、声音的、磁性的原理进行运转;(2)“破坏”在核酸合成基质周围的结构,通过诸如化学溶解的方法或通过使用激光;(3)移动核酸合成基质,通过例如使用热能、静电能、磁能、流体能;(4)混合型钳子,其组合了例如(a)磁性和流体冲洗,(b)磁性和压电方法,和(c)静电提升和流体冲洗;(5)磁性固定/收集,通过使用例如受调节的永磁体、外部线圈、在合成基质上的平面线圈等;(6)静电提升和收集;和(7)溢流指导(例如,将流体添加至孔的底部以提升基质)。
在本发明的实践中所使用的汇集站可以进一步包含微孔处理装置,其包含可控制的可移动机构用于在x和/或y和/或z方向上将微孔平板从第一个位置移动至至少第二个位置,并且可以进行编程以实施液体处理步骤。这样的汇集站可以进一步配备有移液装置和允许试剂的受控添加和移除的抽吸仪器。备选地,可以通过真空机构来实施液体的移除。可以进一步将移液装置连接至试剂储器和混合机构以混合和添加确定量的对于纯化以及随后的加工和装配步骤来说所需要的试剂。组合了各自功能的集成的液体处理装置是本领域技术人员已知的。
在一个特别的实施方案中,汇集站集成了允许进一步地将来自第一个和第二个孔的一个或多个核酸分子汇集物合并到第三个孔中以产生更大的的核酸分子汇集物的机构。在从相同的和可变的序列元件来装配全长构建体的变体或文库的情况下,可能需要这样的逐步汇集。
在本发明的实践中所使用的汇集站可以进一步包含位于微孔平板下面的磁体。在一个特别的实施方案中,这样的平板磁体可以用作微磁体的对应物,以便触发所提取的珠粒释放到受者微孔中。备选地,电微磁体可以是连接至毛细管的中空磁体,所述毛细管可以用液体进行冲洗以将所结合的珠粒吹出到受者孔中。还可以采用其他的珠粒释放机构。
关于核酸分子的汇集,这可以以许多方式来进行。例如,可以收集合成基质并置于单个容器中。备选地,可以从合成基质中释放出核酸分子,然后使它们相互接触。进一步地,可以通过杂交来装配核酸分子。这意味着,可以在同一个容器中发生多于一次的装配。换言之,本发明包括这样的方法,通过所述方法从更小的、经化学合成的核酸分子发生多于一个(例如,两个、三个、四个、五个、六个等)的核酸分子的装配。其中多于一个的更大的核酸分子(例如,可复制的核酸分子)的装配可以是有用的一个应用是,其中意欲将经装配的核酸分子插入到相同细胞中的应用。因此,经装配的核酸分子之一可以是染色体,并且另一个可以是质粒。
一旦产生了所希望的核酸分子汇集物,常常将会进一步加工与珠粒相附着的核酸分子,例如以获得用于下游反应的功能性核酸分子。在链合成后,通常保护5’-末端5’-羟基基团,例如用二甲氧基三苯甲基(dmt)基团;还可以保护核苷间的磷酸酯或硫代磷酸酯部分,例如用2-氰基乙基基团;和可以保护在所有核碱基(除了t和u外)中的环外氨基基团,例如用酰基保护基团。通常,在汇集与珠粒相附着的核酸分子之前,于在支持物上的最后一个合成循环后,切割5’-末端dmt基团。然而,在可以将核酸分子有效地用于随后的过程之前,必须在去保护步骤中移除所有的保护基团。
在本发明的一个实施方案中,实施去保护,而例如不从珠粒上释放出核酸分子。这可以通过选择碱稳定的、非可切割的连接体来进行。各自的连接体是技术人员已知的。
在一个实施方案中,在下游装配之前,从珠粒上释放出核酸分子。如果需要核酸分子的切割,可以在单个步骤中进行切割和去保护。核酸分子的释放可以通过用合适的试剂切割将核酸分子的3’-末端附着至珠粒(例如,磁性珠粒)的连接体来达到。用于切割的合适的试剂和条件取决于连接的性质,如本文别处所描述的,并且是本领域技术人员已知的。
在本发明的一个实施方案中,通过琥珀酰基基团将核酸分子附着至磁性珠粒。琥珀酰基连接体可以通过使用例如浓缩的含水氢氧化铵来进行切割。该反应通常在50℃至80℃的温度下进行至少一个至大约八个小时。当然,取决于实验方案和所使用的保护基团,切割条件可以变化。然后,可以通过蒸发来去除氨溶液,从而留下核酸分子备用于进行纯化。
在一个实施方案中,切割可以通过气相加工来进行。在气相加工中,可以在封闭的小室中,在包含气态切割/去保护试剂(例如,气态氨或氢氧化铵蒸气)的气体环境中切割核酸分子。各自的方法例如陈述在u.s.专利号5,514,789或5,738,829(其公开内容通过提及而并入本文)中。
通常,上面的反应将会还触发其他保护基团(包括氰乙基基团,保护杂环伯胺的基团,和在最后一个碱基上的dmt基团)的切割。因此,在合适时,可以使用单个切割反应,以去除所有存在的保护基团。
可以使用至少两种方法来切割在本发明的实践中所使用的连接体:(a)在与去保护步骤相同的条件下同时地,或(b)在去保护步骤完成后,随后使用用于连接体切割的不同的条件或试剂。用于从核酸分子上去除通用连接体的各种不同的方法描述在本领域中,例如描述在u.s.专利公开号2002/0143166a1(其公开内容通过提及而并入本文)中。
对于下游应用,可能需要纯化经汇集和经去保护的核酸分子以去除切割下来的基团,例如,通过沉淀。可能进一步需要将核酸分子混合物与磁性颗粒或其他支持物分开。在一个实施方案中,可以使用位于微孔平板下面的平板磁体来将珠粒固定在孔中,而同时可以洗脱核酸分子,例如通过抽吸。备选地,在平板磁体不存在下,可以通过磁性手段从孔中自动地移除珠粒,而同时核酸分子将会被保留在孔中以获得准备好用于进一步加工或使用的以皮摩尔浓度的高质量核酸分子的飞摩尔的独个汇集物。
在一些情况下,可以将核酸分子与固体支持物分开,而同时固体支持物仍然位于与其中核酸分子进行合成的地方相同或相似的位置。在此类情况下,通常在合成完成后,可以使寡核苷酸合成试剂从与合成支持物的接触中移除,随后添加一种或多种用于释放所构建的寡核苷酸的试剂(也称为切割试剂)。这些释放试剂可以以诸如液体或气体之类的形式。气体试剂如上面所提到的。
在许多情况下,切割试剂将会是挥发性的(例如,它可以通过冷冻干燥被去除)和非离子型的。那么,可以通过从孔(当存在时)中移除,或通过漂洗合成基质,来回收切割下来的寡核苷酸。当采用微孔来进行合成时,可以使用以液体形式的切割试剂。可以用这样的液体试剂包被合成基质,随后为合成的寡核苷酸的集体移除或独个寡核苷酸的移除(少于全部存在的寡核苷酸)。独个寡核苷酸的移除可以例如通过在发生了切割后限制基质的搅动和位点特异性地移除(例如,用移液管尖端)包含独个寡核苷酸的流体来实现。当基质包含孔或空穴时,此类方法将会是特别有用的。
任选地,在汇集、切割和/或去保护步骤后可以浓缩所合成的核酸分子,而不是进入模块3过程。这样的浓缩的一个浓缩方法将会通过额外的第二次结合、洗涤和洗脱设置系列以减少最终的体积。该增加的浓度将会增加所合成的核酸分子的浓度,导致在亚片段产生中重叠区段的加速的杂交,如可能希望的那样。还可以采用浓缩至增加的浓度来使多个汇集物的浓度“标准化”至更恒定的范围,从而在模块3过程(例如,所有模块3过程)中只需要采用有限的一套例如装配条件。
图13显示了两种方法,通过所述方法可以将合成的寡核苷酸与支持物分开。在该图中,寡核苷酸已经在珠粒(1300)上合成并且被释放到微孔滴定平板(1301)的周围的孔中。在每种情况下,用流体(1302)覆盖用于进行收集的包含寡核苷酸的孔,并使用移液管尖端(1303)来收集该流体。在该图的左侧是两个孔,其中流体被包含在孔中。进一步地,在图13的右侧,屏障(1304)在孔的上方延伸以允许流体以更高的水平集中。在这两种情况下,在将移液管尖端带至紧密接近之前流体可以就在那里,或者可以通过移液管尖端来递送流体。此外,在珠粒(1300)周围的流体可以进行循环以通过由移液管尖端(1303)递送的液流来分配所释放的寡核苷酸。
模块3
一旦完成了化学合成阶段,就可以将所得的核酸分子装配成更大的核酸分子,如果希望。取决于最后的核酸分子进行使用的最终目的,化学合成的核酸分子的“质量”(例如,从序列保真度的角度看)对于所想要的应用来说可能太低了。作为例子,如果化学合成的核酸分子待被用作长的探针,那么它们对于该目的来说可能具有足够的质量,而无需进一步的加工。然而,要考虑这样的情形,其中待装配一百个核酸区段,每个核酸区段的长度为一百个碱基对,并且每五十个碱基对存在一个错误。最终结果将会是,平均地,在每个10,000碱基对的经装配的核酸分子中存在200个序列错误。如果意欲例如从经装配的核酸分子表达一种或多种蛋白质,那么该序列错误数目将会可能被认为是太高了。此外,尽管可以进行独个核酸分子的测序,但这是耗费时间的并且涉及额外的成本。因此,在许多情况下,可以实施错误去除步骤。通常地,这将会在第一轮装配后进行。因此,在一个方面,本发明的方法包括下列(以该次序或不同的次序):
1.片段扩增和装配(例如,pcr/体外装配);
2.错误校正;
3.最终的装配(例如,体内装配)。
在本公开内容的各种不同的实施方案中,错误去除步骤也可以通过执行处理器可执行的指令来实施。因此,本发明包括用于施行与错误去除过程以及本发明的其他方面相关的机械功能的基于软件的指令。
可以使用许多方法来进行片段扩增和装配。一个示例性的方法描述在yang等人,nucleicacidsresearch,21:1889-1893(1993)和u.s.专利号5,580,759(其公开内容通过提及而并入本文)中。
在yang等人的文章中所描述的方法之中,将线性载体与在末端共享序列同源性的双链核酸分子相混合。添加具有核酸外切酶活性的酶(即,t4dna聚合酶、t5核酸外切酶、t7核酸外切酶等),其使存在于混合物中的所有末端的一条链向后剥离。然后,通过与dna聚合酶和脱氧核苷三磷酸一起在允许单链缺口填充的条件下进行温育,使“被向后剥离的”核酸分子退火。在所得的核酸分子中的切口可以通过将分子引入到细胞中或者通过添加连接酶来进行修补。当然,取决于应用和工作流程,可以省略载体。进一步地,可以通过聚合酶链式反应来扩增所得的核酸分子或其亚部分。
核酸装配的其他方法包括在u.s.专利公开号2010/0062495a1、2007/0292954a1、2003/0152984aa和2006/0115850aa中,以及在u.s.专利号6,083726、6,110,668、5,624,827、6,521,427、5,869,644和6,495,318(其公开内容通过提及而并入本文)中所描述的那些。
在u.s.专利公开号2012/0053087(其公开内容通过提及而并入本文)中陈述了用于核酸分子的等温装配的方法。在该方法的一个方面,将用于装配的核酸分子与具有核酸外切酶活性的不耐热的蛋白质(例如,t5聚合酶)、热稳定的聚合酶和热稳定的连接酶在核酸外切酶活性随时间而降低的条件(例如,50℃)下进行接触。所述核酸外切酶“向后咬嚼”核酸分子的一条链,并且,如果存在序列互补性,核酸分子将会互相退火。所述热稳定的聚合酶填充缺口,并且所述热稳定的连接酶封闭切口。可以将像这样的方法与图16的设备一起进行使用。进一步地,可以将多于一个的核酸分子与其他合适的试剂一起储存在1609的独个储存单元内,并且可以将这些储存单元设定至例如50℃的温度以为了装配所储存的分子。
一种商购可得的可用于装配本发明的核酸分子以及用于将这样的核酸分子插入到载体中的试剂盒为
可以包括单链结合蛋白例如t4基因32蛋白和reca,以及本领域中已知的其他核酸结合或重组蛋白,例如以便促进核酸分子退火。
在一些情况下,可以在固体支持物上扩增核酸分子。因此,本发明包括其中合成核酸分子但不将它们从它们在其上进行合成的固体支持物上切割下来的方法。在这样的情况下,可以直接地(例如,作为探针)或经装配地使用扩增出的核酸分子,如本文别处所描述的那样。
一种用于装配核酸分子的方法(图3)涉及以通过使用pcr而“缝合”在一起的重叠核酸分子开始。在许多情况下,经缝合的核酸分子将会是经化学合成的,并且其长度将会少于100个核苷酸(例如,大约40至100个、大约50至100个、大约60至100个、大约40至90个、大约40至80个、大约40至75个、大约50至85个等核苷酸)。在u.s.专利号6,472,184(其公开内容通过提及而并入本文)中陈述了一种与在图3中所显示的那种相似的方法。还可以使用引物,所述引物包含用于其中希望插入到克隆载体中的情况的限制位点。一种合适的克隆系统被称为goldengate,其以各种不同的形式陈述在u.s专利公开号2010/0291633a1和pct公开wo2010/040531(其公开内容通过提及而并入本文)中。因此,在希望时,可以将经装配的核酸分子直接插入到载体和宿主细胞中。当所希望的构建体相当小(例如,小于5千碱基)时,这可能是合适的。当希望更大的构建体(例如,5至100千碱基)时,可以使用由iis型限制位点介导的装配来装配多个片段(例如,二个、三个、五个、八个、十个等)。
用于核酸分子(例如,化学合成的核酸分子)的基于pcr的装配的一种备选的方法基于5’-磷酸化的核酸分子的重叠对的直接连接(“基于连接的装配”)。在该方法中,合成单链核酸分子,使其磷酸化,并进行退火以形成具有互补突出端(例如,四个核苷酸的突出端)的双链分子。然后,将独个双链分子相互连接以形成更大的构建体。在某些实施方案中,可希望该方法超过pcr方法,特别是当待装配高度重复的序列,例如gc序列段时。可以使用该方法来装配大约2至大约40个核酸分子(例如,大约2至大约40个、大约3至大约40个、大约5至大约40个、大约8至大约40个、大约2至大约30个、大约2至大约20个、大约2至大约10个等核酸分子)。相关的方法描述在u.s.专利号4,652,639(其公开内容通过提及而并入本文)中。
在许多情况下,当在使用化学合成的核酸分子的情形下采用基于连接的装配时,这些分子的长度将会少于100个碱基对。此外,互补重叠可以用于连接长度通常在2和10之间(例如,长度为大约2至大约10个、大约4至大约10个、大约5至大约10个、大约2至大约8个、大约3至大约7个等核苷酸)的核酸分子(图4)。
一种可以用于装配核酸分子的方法是red/et重组。该方法采用基于大肠杆菌(e.coli)的同源重组,其由噬菌体蛋白质对,例如rece/rect或redα/redβ来介导。该方法不受核酸大小限制,并且不依赖于限制位点。基本上,通过使用red/et重组,可以在任何位点处改造几乎任何大小的在大肠杆菌中的任何dna分子。大体上,red/et重组涉及三个步骤/条件。第一个步骤或条件是在线性dna中同源性臂(例如,长度为50碱基对的臂)的存在。第二个步骤或条件是在大肠杆菌细胞中线性dna的插入或存在。第三个步骤或条件是在大肠杆菌细胞中任何合适的噬菌体对(例如,rece/rect或redα/redβ)的表达或存在。red/et重组陈述在us专利号6,355,412和6,509,156(其公开内容通过提及而并入本文)中。
进一步地,如在图4中所显示的,可以使用多轮聚合酶链式反应来连续地产生更大的核酸分子。
在大多数情况下,不管通过其而从化学合成的核酸分子产生更大的核酸分子的方法是什么,来自化学合成过程的错误将会存在。因此,在许多情况下,错误校正将会是希望的。错误校正可以通过许多手段来实现。一种方法是通过对化学合成的核酸分子独个地进行测序。
在图6中呈现了另一种错误校正方法。图6是用于合成最小化了错误的核酸分子的示例性过程的流程图。在第一个步骤中,获得长度小于全长的所希望的核苷酸序列的长度的核酸分子(即,全长的所希望的核苷酸序列的“核酸分子片段”)。每个核酸分子意欲具有这样的所希望的核苷酸序列,其包含全长的所希望的核苷酸序列的一部分。每个核酸分子还可能意欲具有这样的所希望的核苷酸序列,其包含用于核酸分子的pcr扩增的适体引物、用于将核酸分子附着至dna微芯片的拴系序列或者由任何实验目的或其他意图决定的任何其他核苷酸序列。可以以一种或多种方式中的任一种,例如通过合成、购买等来获得核酸分子。
在任选的第二个步骤中,扩增核酸分子以获得更多的每个核酸分子。所述扩增可以通过任何方法(例如,通过pcr)来实现。在扩增期间,可能发生额外的错误被引入到任何所述核酸分子的核苷酸序列中。
在第三个步骤中,将扩增出的核酸分子装配成意欲具有所希望的长度(其可以是所希望的核苷酸序列的所想要的全长)的第一组分子。扩增出的核酸分子装配成全长分子可以以任何方式来实现,例如通过使用基于pcr的方法。
在第四个步骤中,使第一组全长分子变性。变性致使双链分子变成单链分子。变性可以通过任何方式来实现。在一些实施方案中,变性通过加热所述分子来实现。
在第五个步骤中,使经变性的分子退火。退火致使单链分子变成第二组全长的双链分子。退火可以通过任何方式来实现。在一些实施方案中,退火通过冷却所述分子来实现。
在第六个步骤中,使第二组全长分子与一种或多种核酸内切酶反应从而产生第三组分子,其意欲具有小于完整的所希望的基因序列的长度的长度。核酸内切酶将第二组中的分子中的一个或多个分子切割成更短的分子。所述切割可以通过任何方式来实现。在任何核苷酸序列错误的位点处的切割是特别希望的,因为一个或多个已在错误位点处进行了切割的分子的断片的装配提供了在该过程的最后步骤中去除切割错误的可能性。在一个示例性的实施方案中,所述分子用t7核酸内切酶i、大肠杆菌核酸内切酶v和绿豆核酸内切酶在锰存在下进行切割。在该实施方案中,核酸内切酶意欲在任何序列错误的位点处以及在其中没有序列错误的随机位点处将平头切割引入到分子中。
在最后的步骤中,将第三组分子装配成第四组分子,其长度意欲为所希望的核苷酸序列的全长。由于通过所提供的方法而使得能够实现的后期错误校正,因而期望该组分子具有比由现有技术的方法所可以提供的错误少得多的核苷酸序列错误。
在上面和在图6中所呈现的过程也陈述在u.s.专利号7,704,690(其公开内容通过提及而并入本文)中。此外,可以将上面所描述的过程作为处理器可执行的指令编码在计算机可读的介质上。
另一种用于实行在化学合成的核酸分子中的错误校正的过程是通过称作errasetm(novicibiotech)的商业程序。适合于在错误校正过程中使用的错误校正方法和试剂陈述在u.s.专利号7,838,210和7,833,759、u.s.专利公开号2008/0145913a1(错配核酸内切酶)和pct公开wo2011/102802a1(其公开内容通过提及而并入本文)中。
示例性的错配核酸内切酶包括核酸内切酶vii(由t4基因49编码)、resi核酸内切酶、celi核酸内切酶和sp核酸内切酶,或甲基定向的核酸内切酶例如muth、muts或mutl。技术人员将会认识到,在本发明的某些实施方案中可以实践其他错误校正方法,例如在u.s.专利公开号2006/0127920aa、2007/0231805aa、2010/0216648a1、2011/0124049a1或u.s.专利号7,820,412(其公开内容通过提及而并入本文)中所描述的那些。
在图7中显示了错误校正方法的另一个示意图。
合成地产生的核酸分子通常具有大约1个碱基/300-500个碱基的错误率。进一步地,在许多情况下,多于80%的错误是单碱基移码缺失和插入。此外,当采用高保真度pcr扩增时,少于2%的错误由于聚合酶的作用而产生。在许多情况下,将会通过使用固定的“蛋白质:dna”比例来进行错配核酸内切酶(mme)校正。
一种错误校正方法涉及下列步骤。第一步是使包含在反应缓冲液(例如,200mmtris-hcl(ph8.3)、250mmkcl、100mmmgcl2、5mmnad和0.1%
另一种用于从化学合成的核酸分子中去除错误的方法是通过选择具有正确的核苷酸序列的核酸分子。这可以通过下述方式来做:选择用于扩增的单个核酸分子,然后对扩增产物进行测序以决定是否存在任何错误。因此,本发明还包括用于减少序列错误的选择方法。用于扩增和测序验证核酸分子的方法陈述在u.s.专利号8,173,368(其公开内容通过提及而并入本文)中。在matzas等人,naturebiotechnology,28:1291-1294(2010)中陈述了类似的方法。
根据本发明的该方面的方法可以包括下列步骤:(a)提供进行合成以具有相同的核苷酸序列的核酸分子的混合物,(b)将该混合物中的核酸分子分开,从而扩增导致源自单个起始核酸分子的子代核酸分子,(c)对多于一个的在步骤(b)中产生的扩增出的核酸分子进行测序,和(d)从在步骤(c)中进行测序的核酸分子中鉴定出至少一个具有所希望的序列的独个核酸。然后,可以将在步骤(d)中鉴定出的核酸分子用作在装配过程中的一个核酸分子,如本文别处所描述的。
根据本文所描述的各种不同的实施方案,可以用处理器可执行的指令对计算机可读的介质进行编码,所述指令用于下列步骤:(a)提供进行合成以具有相同的核苷酸序列的核酸分子的混合物,(b)将该混合物中的核酸分子分开,从而扩增导致源自单个起始核酸分子的子代核酸分子,(c)对多于一个的在步骤(b)中产生的扩增出的核酸分子进行测序,和(d)从在步骤(c)中进行测序的核酸分子中鉴定出至少一个具有所希望的序列的独个核酸。然后,可以将在步骤(d)中鉴定出的核酸分子用作在装配过程中的一个核酸分子,如本文别处所描述的。在各种不同的实施方案中,可以将计算机可读的介质包括在这样的系统中,所述系统被配置成通过选择具有正确的核苷酸序列的核酸分子来减少来自化学合成的核酸分子的错误。
大的核酸分子是相对易碎的,并因此容易剪切。一种用于稳定这样的分子的方法是通过在细胞内维持它们。因此,在一些方面,本发明涉及在宿主细胞中大的核酸分子的装配和/或维持。
已知相当有效地施行同源重组的一组生物是酵母。因此,在本发明的实践中所使用的宿主细胞可以为酵母细胞(例如,酿酒酵母、粟酒裂殖酵母、巴斯德毕赤酵母(pichiapastoris)等)。
酵母宿主由于其独特的一套遗传操作工具而特别适合于供者基因组材料的操作。酵母细胞的天然能力以及几十年的研究已创建了丰富的一套用于在酵母中操作dna的工具。这些优点是本领域熟知的。例如,具有其丰富的遗传系统的酵母可以通过同源重组(一种不被许多容易得到的生物所共享的能力)来装配和再装配核苷酸序列。可以将酵母细胞用于克隆不能在其他生物中进行克隆的较大的dna断片,例如,完整的细胞的、细胞器的和病毒的基因组。因此,在一些实施方案中,本发明利用酵母遗传学的巨大能力,通过使用酵母作为用于装配和维持的宿主细胞来产生大的核酸分子(例如,合成的基因组)。
酵母宿主细胞的例子为,为了高的转化效率而开发的酵母菌株vl6-48n(亲本菌株:vl6-48(atcc编号mya-3666tm)),w303a菌株,mav203菌株(lifetechnologiesinc.,目录编号11281-011),和重组缺陷型酵母菌株例如rad54基因缺陷型菌株vl6-48-δ54g(matαhis3-δ200trp1-δ1ura3-52lys2ade2-101met14rad54-δ1::kanmx),其可以减少酵母人工染色体(yac)中各种各样的重组事件的发生。
存在有很大的一套用于选择和反选择酵母突变体的选择标记(例如,ura3、his3等),其使得能够在酵母宿主细胞内进行多轮无缝的核酸改变。因此,可以使用酵母来引入许多不同的遗传修饰,包括单个核苷酸改变(例如,插入、缺失、突变)、靶核酸部分和区域的修饰以及完全新的染色体的构建。可以在酵母中快速连续地进行对于以另外方式难处理的基因组或其他大的核酸的经克隆的拷贝来施行的系列修饰。酵母的交配能力对于修饰基因组和其他大的核酸来说是有利的。可以使用酵母重组机构系统(当在酵母交配期间被激活时)来产生文库,例如包含经克隆的基因组或核酸的变体的组合文库。
例如,已为数种不同的细菌构建了酵母人工染色(yac)(azevedo等人,pnasusa90,6047(1993);heuer等人,electrophoresis19,486(1998);kuspa等人,pnasusa86,8917(1989))。可以通过使用通用遗传密码来将大的原核dna区段克隆到酵母中。通常,毒性基因表达对于在酵母中克隆核酸来说不是障碍。关于例如细菌和古细菌的基因组的研究表明,由于真核生物使用与这些细菌不同的蛋白质表达机构系统,因此存在很小的由从经克隆的基因组表达出的蛋白质对酵母宿主造成伤害的风险。因此,本发明进一步包括用于产生当被引入到非酵母细胞(例如,细菌细胞)中时赋予毒性表型的核酸分子(例如,合成的基因组)的方法。
在酵母中的转录(kozak,gene234,187(1999))和翻译(kornberg,trends.cell.biol.9,m46(1999))信号不同于在细菌中的那些。事实上,大多数原核基因可能在酵母中不表达。在酵母中不存在限制障碍(belfort和roberts,nucleicacidsres25,3379(1997))。如果存在障碍,它可能是复制障碍,而不是基因表达障碍(stinchcomb等人,pnasusa77,4559(1980))。基因毒性被最小化了,因为在真核生物例如酵母中的基因表达的调节不同于在原核生物中的那种。此外,支原体例如使用密码子uga用于色氨酸,而不是作为翻译终止信号。因此,大多数支原体基因,如果被表达,将会在酵母中产生截短的蛋白质。这大大地避免了毒性基因产物的可能性。
可以在转化到酵母细胞中之前从天然或合成的片段连同酵母载体一起来装配核酸分子,或者可以同时共转化到酵母细胞中。可以通过将这些基因组或其他核酸分子(其已经任选地如所希望的那样进行了操作)转移到相容的受者细胞中来创造新的生物。因此,一个实施方案提供了合适的技术用于将基因组和其他核酸分子转移至酵母宿主细胞,修饰宿主细胞内的基因组而同时保持其稳定性和完整性,和将经克隆和操作的来自酵母宿主细胞的基因组移植回更近地与原始供者(例如,从其获得所述核苷酸序列的生物)相似的受者细胞,如此创造出新的生物。
用于在酵母细胞中装配核酸分子的商购可得的产品是
除了酵母之外的其他生物可以用于体内装配。例如,已经显示,在非同源末端连接方面缺陷的突变型菌株中,以100%的频率将外源dna整合到粗糙脉孢菌的基因组中的同源序列中(ninomiya等人,highlyefficientgenereplacementsinneurosporastrainsdeficientfornonhomologousend-joining,pnas,100:12248–12253,2004)。因此,本发明进一步包括涉及除了酵母之外的其他生物(例如,真菌,例如粗糙脉孢菌)的方法,以及涉及抑制和/或消除非同源末端连接以增加同源重组效率的方法。本质上,可以使用任何经历同源重组的细胞来装配核酸分子。然而,最适合于本发明的该方面的细胞将会是这样的细胞,所述细胞天然地在实施同源重组方面是有效的(例如,酵母)或者可以被改变(例如,通过诱变)以增加它们进行同源重组的频率。
核酸分子的装配和维持常常将会涉及核酸分子的产生或将核酸分子插入到细胞中,所述核酸分子包含诸如下列的元件:一个或多个复制起点(例如,两个复制起点,其在不同的细胞类型中具有功能)和一个或多个选择标记(例如,一个或多个正选择标记和/或一个或多个负选择标记)。
被引入到细胞中用于进行装配的核酸分子通常将会具有允许它们以特定的次序进行装配的某些特征。一种特征是待进行装配的核酸分子之间的末端序列同源性。
可以将经装配的核酸分子引入到位于细胞内的其他核酸分子(例如,病毒基因组、核基因组、细胞器基因组、细菌染色体等)中。在此类情况下,功能元件例如复制起点、着丝粒等,通常将会存在于位于细胞内的其他核酸分子中。因此,本发明部分地提供了涉及核酸分子的装配和所得的装配体插入到其他核酸分子中的组合物和方法。
在一些情况下,可以采用部分地和完全地经装配的核酸分子的基于标准连接酶的连接。例如,可以用接近其末端的限制酶位点来产生完全地经装配的核酸分子。然后,可以用一种或多种合适的限制酶处理这些核酸分子以产生例如一个或两个“粘性末端”。然后,可以通过标准的限制酶-连接酶方法将这些粘性末端分子引入到载体中。在惰性的核酸分子具有仅一个粘性末端的情况下,可以将连接酶用于“非粘性”末端的平头末端连接。
经装配的核酸分子还可以包含赋予所希望的特性的功能元件(例如,复制起点、选择标记等)。在许多情况下,经装配的核酸分子将会从多个独个核酸区段来进行装配,其中所述区段之一为载体(例如,线性载体)。
使用图8的示意图为了举例说明的目的,该方法可以通过将众多(例如,两个、三个、五个、八个、十个、十五个、二十个、三十个等)希望进行装配的“重叠”核酸片段连同宿主载体一起共转化到宿主细胞中来进行。在该情况下,所述片段中的每一个包含两个与被引入到宿主细胞中的其他核酸区段的区域具有同源性的区域。所述核酸区段在转化到宿主细胞中后例如通过经由同源性区域的同源重组来进行装配。在图8中所显示的情况下,结果为经装配的、闭合的、环状的核酸分子。
在图8中所显示的举例说明性的例子的一个变化形式中,将环状细菌基因组的重叠片段连同线性酵母载体一起共转化到酵母宿主细胞中。再次地,酵母载体在其朝向细菌基因组的部分的末端处包含同源性区域。在将基因组片段和酵母宿主载体引入到宿主细胞中之后,所述片段和载体进行重组,由此连接了所述基因组片段和宿主载体。
在图8中所显示的过程部分地依赖于就闭合的、环状的、可复制的核酸分子的装配进行选择。类似的选择机制陈述在u.s.专利公开号2004/0219516a1(参见例如,该申请的图20)(其公开内容通过提及而并入本文)中。当然,通过本发明的方法进行装配的核酸分子不需要总是产生闭合的环状核酸分子。可以通过本发明的方法产生的其他核酸分子包括线性质粒(例如,可以以线性形式进行复制的质粒)和染色体。
在图8中所显示的类型的体内装配系统可以由两个核心组分组成:(1)用于装配的核酸区段;和(2)合适的宿主细胞。在其中在用于装配的核酸区段中没有提供所希望的功能元件(例如,复制起点、选择标记等)的某些实施方案中,可以包括载体作为另外的核酸区段。
待装配的片段通常将会包含在其末端重叠的序列。在一个实施方案中,所述重叠为大约10bp;在其他实施方案中,所述重叠可以为15、25、50、60、70、80或100碱基对,等等(例如,大约10至大约120、大约15至大约120、大约20至大约120、大约25至大约120、大约30至大约120、大约40至大约120、大约10至大约40、大约15至大约50、大约20至大约50等碱基对)。为了避免错装配,独个重叠在所述片段之中不应当重复或紧密地配对。由于同源重组不要求在参与的核酸分子或区域之间的100%的序列同一性,因而每个末端应当足够不同以防止错装配。进一步地,意欲经历相互之间的同源重组的末端应当共享至少90%、93%、95%或98%的序列同一性。
在体内装配方法中,将所有待装配的片段的混合物用于通过使用标准转染技术来转染宿主重组和装配细胞。在混合物中的片段分子的数目与在待转染的培养物中的细胞的数目之比应当足够高以允许至少一些细胞摄取比在混合物中存在的不同片段多的片段分子。因此,在大多数情况下,转染效率越高,将会存在越大数目的包含对于形成最终的所希望的经装配的核酸分子来说所需要的所有核酸区段的细胞。按照这些路线的技术参数陈述在u.s.专利出版号2009/0275086a1(其公开内容通过提及而并入本文)中。
用于连接不共享末端序列同源性的双链核酸分子的装配方法的一个例子显示在图5中。在该实施方案中,通过使用单链“缝合性核酸分子”,将两个双链片段引入到线性载体中。在某种意义上,这是五个核酸区段的装配,其中所述区段中的一个为载体,所述区段中的两个为两个缝合性核酸分子,和最后两个区段为被标注为片段1和片段2的区段。除了促进其他核酸分子的连接之外,缝合性核酸分子还将短的插入物(例如,九碱基对)引入到经装配的核酸分子中。包含这些特征的商购可得的产品是
还可以用位点特异性重组位点(例如,
通过其可以装配核酸分子的一种手段是通过使用重组克隆化。因此,本发明包括与重组克隆化和重组位点以及重组克隆化组分有关的组合物和方法。
许多重组克隆化系统是已知的。可以在此类系统中使用的重组位点的例子包括但不限于:loxp位点;loxp位点突变体、变体或衍生物例如loxp511(参见u.s.专利号5,851,808);frt位点;frt位点突变体、变体或衍生物;dif位点;dif位点突变体、变体或衍生物;psi位点;psi位点突变体、变体或衍生物;cer位点;和cer位点突变体、变体或衍生物。
典型地,这些克隆系统基于这样的原则,即特定的重组位点将会与其关连对应物进行重组。可以对本发明的核酸分子进行设计,只要它们包含不同的重组克隆系统的重组位点(例如,lox位点和att位点)。作为例子,本发明的核酸分子可以包含单个lox位点和两个att位点,其中att位点不相互重组。
用于在本发明中使用的重组位点可以是任何能够在重组反应中充当底物的核酸。这样的重组位点可以是野生型的或天然出现的重组位点,或者经修饰的、变异的、衍生的或突变的重组位点。用于在本发明中使用的重组位点的例子包括但不限于,λ噬菌体重组位点(例如attp、attb、attl和attr以及其突变体或衍生物)和来自其他噬菌体例如phi80、p22、p2、186、p4和p1的重组位点(包括lox位点,例如loxp和loxp511)。经突变的att位点(例如,attb1-10、attp1-10、attr1-10和attl-110)描述在1999年5月28日提交的u.s.申请号60/136,744,和2000年3月2日提交的u.s.申请系列号09/517,466中,这些文献通过提及而明确地并入本文。其他具有单一特异性的重组位点(即,第一个位点将会与其相应的位点重组,而不会与具有不同特异性的第二个位点重组)是本领域技术人员已知的,并且可以用于实践本发明。根据本发明,关于所指出的重组位点可以使用用于这些系统的相应的重组蛋白。提供了用于在本发明中使用的重组位点和重组蛋白的其他系统包括来自酿酒酵母的flp/frt系统、解离酶家族(例如,tndx、tnpx、tn3解离酶、hin、hjc、gin、spcce1、para和cin)和is231以及其他苏云金芽孢杆菌(bacillusthuringiensis)转座元件。用于在本发明中使用的其他合适的重组系统包括xerc和xerd重组酶以及大肠杆菌中的psi、dif和cer重组位点。其他合适的重组位点可以在elledge和liu的u.s.专利号5,851,808(其通过提及而明确地并入本文)中找到。可以在本发明的实践中使用的重组蛋白和突变的、经修饰的、变异的或衍生的重组位点包括:在u.s.专利号5,888,732和6,143,557中以及在基于u.s.临时申请号60/108,324(1998年11月13日提交)的u.s.申请系列号09/438,358(1999年11月12日提交)和基于u.s.临时申请号60/136,744(1999年5月28日提交)的u.s.申请系列号09/517,466(2000年3月2日提交)中所描述的那些,以及与从lifetechnologiescorp.(carlsbad,calif.)可得的
可以在本发明的实践中使用的重组位点的代表性例子包括上面所提到的att位点。与其他att位点特异性地重组的att位点可以通过改变在7-碱基对重叠区域中和附近的核苷酸来进行构建。因此,适合于在本发明的方法、组合物和载体中使用的重组位点包括但不限于,在15-碱基对核心区域(gcttttttatactaa)内具有一个、两个、三个、四个或更多个核苷酸碱基的插入、缺失或置换的那些,该15-碱基对核心区域在所有四种野生型λatt位点即attb、attp、attl和attr中是相同的(参见1996年6月7日提交的u.s.申请系列号08/663,002(现在的u.s.专利号5,888,732)和1998年10月23日提交的u.s.系列号09/177,387,其进一步详细地描述了核心区域,并且其公开内容通过提及而以其整体并入本文)。适合于在本发明的方法、组合物和载体中使用的重组位点还包括,在15-碱基对核心区域(gcttttttatactaa)内具有一个、两个、三个、四个或更多个核苷酸碱基的插入、缺失或置换的那些,其与该15-碱基对核心区域至少50%同一,至少55%同一,至少60%同一,至少65%同一,至少70%同一,至少75%同一,至少80%同一,至少85%同一,至少90%同一,或至少95%同一。
类似地,在attb1、attp1、attl1和attr1中的核心区域彼此是相同的,正如在attb2、attp2、attl2和attr2中的核心区域那样。适合用于本发明的核酸分子还包括,在该15-碱基对核心区域(gcttttttatactaa)内出现的7-碱基对重叠区域(tttatac,其通过用于整合酶蛋白的切割位点来定义并且是其中发生链交换的区域)之内包含一个、两个、三个、四个或更多个核苷酸的插入、缺失或置换的那些。
多位点
本发明还涉及使用一种或多种拓扑异构酶来产生经装配的核酸分子的方法。可以将拓扑异构酶与本文所描述的重组克隆技术相组合地进行使用。例如,可以使用由拓扑异构酶介导的反应来将一个或多个重组位点附着至一个或多个核酸区段。然后,所述区段可以进一步地通过使用例如重组克隆技术来进行操作和组合。
在一个方面,本发明提供了这样的方法,其用于通过使用拓扑异构酶(例如,ia型;ib型,例如痘苗病毒拓扑异构酶;和/或ii型拓扑异构酶)来连接第一个和至少第二个核酸区段,从而经连接的区段的任一条链或两条链在所述区段进行连接的位点处共价地连接在一起。
用于产生在一条链中共价地连接的双链重组核酸分子的方法可以通过下述方式来施行:使在5’或3’末端处具有位点特异性拓扑异构酶识别位点(例如,ia型或ii型拓扑异构酶识别位点)或其切割产物的第一个核酸分子与第二个(或另一个)核酸分子和任选地拓扑异构酶(例如,ia型、ib型和/或ii型拓扑异构酶)相接触,从而可以将第二个核苷酸序列共价地附着至第一个核苷酸序列。如本文所公开的,本发明的方法可以以下述方式来施行:使用许多核苷酸序列,通常地,其中核苷酸序列中至少一个在5’和/或3’末端之一或两者处具有位点特异性拓扑异构酶识别位点(例如,ia型、ib型或ii型拓扑异构酶)或其切割产物的核酸分子。
由拓扑异构酶介导的核酸连接方法详细描述在u.s.专利公开号2004/0265863a1(其全部公开内容通过提及而并入本文)中。
可以进行克隆的经装配的核酸分子可以包含待连接的平头末端,并且在克隆方法中所牵涉的第二个核酸分子可以在待通过位点特异性拓扑异构酶(例如,ia型或ib型拓扑异构酶)进行连接的末端处包含突出端,其中所述突出端包括与包含平头末端的序列互补的序列,由此促进链侵入以作为用于正确地定位用于连接反应的末端的手段。
在本发明的实践中可以使用许多载体。进一步地,用于特定应用的载体的选择将会随这些应用的细节(例如,宿主细胞)而变化。在许多情况下,将会以线性形式将载体引入到宿主细胞中。
用于在本发明中使用的合适的载体还包括原核载体,例如pcdnaii,psl301,pse280,pse380,pse420,ptrchisa、b和c,prseta、b和c(lifetechnologiescorp.),pgemex-1,和pgemex-2(promega,inc.),pet载体(novagen,inc.),ptrc99a,pkk223-3,pgex载体,pezz18,prit2t,和pmc1871(pharmacia,inc.),pkk233-2,和pkk388-1(clontech,inc.),和pproex-ht(lifetechnologiescorp.),以及其变体和衍生物。其他目的载体包括真核表达载体,例如pfastbac,pfastbacht,pfastbacdual,psfv,和ptet-splice(lifetechnologiescorp.),peuk-c1,ppur,pmam,pmamneo,pbi101,pbi121,pdr2,pcmvebna,和pyacneo(clontech),psvk3,psvl,pmsg,pch110,和pkk232-8(pharmacia,inc.),p3'ss,pxt1,psg5,ppbac,pmbac,pmc1neo,和pog44(stratagene,inc.),以及pyes2,pac360,pbluebachisa、b和c,pvl1392,pbluebaciii,pcdm8,pcdna1,pzeosv,pcdna3,prep4,pcep4,和pebvhis(lifetechnologiescorp.),以及其变体或衍生物。
适合于在本发明中使用的其他载体包括puc18,puc19,pbluescript,psport,粘粒,噬菌粒,yac(酵母人工染色体),bac(细菌人工染色体),p1(大肠杆菌噬菌体),pqe70,pqe60,pqe9(qiagen),pbs载体,phagescript载体,bluescript载体,pnh8a,pnh16a,pnh18a,pnh46a(stratagene),pcdna3(lifetechnologiescorp.),pgex,ptrsfus,ptrc99a,pet-5,pet-9,pkk223-3,pkk233-3,pdr540,prit5(pharmacia),psport1,psport2,pcmvsport2.0和psv-sport1(lifetechnologiescorp.),以及其变体或衍生物。
除了本文所描述的其他方法之外,装配方法也能够小型化和/或自动化。事实上,在许多情况下,当被装配和/或引入到载体中的核酸分子以较低的总数目存在时,小型化将会是所希望的。通过其可以实现微混合以为了装配和诸如将核酸分子插入到载体中之类的过程的一种手段是通过电润湿,例如,如在本文别处所描写的。
图16是用于加工本发明的核酸分子的设备的一个实施方案的方框图。在该图的左上部是载体油储器(1600)和用于从该储器运输油的管(1601)。载体油被运输经过一系列额外的包含试剂的储器(1602)。环状结构表示独个试剂储器。示例性的试剂为核酸分子、pcr酶、引物和载体,以及例如其他与模块3相关的成分。所述试剂通常将会以水性囊泡的形式在油屏障之间进行运输。
然后,将通过载体油进行运输的试剂运输至混合室(1603),在那里发生混合。然后,试剂继续前进至数字pcr站(1604)。管(1601)在其中发生变性的加热块(1605)与其中发生退火和pcr的冷却块(1606)之间游走。在第一次后每当囊泡游走至冷却块(1606)时,发生pcr扩增。
在离开数字pcr站(1604)后,囊泡移动经过额外的试剂储器(1607)以便任选地添加更多试剂(例如,缓冲液、错误校正组分,等等),然后继续前进至另一个任选的混合室(1608)。然后,囊泡继续前进至任选的储存场所(1609)。在多于一个的核酸分子待装配成更大分子的情况下,用于装配的独个核酸分子常常将会在不同的时间抵达储存场所(1609),并且将会需要隔离一段时间直至其他组分抵达。
然后,核酸分子继续前进至另一个数字pcr站(1610),并且再次在冷却块与加热块之间循环。错误校正反应可以在数字pcr站(1610)中发生。最后,将经装配的核酸分子运输至界面出口(1611)以进行收集,并且将废弃材料(例如,载体油)收集在废物储器(1612)中。
图16中所呈现的类型的系统可以同时加工多个样品。这些样品可以被隔离在载体油之间,并且连续地通过该系统进行运送。图16的方框图未显示计算机系统、光学部件、阀门和其他与系统自动化有关的部件。可以使用光学元件以及其他元件(例如,电气元件)来记录在该流动系统中试剂囊泡和各种点的位置和鉴定。这些试剂囊泡通常将会包含具有预定的序列的核酸分子。因此,本发明包括用于同时加工(例如,顺次加工)多个样品的方法。
模块4
在分离和处理之后,可以通过使用本文所描述的或本领域已知的方法来进一步将经装配的核酸分子移植到受者细胞中。可以使用的方法包括原生质体和原生质球融合、接合转移(例如,细菌接合)、病毒感染、电穿孔和由仙台病毒介导的细胞融合。因此,本发明包括用于将合成的和/或经装配的核酸分子转移至细胞的方法。
用于产生酵母原生质体融合的一种方法陈述在nakazawa和iwano,efficientselectionofhybridsbyprotoplastfusionusingdrugresistancemarkersandreportergenesinsaccharomycescerevisiae,j.biosci.bioeng.98:353-358(2004)中。进一步地,已经开发出了用于原核和真核细胞的融合的方法(参见例如,gyuris和duda,high-efficiencytransformationofsaccharomycescerevisiaecellsbybacterialminicellprotoplastfusion,mol.cell.biol.6:3295-3297(1986)。诸如这些的方法可以在本发明的实践中使用,以在细胞之间转移核酸分子而不将核酸分子暴露于细胞外环境。可以使用的其他方法包括天然感受态、生物射弹枪、电穿孔、由杆状病毒介导的转导和iii型分泌系统。
示例性的移植实验方案描述在pct公开wo2011/109031中。一种用于将来自供者的支原体(mycoplasma)基因组移植到支原体受者的方法由lartigue等人,genometransplantationinbacteria:changingonespeciestoanother,science317:632(2007)进行了描述。该工作涉及通过经由使用由聚乙二醇介导的转化而以裸dna施行基因组移植,用来自另一个物种的基因组完全代替细菌细胞的基因组。所得的受者细胞在表型上与供体菌株是相同的。此类方法可以用于将通过本发明的方法构建出的经装配的核酸分子转移至受者细胞。
通常地,将会基于其支持从经装配的核酸分子进行的基因表达的能力来选择受者细胞。例如,在已经在具有合适的遗传操作系统的真核宿主细胞(例如,酵母)中装配了细菌基因组后,那么可能需要或希望将基因组移植回细菌受者细胞中。除了其他因素外,翻译和转录方面的差异以及不同的密码子使用尤其可以阻止供者基因产物在宿主细胞中的表达。因此,受者细胞可以是与供者细胞或生物相同的物种或相似的物种。在许多情况下,受者细胞将会是与供者相同的目或界。但是,在需要在不相关的细胞类型中进行表达的情况下,最初的基因设计可以包括密码子和序列优化策略以允许在不同的受者细胞中的表达。
在琼脂糖塞子中分离供者核酸后,可以任选地去除宿主dna(例如,通过消化和/或电泳),和任选地用甲基转移酶和/或蛋白酶进行处理。
可以使琼脂糖塞子融化,例如通过与β-琼脂糖酶i(newenglandbiolabs)一起进行温育,如在pct公开wo2011/109031的实施例3a(ii)(b)中所描述的那样。
移植可以在聚乙二醇(peg),例如peg-6000或peg-8000或者其他peg存在下进行,以促进转化。可以变换peg的来源、数量和大小以确定最佳的peg。在一个例子中,所述peg为peg-2000、peg-4000、peg-6000、peg-8000、peg-10000、peg-20000,等等。取决于移植的条件,peg的浓度可以变化;浓度包括,例如处于或大约5%或者处于或大约10%的那些。例子描述在pct公开wo2011/109031的实施例3a(ii)(c)中。可以在轻轻摇动以进行混合的情况下,在peg存在下,向受者细胞添加经融化的塞子。让细胞恢复,进行离心,并使其在包含合适的选择培养基的培养基中进行生长,以选择包含经移植的供者核酸的受者细胞。在一个方面,将细胞在培养基上进行铺板,并使其在对于受者细胞类型来说合适的条件下进行生长直至集落出现。可以挑取集落,并使其在选择培养基中进一步进行生长以产生所希望的数量的包含经移植的基因组或其他供者核酸的受者细胞。
在需要时,可以保持特定的受者细胞与供者核酸的比例。在一个例子中,可以保持处于或大约107个受者细胞/2μg基因组dna至处于或大约108个受者细胞/2μg基因组dna的比例。所提供的移植方法可以用于得到大约30个转化体/200ng内源基因组dna,或500至1500个移植物/反应,或者其他合适的从宿主或供者细胞获得的量。在一个非限制性的例子中,用107个受者细胞、20皮升的包含100ng/μl的供者基因组的经融化的琼脂糖塞子来进行移植。将会理解,取决于细胞类型,受者细胞与供者核酸的比例可以变化;并且可以使用经验评估来优化该比例。
包含经移植的供者核酸的受者细胞的选择可以通过许多手段来施行。例如,经移植的供者核酸可以包含正选择标记,其将会允许它在受者细胞中进行维持。此外,可以在受者细胞基因组中引入反选择标记,以允许针对保留这些核酸分子的细胞进行选择。如果想要包含经移植的供者核酸而非原始的受者细胞基因组的经改造的受者细胞,那么可以采用正选择和反选择的组合。
进一步地,在一些实施方案中,可以将众多(例如,两个、三个、四个、五个等)供者核酸分子(例如,来自不同生物的基因组)引入到单个宿主细胞中。例如,可以产生包含两种不同生物的基因组(例如,来自不同物种的两个支原体基因组)的二倍体酵母菌株,通过使两个不同的单倍体菌株(每个携带所述基因组之一)进行杂交。使单倍体酵母菌株杂交可以通过使用众所周知的方法来进行。
可以在各自单倍体菌株中使用多个不同的选择标记,以允许在杂交后选择出包含两个基因组的细胞。例如,可以将his3和trp标记分别引入到携带不同基因组的两个不同的单倍体细胞中,随后在缺乏组氨酸和色氨酸的培养基上选择二倍体细胞,如在pct公开wo2011/109031的实施例中所描述的那样。
可以将经装配的核酸分子用于许多目的。例如,在许多情况下,将会希望将此类分子引入到细胞中以为了特定的应用。经装配的核酸分子的组分和其中引入它们的细胞将会随特定的应用而变化。
应用的一个举例说明是原核生产细胞系,对于其而言经装配的核酸分子代表整个基因组。该基因组可以设计为最小功能性,其中表现出/不存在下列特征:
1.缺乏经历接合或交配的能力(安全特征);
2.缺乏合成关键营养物的能力(安全特征);
3.保持高的能量负荷(生产效率特征);
4.用于产生所希望的终产物的途径(生产特征)。
尽管在通过本发明的方法产生的细胞中包括或从通过本发明的方法产生的细胞中排除的特征可以很大地变化,但是在许多情况下,将会包括安全特征以防止生物的“逃跑”,并限制所述生物将性状转移给其他生物的能力。可以包括生产特征以为了具体应用而对生物进行适应调整。该适应调整可以以用“底盘”生物目前不可能的方式进行精细微调。“底盘”生物是具有所希望的应用的许多特征但需要修饰以使它完全适合的生物。通常地,该修饰由于下列原因而产生:(1)一个或多个基因和/或途径的失活;和/或(2)一个或多个基因的引入。在一些情况下,可以将经装配的核酸分子引入到“底盘”生物中,其中具有或没有“底盘”生物基因组的最终去除。
受者细胞可以为例如,细菌细胞、酵母细胞、真菌细胞、昆虫细胞、哺乳动物细胞、植物细胞或藻类细胞。
本发明包括用于产生被设计用于获得所希望的终产物的高水平生产的核酸分子(例如,独个编码元件、基因组等)的方法,以及所述核酸分子本身和其中引入这些核酸分子的生物。使用氨基酸生物合成用于举例说明的目的,许多生物可以自己产生赖氨酸,但以有限的量。在许多情况下,l-天冬氨酸是关于l-赖氨酸生产的起始化合物。进一步地,可以作为天冬氨酸至赖氨酸的转化的一部分而产生的氨基酸包括l-苏氨酸、l-甲硫氨酸和l-异亮氨酸。进一步地,许多酶参与天冬氨酸至赖氨酸的转化,经常以天冬氨酸激酶开始。正如对于本领域技术人员来说将会是显然的,还可以改变与l-赖氨酸的合成相关的途径,以为了l-苏氨酸、l-甲硫氨酸和/或l-异亮氨酸的高水平生产。参与l-赖氨酸、l-苏氨酸、l-甲硫氨酸和l-异亮氨酸的产生的酶陈述在u.s.专利号7,323,321(其全部公开内容通过提及而并入本文)中。
可以采用途径改造来在代谢途径中的特定点处引入组成型、诱导型和阻抑型启动子,以驱动生产朝向所设计的终产物(例如,l-赖氨酸)。经常将会以这样的方式采用途径改造,即允许将细胞的细胞资源(例如,能量负荷、营养物)的方向导向两个功能:(1)细胞生长/分裂;和(2)终产物产生。因此,在一些实施方案中,本发明包括用于设计和构建细胞的方法,以及细胞本身,所述细胞将细胞资源引导到两个功能上去:(1)细胞生长/分裂;和(2)终产物产生。
本发明的细胞可以被设计成不参与正常与野生型细胞相关的活动。这些活动之一是交配。交配消耗细胞资源并促进基因传播。在许多情况下,交配的这些效应中没有一个将会是希望的。进一步地,在一些情况下,交配导致孢子形成。孢子形式化对于生物的储存来说可能是希望的,但是,在许多情况下,如果希望孢子形成,那么可以将交配基因置于严密的调节控制之下或者在载体上接受指导。
在一些实施方案中,本发明包括被设计和构建成具有最小基因组以为了所希望的目的的细胞。作为例子,dna复制、转录和翻译消耗细胞资源。因此,一种用于提供有效的细胞资源引导的方法是设计和/或使用具有最小基因组的细胞。
关于细胞分裂,如果对于细胞功能来说所需要的基本分子降低至低于某些水平,那么细胞生长和分裂通常将会受到影响。再次使用氨基酸生产用于举例说明的目的,当赖氨酸是所希望的终产物时,存在至少三种选择来提供用于细胞代谢的合适浓度的苏氨酸、甲硫氨酸和异亮氨酸:(1)允许通过备选途径来产生这些氨基酸;(2)使用允许作为赖氨酸生产的副产物而稍许产生这些氨基酸的启动子;和(3)外源地供应这些氨基酸。
因此,本发明包括用于细胞的途径改造的方法,此类方法包括:
(a)合成众多核酸分子,其中以微量制备每个核酸分子;
(b)将一些或所有存在于在(a)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;和
(c)将所述众多更大的核酸分子进行装配,从而形成编码至少两种表达产物的核酸分子,
其中所述至少两种表达产物中的至少两种处于相同的将起始化合物(例如,l-天冬氨酸)转化为所希望的终产物(例如,l-赖氨酸、l-异亮氨酸等)的生物学途径中。
本发明的各种不同的实施方案包括用于细胞的途径改造的由计算机施行的方法。这些方法可以通过执行在计算机可读的介质上所编码的指令而由处理器来施行。根据各种不同的实施方案,所述指令可以用于下列步骤:
(a)合成众多核酸分子,其中以微量制备每个核酸分子;
(b)将一些或所有存在于在(a)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;和
(c)将所述众多更大的核酸分子进行装配,从而形成编码至少两种表达产物的核酸分子,
其中所述至少两种表达产物中的至少两种处于相同的将起始化合物(例如,l-天冬氨酸)转化为所希望的终产物(例如,l-赖氨酸、l-异亮氨酸等)的生物学途径中。
本发明的技术的一个应用在于生物燃料生产。在许多情况下,这涉及将碳源转化为生物燃料或生物燃料前体。生物燃料或生物燃料前体可以广泛地变化,如适合于其生产的细胞所做的那样。在许多情况下,用于生产生物燃料或生物燃料前体的细胞将会是藻类细胞或植物细胞。可以在本发明的这个和其他方面中使用的示例性的藻类包括:鱼腥藻属物种(anabaenasp.)、雷氏衣藻(chlamydomonasreinhardtii)、小球藻属物种(chlorellasp.)、小环藻属物种(cyclotellasp.)、紫色粘杆菌(gloeobacterviolaceus)、微拟球藻属物种(nannochloropsissp.)、节球藻属物种(nodulariasp.)、念珠藻属物种(nostocsp.)、原绿球藻属物种(prochlorococcussp.)、聚球藻属物种(synechococcussp.)、颤藻属物种(oscillatoriasp.)、节旋藻属物种(arthrospirasp.)、鞘丝藻属物种(lyngbyasp.)、杜氏藻属物种(dunaliellasp.)和集胞藻属物种(synechocystissp.)。
许多植物物种可以从单个的或小数目的植物细胞来进行培养。因此,可以产生在大多数(如果不是全部)其细胞中包含经装配的核酸分子的植物。可以在本发明的这个和其他方面中使用的示例性的植物包括:玉米、大豆、油菜、甘蔗、芥菜、柳枝稷和麻风树。
生产生物燃料、生物燃料前体和相关化合物的应用对于包括下列方面的应用可以是有用的:空间加热,照明,烹饪,以及汽车发动机和发电机的运转。
示例性的生物燃料和生物燃料前体包括具有大于3个碳原子直至21个碳的正链醇(醇基团-oh附着至末端碳)。可以通过本发明的方法来生产的正链醇包括:正丁醇、正戊醇、正己醇、正庚醇、正辛醇(辛醇)、正壬醇(壬醇)、正癸醇(癸醇)、正十二烷醇(月桂醇)、正十五烷醇、正十六烷醇(鲸蜡醇)、正十四烷醇(肉豆蔻醇)、顺9-十六碳烯-1-醇(棕榈醇)、正十八烷醇(硬脂醇)、9e-十八碳烯-1-醇(反式十八烯醇)、顺-9-十八碳烯-1-醇(油醇)、9z,12z-十八碳二烯-1-醇(亚油醇)、9e,12e-十八碳二烯-1-醇(反式亚油醇)、9z,12z,15z-十八碳三烯-1-醇(亚麻醇)、9e,12e,15e-十八碳三烯-1-醇(反式亚麻醇)、12-羟基-9-十八碳烯-1-醇(蓖麻油醇)和1-二十烷醇(花生醇)或其组合。正链醇可以是饱和的或不饱和的。
正丁醇可以通过微生物发酵产生,化学合成,或者通过细菌作用(例如,通过本发明的方法产生的经改造的细菌)从植物来源获得。这包括从包含纤维素的植物,从包含木质素的植物,从污水和动物排泄物,从由植物来源获得的糖,通过涉及藻类(例如,通过本发明的方法产生的经改造的藻类)的发酵来获得丁醇。也可以以相似的方式获得高级醇。
本发明还可以用于生产化学中间体。此类中间体的例子为1,4-丁二醇和1,3-丙二醇。1,4-丁二醇是一种双官能醇,其在化学工业中具有广泛的用途。作为例子,丁二醇及其衍生物用于塑料、聚氨酯类、溶剂、电子化学品和弹性纤维的生产。1,4-丁二醇合成途径陈述在burk,internationalsugarjournal112:30-35(2010)中。因此,本发明包括为了生产化学中间体(例如,1,4-丁二醇、1,3-丙二醇等)或为了增加化学中间体的生产而进行改造的细胞,以及用于设计和产生此类细胞的方法。
另外的应用
正如本领域技术人员将会理解的,核酸分子以微量(例如,飞摩尔至纳摩尔的量,例如大约0.001飞摩尔至大约1.0纳摩尔、大约0.01飞摩尔至大约1.0纳摩尔、大约0.1飞摩尔至大约1.0纳摩尔、大约0.001飞摩尔至大约0.1纳摩尔、大约0.001飞摩尔至大约0.01纳摩尔、大约0.001飞摩尔至大约0.001纳摩尔、大约1.0飞摩尔至大约1.0纳摩尔、大约1.0飞摩尔至大约0.1纳摩尔、大约1.0飞摩尔至大约0.01纳摩尔、大约1.0飞摩尔至大约0.001纳摩尔、大约10飞摩尔至大约1.0纳摩尔、大约10飞摩尔至大约0.001纳摩尔、大约20飞摩尔至大约1.0纳摩尔、大约100飞摩尔至大约1.0纳摩尔、大约500飞摩尔至大约1.0纳摩尔、大约1纳摩尔至大约800纳摩尔、大约40纳摩尔至大约800纳摩尔、大约100纳摩尔至大约800纳摩尔、大约200纳摩尔至大约800纳摩尔、大约500纳摩尔至大约800纳摩尔、大约100纳摩尔至大约1,000纳摩尔等)产生。
本发明可以用于制备微阵列。此类微阵列可以以多种方式产生,包括通过将核酸分子沉积在支持物(例如,固体支持物,例如平面固体支持物)上或通过直接在支持物上合成核酸。在一个实施方案中,可以修饰图2a-2b中所显示的平板,从而将基底/底部设计成用于在其表面上合成核酸。任选地,可以将基底构造成可移动的,以产生例如平面微阵列。在大多数此类情况下,在核酸合成过程中将会省略图2a-2b中所显示的珠粒。因此,本发明包括用于产生微阵列的方法。
用于打印微阵列的方法陈述在u.s.专利号5,807,522和7,211,148(其公开内容通过提及而并入本文)中。此类方法可以在本发明的实践中使用以产生例如微阵列,通过使如本文所描述的那样产生的核酸分子沉积。
本文所描述的方法的一个优点是其模块性。作为例子,可以在与阵列相同的平板上产生形成不同的更大的核酸分子的亚部分的核酸分子。因此,本发明的方法允许同时产生核酸分子,随后为选择独个的合成的核酸分子用于以后的过程(例如,汇集、切割、去保护和装配)。因此,本发明的方法包括那些方法,其中同时产生(例如,化学合成)核酸分子,随后装配成两个或更多个(例如,二至十个、三至十个、四至十个、五至十个、二至三十个、五至三十个、十至三十个、五至五十个等)更大的核酸分子。
在某些实施方案中,通过本发明的方法合成的核酸分子或众多核酸分子可以是引物和/或探针。引物和/或探针可以通过使用例如本文所描述的固体支持物以微量产生。引物引发可以为扩增反应的一部分的核酸延伸反应。探针用于检测靶核酸序列。因此,在检测方法中使用探针来直接或间接地检测靶核酸序列。引物和探针通常具有与靶核酸序列杂交或者与靶核酸序列结合的预定的核苷酸序列。在举例说明性的实施方案中,探针包括标记物,例如荧光标记物。例如,可以将控制机构与在本发明的方法中所使用的固体支持物或固体支持物阵列相连接,其中将靶核苷酸序列输入到控制机构中。所述控制机构可以用于指导添加用于核酸合成的反应物的顺序,从而合成具有靶核苷酸序列的核酸分子。
由于它们与靶核酸序列共享的序列同一性,探针和引物与靶核酸序列杂交或者与靶核酸序列结合。例如,引物或探针可以与靶核酸序列共享80、85、90、95、96、97、98、99、99.5或100%的连续序列同一性。引物和探针与其靶核酸序列在严紧和通常高严紧条件下进行杂交,正如本领域所已知的那样。
可以将标记物附着至本发明的引物和/或探针的5’末端核苷酸、3’末端核苷酸或任何内部核苷酸。在某些举例说明性的实施方案中,标记物为荧光团。大批的荧光团是本领域技术人员已知的,并且可以包括在本发明的方法和组合物中。参见例如cardullo等人,proc.natl.acad.sci.usa85:8790-8794(1988);dexter,d.l,j.ofchemicalphysics21:836-850(1953);hochstrasser等人,biophysicalchemistry45:133-141(1992);selvin,r,methodsinenzymology246:300-334(1995);steinberg,i.,ann.rev.biochem,40:83-114(1971);stryer,l.,ann.rev.biochem,47:819-846(1978);wang等人,tetrahedronletters31:6493-6496(1990);wang等人,anal.chem.67:1197-1203(1995)。例如,所述荧光团可以为biosearchblue、fam、tet、calfluor染料、joe、vic、hex、quasar染料、cy染料、ned、tamra、rox、德克萨斯红或pulsar染料。这些染料和包括这些染料的核酸合成反应物是商购可得的,例如,从biosearchtechnologies,inc.、glenresearch或lifetechnologies。
在举例说明性的实施方案中,通过本文所提供的方法而合成的引物为pcr引物。在某些实施方案中,用标记物在其5’末端或3’末端对引物进行标记。例如,引物可以为lux引物、蝎形引物、amplifluor引物和/或plexor引物。
在某些实施方案中,本发明提供了用于合成众多引物和探针组(例如,对)的方法。所述引物和探针组(例如,对)可以通过使用本文所描述的平板(例如,图2a-2b中所显示的一般形式的平板)以微量产生。所述引物和探针组(例如,对)包括一个或多个引发延伸反应的引物,所述延伸反应产生核酸延伸产物,所述核酸延伸产物为关于所述引物和探针组(例如,对)的一个或多个探针的靶核酸序列。换言之,在引物和探针组(例如,对)中,探针通常与通过所述引物而产生的扩增产物相结合。在举例说明性的实施方案中,所述引物和探针组(例如,对)包括pcr引物对以及与通过使用所述引物对的扩增反应而产生的扩增产物相结合的探针。例如,所述引物和探针组(例如,对)可以包括两个pcr引物以及一个5’核酸酶探针或一个分子信标探针,其与当在pcr反应中使用所述pcr引物时所产生的扩增产物相结合。
如上面所指明的,本发明的方法可以产生核酸分子(例如,引物、探针和/或引物和探针组(例如,对))的阵列。例如,可以在这样的位置阵列中合成核酸分子,从而每个位置包括一个或众多核酸分子例如引物、探针和/或引物和探针组(例如,对)。阵列可以以100、200、250、500、1000、10,000、100,000、1,000,000或10,000,000/cm2的密度包括引物、探针以及引物和探针组(例如,对)。在通过使用本发明的方法而产生的核酸分子阵列中的核酸分子总数目可以包括,例如100、200、250、500、1000、10,000、100,000、1,000,000、10,000,000、100,000,000、1,000,000,000或10,000,000,000个引物、探针和/或引物和探针组(例如,对)。可以在阵列位置中包括多于一个的引物和探针组(例如,对),从而所述引物和探针组(例如,对)被设计成施行多重反应,例如多重pcr反应。
本发明的探针可以用单个染料(例如,单个荧光团)进行标记。本发明的探针可以为fish探针。
本发明的探针可以是在扩增反应中使用的探针。例如,这些探针可以是经双重标记的探针。在某些举例说明性的实施方案中,经双重标记的探针包括这样的标记物,其是给体-受体能量转移对,例如fret对。当给体(荧光团)是利用给体-受体能量转移的探针的组分时,优选地如此选择本发明的给体发荧光的部分和猝灭剂(受体),从而所述给体和受体部分在当给体部分被激发时展现出给体-受体能量转移。在选择荧光团-猝灭剂对中要考虑的一个因素是在它们之间给体-受体能量转移的效率。在许多情况下,在给体和受体部分之间fret的效率为至少10%,至少50%或至少80%。fret的效率可以容易地通过使用本文所描述的和本领域已知的方法根据经验进行测试。
在一些情况下,给体-受体对可以包括荧光团和猝灭剂。猝灭剂可以是暗猝灭剂。如此,本发明的探针可以包括bhq染料或dq染料(epoch)作为猝灭剂。在其他实施方案中,猝灭剂可以为dabcyl或tamra。
通过使用本发明的方法和系统而合成的引物和探针可以包括使核酸的杂交稳定化的部分(例如,嵌入剂、小沟结合部分、用稳定化部分(例如,炔基部分和氟烷基部分)进行修饰的碱基),和构象稳定化部分,例如在u.s.专利申请公开号2007/0059752(其公开内容通过提及而并入本文)中公开的那些。引物和探针可以包括嵌入试剂,例如吖啶。在其他实施方案中,通过使用本发明的方法和系统而合成的引物和探针可以为锁定核酸(lna)探针或肽核酸(pna)探针。
可以将通过使用本发明的方法和系统而合成的经双重标记的探针用在扩增反应例如实时pcr反应中。在举例说明性的实施例中,所述经双重标记的探针为水解探针,例如5’核酸酶探针(参见例如,livak等人,pcrmethodsappl.,4:357-562(1995);和u.s.专利号5,538,848)、分子信标(参见例如,mhlanga,methods,25:463-472(2001)),蝎形探针(参见例如,saha,j.virol.methods,93:33-42(2001)),或杂交探针(参见例如,u.s.专利号7,670,832)。在某些实施方案中,将本发明的引物和探针用在数字扩增反应例如数字pcr反应中。
通过本发明的方法合成的引物的长度可以为5至50个核苷酸,和典型地为10至30个和更典型地为15至30个核苷酸。本发明的探针的长度可以为5至100、10至50、10至30或15至30个核苷酸。
本发明的方法可以利用本领域中已知用于合成包括一个、两个或更多个标记物(例如,荧光标记物)的核酸分子的一般化学和化学方法。例如,此类方法可以利用亚磷酰胺和/或经修饰而包括此类标记物的固体支持物。示例性的固体支持物例如可以包括至少一个通过连接体结合至固体支持物的猝灭剂。另外的示例性实施方案可以利用固体支持物或经亚磷酰胺官能化的部分,其使根据本发明合成的核酸分子与靶核酸分子的双链体、三链体或高等级聚集(例如,杂交)稳定化。
在某些实施方案中,将本发明的引物和/或探针用在实时pcr测定法例如基因表达测定法或基因型分型测定法(例如,snp基因型分型测定法)中。探针可以通过使用本文所提供的方法,以例如1nm至1m、1mm至1m的浓度产生。示例性的浓度可以为100mm。可以将通过本文所提供的方法产生的探针和/或尤其是引物冷冻干燥。例如,可以在反应容器例如试管或孔中冷冻干燥1-1,000,000皮摩尔的引物,或者可以在位置阵列的点上进行干燥。
在一个实施方案中,本发明提供了用于核酸合成的方法,其包括将核酸合成反应物组合在微孔内并且在该微孔内产生核酸分子。可以将微孔与控制器例如计算机处理器相连接,其中一个或多个核酸分子的核苷酸序列被输入到控制器中或者存在于控制器的计算机存储器中。可以将控制器连接至或与可以在广域网上提供的核酸分子设计和排序功能性相连通。例如,可以在互联网上提供核酸分子设计和排序功能性。
在某些实施方案中,本发明的方法包括hplc-纯化步骤。此外,本发明的方法可以在经iso和/或gmp认证的条件下进行。在一些实施方案中,核酸分子合成通过使用微孔平板来进行。
本发明的方法和仪器也可以用于制备文库。这些文库可以包含一个或多个点突变或者高度分歧的分子(例如,编码具有不同功能活性的蛋白质的核酸分子)。按照这些路线,本发明包括用于产生文库的方法,在所述文库中所有或一些文库成员是化学合成的并因此不从细胞核酸产生。可以通过本发明的方法产生的文库类型包括cdna文库、基因组文库、组合文库、点突变文库和一个或多个此类文库的组合。
如上面所指明的,在一些实施方案中,本发明包括用于产生通过使用生物信息学信息而产生的cdna文库等价物的方法,以及文库本身。使用图11中所显示的示意图用于举例说明的目的,可以根据本文所描述的方法来合成和(如果需要)装配文库。然后,可以将文库成员插入到非文库核酸分子(例如,载体、细胞染色体等)中。插入可以通过许多方式例如连接(例如,“粘性末端”连接)来促进。
本发明包括用于产生文库的方法,以及文库本身。这些文库中的一些是难以或不可能通过标准的文库产生方法来产生的类型。一个这样的类型是部分cdna文库。部分cdna文库(也称为“cdna等价物”文库)可以通过以生物信息学方式选择用于包括在文库中的特定的cdna来产生。然后,可以合成和(如果需要)装配核酸分子以形成文库。
cdna文库通常包含相应于细胞内的rna转录物的dna分子。在许多情况下,此类文库偏向于包含polya尾的转录物。在此类文库中所呈现的mrna通常包含多个相应于独个编码区的cdna。当通过剪接事件产生基因组编码区的剪接变体时,正是这样的情况。本发明允许产生具有“排除性”表现的cdna文库(以及基因组文库)。例如,由于选择核酸分子用于包括(相比于排除而言),因而可以从文库中排除相应于下列那些的dna分子:核糖体rna、珠蛋白rna、trna和指定的mrna。因此,本发明包括用于产生成员-偏爱的和排除性成员包括的cdna和基因组文库的方法,以及文库本身。
进一步地,本发明的文库包括包含指定的核酸分子的那些。例如,本发明包括用于产生cdna文库的方法,所述cdna文库包含有在通过标准方法产生的cdna文库中所呈现的成员的亚组。为了举例说明的目的,假定特定的哺乳动物细胞类型具有平均15,000个不同的mrna转录物(包括剪接变体),并且寻求使用这样的cdna文库,其包含与相应于35个不同激酶的转录物的所有已知的剪接变体相应的125个cdna分子。在另一种情况下,寻求筛选编码相同的野生型编码序列的变体的核酸分子集合。使用图12a用于举例说明的目的,在该图的顶部显示了氨基酸85至95,和野生型cdna的编码序列。氨基酸88至91代表了被预测为连接两个功能结构域的柔韧连接体的区域。在该情况下,产生了编码在位置88至91(连接体区域)处具有不同的但指定的氨基酸的蛋白质的核酸分子集合。核酸分子集合(例如,在图12a中所显示的那些)可以以许多方式产生。
一种方式通常将会是过度包括性的,因为正常地将会产生另外的核酸分子。该方法采用“脏瓶(dirtybottle)”合成。为了产生变体分子例如在图12a中所显示的那些,在特定的位置混合用于添加碱基的试剂。因此,当要添加在密码子88的第一和第二位置处的碱基时,可以使用用于添加c和g的试剂混合物。可以调整这些试剂的比例以有利于c或g添加,或者可以调整该比例从而引入等量的c和g。在该群体的一部分中,还将会产生密码子cgt(精氨酸)。
通过其可以产生核酸分子集合例如在图12a中所显示的那些的另一种方法是通过作为分开的核酸区段来合成独个变体序列。这允许仅产生编码所希望的变体群体成员的核酸分子(除了合成错误外)。
本发明还包括相比于野生型分子而言具有密码子改变的独个核酸分子和核酸分子集合,以及用于产生此类分子的方法。在一些方面,产生密码子经改变的文库,其中所述集合中的核酸分子的一些或全部(在许多情况下,全部或大多数)相比于天然野生型编码序列而言是密码子经改变的。这显示了本发明的方法相对于标准文库构建方法而言的一个重大的优点。用标准文库构建方法,从天然出现的核酸分子(例如,基因组dna、mrna等)来构筑文库。本发明的方法允许通过使用生物信息学信息来有效地构建文库。结果是,在所产生的任何集合中的独个核酸分子可以以“经适应调整的”核苷酸序列来产生。
使用图12b用于举例说明的目的,可以产生包含不同的关于相同编码序列的密码子的核酸分子集合,然后就所希望的特征(例如,增加或降低的表达水平)进行筛选。当蛋白质过表达对于其中产生该蛋白质的细胞或宿主生物有害时,降低的表达水平可能是希望的。因此,可以使用密码子选择作为表达调节机制。
本发明的方法还可以用于产生用于多重扩增(例如,pcr)的大量的引物。典型地,此类引物的长度将会为15至100(例如,15至90、25至90、25至80、25至70、25至60、25至50、30至90、30至60等)个核苷酸。进一步地,引物还可以包含条形码以便允许给扩增出的核酸分子加标签,以例如用于以后的鉴定以及在合成运行期间和之后引物和引物对的追踪。
在一些情况下,将会产生500至50,000个、1,000至50,000个、2,000至50,000个、5,000至50,000个、5,000至40,000个、5,000至30,000个、5,000至100,000个、5,000至300,000个、5,000至500,000个、5,000至1,000,000个、5,000至5,000,000个、10,000至100,000个、10,000至500,000个、10,000至800,000个、20,000至100,000个、20,000至500,000个等的引物对。
本发明包括制备可以在诸如lifetechnologycorporation的ampliseqtm产品(参见例如,目录编号4472395)之类的过程中使用的引物。诸如此类的产品采用多重pcr来扩增特定的核酸分子。然后,扩增出的核酸分子可以用于下游过程例如测序中以鉴定存在于起始样品中的核酸。在一些情况下,将经修饰的核酸碱基和/或通常不与dna相关联的天然碱基(例如,脱氧尿苷)作为“第五(或更大)个瓶”合成地掺入到引物序列中,从而将特殊的特性赋予独个引物和/或引物组,以便在测序之前促进扩增出的产物的下游加工,或者进一步地从而以加条形码的方式赋予独个引物和/或引物组以编码,以便促进和解决通常从样品混合物中的复杂的序列分析。
因此,本发明提供了用于产生引物汇集物的方法,以及引物汇集物本身。引物汇集物可以用于扩增rna和/或dna群或亚群。作为例子,可以产生这样的引物汇集物,其允许扩增出代表了细胞的整个核基因组、单个核染色体、一组核基因或区域(例如,一组染色体座位)、线粒体基因组或叶绿体基因组以及其组合的基因组dna。因此,本发明包括用于特定应用(例如,上面刚刚陈述的应用)的引物的生物信息学设计。
本发明还提供了用于产生用于扩增特定rna群的引物工具的方法。在本发明的一个实施方案中,引物汇集物被设计成扩增所有的mrna分子,或者扩增由细胞所产生的mrna分子的亚群(例如,编码激酶、磷酸酶等的mrna),但任选地不扩增其他rna分子(例如,trna、rrna、hnrna等)。然后,这样的引物工具可以用于表达分析(例如,测量在各种条件下的表达水平)。表达分析可以通过使用例如微阵列或测序平台来进行。因此,本发明包括表达分析方法。在一些实施方案中,这样的方法包括一个或多个下列步骤:(a)以生物信息学方式设计引物汇集物;(b)合成所述引物汇集物的引物对;(c)使所述引物汇集物与源自包含核酸(例如,mrna)的细胞的样品接触;(d)扩增所述样品中的与引物对相应的核酸分子;和(e)分析所得的扩增出的核酸分子。
由于在许多样品中rrna的丰富性,相应于rdna的核酸分子的减少或去除在许多表达分析应用中是所希望的。其他rrna扩增减少方法陈述在u.s.专利公开号2008/0187969(其公开内容通过提及而并入本文)中。
本发明还包括用于另外的应用(例如,鉴定基因组核酸中的突变的多重方法)的上述分案的变化形式。因此,本发明进一步包括用于鉴定突变(包括癌症筛选)的方法和组合物。
本发明包括用于产生各种数目的引物(在许多情况下,以引物对形式)的方法。可以通过本发明的方法作为分开的实体和/或以混合的群体来制备的引物的数目在下列范围内变化:5至500,000、500至500,000、1,000至500,000、5,000至500,000、10,000至500,000、20,000至500,000、30,000至500,000、5,000至250,000、5,000至100,000、5至5,000、5至50,000、5,000至800,000、5,000至1,000,000、5,000至2,000,000、10,000至2,000,000、20,000至1,000,000、30,000至2,000,000等。
因此,本发明提供了用于确定的引物组的快速设计、构造和合成的方法,所述引物组用于特异地测定用于各种各样的分析、样品设置和实验设计的区域的遗传组成和表征。本发明的该方面部分地是使用生物信息学连同本文所描述的核酸分子合成方法一起的结果。特别地,已经对相当大数目的基因组的完整序列进行了测序。该序列信息,与本文所描述的核酸合成方法(以及其他方法)相组合,允许详细的基因组和转录物组分析。多重方法,例如上面所陈述的那些,为施行此类分析提供了一种手段。
代表性的实施方案
本发明的许多变化形式是可行的,并且可以用于取得所希望的结果。可以将许多这样的变化形式导向设计特征。在一些情况下,这样的设计特征可以为了操作者方便和/或成本节省(例如,减少的试剂使用)而进行使用。
图9显示了可以在本发明的特殊实施方案中使用的电线圈的一个实施方案。此类线圈的许多变化形式(其中的许多在本文别处作了描述)可以用于本发明。
可以以下列示例性结构和操作参数来设计电线圈例如图9中所显示的那种:最大电流密度3amps/mm2,双层扁平线圈,线材横截面5×2μm,10匝,内径(di)~10μm,外径(da)~180μm,和线材长度~6mm。
表6
图9和表6显示了可以在晶片上建立起来的扁平双层线圈的示例性规格。可以对线圈例如在图9中所显示的那种进行设计,从而使得与在合成平台中的每个孔相接触。进一步地,磁场的产生可以用于从合成位点(例如,孔)提升珠粒。示例性的磁场强度/磁通量密度数字显示在表6中。可以使用fem-程序例如comsol(www.comsol.com)来计算用于特定系统和型式的参数。
可以在用于本发明的各种不同方面的电极中使用的几种材料以及与这些材料相关的特性陈列在表7中。电极材料的选择将会由许多因素(包括成本以及各种设计规格和功率要求)来决定。
表7
将会对在本发明的实践中所使用的电极(例如,电线圈)进行设计,以便满足它们所用于的特定应用。作为例子,当使用电极来产生ega时,通常将会在牢记下列方面的情况下来设计它们:(1)施加(例如,局部施加)足够的电流以允许在指定的时间段内产生有效量的ega;(2)限制与电流的施加相关的发热。因此,通常将会希望限制所使用的电流量以达到1.0的局部ph,其中添加很少的过量电流。表8提供了用于以特定的孔参数来达到这一点的计算。进一步地,在下面所陈述的孔中ph1的产生将会需要施加727pa的电流大约1秒钟。这导致在工作电极上115a/m2的电流密度。
电极的形状可以很大地变化,并且可以是图9中所显示的线圈、盘、薄膜等。进一步地,在本发明的实践中所使用的电极可以由许多化合物构成,包括铂、钯、铜、金、铝、铌、氧化铌、钨、钛、钽、钼、镍、铂、银、锰、钕、碳和硅,以及合金材料或包含一种或多种上面所描述的元素以及其他元素的复合材料。
图10显示了本发明的示例性的仪器形式。该图显示了两个泵(1000),所述两个泵递送流体以及在合适时递送气体通过管(1001)至流体通道(1002),其在顶部与平板(1007)相邻。将被递送至该仪器的流体移动通过排液通道(1003)至通向废物收集处(1005)的排液管(1004)。将泵(1000)连接至流体储器(未显示)或在合适时气体储器,和调节将什么流体或气体递送至该仪器的控制装置(未显示)。
所述控制装置还调节流体或气体接触核酸合成“芯片”(1006)的时间长度。在图10中可见三个核酸合成“芯片”(1006),其靠置在电极(1008)上。使流体和/或气体与芯片相接触,并且电流通过芯片上的特定位置,在那里希望发生化学反应。正如本文别处所描述的,许多试剂和洗涤材料可以在本发明的实践中使用。在许多情况下,所使用的试剂和材料将会是允许产生核酸分子的那些。
下面的电极(1008),如在图9中所显示的,覆盖该仪器的整个底部。这并不不是必需的情况,并且一个或多个电极可以与每个孔或多于一个的孔的一端相关联。在该电极(在图10中作为下面的电极(1008)所显示的)对面,通常将会存在一个或多个第二电极(在图10中未显示),其允许电流流过整个芯片或流过芯片的孔。在许多情况下,这些第二电极将会置于芯片的独个孔之上,以允许指导电流在独个基础上通过所述孔(参见图2a-2b)。
流体通道(1002)可以在表面层中形成。所述表面层可以由聚合材料、无机材料或其组合形成。例如,所述表面层可以由聚合材料形成。示例性的聚合材料包括丙烯酸类聚合物、含氟聚合物、乙烯-乙酸乙烯酯(eva)或其任何组合。在一个例子中,所述聚合材料为含氟聚合物。示例性的含氟聚合物包括聚偏二氟乙烯(pvdf),聚氟乙烯(pvf),氟化乙烯-丙烯(fep)共聚物,乙烯-氯三氟乙烯(ectfe)共聚物,四氟乙烯、六氟丙烯和偏二氟乙烯(thv)的共聚物,四氟乙烯和全氟甲基·乙烯基醚(pfa或mfa)的共聚物,在其主链中具有氟化氧杂环戊烷的含氟聚合物,全氟醚,或其任何组合。特别地,所述含氟聚合物可以为在其主链中具有氟化氧杂环戊烷的含氟聚合物,例如cytop。进一步地,所述聚合物涂层可以是无定形的,其展现出很少的结晶性或不展现出结晶性。在另一个例子中,所述表面层由无机绝缘体形成。例如,所述无机绝缘体可以包括硅、铝、铪、钽、锆的氧化物或者其任何组合,可以包括四原硅酸盐,可以包括硅的氮化物,或者可以包括其任何组合。在一个例子中,所述无机绝缘体可以包括硅的氧化物。在另一个例子中,所述无机绝缘体包括硅的氮化物。
所述表面层可以具有在0.3微米至10微米的范围内,例如在0.5微米至6微米的范围内的厚度。
在本发明的实践中所使用的独个孔可以具有许多形状和大小。孔参数的一个例子陈列在表9中。当然,孔体积和其他因素将会随孔尺寸而改变。
表9:示例性的圆柱形孔参数
表10
表10显示了一些珠粒参数,并且估计了关于特定珠粒大小的缓冲液体积和浓度。
在核酸分子产生步骤完成后,可以收集包含核酸分子的基质(例如,珠粒),将其与合成基质分开,并且进一步进行加工。
示例性的工作流程为诸如下面的那一个:(1)用官能基团(羟基或氨基)来准备珠粒;(2)分批离线地用预先合成的通用引物使珠粒衍生化,从而形成酰胺,所述通用引物具有用于从珠粒上酶促切割下合成的核酸分子的罕见的iis型限制位点;(3)通过使悬浮液流入芯片来对珠粒进行负载,电流的施加将珠粒关牢在孔中;(4)经负载的珠粒与正极处于物理接触或者接近物理接触,并且在正极处和在珠粒表面上产生ega以用于去保护;(5)施行本文所描述的合成步骤;(6)在合成后,通过反转电流来实现所希望的珠粒从孔中的数字电逐出;(7)从流出芯片的液体中收集和汇集被逐出的珠粒;和(8)将其他珠粒保持在孔中直至稍后以最初的正极/负极方向施加弱的电流。
本领域技术人员将会认识到,通过使用硬件、软件、固件或其组合(在合适时),可以施行各种不同的实施方案的操作。例如,一些过程可以通过在软件、固件或硬连线逻辑的控制之下使用处理器或其他数字电路系统来进行。(本文中的术语“逻辑”是指固定的硬件、可编程的逻辑和/或其合适的组合,正如将会被本领域技术人员认可用于施行所述的功能的)。可以将软件和固件存储在计算机可读的介质上。一些其他过程可以通过使用模拟电路系统来实施,正如本领域普通技术人员所熟知的。另外,在本发明的实施方案中可以使用存储器或其他存储体,以及通信部件。
图15是图解说明可以用于根据各种不同的实施方案来施行处理功能性的计算机系统(1500)的方框图,在该计算机系统上可以使用图5的热循环仪系统(500)的实施方案。计算机系统(1500)可以包括一个或多个处理器或控制器,例如处理器(1504)。处理器(1504)可以通过使用一般或特殊目的处理引擎例如微处理器、控制器或其他控制逻辑来实施。在该例子中,处理器(1504)与总线(1502)或其他通信介质相连接。例如,处理器(1504)可以是在上面通过参考图2a-2b而描述的电流控制器。
进一步地,应当意识到,图12的计算机系统(1500)可以具体化为许多形式,例如机架安装式计算机、主机(mainframe)、超级计算机、服务器、客户机、台式计算机、膝上计算机、平板计算机、手持式计算设备(例如,pda、蜂窝式电话、智能电话、掌上型电脑等)、群集网格(clustergrid)、上网本、嵌入式系统或任何其他类型的特殊或一般目的计算装置,如对于给定的应用或环境而可以是希望的或合适的。另外,计算机系统(1500)可以包括常规网络系统,包括客户端/服务器环境和一个或多个数据库服务器,或者与lis/lims基础设施的集成。许多常规网络系统是本领域中已知的,包括局域网(lan)或广域网(wan),和包括无线和/或有线部件。另外,客户端/服务器环境、数据库服务器和网络在本领域中是有充分文献证明的。
计算机系统(1500)可以包括总线(1502)或其他用于传递信息的通信机构,和用于处理信息的与总线(1502)相联结的处理器(1504)。
计算机系统(1500)还可以包括存储器(1506),其可以是随机存取存储器(ram)或其他动态存储器,其与总线(1502)相联结,用于存储待由处理器(1504)执行的指令。存储器(1506)还可以用于在执行待由处理器(1504)执行的指令期间存储临时变量或其他中间信息。计算机系统(1500)进一步包括只读存储器(rom)(1508)或其他静态存储设备,其与总线(1502)相联结,用于存储关于处理器(1504)的静态信息和指令。
计算机系统(1500)还可以包括非暂时性存储设备(1510),例如提供了磁盘、光盘或固态硬盘(ssd)并将其与总线(1502)相联结,用于存储信息和指令。存储设备(1510)可以包括介质驱动器和可移动存储接口。介质驱动器可以包括驱动器或其他用于支持固定的或可移动的存储介质的机构,例如硬盘驱动器、软盘驱动器、磁带驱动器、光盘驱动器、cd或dvd驱动器(r或rw)、闪存驱动器或其他可移动的或固定的介质驱动器。正如这些例子所举例说明的,存储介质可以包括已经在那里存储了特别是计算机软件、指令或数据的计算机可读的存储介质。
在备选的实施方案中,存储设备(1510)可以包括其他类似的用于允许计算机程序或者其他指令或数据加载到计算机系统(1500)中的工具。此类工具可以包括例如,可移动的存储单元和接口,例如程序盒式存储器和盒式存储器接口,可移动的存储器(例如,闪存或其他可移动的存储器模块)和存储器插槽,以及其他允许软件和数据从存储设备(1510)转移至计算机系统(1500)的可移动的存储单元和接口。
计算机系统(1500)还可以包括通信接口(1518)。通信接口(1518)可以用于允许软件和数据在计算机系统(1500)和外部设备之间转移。通信接口(1518)的例子可以包括调制解调器、网络接口(例如,以太网或其他nic卡)、通信端口(例如,usb端口、rs-232c串行端口)、pcmcia插槽和卡、蓝牙等。通过通信接口(1518)进行转移的软件和数据是以信号的形式,所述信号可以是电子信号、电磁信号、光学信号或其他能够被通信接口(1518)接收的信号。这些信号可以由通信接口(1518)经由诸如无线介质、电线或电缆、光纤或其他通信介质之类的通道进行传送和接收。通道的一些例子包括电话线、蜂窝式电话链接线路、rf链接线路、网络接口、局域或广域网和其他通信通道。
可以将计算机系统(1500)通过总线(1502)联结至显示器(1512),例如阴极射线管(crt)或液晶显示器(lcd),用于将信息显示给计算机用户。将输入设备(1514)(包括字母数字键和其他键)与总线(1502)相联结,用于将信息和命令选择传递给例如处理器(1504)。输入设备也可以是显示器,例如配置有触摸屏输入能力的lcd显示器。用户输入设备的另一种类型为光标控制器(1516),例如鼠标、跟踪球或光标方向键,用于将方向信息和命令选择传递给处理器(1504)和用于控制在显示器(1512)上的光标移动。该输入设备通常具有在两个轴(第一轴(例如,x)和第二轴(例如,y))上的两个自由度,其允许该设备指定在平面中的位置。计算机系统(1500)提供数据处理,并且提供对于此类数据的置信水平。与本教导的实施方案的某些实施相一致,响应于执行一个或多个序列的一个或多个包含在存储器(1506)中的指令的处理器(1504),由计算机系统(1500)来提供数据处理和置信值。此类指令可以被从另一个计算机可读的介质(例如存储设备(1510))读入到存储器(1506)中。包含在存储器(1506)中的指令序列的执行导致处理器(1504)实施本文所描述的过程状态。备选地,代替软件指令或与软件指令相组合地,可以使用硬连线电路系统来实施本教导的实施方案。因此,本教导的实施方案的实施并不限于硬件电路系统和软件的任何特定的组合。
本文所使用的术语“计算机可读的介质”和“计算机程序产品”通常是指任何这样的介质,其参与向处理器(1504)提供一个或多个序列的一个或多个指令以用于执行。此类指令(通常称为“计算机程序代码”(其可以以计算机程序或其他分组法的形式进行编组))在当被执行时,使得计算机系统(1500)能够施行本发明的实施方案的特征或功能。这些和其他形式的计算机可读的介质可以采取许多形式,包括但不限于非易失性介质、易失性介质和传送介质。非易失性介质包括,例如固态硬盘、光盘或磁盘,例如存储设备(1510)。易失性介质包括动态存储器,例如存储器(1506)。传送介质包括同轴电缆、铜线和光纤,包括包含总线(1502)的电线。
计算机可读的介质的一般形式包括,例如软盘,柔性盘,硬盘,磁带,或任何其他磁性介质,cd-rom,任何其他光学介质,穿孔卡,纸带,任何其他具有孔洞模式的物理介质,ram,prom,和eprom,flash-eprom,任何其他存储器芯片或盒,后面所描述的载波,或任何其他计算机可以从中进行读取的介质。
各种不同形式的计算机可读的介质可以参与将一个或多个序列的一个或多个指令携带至处理器(1504)以用于执行。例如,最初可以将指令携带在远程计算机的磁盘上。该远程计算机可以将所述指令加载到其动态存储器中,并且通过使用调制解调器经由电话线发送所述指令。计算机系统(1500)的本地调制解调器可以接收在电话线上的数据,并且使用红外传送器来将所述数据转换为红外信号。与总线(1502)相联结的红外检测器可以接收在红外信号中所携带的数据,并且将所述数据放在总线上(1502)上。总线(1502)将所述数据携带至存储器(1506),处理器(1504)从存储器(1506)中取回并执行所述指令。任选地,在由处理器(1504)进行执行之前或之后,可以将由存储器(1506)所接收的指令存储在存储设备(1510)上。
将会意识到,为了清楚的目的,上面的描述已经关于不同的功能单元和处理器描述了本发明的实施方案。然而,将会明显的是,可以使用在不同的功能单元、处理器或域之间的任何合适的功能性分布,而不对本发明有所减损。例如,在举例说明时由分开的处理器或控制器来实施的功能性可以由相同的处理器或控制器来实施。因此,对于特定功能单元的提及仅被视为提及用于提供所描述的功能性的合适的手段,而不是指明严格的逻辑或物理结构或组织。
实施方案可以符合下列的经编号的条项:
1.用于核酸分子的非模板定向合成的多孔平板,所述平板包含:
(a)至少一个位于所述平板的众多孔的每个孔中的磁性珠粒,和
(b)存在于一个或多个孔中的以电化学方式产生的酸,
其中所述珠粒的直径为0.1μm至100μm。
2.条目1的多孔平板,其中所述平板中的孔的数目为10至10,000,000。
3.前述条目中任一项的多孔平板,其中每个孔的总体积为0.1μl至50μl。
4.前述条目中任一项的多孔平板,其中每个孔可操作地与一对电极相连接。
5.前述条目中任一项的多孔平板,其中所述平板的孔与用于引入和移除试剂的微观流体通道相连接。
6.用于产生经装配的核酸分子的方法,所述方法包括:
(a)合成众多核酸分子,其中以大约0.001纳摩尔至大约1,000纳摩尔的平均量在平板的孔中制备每个核酸分子;
(b)将在(a)中产生的核酸分子进行合并,从而产生汇集物;
(c)将一些或所有存在于在(b)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;
(d)从在(c)中形成的所述众多更大的核酸分子中去除包含序列错误的核酸分子,从而产生校正了错误的核酸分子汇集物;和
(e)将在所述校正了错误的核酸分子汇集物中的核酸分子进行装配,从而形成经装配的核酸分子。
7.条目6的方法,其中(c)中的连接由聚合酶链式反应和/或连接酶来介导。
8.条目6或7中任一项的方法,其中所述经装配的核酸分子由至少五个核酸分子组成。
9.条目6至8中任一项的方法,其中所述经装配的核酸分子由五至五千个核酸分子组成。
10.条目6至9中任一项的方法,其中所述经装配的核酸分子具有至少20千碱基。
11.条目6至10中任一项的方法,其中所述经装配的核酸分子具有10千碱基至1兆碱基。
12.条目6至11中任一项的方法,其中所述经装配的核酸分子是闭合的、环状的。
13.条目6至12中任一项的方法,其中所述经装配的核酸分子为质粒。
14.条目6至13中任一项的方法,其中同时形成两个或更多个经装配的核酸分子。
15.条目6至14中任一项的方法,其中在校正了错误的核酸分子汇集物中的核酸分子的装配在真菌细胞中发生。
16.条目6至15中任一项的方法,其中步骤(b)进一步包括将在(a)中产生的核酸分子与通过其他手段获得的核酸分子进行合并从而形成汇集物,其中所述其他手段包括pcr、限制酶消化或核酸外切酶处理。
17.条目6至16中任一项的方法,其中将在(e)中产生的经装配的核酸分子装配和引入到克隆载体中。
18.用于产生产物核酸分子的方法,所述方法包括:
(a)设计大小为0.1千碱基至500千碱基的产物核酸分子,其中所述产物核酸分子通过核苷酸序列来进行定义;
(b)合成众多在核苷酸序列方面不同的独个核酸分子,其中合成每个独个核酸分子以制备1.0×103至1.0×109个拷贝的数量,并且其中所述独个核酸分子能够与一个或多个其他独个核酸分子杂交;
(c)在一定的条件下将在(b)中合成的独个核酸分子进行合并,所述条件允许所述独个核酸分子在允许形成至少一个更大的核酸分子的条件下进行杂交;和
(d)将在(c)中形成的所述至少一个更大的核酸分子与一个或多个另外的核酸分子进行合并,从而形成产物核酸分子,其中所述产物核酸分子包含少于一个的序列错误/千碱基。
19.条目18的方法,其中所述产物核酸分子具有选自下列的大小:
(a)0.1千碱基至300千碱基;
(b)10千碱基至200千碱基;
(c)10千碱基至100千碱基;和
(d)10千碱基至50千碱基。
20.条目18或19中任一项的方法,其中在步骤(b)之后或在步骤(d)之后采用错误校正程序。
21.条目18至20中任一项的方法,其中合成每个独个核酸分子以制备选自下列的数量:
(a)5.0×103至1.0×109个拷贝;
(b)1.0×106至1.0×109个拷贝;
(c)1.0×107至1.0×108个拷贝;
(d)2.0×107至1.0×109个拷贝;
(e)5.0×107至1.0×109个拷贝;
(f)7.0×107至1.0×109个拷贝;
(g)2.0×107至8.0×108个拷贝;和
(h)2.0×107至5.0×108个拷贝。
22.条目18至21中任一项的方法,其中使用聚合酶链式反应来扩增在步骤(c)中形成的所述至少一个更大的核酸分子。
23.条目18至22中任一项的方法,其中所述产物核酸分子是可自我复制的。
24.条目18至23中任一项的方法,其中所述可自我复制的核酸分子为质粒。
25.条目18至24中任一项的方法,其中在珠粒上合成所述独个核酸分子,其中每个珠粒包含在孔中。
26.条目18至25中任一项的方法,其中所述珠粒具有选自下列的大小:
(a)5μm至100μm的直径;
(b)20μm至100μm的直径;
(c)28μm至32μm的直径;
(d)5μm至60μm的直径;和
(e)10μm至100μm的直径。
27.用于产生自我复制性核酸分子的方法,所述方法包括:
(a)合成众多核酸分子,其中在平板的孔中以微量制备每个核酸分子;
(b)将一些或所有存在于在(a)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;和
(c)将所述众多更大的核酸分子进行装配,从而形成自我复制性核酸分子。
28.条目27的方法,其中所述自我复制性核酸分子为染色体或质粒。
29.条目27或28中任一项的方法,其中所述自我复制性核酸分子为基因组。
30.条目27至29中任一项的方法,其中所述基因组为病毒基因组、核基因组、细胞器基因组或原核细胞的基因组。
31.用于合成和装配编码多于一种的表达产物的核酸分子的方法,所述方法包括:
(a)合成众多核酸分子,其中以微量制备每个核酸分子;
(b)将一些或所有存在于在(a)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;和
(c)将所述众多更大的核酸分子进行装配,从而形成编码多于一种的表达产物的核酸分子。
32.条目31的方法,其中所述多于一种的表达产物为在相同的生物学途径中所牵涉的蛋白质。
33.条目31或32中任一项的方法,其中所述多于一种的表达产物为在相同的生物学途径中所牵涉的蛋白质,所述在相同的生物学途径中所牵涉的蛋白质为催化在生物学途径中的一系列化学反应的酶。
34.条目31至33中任一项的方法,其中所述在相同的生物学途径中的化学反应为顺次反应。
35.条目31至34中任一项的方法,其中所述生物学途径导致选自下列的终产物:
(a)生物燃料前体;
(b)抗生素或抗生素前体;
(c)食物组分;和
(d)工业酶。
36.条目31至35中任一项的方法,其中所述生物燃料前体为选自下列的醇:
(a)丁醇;
(b)戊醇;
(c)己醇;
(d)庚醇;和
(e)辛醇。
37.条目31至36中任一项的方法,其中所述食物组分为选自下列的氨基酸:
(a)l-赖氨酸;
(b)l-苏氨酸;
(c)l-甲硫氨酸;
(d)l-亮氨酸;
(e)l-异亮氨酸;
(f)l-缬氨酸;和
(g)高丝氨酸。
38.条目31至37中任一项的方法,其中将所述经装配的核酸分子引入到原核细胞中。
39.条目31至38中任一项的方法,其中所述原核细胞为棒杆菌属(corynebacterium)细菌。
40.条目31至39中任一项的方法,其中所述棒杆菌属细菌为谷氨酸棒杆菌(corynebacteriumglutamicum)。
41.用通过处理器可执行的指令进行编码的、非暂时性的、计算机可读的存储介质,其用于产生经装配的核酸分子,所述指令包括用于下列步骤的指令:
(a)合成众多核酸分子,其中在平板的孔中以微量制备每个核酸分子;
(b)将在(a)中产生的核酸分子进行合并,从而产生汇集物;
(c)将一些或所有存在于在(b)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;
(d)从在(c)中形成的所述众多更大的核酸分子中去除包含序列错误的核酸分子,从而产生校正了错误的核酸分子汇集物;和
(e)将在所述校正了错误的核酸分子汇集物中的核酸分子进行装配,从而形成经装配的核酸分子。
42.用于产生经装配的核酸分子的系统,所述系统包括:
-处理器;和
-用由处理器可执行的指令进行编码的存储器,所述指令用于下列步骤:
(a)合成众多核酸分子,其中在平板的孔中以微量制备每个核酸分子;
(b)将在(a)中产生的核酸分子进行合并,从而产生汇集物;
(c)将一些或所有存在于在(b)中形成的汇集物中的核酸分子进行连接,从而形成众多更大的核酸分子;
(d)从在(c)中形成的所述众多更大的核酸分子中去除包含序列错误的核酸分子,从而产生校正了错误的核酸分子汇集物;和
(e)将在所述校正了错误的核酸分子汇集物中的核酸分子进行装配,从而形成经装配的核酸分子。
在本说明书中所提到的所有出版物、专利和专利申请表明了本领域普通技术人员的技术水平并且通过提及而并入本文,其程度就如同每一单个出版物、专利或专利申请明确和单独地被指明通过提及而并入一样。
通过如此描述了本发明,本领域技术人员将会认识到,本发明可以以许多方式进行变化。这样的变化形式将不被视为背离本发明的精神和范围,并且所有对于本领域普通技术人员来说将会是显而易见的此类修饰意欲被包括在下述权利要求书的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!