一种培养液的制作方法
本发明涉及干细胞领域,尤其涉及一种培养液。
背景技术:
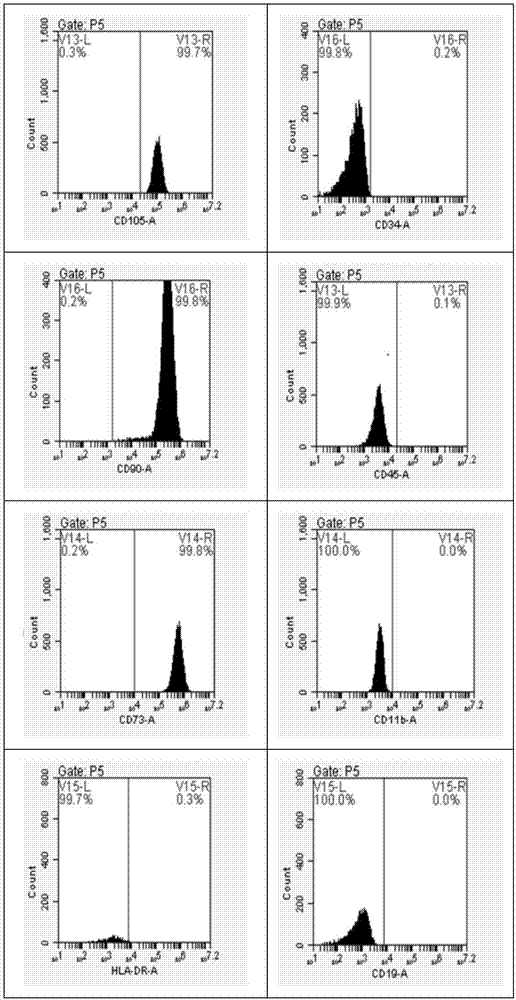
:随着社会经济的发展,生活水平的而提高以及人口老龄化现象,以软骨面破坏为主要表现的骨关节炎等疾病的发病率日益增加。因此,如何微创修复损伤的软骨,缓解病人的痛苦、提高生活质量长期以来就是骨科医学领域研究的重点方向之一。骨关节炎是骨科临床的常见疾病,由于退行性病变、创伤等造成的关节软骨缺损,已成为导致残废、影响生活质量的重要原因。关节软骨是一种无血管组织,软骨细胞主要靠关节滑液及细胞周围的基质供给营养以无氧酵解供能,其自身的修复能力很有限。关节软骨一旦损伤,就会引起关节疼痛、不稳和僵硬,会加速关节的骨化,细胞外基质降解的速度大于新基质的合成,则遗留永久性病变,从而导致关节炎的发生。传统的治疗方法如软骨下骨钻孔术、软骨移植、骨膜或软骨膜移植、软骨细胞移植等因修复组织以纤维软骨为主,缺少正常透明软骨的力学性能及耐用性,故不能取得满意效果。应用组织工程方法修复关节软骨缺损展示了令人鼓舞的前景。种子细胞是组织工程化软骨形成的首要条件。间充质干细胞(mesenchymalstemcells,mscs)作为一种多潜能干细胞,因其成功避开了胚胎干细胞来源缺乏、异体排斥、伦理道德等诸多问题,近年来已成为干细胞领域的研究热点。其不仅支持造血系统,还可向中胚层和外胚层来源的组织分化,在一定的实验条件控制下可分化为肌细胞、成骨细胞、脂肪细胞、神经细胞、肝细胞、心肌细胞等。因此,mscs具有广阔的临床应用前景,是细胞替代治疗和组织工程的首选种子细胞,是移植领域和自身性免疫疾病治疗的研究热点。近年来研究表明,mscs是一类来源于中胚叶的多潜能干细胞,具有自我更新和多向分化的能力,可作为种子细胞促进组织损伤的修复和再生。由于其组织来源广泛,易于体外扩增、免疫原性低等优点,已逐渐成为组织工程和细胞移植最理想的种子细胞。目前,骨髓来源mscs是最常用的种子细胞,但其数量和分化潜能随着年龄的增长显著减少和降低,并且取材时易对供体造成身体伤害。因此,非常有必要寻找新的自体和异体移植的细胞来源。这种新的细胞除了必须具备比骨髓来源mscs有更强的增殖力和多向分化潜能的特点外,还必须取材便利,不易造成病毒污染,且不受伦理道德限制等。自mitchell等首次自脐带中成功地分离出脐带间充质干细胞(huc-mscs)并证实其多分化潜能后,对脐带组织来源间充质干细胞的研究引起了广泛关注,越来越多的研究集中到该领域中。从huc-mscs被发现至今,中外学者已经进行相当多的研究,其具有的低污染、来源充足、增殖旺盛等特点吸引了众多的研究者。从脐带中分离提取间充质干细胞的重要意义在于,脐带作为分娩废弃物,来源广泛,取材方便,不受任何伦理及法理限制。mscs的分化与其生长的微环境有密切关系,因此,体外诱导mscs分化是通过采取不同的方法模拟体内相应组织细胞生长的真实环境和必要条件。传统的治疗方法如软骨下骨钻孔术、软骨移植、骨膜或软骨膜移植、软骨细胞移植等因修复组织以纤维软骨为主,缺少正常透明软骨的力学性能及耐用性,故不能取得满意效果。现有的huc-mscs成软骨分化诱导液效果不佳,诱导分化的特异性不强。技术实现要素:有鉴于此,本发明的目的在于提供一种培养液,本发明提供的培养液能明显提高huc-mscs向软骨细胞的特异性分化。本发明提供了一种培养液,包含人软骨细胞培养上清液和dmem培养液。优选的,所述人软骨细胞培养上清液与dmem培养液的体积比为:0.5~1.5:1.5~1.5。优选的,所述人软骨细胞培养上清液通过以下方法获得:a)收集关节软骨,依次经过清洗、剪碎、离心、过滤,得到细胞悬液;b)将细胞悬液接种后进行培养,细胞融合至覆盖培养皿底80%以上时,进行消化、传代,得到上清液粗品;c)将上清液粗品进行离心,取上清进行过滤、镜检,得到所述人软骨细胞培养上清液。优选的,步骤a)所述过滤的筛网为180~220目。优选的,步骤b)所述接种的细胞密度为0.5~1.5×109/l。优选的,步骤c)所述过滤的滤器粒径为0.2~0.24μm。优选的,所述dmem培养液包含转化生长因子、地塞米松、l-抗坏血酸、itspremix和fbs。优选的,所述转化生长因子为β1或者β2中的任意一种。优选的,所述dmem培养液为高糖型。优选的,上述培养液在体外诱导干细胞分化方面的应用。从以上技术方案可以看出,本发明实施例具有以下优点:本发明提供的一种培养液,本发明提供的培养液包含人软骨细胞培养上清液和dmem培养液,其中人软骨细胞培养上清液含有多种促huc-mscs向软骨细胞特异性分化的细胞因子和有效成分。本发明提供的培养液能够有效促进huc-mscs向软骨细胞的特异性分化。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。图1示细胞形态图(光镜下的huc-mscs(100×))图2示huc-mscs表面标志物流式检测结果示意图图3示番红o-快绿染色和ii型胶原免疫组化结果示意图图4示ⅱ型胶原(col-2)表达水平比较示意图图5示葡萄糖胺聚糖(gag)表达水平比较示意图图6示sox-9表达水平比较示意图具体实施方式为使得本发明的发明目的、特征、优点能够更加的明显和易懂,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,下面所描述的实施例仅仅是本发明一部分实施例,而非全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。本发明提供了一种培养液,包含人软骨细胞培养上清液和dmem培养液。本发明提供了一种培养液,包含人软骨细胞培养上清液和dmem培养液。其中,所述人软骨细胞培养上清液在本发明中的主要作用是促进huc-mscs向软骨细胞的特异性分化。优选的,所述人软骨细胞培养上清液与dmem培养液的体积比为:0.5~1.5:1.5~1.5,更优选的体积比为1:1。本发明提供的培养液,其中人软骨细胞培养上清液优选通过以下方法获得:首先,收集关节软骨组织。所述关节软骨组织来自多指切除手术的指关节。将关节软骨组织收集于磷酸盐缓冲液中,反复清洗剪碎。所述剪碎的组织块的规格优选为lmm×1mm×1mm左右。将组织块转移至50ml无菌离心管中进行消化。所述消化的过程为加入消化液进行消化30min,所述消化液优选为0.05%ⅱ型胶原酶。消化后反复洗涤、离心。然后加入消化液依次进行水浴和过滤。所述水浴优选条件为37℃水浴中轻微振荡消化3–4h。所述过滤的筛网优选为200目细胞筛网。过滤后将细胞悬液收集到50ml无菌离心管内。未消化完全的软骨组织继续进行消化。所述消化过程为加入消化液后置于37℃水浴中轻微振荡消化1~2h,直至软骨组织块基本消失、溶液变浑浊为止。所述消化液优选为0.25%胰蛋白酶溶液。其次,收集消化后的细胞,进行计数。所述计数的数量优选为1×109/l。计数后将细胞接种于10cm培养中,每2天换液1次。当原代细胞融合并覆盖皿底80%以上时,进行消化和传代。所述消化过程使用的的消化液优选为0.25%胰蛋白酶,所述传代的比例优选为1:2。最后,每隔48h收集细胞培养上清至50ml离心管进行离心。所述离心的条件优选为2000rpm/min离心10min。离心后在无菌条件下取上清液进行过滤。所述过滤的滤器粒径优选为0.2~0.24μm,更优选为0.22μm。过滤后的上清液经镜检不含软骨细胞,制得所述人软骨细胞培养上清液,在-20℃冰箱中保存备用。在本发明中,所述dmem培养液的作用为细胞提供有效营养成分。优选的,所述dmem培养液包含转化生长因子、地塞米松、l-抗坏血酸、its+premix和fbs。更为优选的,所述转化生长因子为β1或者β2中的任意一种。优选的,所述dmem培养液为高糖型。本发明还提供了上述培养液在体外诱导干细胞分化方面的应用。本发明提供的一种培养液,本发明提供的培养液包含人软骨细胞培养上清液和dmem培养液,其中人软骨细胞培养上清液含有多种促huc-mscs向软骨细胞特异性分化的细胞因子和有效成分。本发明提供的培养液能够有效增加ii型胶原合成量,促进huc-mscs向软骨细胞的特异性分化。为了更清楚起见,下面通过以下实施例进行详细说明。实施例1脐带间充质干细胞培养(1)脐带间充质干细胞的分离①脐带取自健康产妇(乙肝、丙肝、hiv、支原体、梅毒等血清学检查均为阴性),将脐带置于含有100u/ml青霉素和100u/ml链霉素的pbs中漂洗2次,加入预冷的75%酒精,浸泡1-2min,期间不停翻动脐带;②加入pbs漂洗2次洗去酒精。用组织剪将脐带剪成2mm左右的小段,每段用眼科剪纵向开,用血管钳去除脐带内三根血管(两条动脉,一条静脉),同时去除脐带外膜;将分离好的脐带用眼科剪剪成约1mm3大小的组织块,取适量放入直径为10cm的无菌培养皿中,覆盖70%培养皿的底面积。③加入lonza人干细胞无血清培养液(lonzaultraculturetm),5%co2、37℃、饱和湿度为95%的co2培养箱中培养。第5~7天半量换培养基,继续培养12~14天左右全量换液去掉组织块,同时收集细胞传代培养。(2)细胞形态观察在显微镜下观察细胞形态,如图1所示。从图1中可以看出huc-mscs生长旺盛,边界光滑,呈现巢状生长,集落大多呈多角形或梭形,集落内细胞排列紧密,胞浆较丰富,细胞核大,核仁大。(3)细胞表面抗原检测取第3代对数生长期细胞,细胞分离液消化,流式细胞术检测表面抗原cd105、cd73、cd90、cd34、cd45、cd11b、cd19、hla-dr表达情况,cell-quest软件分析结果。每个样本分析6000~8000个细胞。表1huc-mscs细胞表面标志物表达率细胞表型cd105cd90cd73hla-drcd34cd45cd11bcd19阳性表达率(%)99.7099.8099.800.300.200.100.000.00如表1,图2所示,经流式细胞术检测,第3代huc-mscs高表达cd105、cd73和cd90,低表达或不表达hla-dr、cd19、cd11b、cd45和cd34等标记物。结果表明huc-mscs与其他来源的mscs基本相同。实施例2(1)取实施例1中培养得到的第3代huc-mscs,按5×105cell/管接种于15ml离心管内,1000rpm离心5min,使细胞成团聚集在离心管底部,管盖拧松一半,放入37℃,5%co2培养箱静置培养。(2)24h后吸弃旧液,更换1ml阴性对照组培养基:含10%fbs的高糖dmem培养液。轻弹离心管使细胞团漂浮,管盖拧松一半,放入37℃,5%co2培养箱静置培养。(3)培养21d后对细胞进行石蜡切片、番红o-快绿染色及ii型胶原免疫组化等实验。(4)番红o-快绿染色实验结果如图3所示,细胞切片无着色。ii型胶原免疫组化实验结果显示无ii型胶原形成。实施例3(1)取实施例1中培养得到的第3代huc-mscs,按5×105cell/管接种于15ml离心管内,1000rpm离心5min,使细胞成团聚集在离心管底部,管盖拧松一半,放入37℃,5%co2培养箱静置培养。(2)24h后吸弃旧液,更换1ml阳性对照组成软骨诱导液:含10μg/l转化生长因子β1、10-7mol/l地塞米松、100μmol/ll-抗坏血酸、1%itspremix,10%fbs的高糖dmem培养液。轻弹离心管使细胞团漂浮,管盖拧松一半,放入37℃,5%co2培养箱静置培养。(3)诱导分化培养21d后对细胞进行石蜡切片、番红o-快绿染色及ii型胶原免疫组化等实验。(4)番红o-快绿染色实验结果如图3所示,细胞切片有着色,但着色区域较小,ii型胶原免疫组化实验结果显示有ii型胶原形成。实施例4(1)取实施例1中培养得到的第3代huc-mscs,按5×105cell/管接种于15ml离心管内,1000rpm离心5min,使细胞成团聚集在离心管底部,管盖拧松一半,放入37℃,5%co2培养箱静置培养。(2)24h后吸弃旧液,更换1ml实验组成软骨诱导液:由50%含10μg/l转化生长因子β1、10-7mol/l地塞米松、100μmol/ll-抗坏血酸、1%itspremix,10%fbs的高糖dmem培养液,50%人软骨细胞培养上清混合而成的诱导分化培养基。轻弹离心管使细胞团漂浮,管盖拧松一半,放入37℃,5%co2培养箱静置培养。(3)诱导分化培养21d后对细胞进行石蜡切片、番红o-快绿染色及ii型胶原免疫组化等实验。(4)番红o-快绿染色实验结果如图3所示,细胞切片有着色,着色区域明显大于对比例2,ii型胶原免疫组化实验结果显示有ii型胶原合成,ii型胶原合成量明显多于对比例2。实施例5培养液诱导效果评价根据ⅱ型胶原(col-2)、葡萄糖胺聚糖(gag)和sox-9基因的表达结果进行评定。实验检测过程按照实施例2、实施例3和实施例4的操作方法对huc-mscs进行培养或成软骨分化诱导,连续诱导培养21d后对细胞进行ⅱ型胶原(col-2)、葡萄糖胺聚糖(gag)和sox-9基因的表达检测。按照trizol试剂盒说明书进行细胞总rna提取;m-mlv反转录试剂盒获得cdna。按照sybrgreen定量pcr试剂盒说明书对ⅱ型胶原(col-2)、葡萄糖胺聚糖(gag)和sox-9基因表达水平进行检测。以gapdh作为内参基因。使用的引物如表2所示。以2-△△ct法进行定量分析。表2引物序列表实验结果如图4、5、6所示,细胞诱导培养21d后,实施例3、实施例4与实施例2(阴性对照组)比较,成软骨分化细胞标志性基因ⅱ型胶原(col-2)、葡萄糖胺聚糖(gag)和sox-9基因表达水平均有极显著性差异(**,p<0.01),实施例4与实施例3有显著性差异(*,p<0.05)。根据实验结果可以说明本发明提供的培养液能有效促进huc-mscs向软骨细胞的特异性分化。以上所述,以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1