一种微量核酸释放剂、制备方法及其应用与流程
本发明属于分子生物学领域,具体涉及一种微量核酸释放剂、制备方法及其应用。
背景技术:
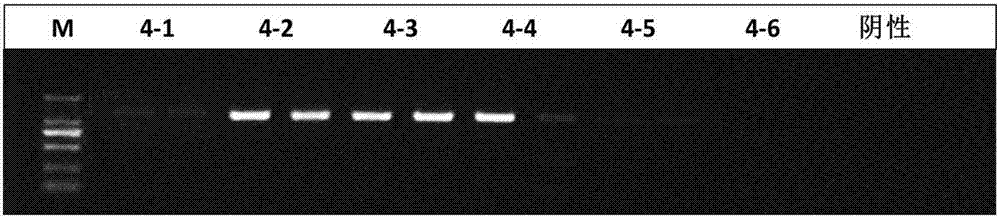
:自1985年pcr技术问世以来,这一技术已被广泛应用到生命科学各个领域,其特点是敏感性高、特异性强、操作简便、所需时间短等。由于临床或直接获得标本中含有蛋白质、脂类等可干扰pcr反应的物质,故在做pcr反应前必须进行核酸提取与纯化。pcr检测技术的第一步就是模板dna/rna的制备,这直接影响后续pcr反应的结果。一直以来,样本中核酸的提取和纯化是整个实验中最耗时,最繁琐的过程,严重影响样本检测的速度。样本中核酸的提取主要包括两个步骤:裂解细胞和提取核酸。裂解细胞使核酸从细胞中释放,蛋白解离的常用方法包括物理法(煮沸、冻融、微波、超声、研磨等)、化学方法(高盐、表面活性剂、苯酚等)和酶消化法(溶菌酶、蛋白酶k等)。苯酚-氯仿抽提法、异丙醇沉淀法及甲酰胺裂解法是提取dna最为经典的方法,目前很多方法的改进都是在这些方法的基础上进行的,这三种方法均是利用蛋白酶k和十二烷基硫酸钠(sds)消化裂解细胞。在前两种方法中,裂解液先用苯酚-氯仿去除蛋白质,再分别用乙醇或异丙醇双醇沉淀dna。甲酰胺法是利用高浓度的甲酰胺解聚蛋白质与dna的结合,然后利用透析来处理dna样品。这些经典方法在不计样本量情况下获得的dna纯度很高,能够满足各种试验的要求,但操作繁琐,用时长,且所用试剂具有一定的毒性。碱裂解法是在naoh提供的高ph(12.0~12.6)条件下,用强阳离子去垢剂sds破坏细胞壁,裂解细胞,与naoh共同使细胞的蛋白质发生变性,释放出dna。裂解后,细胞壁碎片与变性的蛋白质和其他杂质形成大的复合物,这些复合物在高钾盐条件下,可有效沉淀,而dna保留于上清液中,再通过无水乙醇沉淀、乙醇洗涤等步骤纯化dna。碱裂解法虽然快速简便,但去蛋白效果欠佳,明显影响了后续pcr效果。煮沸裂解法原理,是在煮沸时将样品中的dna通过含蛋白酶k等裂解缓冲液的作用释放出来,溶解在缓冲液中,沸水浴裂解细胞的同时,可破坏dna链的碱基配对,并使细胞的蛋白质与染色体dna变性。通过离心沉淀去除变性的蛋白质和其他杂质,然后回收上清液中的dna用于pcr扩增。然而,经高温煮沸,蛋白凝固使部分核酸被包裹并随离心沉淀丢失,直接导致上清液中模板核酸量减少;另外,虽经煮沸并高速沉淀,上清液中仍含有少量抑制扩增的成分如蛋白、肝素及微量血红蛋白等,抑制了扩增效率。磁珠法是近几年才发展起来的核酸提取方法,磁珠法提取核酸是通过细胞裂解液裂解细胞,从细胞中游离出来的核酸分子被特异的吸附到磁性颗粒表面,而蛋白质等杂质不被吸附而留在溶液中。反应一定时间之后,再在磁场作用下,使磁性颗粒与液体分开,回收颗粒(即磁珠-dna混合物),再用洗脱液洗脱,得到纯净的dna。由于其系列试剂不含氯仿、苯酚等毒性大的有机溶剂,提取步骤更简单,对核酸样本的回收率高和纯度好等优势而倍受研究者青睐。不过产品基本上为国外所垄断,价格非常昂贵,从而限制了其在我国的广泛应用。目前,国内外临床应用于荧光定量pcr扩增核酸提取方法主要有:(1)碱裂解煮沸法,在样本中加入裂解液煮沸提取核酸;(2)硅胶膜吸附柱法,采用硅胶膜层析柱吸附、清洗、洗脱获得核酸;(3)磁珠吸附法,采用磁珠吸附、清洗、洗脱获得核酸。这三种方法都需要经过多步骤离心(或负压抽吸、磁棒分离)、换管或移液操作才能获得核酸,存在操作步骤繁多、过程中核酸容易丢失或污染的不足。因此由于临床上样本的量比较少,例如临床样本包括血液、唾液、擦拭物等,无法通过常规核酸提取方法得到符合要求的核酸,影响后续的核酸检测结果,因此迫切需要一种可以进行微量核酸释放的试剂,既可以灵敏地进行核酸的检测,又免去核酸的回收步骤,避免核酸丢失或污染。技术实现要素:针对上述技术问题,本发明的目的提供了一种微量核酸释放剂,其中,所述核酸释放剂的各组分配比为:体积百分比0.2%~2.5%的表面活性剂、质量体积百分比0.5%~8%的氯化钾、质量体积浓度0.02mg/ml~1.5mg/ml的蛋白酶k、质量体积百分比0.5%~10%的牛血清白蛋白和2mg/ml~50mg/ml氢氧化钠,余量为水。其中表面活性剂tween-20(聚氧乙烯失水山梨醇单月桂酸酯;吐温-20)。本发明是在经典碱裂解煮沸法的基础上,加入多项试剂优化而来的。经典碱裂解法可以释放大部分液体样本dna,但有诸多缺点:1、裂解不够充分,如果低于1000拷贝/毫升dna,样本无法得以有效裂解。2、反应后溶液ph值比较高,裂解液无法直接用作pcr模板。3、在碱性环境下,rna极易水解,该方法不能用于提取rna样本。因此本发明创新在于:1、加入蛋白酶k,可以在较高ph值条件下解离核酸结合蛋白,同时高温灭活蛋白酶k,不影响后续pcr实验。2、加入tween-20表面活性剂,由于表面活性剂具有极性和非极性基团,可以很好的破膜作用,使核酸从包膜蛋白中释放,同时低浓度的tween-20不会抑制后续pcr反应。3、加入适量的kcl盐,低盐浓度(<1mol/l)可以增加核酸在溶液中的溶解度。4、加入bsa,bsa是一种很好的稳定剂,同时能够保护核酸水解,结合螯合剂、血红素等抑制pcr反应的物质。5、本发明研究显示,合适的tween-20和kcl浓度比例可以降低强碱和蛋白酶k对bsa的水解作用,合适浓度的tween-20和kcl环境中,bsa可与naoh和蛋白酶k稳定共存。本发明进一步提供了一种微量核酸释放剂,其中,所述核酸释放剂的各组分配比为:体积百分比0.5%~2%的表面活性剂、质量体积百分比1%~5%的氯化钾、质量体积浓度0.05mg/ml~1mg/ml的蛋白酶k、质量体积百分比1%~8%的牛血清白蛋白和5mg/ml~40mg/ml氢氧化钠,余量为水。本发明进一步提供了一种微量核酸释放剂,其中,所述核酸释放剂的各组分配比为:体积百分比0.5%~1.5%的tween-20、质量体积百分比1.2%~3%的氯化钾、质量体积浓度0.1mg/ml~0.8mg/ml的蛋白酶k、质量体积百分比2%~6%的牛血清白蛋白和6mg/ml~30mg/ml氢氧化钠,余量为水。体积百分比%(v/v),质量百分比%(w/v)本发明进一步提供了一种微量核酸释放剂,其中,所述核酸释放剂的各组分配比为:体积百分比0.6%~1.0%的tween-20、质量体积百分比1.2%~1.75%的氯化钾、质量体积浓度0.1mg/ml~0.5mg/ml的蛋白酶k、质量体积百分比2%~5%的牛血清白蛋白和10mg/ml~24mg/ml氢氧化钠,余量为水。本发明更优选了一种微量核酸释放剂,其中,所述核酸释放剂的各组分配比为:体积百分比0.8%的表面活性剂、质量体积百分比1.75%的氯化钾、质量体积浓度0.5mg/ml的蛋白酶k、质量体积百分比4%的牛血清白蛋白和20mg/ml氢氧化钠,余量为水。本发明还提供了一种微量核酸释放剂的制备方法,其中,由以下步骤组成:称取处方量的表面活性剂、氯化钾、蛋白酶k、牛血清白蛋白、氢氧化钠和水后,混合配置溶液,将溶液进行过滤除菌即得所述核酸释放剂。制备方法简单,符合方便临床检测的要求。本发明还提供一种微量核酸释放剂在核酸释放检测中的应用,由以下步骤组成:1)将待测样本与所述微量核酸释放剂进行均匀混合,得到混合溶液a;2)将所述混合溶液a进行加热处理后,室温平衡得到目的核酸;3)使用目的核酸进行相关的核酸检测。可以将将样本和所述微量核酸释放剂置于室温平衡,颠倒混匀后取一定量的所述微量核酸释放剂加入pcr管中,再取待测样本加入管中轻柔混匀。所述待测样本为全血,血浆,血清,咽试子洗脱液或分泌物。所述微量核酸释放剂与待测样本的体积比为1:1-1.5。所述加热处理为加热温度90~100℃,加热时间为10~15分钟,所述室温平衡为室温下平衡2-3分钟。所述加热处理可采用液体石蜡油加热或者直接用带热盖的金属浴进行加热。所述目的核酸为dna或rna。所述核酸释放剂的定义为既能裂解dna,又可以进行rna裂解的核酸释放剂,而并非只能进行dna裂解或者rna的释放剂。本发明微量核酸释放剂及其释放方法解决了常规核酸提取方法的核酸回收率低,操作步骤繁琐,成本高等问题。采用本发明试剂及对应方法,无需单独提取核酸,只需要将待测样本与所述微量核酸释放剂按比例混合后按照所述释放方法处理即可达到目的核酸的释放,无需以往方法的抽提、离心和转管等步骤。在很大程度上减少操作步骤,减少了核酸丢失,增加了检测的灵敏度并且降低了成本,并且裂解液可以直接用于核酸检测,不会影响检测结果的稳定性和灵敏度。附图说明图1:实施例1中dnapcr凝胶图;m为分子标记梯度蛋白,阴性对照为:无菌水;hbvdnapcr产物片段为1225bp;图2:kcl和tween20浓度调整实验dna鉴定结果;图3:kcl和tween20浓度调整实验rna鉴定结果;图4:实施例2中rnapcr凝胶图;ev71rnart-pcr产物片段为676bp;图5:ip-10pcr凝胶图;ip-10pcr产物片段为503bp;图6:foxp3pcr凝胶图;foxp3pcr产物片段为486bp;图7:ev71rt-pcr凝胶图;3ul和4ul是逆转录后,cdna扩增时加入逆转录产物的量。具体实施方式下面实验例用于进一步说明本发明但不限于本发明。凡基于本发明上述内容所实现的技术均属于本发明范围。实验引物汇总:dnahbvhbvrtupprimer5’-ttcctgctggtggctccagttc-3’hbvrtdownprimer5’-ctttgaagtatgcctcaaggtc-3’rnaev71ev71upprimer5’-ccctgaatgcggctaatcc-3’ev71downprimer5’-ccactgctgtagcgtcagaatc-3’foxp3fox-upprimer5’-ctatctcttgttctctcttgctcgc-3’fox-downprimer5’-ttctctcttgctcgctctttgtg-3’ip-10ip-upprimer5’-tcaaggaggactgtccaggtaaatc-3’ip-downprimer5’-tggcagtttgattcatggtgc-3’hbvdna荧光定量引物探针hbq-upprimer5’-ggagtgtggattcgcactcc-3’hbq-downprimer5’-gatcttctgcgacgcggcga-3’hbq-p5’-fam-cctatcttatcaacacttccg-bhq-3’实施例1不同试剂加入对经典碱裂解煮沸法提取核酸pcr扩增比较碱裂解煮沸法:0.5mol/lnaoh水溶液方案1:2%kcl+0.5mg/ml蛋白酶k+0.5mol/lnaoh水溶液方案2:1%tween-20+2%kcl+0.5mg/ml蛋白酶k+0.5mol/lnaoh水溶液方案3:4%bsa+1%tween-20+2%kcl+0.5mg/ml蛋白酶k+0.5mol/lnaoh水溶液方案4:4%bsa+0.8%tween-20+1.75%kcl+0.5mg/ml蛋白酶k+0.5mol/lnaoh(20mg/ml)水溶液所述浓度与权利要求书和说明书中处方的浓度单位相对应。所有试剂均用双蒸水配制后过滤除菌。1dna样本扩增样本材料为乙型肝炎患者血清,hbvdna定量为5×102拷贝/毫升。分别用碱裂解煮沸法,方案1~方案4核酸释放剂配方与样本1:1混合。核酸释放方法:99℃,10分钟,室温平衡2分钟。pcr扩增试剂为北京全式金2×easytaqpcrsupermixpcr扩增体系为50ul,见表1表1pcr扩增条件:94℃3分钟;94℃25秒,56℃25秒,72℃50秒;╳45循环72℃10分钟;4℃forever。实验结果:pcr扩增完成后,取5ulpcr产物,经1%tae琼脂糖凝胶电泳鉴定,结果见图1。实验结果显示,方案3和方案4释放样本dna效果较好,结果条带单一稳定,能够达到实验要求。2.rna样本扩增样本材料为ev71病毒细胞培养上清,ev71病毒定量为5×104拷贝/毫升。分别用碱裂解煮沸法,方案1~方案4核酸释放剂配方与样本1:1混合。核酸释放方法:99℃,10分钟,室温平衡2分钟。逆转录试剂盒选用fermentas公司的revetaid逆转录试剂产品规格:30次/盒,按照逆转录试剂盒操作步骤。每管20ulmix(包括,逆转录酶,引物,buffer,dntp,rnaseinhibiter与5ul核酸释放剂处理后的样本混合于pcr管中,上pcr仪逆转录反应。反应条件:42℃30分钟,70℃10分钟,4℃forever。反应完成后,产物及为rna的cdna产物。cdnapcr扩增试剂为北京全式金2×easytaqpcrsupermixpcr扩增体系为50ul,见表2表2pcr扩增条件:94℃3分钟;94℃25秒,52℃25秒,72℃50秒;╳45循环72℃10分钟;4℃forever。实验结果:pcr扩增完成后,取5ulpcr产物,经1%tae琼脂糖凝胶电泳鉴定,结果见图4实验结果显示,方案3和方案4释放样本rna均有效,结果条带单一稳定,方案4结果最好,能够达到实验要求。3.kcl和tween20浓度调整实验样本dna材料为乙型肝炎患者血清,hbvdna定量为5×102copies/ml.样本rna材料为ev71病毒细胞培养上清,ev71病毒定量为5×104copies/ml.优化试剂4:4%bsa+0.8%tween-20+1.75%kcl+0.5mg/ml蛋白酶k+0.5mol/lnaoh水溶液按照优化方案4中,调整tween20和kcl浓度来选择最佳配比的优化配方。#4-1:0.2%tween-20+1%kcl+其余组分不变;#4-2:0.6%tween-20+1.2%kcl+其余组分不变;#4-3:0.8%tween-20+1.75%kcl+其余组分不变(优化方案4配方);#4-4:1.0%tween-20+1.75%kcl+其余组分不变;#4-5:1.2%tween-20+2.0%kcl+其余组分不变;#4-6:2.0%tween-20+2.5%kcl+其余组分不变;dna样本前处理步骤、反应体系和扩增条件同前述dna实验。rna样本前处理步骤、反应条件和扩增体系同前述rna试验。实验结果:pcr扩增完成后,取5ulpcr产物,经1%tae琼脂糖凝胶电泳鉴定,结果如下:dna样本鉴定结果:见图2实验结果显示,4-2、4-3和4-4释放样本dna效果较好,结果条带单一稳定,其中4-3的tween-20和kcl配比效果最优,能够达到实验要求。rna样本鉴定结果:见图3实验结果显示,4-3和4-4释放样本rna效果较好,其中4-4的效果更好,结果条带单一稳定,其tween-20和kcl配比效果最好。优化方案4在实施例1和2中表现最佳,这并不意味着此方案为唯一可行技术方案,dna和rna属于不同样本的不同试验,上述实验结果也与样本中dna或rna的浓度相关,申请人以方案4为基础处方,分别对tween-20、kcl、蛋白酶k、牛血清白蛋白、naoh进行浓度调整试验,测定处方为体积百分比0.2%~2.5%的tween-20、质量体积百分比0.5%~8%的氯化钾、质量体积浓度0.02mg/ml~1.5mg/ml的蛋白酶k、质量体积百分比0.5%~10%的牛血清白蛋白和2mg/ml~50mg/ml氢氧化钠,余量为水的核算释放剂均可在其他样本中进行微量核酸裂解,效果明显(试验数据较多,限于篇幅暂未提供,可根据要求,进行提供)。以下实施例中的微量释放剂配方都是按照方案4配制。实施例2人全血基因扩增:ip-10是c-x-c类elr族趋化因子,是由干扰素(ifn)诱导产生的蛋白质类细胞因子,foxp3是叉状头转录因子家族中的一个成员,被认为是调节性t细胞(treg)的标志性分子,foxp3基因突变能引起严重的自身免疫性疾病,因此foxp3在调节机体免疫自稳中起关键作用。1.实验步骤a.用200ulpcr管加入5ul微量核酸释放剂溶液,再加入5ul全血,轻柔混匀;b.将加好微量核酸释放剂混合液的pcr管置于pcr仪(带热盖)中,99℃,10min;c.取出样本后再室温平衡2-3min,pcr管底可见白色沉淀物,说明裂解完全;d.直接进行pcr扩增程序;pcr扩增体系50ul,见表3表3组分体积100mmtris-hcl(ph8.8)5ul500mmkcl5ul2.5mmdntp4ul25mmmgcl26ulip-10/foxp3upprimers0.5ulip-10/foxp3downprimers0.5ultaq(5u/ul)1ulddh2o补足到40ul将配好的扩增体系直接加入微量核酸释放剂处理的样本管中,置于pcr仪中开始实验。pcr扩增条件:94℃3分钟;94℃20秒,56℃20秒,72℃40秒;╳35循环72℃10分钟;4℃forever。1.实验结果pcr扩增完成后,取5μlpcr产物,经1%tae琼脂糖凝胶电泳鉴定,结果见图5和图6。实验结果显示微量核酸释放剂可以从全血中释放基因组dna,经普通pcr成功扩增基因。实施例3病毒细胞培养上清中rna的扩增ev71是肠道病毒的一种,可引起婴幼儿的“手足口”病,严重会导致死亡。实验步骤1、用200ulpcr管加入5ul微量核酸释放剂溶液,再加入5ul病毒细胞培养上清,轻柔混匀;2、将加好微量核酸释放剂混合液的pcr管置于pcr仪(带热盖)中,99℃,10min;3、取出样本后再室温平衡2-3min,pcr管底可见白色沉淀物,说明裂解完全;4、直接进行pcr扩增程序;(1)逆转录步骤:逆转录试剂盒选用fermentas公司的revetaid逆转录试剂产品规格:30次/盒,按照逆转录试剂盒操作步骤。每管20ulmix(包括,逆转录酶,引物,buffer,dntp,rnaseinhibiter加入微量核酸释放剂处理后的样本pcr管中,上pcr仪逆转录反应。反应条件:42℃30-60分钟,70℃10分钟,4℃forever。反应完成后,产物及为rna的cdna产物。(2)cdnapcr扩增体系:见表4表4组分体积100mmtris-hcl(ph8.8)5ul500mmkcl5ul2.5mmdntp4ul25mmmgcl26ulev71upprimers0.5ulev71downprimers0.5ultaq(5u/ul)1ul模板(cdna产物)5ulddh2o补足到50ul3、cdnapcr扩增条件:94℃5分钟;94℃20秒,48℃20秒,72℃40秒;╳35循环72℃10分钟;4℃forever。实验结果1%tae琼脂糖凝胶,上样5ul,110v电压,电泳20-30分钟,结果如图7。实验结果显示微量核酸释放剂可以从细胞培养上清中释放病毒rna,经普通pcr成功扩增基因。实施例4乙型肝炎病毒(hbv)血清样本荧光pcr定量检测乙型肝炎病毒是一种嗜肝性dna病毒,可引起肝炎严重会发展为肝硬化,肝癌,是目前较常见的传染疾病,我国乙肝病毒携带者约有9300万。实验步骤对照商业试剂盒:乙型肝炎病毒核酸定量检测试剂盒(pcr-荧光探针“一管法”)医疗器械注册证书编号:国食药监械(准)字2013第3400344号产品标准:yzb/国0443-2013产品规格:48人份/盒公司:北京鑫诺美迪基因检测技术有限公司采用试剂盒所配的标准品血清样本:a:1×107iu/ml,b:2×105iu/ml,c:3×103iu/ml样本dna提取:a,b,c分别两份按照试剂盒说明书处理a,b,c分别两份采用微量核酸释放剂处理(1)用200ulpcr管加入5ul微量核酸释放剂溶液,再加入5ul样本,轻柔混匀;(2)将加好微量核酸释放剂混合液的pcr管置于pcr仪(带热盖)中,99℃,10min;(3)取出样本后再室温平衡2-3min,pcr管底可见白色沉淀物,说明裂解完全;(4)直接进行pcr扩增程序;(5)pcr扩增体系40ul荧光定量pcr反应试剂:所有样本均采用商业试剂盒的pcr反应试剂。见表5表5组分体积1╳hbvqpcrmix28.5ulhot-starttaq酶1.5ul模板10ul(核酸释放剂处理)(6)pcr扩增条件(商业试剂盒说明书条件):94℃5分钟;94℃15秒,60℃30秒,;╳40循环(采光)实验结果荧光定量pcr仪为上海宏石slan-96p扩增结果如下:按所给标准品建立标准曲线为:斜率:-3.00423,截距:41.83828,相关系数:-0.99657两种方法提取dna后hbv荧光定量ct值比见表6表6实验结果显示:微量核酸释放剂可以释放血清中hbv基因组dna,定量结果显示微量核酸释放剂比对应商业试剂盒有较好的病毒核酸释放结果和重复性。实施例5处方:体积百分比0.2%的表面活性剂、质量体积百分比0.5%的氯化钾、质量体积浓度0.02mg/ml的蛋白酶k、质量体积百分比0.5%的牛血清白蛋白和2mg/ml氢氧化钠,余量为水。称取处方量各组分,配置成溶液,过滤除菌。实施例6体积百分比2.5%的表面活性剂、质量体积百分比8%的氯化钾、质量体积浓度1.5mg/ml的蛋白酶k、质量体积百分比10%的牛血清白蛋白和50mg/ml氢氧化钠,余量为水。称取处方量各组分,配置成溶液,过滤除菌。实施例7体积百分比0.5%的表面活性剂、质量体积百分比1%的氯化钾、质量体积浓度0.05mg/ml的蛋白酶k、质量体积百分比1%的牛血清白蛋白和5mg/ml氢氧化钠,余量为水。称取处方量各组分,配置成溶液,过滤除菌。实施例8体积百分比2%的表面活性剂、质量体积百分比5%的氯化钾、质量体积浓度1mg/ml的蛋白酶k、质量体积百分比8%的牛血清白蛋白和40mg/ml氢氧化钠,余量为水。称取处方量各组分,配置成溶液,过滤除菌。实施例9体积百分比0.5%的表面活性剂、质量体积百分比1.2%的氯化钾、质量体积浓度0.1mg/ml的蛋白酶k、质量体积百分比2%的牛血清白蛋白和6mg/ml氢氧化钠,余量为水。称取处方量各组分,配置成溶液,过滤除菌。实施例10体积百分比1.5%的表面活性剂、质量体积百分比3%的氯化钾、质量体积浓度0.8mg/ml的蛋白酶k、质量体积百分比6%的牛血清白蛋白和30mg/ml氢氧化钠,余量为水。称取处方量各组分,配置成溶液,过滤除菌。实施例11体积百分比0.6%的表面活性剂、质量体积百分比1.2%的氯化钾、质量体积浓度0.1mg/ml的蛋白酶k、质量体积百分比2%的牛血清白蛋白和10mg/ml氢氧化钠,余量为水。称取处方量各组分,配置成溶液,过滤除菌。实施例12体积百分比1.0%的表面活性剂、质量体积百分比1.75%的氯化钾、质量体积浓度0.5mg/ml的蛋白酶k、质量体积百分比5%的牛血清白蛋白和24mg/ml氢氧化钠,余量为水。称取处方量各组分,配置成溶液,过滤除菌。本发明申请中的所有引物和pcr技术均为本领域技术人员根据现有技术可以实现的,相关技术请参照分子克隆等教科书。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1