一种用于检测TERT基因断裂的探针组、试剂盒及其应用的制作方法
本发明涉及原位杂交领域,具体而言,涉及一种用于检测tert基因断裂的探针组、试剂盒及其应用。
背景技术:
神经母细胞瘤(neuroblastoma,nb)属于儿童外周交感神经系统肿瘤,是儿童最常见的胚胎性颅外肿瘤。nb肿瘤的恶性度高、进展快,易发生骨髓、骨及其他器官转移,在儿童肿瘤相关死因中高达15%。nb肿瘤即使经过化疗、手术和放疗等多元化治疗,仍有约60%的病例复发。神母肿瘤患儿中,约40%诊断为高危型nb,其5年生存率仅为30%-50%。由于缺乏有效治疗手段、预后差、复发率和死亡率高,nb给患儿家庭和社会带来沉重的经济损失和负担。因此,深入开展nb肿瘤分子标志物研究,尤其是高危型nb肿瘤的分子标记物,对于儿童nb肿瘤的早期预防和诊疗具有重要的临床意义和社会意义。
mycn基因是公认的nb肿瘤最主要致癌基因,也是国际神经母细胞瘤危险度分级协作组(theinternationalneuroblastomariskgroup,inrg)推荐的nb肿瘤分期/分级标志物。但临床上仅在20%高危nb患儿中发现mycn基因异常扩增(>10拷贝),仍广泛存在mycn未异常扩增的高危nb患者,说明现有nb肿瘤标志物不能完全满足病因复杂的nb肿瘤诊治需要。
最新研究发现在高危nb肿瘤中,约有20-30%的肿瘤发生端粒酶逆转录酶(telomerasereversetranscriptase,tert)基因断裂,能够激活端粒酶活性,促进nb肿瘤进展,而且tert也可辅助mycn鉴别高危nb亚型。因此为了更好地对nb肿瘤患者进行分级、风险评估以及精准治疗,检测nb肿瘤患者是否出现tert基因的断裂十分必要。
但目前检测tert的断裂只能基于全基因组测序技术,不但样本处理复杂、专业要求高、检测周期长并且成本昂贵,不适合医院开展tert基因的快速检测。
因此,本领域亟待提出一种快速、准确且成本低的检测tert基因断裂的试剂和方法。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一目的在于提供一种用于检测tert基因断裂的探针组,该探针组可以快速、准确、灵敏地检测tert基因的断裂。
本发明的第二目的在于提供一种用于检测tert基因断裂的试剂盒,该试剂盒包括上述探针组,可以快速、方便、准确、灵敏地检测tert基因的断裂。
本发明的第三目的在于提供上述探针组在制备用于鉴别高危神经母细胞瘤的试剂或试剂盒中的应用,由本发明上述应用制备的试剂或试剂盒能够辅助鉴别高危神经母细胞瘤亚型,帮助神经母细胞瘤患者进行精准的个体化治疗。
为了实现本发明的上述目的,特采用以下技术方案:
一种用于检测tert基因断裂的探针组,所述探针组包括标记有荧光标记的克隆片段rp11-325i22、rp11-768m3、rp11-1107m2和rp11-260h6,其中rp11-325i22和rp11-768m3标记有同一种颜色的荧光染料,rp11-1107m2和rp11-260h6标记有另一种颜色的荧光染料。
本发明提供上述探针组,通过上述探针组可以利用荧光原位杂交检测样品中tert基因的断裂或断裂。荧光原位杂交是利用标记有荧光素的探针特异性与染色体和(或)基因位点相结合,通过荧光显微镜即可观察荧光信号的类型,从而检测染色体和相应基因变化的方法,具有安全、经济、快速、灵敏度高、检测信号强、杂交特异性高、能同时显示多种颜色等优点,而且弥补了传统方法对间期细胞、复杂核型细胞以及染色体微缺失无法诊断的缺陷。同时荧光原位杂交技术应用于石蜡包埋的样本上进行回顾性研究,大大降低了对研究样本的要求。
tert基因两端存在数十个细菌人工染色体(bac)克隆,但这些克隆没有经过验证,缺乏特征性描述,且其中许多克隆为商品化克隆,只进行末端测序,存在约10%的错误率,体现为这些克隆标记后显示的不是目的片段或在目的片段之外,还存在较多杂交信号。同时,bac克隆还存在标记后信号强度不强或bac克隆之间信号不连续的情况。因此,获得特异性好、信号强度高且信号连续、不弥散的克隆是能够准确、灵敏地检测tert基因断裂的关键。本发明经过多重分析和验证之后,最终选择确定的bac克隆为rp11-325i22、rp11-768m3、rp11-1107m2和rp11-260h6,其无论是在特异性、信号强度还是信号的连续性上都能满足检测要求,对上述bac克隆进行荧光标记,可以灵敏、准确地检测tert基因断裂。
首先,经efish预测和实际测试,本发明上述bac克隆在tert基因两端具有极高的特异性,基本不与细胞内其他染色体发生非特异性杂交,且信号强度高,检测的灵敏度高。另外,本发明上述克隆片段的大小相近,克隆片段彼此间的信号强度相似,不会出现因为克隆片段长短不一导致信号的强度差异较大的问题。
其次,tert基因两端的bac克隆片段之间的最短距离约110kb,探针在未发生断裂或重组时两种信号能紧密靠近,不会因为两个信号之间的距离过大而出现信号分离,导致假阳性。
再者,tert基因同侧相邻的克隆片段之间存在少量的片段重叠,避免同侧克隆片段因为间距较大而出现信号断裂或重组,出现单独信号,造成假阳性。
一些实施方式中,所述rp11-325i22和rp11-768m3标记有绿色荧光染料,rp11-1107m2和rp11-260h6标记有红色荧光染料。
在一些实施方式中,所述rp11-325i22和rp11-768m3标记有红色荧光染料,rp11-1107m2和rp11-260h6标记有绿色荧光染料。
在一些实施方式中,所述绿色荧光染料选自光谱绿、荧光素、羧基荧光素、异硫氰酸荧光素、四氯荧光素、罗丹明、羧基四甲基罗丹明、bodipyfl或cy2中的一种或两种,所述红色荧光染料选自光谱橙、texasred、bodipytr、cy3或cy5中的一种或两种。
在一些实施方式中,优选地,所述绿色荧光染料为光谱绿,所述红色荧光染料为光谱橙。
本发明还涉及一种用于检测tert基因断裂的试剂盒,所述试剂盒包括上述的探针组,所述试剂盒还包括杂交缓冲液、洗涤缓冲液、非特异性杂交阻断剂、水和细胞核染料中的一种或多种。。
本发明上述试剂盒包括用于检测tert基因断裂的探针组,能够快速、方便、准确地实现对tert基因断裂的检测。
在一些实施方式中,所述杂交缓冲液为ssc缓冲液,所述洗涤缓冲液为含np-40的ssc缓冲液。
在一些实施方式中,所述非特异性杂交阻断剂为牛血清白蛋白、鲑鱼精子dna或人cot-1dna,优选地,所述非特异性杂交阻断剂为人cot-1dna。
在一些实施方式中,所述细胞核染料选自dapi、吖啶橙、溴化乙锭、碘化丙啶和hoechst染料中的一种或多种,优选地,所述细胞核染料为dapi。
在一些实施方式中,所述探针组与所述杂交缓冲液、非特异性杂交阻断剂和水混合配制为探针杂交液。
本发明还涉及上述探针组在制备用于鉴别高危神经母细胞瘤的试剂或试剂盒中的应用。
由本发明上述应用制备的试剂或试剂盒能够辅助鉴别高危神经母细胞瘤亚型,帮助神经母瘤细胞患者进行精准的个体化治疗。
与现有技术相比,本发明的有益效果为:
1)本发明提供用于荧光原位杂交的探针组或试剂盒,利用该探针组或试剂盒能够通过荧光原位杂交检测tert基因的断裂,可以快速、准确、灵敏度、低成本地检测tert基因的断裂。
2)本发明上述探针组或试剂盒中的克隆片段具有信号强度高、特异性好的优点,上述克隆片段的组合具有信号连续、信号强度差异小,不容易出现假阳性等优点。
3)通过检测tert基因断裂,本发明上述探针组或试剂盒能够辅助鉴别高危神经母细胞瘤亚型,帮助神经母细胞瘤患者进行精准的个体化治疗。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为;bac克隆rp11-161f13的efish比对结果;
图2为:bac克隆rp11-161f13在经培养的外周血中期染色体上的杂交结果;
图3为:bac克隆rp11-379b11的efish比对结果;
图4为:bac克隆rp11-379b11在经培养的外周血中期染色体上的杂交结果;
图5为:荧光原位杂交多克隆分离探针定位模式示意图;
图6为:外周血涂片的fish检测图;
图7为:儿童nb肿瘤组织样本的fish检测图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
筛选检测tert基因断裂的探针组:
(1)通过http://genome.ucsc.edu/查找5号染色体tert基因两侧(即端粒侧和着丝粒侧)对应的细菌人工染色体(bac克隆)。结果表明,在tert基因(chr5:1,253,287-1,295,162)位置两端约500kb处有数十个bac克隆可覆盖,但这些克隆没有经过验证,缺乏特异性描述。
(2)探针设计原则:在基因断裂点两侧分别选取多个大小相近的bac克隆,控制两侧bac克隆片段之间的最远距离在1500kb以内且互不重叠,同侧多个片段相互之间有一定序列的重叠,避免较大缺口造成信号弥散。根据上述探针设计原则,计划在tert基因的一侧选取3个bac克隆,分别为rp11-325i22(chr5:1317,996-1,509,712)、rp11-161f13(chr5:1,509,781-1,671,154)和rp11-768m3(chr5:1,682,330-1,844,278),长约530kb,标记绿色荧光;在tert基因的另一侧选取3个bac克隆,分别为rp11-379b11(chr5:620,050-842,110)、rp11-260h6(chr5:830,274-1,019,881)和rp11-1107m2(chr5:1,009,812-1,206,909),长约470kb,标记绿色荧光。
(3)对上述bac克隆进行efish比对和用外周血培养的中期染色体涂片验证:
①用efish(http://projects.tcag.ca/cgi-bin/efish/index.cgi)分析上述bac克隆的特异性,结果发现,rp11-161f13在基因组中存在非特异片段,分别在2号、3号染色体中有非特异杂交(参见说明书附图图1),可能标记后有较明显的非特异点干扰判读,其他五个bac克隆在比对过程中未发现非特异性杂交。
由于基于生物信息学的比对结果未必可靠,同时考虑到如果只选取rp11-325i22和rp11-768m3,中间约有173kb的缺口,担心信号会有弥散,而如果只选取靠近tert基因的rp11-325i22,信号点荧光强度可能较弱,不满足样本检测,因此最终对rp11-325i22、rp11-768m3和rp11-161f13均进行中期染色体涂片验证。
②从invitrogen公司购买上述六个商品化的bac克隆,用绿色荧光染料标记,检测上述bac克隆在外周血细胞中期染色体上的杂交情况。结果表明:
rp11-161f13在经培养的中期染色体细胞上显示有非特异杂交信号(见说明书附图图2),不能使用;rp11-325i22单个克隆的标记信号强度较弱;而rp11-325i22和rp11-768m3搭配的组合标记信号强度可以满足样本检测的要求,且虽然其中存在173kb的缺口,并没有对信号造成影响判断的弥散效果。
rp11-379b11在efish比对过程中没有发现非特异杂交(附图3),但是在培养的中期染色体和间期细胞中出现非特异信号点,不能用于后续试验(见说明书附图图4)。而rp11-1107m2和rp11-260h6的组合可以满足信号强度和信号连续性的要求。
根据上述外周血中期染色体涂片结果,最终确定用于检测tert基因断裂的bac克隆为rp11-325i22、rp11-768m3、rp11-1107m2和rp11-260h6,其定位模式如图5所示。
实施例2
制备检测tert基因断裂的荧光标记bac克隆探针组:
从invitrogen公司购置相应的bac克隆,将bac克隆培养后提取质粒,利用缺口平移法,将端粒侧的2个bac克隆片段rp11-1107m2和rp11-260h6用sptectrumgreen-dutp标记为绿色荧光,将着丝粒侧2个bac克隆片段rp11-325i22和rp11-768m3用sptectrumorange-dutp标记为红色荧光。将标记好的探针与humancot-1dna、杂交缓冲液、纯化水按比例配置成探针杂交液,-20℃避光冷冻保存。
实施例3
制备用于检测tert基因断裂的试剂盒:
将实施例1制备的探针杂交液与用于细胞核dna染色的dapi染料组成试剂盒。
实验例1
以人外周血淋巴细胞为检测对象,评价实施例2制备的探针组的标记效果及检测效果。
1、人外周血培养及染色体制备:
(1)准备以下实验材料:人外周血;胰酶:gibico;培养液:dmem(hyclone)+10%新生牛血清(gibico)+100up.s。
(2)采血:用肝素润湿注射针筒(0.2m1)后,常规取静脉血约1-2ml,转动针筒混匀肝素。
(3)接种(在超净工作台中无菌操作):在每个培养瓶中(含20%血清的1640培养液5ml,ph7.2),加入全血0.25-0.30ml(7号针头13-15滴)、pha5mg,盖紧胶塞,轻轻摇匀。
(4)培养:将培养瓶放在37℃恒温培养箱内培养72h。终止培养前2-4h,加入0.01%秋水仙素溶液(100μg/m1)1-2滴(7号针头),使终浓度为0.2μg/ml培养液。轻轻摇匀后,放回培养箱继续培养2-4h。
(5)收获:将培养后的血细胞收集在离心管中,平衡后1000rpm离心8min,弃去上清。
(6)低渗:向离心管中加入37℃0.075mol/lkcl溶液至8ml,用吸管轻轻吹打混匀细胞,置于37℃水浴箱温育15min。
(7)预固定:向离心管中滴加新配制的甲醇-冰醋酸固定液1-2ml,用吸管轻轻吹打混匀后1000rpm离心8min,弃去上清。
(8)固定:加入新配制的固定液至8ml,室温静置30min。3000rpm离心8min,弃去上清。可再重复固定1次。
2、细胞涂片处理方法:
(1)准备以下材料:
①样本处理所需材料:固定液:体积比3:1的甲醇:冰醋酸,化学通风橱中配制,充分混匀;离心机。
②制片时所需材料:载玻片、移液器、显微镜。
③预处理时所需材料:
20×pbs;70%、90%、100%梯度乙醇;圆形玻璃染色缸;恒温水浴锅(37±1℃);
胃蛋白酶溶液:400μl1mol/l的hcl加入40ml水中,置于37±1℃水浴中,使用前加入75ul10%胃蛋白酶,混匀,使用一天后更换;
4%多聚甲醛:900ml去离子水中加入500μl1mol/lnaoh,加热到65-70℃;边搅拌边加入40g多聚甲醛,持续搅拌直到溶解;冷却至室温后加入100ml的10×pbs;用hcl调节ph到7.3;过滤除菌,2-8℃避光保存;
1%多聚甲醛(水:26ml+20×pbs:2ml+4%的多聚甲醛:10ml+1m的mgcl2:2ml)。
④杂交时需要的材料:18×18mm盖玻片、镊子、橡皮胶(rubbercement)、原位杂交仪(abbott)。
⑤杂交后洗涤及复染所需材料:
20×ssc;np-40;镊子;圆形玻璃染色缸;恒温水浴锅(72±1℃);70%、90%、100%梯度乙醇;22×22mm盖玻片;
洗液i(1×ssc/0.3%np-40):37.88ml纯水+2ml20×ssc+120μlnp-40,总体积40ml;
洗液ii(2×ssc/0.1%np-40):35.96ml纯水+4ml20×ssc+40μlnp-40,总体积40ml。
(2)将实施例2制备的探针组用于检测经培养的外周血细胞的中期染色体:
①制片:
1.1、用新鲜固定液配平细胞悬液,5000rpm离心5分钟,弃上清;
1.2、加1ml固定液,震荡混匀,5000rpm离心5分钟,弃上清;
1.3、重复1.2;
1.4、取一张干净的载玻片;
1.5、重悬细胞后取3μl悬液滴加到载玻片上;室温下晾干;
1.6、用10×物镜在相差显微镜下观察三个区域的细胞密度,记录细胞没有明显重叠,且数量在100-200个以上;如果细胞密度及数目不合适,继续步骤1.7;
1.7、如果滴加3μl悬液的区域仍然细胞数目太多,用新鲜固定液稀释细胞悬液,重复步骤1.4-6;
1.8、另取一张干净的载玻片,滴加适量的细胞悬液;
1.9、在相差显微镜下观察,如果细胞碎片太多,则需要做预处理并且选择合适的杂交区域。
②玻片预处理:
2.1玻片放入37±1℃的1×pbs中孵育5分钟;
2.2取出玻片,再将其放入37±1℃胃蛋白酶溶液中消化7-15分钟(可通过预试验确定酶效力);
2.3取出玻片,再将其放入1×pbs室温洗涤3分钟;
2.4取出玻片,再将其放入1%多聚甲醛/pbs室温固定10分钟;
2.5取出玻片,再将其放入1×pbs室温洗涤3分钟;
2.6取出玻片,再将其放入70%、90%、100%梯度乙醇脱水各2分钟;
2.7取出玻片,室温晾干。
③杂交:
3.1从-20℃冰箱中取出杂交液,震荡混匀,瞬时离心;
3.2加10μl的杂交液到杂交区域,迅速盖上18×18mm盖玻片,轻压使杂交液均匀分布,避免产生气泡;
3.3用橡皮胶沿盖玻片边缘封片,完全覆盖盖玻片和载玻片接触的部位;
3.4湿润原位杂交仪湿度条,将玻片置于原位杂交仪上,关闭原位杂交仪盖子,设置“denat&hyb”程序,变性78℃2分钟,杂交37℃10-18小时。
④杂交后洗涤及复染:
4.1关闭杂交仪电源,将玻片取出,轻轻撕去橡皮胶,移去盖玻片(若盖玻片难以去除,可以将其放入室温2×ssc中微微摇晃,以利于其脱落);
4.2玻片放入72±1℃洗液i(1×ssc/0.3%np-40)中2分钟;
4.3取出玻片,再将其放入室温洗液ii(0.1%np-40/2×ssc)中30秒;
4.4取出玻片,再将其放入室温70%,90%,100%乙醇中各2分钟;
4.5取出玻片,暗处自然干燥玻片;室温,滴加10μldapi复染剂到22×22mm的盖玻片,载玻片目标区域朝下,轻放于盖玻片上,轻压,避免产生气泡,在暗处存放,待观察。
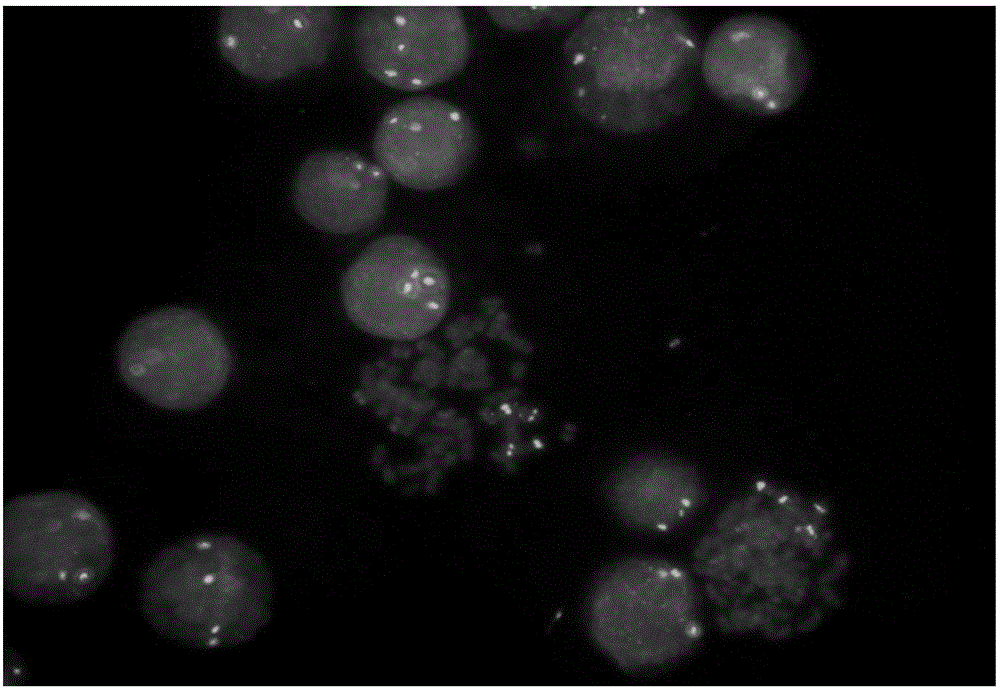
(3)结果判定:参照通行的双色探针使用标准,在暗室中使用荧光显微镜dapi/fifc/texasred三色滤光镜激发,100倍物镜下观察间期细胞,判别荧光信号,评价探针的特异性、灵敏度、信号的强弱以及信号连续性(见说明书附图图6)。
探针组质量评价:说明书附图图7的单个细胞核中只有两个连续的红绿信号或两个黄色信号。首先,荧光信号的数量表明表明实施例1所述探针组的特异性好,只特异性地与5号染色体上tert两侧的目的片段结合,没有非特异性地结合其他染色体;其次,红绿信号紧密相连或融合形成黄色信号,表明上述探针之间的间距合适,不会因为间距过大而出现信号分离,造成检测结果的误判;再者,图7所示荧光信号清晰,信号亮度高,探针组的检测灵敏度高。考察染色体对应区段的荧光信号及计数50个细胞核中信号杂交情况,判定荧光探针的灵敏度和特异性。结果显示100%的染色体显示相应颜色的荧光信号,且无任何染色体位点之间的交叉杂交现象。探针灵敏度和特异性均达100%。
实验例2
使用实施例2制备的探针组检测儿童nb肿瘤组织,具体检测方法如下所示:
(1)将包含肿瘤组织的样本经10%中性福尔马林固定,石蜡包埋后制备成3μm组织切片。
(2)将切片置于65±1℃恒温箱烤片过夜;之后,取出后放入二甲苯浸泡30min,再放入无水乙醇浸泡10min;接着放入100%、85%、70%梯度乙醇和纯化水中复水3min,再放入纯化水中100±5℃煮片20min。
(3)取出晾干后,在样本区域滴加100μl胃蛋白酶反应液,消化5min;之后迅速放入2×ssc洗涤5min,最后放入室温70%、85%、100%梯度乙醇依次脱水各3min,取出晾干。
(4)加10μl本发明的探针杂交液至干燥22×22mm盖玻片上,将样本片翻转,使样本朝下,迅速盖上,反转后轻压盖玻片使杂交液均匀分布;用橡皮胶水沿盖玻片边缘封片,完全覆盖盖玻片与载玻片接触边缘。
(5)将玻片放在85±1℃的热台上,变性5min;迅速将玻片放入预热的杂交盒中,避光,37±1℃孵育过夜。
(6)将2×ssc溶液和0.1%np-40/2×ssc溶液放入37±1℃的水浴中预热;去除橡皮胶水和盖玻片,将玻片放入2×ssc溶液中洗涤10min;再转入0.1%np-40/2×ssc溶液中洗涤5min;然后室温70%乙醇脱水3min。
(7)取出玻片在暗处晾干后,滴加10μldapi复染剂至干燥的22×22mm盖玻片上,反转样本片,使盖玻片载玻片的目标区域接触,反转后减压,避免产生气泡,在暗处存放,使用荧光显微镜观察荧光性。
(8)结果判定:参照通行的双色探针使用标准,在暗室中使用荧光显微镜dapi/fifc/texasred三色滤光镜激发,100倍物镜下观察间期细胞,判别荧光信号,确定免疫荧光原位杂交检测的有效性(具体检测结果见说明书附图图7)。
使用荧光显微镜可以观察到两种信号类型:(1)正常信号:在未发生tert基因断裂或重组的肿瘤组织中,由于双色信号相距较近而出现红绿连续信号或者黄色信号(红绿双色叠加的效果),信号点的数量取决于细胞核内5号染色体数目;(2)分离信号:当发生tert基因断裂或重组时,导致分别标记在tert基因两端的红绿信号出现分离。只有当红绿信号分离同时出现且距离一个信号直径以上时,才能记为分离信号。每一列切片的整个核心区域至少有100个互不重叠的细胞核,在核心区域有超过10%的肿瘤细胞核出现红绿分离信号,判断荧光原位杂交阳性;未出现红绿信号分离,则判断荧光原位杂交阴性;单独出现红色或绿色信号则不计数。
根据图7所示结果可知,实施例2所述探针组在nb肿瘤组织的多数细胞核中均能显示荧光信号,而且荧光信号清晰,信号亮度高,且在每一例组织切片中均成功进行fish检测,表明实施例2所述探针组具有特异性强及敏感性高的优势,同时该探针穿透性强,信号清晰,信号亮度高,符合制备成诊断试剂盒的要求。
实验例3
参照实验例2所述方法,使用实施例2制备的探针组检测50例已经被确定为tert基因断裂的nb肿瘤组织,结果显示,其中的48例nb肿瘤组织被所述探针组检测到红绿分离信号,被判断为tert断裂或重组阳性。由此可见,本发明所述探针组在检测肿瘤组织的tert断裂或重组情况的准确率已经达到96%。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!