一种适用于产孢真菌核型分析的染色体DNA制备方法与流程
本发明属于生物技术领域,涉及一种适合于产孢真菌核型分析的染色体dna制备方法。
背景技术:
真核生物的染色体承载着遗传信息,控制着生物体的生长、遗传、发育和变异。染色体是由dna和蛋白质组成,其上的遗传信息以密码子的形式储存在dna上,研究染色体的组型和行为是至关重要的。由于大多数真菌属于半知菌亚门,缺乏有性世代,细胞核分裂时观察不到染色体凝缩,同时真菌染色体很小,没有足够数目的基因标记,所以很难用核染色和杂交等的方法进核型分析和遗传育种研究,也很难用细胞学方法测定其染色体数目和大小。此外,真菌的染色体数目变化范围相对大,用普通的琼脂糖凝胶电泳(小于50kb)和聚丙烯酰胺凝胶电泳(5-500kb)都不能完整的分析。八十年代初发展起来的脉冲电泳(pulsedfieldgelelectrophoresis,pfge)技术解决了这方面的问题,此技术分离的dna分子量范围较大,能最大分离大于10mb的dna。因此,近年来被应用来分离真菌染色体dna,测定其染色体数目和大小。
用pfge技术分离染色体dna时,首先要解决染色体标本的制备,在制备标本时必须让染色体dna从细胞中释放出来,同时又要保持染色体dna的完整性。真菌的细胞壁组成成分较为复杂,破壁困难,不能获得高质量的原生质体,最后导致染色体dna不能从细胞中大量释放出来。目前真菌原生质体制备主要采用酶解法,酶解时一定要选择合适的破壁酶,此外,要掌握好酶解的温度和时间等因素。
技术实现要素:
为了解决现有技术中存在的问题,本发明提供了一种适合于产孢真菌核型分析的染色体dna制备方法,操作简单,且能获取高浓度、完整的染色体dna,能够直接用于真菌核型分析和遗传育种研究。
解决以上技术问题的本发明中的一种适用于产孢真菌核型分析的染色体dna制备方法,其特征在于:包括以下步骤:
(1)分生孢子收集:将产孢真菌进行液体培养后过滤菌液,得到分生孢子悬浮液,离心,用edta溶液洗涤2次,再将孢子悬浮在edta溶液中,制成浓度为2×108/ml的分生孢子悬浮液;
(2)孢子琼脂糖块制备:将步骤(1)中分生孢子悬浮液与琼脂糖等体积混合制成孢子琼脂糖块,把孢子琼脂糖块放入3-4℃凝固10-15min;
将分生孢子固定在琼脂糖内,避免后面释放的染色体dna被打断,保证染色体dna的完整性,同时制备染色体dna。
(3)原生质体琼脂糖块制备:将步骤(2)中的孢子琼脂糖块放入酶液中,于36-37℃酶解3-4h,用无菌水洗涤2次;
(4)完整染色体琼脂糖块制备:将步骤(3)中酶解后的琼脂糖块放入nds缓冲液中,于45-55℃水浴中裂解22-25h,重复1次;最后原生质体的浓度为1×108/ml。
(5)将步骤(4)中的琼脂糖块,用te缓冲液在48-53℃下洗涤2次,每次0.8-1.4h,然后浸在te缓冲液中并保存在4℃备用。
所述步骤(1)中edta溶液浓度为0.02-0.05m。
所述步骤(2)中琼脂糖先预冷至45-50℃,质量浓度1.4%,低熔点(熔点为64-65℃)。
所述步骤(3)中酶液配方为:破壁酶5-10mg/ml,nacl0.6m,nah2po48.4mm,na2hpo41.6mm,ph5.8。
所述破壁酶为溶壁酶或蜗牛酶。
所述步骤(4)中nds缓冲液配方为:sds1-2%、蛋白酶k2mg/ml,tris-hcl1m,edta0.5m,ph8.0。
所述步骤(5)中te缓冲液配方为:edta1mm,tris-hcl10mm,ph=8.0。
所述tris-hcl的ph=9.4。
本发明中酶的种类、酶解温度、酶解时间、完整染色体dna释放的nds溶解液,等等,都有着重要的作用和影响。
本发明的有益效果在于:
(1)采用真菌的分生孢子制备染色体dna,为真菌的染色体核型分析提供了一种有效可行的分子技术途径。
(2)能将染色体dna从细胞中释放出来,同时又能保持染色体dna的完整性。
附图说明
下面结合附图及具体实施方式对本发明做更进一步详细说明:
图1为本发明实施例1的稻曲病菌脉冲电泳结果图
图2为本发明实施例2的稻粒黑粉病菌脉冲电泳结果图
图3为本发明对照组1的脉冲电泳结果图
图4为本发明对照组2的脉冲电泳结果图
具体实施方式
下面结合附图,对本发明作详细的说明:
实施例1
本实施例涉及一种产孢真菌稻曲病菌的染色体dna制备方法,包括以下步骤:
(1)稻曲病菌分生孢子收集:将稻曲病菌菌丝进行液体培养7d,然后收集分生孢子,用0.05medta洗涤2次,将孢子悬浮在0.05medta中,制成浓度为2×108/ml的孢悬液;
(2)孢子琼脂糖块制备:把保温在50℃中,熔化的1.4%低熔点琼脂糖,按等体积混入稻曲病菌孢悬液,混匀后注入bio-rad的模具中制成孢子琼脂糖块,把琼脂块放入4℃凝固10-15min;
(3)原生质体琼脂糖块制备:将含孢子的琼脂糖块放入酶液中,于37℃酶解3h,酶解后的样品用无菌水洗涤2次;所诉酶液配方为:10mg/ml溶壁酶,0.6mnacl,8.4mmnah2po4,1.6mmna2hpo4,ph5.8;
(4)完整染色体琼脂糖块制备:将酶解后的样品放入nds缓冲液中,于50°c水浴中裂解24h,重复1次;所诉nds缓冲液配方为:1%sds、2mg/ml蛋白酶k,1mtris-hcl(ph9.4),0.5medta,ph8.0;最后原生质体的浓度为1×108/ml。
(5)将裂解后的琼脂糖块,用te缓冲液在50℃洗涤2次,每次1h,最后浸在te缓冲液中并保存在4°c备用。
实施例2
本实施例涉及一种产孢真菌稻粒黑粉病菌的染色体dna制备方法,包括以下步骤:
(1)稻粒黑粉病菌的分生孢子收集:收集产孢真菌的分生孢子,用0.05medta洗涤2次,将孢子悬浮在0.05medta中,制成浓度为2×108/ml的孢悬液;
(2)孢子琼脂糖块制备:把保温在50℃中,熔化的1.4%低熔点琼脂糖,按等体积混入稻粒黑粉病菌孢悬液,混匀后注入bio-rad的模具中制成孢子琼脂糖块,把琼脂块放入4℃凝固10-15min;
(3)原生质体琼脂糖块制备:将含孢子的琼脂糖块放入酶液中,于37℃酶解3h,酶解后的样品用无菌水洗涤2次;所诉酶液配方为:10mg/ml溶壁酶,0.6mnacl,8.4mmnah2po4,1.6mmna2hpo4,ph5.8;
(4)完整染色体琼脂糖块制备:将酶解后的样品放入nds缓冲液中,于50°c水浴中裂解24h,重复1次;所诉nds缓冲液配方为:2%sds、2mg/ml蛋白酶k,1mtris-hcl(ph9.4),0.5medta,ph8.0;
(5)将裂解后的琼脂糖块,用te缓冲液在50℃洗涤2次,每次1h,最后浸在te缓冲液中并保存在4°c备用。
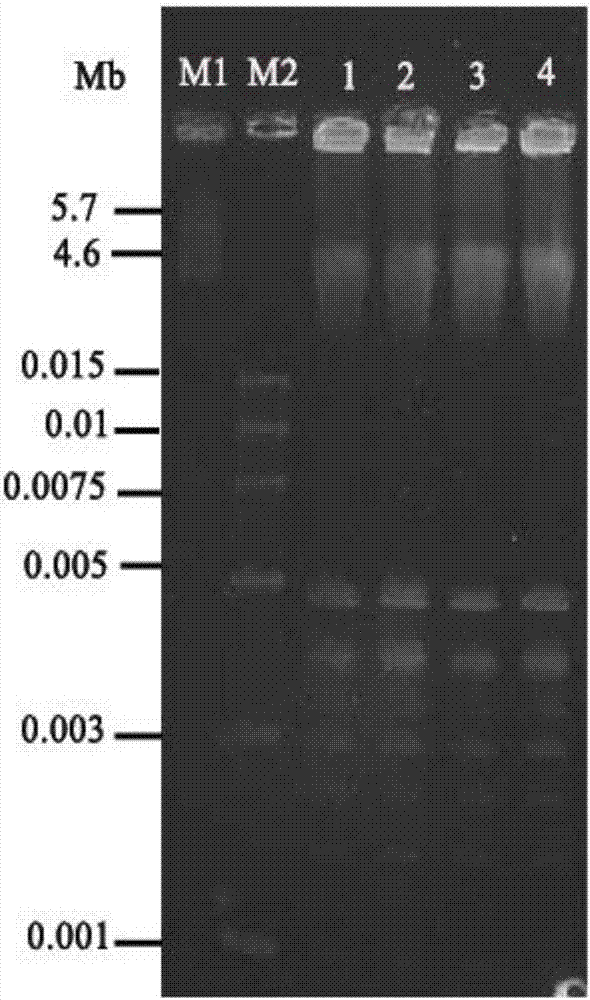
将实施例1和2制备好的样品进行脉冲电泳,电泳48h后,用含1μg/l溴化乙锭超纯水溶液染色1h,再用超纯水漂洗2次后,放在紫外成像仪中观察电泳带型并成像,如图1和图2。
从图1和图2中可以得知不同菌种条件下的有着不同的电泳结果,实施例1和实施2为最佳条件,脉冲电泳时将染色dna充分分离开,得到清晰可见的染色体dna电泳条带。
实施例3
适用于产孢真菌核型分析的染色体dna制备方法,包括以下步骤:
(1)分生孢子收集:将产孢真菌进行液体培养后过滤菌液,得到分生孢子悬浮液,离心,用edta溶液洗涤2次,再将孢子悬浮在edta溶液中,制成浓度为2×108/ml的孢悬液;edta溶液浓度为0.02m。
(2)孢子琼脂糖块制备:将步骤(1)中分生孢悬液与琼脂糖等体积混合制成孢子琼脂糖块,把孢子琼脂糖块放入3℃凝固15min;琼脂糖先预冷至45℃,质量浓度1.4%,低熔点。
(3)原生质体琼脂糖块制备:将步骤(2)中的孢子琼脂糖块放入酶液中,于36℃酶解4h,用无菌水洗涤2次;酶液配方为:溶壁酶5mg/ml,nacl0.6m,nah2po48.4mm,na2hpo41.6mm,ph5.8。
(4)完整染色体琼脂糖块制备:将步骤(3)中酶解后的琼脂糖块放入nds缓冲液中,于55℃水浴中裂解22h,重复1次;最后原生质体的浓度为1×108/ml。
nds缓冲液配方为:sds2%、蛋白酶k2mg/ml,tris-hcl1m,edta0.5m,ph8.0。tris-hcl的ph=9.4。
(5)将步骤(4)中的琼脂糖块,用te缓冲液在48℃下洗涤2次,每次0.8h,然后浸在te缓冲液中并保存在4℃备用。
te缓冲液配方为:edta1mm,tris-cl10mm,ph=8.0。tris-hcl的ph=9.4。
实施例4
适用于产孢真菌核型分析的染色体dna制备方法,包括以下步骤:
(1)分生孢子收集:将产孢真菌进行液体培养后过滤菌液,得到分生孢子悬浮液,离心,用edta溶液洗涤2次,再将孢子悬浮在edta溶液中,制成浓度为2×108/ml的孢悬液;edta溶液浓度为0.03m。
(2)孢子琼脂糖块制备:将步骤(1)中分生孢悬液与琼脂糖等体积混合制成孢子琼脂糖块,把孢子琼脂糖块放入4℃凝固10min;琼脂糖先预冷至48℃,质量浓度1.4%,低熔点。
(3)原生质体琼脂糖块制备:将步骤(2)中的孢子琼脂糖块放入酶液中,于36.5℃酶解3.5h,用无菌水洗涤2次;酶液配方为:蜗牛酶10mg/ml,nacl0.6m,nah2po48.4mm,na2hpo41.6mm,ph5.8。
(4)完整染色体琼脂糖块制备:将步骤(3)中酶解后的琼脂糖块放入nds缓冲液中,于45℃水浴中裂解25h,重复1次;最后原生质体的浓度为1×108/ml。
nds缓冲液配方为:sds1%、蛋白酶k2mg/ml,tris-hcl1m,edta0.5m,ph8.0。tris-hcl的ph=9.4。
(5)将步骤(4)中的琼脂糖块,用te缓冲液在53℃下洗涤2次,每次1.4h,然后浸在te缓冲液中并保存在4℃备用。
te缓冲液配方为:edta1mm,tris-hcl10mm,ph=8.0。tris-hcl的ph=9.4。
实施例5
适用于产孢真菌核型分析的染色体dna制备方法,包括以下步骤:
(1)分生孢子收集:将产孢真菌进行液体培养后过滤菌液,得到分生孢子悬浮液,离心,用edta溶液洗涤2次,再将孢子悬浮在edta溶液中,制成浓度为2×108/ml的孢悬液;edta溶液浓度为0.04m。
(2)孢子琼脂糖块制备:将步骤(1)中分生孢悬液与琼脂糖等体积混合制成孢子琼脂糖块,把孢子琼脂糖块放入4℃凝固12min;琼脂糖先预冷至50℃,质量浓度1.4%,低熔点。
(3)原生质体琼脂糖块制备:将步骤(2)中的孢子琼脂糖块放入酶液中,于37℃酶解3h,用无菌水洗涤2次;酶液配方为:溶壁酶8mg/ml,nacl0.6m,nah2po48.4mm,na2hpo41.6mm,ph5.8。
(4)完整染色体琼脂糖块制备:将步骤(3)中酶解后的琼脂糖块放入nds缓冲液中,于50℃水浴中裂解23h,重复1次;最后原生质体的浓度为1×108/ml。
nds缓冲液配方为:sds1.5%、蛋白酶k2mg/ml,tris-hcl1m,edta0.5m,ph8.0。tris-hcl的ph=9.4。
(5)将步骤(4)中的琼脂糖块,用te缓冲液在50℃下洗涤2次,每次1h,然后浸在te缓冲液中并保存在4℃备用。
te缓冲液配方为:edta1mm,tris-hcl10mm,ph=8.0。tris-hcl的ph=9.4。
对照组1
其它内容如实施例1中的内容,其中步骤(3)中酶解温度为34℃,则最后无法达到将染色体dna从细胞中释放出来,同时也不能保持染色体dna的完整性结果。如图3.
对照组2
其它内容如实施例1中的内容,其中步骤(4)中nds缓冲液换成其它的缓冲液(ctab),则最后无法达到将染色体dna从细胞中释放出来,同时也不能保持染色体dna的完整性结果。如图4。
- 还没有人留言评论。精彩留言会获得点赞!