一种废弃生物质资源化方法与流程
技术领域:
本发明属于生物质新能源技术领域,具体涉及一种利用微生物实现废弃生物质资源化的工艺。
背景技术:
:
随着世界范围化石能源的日益枯竭,开发与利用可再生能源成为当务之急。与以葡萄糖和淀粉为代表的第一代生物质相比,以农林废弃物为代表的第二代生物质避免了成本上升、与人争粮、与粮争地的问题,成为最适合的替代能源之一。木质纤维素作为农林废弃物的有效成分,是地球上最丰富、最廉价的可再生资源。其主要由纤维素、半纤维素和木质素组成。其中纤维素是由d-葡萄糖通过β-1,4糖苷键联结而成的长链分子,长链分子进一步通过氢键等作用力形成具有高度结晶区的超分子稳定结构。同时,半纤维素和木质素紧密镶嵌在纤维素周围。废弃生物质结构复杂且稳定,使其对化学和生物降解均具有天然的顽抗性。
鉴于木质纤维素的复杂顽抗性,其开发利用的首要环节是预处理,即采用物理、化学或生物法破坏并去除表面木质素和半纤维素,留下纤维素渣应用于后续酶解和生物转化。目前,已有人采用真菌法或真菌-化学联合预处理实现了木质素的深度去除。但真菌生长所需时间过长(10~50天),不利于工艺扩大化和商业化。与真菌相比,细菌的数量虽然较少,但可大大缩短生物处理接种时间(<7天),因此采用细菌替代真菌进行废弃生物质预处理具有重要意义。目前,国内外尚无细菌强化废弃生物质碱法预处理的相关报道。
在废弃生物质预处理过程中,还会产生大量的含木质素成分的黑液,这部分木质素通常会被丢弃或焚烧,其资源化潜力被严重忽视,不仅造成了生物质中近1/3碳资源的浪费,也带来了潜在的环境污染。此外,传统预处理的单一产品线生物精炼工艺导致目标产品的成本过高,难以扩大。不少研究提出整合预处理、酶解和发酵的一步转化法,简化了工艺流程,但未能解决木质素资源浪费的问题。因此,预处理黑液的资源化是提高废弃生物质利用率和工艺经济性的重要途径。
事实上,对于废弃生物质预处理后形成的渣和黑液,目前尚无同时实现两者的深度去除和资源化的方法。
为解决上述问题,本发明提出了一种废弃生物质资源化方法(工艺流程如附图1所示),即利用一株木质素降解菌(cupriavidusbasilensisb-8)应用于碱法预处理后,不仅可深度去除预处理渣中的残留木质素并将其资源化形成聚羟基脂肪酸酯,还可显著提高废弃生物质预处理的酶解效率。同时,将该株菌应用于预处理黑液中,进一步实现了黑液中木质素的利用和资源化。此外,cupriavidusbasilensisb-8资源化产生的聚羟基脂肪酸酯具有类似于合成塑料的物化特性及合成塑料所不具备的生物可降解性、生物相容性、光学活性、压电性、气体相隔性等许性能,在包装材料、组织工程材料、缓释材料、电学材料以及医疗材料方面有广阔的应用前景。
总的来说,本发明提出的一种废弃生物质资源化的方法可显著推动废弃生物质的开发和利用。
技术实现要素:
:
为了解决现有废弃生物质中木质素资源浪费的问题,提高废弃生物质的利用率,本发明提供了一种利用木质素降解菌实现废弃生物质资源化的方法。
本发明的技术方案为:
一种废弃生物质资源化方法,具体步骤如下:
(1)碱法预处理:将废弃生物质加入氢氧化钠溶液中,加热处理后,过滤分离,分别获得黑液和碱处理湿渣;碱处理湿渣清洗至ph呈中性,烘干至恒重,即得碱处理干渣;
(2)碱处理黑液生物资源化:将木质素降解菌cupriavidusbasilensisb-8,保藏编号为cgmccno.4240接种于含步骤(1)得到的黑液的无菌培养基中,培养后,收集菌体,采用甲醇-氯仿法提取菌体内的聚羟基脂肪酸酯;
(3)碱处理干渣的生物处理和资源化:将木质素降解菌cupriavidusbasilensisb-8,保藏编号为cgmccno.4240接种于含步骤(1)得到的碱处理干渣的无菌培养基中,培养后,过滤分离得碱-生物处理湿渣及上层清液,碱-生物处理湿渣清洗,烘干至恒重,得到碱-生物处理干渣,清液经离心收集菌体;将离心收集的菌体采用甲醇-氯仿法提取菌体内的聚羟基脂肪酸酯;
(4)碱-生物处理干渣资源化:将碱-生物处理干渣酶解,得到糖。
步骤(1)所述的废弃生物质包括水稻秸秆,玉米秸秆,甘蔗渣或柳枝稷等,将废弃生物质粉碎后20-100目过筛,超纯水清洗两遍,于60℃烘干至恒重。
步骤(1)将废弃生物质按固液比为1:10-1:20(g/ml)加入浓度为0.5-2.0%的氢氧化钠溶液中,静置于120-125℃恒温环境中10-60min后,过滤分离,分别获得黑液和碱处理湿渣;碱处理湿渣用超纯水清洗至ph呈中性,烘干至恒重,即碱处理干渣。
步骤(2)将木质素降解菌cupriavidusbasilensisb-8,保藏编号为cgmccno.4240接种于含步骤(1)得到的黑液的无菌培养基中,培养后培养1-2天后,收集菌体,采用甲醇-氯仿法提取菌体内的聚羟基脂肪酸酯。
步骤(2)中细菌接种量为10-20%(移入种子液的体积和接种后培养液体积的比例),温度25-40℃,自然ph条件,培养时间1-2天。
步骤(2)含黑液的无菌培养基为:黑液5~15g/l,(nh4)2so40.03g/l,k2hpo41g/l,kh2po41g/l,mgso4·7h2o0.2g/l,cacl20.01g/l,feso4·7h2o0.015g/l,mnso4·h2o0.01g/l。
步骤(3)将木质素降解菌接种于含碱处理干渣的无菌培养基中,培养1-2天后,过滤分离得碱-生物处理湿渣及上层清液;碱-生物处理湿渣用超纯水清洗3次,烘干至恒重,得到碱-生物处理干渣。
步骤(3)中细菌接种量为10-20%(移入种子液的体积和接种后培养液体积的比例),温度25-40℃,自然ph条件,培养时间1-2天。
步骤(3)中含碱处理干渣的无菌培养基:碱处理干渣5~15g/l,(nh4)2so40.03g/l,k2hpo41g/l,kh2po41g/l,mgso4·7h2o0.2g/l,cacl20.01g/l,feso4·7h2o0.015g/l,mnso4·h2o0.01g/l。
步骤(4)碱-生物处理干渣资源化:将碱-生物处理干渣按固液比1:40(g/ml)加入50mmph=4.8的柠檬酸缓冲液及纤维素酶12pfu/g水稻秸秆干重,在50℃条件下,酶解24h,得到糖。
本发明提供的预处理方法的优势在于:
(1)利用木质素降解菌预处理可深度去除碱处理后中残留的木质素和半纤维素,同时破坏废弃生物质结构,使废弃生物质的直杆状结构消失,而呈现出细丝状,结构变得松散,增加了酶解糖化时的可及表面。
(2)现有技术中的化学处理方法强度大,能耗高、药剂使用量大;本发明实现了木质素的深度去除,同时降低了化学预处理的强度、能耗和药耗,提高了废弃生物质中碳源利用和资源化产率。
(3)本发明采用的原料为木质纤维素的碱处理黑液,相比于现有技术中采用的其他原料,具有成本低廉的优势,可大大降低生物塑料工业化应用的成本,同时可减少木质纤维素预处理过程中带来的环境污染问题。且本发明采用的培养基中多种组分均明显减少了使用量,从而降低了成本。
(4)大幅提高酶解糖化效率,相比于未经预处理的废弃生物质,酶解效率最多提高为原来的10倍以上,实现了纤维素及半纤维成分的高效资源化。
(5)具有操作简单、二次污染小、处理时间短、成本低廉等优点。
(6)实现废弃生物质中木质素成分资源化的最大化,得到的聚羟基脂肪酸酯在可生物降解的包装材料、组织工程材料、缓释材料、电学材料以及医疗材料方面有广阔的应用前景,丰富了废弃生物质应用工艺的产品线和经济性。
本发明所使用的木质素降解菌(cupriavidusbasilensisb-8),保藏编号cgmccno.4240,是由本申请人筛选的已经做过专利保藏和专利申请的菌株。
附图说明:
图1:本发明废弃生物质资源化工艺示意图;
图2:实施例中预处理后废弃生物质糖产量变化;
图3:实施例中经本发明预处理后废弃生物质各组分变化;
图4:实施例中预处理的废弃生物质预处理前后扫描电镜分析;
图5:实施例中得到聚羟基脂肪酸酯的组分(gc-ms)分析结果。
具体实施方式
下面结合附图和具体实施例对本发明作进一步详细描述,但不作为对本发明的限定。
实施例1
(1)将水稻秸秆粉碎后60目过筛,超纯水清洗两遍,于60℃烘干至恒重。
(2)将废弃生物质置于适当大小容器中,按固液比为1:10(g/ml)加入浓度为2%的naoh溶液,静置于121℃恒温环境中60min后,过滤分离得到湿渣a1及处理黑液b。
(3)用蒸馏水反复冲洗过滤分离得到的湿渣a1,直至冲洗液ph呈中性,置于60℃烘干至恒重得干渣a2。
(4)将保存在lb斜面的cupriavidusbasilensisb-8菌体接种于lb液体培养基中,于30℃温度下,培养18h(600nm的光密度达到0.8-1.0),得到cupriavidusbasilensisb-8的种子液;其中所述lb液体培养基各成分配比为:蛋白胨10g,酵母粉5g,氯化钠10g,蒸馏水1l;所述lb斜面是在上述配方的基础上加入15g/l的琼脂;
(5)将上一步所得到的cupriavidusbasilensisb-8种子液在12000rpm条件下离心5分钟,弃去上层清液,收集菌体;
(6)将收集的cupriavidusbasilensisb-8菌体按20%接种量(移入种子液的体积和接种后培养液体积的比例),接种于a2培养基中,于30℃温度下,自然ph,培养2天,过滤分离得湿渣a3及上清液,将上清液在12000rpm条件下离心5分钟,收集沉淀的菌体c1;其中a2培养基各成分配比为:碱处理干渣a210.0g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸馏水1l;
(7)用蒸馏水反复冲洗过滤分离得到的湿渣a3,置于60℃烘干至恒重得到干渣a4。
(8)将干渣a4按固液比1:40(g/ml)加入50mm柠檬酸缓冲液(ph=4.8)及纤维素酶12pfu/g(水稻秸秆干重),在50℃条件下,酶解24h,得到高纯度糖。
(9)将步骤(5)收集的cupriavidusbasilensisb-8菌体按20%接种量(移入种子液的体积和接种后培养液体积的比例),接种于处理黑液b培养基中,于30℃温度下,自然ph,培养2天,其中所述处理黑液b培养基各成分配比为:处理黑液b5g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸馏水1l;
(10)将培养液在12000rpm条件下离心5分钟,弃去上层清液,收集菌体c2;
(11)将收集到的菌体c1、c2分别采用甲醇-氯仿法提取菌体内积累的聚羟基脂肪酸酯。
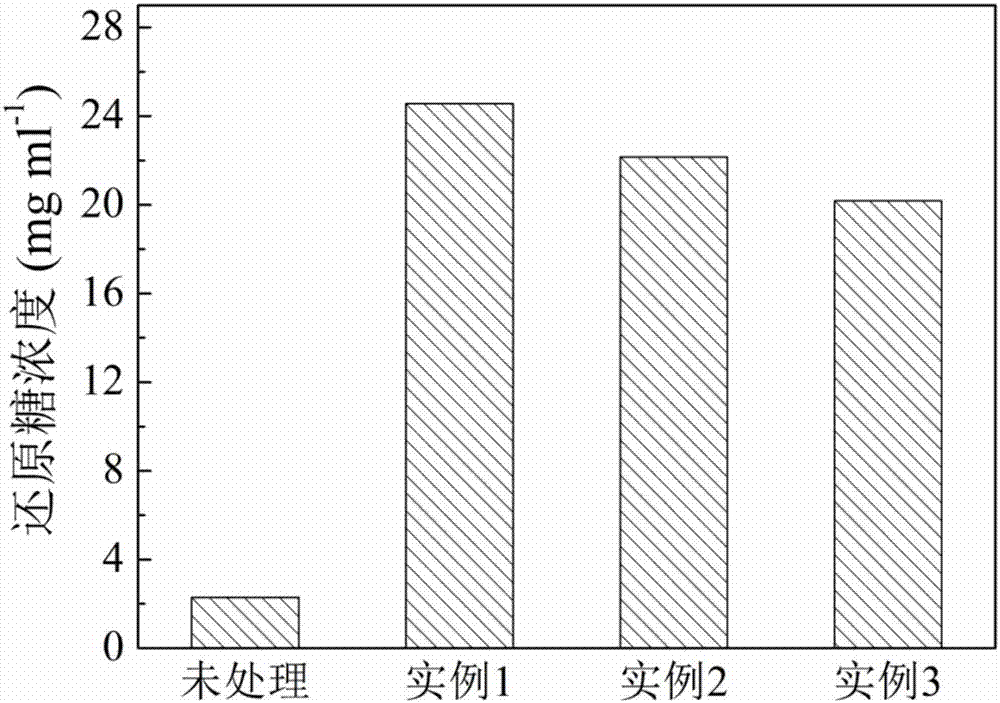
通过本实施例的实施,水稻秸秆各组分含量发生显著变化,木质素及半纤维素含量显著降低,而纤维素含量升高(如附图3)。木质素和半纤维素的去除,使得水稻秸秆的结构更容易被酶解糖化;扫描电镜图像(如附图4)所示,预处理使直杆状结构消失,原料呈现出细丝状,使废弃生物质结构变得松散。经本实施例细菌强化预处理后的水稻秸秆酶解液中还原糖含量从2.3g/l提高到24.6g/l,细菌强化预处理后的酶解效率为未处理的10.7倍(如附图2),效果显著。处理废液经生物处理后,得到聚羟基脂肪酸酯(如附图5)270mg/l,转化率高。
实施例2
(1)将水稻秸秆粉碎后60目过筛,超纯水清洗两遍,于60℃烘干至恒重。
(2)将废弃生物质置于适当大小容器中,按固液比为1:10(g/ml)加入浓度为2%的naoh溶液,静置于121℃恒温环境中15min后,过滤分离得到湿渣a1及处理黑液b。
(3)用蒸馏水反复冲洗过滤分离得到的湿渣a1,直至冲洗液ph呈中性,置于60℃烘干至恒重得干渣a2。
(4)将保存在lb斜面的cupriavidusbasilensisb-8菌体接种于lb液体培养基中,于30℃温度下,培养18h(即600nm处光密度达到0.8-1.0),得到cupriavidusbasilensisb-8的种子液;其中所述lb液体培养基各成分配比为:蛋白胨10g,酵母粉5g,氯化钠10g,蒸馏水1l;所述lb斜面是在上述配方的基础上加入15g/l的琼脂;
(5)将上一步所得到的cupriavidusbasilensisb-8种子液在12000rpm条件下离心5分钟,弃去上层清液,收集菌体;
(6)将收集的cupriavidusbasilensisb-8菌体按20%接种量(移入种子液的体积和接种后培养液体积的比例),接种于a2培养基中,于30℃温度下,自然ph,培养2天,过滤分离得湿渣a3及上清液,将上清液在12000rpm条件下离心5分钟,收集沉淀的菌体c1;其中a2培养基各成分配比为:碱处理干渣a210.0g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸馏水1l;
(7)用蒸馏水反复冲洗过滤分离得到的湿渣a3,置于60℃烘干至恒重得到干渣a4。
(8)将干渣a4按固液比1:40(g/ml)加入50mm柠檬酸缓冲液(ph=4.8)及纤维素酶12pfu/g(水稻秸秆干重),在50℃条件下,酶解24h,得到高纯度糖。
(9)将步骤(5)收集的cupriavidusbasilensisb-8菌体按20%接种量(移入种子液的体积和接种后培养液体积的比例),接种于处理黑液b培养基中,于30℃温度下,自然ph,培养2天,其中所述处理黑液b培养基各成分配比为:处理黑液b5g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸馏水1l;
(10)将培养液在12000rpm条件下离心5分钟,弃去上层清液,收集菌体c2;
(11)将收集到的菌体c1、c2分别采用甲醇-氯仿法提取菌体内积累的聚羟基脂肪酸酯。
经本实施例细菌强化预处理后的水稻秸秆酶解液中还原糖含量从2.3g/l提高到22.2g/l,酶解效率提高为未处理的9.7倍(如附图1);处理废液经生物处理后,得到聚羟基脂肪酸酯270mg/l,转化率高。
实施例3
(1)将水稻秸秆粉碎后60目过筛,超纯水清洗两遍,于60℃烘干至恒重。
(2)将废弃生物质置于适当大小容器中,按固液比为1:10(g/ml)加入浓度为1%的naoh溶液,静置于121℃恒温环境中30min后,过滤分离得到湿渣a1及处理黑液b。
(3)用蒸馏水反复冲洗过滤分离得到的湿渣a1,直至冲洗液ph呈中性,置于60℃烘干至恒重得干渣a2。
(4)将保存在lb斜面的cupriavidusbasilensisb-8菌体接种于lb液体培养基中,于30℃温度下,培养18h(即600nm处光密度达到0.8-1.0),得到cupriavidusbasilensisb-8的种子液;其中所述lb液体培养基各成分配比为:蛋白胨10g,酵母粉5g,氯化钠10g,蒸馏水1l;所述lb斜面是在上述配方的基础上加入15g/l的琼脂;
(5)将上一步所得到的cupriavidusbasilensisb-8种子液在12000rpm条件下离心5分钟,弃去上层清液,收集菌体;
(6)将收集的cupriavidusbasilensisb-8菌体按20%接种量(移入种子液的体积和接种后培养液体积的比例),接种于a2培养基中,于30℃温度下,自然ph,培养2天,过滤分离得湿渣a3及上清液,将上清液在12000rpm条件下离心5分钟,收集沉淀的菌体c1;其中a2培养基各成分配比为:碱处理干渣a210.0g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸馏水1l;
(7)用蒸馏水反复冲洗过滤分离得到的湿渣a3,置于60℃烘干至恒重得到干渣a4。
(8)将干渣a4按固液比1:40(g/ml)加入50mm柠檬酸缓冲液(ph=4.8)及纤维素酶12pfu/g(水稻秸秆干重),在50℃条件下,酶解24h,得到高纯度糖。
(9)将步骤(5)收集的cupriavidusbasilensisb-8菌体按20%接种量(移入种子液的体积和接种后培养液体积的比例),接种于处理黑液b培养基中,于30℃温度下,自然ph,培养2天,其中所述处理黑液b培养基各成分配比为:处理黑液b5g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso4·7h2o0.015g,mnso4·h2o0.01g,蒸馏水1l;
(10)将培养液在12000rpm条件下离心5分钟,弃去上层清液,收集菌体c2;
(11)将收集到的菌体c1、c2分别采用甲醇-氯仿法提取菌体内积累的聚羟基脂肪酸酯。
经本实施例细菌强化预处理后的水稻秸秆酶解液中还原糖含量从2.3g/l提高到20.2g/l,酶解效率提高为未处理的8.8倍(如附图1);处理废液经生物处理后,得到聚羟基脂肪酸酯270mg/l,转化率高。
对比例1
本对比例中的木质纤维素的预处理方法,仅包括实施例3中步骤(1)-(3)的碱溶液预处理过程,其中使用原料、操作参数等均与实施例3相同。经本对比例预处理后的水稻秸秆酶解液中还原糖含量为17.8g/l,低于实施例3中20.2g/l的还原糖产量。此外,实施例3中细菌cupriavidusbasilensisb-8能在预处理过程在菌体内积累聚羟基脂肪酸酯。从而同时实现木质纤维素去除木质素的预处理目的和木质素成分资源化的目的。
对比例2
本对比例仅仅采用碱预处理水稻秸秆,所采用的条件,即按照固液比为1:10,将水稻秸秆置于2%的naoh溶液中,120℃反应4小时。相比于未经预处理水稻秸秆,该对比例处理后的玉米秸秆酶解效率提高9倍。该对比例中固液比、处理液浓度、反应温度均与实施例1中相似,而处理时间4小时明显长于实施例1中1小时,但相对酶解效率提高比例却低于实施例1中的10.7倍。该对比例表明:本发明能够大大降低化学预处理的能耗。
对比例3
本对比例中采用的木质纤维素预处理方法,仅包括实施例2中步骤(4)-(7)的细菌cupriavidusbasilensisb-8预处理过程,具体步骤如下:
(1)将水稻秸秆粉碎后60目过筛,超纯水清洗两遍,于60℃烘干至恒重,得到干渣b。
(2)将保存在lb斜面的cupriavidusbasilensisb-8菌体接种于lb液体培养基中,于30℃温度下,培养18h(即600nm处光密度达到0.8-1.0),得到cupriavidusbasilensisb-8的种子液;其中所述lb液体培养基各成分配比为:蛋白胨10g,酵母粉5g,氯化钠10g,蒸馏水1l;所述lb斜面是在上述配方的基础上加入15g/l的琼脂;
(3)将上一步所得到的cupriavidusbasilensisb-8种子液在12000rpm条件下离心5分钟,弃去上层清液,收集菌体;
(4)将收集的cupriavidusbasilensisb-8菌体按20%接种量(移入种子液的体积和接种后培养液体积的比例),接种于水稻秸秆培养基中,于30℃温度下,自然ph,培养2天,过滤分离得湿渣c1;其中所述水稻秸秆培养基各成分配比为:干渣b10.0g,k2hpo41.0g,(nh4)2so40.03g,kh2po41.0g,mgso40.2g,cacl20.01g,feso47h2o0.015g,mnso4h2o0.01g,蒸馏水1l;
(5)用蒸馏水反复冲洗过滤分离得到的湿渣c1,置于60℃烘干至恒重得到干渣c2;
(6)将干渣c2按固液比1:40(g/ml)加入50mm柠檬酸缓冲液(ph=4.8)及纤维素酶12pfu/g(水稻秸秆干重),在50℃条件下,酶解24h,得到糖。
经本对比例预处理后的水稻秸秆酶解液中还原糖含量为3.2g/l,略高于未处理水稻秸秆的2.3g/l,但远远低于实施例2中22.2g/l的还原糖产量。说明单独采用cupriavidusbasilensisb-8预处理未能达到理想效果。
对比例4
本对比例即本发明方法处理完成后收集到的菌体c1、c2,与专利(申请号:201610569477.0)中发酵后得到的木质素降解菌cupriavidusbasilensisb-8稀释至相同菌浓后采用相同的甲醇-氯仿法提取菌体内积累的聚羟基脂肪酸酯进行对比。
专利(申请号:201610569477.0)中细菌cupriavidusbasilensisb-8可利用碱木质素合成的聚羟基脂肪酸酯的产量为0.128g/l,该产量低于本发明实施例1中270mg/l的聚羟基脂肪酸酯的产量。可能是由于本发明采用的原料黑液和碱处理干渣成分复杂,不同于该专利中的碱木质素,而且经过培养基成分的调整,以适应本发明的原料,并得到明显的优化效果。
此外,实施例1中采用的原料为木质纤维素的碱处理黑液,相比于本对比例中采用的碱木质素,具有成本低廉的优势,可大大降低生物塑料工业化应用的成本,同时可减少木质纤维素预处理过程中带来的环境污染问题。且本发明中的氮源浓度(nh4)2so40.03g/l低于该专利中(nh4)2so40.28g/l,cacl20.01g/l低于该专利中0.1g/l,feso4·7h2o0.015g/l低于该专利中0.05g/l,mnso4·h2o0.01g/l低于该专利中0.02g/l。减少了原料的使用量,从而降低成本。
实施例步骤(6)的大部分培养基成分改为与专利(申请号:201610569477.0)相同,以本发明实施例制备的碱处理干渣5~15g/l,代替碱木质素1-6g,其他组分为:(nh4)2so40.28g,k2hpo41g,mgso40.2g,cacl20.1g,feso40.05g,mnso40.02g,kh2po41g,蒸馏水1000ml。结果发现,利用专利(申请号:201610569477.0)中的培养基条件后,细菌生物量显著减少,预处理后的水稻秸秆的酶解效果仅约为实施例中的1/2。
- 还没有人留言评论。精彩留言会获得点赞!