提高同步糖化发酵反应效率的方法与流程
本申请是申请人于2010年12月17日提交的题为“提高同步糖化发酵反应效率的方法”的中国专利申请201080058488.3的分案申请。
1.相关专利申请的交叉引用
本专利申请要求提交于2009年12月23日的美国临时申请61/289,917的权益,该专利全文以引用方式并入。
2.技术领域
本发明整体涉及提高同步糖化发酵反应产物产量的方法和组合物。
3.
背景技术:
在二十世纪七十年代,由于opec减少石油输出,发生了石油危机,自那时起研究人员便一直高度关注可再生木质纤维素生物质向可发酵糖的生物转化,可发酵糖随后发酵产生能够作为液体燃料替代物的醇(如乙醇或“生物乙醇”)(bungay,“energy:thebiomassoptions”(能源:生物质选择),ny:wiley,1981;olsson和hahn-hagerdal,1996,enzymemicrob.technol.(酶微生物技术)18:312-31;zaldivar等人,2001,appl.microbiol.biotechnol.(微生物学和生物学技术应用)56:17-34;galbe和zacchi,2002,appl.microbiol.biotechnol.(微生物学和生物学技术应用)59:618-28)。最近二十年,乙醇在美国广泛用作汽油的10%共混物,或者在巴西作为车辆的单一燃料。随着石油价格的暴涨及其来源的逐渐枯竭,燃料生物乙醇将变得愈发重要。
预计木质纤维素生物质是廉价的可再生资源,能够支持以足够大的规模进行生物燃料(如生物乙醇)的可持续生产,可充分应对世界旺盛的能源需求。木质纤维素材料包括但不限于玉米秸秆(除去籽粒和根的玉米植株)、林业废弃物(例如锯屑和纸材)、来自市政固体垃圾的庭院垃圾、草本植物(例如柳枝稷)以及木本植物(例如杨树)。木质纤维素生物质有三种主要成分:半纤维素、纤维素和木质素。半纤维素是非晶态支链聚合物,通常主要由五种糖(阿拉伯糖、半乳糖、葡萄糖、甘露糖和木糖)组成。纤维素是葡萄糖分子的直链大聚合物,通常由于平行链之间氢键的作用而连接在一起形成高结晶性结构。木质素是苯基-丙烷的复杂聚合物。
木质纤维素生物质的生物处理包括使用纤维素酶和半纤维素酶分别使半纤维素和纤维素发生通常的水解反应而从中释放出糖。然后将所得的糖使用合适的发酵微生物发酵得到生物燃料例如生物乙醇。
当纤维素被纤维素酶分解时释放的葡萄糖通常是此类酶的有效抑制剂。要减少纤维素分解(或者在本文中称为“糖化”)期间葡萄糖的累积,可在糖化释放出糖的同时,加入发酵微生物,从而将释放的糖转化为生物乙醇。此配置称为同步糖化发酵(“ssf”)。一般来讲,ssf与分步水解发酵(“shf”)配置相比,所产乙醇的速率、产量和浓度更好/更高,尽管运行的温度低于大多数参与这些发酵过程的酶的最适温度。然而,典型的ssf反应是非常漫长、持久的,例如几天,以达到适度的乙醇浓度(参见,例如kadam等人,2004,biotechnol.progr.(生物技术进展)20(3):705)。
因此,在本领域中需要开发与此相关的方法和组合物,以提高ssf反应的效率,并且增加生物燃料例如生物乙醇的产量。
4.
技术实现要素:
本发明基于这样的发现:同步糖化发酵(“ssf”)反应中存在某些β-木糖苷酶会使烷基-β-吡喃木糖苷副产物快速累积。具体地讲,据发现具有保持作用机制的某些β-木糖苷酶在用于ssf反应时,能使烷基-β-吡喃木糖苷副产物快速累积,从而会导致发酵产物的产量减少。本发明还基于这样的发现:ssf反应中存在具有翻转作用机制的某些其他β-木糖苷酶会降低或最大程度减少烷基-β-吡喃木糖苷副产物累积。已发现,在ssf反应中加入具有翻转作用机制的β-木糖苷酶会提高发酵产物的产量。
对于本发明的目的来说,具有翻转作用机制的β-木糖苷酶也称为“具有翻转型β-木糖苷酶活性的酶”、“翻转型β-木糖苷酶”或“翻转型β-木糖苷酶多肽”。相反,具有保持作用机制的β-木糖苷酶也称为“具有保持型β-木糖苷酶活性的酶”、“保持型β-木糖苷酶”或“保持型β-木糖苷酶多肽”。
因此,本文提供实行ssf反应而需要减少保持型β-木糖苷酶量的改进方法。本文还提供实行ssf反应而需要增加翻转型β-木糖苷酶量的改进方法。本文还提供实行ssf反应而需要减少保持型β-木糖苷酶量,并且增加翻转型β-木糖苷酶量的改进方法。还可设想与上述改进方法及本文所述的其他方法相关的组合物。
在某些方面,本发明提供的ssf方法包括在适于发酵产物形成的条件下培养完全发酵培养基一段时间,所述完全发酵培养基包含至少一种发酵微生物、至少一种含木聚糖生物质、至少一种纤维素酶、至少一种半纤维素酶和至少一种具有翻转型β-木糖苷酶活性的酶。
在本发明中,与缺乏所述具有翻转型β-木糖苷酶活性的一种或多种酶的对照发酵培养基相比,具有翻转型β-木糖苷酶活性的一种或多种酶(在本文中作为另外一种选择且可互换地称为“至少一种酶”)在所述完全发酵培养基中的含量能够有效减少短链烷基-β-吡喃木糖苷(“axp”)(如甲基-β-吡喃木糖苷(“mxp”)、乙基-β-吡喃木糖苷(“exp”)、丙基-β-吡喃木糖苷(“pxp”)或丁基-β-吡喃木糖苷(“bxp”))的形成。例如,与缺乏所述具有翻转型β-木糖苷酶活性的一种或多种酶的对照发酵培养基相比,此类酶的含量会有效(a)减少axp的形成量至少20%、至少30%、至少40%、至少50%、至少60%、至少70%或至少80%和/或(b)增加发酵产物(如醇,例如但不限于甲醇、乙醇、丙醇、丙烷-1,3-二醇或丁醇)的产量(例如至少0.1%、至少0.5%、至少0.7%、至少1%、至少2%、至少3%、至少5%、至少7.5%、或至少10%)。在某些实施例中,与缺乏所述具有翻转型β-木糖苷酶活性的一种或多种酶的对照发酵培养基相比,此类酶的含量会将axp形成量有效减少到一定水平,该水平高于反应平衡时axp水平的不超过50%、不超过40%、不超过30%、不超过20%、或不超过10%。
在某些方面,发酵微生物能够从至少一个可发酵碳源产生醇,例如甲醇、乙醇、丙醇、丙烷-1,3-二醇或丁醇。在某些方面,发酵微生物是细菌例如运动发酵单胞菌(zymomonasmobilis)或真菌例如酵母或丝状真菌。
在某些方面,所述至少一种翻转型β-木糖苷酶是gh43家族酶。在某些实施例中,翻转型β-木糖苷酶选自fv43d,pf43a,fv43e,fv43b,af43a,fo43a,gz43a,或xynb3多肽。具体地讲,fv43d多肽(如果存在于完全发酵培养基中的话)是与seqidno:2或seqidno:2的第21至350位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。pf43a多肽(如果存在于完全发酵培养基中的话)是与seqidno:8或seqidno:8的第21至445位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。fv43e多肽(如果存在于完全发酵培养基中的话)是与seqidno:10或seqidno:10的第19至530位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。fv43b多肽(如果存在于完全发酵培养基中的话)是与seqidno:12或seqidno:12的第17至574位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。af43a多肽(如果存在于完全发酵培养基中的话)是与seqidno:14或seqidno:14的第15至558位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。fo43a多肽(如果存在于完全发酵培养基中的话)是与seqidno:24或seqidno:24的第21至348位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。gz43a多肽(如果存在于完全发酵培养基中的话)是与seqidno:22或seqidno:22的第19至340位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。xynb3多肽(如果存在于完全发酵培养基中的话)是与seqidno:25对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。
在某些方面,所述完全培养基中翻转型β-木糖苷酶多肽的量为所述含木聚糖生物质中每克木聚糖至少约0.2mg、至少约0.3mg、至少约0.4mg、至少约0.5mg、至少约0.7mg、至少约1mg、至少约2mg或至少约3mg,所述含木聚糖的生物质也是完全发酵培养基的组分。在其他方面,翻转型β-木糖苷酶多肽的量为所述含木聚糖生物质中每克木聚糖约3mg或更少、约2mg或更少、约1.5mg或更少、约1.0mg或更少、约0.7mg或更少、约0.5mg或更少、约0.4mg或更少、约0.3mg或更少、或约0.2mg或更少。在某些方面,所述完全培养基中翻转型β-木糖苷酶多肽的量在例如所述含木聚糖生物质中每克木聚糖(a)0.4mg至10mg、(b)0.5mg至2mg、(c)0.4mg至5mg、(d)0.5mg至1.5mg、(e)1mg至2mg、(f)0.3mg至3mg、(g)0.2mg至5mg、(h)0.3mg至5mg或(i)0.3mg至10mg的范围内,或所述量在这样的范围内:其上限和下限各自独立地选自前述值。
在某些方面,所述完全发酵培养基中翻转型β-木糖苷酶多肽的量基于摩尔计、基于分子量计或同时基于摩尔和分子量计超过了保持型β-木糖苷酶多肽的量。在具体实施例中,翻转型β-木糖苷酶多肽与保持型β-木糖苷酶多肽的比率基于摩尔计、基于分子量计或同时基于摩尔和分子量计为至少2:1、至少3:1、至少4:1、至少5:1、至少10:1、或至少50:1。在具体实施例中,完全发酵培养基中不存在或未检测到具有保持型β-木糖苷酶活性的酶。在某些实施例中,完全发酵培养基中未检测到保持型β-木糖苷酶活性。
根据本文所述的方法,完全发酵培养基的培养在连续、分批或分批补料条件下进行。例如,本发明的完全发酵培养基的培养是连续ssf反应、分批型ssf反应或分批补料型ssf反应。
在某些方面,本发明的方法还涵盖培养步骤前完全发酵培养基的形成。例如,完全发酵培养基能够通过将(a)至少一种发酵微生物、(b)至少一种含木聚糖生物质、(c)至少一种纤维素酶、(d)至少一种半纤维素酶、(e)至少一种翻转型β-木糖苷酶以及(f)缺乏(a)至(e)中一种或多种组分的培养基混合而形成。在具体实施例中,所述至少一种纤维素酶能够以纤维素酶制品的形式存在。例如纤维素酶制品能够是全纤维素酶制品,该制品还能够任选地包含所述至少一种半纤维素酶。在具体实施例中,纤维素酶制品是得自丝状真菌培养物的培养液,例如使用里氏木霉(t.reesei)细胞制备的里氏木霉培养物。在某些方面,里氏木霉细胞经工程改造,使得天然β-木糖苷酶基因失活或缺失。应当指出的是,“经工程改造,使得天然β-木糖苷酶基因失活或缺失的里氏木霉细胞”不仅包括原代或亲代细胞(其中失活首次发生),而且包括子代细胞(其中天然β-木糖苷酶基因是失活或缺失的)。
在某些方面,本发明的方法涉及培养包含至少一种含木聚糖生物质的发酵液。在某些方面,含木聚糖生物质为例如玉米秸秆、蔗渣、高粱、芦竹、象草、芒草、日本柳杉、小麦秸秆、柳枝稷、阔叶木浆或针叶木浆。例如,含木聚糖生物质能够合适地以浆液的形式加入ssf反应。例如,含木聚糖生物质能够以固体的形式加入ssf反应。因此,含木聚糖生物质能够合适地以液体形式(该液体形式能够是例如溶液、悬浮液或固体和液体的混合物)或以固体形式加入ssf反应。在某些实施例中,含木聚糖生物质已经过预处理。
在ssf反应发生后,任选地至完成后,能够接着进行回收步骤,其中发酵产物(例如乙醇、甲醇、丙醇、丙烷-1,3-二醇或丁醇)被回收。
本发明还提供适用于本发明方法的完全发酵培养基,例如上文和下文关于纤维素酶、半纤维素酶、β-木糖苷酶和发酵微生物组分的描述。
本发明还提供经工程改造,使得天然β-木糖苷酶基因失活或缺失的里氏木霉细胞。里氏木霉细胞能够经工程改造而重组表达gh43家族酶,gh43家族酶例如选自fv43d,pf43a,fv43e,fv43b,af43a,fo43a,gz43a,或xynb3多肽的酶。例如,fv43d多肽与seqidno:2或seqidno:2的第21至350位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。pf43a多肽与seqidno:8或seqidno:8的第21至445位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。fv43e多肽与seqidno:10或seqidno:10的第19至530位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。fv43b多肽与seqidno:12或seqidno:12的第17至574位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。af43a多肽与seqidno:14或seqidno:14的第15至558位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。fo43a多肽与seqidno:24或seqidno:24的第21至348位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。gz43a多肽与seqidno:22或seqidno:22的第19至340位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。xynb3多肽与seqidno:25对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。
本发明还提供产生纤维素酶多肽的方法,该方法包括:(a)在允许产生一种或多种纤维素酶多肽的条件下培养此类里氏木霉细胞,例如上文所述和/或下文所述的细胞,以及(b)回收纤维素酶多肽,例如通过回收包含纤维素酶多肽的培养液进行。本发明还提供由里氏木霉细胞制备的培养液,及其在糖化反应(包括例如ssf反应)中的使用。
在某些方面,本发明提供完全发酵培养基组合物,该组合物包含至少一种翻转型β-木糖苷酶、至少一种发酵微生物、至少一种含木聚糖生物质、至少一种纤维素酶、至少一种半纤维素酶和发酵培养基。翻转型β-木糖苷酶为例如gh43家族酶。在某些方面,翻转型β-木糖苷酶为选自fv43d,pf43a,fv43e,fv43b,af43a,fo43a,gz43a,或xynb3多肽的酶。发酵微生物为合适地能够将合适的碳源(例如含木聚糖生物质)或糖(例如葡萄糖、木糖、阿拉伯糖、甘露糖、半乳糖或低聚糖)直接或间接发酵为所需发酵产物的微生物,所述产物包括,例如甲醇(“meoh”)、乙醇(“etoh”)、丙醇、丙烷-1,3-二醇或丁醇。发酵微生物能够选自真菌例如酵母或丝状真菌、细菌例如运动发酵单胞菌或热纤梭菌(clostridiumthermocellum)。合适的碳源或底物包括例如含木聚糖生物质底物,该底物选自例如木质纤维素底物或其他含碳水化合物原料。某些木质纤维素底物能够包括例如纤维素、半纤维素和/或木质素。
纤维素酶为例如β-葡萄糖苷酶、内切葡聚糖酶或纤维二糖水解酶多肽。在本文中酶以它们的命名或它们所属的酶家族(如gh43家族酶;或根据ec3.2.1.91归类的酶)称呼;当它们以命名称呼时,也能够可互换地称为“[命名]多肽”(如β-葡萄糖苷酶也能够可互换地称为β-葡萄糖苷酶多肽)。纤维素酶也能够是例如全纤维素酶制品的形式。半纤维素酶是例如木聚糖酶、β-木糖苷酶、l-α-阿拉伯呋喃糖苷酶或辅助蛋白质。在某些实施例中,全纤维素酶制品能够包含一种或多种半纤维素酶多肽。
发酵培养基能够是得自部分糖化过程的培养基,或包含一定量糖化产物的培养基。此类组合物能够合适地在允许产生所关注发酵产物的条件下用于糖化反应,包括例如ssf反应。
在某些方面,一种或多种纤维素酶和/或一种或多种半纤维素酶由经基因工程改造的微生物制备,其中编码一种或多种(如果存在多于一种的天然β-木糖苷酶)天然β-木糖苷酶的基因是缺失的,或未检测到天然β-木糖苷酶活性。在某些实施例中,经工程改造产生一种或多种纤维素酶和/或一种或多种半纤维素酶的微生物不包含保持型β-木糖苷酶,或未检测到保持型β-木糖苷酶活性。
在一些方面,本发明涉及对含木聚糖生物质实行ssf反应以获得生物乙醇发酵产物的改进方法,其中所述方法包括培养包含至少一种纤维素酶、至少一种半纤维素酶和至少一种发酵微生物的发酵培养基,其中所述改进包括使用具有翻转型β-木糖苷酶活性的酶。
在相关方面,本发明还提供提高烷基-β-吡喃木糖苷产量的方法,该方法已知在许多行业应用中在需要此类产量的情况下具有用途和价值。例如,烷基-β-吡喃木糖苷在烷基-葡糖苷的合成中能够合适地用作化学中间体,烷基-葡糖苷用作可生物降解的表面活性剂和乳化剂(参见,例如k.schmid和h.tesmann,2001,alkylpolyglucosides,detergencyofspecialtysurfactants,surfactantscienceseries(烷基多葡糖苷,特异性表面活性剂的去污力,表面活性剂系列),第98卷;(f.e.fried编辑);马克德克有限公司(marceldekkerinc.),ny,第1-70页)。这些化合物自身也是诱导剂,或能够用于在许多微生物中制备诱导木聚糖酶产生的诱导剂(参见,例如m.marui等人,1985,agric.biol.chem.(农业与生物化学)49(12):3399-3407;h.shinoyama等人,1988,agric.biol.chem.(农业与生物化学)52(9):2197-2202)。此外,各种烷基-吡喃糖苷能够用作硫酸软骨素的引物,以及蛋白聚糖生物合成的刺激物(参见,例如h.shinoyama等人,1988,agric.biol.chem.52(9):2197-2202)。在本发明另一方面,ssf反应中加入具有保持作用机制的β-木糖苷酶或增加其产量能够用于提高这些有用的烷基-β-吡喃木糖苷的产量。
因此,在某些实施例中,本发明的方法包括增加保持型β-木糖苷酶的量。本文还提供实行ssf反应而需要增加保持型β-木糖苷酶量的改进方法。在其他实例中,设想了实行ssf反应而需要增加保持型β-木糖苷酶量同时减少翻转型β-木糖苷酶量的改进方法。
在其他方面,本发明提供的ssf方法包括在适于烷基-β-吡喃木糖苷形成的条件下培养完全发酵培养基一段时间,所述完全发酵培养基包含至少一种发酵微生物、至少一种含木聚糖生物质、至少一种纤维素酶、至少一种半纤维素酶和至少一种具有保持型β-木糖苷酶活性的酶,所述烷基-β-吡喃木糖苷例如甲基-β-吡喃木糖苷(“mxp”)、乙基-β-吡喃木糖苷(“exp”)、丙基-β-吡喃木糖苷(“pxp”)或丁基-β-吡喃木糖苷(“bxp”)。
在某些方面,与缺乏或具有更少量所述具有保持型β-木糖苷酶活性的酶的对照发酵培养基相比,所述至少一种具有保持型β-木糖苷酶活性的酶在所述完全发酵培养基中的含量能够有效增加短链烷基-β-吡喃木糖苷(“axp”)(如甲基-β-吡喃木糖苷(“mxp”)、乙基-β-吡喃木糖苷(“exp”)、丙基-β-吡喃木糖苷(“pxp”)或丁基-β-吡喃木糖苷(“bxp”))的形成。例如,与缺乏或具有更少量所述具有保持型β-木糖苷酶活性的一种或多种酶的对照发酵培养基相比,此类酶的含量会有效增加axp的形成量至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、或至少80%。
在某些方面,发酵微生物能够产生许多短链烷基-β-吡喃木糖苷(“axp”)化合物,包括但不限于甲基-β-吡喃木糖苷(“mxp”)、乙基-β-吡喃木糖苷(“exp”)、丙基-β-吡喃木糖苷(“pxp”)或丁基-β-吡喃木糖苷(“bxp”)化合物。在一些方面,发酵微生物是细菌例如运动发酵单胞菌或真菌例如酵母或丝状真菌。
在某些方面,所述至少一种保持型β-木糖苷酶是gh3、gh30、gh31、gh39、gh52、gh54或gh116家族酶。在某些实施例中,保持型β-木糖苷酶选自xlnd,fv30a,fv30b,fv39a,fv39b,xynb,xyla或xyl1多肽。具体地讲,xlnd多肽(如果存在于完全发酵培养基中的话)是与seqidno:40或seqidno:40的第18至804位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。fv30a多肽(如果存在于完全发酵培养基中的话)是与seqidno:42或seqidno:42的第20至537位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。fv30b多肽(如果存在于完全发酵培养基中的话)是与seqidno:44或seqidno:44的第25至485位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。fv39a多肽(如果存在于完全发酵培养基中的话)是与seqidno:46或seqidno:46的第20至439位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。fv39b多肽(如果存在于完全发酵培养基中的话)是与seqidno:48或seqidno:48的第19至456位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。xynb多肽(如果存在于完全发酵培养基中的话)是与seqidno:50对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。xyla(如果存在于完全发酵培养基中的话)是与seqidno:52对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。xyl1多肽(如果存在于完全发酵培养基中的话)是与seqidno:54或seqidno:54的第22至500位残基对应的氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的多肽。
在某些方面,所述完全培养基中保持型β-木糖苷酶多肽的量为所述含木聚糖生物质中每克木聚糖至少约0.2mg、至少约0.5mg、至少约0.7mg、至少约1mg、至少约2mg、或至少约5mg,所述含木聚糖的生物质也是完全发酵培养基的组分。在其他方面,翻转型β-木糖苷酶多肽的量为所述含木聚糖生物质中每克木聚糖约10mg或更少、约5mg或更少、约2mg或更少、约1mg或更少、约0.7mg或更少、约0.5mg或更少、或约0.2mg或更少。在某些方面,所述完全培养基中保持型β-木糖苷酶多肽的量在例如所述含木聚糖生物质中每克木聚糖(a)0.2mg至10mg、(b)0.2mg至5mg、(c)0.5mg至5mg、(d)1mg至10mg、(e)2mg至10mg、(f)0.2mg至5mg、(g)0.2mg至2mg、或(h)0.5mg至10mg的范围内,或所述量在这样的范围内:其上限和下限各自独立地选自前述值。
在某些方面,所述完全发酵培养基中保持型β-木糖苷酶多肽的量基于摩尔计、基于分子量计或同时基于摩尔和分子量计超过了翻转型β-木糖苷酶多肽的量。在具体实施例中,保持型β-木糖苷酶多肽与翻转型β-木糖苷酶多肽的比率基于摩尔计、基于分子量计或同时基于摩尔和分子量计为至少2:1、至少3:1、至少4:1、至少5:1、至少10:1、或至少50:1。在具体实施例中,完全发酵培养基中不存在或未检测到具有翻转型β-木糖苷酶活性的酶。在某些实施例中,完全发酵培养基中未检测到翻转型β-木糖苷酶活性。
根据本文所述的方法,完全发酵培养基的培养在连续、分批或分批补料条件下进行。例如,本发明的完全发酵培养基的培养是连续ssf反应、分批型ssf反应或分批补料型ssf反应。
在某些方面,本发明的方法还涵盖培养步骤前完全发酵培养基的形成。例如,完全发酵培养基能够通过将(a)至少一种发酵微生物、(b)至少一种含木聚糖生物质、(c)至少一种纤维素酶、(d)至少一种半纤维素酶、(e)至少一种保持型β-木糖苷酶以及(f)缺乏(a)至(e)中一种或多种组分的培养基混合而形成。在具体实施例中,所述至少一种纤维素酶能够以纤维素酶制品的形式存在。例如纤维素酶制品能够是全纤维素酶制品,该制品还能够任选地包含所述至少一种半纤维素酶。在具体实施例中,纤维素酶制品是得自丝状真菌培养物的培养液,例如使用里氏木霉细胞制备的里氏木霉培养物。在某些方面,里氏木霉细胞经工程改造,使得天然保持型β-木糖苷酶基因过表达,或引入外源保持型β-木糖苷酶基因并且在其中表达。应当指出的是,“经工程改造,使得天然保持型β-木糖苷酶基因过表达或引入外源保持型β-木糖苷酶基因并且在其中表达的里氏木霉细胞”不仅包括原代或亲代细胞(其中失活首次发生),而且包括子代细胞。
在某些方面,本发明的方法涉及培养包含至少一种含木聚糖生物质的发酵液。在某些方面,含木聚糖生物质为例如玉米秸秆、蔗渣、高粱、芦竹、象草、芒草、日本柳杉、小麦秸秆、柳枝稷、阔叶木浆或针叶木浆。例如,含木聚糖生物质能够合适地以浆液的形式加入ssf反应。例如,含木聚糖生物质能够以固体的形式加入ssf反应。因此,含木聚糖生物质能够合适地以液体形式(该液体形式能够是例如溶液、悬浮液或固体和液体的混合物)或以固体形式加入ssf反应。在某些实施例中,含木聚糖生物质已经过预处理。
在ssf反应发生后,任选地在完成后,能够接着进行回收步骤,其中axp产物(如mxp、exp、pxp或bxp)被回收。
本发明还提供适用于本发明方法的完全发酵培养基,例如上文和下文关于纤维素酶、半纤维素酶、β-木糖苷酶和发酵微生物组分的描述。
本发明还提供经工程改造,使得天然保持型β-木糖苷酶基因过表达,或外源保持型β-木糖苷酶基因在其中表达的里氏木霉细胞。里氏木霉细胞能够经工程改造以重组表达gh3、gh30、gh31、gh39、gh52、gh54或gh116家族酶,所述酶例如选自xlnd,fv30a,fv30b,fv39a,fv39b,xynb,xyla或xyl1多肽的酶。例如,xlnd多肽与seqidno:40或seqidno:40的第18至804位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。fv30a多肽与seqidno:42或seqidno:42的第20至537位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。fv30b多肽与seqidno:44或seqidno:44的第25至485位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。fv39a多肽与seqidno:46或seqidno:46的第20至439位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。fv39b多肽与seqidno:48或seqidno:48的第19至456位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。xynb多肽与seqidno:50对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。xyla多肽与seqidno:52或seqidno:52的第19至705位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。xyl1多肽与seqidno:54或seqidno:54的第22至500位残基对应的氨基酸序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性。
本发明还提供产生纤维素酶多肽的方法,该方法包括:(a)在允许产生一种或多种纤维素酶多肽的条件下培养此类里氏木霉细胞,例如上文所述和/或下文所述的细胞,以及(b)回收纤维素酶多肽,例如通过回收包含纤维素酶多肽的培养液进行。本发明还提供由里氏木霉细胞制备的培养液,及其在糖化反应(包括例如ssf反应)中的使用。
在某些方面,本发明提供完全发酵培养基组合物,该组合物包含至少一种保持型β-木糖苷酶、至少一种发酵微生物、至少一种含木聚糖生物质、至少一种纤维素酶、至少一种半纤维素酶和发酵培养基。保持型β-木糖苷酶是例如过表达的天然保持型β-木糖苷酶,或引入合适宿主细胞的外源β-木糖苷酶。保持型β-木糖苷酶是例如gh3、gh30、gh31、gh39、gh52、gh54或gh116家族酶。在某些方面,保持型β-木糖苷酶为选自xlnd,fv30a,fv30b,fv39a,fv39b,xynb,xyla或xyl1多肽的酶。发酵微生物为合适地能够将合适的碳源(例如含木聚糖生物质)或糖(例如葡萄糖、木糖、阿拉伯糖、甘露糖、半乳糖或低聚糖)直接或间接发酵为所需发酵产物的微生物,所述产物包括,例如甲醇、乙醇、丙醇、丙烷-1,3-二醇或丁醇。发酵微生物能够为真菌例如酵母或丝状真菌,或细菌例如运动发酵单胞菌或热纤梭菌。合适的碳源或底物能够是例如含木聚糖生物质底物,该底物选自例如木质纤维素底物或其他含碳水化合物原料。某些木质纤维素底物能够包括例如纤维素、半纤维素和/或木质素。
纤维素酶为例如β-葡萄糖苷酶、内切葡聚糖酶或纤维二糖水解酶多肽。纤维素酶也能够是例如全纤维素酶制品的形式。半纤维素酶是例如木聚糖酶、β-木糖苷酶、l-α-阿拉伯呋喃糖苷酶或辅助蛋白质。在某些实施例中,全纤维素酶制品能够包含一种或多种半纤维素酶多肽。
发酵培养基能够是得自部分糖化过程的培养基,或包含一定量糖化产物的培养基。此类组合物能够合适地在允许产生axp化合物(包括例如mxp、exp、pxp或bxp)的条件下用于糖化反应(包括例如ssf反应)。
在某些方面,一种或多种纤维素酶或一种或多种半纤维素酶由经基因工程改造的微生物制备,其中编码一种或多种(如果存在多于一种的天然β-木糖苷酶)天然β-木糖苷酶的基因是过表达的,或编码外源β-木糖苷酶的基因已引入和/或表达。在某些实施例中,与未经过相同基因工程改造的对照微生物相比,经工程改造产生一种或多种纤维素酶和/或一种或多种半纤维素酶的微生物,其保持型β-木糖苷酶活性的表达增加。在某些实施例中,经工程改造产生一种或多种纤维素酶和/或一种或多种半纤维素酶的微生物不包含翻转型β-木糖苷酶,或未检测到翻转型β-木糖苷酶活性。
在某些相关方面,本发明涉及对含木聚糖生物质实行ssf反应以获得axp产物的改进方法,其中所述方法包括培养包含至少一种纤维素酶、至少一种半纤维素酶和至少一种发酵微生物的发酵培养基,其中所述改进包括使用由里氏木霉细胞制成的纤维素酶制品,里氏木霉细胞经工程改造而过表达天然β-木糖苷酶基因,或表达外源β-木糖苷酶。在一些实施例中,过表达的天然β-木糖苷酶基因,或表达的外源β-木糖苷酶基因是编码保持型β-木糖苷酶的基因。
本文引用的所有出版物、专利、专利申请、genbank序列和atcc保藏号据此出于所有目的明确地以引用方式并入。
5.附图和附表说明
表1:利用重组运动发酵单胞菌在ssf条件下从玉米芯和葡萄糖/木糖形成exp的情况。
表2:使用各种类型生物质底物形成exp的情况。
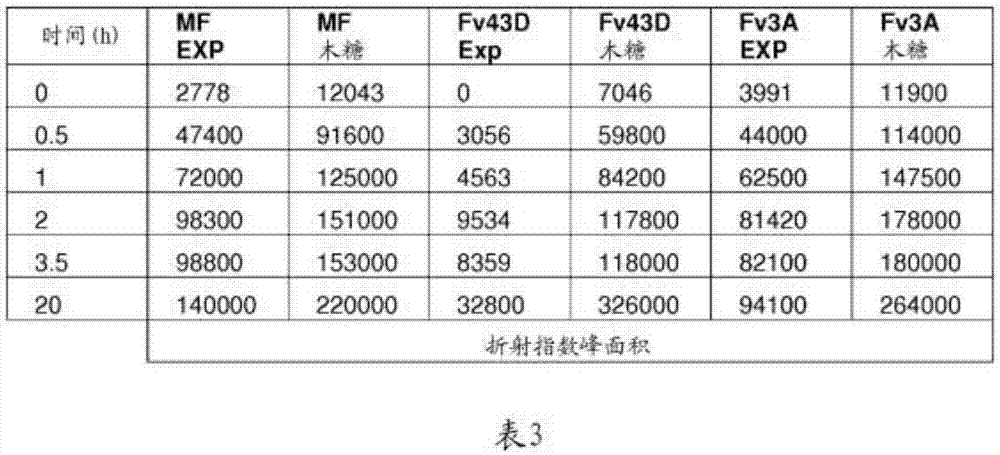
表3:在46℃
表4:构建bxl1缺失盒的引物序列。
表5:构建轮枝镰孢菌(f.verticillioides)β-木糖苷酶fv43d表达盒的引物序列。
表6:提供某些用于ssf反应的酶的序列标识汇总。
图1:在不含醇、各含0.72m的乙醇(“etoh”)、甲醇(“meoh”)或正丙醇(“n-proh”)的情况下将溶于50mm柠檬酸钠(ph4.6)、
图2:在与图1实验中描述相同的条件下出现/形成烷基-吡喃木糖苷(“axp”)后的时间进程。发酵产物的形成量以产物峰面积相对于木糖峰面积的比率表示。
图3:nmr波谱指示乙基-β-吡喃木糖苷的存在情况。
图4:在ssf条件下使用酵母和野生型运动发酵单胞菌时的exp形成情况。
图5:在酵母ssf条件下加入和不加入里氏木霉bxl1时的exp形成情况。
图6:在重组发酵单胞菌属ssf条件下,向整合型里氏木霉菌株#229产生的酶复合物中加入里氏木霉bxl1后,exp的剂量响应情况。
图7:利用如下糖化用的酶配置/混合物进行ssf反应期间的exp形成情况:accellerasetm
图8:使用糖化用的各种纯化纤维素酶和xynb3进行ssf反应期间的exp形成情况。
图9:使用整合型里氏木霉菌株#229产生的酶复合物,在里氏木霉bxl1的存在下,或在某些其他gh43家族β-木糖苷酶的存在下进行ssf反应期间的exp形成情况。
图10:在重组发酵单胞菌属ssf条件下加入fv43d后,观察到exp形成减少。
图11:在酵母ssf条件下加入fv43d后,观察到exp形成减少。
图12:向accellerasetm
图13:向纯化的纤维素酶和xynb3中加入fv43d后观察到exp形成减少。
图14a至14b:图14a示出了在重组发酵单胞菌属ssf条件下,向里氏木霉整合型菌株#229+里氏木霉bxl1产生的酶组合物或共混物中加入fv43d后,exp减少的剂量响应情况。图14b示出了在重组发酵单胞菌属ssf条件下,向整合型里氏木霉菌株#229+里氏木霉bxl1产生的酶复合物加入fo43a或gz43a后,exp的减少情况。
图15:在46℃
图16:在46℃
图17:pcr-bluntii-topo、bxl1缺失、hph-loxp的质粒图谱。
图18:topoblunt/pegl1-f的质粒图谱v43d。
图19a至19b:图19a:fv43d核苷酸序列(seqidno:1)。图19b:fv43d氨基酸序列(seqidno:2)。seqidno:2是未成熟的fv43d序列。fv43d具有对应于seqidno:2第1至20位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:2第21至350位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。预测保守域残基以黑体表示。域预测基于pfam、smart或ncbi数据库进行。
图20a至20b:图20a:里氏木霉bxl1核苷酸序列(seqidno:3)。图20b:里氏木霉bxl1氨基酸序列(seqidno:4)。信号序列标有下划线。预测保守域残基以黑体表示。域预测基于pfam、smart或ncbi数据库进行。
图21a至21b:图21a:fv3a核苷酸序列(seqidno:5)。图21b:fv3a氨基酸序列(seqidno:6)。seqidno:6是未成熟的fv3a序列。fv3a具有对应于seqidno:6第1至23位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:6第24至766位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。预测保守域残基以黑体表示。域预测基于pfam、smart或ncbi数据库进行。
图22a至22b:图22a:pf43a核苷酸序列(seqidno:7)。图22b:pf43a氨基酸序列(seqidno:8)。seqidno:8是未成熟的pf43a序列。pf43a具有对应于seqidno:8第1至20位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:8第21至445位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。预测保守域残基以黑体表示,预测碳水化合物结合组件(“cbm”)残基以大写字母表示,分隔cd和cbm的预测接头以斜体表示。域预测基于pfam、smart或ncbi数据库进行。
图23a至23b:图23a:fv43e核苷酸序列(seqidno:9)。图23b:fv43e氨基酸序列(seqidno:10)。seqidno:10是未成熟的fv43e序列。fv43e具有对应于seqidno:10第1至18位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:10第19至530位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。预测保守域残基以黑体表示。域预测基于pfam、smart或ncbi数据库进行。
图24a至24b:图24a:fv43b核苷酸序列(seqidno:11)。图24b:fv43b氨基酸序列(seqidno:12)。seqidno:12是未成熟的fv43b序列。fv43b具有对应于seqidno:12第1至16位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:12第17至574位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。预测保守域残基以黑体表示。域预测基于pfam、smart或ncbi数据库进行。
图25a至25b:图25a:af43a核苷酸序列(seqidno:13)。图25b:af43a氨基酸序列(seqidno:14)。seqidno:14是未成熟的af43a序列。af43a不具有预测信号序列,该序列能够使用signalp算法(访问地址:http://www.cbs.dtu.dk)推算出。预测保守域残基以黑体表示。域预测基于pfam、smart或ncbi数据库进行。
图26a至26b:图26a:fv51a核苷酸序列(seqidno:15)。图26b:fv51a氨基酸序列(seqidno:16)。seqidno:16是未成熟的fv51a序列。fv51a具有对应于seqidno:16第1至19位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:16第20至660位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。预测的l-α-阿拉伯呋喃糖苷酶保守域残基以黑体表示。域预测基于pfam、smart或ncbi数据库进行。
图27a至27b:图27a:里氏木霉xyn3核苷酸序列(seqidno:17)。图27b:里氏木霉xyn3氨基酸序列(seqidno:18)。seqidno:18是未成熟的里氏木霉xyn3序列。里氏木霉xyn3具有对应于seqidno:18第1至16位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:18第17至347位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。预测保守域残基以黑体表示。域预测基于pfam、smart或ncbi数据库进行。
图28a至28b:图28a:xlna核苷酸序列(seqidno:19)。图28b:xlna氨基酸序列(seqidno:20)。seqidno:20是未成熟的xlna蛋白质序列。xlna具有对应于seqidno:20第1至27位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:20第28至211位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。seqidno:19是xlna的基因组序列;起始密码子和终止密码子的核苷酸残基在图28a中以黑体示出,并且xlna基因的内含子a在图28a中标有下划线。
图29:图29示出了葡萄糖的“α”和“β”异头物构型。异头物根据异头碳上的环外氧原子和连接到构型原子(将糖定义为d或l,通常是环中最远的手性中心)上的氧原子之间的立体化学关系确定为“α”或“β”。其中这两个位置具有相同构型为α异头物;在β异头物中它们的构型相反。因此,α-d-葡萄糖的c1和c5均具有相同的立体化学结构,而β-d-葡萄糖c1的立体化学结构与c5相反。
图30a至30b:图30a:gz43a核苷酸序列(seqidno:21)。图30b:gz43a氨基酸序列(seqidno:22)。seqidno:22是未成熟的gz43a序列。gz43a具有对应于seqidno:22第1至18位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:22第19至340位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。预测保守域残基以黑体表示。域预测基于pfam、smart或ncbi数据库进行。
图31a至31b:图31a:fo43a核苷酸序列(seqidno:23)。图31b:fo43a氨基酸序列(seqidno:24)。seqidno:24是未成熟的fo43a序列。fo43a具有对应于seqidno:24第1至20位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:24第21至348位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。预测保守域残基以黑体表示。域预测基于pfam、smart或ncbi数据库进行。
图32-1至32-2:gh43家族水解酶的比对。家族成员中高度保守的氨基酸残基以黑体和下划线示出。
图33:xynb3氨基酸序列(seqidno:25)。
图34:里氏木霉bgl1氨基酸序列(seqidno:45)。信号序列标有下划线。预测保守域残基以黑体表示。编码序列在如下文献中有所描述:barnett等人,1991,bio-technology(生物技术)9(6):562-567。
图35a至35b:图35a:xlnd核苷酸序列(seqidno:39)。图35b:xlnd氨基酸序列(seqidno:40)。seqidno:40是未成熟的xlnd序列。xlnd具有对应于seqidno:40第1至17位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:40第18至804位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。
图36a至36b:图36a:fv30a核苷酸序列(seqidno:41)。图36b:fv30a氨基酸序列(seqidno:42)。seqidno:42是未成熟的fv30a序列。fv30a具有对应于seqidno:42第1至19位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:42第20至537位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。
图37a至37b:图37a:fv30b核苷酸序列(seqidno:43)。图37b:fv30b氨基酸序列(seqidno:44)。seqidno:44是未成熟的fv30b序列。fv30b具有对应于seqidno:44第1至24位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:44第25至485位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。
图38a至38b:图38a:fv39a核苷酸序列(seqidno:45)。图38b:fv39a氨基酸序列(seqidno:46)。seqidno:46是未成熟的fv39a序列。fv39a具有对应于seqidno:46第1至19位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:46第20至439位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。
图39a至39b:图39a:fv39b核苷酸序列(seqidno:47)。图39b:fv39b氨基酸序列(seqidno:48)。seqidno:48是未成熟的fv39b序列。fv39b具有对应于seqidno:48第1至18位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:48第19至456位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。
图40a至40b:图40a:xynb核苷酸序列(seqidno:49)。图40b:xynb氨基酸序列(seqidno:50)。xynb不具有signalp算法(访问地址:http://www.cbs.dtu.dk)得到的预测信号序列。
图41a至41b:图41a:xyla核苷酸序列(seqidno:51)。图41b:xyla氨基酸序列(seqidno:52)。xyla不具有signalp算法(访问地址:http://www.cbs.dtu.dk)得到的预测信号序列,但是具有uniprot算法(访问地址:http://www.uniprot.org/uniprot)预测的信号序列,该序列对应于seqidno:52第1至18位残基(标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:52第19至705位残基的序列。
图42a至42b:图42a:xyl1核苷酸序列(seqidno:53)。图42b:xyl1氨基酸序列(seqidno:54)。seqidno:54是未成熟的xyl1序列。xyl1具有对应于seqidno:54第1至21位残基(标有下划线)的预测信号序列;信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:54第22至500位残基的序列。信号序列预测使用signalp算法(访问地址:http://www.cbs.dtu.dk)进行。
图43a至43b:图43a:利用bxl1-里氏木霉菌株#229进行ssf反应第1天测量的exp和乙醇浓度,其中向ssf反应加入0.5或1.5mg/g纯化里氏木霉bxl1木聚糖,或加入1mg/g纯化fv43d木聚糖;图43b:利用bxl1-里氏木霉#229进行ssf反应第3天测量的exp和乙醇浓度,其中向ssf反应加入0.5或1.0mg/g木聚糖或纯化里氏木霉bxl1,或加入1mg/g纯化fv43d木聚糖。ssf反应条件在如下实例6中有所描述。
6.具体实施方式
本文所用缩写词的含义在下面列出:“min”和“mins”意指分钟;“hr”和“hrs”意指小时,“d”意指天,“μl”意指微升,“ml”意指毫升,“l”意指升,“nm”意指纳米,“mm”意指毫米,“cm”意指厘米,“μm”意指微米,“mm”意指毫摩尔每升,“m”意指摩尔每升,“mmol”意指毫摩尔,“μmole”意指微摩尔,“g”意指克,“μg”意指微克,“mg”意指毫克,“kg”意指千克,“rpm”或“rpm”意指每分钟转数,“vol.%”意指体积%,“wt.%”意指重量%,并且“rps”意指每秒转数。
6.1.通用定义
除非另外指明,本文引用的所有美国专利和美国专利申请全文以引用方式并入。此外,当数量、浓度或其他值或参数以范围、优选的范围或优选的上限值或优选的下限值的列表给出时,应当理解为明确地公开了沿着那些范围形成的连续统的所有范围或数字。当本文引用数值范围时,除非另外指明,该范围旨在涵盖范围的端点,以及该范围内的所有整数和分数。当限定范围时,本发明的范围不旨在局限于引用的具体值。
如本文所用,在本发明的成分或组分之前的冠词“一个”、“一种”和“该”旨在不对所述成分或组分的实例(如存在)数目构成限制。因此“一个”、“一种”和“该”应理解为包括一个或至少一个,并且成分或组分的单数词形式也包括复数,除非该数字明显意指单数。
如本文所用,术语“包含”或“包括”意指存在如权利要求中涉及的所述特征、整数、步骤或组分,但是不排除它们一个或多个其他特征、整数、步骤、组分或组的存在或添加。术语“包含”或“包括”旨在包括术语“基本上由…组成”和“由…组成”涵盖的实施例。类似地,术语“基本上由…组成”旨在包括术语“由…组成”涵盖的实施例。
如本文所用,修饰成分或反应物数量或本发明参数数量的术语“约”是指可能由于如下情形而发生数量变化:例如现实世界中用于制备浓缩物或溶液的典型测量和移液操作、这些操作中因疏忽而造成的误差、用于制备组合物或实施方法的成分的制备、来源或纯度差异等等。术语“约”还涵盖特定初始混合物形成的组合物的不同平衡条件导致的数量差异。无论是否被术语“约”修饰,权利要求包括其引用的数量的等价物。
术语“同步糖化发酵”或“ssf”是指这样的过程或反应配置,其中生物质被糖化,与此同时,通常在同一个反应容器中糖化产生的可发酵糖被酶和/或发酵微生物利用而生成产物。
术语“混合糖化发酵”或“hsf”是指这样的过程或反应配置,其中生物质被糖化至有限程度(不完全或部分糖化),然后继续进行同步糖化发酵。
术语“分步糖化发酵”、“分步水解发酵”和“shf”在本文中可以互换使用。它们是指这样的过程或反应配置,其中生物质被基本完全(例如约60%或更完全、约70%或更完全、约80%或更完全、约90%或更完全、或约95%或更完全)或完全(例如约99%或更完全、或约100%完全,使得将会从给定糖化反应释放的所有可发酵糖都释放)糖化或水解,然后进行单独且不同的发酵步骤,其中使糖化或水解步骤产生的发酵糖发酵以产生发酵产物。
术语“可发酵糖”是指在发酵过程中能够被微生物用作碳源的低聚糖和单糖。
术语“部分糖化”是指生物质的有限糖化,其中释放的可发酵糖少于糖化进行完全时将会释放的总可发酵糖。
术语“纤维素的”是指包含纤维素和附加组分(包括例如半纤维素)的组合物。
术语“糖化”是指从多糖或含多糖的材料产生可发酵糖。
术语“生物质”是指任何纤维素或木质纤维素材料,并且其包括的材料包含纤维素,任选地还包含半纤维素、木质素、淀粉、低聚糖和/或单糖。生物质也能够包含附加组分,例如蛋白质和/或脂质。生物质能够得自单个来源,或生物质能够包括得自多于一种来源的混合物。例如,生物质能够包含玉米芯和玉米秸秆的混合物或草和叶片的混合物。生物质包括但不限于生物能源作物、农业废弃物、市政固体垃圾、工业固体垃圾、来自造纸业的淤渣、庭院垃圾、木材废料和林业垃圾。生物质的实例包括但不限于玉米芯、作物废弃物例如玉米壳、玉米秸秆、草、小麦、小麦秸秆、大麦秸秆、干草、稻秆、柳枝稷、废纸、蔗渣、高粱、芦竹、象草、芒草、日本柳杉、谷物碾磨而成的组分、枝条、树枝、根、叶片、木片、锯屑、灌木和灌丛、蔬菜、果实、花和动物粪肥。
术语“糖化酶”是指能够催化生物质组分转化为可发酵糖的酶。通常情况下,当预处理生物质时,酶产生可发酵糖的效率更高。
6.2.发明详述
从纤维素材料制备物质或发酵产物通常包括三个主要步骤。这三个步骤为(1)预处理或预水解、(2)酶水解或糖化以及(3)发酵,然后回收物质或发酵产物。以下举例说明了制备乙醇的方法,但应当理解类似的方法能用于制备其他物质。
预处理。在预处理或预水解步骤中,将纤维素材料(包括例如木质纤维素材料)加热以分解木质素和碳水化合物结构,溶解大多数半纤维素,并使纤维素部分触及纤维素水解酶。加热步骤直接使用蒸汽或在浆液或混合物中进行,其中催化剂可任选地加入材料中以加速反应。合适的催化剂包括例如强酸(如硫酸和so2)或强碱(如氢氧化钠)。预处理步骤会促进酶和微生物的渗透。纤维素生物质也可经过水热蒸汽爆破预处理(参见,例如美国专利公开2002/0164730)。
糖化。在酶水解步骤(也称为糖化步骤)中,将本文所述的酶加入预处理材料中,从而将纤维素部分转化为葡萄糖和/或其他糖。糖化步骤通常在搅拌釜反应器或发酵罐中于受控ph、温度和混合条件下进行。在某些情况下,糖化步骤可持续至多200小时。糖化能够在约30℃至约65℃的温度,尤其是约50℃,以及约4和约5之间的ph,尤其是约ph4.5下进行。要制备能通过发酵微生物例如真菌(例如酵母或丝状真菌)或细菌(例如运动发酵单胞菌或热纤梭菌)代谢而制备的葡萄糖,酶水解步骤通常在β-葡萄糖苷酶的存在下进行。
发酵。在发酵步骤中,将经预处理和酶水解步骤而从纤维素材料释放的糖通过发酵生物,例如真菌(例如酵母或丝状真菌)或细菌(例如运动发酵单胞菌或热纤梭菌)发酵为乙醇(或其他物质)。
ssf。本发明提供提高反应产量的方法和组合物,其中发酵步骤与酶水解步骤在同一个容器中,优选地在受控ph、温度和混合条件下同时进行,而不是在酶水解步骤后以不同或单独的步骤进行。在某些方面,糖化和发酵在同一个容器中同时进行,即同步糖化发酵或“ssf”。如本文所述,该过程还涵盖使用“混合糖化发酵”或“hsf”配置进行的过程。在某些方面,当不超过30%、不超过25%、不超过20%、不超过15%、不超过10%、或不超过5%的生物质被糖化时引发ssf反应(例如通过将发酵微生物加入糖化反应,或通过设立一组促进发酵的条件)。如本文所用,术语“ssf”还涵盖多种糖的共发酵(sheehan和himmel,1999,“enzymes,energyandtheenvironment:astrategicperspectiveontheu.s.departmentofenergy'sresearchanddevelopmentactivitiesforbioethanol”(酶,能量和环境:关于美国能源部对生物乙醇的研究和开发活动的战略透视),biotechnol.prog.(生物技术进展)15:817-827)。
6.3酶水解
高等植物的细胞壁包含多种碳水化合物聚合物(cp)组分。这些cp组分通过共价和非共价方式相互作用,为植物提供形成刚性细胞壁和抵抗膨压所需的结构完整性。存在于植物中的主要cp为纤维素,其形成植物细胞壁的结构骨架。在纤维素生物合成期间,聚-β-1,4-d-葡萄糖链通过氢键和疏水相互作用自交联形成纤维素微纤丝,纤维素微纤丝进一步自交联形成更大的原纤维。纤维素微纤丝有些不规则,并且包含不同结晶度的区域。纤维素原纤维的结晶度取决于任意两种组分纤维素链之间氢键的紧密有序程度。低序键合因而更容易触及葡萄糖链的区域称为非晶区。
纤维素转化或解聚为葡萄糖的一般模式涉及三种酶活性。内切葡聚糖酶从内部裂解纤维素链生成短链,并且增加可触及末端的数量,然后外切葡聚糖酶对该末端作用。外切葡聚糖酶对短链的还原末端或非还原末端具有特异性,并且能够释放纤维二糖,其为葡萄糖二聚体。外切葡聚糖酶的实例包括但不限于各种纤维二糖水解酶。然后将累积的纤维二糖通过纤维二糖酶裂解形成葡萄糖。纤维二糖酶的实例包括但不限于各种β-1,4-葡萄糖苷酶。
半纤维素包含一组不同于纤维素糖单体的糖单体,纤维素包含无水葡萄糖。例如,除葡萄糖以外,半纤维素中的糖单体能够包括木糖、甘露糖、半乳糖、鼠李糖和阿拉伯糖。半纤维素主要包含d-戊糖,有时也包含少量l-糖。木糖是含量最大的糖单体,但往往也存在甘露糖醛酸和半乳糖醛酸。半纤维素包括例如木聚糖、葡糖醛酸木聚糖、阿糖基木聚糖、葡甘露聚糖和木葡聚糖。
本发明的酶和多酶组合物用于半纤维素材料,例如木聚糖、阿糖基木聚糖和含木聚糖或阿拉伯木聚糖底物的糖化。阿糖基木聚糖是由木糖和阿拉伯糖组成的多糖,其中l-α-阿拉伯呋喃糖残基作为分支点连接到β-(1,4)-连接木糖聚合物主链。
由于大部分生物质来源的复杂性(生物质来源能够包含纤维素、半纤维素、果胶、木质素、蛋白质和灰分以及其他组分),在某些方面,本发明的酶共混物能够包含具有一系列底物特异性的酶,所述酶协同通过有效方式将生物质降解为可发酵糖。用于木质纤维素糖化的多酶复合物的一个实例包含纤维二糖水解酶、木聚糖酶、内切葡聚糖酶、β-葡萄糖苷酶、β-木糖苷酶和任选地各种辅助蛋白质的混合物。
因此,本发明设想了使用能够单独或共同产生碳水化合物的一种或多种酶,碳水化合物在产生发酵产物例如乙醇的ssf反应中能够被发酵生物用作能量来源。
在某些方面,多酶组合物在ssf反应中用于碳水化合物或含碳水化合物生物质底物的水解以产生糖,所述糖在相同的反应中被发酵微生物发酵。多酶组合物(包括制备产物、酶集合体或“共混物”)包含在某些方面为非天然存在的酶的混合物(或“共混物”)。如本文所用,术语“共混物”是指:
(1)将组分酶以发酵液的形式,或以部分地或完全地分离或纯化的多肽的形式组合而制备的组合物;
(2)通过经修饰可表达一种或多种组分酶的生物制备的组合物;任选地,所述生物可经修饰而缺失一个或多个基因或使一个或多个基因产物失活,其中所述基因编码影响木聚糖水解、半纤维素水解和/或纤维素水解的蛋白质;
(3)在ssf反应期间,将组分酶同步、分步或顺序混合而制备的组合物;以及
(4)例如在ssf反应期间原位制备的酶混合物;
(5)上述(1)至(4)中任意或所有的组合。
还应当理解,能够将本文具体描述的任何酶与本文所述的任何一种或多种酶,或与任何其他可用和合适的酶组合,来制备多酶组合物。本发明不受限于或局限于本文列出或举例说明的具体示例性组合。
在本发明的方法中,在ssf反应之前或期间,包括发酵微生物增殖期间或之后,能够加入本文所述的任何酶。所述酶能够单独、以酶共混物或以发酵液等加入。
本文涉及的酶能够源自或得自任何合适的来源,包括例如细菌、真菌、酵母或哺乳动物来源。术语“得自”意指酶能够以天然酶的形式从天然产酶的生物分离,或酶能够在宿主生物中重组制备,其中重组制备的酶是宿主生物天然的或外源的,具有修饰的氨基酸序列,例如具有一个或多个缺失、插入和/或取代的氨基酸,或是本领域已知的核酸改组方法制备的酶。例如,重组制备的酶能够是作为突变体和/或天然氨基酸序列片段的酶。所谓“天然酶”是指涵盖生物基因组中天然位置的基因的产物,并且还涵盖天然变体;所谓“外源酶”是指涵盖通常不存在于宿主生物中,但通过基因转移而引入宿主生物的基因,或插入非天然生物中的基因,或嵌合基因的产物,其包括以重组方式例如通过定点诱变或改组获得的酶。
在某些方面,酶能够是纯化的。本文中用于修饰例如酶、蛋白质、多肽、多核苷酸和其他组分的物质的术语“纯化的”是指酶不含或基本上不含所述酶来源生物的其他组分。在某些方面,术语“纯化的”还涵盖其中酶不含或基本上不含所述酶得自天然生物的组分的情形。酶能够被视为“纯化的”,但仍然结合或存在少量其他蛋白质。如本文所用,术语“其他蛋白质”具体地讲是指其他酶。如本文所用,术语“纯化的”还指移除其他组分,具体地讲是指移除其他蛋白质,并且更具体地讲存在于本发明的酶的来源细胞中的其他酶。因此,酶能够是例如“基本上纯的多肽”,该多肽基本上不含其他组分。其中产生给定酶的生物能够是例如适于重组制备酶的宿主生物。例如,基本上纯的多肽能够指以50重量%或更多、60重量%或更多、70重量%或更多、80重量%或更多、90重量%或更多、95重量%或更多、98%或更多、或99%或更多的含量存在于混合物中作为其中一部分的多肽。基本上不含其他组分的多肽是存在于包含小于40重量%、小于30重量%、小于20重量%、小于10重量%、小于5重量%、小于2重量%、或小于1重量%其他组分的混合物中的多肽。
6.3.1.纤维素酶
本发明的酶共混物能够包含一种或多种纤维素酶。纤维素酶是将纤维素(β-1,4-葡聚糖或β-d-葡糖苷键)水解形成葡萄糖、纤维二糖、纤维低聚糖等的酶。纤维素酶习惯上分为三种主要类型:内切葡聚糖酶(ec3.2.1.4)(“eg”)、外切葡聚糖酶或纤维二糖水解酶(ec3.2.1.91)(“cbh”)和β-葡萄糖苷酶(β-d-葡萄糖苷葡萄糖水解酶;ec3.2.1.21)(“bg”)(knowles等人,1987,trendsinbiotechnol.(生物技术趋势)5(9):255-261和schulein,1988,methodsofenzymology(酶学方法)160:234-242)。内切葡聚糖酶主要作用于纤维素纤维的非晶部分,而纤维二糖水解酶能够降解结晶纤维素。
根据本发明的方法和组合物使用的纤维素酶能够得自特别是一种或多种以下生物:柄毛皮伞(crinipellisscapella)、菜豆壳球孢(macrophominaphaseolina)、嗜热毁丝菌(myceliophthorathermophila)、粪生粪壳菌(sordariafimicola)、拟刺盘孢周刺座霉(volutellacolletotrichoides)、太瑞斯梭孢壳霉(thielaviaterrestris)、支顶孢属(acremoniumsp.)、黑耳(exidiaglandulosa)、木蹄层孔菌(fomesfomentarius)、绵皮孔菌属(spongipellissp.)、红根囊壶菌(rhizophlyctisrosea)、微小根毛霉(rhizomucorpusillus)、闪光须霉(phycomycesniteus)、弗雷生剌枝霉(chaetostylumfresenii)、棉色二孢(diplodiagossypina)、异色尾孢藻(ulosporabilgramii)、集孢粪盘菌(saccobolusdilutellus)、疣孢青霉(penicilliumverruculosum)、产黄青霉(penicilliumchrysogenum)、疣状顶孢霉(thermomycesverrucosus)、合生腐皮壳菌(diaporthesyngenesia)、黄瓜炭疽菌(colletotrichumlagenarium)、黑孢霉属(nigrosporasp.)、团炭角菌(xylariahypoxylon)、松色丛赤壳菌(nectriapinea)、大孢粪壳菌(sordariamacrospora)、嗜热梭孢壳霉(thielaviathermophila)、突孢毛壳(chaetomiummororum)、绿毛壳(chaetomiumvirscens)、巴西毛壳(chaetomiumbrasiliensis)、链丝毛壳菌(chaetomiumcunicolorum)、syspastosporaboninensis、多生枝鼻菌(cladorrhinumfoecundissimum)、嗜热柱霉(scytalidiumthermophila)、链孢粘帚菌(gliocladiumcatenulatum)、尖孢镰孢菌番茄亚种(fusariumoxysporumssp.lycopersici)、尖孢镰孢菌西番莲亚种(fusariumoxysporumssp.passiflora)、镧素对镰孢菌(fusariumsolani)、蛇形镰孢菌(fusariumanguioides)、梨孢镰孢菌(fusariumpoae)、黑腐质霉(humicolanigrescens)、灰腐质霉(humicolagrisea)、网纹斑褶菌(panaeolusretirugis)、血红栓菌(trametessanguinea)、裂褶菌(schizophyllumcommune)、粉红单端孢(trichotheciumroseum)、小球壳孢菌(microsphaeropsissp.)、粪盘菌(acsobolusstictoideusspej.)、点孔座壳(poroniapunctata)、多节孢属(nodulisporumsp.)、木霉属(trichodermasp.)(如里氏木霉(trichodermareesei))和柱孢菌属(cylindrocarponsp.)。
在具体实施例中,如以下小节描述的卡尔科弗卢尔测定法所测定,用于本发明组合物的纤维素酶能够达到至少0.1、至少0.2、至少0.3、至少0.4、或至少0.5分率产物。在一些实施例中,如以下小节描述的卡尔科弗卢尔测定法所测定,用于本发明组合物的纤维素酶是全纤维素酶和/或能够达到至少0.1、至少0.2、至少0.3、至少0.4、或至少0.5分率产物。在一些实施例中,如卡尔科弗卢尔测定法所测定,用于本发明组合物的纤维素酶是全纤维素酶和/或能够达到约0.1至约0.5、或约0.1至约0.4、或约0.2至约0.4、或约0.3至约0.4、或约0.2至约0.5、或约0.3至约0.5分率产物。
6.3.1.1.使用卡尔科弗卢尔荧光增白剂进行纤维素酶活性测定
磷酸溶胀纤维素(pasc)使用如下文献的修订方案从avicelph-101制备:walseth,1971,tappi(纸浆的造纸工业技术协会)35:228和wood,1971,biochem.(生物化学)j.121:353-362。简而言之,在示例性方法中,将avicel溶解于浓磷酸中,然后使用冷去离子水沉淀。收集纤维素并且用水洗涤达到中性ph后,将其在50mm乙酸钠缓冲液(ph5.0)中稀释到1%固体含量。
所有酶稀释液均使用50mm乙酸钠缓冲液(ph5.0)制备。将gc220纤维素酶(daniscousinc.,genencor)稀释至2.5、5、10和15mg蛋白质/gpasc,以绘制线性校准曲线。将待测试的样品稀释至校准曲线的范围内,即得到0.1至0.4分率产物的响应。向合适容器例如96-孔微量滴定板中的每20μl酶溶液加入一百五十(150)μl冷的1%pasc。盖上滴定板,并且在培养箱/摇床中以200rpm的转速在50℃下温育2小时。然后使用100μl溶于100mm甘氨酸(ph10)的50μg/ml卡尔科弗卢尔淬灭反应。荧光在荧光酶标仪上读取,激发波长ex=365nm,发射波长em=435nm。根据以下公式得到结果,以分率产物表示:
fp=1-(fl样品-含纤维二糖的fl缓冲液)/(fl起点酶–含纤维二糖的fl缓冲液),
其中“fp”为分率产物,并且“fl”为荧光单位。
6.3.1.2.β-葡萄糖苷酶
本发明的酶共混物任选地包含一种或多种β-葡萄糖苷酶。如本文所用,术语“β-葡萄糖苷酶”是指归为或归入ec3.2.1.21的β-d-葡萄糖苷葡萄糖水解酶和/或某些糖基水解酶(“gh”)家族,包括但不限于gh家族1、3、9或48成员酶。在某些方面,该术语是指能够催化纤维二糖水解释放β-d-葡萄糖的酶。
β-葡萄糖苷酶能够从任何合适的微生物获得。它们能够以重组方式获得或制备,或能够从商业来源获得。合适的β-葡萄糖苷酶能够例如从微生物,如细菌和真菌获得。例如,合适的β-葡萄糖苷酶能够从丝状真菌获得。
在某些方面,合适的β-葡萄糖苷酶能够从棘孢曲霉(aspergillusaculeatus)(kawaguchi等人,1996,gene(基因)173:287-288)、白曲霉(aspergilluskawachi)(iwashita等人,1999,appl.environ.microbiol.(微生物学应用和环境)65:5546-5553)、米曲霉(aspergillusoryzae)(pct专利申请公布wo2002/095014)、双氮纤维单胞菌(cellulomonasbiazotea)(wong等人,1998,gene(基因)207:79-86)、绳状青霉(penicilliumfuniculosum)(pct专利申请公布wo200478919)、扣囊复膜酵母(saccharomycopsisfibuligera)(machida等人,1988,appl.environ.microbiol.(微生物学应用和环境)54:3147-3155)、粟酒裂殖酵母(schizosaccharomycespombe)(wood等人,2002,nature(自然)415:871-880)或里氏木霉获得。例如,得自里氏木霉的合适的β-葡萄糖苷酶能够包括β-葡萄糖苷酶1(美国专利6,022,725)、里氏木霉β-葡萄糖苷酶3(美国专利6,982,159)、里氏木霉β-葡萄糖苷酶4(美国专利7,045,332)、里氏木霉β-葡萄糖苷酶5(美国专利7,005,289)、里氏木霉β-葡萄糖苷酶6(美国专利申请公布20060258554)或里氏木霉β-葡萄糖苷酶7(美国专利申请公布20060258554)。
在一些实施例中,合适的β-葡萄糖苷酶能够通过表达编码β-葡萄糖苷酶的基因制备。例如,合适的β-葡萄糖苷酶能够例如通过某些革兰氏阳性生物(例如芽孢杆菌(bacillus)或放线菌(actinomycetes))或通过真核宿主(例如木霉、曲霉(aspergillus)、酵母(saccharomyces)或毕赤酵母(pichia))分泌至细胞外间隙。
合适的β-葡萄糖苷酶也能够从商业来源获得。适用于本发明方法、组合物和其他实施例的市售β-葡萄糖苷酶制品的实例包括但不限于以accellerasetmbg(丹尼斯科美国有线公司,杰能科(daniscousinc.,genencor))商购获得的里氏木霉β-葡萄糖苷酶、novozymtm188(得自黑曲霉的β-葡萄糖苷酶)、农杆菌属(agrobacteriumsp.)β-葡萄糖苷酶和购自megazyme(megazymeinternationalirelandltd.,braybusinesspark,bray,co.(wicklow,ireland))的海栖热袍菌(thermatogamaritima)β-葡萄糖苷酶。
在某些方面,合适的β-葡萄糖苷酶能够是全纤维素酶的组分,如以下第6.3.1.5节所述。
β-葡萄糖苷酶活性能够通过本领域已知的方法测定。例如,能够使用如下文献所述的测定法:chen等人,1992,biochimicaetbiophysicaacta(生物化学与生物物理学报)121:54-60。在该测定法中,一个单位pnpg表示在50℃(或122℉)和ph4.8下10分钟内从对硝基苯基-β-d-吡喃葡萄糖苷释放1μmol硝基酚。
6.3.1.3.内切葡聚糖酶
本发明的酶共混物任选地包含一种或多种内切葡聚糖酶。术语“内切葡聚糖酶”是指归为ec3.2.1.4的任何多肽。
在某些方面,本发明的方法和组合物中使用里氏木霉eg1(penttila等人,1986,gene(基因)63:103-112)和/或里氏木霉egii(saloheimo等人,1988,gene(基因)63:11-21)。在其他方面,内切葡聚糖酶能够是里氏木霉内切葡聚糖酶vi(参见例如美国专利7,351,568)、内切葡聚糖酶vii(参见例如美国专利7,449,319)或内切葡聚糖酶viii(参见例如美国专利7,049,125)。
在具体实施例中,合适的内切葡聚糖酶能够是太瑞斯梭孢壳霉热稳定内切葡聚糖酶(kvesitadaze等人,1995,appl.biochem.biotechnol.(生物化学和生物技术应用)50:137-143)、里氏木霉egiii(okada等人,1988,appl.environ.microbiol.(微生物学应用和环境)64:555-563)、egiv(saloheimo等人,1997,eur.j.biochem.(欧洲生物化学杂志)249:584-591)、eg5(saloheimo等人,1994,mol.microbiol.(分子微生物学)13:219-228)、egvi(美国专利申请公布20070213249)或egvii(美国专利申请公布20090170181)、解纤维热酸菌(acidothermuscellulolyticus)ei内切葡聚糖酶(美国专利5,536,655)、特异腐质霉(humicolainsolens)内切葡聚糖酶v(egv)(蛋白质数据库登录号4eng)、坚孢葡萄单孢(staphylotrichumcoccosporum)内切葡聚糖酶(美国专利申请公布20070111278)、棘孢曲霉内切葡聚糖酶f1-cmc(ooi等人,1990,nucleicacidres.(核酸研究)18:5884)、白曲霉(aspergilluskawachii)ifo4308内切葡聚糖酶cmcase-1(sakamoto等人,1995,curr.genet.(当代遗传学)27:435-439)、或胡萝卜软腐欧文氏菌(erwiniacarotovara)(saarilahti等人,1990,gene(基因)90:9-14)、嗜热支顶孢(acremoniumthermophilum)alko4245内切葡聚糖酶(美国专利公布20070148732)。
适用于本发明的方法和组合物的内切葡聚糖酶也能够是例如pct专利申请公布wo91/17243、wo91/17244、wo91/10732或美国专利6,001,639所述的那些。
6.3.1.4.纤维二糖水解酶
如本文所用,术语“纤维二糖水解酶”是指归为ec3.2.1.91的任何纤维二糖水解酶。本发明的方法和组合物能够合适地包含一种或多种纤维二糖水解酶(“cbh”)。
在某些方面,里氏木霉cbhi(shoemaker等人,1983,bio/technology(生物/技术)1:691-696)和/或cbhii(teeri等人,1983,bio/technolgy(生物/技术)1:696-699)能够用于本发明的方法和组合物。
在某些方面,合适的cbh能够是双孢蘑菇(agaricusbisporus)cbh1(swissprot登录号q92400)、棘孢曲霉cbh1(swissprot登录号o59843)、构巢曲霉(aspergillusnidulans)cbha(genbank登录号af420019)、构巢曲霉cbhb(genbank登录号af420020)、黑曲霉cbha(genbank登录号af156268)、黑曲霉cbhb(genbank登录号af156269)、麦角菌(clavicepspurpurea)cbh1(swissprot登录号o00082)、炭色旋孢腔菌(cochlioboluscarbonarum)cbh1(swissprot登录号q00328)、寄生隐丛赤壳菌(cryphonectriaparasitica)cbh1(swissprot登录号q00548)、尖孢镰孢菌cbh1(cel7a)(swissprot登录号p46238)、灰腐质霉cbh1.2(genbank登录号u50594)、灰腐质霉高温变种(humicolagriseavar.thermoidea)cbh1(genbank登录号d63515)、灰腐质霉高温变种cbhi.2(genbank登录号af123441)、灰腐质霉高温变种exo1(genbank登录号ab003105)、热白丝菌(melanocarpusalbomyces)cel7b(genbank登录号aj515705)、粗糙脉孢菌(neurosporacrassa)cbhi(genbank登录号x77778)、绳状青霉cbhi(cel7a)(美国专利公布20070148730)、微紫青霉(penicilliumjanthinellum)cbhi(genbank登录号s56178)、黄孢原毛平革菌(phanerochaetechrysosporium)cbh(genbank登录号m22220)、黄孢原毛平革菌cbhi-2(cel7d)(genbank登录号l22656)、埃默森篮状菌(talaromycesemersonii)cbh1a(genbank登录号af439935)、绿色木霉(trichodermaviride)cbh1(genbank登录号x53931)或草茹(volvariellavolvacea)v14cbh1(genbank登录号af156693)。
6.3.1.5.全纤维素酶
在某些方面,本发明的酶共混物包含全纤维素酶。如本文所用,“全纤维素酶”是指含天然存在的和非天然存在的纤维素酶的组合物,该组合物包含:(1)内切葡聚糖酶,其裂解纤维素的内部β-1,4键,得到短葡萄糖寡聚糖;(2)纤维二糖水解酶,其以“外切”方式发挥作用,从短葡萄糖寡聚糖释放纤维二糖单位;纤维二糖单位的实例包括β-1,4-葡萄糖-葡萄糖二糖,以及(3)β-葡萄糖苷酶,其催化作为葡萄糖二聚体的短纤维低聚糖或纤维二糖释放葡萄糖单体。
“含天然存在的纤维素酶的”组合物是由天然来源制备的组合物,该组合物具有一种或多种纤维二糖水解酶类型、一种或多种内切葡聚糖酶类型以及一种或多种β-葡萄糖苷酶类型组分或活性,其中这些组分或活性各自以天然的、未受人工影响的比例和水平存在。因此,含天然存在的纤维素酶的组合物为例如这样的生物所产生的组合物,该生物未针对纤维素水解酶进行修饰,因此组分酶的比例和水平与自然界中天然生物产生的无差别。“含非天然存在的纤维素酶的组合物”是指通过以下方法产生的组合物:(1)将组分纤维素水解酶以天然存在的比例或非天然存在的(即改变的)比例混合;或(2)修饰生物,使其过表达或低表达一种或多种纤维素水解酶;或(3)修饰生物,使得至少一种纤维素水解酶缺失。“含非天然存在的纤维素酶的”组合物也能够指调整天然存在生物的培养条件,使得天然存在生物在非天然条件下生长,产生水平或比例改变的酶,从而得到的组合物。因此,在一些实施例中,本发明的全纤维素酶制品能够具有一种或多种缺失和/或过表达的eg和/或cbh和/或β-葡萄糖苷酶。在本发明中,全纤维素酶制品能够得自任何能够水解纤维素材料的微生物。在一些实施例中,全纤维素酶制品是丝状真菌全纤维素酶。例如,全纤维素酶制品能够得自支顶孢属(acremonium)、曲霉属(aspergillus)、裸胞壳属(emericella)、镰孢属(fusarium)、腐质霉属(humicola)、毛霉菌属(mucor)、毁丝菌属(myceliophthora)、脉孢菌属(neurospora)、青霉属(penicillium)、柱霉属(scytalidium)、梭孢壳属(thielavia)、弯颈霉属(tolypocladium)或木霉属(trichoderma)菌种。全纤维素酶制品是例如棘孢曲霉、泡盛曲霉(aspergillusawamori)、臭曲霉(aspergillusfoetidus)、日本曲霉(aspergillusjaponicus)、构巢曲霉、黑曲霉或米曲霉全纤维素酶。此外,全纤维素酶制品能够是拟棒座镰孢菌(fusariumbactridioides)、小麦镰孢菌(fusariumcerealis)、克地镰孢菌(fusariumcrookwellense)、黄色镰孢菌(fusariumculmorum)、禾谷镰孢菌(fusariumgraminearum)、禾赤镰孢菌(fusariumgraminum)、异孢镰孢菌(fusariumheterosporum)、荆条镰孢菌(fusariumnegundi)、尖孢镰孢菌(fusariumoxysporum)、多枝镰孢菌(fusariumreticulatum)、粉红镰孢菌(fusariumroseum)、接骨木镰孢菌(fusariumsambucinum)、肤色镰孢菌(fusariumsarcochroum)、拟枝孢镰孢菌(fusariumsporotrichioides)、硫色镰孢菌(fusariumsulphureum)、簇囊镰孢菌(fusariumtorulosum)、拟丝孢镰孢菌(fusariumtrichothecioides)或毒性镰孢菌(fusariumvenenatum)全纤维素酶制品。全纤维素酶制品也能够是金孢子菌(chrysosporiumlucknowense)、特异腐质霉、绵毛状腐质霉(humicolalanuginosa)、米赫毛霉(mucormiehei)、嗜热毁丝菌、粗糙脉孢菌、产紫青霉(penicilliumpurpurogenum)、绳状青霉、嗜热革节孢(scytalidiumthermophilum)或太瑞斯梭孢壳霉全纤维素酶制品。此外,全纤维素酶制品能够是哈茨木霉(trichodermaharzianum)、康宁木霉(trichodermakoningii)、长枝木霉(trichodermalongibrachiatum)、里氏木霉(例如rl-p37(sheir-neissg等人,appl.microbiol.biotechnol.(微生物和生物技术应用)1984,20,第46-53页)、qm9414(atccno.26921)、nrrl15709、atcc13631、56764、56466、56767)或绿色木霉(例如atcc32098和32086)全纤维素酶制品。
具体地讲,全纤维素酶制品能够合适地为里氏木霉rutc30全纤维素酶制品,该制品以里氏木霉atcc56765得自美国典型培养物保藏中心(americantypeculturecollection)。例如,全纤维素酶制品也能够合适地为绳状青霉全纤维素酶,该制品以绳状青霉atccno.10446得自美国典型培养物保藏中心。
全纤维素酶制品也能够从商业来源获得。适用于本发明方法和组合物的市售纤维素酶制品的实例包括例如celluclasttm和cellictm(novozymesa/s)和laminextmbg、indiagetm44l、primafasttm100、primafasttm200、spezymetmcp、accellerasetm1000和accellerasetm1500(丹尼斯科美国有线公司,杰能科(daniscous.inc.,genencor))。
合适的全纤维素酶制品能够使用本领域已知的任何微生物培养方法,尤其是发酵制备,使能够水解纤维素材料的酶得到表达。如本文所用,“发酵”是指摇瓶培养、小规模或大规模发酵,例如在允许纤维素酶和/或受关注的酶表达和/或分离的条件下,使用合适的培养基,在实验室或工业发酵罐中进行的连续、分批、分批补料或固态发酵。
一般来讲,在适于产生能够水解纤维素材料的酶的细胞培养基中培养微生物。培养使用本领域已知的步骤和变化在合适的营养培养基中进行,所述培养基包含碳源和氮源及无机盐。适于生长和纤维素酶产生的培养基、温度范围和其他条件是本领域已知的。作为非限制性实例,通过里氏木霉产生纤维素酶的典型温度范围为24℃至28℃。
通过发酵制备全纤维素酶制品后,即能够按原样使用,不需要回收和/或纯化或只需要最低程度地回收和/或纯化。例如,一旦纤维素酶分泌至细胞培养基中,即能够直接使用包含纤维素酶的细胞培养基。全纤维素酶制品能够包含未分离的发酵材料内容物,其包括用过的细胞培养基、胞外酶和细胞。在另一个方面,全纤维素酶制品也能够经过多个常规步骤,例如沉淀、离心、亲和色谱、过滤等等进一步处理。例如,全纤维素酶制品能够浓缩后直接使用无需进一步纯化。例如,全纤维素酶制品能够配制为包含发酵后降低细胞活力或杀死细胞的某些化学试剂。例如,能够使用本领域已知的方法裂解或透化细胞。
全纤维素酶制品的内切葡聚糖酶活性能够使用羧甲基纤维素(cmc)作为底物测定。合适的测定法测量酶混合物对cmc作用产生的还原末端,其中1个单位为释放1μmol产物/min的酶量(ghose,t.k.,pure&appl.chem.(纯粹与应用化学)1987,59,第257-268页)。
全纤维素酶能够是富含β-葡萄糖苷酶的纤维素酶。富含β-葡萄糖苷酶的全纤维素酶通常包含β-葡萄糖苷酶和全纤维素酶制品。富含β-葡萄糖苷酶的全纤维素酶组合物能够通过重组方法制备。例如,此类全纤维素酶制品能够在能够产生全纤维素酶的微生物中表达β-葡萄糖苷酶来获得。例如,富含β-葡萄糖苷酶的全纤维素酶组合物也能够包含全纤维素酶制品和β-葡萄糖苷酶。例如,富含β-葡萄糖苷酶的全纤维素酶制品能够合适地包含基于该共混物/组合物中蛋白质的总重量计至少5重量%、7重量%、10重量%、15重量%或20重量%以及至多25重量%、30重量%、35重量%、40重量%或50重量%的β-葡萄糖苷酶。
在某些方面,合适的全纤维素酶能够从经遗传工程改造而减少或消除保持型β-木糖苷酶活性的微生物获得。在其他方面,合适的全纤维素酶能够从经遗传工程改造而增加翻转型β-木糖苷酶活性的微生物获得。在另外方面,合适的全纤维素酶能够从经遗传工程改造而不仅减少或消除保持型β-木糖苷酶活性,而且增加翻转型β-木糖苷酶活性的微生物获得。例如,全纤维素酶能够合适地从经工程改造而使得天然bxl1基因缺失的里氏木霉获得。在另一个实例中,全纤维素酶能够合适地从经工程改造而重组表达具有翻转型β-木糖苷酶活性的酶的里氏木霉获得。在另一个实例中,全纤维素酶能够合适地从经工程改造而使其天然bxl1基因缺失,并且重组表达具有翻转型β-木糖苷酶活性的酶的里氏木霉获得。具有翻转型β-木糖苷酶活性的酶的实例包括但不限于fv43d和本文第6.4节中所述的其他酶。
β-木糖苷酶活性能够通过测量人工底物对硝基苯基-β-吡喃木糖苷的水解水平来确定。在反应进程期间,水解反应能够使用1h-nmr分析来跟踪。产生糖苷键还原末端的残基异头质子根据其直立或平伏取向的不同而具有不同的化学位移,正如水解后新形成的还原糖的异头质子一样。与水解反应相比,新形成的还原糖异头质子变旋为直立和平伏形式的平衡混合物更慢。因此,对最初形成的还原末端异头质子的取向与底物中存在的形式进行比较的1h-nmr测定是保持构型的机制相比于翻转构型的机制的测定法。实验方法在以下文献中有所描述:例如pauly等人,1999,glycobiology(糖生物学v43d)9:93-100。
作为另外一种选择,水解的水平能够通过鉴定保持型酶的转糖基酶活性来确定,翻转型酶中不存在该活性。此类测定的实例在图16中示出。木二糖或木糖低聚物在保持型酶(例如
6.3.2.半纤维素酶
多种真菌和细菌能够通过酶法水解半纤维素。与纤维素降解类似,半纤维素水解涉及多种酶的协同作用。半纤维素酶通常分为三大类:攻击多糖链内部化学键的内切作用酶,从多糖链的还原或非还原末端向前作用的外切作用酶,以及水解木质素糖苷键的辅助酶、乙酰酯酶和/或酯酶。酯酶的实例能够包括香豆酸酯酶和阿魏酸酯酶(wong等人,1988,microbiol.rev.(微生物学评论)52:305-317;tenkanen和poutanen,1992,“significanceofesterasesinthedegradationofxylans”(酯酶在木聚糖降解中的重要意义),xylansandxylanases(木聚糖和木聚糖酶),visser等人编辑,elsevier,newyork,n.y.,第203-212页;coughlan和hazlewood,1993,“hemicelluloseandhemicellulases”(半纤维素和半纤维素酶),portland,london,uk;brigham等人,1996,“hemicellulases:diversityandapplications”(半纤维素酶:多样性和应用),handbookonbioethanol:productionandutilization(生物乙醇手册:生产和利用),wyman编辑,taylor&francis,washington,d.c.,第119-141页)。
用于本发明组合物和/或方法的合适的半纤维素酶包括例如木聚糖酶、阿拉伯呋喃糖苷酶、乙酰木聚糖酯酶、葡糖醛酸酶、内切半乳聚糖酶、甘露聚糖酶、内切或外切阿拉伯糖酶、外切半乳聚糖酶、以及它们的混合物。内切作用半纤维素酶和辅助酶的实例包括但不限于内切阿拉伯聚糖酶、内切阿拉伯糖半乳聚糖酶、内切葡聚糖酶、内切甘露聚糖酶、内切木聚糖酶、和阿魏酰阿糖基木聚糖内切木聚糖酶。外切作用半纤维素酶和辅助酶的实例包括但不限于α-l-阿拉伯糖苷酶、β-l-阿拉伯糖苷酶、α-1,2-l-岩藻糖苷酶、α-d-半乳糖苷酶、β-d-半乳糖苷酶、β-d-葡萄糖苷酶、β-d-葡糖醛酸酶、β-d-甘露糖苷酶、β-d-木糖苷酶、外切葡萄糖苷酶、外切纤维二糖水解酶、外切甘露二糖水解酶、外切甘露聚糖酶、外切木聚糖酶、木聚糖α-葡糖醛酸酶和松柏苷β-葡萄糖苷酶。酯酶的实例包括但不限于乙酰酯酶(乙酰半乳聚糖酯酶、乙酰甘露聚糖酯酶和乙酰木聚糖酯酶)和芳基酯酶(香豆酸酯酶和阿魏酸酯酶)。
在某些方面,半纤维素酶是外切作用半纤维素酶。优选地,外切作用半纤维素酶具有在酸性条件下,例如等于或低于ph7时水解半纤维素的能力。
在某些方面,半纤维素酶以有效量加入。例如,半纤维素酶以相对于完全发酵培养基中固体重量的约0.001重量%或更多、约0.002重量%或更多、约0.0025重量%或更多、约0.005重量%或更多、或约0.01重量%或更多的量加入本发明的多酶共混物中。在另一个实例中,半纤维素酶以相对于完全发酵培养基中固体重量的约0.001重量%至约5.0重量%,例如约0.025重量%至约4.0重量%、约0.005重量%至约2.0重量%的量加入本发明的多酶共混物中。
6.3.2.1.木聚糖酶
本发明的酶共混物任选地包含一种或多种木聚糖酶。如本文所用,术语“木聚糖酶”是指归为或归入ec3.2.1.8的任何木聚糖酶。合适的木聚糖酶包括例如解糖热纤维菌(caldocellumsaccharolyticum)木聚糖酶(luthi等人,1990,appl.environ.microbiol.(微生物学应用和环境)56(9):2677-2683)、海栖热袍菌木聚糖酶(winterhalter和liebel,1995,appl.environ.microbiol.(微生物学应用和环境)61(5):1810–1815)、栖热袍菌属(thermatogasp.)菌株fjss-b.1木聚糖酶(simpson等人,1991,biochem.j.(生物化学期刊)277,413-417)、环状芽孢杆菌(bacilluscirculans)木聚糖酶(bcx)(美国专利5,405,769)、黑曲霉木聚糖酶(kinoshita等人,1995,j.ferment.bioeng.(发酵生物工程)79(5):422-428)、浅青紫链霉菌(streptomyceslividans)木聚糖酶(shareck等人,1991,gene(基因)107:75-82;morosoli等人,1986,biochem.j.(生物化学期刊)239:587-592;kluepfel等人,1990,biochem.j.(生物化学期刊)287:45-50)、枯草芽孢杆菌(bacillussubtilis)木聚糖酶(bernier等人,1983,gene(基因)26(1):59–65)、粪肥纤维单胞菌(cellulomonasfimi)木聚糖酶(clarke等人,1996,femsmicrobiol.lett.(fems微生物学报)139:27-35)、荧光假单胞菌(pseudomonasfluorescens)木聚糖酶(gilbert等人,1988,j.gen.microbiol.(普通微生物学期刊)134:3239-3247)、热纤梭菌木聚糖酶(dominguez等人,1995,nat.struct.biol.(自然结构生物学)2(7):569-76)、短小芽孢杆菌(bacilluspumilus)木聚糖酶(nuyens等人,2001,appl.microbiol.biotech.(微生物和生物技术应用)56:431-434;yang等人,1988,nucleicacidsres.(核酸评论)16(14b):7187)、丙酮丁醇梭菌(clostridiumacetobutylicum)p262木聚糖酶(zappe等人,1990,nucleicacidsres.(核酸评论)18(8):2179)或哈茨木霉木聚糖酶(rose等人,1987,j.mol.biol.(分子生物学期刊)194(4):755–756)。
木聚糖酶能够合适地得自许多来源,包括例如真菌和细菌生物体,例如曲霉属、双侧孢霉属(disporotrichum)、青霉属、脉孢菌属、镰孢属、木霉属、腐质霉属、嗜热真菌属(thermomyces)和芽孢杆菌属。某些可商购获得的包含木聚糖酶的制品也能够用于本发明的组合物和方法;那些制品包括
在某些方面,木聚糖酶不具有保持型β-木糖苷酶活性和/或翻转型β-木糖苷酶活性。酶能够如上述第6.3.1.5节中所述测试保持与翻转活性。
6.3.2.2.β-木糖苷酶
本发明的酶共混物任选地包含一种或多种β-木糖苷酶。
如本文所用,术语“β-木糖苷酶”是指归为或归入ec3.2.1.37的任何β-木糖苷酶。合适的β-木糖苷酶包括例如埃默森篮状菌bxl1(reen等人,2003,biochem.biophys.res.(生物化学和生物物理学杂志)commun.(交流)305(3):579-85);以及得自如下的β-木糖苷酶:嗜热脂肪芽孢杆菌(geobacillusstearothermophilus)(shallom等人,2005,biochem.(生物化学)44:387-397)、嗜热革节孢(zanoelo等人,2004,j.ind.microbiol.biotechnol.(工业微生物和生物技术期刊)31:170-176)、木素木霉(trichodermalignorum)(schmidt,1988,methodsenzymol.(酶学方法)160:662-671)、泡盛曲霉(kurakake等人,2005,biochim.biophys.acta(生物化学和生物物理学汇编)1726:272-279)、杂色曲霉(aspergillusversicolor)(andrade等人,processbiochem.(生物化学进展)39:1931-1938)、链霉菌属(streptomycessp.)(pinphanichakarn等人,2004,worldj.microbiol.biotechnol.(微生物和生物技术世界期刊)20:727-733)、海栖热袍菌(xue和shao,2004,biotechnol.lett.(生物技术学报)26:1511-1515)、木霉属sy(kim等人,2004,j.microbiol.biotechnol.(微生物和生物技术期刊)14:643-645)、黑曲霉(oguntimein和reilly,1980,biotechnol.bioeng.(生物技术和生物工程)22:1143-1154)、或渥曼青霉(penicilliumwortmanni)(matsuo等人,1987,agric.biol.chem.(农业和生物化学)51:2367-2379)。
在某些方面,β-木糖苷酶不具有保持型β-木糖苷酶活性。在其他方面,β-木糖苷酶具有翻转型β-木糖苷酶活性。在另外方面,β-木糖苷酶不具有保持型β-木糖苷酶活性,但具有翻转型β-木糖苷酶活性。酶能够如上述第6.3.1.5节中所述测试保持与翻转活性。
6.3.2.3.l-α-阿拉伯呋喃糖苷酶
本发明的酶共混物任选地包含一种或多种l-α-阿拉伯呋喃糖苷酶。
如本文所用,术语“l-α-阿拉伯呋喃糖苷酶”是指归为或归入ec3.2.1.55的任何酶。合适的l-α-阿拉伯呋喃糖苷酶能够得自例如米曲霉(numan和bhosle,2006,j.ind.microbiol.biotechnol.(工业微生物和生物技术期刊)33:247-260)、酱油曲霉(aspergillussojae)(oshima等人,2005,j.appl.glycosci.(糖科学应用期刊)52:261-265)、短芽孢杆菌(bacillusbrevis)(numan和bhosle,2006,j.ind.microbiol.biotechnol.(工业微生物和生物技术期刊)33:247-260)、嗜热脂肪芽孢杆菌(kim等人,2004,j.microbiol.biotechnol.(微生物和生物技术期刊)14:474-482)、短双歧杆菌(bifidobacteriumbreve)(shin等人,2003,appl.environ.microbiol.(微生物学应用和环境)69:7116-7123)、长双歧杆菌(bifidobacteriumlongum)(margolles等人,2003,appl.environ.microbiol.(微生物学应用和环境)69:5096-5103)、热纤梭菌(taylor等人,2006,biochem.j.(生物化学期刊)395:31-37)、尖孢镰孢菌(panagiotou等人,2003,can.j.microbiol.(加拿大微生物学期刊)49:639-644)、尖孢镰孢菌石竹专化型(fusariumoxysporumf.sp.dianthi)(numan和bhosle,2006,j.ind.microbiol.biotechnol.(工业微生物和生物技术期刊)33:247-260)、嗜热脂肪芽孢杆菌t-6(shallom等人,2002,j.biol.chem.(生物化学期刊)277:43667-43673)、多棱大麦(hordeumvulgare)(lee等人,2003,j.biol.chem.(生物化学期刊)278:5377-5387)、产黄青霉(sakamoto等人,2003,biophys.acta(生物物理学汇编)1621:204-210)、青霉属(penicilliumsp.)(rahman等人,2003,can.j.microbiol.(加拿大微生物学期刊)49:58-64)、纤维素假单胞菌(pseudomonascellulosa)(numan和bhosle,2006,j.ind.microbiol.biotechnol.(工业微生物和生物技术期刊)33:247-260)、微小根毛霉(rahman等人,2003,carbohydr.res.(烃研究)338:1469-1476)、教酒链霉菌(streptomyceschartreusis)(numan和bhosle,2006,j.ind.microbiol.biotechnol.(工业微生物和生物技术期刊)33:247-260)、热紫链霉菌(streptomycesthermoviolacus)(numan和bhosle,2006,j.ind.microbiol.biotechnol.(工业微生物和生物技术期刊)33:247-260)、嗜热厌氧乙醇杆菌(thermoanaerobacterethanolicus)(numan和bhosle,2006,j.ind.microbiol.biotechnol.(工业微生物和生物技术期刊)33:247-260)、解木聚糖热杆菌(thermobacillusxylanilyticus)(numan和bhosle,2006,j.ind.microbiol.biotechnol.(工业微生物和生物技术期刊)33:247-260)、褐色高温单孢菌(thermomonosporafusca)(tuncer和ball,2003,foliamicrobiol.(praha)(微生物薄册(布拉格))48:168-172)、海栖热袍菌(miyazaki,2005,extremophiles(极端生物)9:399-406)、木霉属sy(jung等人,2005,agric.chem.biotechnol.(农业化学和生物技术)48:7-10)、白曲霉(koseki等人,2006,biochim.biophys.acta(生物化学和生物物理学汇编)1760:1458-1464)、尖孢镰孢菌石竹专化型(chacon-martinez等人,2004,physiol.mol.plantpathol.(生理分子学植物病理学)64:201-208)、解木聚糖热杆菌(debeche等人,2002,proteineng.(蛋白质工程)15:21-28)、特异腐质霉(sorensen等人,2007,biotechnol.prog.(生物技术进展)23:100-107)、大型亚灰树花菌(meripilusgiganteus)(sorensen等人,2007,biotechnol.prog.(生物技术进展)23:100-107)、或萝卜(raphanussativus)(kotake等人,2006,j.exp.bot.57:2353-2362)。
在某些方面,l-α-阿拉伯呋喃糖苷酶不具有保持型β-木糖苷酶活性。在其他方面,l-α-阿拉伯呋喃糖苷酶具有翻转型β-木糖苷酶活性。在另外方面,l-α-阿拉伯呋喃糖苷酶不具有保持型β-木糖苷酶,但具有翻转型β-木糖苷酶活性。酶能够如上述第6.3.1.5节中所述测试保持与翻转活性。
6.3.3.辅助蛋白质
许多具有纤维分解增强活性的多肽也能够与上述酶和/或纤维分解蛋白质共同使用,以进一步降解生物质底物的纤维素组分(参见例如brigham等人,1995,handbookonbioethanol(生物乙醇手册)(charlese.wyman编辑),第119-141页,taylor&francis,washingtond.c.;lee,1997,j.biotechnol.(生物技术进展)56:1-24)。
此类具有纤维分解增强活性的多肽和纤维分解蛋白质的最佳用量取决于多种因素,包括但不限于组分纤维分解蛋白质的具体混合物、纤维质底物、纤维质底物的浓度、纤维质底物的预处理、温度、时间和ph、以及发酵生物的性质。
本发明的酶共混物/组合物能够例如合适地进一步包含一种或多种辅助蛋白质。辅助蛋白质的实例包括但不限于甘露聚糖酶(例如内切甘露聚糖酶、外切甘露聚糖酶、和β-甘露糖苷酶)、半乳聚糖酶(例如内切和外切半乳聚糖酶)、阿拉伯糖酶(例如内切阿拉伯糖酶和外切阿拉伯糖酶)、木质酶、淀粉酶、葡糖醛酸酶、蛋白酶、酯酶(例如阿魏酸酯酶、乙酰木聚糖酯酶、香豆酸酯酶或果胶甲基酯酶)、脂肪酶、糖苷水解酶家族61多肽、木葡聚糖酶、cip1、cip2、膨胀因子、扩展蛋白、和纤维素破坏蛋白。辅助蛋白质的实例也能够包括cip1样蛋白、cip2样蛋白、纤维二糖脱氢酶和锰过氧化物酶。在特定实施例中,纤维素破坏蛋白是纤维素结合模块。
6.4具有翻转型β-木糖苷酶活性的酶
根据本发明,具有翻转型β-木糖苷酶活性的酶用于减少ssf反应中axp(如exp)形成。因此,在一个方面,本发明涉及包含至少一种翻转型β-木糖苷酶多肽的组合物。在另一方面,本发明涉及在ssf反应中产生所需发酵产物的方法,该方法包括培养完全发酵培养基,所述完全发酵培养基包含至少一种翻转型β-木糖苷酶多肽。
合适的翻转型β-木糖苷酶多肽能够选自作为糖苷水解酶家族43(“gh43”)成员的那些多肽。gh43家族酶具有许多已知活性。例如,gh43家族酶能够是归入ec3.2.1.55的酶,并且能够具有l-α-阿拉伯呋喃糖苷酶活性。在另一个实例中,gh43家族酶能够是归入ec3.2.1.99的酶,并且能够具有内切阿拉伯聚糖酶活性。在另一个实例中,gh43家族酶能够归入ec3.2.1.145,并且能够具有半乳聚糖1,3-β-半乳糖苷酶活性。在其他实例中,gh43家族酶能够归入ec3.2.1.37,并且能够具有β-木糖苷酶活性。虽然gh43家族β-木糖苷酶(例如上述那些酶)通常仅能够进行翻转水解,但与此相反,据报道得自gh3、-39、-52、和-54家族的各种β-木糖苷酶具有保持活性,并且能够同时进行水解和转糖基反应。(smaali等人,2006,appl.microbiol.biotechnol.(微生物和生物技术应用)73:582-590)。
gh43家族酶通常显示出五叶β-螺旋桨三维构象。结构的“螺旋桨”部分基于包括四股β-折叠的“叶片”样构象的五倍重复。广义催化碱天冬氨酸盐、广义催化酸谷氨酸盐、调节广义碱pka的天冬氨酸残基通过纤维弧菌(cellvibriojaponicus)cjarb43a,的晶体结构鉴定,并且通过定点诱变确认(参见nurizzo等人,2002,nat.struct.biol.(生物学自然结构)9(9)665-8)。催化残基被布置在三个保守区,这些保守区广泛分布于氨基酸序列中(pons等人,2004,proteins:structure,functionandbioinformatics(蛋白质:结构、功能和生物信息学)54:424-432)。对于gh43家族β-木糖苷酶,预测的催化残基在图32的序列中以黑体和下划线字体示出。嗜热脂肪芽孢杆菌木糖苷酶的晶体结构(brux等人,2006,j.mol.bio.(分子生物期刊)359:97-109)表明多个附加残基对于该酶的底物结合可能是重要的。
如上述第6.3.1.5节中所述,翻转型β-木糖苷酶活性能够通过合适的测定法测定。
因此,在某些方面,本文中具有翻转型β-木糖苷酶活性的酶是gh43家族成员。例如,所述酶是fv43d,pf43a,fv43e,fv43b,af43a,fo43a,gz43a,或xynb3多肽。此类多肽如下所述。
6.4.1.fv43d多肽
在某些实施例中,具有翻转型β-木糖苷酶活性的酶是fv43d多肽。fv43d的氨基酸序列(seqidno:2)在图19b和图32的第一行示出。seqidno:2是未成熟的fv43d序列。fv43d具有对应于seqidno:2第1至20位残基的预测信号序列(在图19b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:2第21至350位残基的序列。在图19b中预测保守域残基以黑体表示。已在使用对硝基苯基-β-吡喃木糖苷、木二糖或混合的线性木聚糖低聚物作为底物的测定中,证明fv43d具有β-木糖苷酶活性。预测的催化残基为:d37或d71、d155、和e251。
如本文所用,“fv43d多肽”是指包含与seqidno:2第21至350位残基中的至少50,例如至少75、100、125、150、175、200、250、300、或320个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。与天然fv43d相比,fv43d多肽的d37或d71、d155、和e251残基优选地是未改变的。fv43d多肽优选地至少70%、75%、80%、85%、90%、95%、98%、或99%的氨基酸残基是未改变的,所述残基对于fv43d,fo43a,gz43a,pf43a,fv43a,fv43b,af43a,pf43b,和fv43e,中的两个或更多个、三个或更多个、四个或更多个、五个或更多个、六个或更多个、七个或更多个、八个或更多个、或全部九个是保守的,如图32的比对所示。如图19b所示,fv43d多肽合适地包含天然fv43d的整个预测保守域。本发明的示例性fv43d多肽包含与图19b所示的成熟fv43d序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的fv43d多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的fv43d多肽具有翻转型β-木糖苷酶活性。
6.4.2.pf43a多肽
在某些实施例中,具有翻转型β-木糖苷酶活性的酶是pf43a多肽。pf43a的氨基酸序列(seqidno:8)在图22b和图32的第四行示出。seqidno:8是未成熟的pf43a序列。pf43a具有对应于seqidno:8第1至20位残基的预测信号序列(在图22b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:8第21至445位残基的序列。在图22b中预测催化域残基以黑体表示,预测碳水化合物结合域残基以大写字母表示,并且分隔催化域和碳水化合物结合域的预测接头残基以斜体表示。已在使用对硝基苯基-β-吡喃木糖苷、木二糖或混合的线性木聚糖低聚物作为底物的测定中,证明pf43a具有β-木糖苷酶活性。预测的催化残基为:d32或d60、d145、和e196。
如本文所用,“pf43a多肽”是指包含与seqidno:8第21至445位残基中的至少50,例如至少75、100、125、150、175、200、250、300、350、或400个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。与天然pf43a相比,pf43a多肽的d32或d60、d145、和e196残基优选地是未改变的。pf43a多肽优选地至少70%、75%、80%、85%、90%、95%、98%、或99%的氨基酸残基是未改变的,所述残基对于fv43d,fo43a,gz43a,pf43a,fv43a,fv43b,af43a,pf43b,和fv43e,中的两个或更多个、三个或更多个、四个或更多个、五个或更多个、六个或更多个、七个或更多个、八个或更多个、或全部九个是保守的,如图32的比对所示。如图22b所示,pf43a多肽合适地包含天然pf43a的整个预测保守域。本发明的示例性pf43a多肽包含与图22b所示的成熟pf43a序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的pf43a多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的pf43a多肽具有翻转型β-木糖苷酶活性。
6.4.3.fv43e多肽
在某些实施例中,具有翻转型β-木糖苷酶活性的酶是fv43e多肽。fv43e的氨基酸序列(seqidno:10)在图23b和图32的第九行示出。seqidno:10是未成熟的fv43e序列。fv43e具有对应于seqidno:10第1至18位残基的预测信号序列(在图23b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:10第19至530位残基的序列。在图23b中预测催化域残基以黑体表示。已在使用对硝基苯基-β-吡喃木糖苷、木二糖和混合的线性木聚糖低聚物作为底物的测定中,证明fv43e具有β-木糖苷酶活性。预测的催化残基为:d40或d71、d155、和e242。
如本文所用,“fv43e多肽”是指包含与seqidno:10第19至530位残基中的至少50,例如至少75、100、125、150、175、200、250、300、350、400、450、或500个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。与天然fv43e相比,fv43e多肽的d40或d71、d155、和e242残基优选地是未改变的。fv43e多肽优选地至少70%、75%、80%、85%、90%、95%、98%、或99%的氨基酸残基是未改变的,所述残基对于fv43d,fo43a,gz43a,pf43a,fv43a,fv43b,af43a,pf43b,和fv43e,中的两个或更多个、三个或更多个、四个或更多个、五个或更多个、六个或更多个、七个或更多个、八个或更多个、或全部九个是保守的,如图32的比对所示。如图23b所示,fv43e多肽合适地包含天然fv43e的整个预测保守域。本发明的示例性fv43e多肽包含与图23b所示的成熟fv43e序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的fv43e多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的fv43e多肽具有翻转型β-木糖苷酶活性。
6.4.4.fv43b多肽
在某些实施例中,具有翻转型β-木糖苷酶活性的酶是fv43b多肽。fv43b的氨基酸序列(seqidno:12)在图24b和图32的第六行示出。seqidno:12是未成熟的fv43b序列。fv43b具有对应于seqidno:12第1至16位残基的预测信号序列(在图24b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:12第17至574位残基的序列。在图24b中预测催化域残基以黑体表示。已在使用对硝基苯基-β-吡喃木糖苷和/或对硝基苯基-α-l-阿拉伯呋喃糖苷作为底物的测定中,证明fv43b同时具有β-木糖苷酶和l-α-阿拉伯呋喃糖苷酶活性。研究表明,其使支链阿拉伯木聚糖低聚物释放出阿拉伯糖,并且在其他木糖苷酶的存在下使低聚物混合物释放的木糖增加。预测的催化残基为:d38或d68、d151、和e236。
如本文所用,“fv43b多肽”是指包含与seqidno:12第17至472位残基中的至少50,例如至少75、100、125、150、175、200、250、300、350、400、450、500、或550个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。与天然fv43b相比,fv43b多肽的d38或d68、d151、和e236残基优选地是未改变的。fv43b多肽优选地至少70%、75%、80%、85%、90%、95%、98%、或99%的氨基酸残基是未改变的,所述残基对于fv43d,fo43a,gz43a,pf43a,fv43a,fv43b,af43a,pf43b,和fv43e,中的两个或更多个、三个或更多个、四个或更多个、五个或更多个、六个或更多个、七个或更多个、八个或更多个、或全部九个是保守的,如图32的比对所示。如图24b所示,fv43b多肽合适地包含天然fv43b的整个预测保守域。本发明的示例性fv43b多肽包含与图24b所示的成熟fv43b序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的fv43b多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的fv43b多肽具有翻转型β-木糖苷酶活性。
6.4.5.af43a多肽
在某些实施例中,具有翻转型β-木糖苷酶活性的酶是af43a多肽。af43a的氨基酸序列(seqidno:14)在图25b和图32的第七行示出。seqidno:14是未成熟的af43a序列。在图25b中预测保守域残基以黑体表示。已在使用对硝基苯基-α-l-阿拉伯呋喃糖苷的测定中,证明af43a具有l-α-阿拉伯呋喃糖苷酶活性,并且通过对内切木聚糖酶的作用产生的一组低聚物进行转化进而释放出阿拉伯糖也证明了这一点。预测的催化残基为:d26或d58、d139、和e227。
如本文所用,“af43a多肽”是指包含与seqidno:14的至少50,例如至少75、100、125、150、175、200、250、或300个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。与天然af43a相比,af43a多肽的d26或d58、d139、和e227残基优选地是未改变的。af43a多肽优选地至少70%、75%、80%、85%、90%、95%、98%、或99%的氨基酸残基是未改变的,所述残基对于fv43d,fo43a,gz43a,pf43a,fv43a,fv43b,af43a,pf43b,和fv43e,中的两个或更多个、三个或更多个、四个或更多个、五个或更多个、六个或更多个、七个或更多个、八个或更多个、或全部九个是保守的,如图32的比对所示。如图25b所示,af43a多肽合适地包含天然af43a的整个预测保守域。本发明的示例性fv43b多肽包含与图25b所示的成熟af43a序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的af43a多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的af43a多肽具有翻转型β-木糖苷酶活性。
6.4.6.fo43a多肽
在某些实施例中,具有翻转型β-木糖苷酶活性的酶是fo43a多肽。fo43a的氨基酸序列(seqidno:24)在图31b和图32的第二行示出。seqidno:24是未成熟的fo43a序列。fo43a具有对应于seqidno:24第1至17位残基的预测信号序列(在图31b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:24第21至348位残基的序列。在图31b中预测保守域残基以黑体表示。已在使用对硝基苯基-β-吡喃木糖苷、木二糖或混合的线性木聚糖低聚物作为底物的测定中,证明fo43a具有β-木糖苷酶活性。预测的催化残基为:d37或d72、d159、和e251。
如本文所用,“fo43a多肽”是指包含与seqidno:24第21至348位残基中的至少50,例如至少75、100、125、150、175、200、250、300、或320个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。与天然fo43a相比,fo43a多肽的d37或d72、d159、和e251残基优选地是未改变的。fo43a多肽优选地至少70%、75%、80%、85%、90%、95%、98%、或99%的氨基酸残基是未改变的,所述残基对于fv43d,fo43a,gz43a,pf43a,fv43a,fv43b,af43a,pf43b,和fv43e,中的两个或更多个、三个或更多个、四个或更多个、五个或更多个、六个或更多个、七个或更多个、八个或更多个、或全部九个是保守的,如图32的比对所示。如图31b所示,fo43a多肽合适地包含天然fo43a的整个预测保守域。本发明的示例性fo43a多肽包含与图31b所示的成熟fo43a序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的fo43a多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的fo43a多肽具有翻转型β-木糖苷酶活性。
6.4.7.gz43a多肽
在某些实施例中,具有翻转型β-木糖苷酶活性的酶是gz43a多肽。gz43a的氨基酸序列(seqidno:22)在图30b和图32的第三行示出。seqidno:22是未成熟的gz43a序列。gz43a具有对应于seqidno:22第1至18位残基的预测信号序列(在图30b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:22第19至340位残基的序列。在图30b中预测保守域残基以黑体表示。已在使用对硝基苯基-β-吡喃木糖苷、木二糖或混合的线性木聚糖低聚物作为底物的测定中,证明gz43a具有β-木糖苷酶活性。预测的催化残基为:d33或d68、d154、和e243。
如本文所用,“gz43a多肽”是指包含与seqidno:22第19至340位残基中的至少50,例如至少75、100、125、150、175、200、250、或300个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。与天然gz43a相比,gz43a多肽的d33或d68、d154、和e243残基优选地是未改变的。gz43a多肽优选地至少70%、75%、80%、85%、90%、95%、98%、或99%的氨基酸残基是未改变的,所述残基对于fv43d,fo43a,gz43a,pf43a,fv43a,fv43b,af43a,pf43b,和fv43e,中的两个或更多个、三个或更多个、四个或更多个、五个或更多个、六个或更多个、七个或更多个、八个或更多个、或全部九个是保守的,如图32的比对所示。如图30b所示,gz43a多肽合适地包含天然gz43a的整个预测保守域。本发明的示例性gz43a多肽包含与图30b所示的成熟fo43a序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的gz43a多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的gz43a多肽具有翻转型β-木糖苷酶活性。
6.4.8.嗜热脂肪芽孢杆菌xynb3多肽
在其他方面,具有翻转型β-木糖苷酶活性的酶是嗜热脂肪芽孢杆菌xynb3多肽。嗜热脂肪芽孢杆菌xynb3的序列以seqidno:25表示。嗜热脂肪芽孢杆菌xynb3是得自嗜热脂肪芽孢杆菌t-6的具有535个氨基酸的gh43家族酶。该酶从木糖低聚物的非还原末端裂解单个木糖单元;据发现,三个催化残基d15、d128、和e187对于其活性是必不可少的(shallom等人,2005,biochemistry(生物化学),44:387–397)。
如本文所用,“嗜热脂肪芽孢杆菌xynb3多肽”是指包含与seqidno:25的至少50,例如至少75、100、125、150、175、200、250、300、350、400、450、或500个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。与天然xynb3相比,嗜热脂肪芽孢杆菌xynb3多肽的d15、d128、和e187残基优选地是未改变的。本发明的嗜热脂肪芽孢杆菌xynb3多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的嗜热脂肪芽孢杆菌xynb3多肽具有翻转型β-木糖苷酶活性。
6.4.9.弧菌属(vibriosp.)xloa多肽
在某些实施例中,具有翻转型β-木糖苷酶活性的酶是弧菌属xloa多肽。弧菌属xloa是得自弧菌属菌株xy-214的β-1,3-木糖苷酶。
如本文所用,“弧菌属xloa多肽”是指包含与弧菌属菌株xy-214来源β-1,3-木糖苷酶的至少50,例如至少75、100、125、150、175、200、250、300、350或400个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。(umemoto等人,2008,appl.environ.microbiol.(微生物学应用和环境)74(1):305–308;genbank登录号ab300564)。本发明的弧菌属xloa多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的弧菌属xloa多肽具有翻转型β-木糖苷酶活性。
6.5具有保持型β-木糖苷酶活性的酶
根据本发明,具有保持型β-木糖苷酶活性的酶用于提高或增加ssf反应中axp(例如exp)的产量。因此,在一个方面,本发明涉及包含至少一种保持型β-木糖苷酶多肽的组合物。在另一方面,本发明涉及在ssf反应中产生所需的axp化合物或提高或增加axp产物的量的方法,该方法包括培养完全发酵培养基,所述完全发酵培养基包含至少一种保持型β-木糖苷酶多肽。
合适的翻转型β-木糖苷酶多肽能够选自作为糖苷水解酶家族3(“gh3”)、gh30、gh31、gh39、gh52、gh54、或gh116家族酶成员的那些多肽。
如上述第6.3.1.5节中所述,保持型β-木糖苷酶活性能够通过合适的测定法测定。
因此,在某些方面,本文中具有保持型β-木糖苷酶活性的酶是gh3、gh30、gh31、gh39、gh52、gh54、或gh116家族成员。例如,所述酶是日本曲霉xlnd,轮枝镰孢菌fv30a,轮枝镰孢菌fv30b,轮枝镰孢菌fv39a,轮枝镰孢菌fv39b,解糖热厌氧杆菌(thermoanaerobactersaccharolyticum)xynb,嗜热脂肪芽孢杆菌xyla或康宁木霉(康宁肉座菌(hypocreakoningii))xyl1多肽。此类多肽如下所述。
6.5.1.日本曲霉xlnd多肽
在某些实施例中,具有保持型β-木糖苷酶活性的酶是xlnd多肽。xlnd的氨基酸序列(seqidno:40)在图35b中示出。seqidno:40是未成熟的xlnd序列。xlnd具有对应于seqidno:40第1至17位残基的预测信号序列(在图35b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:40第18至804位残基的序列。
如本文所用,“xlnd多肽”是指包含与seqidno:40第18至804位残基中的至少50,例如至少75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、或750个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。本发明的示例性xlnd多肽包含与图35b所示的成熟xlnd序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的xlnb多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的xlnb多肽具有保持型β-木糖苷酶活性。
6.5.2.轮枝镰孢菌fv30a多肽
在某些实施例中,具有保持型β-木糖苷酶活性的酶是fv30a多肽。xlnd的氨基酸序列(seqidno:42)在图36b中示出。seqidno:42是未成熟的fv30a序列。xlnd具有对应于seqidno:42第1至19位残基的预测信号序列(在图36b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:42第20至537位残基的序列。
如本文所用,“fv30a多肽”是指包含与seqidno:42第20至537位残基中的至少50,例如至少75、100、125、150、175、200、250、300、350、400、450、或500个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。本发明的示例性fv30a多肽包含与图36b所示的成熟fv30a序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的fv30a多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的fv30a多肽具有保持型β-木糖苷酶活性。
6.5.3.轮枝镰孢菌fv30b多肽
在某些实施例中,具有保持型β-木糖苷酶活性的酶是fv30b多肽。fv30b的氨基酸序列(seqidno:44)在图37b中示出。seqidno:44是未成熟的fv30b序列。fv30b具有对应于seqidno:44第1至24位残基的预测信号序列(在图37b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:44第25至485位残基的序列。
如本文所用,“fv30b多肽”是指包含与seqidno:44第25至485位残基中的至少50,例如至少75、100、125、150、175、200、250、300、350、400、或450个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。本发明的示例性fv30b多肽包含与图37b所示的成熟fv30b序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的fv30b多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的fv30b多肽具有保持型β-木糖苷酶活性。
6.5.4.轮枝镰孢菌fv39a多肽
在某些实施例中,具有保持型β-木糖苷酶活性的酶是fv39a多肽。fv39a的氨基酸序列(seqidno:46)在图38b中示出。seqidno:46是未成熟的fv39a序列。fv39a具有对应于seqidno:46第1至19位残基的预测信号序列(在图38b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:46第20至439位残基的序列。
如本文所用,“fv39a多肽”是指包含与seqidno:46第20至439位残基中的至少50,例如至少75、100、125、150、175、200、250、300、350、或400个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。本发明的示例性fv39a多肽包含与图38b所示的成熟fv39a序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的fv39a多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的fv39a多肽具有保持型β-木糖苷酶活性。
6.5.5.轮枝镰孢菌fv39b多肽
在某些实施例中,具有保持型β-木糖苷酶活性的酶是fv39b多肽。fv39b的氨基酸序列(seqidno:48)在图39b中示出。seqidno:48是未成熟的fv39b序列。fv39b具有对应于seqidno:48第1至18位残基的预测信号序列(在图39b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:48第19至456位残基的序列。
如本文所用,“fv39b多肽”是指包含与seqidno:48第19至456位残基中的至少50,例如至少75、100、125、150、175、200、250、300、或350个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。本发明的示例性fv39b多肽包含与图39b所示的成熟fv39b序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的fv39b多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的fv39b多肽具有保持型β-木糖苷酶活性。
6.5.6.解糖热厌氧杆菌xynb多肽
在某些实施例中,具有保持型β-木糖苷酶活性的酶是xynb多肽。xynb的氨基酸序列(seqidno:50)在图40b中示出。xynb不具有signalp算法(访问地址:http://www.cbs.dtu.dk)得到的预测信号序列。
如本文所用,“xynb多肽”是指包含与seqidno:50的至少50,例如至少75、100、125、150、175、200、250、300、350、400、或450个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。本发明的示例性xynb多肽包含与图40b所示的xynb序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的xynb多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的xynb多肽具有保持型β-木糖苷酶活性。
6.5.7.嗜热脂肪芽孢杆菌xyla多肽
在某些实施例中,具有保持型β-木糖苷酶活性的酶是xyla多肽。xyla的氨基酸序列(seqidno:52)在图41b中示出。xyla不具有signalp算法(访问地址:http://www.cbs.dtu.dk)得到的预测信号序列,但是具有uniprot算法(访问地址:http://www.uniprot.org/uniprot)预测的信号序列,该序列对应于seqidno:52第1至18位残基(标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:52第19至705位残基的序列。
如本文所用,“xyla多肽”是指包含与seqidno:52的至少50,例如至少75、100、125、150、175、200、250、300、350、400、450、500、550、600、或650个连续氨基酸残基或seqidno:52第19至705位残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。本发明的示例性xyla多肽包含与图41b所示的成熟xyla序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的xyla多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的xyla多肽具有保持型β-木糖苷酶活性。
6.5.8.康宁木霉(康宁肉座菌)xyl1多肽
在某些实施例中,具有保持型β-木糖苷酶活性的酶是xyl1多肽。xyl1的氨基酸序列(seqidno:54)在图42b中示出。seqidno:54是未成熟的xyl1序列。xyl1具有对应于seqidno:54第1至21位残基的预测信号序列(在图42b中标有下划线);信号序列的剪切预计会产生成熟蛋白质,该蛋白质具有对应于seqidno:54第22至500位残基的序列。
如本文所用,“xyl1多肽”是指包含与seqidno:54第22至500位残基中的至少50,例如至少75、100、125、150、175、200、250、300、350、400、或450个连续氨基酸残基具有至少85%,例如至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%序列同一性的序列的多肽和/或其变体。本发明的示例性xyl1多肽包含与图42b所示的成熟xyl1序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%同一性的序列。本发明的xyl1多肽合适地具有β-木糖苷酶活性。在某些实施例中,本发明的xyl1多肽具有保持型β-木糖苷酶活性。
6.6用于ssf的酶的重组制备方法
6.6.1.核酸和表达载体
能够将编码用于ssf的酶(“ssf酶”)的天然或合成多核苷酸片段并入异源核酸构建体或载体,所述酶包括翻转型β-木糖苷酶多肽或其他糖化酶(例如纤维素酶或半纤维素酶)。然后能够将那些载体引入合适的宿主细胞或在合适的宿主细胞中复制,所述合适的宿主细胞包括例如丝状真菌、酵母、或细菌细胞。本文所公开的载体和方法能够用于表达一种或多种ssf酶。只要能够在其被引入的细胞中复制并且存活,任何载体都能够使用。许多合适的载体和启动子是本领域技术人员已知的,其中多种载体和启动子是可商购获得的。克隆和表达载体已在如下文献中详细描述:例如sambrook等人,2001,molecularcloning:alaboratorymanual(分子克隆:实验室手册)(cshlpress)和ausubel等人,2002,shortprotocolsinmolecularbiology(currentprotocols)(分生物学短期协议(当前协议)),其中各自关于表达载体的内容明确地以引用方式并入本文。适用于真菌宿主细胞的其他示例性表达载体在如下文献中有所描述:vandenhondel等人,1991,bennett和lasure(编辑)moregenemanipulationsinfungi(真菌中的更多基因操作),academicpress(学术出版社),第396-428页。
本领域已知的是,多种所关注的dna序列能够使用许多标准步骤插入质粒或载体(本文统称为“载体”)。通常,例如使用标准步骤并且在标准条件下将所关注的dna序列插入合适的限制性内切核酸酶位点。此类步骤和相关的亚克隆步骤在本领域普通技术人员的知识范围内。
包含ssf酶编码序列的重组丝状真菌能够通过将包含编码ssf酶的dna序列的异源核酸构建体引入丝状真菌宿主细胞的遗传物质而制备。
一旦得到所需形式的编码ssf酶的核酸序列,则能够任选地以多种方式修饰。当序列包含非编码侧翼区时,能够对侧翼区进行切除、诱变等。因此,能够在天然存在的序列上进行转换、颠换、缺失和/或插入。
所选的编码ssf酶的序列能够根据熟知的重组技术插入合适的载体中,然后该载体能够用于转化能够表达ssf酶的丝状真菌宿主细胞。由于遗传密码固有的简并性,编码基本上相同或功能等效的氨基酸序列的其他dna序列能够用于克隆和表达ssf酶。
如上所述,本发明还包括重组核酸构建体,该构建体包含一个或多个编码ssf酶的核酸序列。每个构建体合适地包含其中已正向或反向插入了本发明序列的载体,例如质粒或病毒载体。
异源核酸构建体能够合适地包括如下形式的ssf酶编码序列:(i)孤立形式;(ii)与附加编码序列(例如融合蛋白或信号肽编码序列)的组合形式,其中所需的编码ssf酶的序列是主导编码序列;(iii)与一种或多种使编码序列在合适的宿主中高效表达的非编码序列的组合形式,所述非编码序列例如内含子和控制元件(例如启动子和终止子元件、或5'和/或3'非翻译区);和/或(iv)在载体或宿主环境中,其中编码ssf酶的序列相对于宿主细胞是异源的。
在某些方面,异源核酸构建体用于在体外将编码ssf酶的核酸序列转移至细胞,例如已构建的丝状真菌或酵母细胞系。对于ssf酶的长期制备,稳定表达是优选的。因此,对产生稳定转化体有效的任何方法都能够合适地应用于本文所公开的发明。
合适的载体通常配有编码选择性标记的核酸序列、插入位点、以及合适的控制元件,例如启动子和终止序列。该载体可包含调节序列,包括例如非编码序列,如可操作地连接至编码序列,并且使编码序列在宿主细胞中高效表达的内含子和控制元件。合适的控制元件包括例如启动子和终止子元件、或5'和/或3'非翻译区。许多载体和启动子是本领域技术人员已知的,其中多种载体和启动子是可商购获得的。合适的载体和启动子在如下文献中也有所描述:例如sambrook等人,2001,molecularcloning:alaboratorymanual(分子克隆:实验室手册)(cshlpress)。
示例性启动子包括例如组成型启动子和诱导型启动子,例如但不限于cmv启动子、sv40早期启动子、rsv启动子、ef-1α启动子、包含tet-on或tet-off系统中的四环素应答元件(tre)的启动子(参见例如clontech对
选择性标记的选择将取决于宿主细胞,并且适用于不同宿主细胞的合适选择性标记在本领域是已知的。示例性选择性标记基因包括得自构巢曲霉或红褐肉座菌的argb、得自构巢曲霉的amds、得自粗糙脉孢菌或红褐肉座菌的pyr4、得自黑曲霉或构巢曲霉的pyrg。其他合适的选择性标记包括例如trpc、trp1、olic31、niad、或leu2,所述标记包含在异源核酸构建体中,该构建体用于转化突变株,例如trp-、pyr-、或leu-突变株等等。
此类选择性标记能够赋予转化体利用在其他情形下宿主细胞不能代谢的代谢物的能力。例如,得自红褐肉座菌的amds基因编码乙酰胺酶,该基因允许转化细胞以乙酰胺作为氮源生长。在另一个实例中,选择性标记(例如pyrg)能够恢复营养缺陷型突变株在选择性基本培养基上生长的能力。在另一个实例中,选择性标记(例如olic31)能够赋予转化体在抑制性药物或抗生素的存在下生长的能力。
使用本领域已知的方法和技术将选择性标记编码序列合适地克隆到质粒中。示例性质粒包括但不限于puc18、pbr322、prax和puc100。例如,prax质粒包含得自构巢曲霉的amal序列,使其能够在黑曲霉中复制。
除非另外具体指明,本发明的实践将利用分子生物学、微生物学、重组dna和免疫学的常规技术,这些技术在本领域普通技术人员的知识范围内。此类技术在文献中有详细描述。参见例如sambrook等人,2001,moecularcloning:alaboratorymanual(分子克隆:实验室手册)(cshlpress);ausubel等人,2002,shortprotocolsinmolecularbiology(currentprotocols)(分子生物学短息协议(当前协议));freshney,2005,cultureofanimalcells:amanualofbasictechnique(动物细胞培养物:技术技术手册)(wiley-liss);和dunn等人,2003,shortprotocolsinproteinscience(蛋白质科学短期协议)(wiley)。本文涉及的所有专利、专利申请、文章和出版物据此以引用方式并入。
6.6.2.宿主生物和蛋白质表达
本发明提供了经工程改造而表达所关注的ssf蛋白的宿主细胞,该蛋白用于本文所述的方法。合适的宿主细胞包括任何微生物(例如细菌、原生生物、藻类、真菌(如酵母或丝状真菌)、或任何其他微生物)。合适的宿主细胞优选地是细菌、酵母、或丝状真菌细胞。
合适的细菌属包括但不限于埃希氏菌属(escherichia)、芽孢杆菌属、乳杆菌属(lactobacillus)、假单胞菌属(pseudomonas)和链霉菌属。合适的细菌种包括但不限于大肠杆菌(escherichiacoli)、枯草芽孢杆菌、地衣芽孢杆菌(bacilluslicheniformis)、短乳杆菌(lactobacillusbrevis)、铜绿假单胞菌(pseudomonasaeruginosa)和浅青紫链霉菌。
合适的酵母属包括但不限于酵母菌属(saccharomyces)、裂殖酵母属(schizosaccharomyces)、假丝酵母属(candida)、汉逊酵母属(hansenula)、毕赤酵母属(pichia)、克鲁维酵母属(kluyveromyces)、和法夫酵母属(phaffia)。合适的酵母种包括但不限于酿酒酵母(saccharomycescerevisiae)、粟酒裂殖酵母、白假丝酵母(candidaalbicans)、多形汉逊酵母(hansenulapolymorpha)、巴斯德毕赤酵母(pichiapastoris)、加拿大毕赤酵母(p.canadensis)、马克斯克鲁维酵母(kluyveromycesmarxianus)和红法夫酵母(phaffiarhodozyma)。
合适的丝状真菌包括真菌亚门的所有丝状形式。合适的丝状真菌属包括但不限于支顶孢属、曲霉属、出芽短梗霉属(aureobasidium)、黑管菌属(bjerkandera)、拟蜡菌属(ceriporiopsis)、金孢子菌属(chrysoporium)、鬼伞属(coprinus)、革盖菌属(coriolus)、棒囊壳属(corynascus)、毛壳菌属(chaertomium)、隐球酵母属(cryptococcus)、线黑粉酵母属(filobasidium)、镰孢属、赤霉菌属(gibberella)、腐质霉属、大角间座壳菌属(magnaporthe)、毛霉菌属、毁丝菌属、毛霉菌属、新美鞭菌属(neocallimastix)、脉孢菌属、拟青霉属(paecilomyces)、青霉属、平革菌属(phanerochaete)、射脉菌属(phlebia)、piromyces、侧耳属(pleurotus)、柱顶孢属(scytaldium)、裂褶菌属(schizophyllum)、孢子丝菌属(sporotrichum)、篮状菌属(talaromyces)、嗜热子囊菌属(thermoascus)、梭孢壳属、弯颈霉属、栓菌属(trametes)和木霉属。
合适的丝状真菌种包括但不限于泡盛曲霉、烟曲霉(aspergillusfumigatus)、臭曲霉、日本曲霉、构巢曲霉、黑曲霉、米曲霉、金孢子菌(chrysosporiumlucknowense)、拟棒座镰孢菌(fusariumbactridioides)、小麦镰孢菌、克地镰孢菌、黄色镰孢菌、禾谷镰孢菌、禾赤镰孢菌、异孢镰孢菌、荆条镰孢菌(fusariumnegundi)、尖孢镰孢菌、多枝镰孢菌、粉红镰孢菌、接骨木镰孢菌、肤色镰孢菌、拟枝孢镰孢菌、硫色镰孢菌、簇囊镰孢菌(fusariumtorulosum)、拟丝孢镰孢菌、毒性镰孢菌(fusariumvenenatum)、烟管菌(bjerkanderaadusta)、干拟蜡菌(ceriporiopsisaneirina)、拟蜡菌(ceriporiopsiscaregiea)、浅黄拟蜡菌(ceriporiopsiscaregiea)、乾拟蜡孔菌(ceriporiopsisgilvescens)、拟蜡菌(ceriporiopsispannocinta)、环带拟蜡菌(ceriporiopsisrivulosa)、浅红拟蜡菌(ceriporiopsissubrufa)、虫拟蜡菌(ceriporiopsissubvermispora)、灰盖鬼伞(coprinuscinereus)、毛云芝菌(coriolushirsutus)、特异腐质霉、绵毛状腐质霉、米赫毛霉、嗜热毁丝菌、粗糙脉孢菌、间型脉孢菌(neurosporaintermedia)、产紫青霉、变灰青霉(penicilliumcanescens)、离生青霉(penicilliumsolitum)、绳状青霉、黄孢原毛平革菌、射脉菌(phlebiaradiate)、杏鲍菇(pleurotuseryngii)、黄色篮状菌(talaromycesflavus)、太瑞斯梭孢壳霉、长绒毛栓菌(trametesvillosa)、变色栓菌(trametesversicolor)、哈茨木霉、康宁木霉、长枝木霉、里氏木霉和绿色木霉。
一旦产生重组ssf酶表达构建体,例如根据本文所述的方法产生,则该构建体即能够使用常规方法转化至合适的宿主细胞。
6.6.3.酶分离和/或纯化方法
在某些方面,重组ssf酶是经工程改造具有信号序列的,使得重组ssf酶分泌至宿主细胞的培养基。在某些方面,所关注的ssf酶以发酵液的形式回收。如本文所用,术语“发酵液”是指通过发酵并随后不经过或几乎不经过回收和/或纯化而制备的酶制品。例如,微生物培养物生长至饱和,在碳源限制条件下温育,从而允许蛋白质合成(例如酶的表达),一旦酶分泌至细胞培养基后,发酵液便成为能够从中回收所关注的ssf酶的发酵液。例如发酵液能够包含发酵结束时得到的未分离的或分离的发酵材料内容物。通常,发酵液是未分离的,并且包含用过的培养基,以及例如通过离心移除微生物细胞(如丝状真菌细胞)后存在的细胞碎片。在某些实施例中,发酵液包含用过的细胞培养基、胞外酶、以及存活的或死亡的微生物细胞。在一些实施例中,使发酵液分离以移除微生物细胞,从而使其包含用过的细胞培养基和胞外酶。
在一些方面,ssf酶的部分或完全纯化可以是所期望的。在某些实施例中,ssf酶被纯化为具有至少40%、至少50%、至少60%、至少70%、至少80%、至少95%、至少98%、或至少99%均一性。
然而,在某些其他方面,所关注的ssf酶能够以细胞形式制备(即部分或完全不分泌的),然后所述酶可能需要从细胞裂解物中回收。在这种情况下,使用本领域的常用技术从产生ssf酶的细胞纯化ssf酶。此类技术的实例包括但不限于亲和色谱法(参见例如vantilbeurgh等人,1984,febslett.(febs学报)169:215-218)、离子交换色谱法(参见例如goyal等人,1991,bioresourcetechnol.(生物资源技术)36:37-50;fliess等人,1983,eur.j.appl.microbiol.biotechnol.(欧洲微生物和生物技术应用期刊)17:314-318;bhikhabhai等人,1984,j.appl.biochem.(生物化学应用期刊)6:336-345;ellouz等人,1987,j.chromatography(色谱法期刊)396:307-317)、利用具有高分辨力的材料的离子交换色谱法(参见例如medve等人,1998,j.chromatography(色谱法期刊)a808:153-165)、疏水相互作用色谱法(参见例如tomaz和queiroz,1999,j.chromatography(色谱法期刊)a865:123-128)、和两相分配(参见例如brumbauer等人,1999,bioseparation(生物分离)7:287-295)。
适当地分离ssf酶以分离具有预先确定特性的蛋白质,所述特性例如与具体结合试剂或介质,如抗体或受体的结合亲和力;某些分子量范围;或某些等电点范围。
一旦实现给定ssf酶的表达,由此制备的ssf酶即能够从细胞或细胞培养物纯化。适用于此类纯化的示例性步骤包括但不限于抗体-亲和柱层析、离子交换色谱法、乙醇沉淀、反相hplc、硅胶或阳离子交换树脂(例如deae)色谱法、色谱聚焦、sds-page、硫酸铵沉淀、和使用例如sephadexg-75进行的凝胶过滤。许多蛋白质纯化方法都能够使用,这些方法在本领域是已知的,并且在文献中有所详细描述。例如,蛋白质纯化方法在如下文献中有所描述:deutscher,1990,methodsinenzymology(酶学方法),182(57):779;和scopes,1982,methodsinenzymology(酶学方法)90:479-91。
通常,纯化步骤或方法的选择取决于例如制备方法和所制备的具体蛋白质的性质。
6.6.4.发酵微生物
本发明的ssf方法利用“发酵微生物”从伴随糖化反应产生的和/或加入体系的糖产生发酵产物(例如乙醇)。能够产生乙醇的发酵微生物有时称为产乙醇生物。
如本文所用,术语“发酵微生物”是指适用于所需发酵方法的任何微生物。根据本发明的合适发酵微生物能够直接或间接使糖,例如葡萄糖、木糖、阿拉伯糖、甘露糖、半乳糖、或低聚糖发酵,即转化为所需的发酵产物。
合适的发酵微生物的实例包括但不限于真菌生物,例如酵母。具体地讲,合适的酵母能够选自酵母(saccharomycesspp.)菌株,具体地讲酿酒酵母。各种类型的酵母是可商购获得的,其中例如ethanolredtm酵母(得自fermentis/lesaffre,usa)、fali(得自fleischmann'syeast,usa)、superstarttm和
在其他方面,酵母是糖化酵母(saccharomycesdistaticus)或葡萄汁酵母(saccharomycesuvarum)。在其他方面,酵母是克鲁维酵母。克鲁维酵母的非限制性实例包括马克斯克鲁维酵母或脆壁克鲁维酵母(kluyveromycesfragilis)。在其他方面,酵母是假丝酵母。假丝酵母的非限制性实例包括拟热带假丝酵母(candidapseudotropicalis)和云苔假丝酵母(candidabrassicae)。在其他方面,酵母是棒孢酵母(clavispora)。棒孢酵母的非限制性实例包括葡萄牙棒孢酵母(clavisporalusitaniae)和仙人掌棒孢酵母(clavisporaopuntiae)。在另一方面,酵母是管囊酵母(pachysolen),例如嗜鞣管囊酵母(pachysolentannophilus)。在另一方面,酵母是酒香酵母(bretannomyces),例如克劳森酒香酵母(bretannomycesclausenii)。酵母发酵在文献中已有所描述。参见例如philippidis,1996,“cellulosebioconversiontechnology”(纤维素生物转化技术),handbookonbioethanol:productionandutilization(生物乙醇手册:生产和利用)(wyman编辑,taylor&francis,washington,d.c.,179-212)。
能够有效地将葡萄糖发酵为乙醇的细菌包括例如运动发酵单胞菌和热纤梭菌(参见例如philippidis,1996,上文)。
在酿酒酵母(参见例如chen和ho,1993,appl.biochem.biotechnol.(生物化学和生物技术)39-40:135-147;ho等人,1998,appl.environ.microbiol.(微生物学应用和环境)64:1852-1859)或细菌例如大肠杆菌(参见例如beall等人,1991,biotech.bioeng.(生物技术和生物工程)38:296-303)、产酸克雷伯氏菌(klebsiellaoxytoca)(参见例如ingram等人,1998,biotechnol.bioeng.(生物技术和生物工程)58:204-214)、或运动发酵单胞菌(参见例如zhang等人,1995,science(科学)267:240-243;deanda等人,1996,appl.environ.microbiol.(微生物学应用和环境)62:4465-4470)中克隆异源基因使构建的生物能够将己糖和戊糖转换为乙醇(共发酵)。此类微生物能够有利地用于本发明的方法。
在某些实施例中,发酵微生物是具有改善的乙酸盐耐受性的运动发酵单胞菌(参见例如美国专利公布us2009/0221078)。
在某些实施例中,发酵微生物是具有改善的木糖利用率的运动发酵单胞菌(参见例如美国专利公布us2009/0246846)。
在某些实施例中,发酵微生物是具有将戊糖发酵为乙醇的能力的运动发酵单胞菌(参见例如美国专利公布us2003/0162271)。
6.6.5.发酵培养基
在一些方面,本发明的ssf反应或方法在发酵培养基或完全发酵培养基中进行。如本文所用,术语“发酵培养基”是指ssf反应发生所必需的所有组分存在之前的培养基。因此,发酵培养基能够是例如得自部分糖化方法的培养基。在其他实施例中,发酵培养基能够是包含ssf反应发生所必需的所有组分的培养基。在此种情况下,发酵培养基也称为“完全发酵培养基”。此外,在其他实施例中,发酵培养基能够是其中ssf反应处于进行中的培养基,因此该培养基可包含某些糖化产物。
完全发酵培养基包含能够水解碳水化合物基纤维质底物或其他底物的酶、发酵生物、和碳水化合物基纤维质底物或其他底物(例如下面第6.7.2节中所述)。在完全发酵培养基的培养过程中,可发酵糖通过酶水解形成,继而通过发酵生物代谢而产生发酵产物。
6.7.同步糖化发酵方法
在某些方面,本发明的ssf反应在25℃和50℃之间的温度下进行。例如,ssf反应在25℃或以上、28℃或以上、30℃或以上、32℃或以上、35℃或以上、或38℃或以上的温度下发生。例如,ssf反应在50℃或以下、45℃或以下、40℃或以下、38℃或以下、35℃或以下、或30℃或以下的温度下发生。例如,ssf反应在28℃至45℃,例如30℃至40℃、32℃至38℃的温度范围内发生。在示例性实施例中,ssf反应在32℃至35℃的温度下进行。在另一个实施例中,ssf反应在约32℃的温度下进行。在反应期间,ssf反应进行的温度能够例如调高或调低。
在ssf中,纤维素的酶水解和葡萄糖发酵为乙醇组合成一个步骤(参见例如philippidis,1996,“cellulosebioconversiontechnology”(纤维素生物转化技术),handbookonbioethanol:productionandutilization(生物乙醇手册:生产和利用),wyman编辑,taylor&francis,washington,d.c.,第179-212页)。
ssf过程通常以分批发酵过程进行,其中发酵从开始至完成在单个发酵罐中进行。作为另外一种选择,ssf过程能够以连续发酵过程进行,该过程是运行无中断的稳定状态的发酵体系,并且其中每个发酵阶段在给定发酵体系的单独部分进行,流量设置对应于所需的保留时间。换句话讲,本发明发酵过程中的单个步骤能够以分批方式或连续方式进行。本文设想了其中所有步骤以分批方式进行的过程,或其中所有步骤以连续方式进行的过程,或其中一个或多个步骤以分批方式进行并且一个或多个步骤以连续方式进行的过程。
在某些实施例中,分批补料ssf过程可以是所期望的。分批补料过程需要分批阶段和进料阶段。分批阶段的培养基和进料阶段过程中加入的培养基是化学成分限定的,并且进料阶段的培养基在至少一部分进料阶段,以遵循预定义的指数函数的进料速率加入,从而使比生长速率保持在预定义值。
本发明的ssf反应能够合适地进行3至7天的时间。例如,本发明的ssf反应能够进行最多3天、4天、5天、6天、或7天。
本发明的ssf发酵过程包括但不限于用于制备发酵产物的发酵过程,所述发酵产物包括醇(例如乙醇、甲醇、丁醇、1,3-丙二醇)、有机酸(例如柠檬酸、乙酸、衣康酸、乳酸、葡萄糖酸、葡萄糖酸盐、乳酸、琥珀酸、2,5-二酮-d-葡萄糖酸)、酮(例如丙酮)、氨基酸(例如谷氨酸)、气体(例如h2和co2)、以及更复杂的化合物,包括例如抗生素(例如青霉素和四环素)、酶、维生素(例如核黄素、b12、β-胡萝卜素)、激素和其他化合物。
在某些方面,本发明提供一组特别适用于重组发酵细菌例如发酵单胞菌的ssf条件(即,本文也称为“重组发酵单胞菌ssf条件”)。例如,这些条件包括使用预处理的底物,例如玉米芯、蔗渣、牛皮纸浆底物以合适的重组运动发酵单胞菌厌氧地实施ssf烧瓶批次,以及使反应在约33℃、ph5.8以及约10重量%至25重量%固体负载量下进行,固体负载量取决于具体的底物和预处理。这些条件还包括例如通过向反应混合物中加入10%合适的运动发酵单胞菌菌株,例如菌株zw705(重组体)或zw1(野生型)种菌(5克)来开始发酵,无需任何另外的营养物。
在某些方面,本发明提供一组特别适用于发酵微生物的ssf条件,所述微生物为真菌,例如酿酒酵母(即,本文也称为“酵母ssf条件”)。例如,这些条件包括利用合适的酵母菌株,例如
6.7.1.ssf产物的回收
发酵产物能够是发酵生物产生的任何物质。在具体方面,该物质是醇。应当理解,术语“醇”涵盖包含一种或多种羟基部分的物质。在具体方面,醇是阿拉伯糖醇。在另一方面,醇是丁醇。在另一方面,醇是乙醇。在另一方面,醇是甘油。在另一方面,醇是甲醇。在另一方面,醇是1,3-丙二醇。在又一方面,醇是山梨醇。在又一方面,醇是木糖醇。参见例如gong等人,1999,“ethanolproductionfromrenewableresources”(由可再生资源制备乙醇),advancesinbiochemicalengineering/biotechnology(生物化学工程/生物技术进展),scheper编辑,springer-verlagberlinheidelberg,germany,65:207-241;silveira和jonas2002,appl.microbiol.biotechnol.(微生物和生物技术应用)59:400-408;nigam和singh,1995,processbiochem.(生物化学进展)30(2):117-124;ezeji等人,2003,worldj.microbiol.biotechnol.(世界微生物和生物技术期刊)19(6):595-603。
能够对得自发酵步骤的发酵液进行蒸馏,以回收发酵产物例如乙醇。发酵和蒸馏步骤能够同步或分步/顺序进行。在一些方面,蒸馏后,回收两种产物:醇例如乙醇以及发酵剩余物或残余产物(全釜馏物)。醇是与水的共沸混合物,在分离步骤中通过标准方法例如分子筛分法进一步纯化。例如,能够得到纯度最多约96体积%的乙醇,所述乙醇能够用作例如燃料乙醇、饮用乙醇即饮用中性酒精、或工业乙醇。
对于其他物质或发酵产物,本领域已知的任何方法均能够用于回收,包括但不限于色谱法(例如离子交换、亲和、疏水、色谱聚焦和分子排阻)、电泳步骤(例如制备式等电聚焦)、差别溶解(例如硫酸铵沉淀)、sds-page、蒸馏、或萃取。
6.7.2.碳水化合物或给料的来源
任何合适的纤维质底物或原料都能够应用于本发明的ssf过程。如本领域所熟知,能够根据所需的发酵产物,即得自发酵的物质,以及使用的方法来选择底物。
适用于本发明方法的底物实例包括含有纤维素的材料,例如木材废料或植物残体或能够随后通过发酵微生物代谢而从处理纤维素材料获得的低分子糖dp1-3,和/或能够通过直接加入发酵培养基来提供低分子糖dp1-3。
生物质能够包括含纤维素和/或半纤维素的任何组合物(木质纤维素生物质也能够包含木质素),例如种子、谷物、块茎、植物废料或食品加工或工业加工副产物(例如茎)、玉米(包括芯、秸秆等等)、草(例如印度草,如黄假高梁(sorghastrumnutans);或软枝草,例如黍属(panicum)物种例如柳枝稷(panicumvirgatum))、木材(包括木片、加工废料)、纸材、纸浆、回收纸(例如报纸)。其他生物质材料包括但不限于土豆、大豆(油菜籽)、大麦、黑麦、燕麦、小麦、甜菜或蔗渣。
6.8.生物质的预处理
在ssf反应前,生物质(例如木质纤维素材料)优选地经过预处理步骤以使木聚糖、半纤维素、纤维素和/或木质素材料更容易接触酶,因此更容易通过本发明的方法进行糖化和发酵。
在一个方面,预处理需要将合适容器例如反应器中的干燥生物质材料接触催化剂,所述催化剂包含强酸和金属盐的稀释溶液;这样能够降低纤维素水解的活化能或温度,以得到更高的糖产量;参见例如美国专利6,660,506、6,423,145。
另一个示例性预处理方法需要使材料经过第一阶段水解步骤来水解生物质,该步骤在含水培养基中进行,所选择的温度和压力水平会实现半纤维素的初步解聚,而纤维素不会大量解聚为葡萄糖。该步骤产生了浆液,其中液体水相包含半纤维素解聚得到的溶解单糖,固相包含纤维素和木质素。第二水解步骤能够涉及这样的条件,在此条件下至少纤维素主要部分解聚,从而得到含溶解/可溶解纤维素解聚产物的液体水相。参见例如美国专利5,536,325。
另一个示例性方法包括使用约0.4%至2%的强酸,通过一个或多个阶段的稀酸水解来处理生物质材料;以及通过碱法脱木素处理酸水解生物质材料的未反应固体木质纤维素组分。参见例如美国专利6,409,841。
另一个示例性预处理方法包括在预水解容器例如反应器中预水解生物质(例如木质纤维素材料);将酸性液体加入固体木质纤维素材料制得混合物;将混合物加热至合适的反应温度;保持反应温度一段时间,使之足够使木质纤维素材料分解成溶解部分和固体部分,所述溶解部分包含至少约20%得自木质纤维素材料的木质素,所述固体部分包含纤维素;将溶解部分从固体部分移除,同时使混合物保持在反应温度或附近,在这样的情况下使得固体部分中的纤维素更容易被酶消化;以及回收溶解部分。参见例如美国专利5,705,369。
在另一个示例性方法中,预处理方法使用过氧化氢h2o2。参见例如gould,1984,biotech.bioengr.26:46-52。
在又一个示例性方法中,预处理包括使生物质以非常低的生物质浓度接触化学计量的氢氧化钠和氢氧化铵。参见例如teixeira等人,1999,appl.biochem.biotech.(生物化学和生物技术应用)77-79:19-34。
在另一个实施例中,预处理包括使木质纤维素在约9至约14的ph、适当温度、压力和ph下接触化学品(例如碱,如碳酸钠或氢氧化钾)。参见例如pct专利申请公布wo2004/081185。
在另一个示例性方法中,预处理使用氨。例如,预处理方法包括在高固体含量的条件下使生物质接触低浓度的氨。参见例如美国专利公布20070031918、pct专利申请公布wo2006/11901。
本发明还通过以下实例阐述。这些实例的提供仅出于例证性目的。它们不应解释为以任何方式限制本发明的范围或内容。
7.实例1:ssf反应中exp形成的分析
7.1.材料与方法
7.1.1.底物
下面列出这项工作中所用的底物。也列出预处理底物的纤维素、木聚糖和木质素组分。组成分析利用“nrelprotocolsforstandardbiomassanalyticalprocedures”(标准生物质分析步骤的nrel方案)(可在http://www.nrel.gov/biomass/pdfs/42618.pdf处获得)中详述的标准测定法进行:
稀氨水预处理的玉米芯。在酶促水解之前对玉米芯进行预处理,根据例如美国专利申请公布2007-0031918-a1、us-2007-0031919-a1、us-2007-0031953-a1、us-2007-0037259-a1,和pct专利申请公布wo06/110901a2中描述的方法和加工范围进行(除非另外指明)。
该底物的组成包含:34.8%纤维素、29.2%木聚糖、12.8%木质素。
稀硫酸预处理的蔗渣。这种底物由nrel生产和提供,如schell等人,2003(app.biochem.biotechnol.(生物化学和生物技术应用)第105-108卷,69-85)中详述的。对蔗渣进行预处理,处理条件为:固体浓度为20%(重量/重量),温度为165℃,酸浓度为1.44%(重量/重量),以及停留时间约为8min。该底物的组成包含:55.0%纤维素、3.1%木聚糖、31.2%木质素。
混合的工业未漂白阔叶纸浆底物。这种底物利用牛皮纸浆制法和氧脱木素方法制备(卡伯值=13)。(研究得到l’agencenationaledelarecherche(anr-05-bioe-007)与l'agencedel’environnementetdelamaitrisedel'energie(ademe0501c0099)资助)。该底物的组成包含:74.6%纤维素、20.7%木聚糖、2.6%木质素。
工业未漂白针叶纸浆底物。这种底物利用牛皮纸浆制法和氧脱木素方法制备(卡伯值=14)。(研究得到l’agencenationaledelarecherche(anr-05-bioe-007)与l'agencedel’environnementetdelamaitrisedel'energie(ademe0501c0099)资助)。该底物的组成包含:81.9%纤维素、8.0%木聚糖、1.9%木质素。
7.1.2.酶
下面列出这项工作中所用的酶和酶混合物。
accellerasetm1500(daniscou.s.inc.,genencor)是具有较高β-葡萄糖苷酶活性的纤维素酶复合物,其由经基因修饰的里氏木霉制备。它包含多种酶活性,其中的大多数为外切葡聚糖酶活性、内葡聚糖酶活性、β-葡萄糖苷酶活性,和半纤维素酶活性。
bxl1:是来自里氏木霉的β-木糖苷酶。bxl1的氨基酸序列是随同本文提供的seqidno:4。已在使用对硝基苯基-β-吡喃木糖苷、木二糖或混合的线性木聚糖低聚物作为底物的测定中,证明bxl1具有β-木糖苷酶活性。
xyn3:是来自里氏木霉的gh10家族木聚糖酶。xyn3的氨基酸序列是随同本文提供的seqidno:18。已使用桦木偶氮木聚糖(megazyme,wicklow,ireland)证明xyn3具有内切木聚糖酶活性,而且当xyn3与木二糖糖苷酶共同对预处理的生物质或分离的半纤维素起作用时在木二糖糖苷酶的存在下xyn3具有增大木糖单体产量的能力,这间接地证明了这一点。
fv3a:是来自轮枝镰孢菌的gh3家族酶。fv3a的氨基酸序列是随同本文提供的seqidno:6。已在使用对硝基苯基-β-吡喃木糖苷、木二糖和混合的线性木聚糖低聚物(图15和16)以及来自半纤维素的支化的阿糖基木聚糖低聚物作为底物的测定中,证明fv3a具有β-木糖苷酶活性。
fv51a是来自轮枝镰孢菌的gh51家族酶。fv51a的氨基酸序列是本文提供的seqidno:16。已在使用对硝基苯基-α-l-阿拉伯呋喃糖苷的测定中,证明fv51a具有l-α-阿拉伯呋喃糖苷酶活性,而且半纤维素因内切木聚糖酶的作用而释放的一组低聚物释放出阿拉伯糖也证明了这一点。
fv43d:是来自轮枝镰孢菌的gh43家族酶。fv43d的氨基酸序列是本文提供的seqidno:2。已在使用对硝基苯基-β-吡喃木糖苷、木二糖或混合的线性木聚糖低聚物作为底物的测定中,证明fv43d具有β-木糖苷酶活性。(图15和16)。
fv43b:是来自轮枝镰孢菌的gh43家族酶。fv43b的氨基酸序列是本文提供的seqidno:12。已在使用对硝基苯基-β-吡喃木糖苷、木二糖或混合的线性木聚糖低聚物作为底物的测定中,证明fv43e具有β-木糖苷酶活性。
pf43a:是来自绳状青霉的gh43家族酶。pf43a的氨基酸序列是本文提供的seqidno:8。已在使用对硝基苯基-β-吡喃木糖苷、木二糖或混合的线性木聚糖低聚物作为底物的测定中,证明pf43a具有β-木糖苷酶活性。
fv43e:是来自轮枝镰孢菌的gh43家族酶。fv43e的氨基酸序列是本文提供的seqidno:10。已在使用对硝基苯基-β-吡喃木糖苷、木二糖或混合的线性木聚糖低聚物作为底物的测定中,证明fv43e具有β-木糖苷酶活性。
af43a:是来自烟曲霉的gh43家族酶。af43a的氨基酸序列是本文提供的seqidno:14。已在使用对硝基苯基-α-l-阿拉伯呋喃糖苷的测定中,证明af43a具有l-α-阿拉伯呋喃糖酶活性,而且半纤维素因内切木聚糖酶的作用而释放的一组低聚物释放出阿拉伯糖也证明了这一点。
xlna:xlna是来自塔宾曲霉(aspergillustubengensis)的木聚糖酶。xlna的氨基酸序列是本文提供的seqidno:20。本实例中所用的xlna蛋白质是未纯化的,是主要组分为xlna的酶制品形式。
bgl1:bgl1是里氏木霉β-葡萄糖苷酶1(seqidno:26)。bgl1基因已在如下文献中描述:例如barnett等人,1991,bio-technology(生物技术)9(6):562-567。
7.1.3.菌株
菌株#229:利用peg介导转化(参见,例如penttila等人,1987,gene61(2):155-64),将通过诱变和选择高纤维素酶生产滴度从rl-p37(sheir-neiss和montenecourt,1984,appl.microbiol.biotechnol.(微生物和生物技术应用)20:46-53)得到的里氏木霉菌株用β-葡萄糖苷酶表达盒(其包含cbh1启动子、里氏木霉β-葡糖苷酶1基因、cbh1终止子和amds标记(构巢曲霉乙酰胺酶))和内切木聚糖酶表达盒(其包含cbh1启动子、里氏木霉xyn3和cbh1终止子)进行共转化。分离出许多转化体并对它们的β-葡萄糖苷酶和内切木聚糖酶生产进行检测。将一个称为里氏木霉菌株#229的转化体用于本文所述的某些研究中。
菌株h3a:利用电穿孔(参见,例如,pct专利申请公布wo2008/153712a2),将里氏木霉菌株#229用β-木糖苷酶fv3a表达盒(其包含cbh1启动子、fv3a基因、cbh1终止子和alsr标记(天然里氏木霉乙酰乳酸合酶的氯嘧磺隆抗性突变体))、β-木糖苷酶fv43d表达盒(其包含egl1启动子、fv43d基因、天然fv43d终止子)和fv51aα-阿拉伯呋喃糖苷酶表达盒(其包含egl1启动子、fv51a基因、天然fv51a终止子)进行共转化。在含有氯嘧磺隆的vogels琼脂板上挑选转化体。分离出许多转化体并对它们的β-木糖苷酶和l-α-阿拉伯呋喃糖苷酶生产进行检测。分离出重组表达里氏木霉β-葡萄糖苷酶1、里氏木霉xyn3、fv3a,fv51a,和fv43d,的里氏木霉整合型表达菌株h3a,并将其用于本文所述的某些研究中。
7.1.4.生物和种菌制备
7.1.4.1.运动发酵单胞菌
背景:运动发酵单胞菌菌株zw1是野生型菌株,类似于来自美国典型培养物保藏中心(atcc31821,manassas,va)的菌株zm4。重组运动发酵单胞菌菌株zw705由菌株zw801-4制得,如下所概述。让运动发酵单胞菌菌株zw801-4的培养物在如下所述的应力条件下生长。zw801-4是运动发酵单胞菌的木糖利用重组菌株,其描述在美国专利申请公布2008/0286870中。菌株zw801-4来源于菌株zw800,菌株zw800继而来源于菌株zw658,它们都描述于美国专利申请公布2008/0286870中。zw658通过下列方法构建:经由连续的转座事件将两个包含编码木糖异构酶、木酮糖激酶、转醛醇酶和转酮醇酶的四个木糖利用基因的操纵子pgapxylab和pgaptaltkt整合到zw1(atcc#31821)基因组中,然后在含有木糖的选择培养基上进行适应步骤。zw658的保藏号为atcc#pta-7858。在zw658中,利用宿主介导的双交换同源重组,以壮观霉素抗性为选择性标记对编码葡萄糖-果糖氧化还原酶的基因插入失活从而构建zw800。使用cre重组酶通过位点特异性重组除去以loxp位点为边界的壮观霉素抗性标记,从而构建zw801-4。
将zw801-4的连续培养物培养于250mlph和温度受控的搅拌发酵罐(sixfors;bottmingen,switzerland)中。发酵的基础培养基是5g/l酵母提取物、15mm磷酸铵、1g/l硫酸镁、10mm山梨醇、50g/l木糖和50g/l葡萄糖。通过逐渐增大上述连续培养基中的醋酸铵浓度,同时维持如通过在97天的时间内达到160mm浓度所需的特定稀释速率测得的既定生长速率,实现在高浓度醋酸盐和氨的存在下培养的适应。通过增量添加磷酸铵来进一步增大铵离子的浓度,直至在139天的连续培养结束时达到210mm的最终总铵离子浓度。通过平板法、pcr扩增和/或其他常规的熟知方法,从适应的种群中分离出菌株zw705。
7.1.4.2.用于ssf的种子培养物的生长
将运动发酵单胞菌菌株zw705和zw1作为20%甘油储液保存,冷冻在-80℃下。为了制备种子培养物,将2ml的这种冻存储液解冻,并用来接种45mlph5.8的培养基,所述培养基含有5g/l酵母提取物、4g/l磷酸氢钾、1g/l硫酸镁和100g/l葡萄糖。起始od600nm为0.4。让该培养物于32℃在50ml的加盖管中生长至od600nm为约2.5,然后将其用来接种ph5.8的最终种子培养物,所述培养物含有200g/l葡萄糖、4g/l磷酸氢钾、2g/l硫酸镁和20g/l酵母提取物。让该培养物于32℃在ph受控的搅拌发酵罐中生长,直至od600nm为约10和剩余葡萄糖浓度为约80g/l。使用与10%ssf发酵体积相等的体积的这种种子培养物(具有约10的od600nm)来启动ssf。
7.1.4.3.酵母
所用的产乙醇酵母为
7.1.5.使用糖的发酵
采用分批和分批补料方法,在500mlsixfors生物反应器中使用合成糖进行运动发酵单胞菌发酵,持续3天。合成糖由葡萄糖和木糖组成。对于分批方法,初始装载约80g/l葡萄糖和70g/l木糖的浓度的糖。对于分批补料方法,首先制备浓缩储备糖溶液,然后利用注射器泵(phd2000,harvardapparatus,holliston,ma)注入生物反应器中。对流速进行设定和控制,使得它在第3天时供给约80g/l葡萄糖和70g/l木糖的最终等效糖负载量。对于分批或分批补料方法,开始时将10重量%的发酵单胞菌属种菌装入反应混合物中,并在33℃和ph5.5下进行厌氧发酵。
7.1.6.同步糖化发酵(ssf)
ssf烧瓶批次在适宜的重组运动发酵单胞菌和酵母发酵条件下厌氧进行。除非另有说明,否则使用稀氨水预处理的玉米芯、蔗渣或牛皮纸浆底物的重组发酵单胞菌属ssf实验都在33℃、ph5.8下,分别以25重量%、20重量%、10重量%固体负载量进行。首先将25重量%固体(12.5g干重)、20重量%固体(10.0g干重)或10重量%固体(5.0g干重)的相应底物各自装入125ml锥形瓶中,接着加入预先与所需量的6n硫酸混合的去离子水以便将底物ph滴定至5.8。添加上述纤维素酶和半纤维素酶,它们的添加量分别基于生物质底物中的毫克纤维素酶蛋白质/克纤维素和毫克半纤维素酶蛋白质/克木聚糖。通过向反应混合物中加入10重量%的运动发酵单胞菌菌株zw705(重组)或zw1(野生型)种菌(5g)开始发酵,无需另外的营养物。对于
7.1.7.分步水解发酵(shf)
shf批次涉及糖化阶段,糖化阶段之后是发酵阶段。除了对酶类型和/或水平、纤维素负载量和ph的某些修改之外,糖化条件都是基于“nrellaboratoryanalyticalprocedure”(nrel实验室分析步骤)(参见,selig等人,2008,enzymaticsaccharificationoflignocellulosicbiomasslaboratoryanalyticalprocedure(lap),technicalreport(木质纤维素生物质酶糖化的实验室分析方法(lap)技术报告)nrel/tp-510-42629)。将25重量%固体(12.5g干重)的稀氨水预处理的玉米芯或10重量%固体(5.0g干重)的混合阔叶纸浆装入125ml锥形瓶中。然后,接着加入预先与所需量的6n硫酸混合的去离子水以便将底物ph滴定至5.3。糖化步骤通过加入纤维素酶和半纤维素酶开始,纤维素酶和半纤维素酶的添加量分别基于生物质底物中的总毫克蛋白质/克纤维素和总毫克蛋白质/克木聚糖。对于所有发酵单胞菌属shf批次,温度50℃和ph5.30用于持续3天的糖化,接着利用与ssf过程(上文)中描述的条件相似的条件进行发酵步骤。使用氢氧化钠将ph值从5.3增大至5.8。然后加入10重量%的发酵单胞菌属种菌从而开始发酵。
7.1.8.分批补料ssf
分批补料ssf研究在与ssf过程(上文)中描述的条件相似的条件下进行,不同的是将稀氨水预处理的玉米芯底物(获得最终25重量%固体所需的)平均分成8批,并分批加入生物反应器中,最后一批在第30小时装载。
7.1.9.hplc分析和exp定量
按定时的间隔取出发酵样品,并利用watershplc系统(alliancesystem,waterscorp.,milford,ma)对乙醇、残余糖、乙基-β-吡喃木糖苷(exp)和其他代谢产物,例如,乙酸和甘油进行分析。hplc色谱柱购自biorad(aminexhpx-87h,bioradinc.,hercules,ca)。根据折射指数检测的exp定量按照与zhang等人(2009,enzymeandmicrobialtechnology(酶和微生物技术)44:196–202)所述类似的一整套步骤进行。发现另一种代谢副产物琥珀酸与exp共洗脱,并潜在地使exp定量值增大。经测定,对于酵母和发酵单胞菌属发酵,在测试条件下产生的琥珀酸浓度不超过1至2g/l,如利用uv检测器在220nm处和酶分析试剂盒(k-succ,megazyme,co.wicklow,ireland)测得的。
7.2.结果
7.2.1.exp形成和鉴定
7.2.1.1.使用重组运动发酵单胞菌的ssf中的exp形成
使用能够使葡萄糖和木糖共发酵成乙醇的重组运动发酵单胞菌菌株,在上述ssf发酵条件下观察到副产物的形成。这项研究中所用的底物是稀氨水预处理的玉米芯,其具有高木聚糖含量,并用市售纤维素酶/半纤维素酶制品(20mg/g纤维素的accellerasetm1500)和
使用稀氨水预处理的玉米芯和如上所述的运动发酵单胞菌菌株,在ssf条件下产生的副产物在hplchpx-87h色谱柱上的洗脱时间为约11.75min(在0.6ml/min的流速下),与琥珀酸的洗脱时间接近。图1第2组示出在将木糖和
7.2.1.2.时间进程
甲基吡喃木糖苷、乙基吡喃木糖苷和正丙基吡喃木糖苷出现的时间进程在图2中示出。100小时后形成的产物的相对量如下:甲基木糖苷>乙基木糖苷>正丙基木糖苷(图2),与drouet等人(在1994,biotech.&bioeng.(生物技术和生物工程)43:1075-1080中)针对在meoh、etoh和n-proh的存在下由逆水解形成烷基-β-d-吡喃木糖苷报道的顺序一致。乙基吡喃木糖苷(exp)的洗脱时间与在ssf条件下观察到的那些的一致性、洗脱时间对醇的存在和性质的依赖性,以及这些醇的相对反应性,所有这些都表明exp是在ssf条件下产生的副产物。
7.2.1.3.通过1hnmr分析鉴定exp样品中的乙基-β-糖苷
制备乙基b-d-吡喃木糖苷标准品:通过下列方式制备乙基木糖苷样品:将50mgd-木糖溶解在3ml乙醇中并将所得溶液在amberlyst15h+树脂(100mg)的存在下在70℃加热3小时。过滤树脂,减压除去乙醇溶剂,得到无色油状物。1hnmr分析显示为乙基木糖苷的混合物,其中a-d-吡喃木糖苷占优势,还有一些量的乙基β-吡喃木糖苷和乙基α/β-呋喃木糖苷。
exp样品的1hnmr:将从稀氨水预处理的玉米芯ssf发酵液样品中纯化和分馏(利用hplc)出的冻干的exp样品复原于750μld2o中,并将其转移至pp-528nmr玻璃管中。质子nmr波谱是在varian500mhzvnmrsnmr系统上使用基本s2pul脉冲序列持续超过8个脉冲获得的。1hnmr波谱(500mhz,d2o)以d4.80处的hod信号为参照,基于d1.20-1.26区域出现的数个三重信号,指示存在至少4种不同的乙基糖苷。该波谱还包含5个不同的双重信号,位于d4.43、4.49、4.53和4.66处,耦合常数为7.8hz,指示存在b-糖苷键。d4.43处的信号最强烈并与文献(drouet等人,1994,biotech.&bioeng.(生物技术和生物工程)43:1075-1080),zhang等人(2009,enzymeandmicrobialtechnology(酶和微生物技术)44:196–202)中所报道的乙基-β-d-吡喃木糖苷的化学位移匹配。总体而言,在1hnmr波谱(图3)中观察到的信号指示存在β-异头物、β-d-乙基吡喃木糖苷,以及3至4种另外的乙基β-糖苷。
7.2.2.使用酵母和野生型运动发酵单胞菌时的exp形成
在使用稀氨水预处理的玉米芯底物的ssf和分批补料ssf条件下,使用产乙醇运动发酵单胞菌的c5/c6糖共发酵产生高水平的exp。设计新的实验以确定当使用野生型酵母和运动发酵单胞菌(它们是只能够发酵c6糖的生物)进行ssf时是否有exp形成。结果(图4)表明在由酵母(5.5g/l)或野生型运动发酵单胞菌(9.1g/l)进行发酵的ssf反应中产生高水平的exp。因而,exp形成并不是重组运动发酵单胞菌所特有的,因为在使用酿酒酵母和野生型运动发酵单胞菌的ssf期间也检测到exp形成。
7.2.3.用其他生物质来源时的exp形成
设计另外的实验以确定使用不同于稀氨水预处理的玉米芯的底物是否能够形成exp。从表2中所示的结果可看出,在使用里氏木霉纤维素酶/半纤维素酶制品的ssf条件下,exp的形成似乎与任何高木聚糖含量的底物的发酵都有关联。例如,使用具有高木聚糖含量的混合阔叶工业牛皮纸浆在重组发酵单胞菌属ssf条件下形成的exp多达16.1g/l。另一方面,低木聚糖含量的底物,如预先处理的蔗渣和针叶纸浆在相似条件下产生的exp量较少(分别为0.91g/l和4.75g/l)。此外,再次证明仅在本文所述的ssf过程中有大量的exp生成。在shf过程条件下即使使用高木聚糖含量的底物,形成的exp也少很多(3.52g/l)。
7.2.4.在对ssf中所用的酶进行不同的排列时的exp形成
7.2.4.1.使用bxl1时的exp形成
根据drouet等人(1994,biotech.&bioeng.(生物技术和生物工程)43:1075-1080中),里氏木霉bxl1经由转木糖基化(transxylosylation)和逆水解反应催化exp的形成。图5表明在里氏木霉bxl1的存在下,上述酵母ssf条件下的exp形成增加。在加入5mg/gbxl1时,exp产量从5.5g/l增加至18.8g/l。
如图6所示,在里氏木霉bxl1的存在下,使用25重量%固体的稀氨水预处理的玉米芯底物在重组运动发酵单胞菌ssf条件下形成的exp也增加。在加入6mg/g里氏木霉bxl1时,exp稳定在25.6g/l浓度。将来自里氏木霉整合型菌株#229(其过表达木聚糖酶,即里氏木霉xyn3)的纤维素酶/半纤维素酶复合物用在这个实验中以代替accellerasetm
研究了轮枝镰孢菌半纤维素酶的加入对exp形成的影响。使用accellerasetm
7.2.4.2.使用纯化酶时的exp形成
上面讨论的结果表明里氏木霉bxl1极大地影响并有效地催化exp形成,并且里氏木霉bxl1在使用某些高木聚糖含量的生物质底物的ssf条件下显著且特别有效地制备exp。然而,到目前为止测试的(和上面讨论的)所有酶都没有纯化,并可包含与能够制备exp的里氏木霉bxl1的酶活性相似的背景酶活性。为了查明背景酶活性的影响,还研究了纯化酶对exp形成的影响。将纯化的里氏木霉纤维二糖水解酶cbh1和cbh2;里氏木霉内切葡聚糖酶eg2;和里氏木霉β-葡萄糖苷酶bgl1的纤维素酶混合物用作accellerasetm1500的替代品,而将纯化的里氏木霉xyn3用作multifecttm木聚糖酶的替代品。从图8中所示的结果可明显看出,单独的纤维素酶不产生exp。未纯化里氏木霉xyn3的加入产生大量的exp,例如,约13.1g/l。这种大幅度增加可能是由于未纯化里氏木霉xyn3样品中存在较多的背景里氏木霉bxl1。
7.2.4.3.使用gh43类bxl酶时的exp形成
bxl1是gh3家族水解酶,已被证明对于在ssf条件(上文)下催化exp的形成有活性且有效。仍然存在的问题是其他gh家族β-木糖苷酶是否也能够在类似条件下催化exp形成。使用25重量%固体的稀氨水预处理的玉米芯底物在重组发酵单胞菌属ssf条件下,测试来自gh43家族的许多β-木糖苷酶,包括fv43b,pf43a,fv43e,和af43a,。已发现,与由菌株#229蛋白质制品制成的对照样品相比,pf43a,fv43e,和af43a使exp的形成稍有增加。另一方面,fv43b使exp的形成增加较多,增加1.5倍(图9)。因为所有这些gh43家族酶都表达于里氏木霉中,并且因为它们在这项研究中都是未纯化蛋白质制品,所以能够推断,exp形成的增加可能归因于蛋白质制品中存在天然bxl1。
8.实例2:半纤维素酶导致exp减少
下面的实例说明在ssf反应中某些半纤维素酶的加入使exp减少。
8.1.fv43d导致发酵单胞菌属ssf中的exp减少
exp形成通常等摩尔比地消耗木糖(直接消耗,或从木二糖或其他木糖低聚物消耗)和乙醇。这种消耗机制直接导致乙醇的产量明显减小,因为包括发酵单胞菌属在内的许多微生物都不能降解或发酵exp,或以其他方式利用exp。计算出一(1)克exp相当于已产生的乙醇损失0.688g(假设木糖以0.51g/g木糖的比率发酵成乙醇)。因而,阻止exp的形成能使得乙醇的产量随之增大。已发现,如图10所示,以仅1mg/g木聚糖的量加入轮枝镰孢菌β-木糖苷酶fv43d,极大地减少(约4倍)在重组发酵单胞菌属ssf条件下形成的exp量。
8.2fv43d导致酵母ssf中的exp减少
类似于从c5/c6-发酵重组发酵单胞菌属获得的结果,在使用酵母作为c6-发酵微生物的ssf反应中,在accellerasetm
8.3fv43d导致使用multifect木聚糖酶、使用xlna和使用来自里氏木霉整合型菌株#229的酶复合物的ssf中的exp减少
研究了在重组发酵单胞菌属ssf条件下,在三种酶配置即accellerasetm
图12表明,向accellerasetm
8.4使用纯化酶的ssf中exp形成的减少
为了确保fv43d所导致的exp减少不是由背景酶活性引起的,使用包括纯化fv43d在内的纯化酶测试exp形成的减少。将纯化cbh1、cbh2、eg2和bgl1的里氏木霉纤维素酶混合物用作accellerasetm1500的替代品,并将纯化里氏木霉xyn3用作
8.5在ssf中加入fv43d时exp减少的剂量响应
在bxl1的存在下exp的形成是明显的,其中持续检测到多于20g/l的exp,但确切的数量随着所用的ssf条件改变。进行剂量响应研究以评估exp形成的减少与所加入的fv43d量的关系。图14a示出向由里氏木霉整合型菌株#229产生的酶复合物和里氏木霉bxl1中加入递增量的fv43d所导致的exp减少的结果。与前面所示的结果类似,发现1mg/g的fv43d有效地使exp形成减少近3倍,并同时导致乙醇滴度增大。然而,以3mg/g、6mg/g和9mg/g的递增量加入fv43d并没有极大地减少exp的形成,但观察到乙醇滴度显著增大。似乎即使加入大量的fv43d(为9mg/g),exp浓度也不能降低至低于6.6g/l,即,exp量在测试所用的特定条件下可到达平衡的水平。在这些特定实验条件下,进一步加入超过例如1mg/g木聚糖的fv43d,不再对减少exp的形成有影响。
这些观察结果能潜在地由ssf条件下exp形成和减少的机制加以解释。
所提出的机制基于从这项工作得到的观察结果,与文献(参见,例如,drouet等人,1994,biotech.&bioeng.(生物技术和生物工程)43:1075-1080和zhang等人,2009,enzymeandmicrobialtechnology(酶和微生物技术)44:196–202)中报道的数据一致,并详细描述在下面的实例3中。
8.6在ssf中fo43a和gz43a的加入所导致的exp减少
还在本文所述的ssf条件下测试作为翻转型gh43家族β-木糖苷酶的fo43a和gz43a,减少exp形成的功效。基于图14b中所示的结果,当将这两种酶以3mg/g木聚糖的量加入到包含由里氏木霉整合型菌株#229产生的酶复合物、里氏木霉bxl1、稀氨水预处理的玉米芯底物、和重组发酵单胞菌属的酶共混物中时,它们各自均能够使exp形成减少近4倍。与加入fv43d(上文)观察到的结果类似,观察到exp形成的减少和乙醇滴度的相应增大(增大约10g/l)。
9.实例3:exp形成机制
在ssf条件下(图10和11),在轮枝镰孢菌β-木糖苷酶fv3a的存在下的exp产量比在轮枝镰孢菌β-木糖苷酶fv43d的存在下的exp产量高出大约4倍,这样的观察结果激发人们努力去了解exp形成的机制。
对于exp的形成,潜在地存在两种可能的途径:(1)通过转糖基作用;或(2)通过逆水解。这些途径中的每种描述如下:
1)转糖基作用:x-o-x+etoh→x-o-et+x
2)逆水解:
根据drouet等人(1994,biotech.&bioeng.(生物技术和生物工程)43:1075-1080),转糖基作用机制是这两者中较迅速的。转糖基反应中仅形成β异头物(参见图29)的这一事实暗示,该反应由以保持异头构型的方式对底物起作用的酶催化,其中糖通过β-糖基键连接。另一方面,逆水解形成exp的β异头物,这提示起始底物是α-或β-木糖,具体取决于exp是通过异头构型的翻转还是异头构型的保持形成。
β-木糖苷酶、fv3a(gh3家族成员)和fv43d(gh43家族成员)分别以构型保持和翻转的方式起作用。为了鉴别和鉴定上述两种潜在机制中的哪一种是真正的机制,进行这样的实验,其中将
如图15和表3所示,很短的一段时间之后,
9.1exp形成的平衡方程式
在ssf条件下,
3)x4+etoh→x2-et+x2
4)x2-et+etoh→2exp
5)x2+etoh→exp+x
注意如果仅木二糖被转糖基化,则exp的形成仅来自行5)的反应。
通过对木糖低聚物(平均分子量=539)的水解与木二糖的水解进行比较检查这些可能性,使用如下相同的三种酶中的每种:fv3a,fv43d,和
图16(左图)和图16(右图)中绘制出在使彼此之间的木糖形成率在两倍以内的浓度的
在
9.2平衡常数计算
drouet等人(1994,biotech.&bioeng.(生物技术和生物工程)43:1075-1080)已提出,逆水解之后烷基吡喃木糖苷(axp)例如exp的形成程度能够由醇、木糖和烷基吡喃木糖苷产物之间建立的平衡确定。
乙基吡喃木糖苷(exp)的解离常数为:
利用该式,能够从图2所示数据计算出当ssf反应中存在
10.实例4:从里氏木霉中缺失bxl1基因
10.1构建bxl1缺失盒
为了构建bxl1缺失盒,使用pfuultraiifusionhsdna聚合酶(stratagene),分别用引物对mh375/mh376和mh377/mh378(表4所示)通过pcr对来自里氏木霉基因组dna的bxl1基因的5'和3'-侧翼序列(margolles-clark等人,1996,app.environ.microbiol.(微生物应用和环境)62(10):3840-6)进行扩增。3’-侧翼序列包含bxl1编码序列的一部分从而避开附近的bgl1基因。引物mh376在5'-端磷酸化。将总体积为10μl的一(1)μl5u/ml浓度的t4dna连接酶(rocheappliedbioscience)、1μl10x连接缓冲液(roche)和约20ngpcr片段在室温下温育10分钟。将连接反应混合物用作pcr反应的模板,该pcr反应使用引物对h379/mh380和pfuultraiifusionhsdna聚合酶(stratagene)。
根据制造商说明书(invitrogen),将所得4.0kb片段克隆到pcr-bluntii-topo中。将该质粒转化到大肠杆菌one
使用pfuultraiifusionhsdna聚合酶(stratagene),用引物mh292/mh290从含有构巢曲霉olic启动子、潮霉素抗性基因(大肠杆菌,潮霉素磷酸转移酶,hph)和构巢曲霉trpc终止子的载体中扩增出潮霉素抗性基因。将pcr扩增片段克隆到pcr-bluntii-topo(invitrogen)中,并将其转化到大肠杆菌one
对如上所述的两种分离的片段进行连接,使用反应体积为10μl的1μl10x连接缓冲液(roche)、1μl5u/mlt4dna连接酶(roche)和50ng的每种片段进行。将连接混合物克隆到大肠杆菌one
通过使用引物mh379/mh380和pfuultraiifusionhsdna聚合酶(stratagene)以10ml总体积从质粒(pcr-bluntii-topo,bxl1缺失,hph-loxp)中扩增片段来形成bxl1-缺失盒。利用qiaexii试剂盒(qiagen)纯化并浓缩pcr产物。将dna用speedvac进一步浓缩至约1.5mg/ml的浓度。
10.2将bxl1缺失质粒转化到里氏木霉中
将来自bxl1缺失盒的dna转化到里氏木霉菌株#229中,里氏木霉菌株#229过表达里氏木霉bgl1和里氏木霉xyn3,如本文前面所述。在包含100ppm潮霉素b(invitrogen)的培养基上选择转化体。通过pcr选择包含bxl1缺失的转化体。bxl1缺陷型里氏木霉菌株在本文称为“bxl1-”菌株。
11.实例5:使里氏木霉菌株表达fv43d
下面的实例说明了如何对里氏木霉进行工程化改造从而使其表达fv43d。经工程化改造从而表达fv43d的里氏木霉菌株在本文称为“fv43d+”菌株。
11.1构建表达盒
使用引物sk1322/sk1297(表5)通过pcr从轮枝镰孢菌基因组dna样品中扩增出fv43d基因,来构建轮枝镰孢菌β-木糖苷酶fv43d表达盒。使用引物sk1236/sk1321,通过pcr从在经工程化改造的里氏木霉菌株rl-p37(参见,例如sheir-neissg.和b.s.montenecourt,appl.microbiol.biotechnology(微生物和生物技术应用),20(1984),第46-53页)中提取的里氏木霉基因组dna样品中扩增出内切葡聚糖酶基因egl1的启动子区域。随后使用引物sk1236/sk1297,在融合pcr反应中使这两个扩增片段融合在一起。将所得融合pcr片段克隆到pcr-bluntii-topo载体(invitrogen)中,从而产生质粒topoblunt/pegl1-fv43d(图18),该质粒继而用于转化大肠杆菌one
使用引物sk1236/sk1297(表5)通过pcr对来自topoblunt/pegl1-fv43d的表达盒进行扩增,从而产生用于里氏木霉转化的dna产物。将该表达盒与含有als基因(乙酰乳酸合酶)的既有选择标记盒共转化。
11.2用fv43d表达盒转化bxl1缺陷型里氏木霉
利用标准转化方法,例如电穿孔(参见,例如,pct专利申请公布wo08/153712),将bxl1缺失里氏木霉宿主菌株用fv43d表达盒(包含eg1启动子、fv43d开放阅读框和天然fv43d终止子)和含有天然als基因的既有选择标记盒进行转化。在含有氯嘧磺隆的基本培养基琼脂平板上选择转化体。这些转化体是bxl1-fv43d+里氏木霉。
11.3用fv43d表达盒转化bxl1表达里氏木霉
利用标准转化方法,例如电穿孔(参见,例如,pct专利申请公布wo08/153712),将具有野生型bxl1基因的里氏木霉宿主菌株(参见,pct专利申请公布wo2005/001036a2)用fv43d表达盒(包含eg1启动子、fv43d开放阅读框和天然fv43d终止子)和含有天然als基因的既有选择标记盒进行转化。在含有氯嘧磺隆的基本培养基琼脂平板上选择转化体。这些转化体是fv43d+里氏木霉。
12.实例6:产纤维素酶的经工程化改造的里氏木霉菌株在ssf中的应用
使用转化体bxl1-fv43d+里氏木霉和fv43d+里氏木霉来生产含有纤维素酶的培养液。然后按本文所述的连续、分批或分批补料配置将这些培养液用于ssf反应中,从而减少axp的产生并降低由逆水解产物的转木糖基化所造成的糖产量损失。
在特定实例中,培养bxl1-里氏木霉菌株#229(“229bxldel”)转化体从而生产含有纤维素酶的培养液,然后在培养液中补充纯化的里氏木霉bxl1(浓度为0.5mg/g或1mg/g木聚糖)或1mg/g木聚糖的纯化fv43d。第1天和第3天的exp和乙醇浓度分别绘制在图43a(第1天)和43b(第3天)中。该反应在重组发酵单胞菌属ssf条件下使用25重量%固体负载量的稀氨水预处理的玉米芯底物进行。
1.一种用于同步糖化发酵(ssf)的方法,所述方法包括在适于发酵产物产生的条件下培养完全发酵培养基一段时间,所述完全发酵培养基包含至少一种发酵微生物、至少一种含木聚糖的生物质、至少一种纤维素酶、至少一种半纤维素酶和至少一种翻转型β-木糖苷酶。
2.实施方案1的方法,其中所述完全发酵培养基包含有效量的所述翻转型β-木糖苷酶,使得所述完全发酵培养基产生的短链烷基-β-吡喃木糖苷(“axp”)少于缺少所述翻转型β-木糖苷酶的对照发酵培养基产生的。
3.实施方案1或2的方法,其中所述完全发酵培养基包含有效量的所述翻转型β-木糖苷酶,使得所述完全发酵培养基产生的axp比缺少所述翻转型β-木糖苷酶的对照发酵培养基产生的axp少至少40%。
4.实施方案3的方法,其中所述完全发酵培养基包含有效量的所述翻转型β-木糖苷酶,使得所述完全发酵培养基产生的axp比缺少所述翻转型β-木糖苷酶的对照发酵培养基产生的axp少至少50%。
5.实施方案4的方法,其中所述完全发酵培养基包含有效量的所述翻转型β-木糖苷酶,使得所述完全发酵培养基产生的axp比缺少所述翻转型β-木糖苷酶的对照发酵培养基产生的axp少至少60%。
6.实施方案5的方法,其中所述完全发酵培养基包含有效量的所述翻转型β-木糖苷酶,使得所述完全发酵培养基产生的axp比缺少所述翻转型β-木糖苷酶的对照发酵培养基产生的axp少至少70%。
7.实施方案1至6中任一项的方法,其中所述axp是甲基-β-吡喃木糖苷(mxp)、乙基-β-吡喃木糖苷(exp)、丙基-β-吡喃木糖苷(pxp),或丁基-β-吡喃木糖苷(bxp)。
8.实施方案1至7中任一项的方法,其中所述完全发酵培养基包含有效量的所述翻转型β-木糖苷酶,从而使所述发酵产物产量与通过培养缺少所述翻转型β-木糖苷酶的对照发酵培养基获得的所述发酵产物产量相比有所增大。
9.实施方案8的方法,其中所述发酵产物产量增大至少1%。
10.实施方案9的方法,其中所述发酵产物产量增大至少2%。
11.实施方案10的方法,其中所述发酵产物产量增大至少3%。
12.实施方案11的方法,其中所述发酵产物产量增大至少5%。
13.实施方案12的方法,其中所述发酵产物产量增大至少7.5%。
14.实施方案13的方法,其中所述发酵产物产量增大至少10%。
15.实施方案1至14中任一项的方法,其中所述发酵产物是醇。
16.实施方案15的方法,其中所述醇是甲醇、乙醇、丙醇、丙烷-1,3-二醇、或丁醇。
17.实施方案1至16中任一项的方法,其中所述翻转型β-木糖苷酶是gh43家族酶。
18.实施方案17的方法,其中所述翻转型β-木糖苷酶是fv43d,pf43a,fv43e,fv43b,af43a,fo43a,gz43a,或xynb3多肽。
19.实施方案18的方法,其中所述fv43d多肽与seqidno:2或seqidno:2的第21至350位残基对应的氨基酸序列具有至少90%的序列同一性。
20.实施方案18的方法,其中所述pf43a多肽与seqidno:8或seqidno:8的第21至445位残基对应的氨基酸序列具有至少90%的序列同一性。
21.实施方案18的方法,其中所述fv43e多肽与seqidno:10或seqidno:10的第19至530位残基对应的氨基酸序列具有至少90%的序列同一性。
22.实施方案18的方法,其中所述fv43b多肽与seqidno:12或seqidno:12的第17至574位残基对应的氨基酸序列具有至少90%的序列同一性。
23.实施方案18的方法,其中所述af43a多肽与seqidno:14或seqidno:14的第15至558位残基对应的氨基酸序列具有至少90%的序列同一性。
24.实施方案18的方法,其中所述fo43a多肽与seqidno:24或seqidno:24的第21至348位残基对应的氨基酸序列具有至少90%的序列同一性。
25.实施方案18的方法,其中所述gz43a多肽与seqidno:22或seqidno:22的第19至340位残基对应的氨基酸序列具有至少90%的序列同一性。
26.实施方案18的方法,其中所述xynb3多肽与seqidno:25对应的氨基酸序列具有至少90%的序列同一性。
27.实施方案17至26中任一项的方法,其中所述翻转型β-木糖苷酶在所述完全发酵培养基中的存在浓度为0.3mg至10mg/g所述含木聚糖生物质中的木聚糖。
28.实施方案27的方法,其中所述翻转型β-木糖苷酶的存在浓度为0.4mg至10mg/g所述含木聚糖生物质中的木聚糖。
29.实施方案27的方法,其中所述翻转型β-木糖苷酶的存在浓度为0.3mg至3mg/g所述含木聚糖生物质中的木聚糖。
30.实施方案1至29中任一项的方法,所述方法作为连续、分批、或分批补料ssf过程进行。
31.实施方案1至30中任一项的方法,所述方法还包括形成所述完全发酵培养基的步骤。
32.实施方案31的方法,其中形成所述完全发酵培养基的所述步骤包括混合(a)所述发酵微生物、(b)所述含木聚糖的生物质、(c)所述纤维素酶、(d)所述半纤维素酶、(e)所述翻转型β-木糖苷酶,和(f)缺少(a)至(e)中的一种或多种或全部的培养基。
33.实施方案32的方法,其中所述纤维素酶以全纤维素酶制品形式存在。
34.实施方案33的方法,其中所述全纤维素酶制品包含半纤维素酶。
35.实施方案33或34的方法,其中所述全纤维素酶制品是通过培养丝状真菌获得的培养液。
36.实施方案35所述的方法,其中所述丝状真菌是里氏木霉(t.reesei)。
37.实施方案36的方法,其中所述里氏木霉(t.reesei)经工程化改造,使得所述天然β-木糖苷酶基因缺失或失活。
38.实施方案1至37中任一项的方法,其中所述发酵微生物是真菌。
39.实施方案38的方法,其中所述真菌是酿酒酵母(saccharomycescerevisiae)。
40.实施方案1至37中任一项的方法,其中所述发酵微生物是细菌。
41.实施方案40的方法,其中所述细菌是运动发酵单胞菌(zymomonasmobilis)。
42.实施方案1至41中任一项的方法,其中所述含木聚糖的生物质是玉米秸秆、蔗渣、高粱、芦竹、象草、芒草、日本柳杉、小麦秸秆、柳枝稷、阔叶纸浆、或针叶纸浆。
43.实施方案42的方法,其中所述含木聚糖的生物质是浆液形式的。
44.实施方案42或43的方法,其中所述含木聚糖的生物质已经过预处理。
45.实施方案1至44中任一项的方法,所述方法还包括回收所述发酵产物的所述步骤。
46.实施方案1至45中任一项的方法,其中基于摩尔计、基于分子量计、或者基于摩尔和分子量计,所述完全发酵培养基包含的翻转型β-木糖苷酶的量大于保持型β-木糖苷酶的量。
47.实施方案46的方法,其中基于摩尔计、基于分子量计、或者基于摩尔和分子量计,所述完全发酵培养基中的翻转型β-木糖苷酶和保持型β-木糖苷酶的所述比率为至少2:1。
48.一种里氏木霉(t.reesei)细胞,所述细胞经工程化改造,使得所述天然β-木糖苷酶基因缺失或者使其没有可检测的β-木糖苷酶活性。
49.实施方案48的里氏木霉(t.reesei)细胞,所述细胞经工程化改造而重组表达gh43家族酶。
50.实施方案48的里氏木霉(t.reesei)细胞,所述细胞经工程化改造而重组表达fv43d,pf43a,fv43e,fv43b,af43a,fo43a,gz43a,或xynb3多肽。
51.实施方案49至50的里氏木霉(t.reesei)细胞,其中所述fv43d多肽与seqidno:2或seqidno:2的第21至350位残基对应的氨基酸序列具有至少90%的序列同一性。
52.实施方案51的里氏木霉(t.reesei)细胞,其中所述pf43a多肽与seqidno:8或seqidno:8的第21至445位残基对应的氨基酸序列具有至少90%的序列同一性。
53.实施方案51的里氏木霉(t.reesei)细胞,其中所述fv43e多肽与seqidno:10或seqidno:10的第19至530位残基对应的氨基酸序列具有至少90%的序列同一性。
54.实施方案51的里氏木霉(t.reesei)细胞,其中所述fv43b多肽与seqidno:12或seqidno:12的第17至574位残基对应的氨基酸序列具有至少90%的序列同一性。
55.实施方案51的里氏木霉(t.reesei)细胞,其中所述af43a多肽与seqidno:14或seqidno:14的第15至558位残基对应的氨基酸序列具有至少90%的序列同一性。
56.实施方案51的里氏木霉(t.reesei)细胞,其中所述fo43a多肽与seqidno:24或seqidno:24的第21至348位残基对应的氨基酸序列具有至少90%的序列同一性。
57.实施方案51的里氏木霉(t.reesei)细胞,其中所述gz43a多肽与seqidno:22或seqidno:22的第19至340位残基对应的氨基酸序列具有至少90%的序列同一性。
58.实施方案51的里氏木霉(t.reesei)细胞,其中所述xynb3多肽与seqidno:25对应的氨基酸序列具有至少90%的序列同一性。
59.一种用于生产纤维素酶制品的方法,所述方法包括在导致所述纤维素酶制品产生的条件下培养实施方案49至58中任一项所述的里氏木霉(t.reesei)细胞。
60.实施方案59的方法,所述方法还包括回收所述纤维素酶制品。
61.一种通过执行实施方案59或60所述的方法获得的纤维素酶制品。
62.一种通过培养实施方案49至58中任一项所述的里氏木霉(t.reesei)细胞制得的培养液。
63.一种生物质糖化的方法,所述方法包括使所述生物质与实施方案61所述的纤维素酶制品接触。
64.一种生物质糖化的方法,所述方法包括使所述生物质与实施方案62所述的培养液接触。
65.一种组合物,所述组合物包含至少一种发酵微生物、至少一种含木聚糖的生物质、至少一种纤维素酶、至少一种半纤维素酶和至少一种翻转型β-木糖苷酶。
66.实施方案65的组合物,其中所述翻转型β-木糖苷酶是gh43家族酶。
67.实施方案65的组合物,其中所述翻转型β-木糖苷酶是fv43d,pf43a,fv43e,fv43b,af43a,fo43a,gz43a,或xynb3多肽。
68.实施方案66或67的组合物,其中如果存在的话,所述fv43d多肽与seqidno:2或seqidno:2的第21至350位残基对应的氨基酸序列具有至少90%的序列同一性。
69.实施方案66或67的组合物,其中如果存在的话,所述pf43a多肽与seqidno:8或seqidno:8的第21至445位残基对应的氨基酸序列具有至少90%的序列同一性。
70.实施方案66或67的组合物,其中如果存在的话,所述fv43e多肽与seqidno:10或seqidno:10的第19至530位残基对应的氨基酸序列具有至少90%的序列同一性。
71.实施方案66或67的组合物,其中如果存在的话,所述fv43b多肽与seqidno:12或seqidno:12的第17至574位残基对应的氨基酸序列具有至少90%的序列同一性。
72.实施方案66或67的组合物,其中如果存在的话,所述af43a多肽与seqidno:14或seqidno:14的第15至558位残基对应的氨基酸序列具有至少90%的序列同一性。
73.实施方案66或67的组合物,其中如果存在的话,所述fo43a多肽与seqidno:24或seqidno:24的第21至348位残基对应的氨基酸序列具有至少90%的序列同一性。
74.实施方案66或67的组合物,其中如果存在的话,所述gz43a多肽与seqidno:22或seqidno:22的第19至340位残基对应的氨基酸序列具有至少90%的序列同一性。
75.实施方案66或67的组合物,其中如果存在的话,所述xynb3多肽与seqidno:25对应的氨基酸序列具有至少90%的序列同一性。
76.实施方案65至75中任一项的组合物,其中所述含木聚糖的生物质是玉米秸秆、蔗渣、高粱、芦竹、象草、芒草、日本柳杉、小麦秸秆、柳枝稷、阔叶纸浆、或针叶纸浆。
77.实施方案65至76中任一项的组合物,其中所述发酵微生物是真菌或细菌。
78.实施方案77的组合物,其中所述真菌是酿酒酵母(saccharomycescerevisiae)。
79.实施方案77的组合物,其中所述细菌是运动发酵单胞菌(zymomonasmobilis)。
80.实施方案65至79中任一项的组合物,其中所述纤维素酶以全纤维素酶制品形式存在。
81.实施方案80的组合物,其中所述纤维素酶制品包含半纤维素酶。
82.实施方案65至81中任一项的组合物,其中所述组合物基本上不含保持型β-木糖苷酶或没有可检测的保持型β-木糖苷酶活性。
83.一种生产发酵产物的方法,所述方法包括培养实施方案65至82中任一项所述的组合物一段时间。
84.实施方案83的方法,其中所述发酵产物是醇。
85.实施方案84的方法,其中所述醇是甲醇、乙醇、丙醇、丙烷-1,3-二醇、或丁醇。
86.一种用于同步糖化发酵(ssf)的方法,所述方法包括在适于烷基-β-吡喃木糖苷(“axp”)产生的条件下培养完全发酵培养基一段时间,所述完全发酵培养基包含至少一种发酵微生物、至少一种含木聚糖的生物质、至少一种纤维素酶、至少一种半纤维素酶和至少一种保持型β-木糖苷酶。
87.实施方案86的方法,其中所述完全发酵培养基包含有效量的保持型β-木糖苷酶,使得所述完全发酵培养基产生的axp多于缺少所述保持型β-木糖苷酶或具有较少量的所述保持型β-木糖苷酶的对照发酵培养基产生的axp。
88.实施方案86或87的方法,其中所述axp是甲基-β-吡喃木糖苷(mxp)、乙基-β-吡喃木糖苷(exp)、丙基-β-吡喃木糖苷(pxp)、或丁基-β-吡喃木糖苷(bxp)。
89.实施方案86至88中任一项的方法,其中所述保持型β-木糖苷酶是gh3、gh30、gh31、gh39、gh52、gh54或gh116家族酶。
90.实施方案86至89中任一项的方法,其中所述保持型β-木糖苷酶是xlnd,fv30a,fv30b,fv39a,fv39b,或xynb多肽。
91.实施方案90的方法,其中所述xlnd多肽与seqidno:40或seqidno:40的第18至804位残基对应的氨基酸序列具有至少90%的序列同一性。
92.实施方案90的方法,其中所述fv30a多肽与seqidno:42或seqidno:42的第20至537位残基对应的氨基酸序列具有至少90%的序列同一性。
93.实施方案90的方法,其中所述fv30b多肽与seqidno:44或seqidno:44的第25至485位残基对应的氨基酸序列具有至少90%的序列同一性。
94.实施方案90的方法,其中所述fv39a多肽与seqidno:46或seqidno:46的第20至439位残基对应的氨基酸序列具有至少90%的序列同一性。
95.实施方案90的方法,其中所述fv39b多肽与seqidno:48或seqidno:48的第19至456位残基对应的氨基酸序列具有至少90%的序列同一性。
96.实施方案90的方法,其中所述xynb多肽与seqidno:50对应的氨基酸序列具有至少90%的序列同一性。
97.实施方案90的方法,其中所述xyla多肽与seqidno:52或seqidno:52的第19至705位残基对应的氨基酸序列具有至少90%的序列同一性。
98.实施方案90的方法,其中所述xyl1多肽与seqidno:54对应的氨基酸序列具有至少90%的序列同一性。
99.实施方案86至98中任一项的方法,所述方法作为连续、分批、或分批补料ssf过程进行。
100.实施方案86至99中任一项的方法,所述方法还包括形成所述完全发酵培养基的步骤。
101.实施方案100的方法,其中形成所述完全发酵培养基的所述步骤包括混合(a)所述发酵微生物、(b)所述含木聚糖的生物质、(c)所述纤维素酶、(d)所述半纤维素酶、(e)所述保持型β-木糖苷酶,和(f)缺少(a)至(e)中的一种或多种或全部的培养基。
102.实施方案101的方法,其中所述纤维素酶以全纤维素酶制品形式存在。
103.实施方案102的方法,其中所述全纤维素酶制品包含半纤维素酶。
104.实施方案102或103的方法,其中所述全纤维素酶制品是通过培养丝状真菌获得的培养液。
105.实施方案104所述的方法,其中所述丝状真菌是里氏木霉(t.reesei)。
106.实施方案105的方法,其中所述里氏木霉(t.reesei)经工程化改造而过表达天然的保持型β-木糖苷酶基因或表达外源的保持型β-木糖苷酶基因。
107.实施方案86至106中任一项的方法,其中所述发酵微生物是真菌或细菌。
108.实施方案86至107中任一项的方法,其中所述含木聚糖的生物质是玉米秸秆、蔗渣、高粱、芦竹、象草、芒草、日本柳杉、小麦秸秆、柳枝稷、阔叶纸浆、或针叶纸浆。
109.实施方案108的方法,其中所述含木聚糖的生物质已经过预处理。
110.实施方案86至108中任一项的方法,所述方法还包括回收所述axp化合物的所述步骤。
111.实施方案86至110中任一项的方法,其中基于摩尔计、基于分子量计、或者基于摩尔和分子量计,所述完全发酵培养基包含的保持型β-木糖苷酶的量大于翻转型β-木糖苷酶的量。
112.一种里氏木霉(t.reesei)细胞,所述细胞经工程化改造,使得其天然β-木糖苷酶基因过表达或者使其表达外源的β-木糖苷酶基因。
113.实施方案112的里氏木霉(t.reesei)细胞,所述细胞经工程化改造而重组表达gh3、gh30、gh31、gh39、gh52、gh54或gh116家族酶。
114.实施方案112的里氏木霉(t.reesei)细胞,所述细胞经工程化改造而重组表达xlnd,fv30a,fv30b,fv39a,fv39b,xynb,xyla或xyl1多肽。
115.一种用于生产纤维素酶制品的方法,所述方法包括在导致所述纤维素酶制品产生的条件下培养实施方案112至114中任一项所述的里氏木霉(t.reesei)细胞。
116.实施方案115的方法,该方法还包括回收所述纤维素酶制品。
117.一种通过执行实施方案115或116所述的方法获得的纤维素酶制品。
118.一种通过培养实施方案112至114中任一项所述的里氏木霉(t.reesei)细胞制得的培养液。
119.一种生物质糖化的方法,所述方法包括使所述生物质与实施方案117所述的纤维素酶制品接触。
120.一种生物质糖化的方法,所述方法包括使所述生物质与实施方案118所述的培养液接触。
121.一种组合物,所述组合物包含至少一种发酵微生物、至少一种含木聚糖的生物质、至少一种纤维素酶、至少一种半纤维素酶和至少一种保持型β-木糖苷酶。
122.实施方案121的组合物,其中所述保持型β-木糖苷酶是gh3、gh30、gh31、gh39、gh52、gh54或gh116家族酶。
123.实施方案121的组合物,其中所述翻转型β-木糖苷酶是xlnd,fv30a,fv30b,fv39a,fv39b,xynb,xyla或xyl1多肽。
124.实施方案121至123中任一项的组合物,其中所述含木聚糖的生物质是玉米秸秆、蔗渣、高粱、芦竹、象草、芒草、日本柳杉、小麦秸秆、柳枝稷、阔叶纸浆、或针叶纸浆。
125.实施方案121至124中任一项的组合物,其中所述发酵微生物是真菌或细菌。
126.实施方案121至125中任一项的组合物,其中所述纤维素酶以全纤维素酶制品形式存在。
127.实施方案126的组合物,其中所述纤维素酶制品包含半纤维素酶。
128.实施方案121至127中任一项的组合物,其中所述组合物基本上不含翻转型β-木糖苷酶或没有可检测的翻转型β-木糖苷酶活性。
129.一种生产axp化合物的方法,所述方法包括培养实施方案121至128中任一项所述的组合物一段时间。
- 还没有人留言评论。精彩留言会获得点赞!