一种HER2融合单链抗体、制备方法与应用与流程
本发明属于生物
技术领域:
和医学领域,特别涉及一种her2融合单链抗体、制备方法与应用。
背景技术:
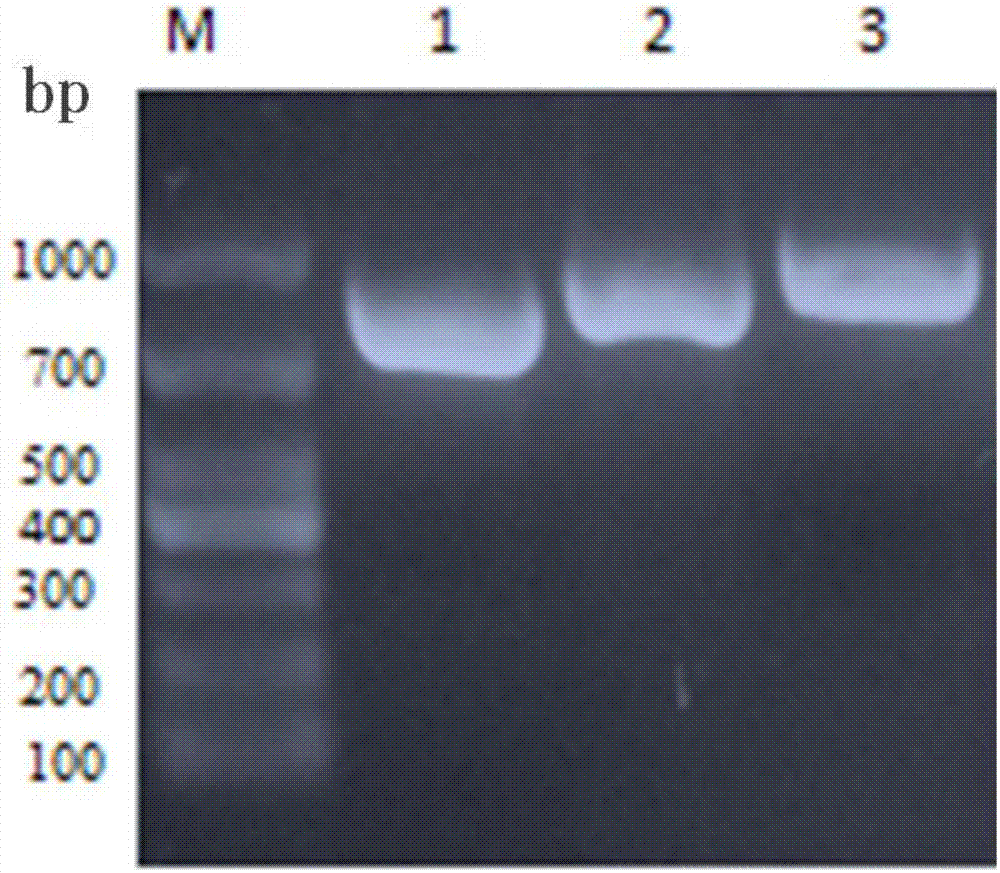
:2014年世界卫生组织国际癌症研究中心最新数据统计显示,全球每年约140万女性发生乳腺癌,病死率高达33%。我国乳腺癌的发病率居女性恶性肿瘤首位,病死率仅次于肺癌,严重影响女性的生活质量和生存寿命。目前,乳腺癌治疗方法主要有:新辅助治疗、手术治疗、辅助放化疗、内分泌治疗和靶向治疗。近年来,靶向治疗能够使患者更大程度的获益,与化疗相辅相成,且釆用化学方法连接抗体和药物,合成抗体偶联物已成为研究热点,既能特异性地识别肿瘤细胞,又能高效地杀死靶细胞,从而达到高效低毒的治疗目的。基因过度表达可导致细胞过度增殖和表型恶性转化,在肿瘤中会出现不同的基因表型,而这些基因表型对肿瘤的治疗提供有效的靶点。her2是一种酪氨酸激酶受体,在25%~30%乳腺癌中过表达,且与肿瘤的侵袭性及患者的预后相关。1998年美国fda批准靶向her2的人源化单克隆抗体曲妥珠单抗(trastuzumab,herceptin)上市,trastuzumab在临床上的成功应用促进了以her2单克隆抗体为导向的单抗靶向药物研究。已有超过30种的单克隆抗体药物被批准用于临床治疗。以低排斥反应等优点的人源化及全人抗体近年来发展迅速,在fda批准的抗体药物中已占80%以上,已成为抗体药物发展的主要趋势。但由于大分子蛋白的人源化及全人抗体具有很强的免疫原性,影响了治疗效果。单链片段抗体技术则克服了这些缺点,单链抗体是由抗体重链可变区和轻链可变区通过15~20个氨基酸的肽连接而成的重组蛋白,与完整抗体相比,其保持了抗原亲和活性。由于它的分子量小,组织穿透能力强,较易穿透细胞外间隙到达深部的肿瘤细胞;由于它缺乏fc段,丧失完整抗体的效应功能如抗体依赖细胞毒作用(adcc)或补体依赖细胞毒作用(cdcc)使得免疫原性较弱,日益成为诊断和治疗的良好导向载体;因此,如何充分利用单链片段抗体的靶向功能是目前研究的重点。临床试验结果表明,由美国genentech公司开发靶向her2的人源化单克隆抗体曲妥珠单抗(trastuzumab,herceptin),单独应用时有效率为11.6%~16%。由于抗肿瘤抗体能特异性的识别肿瘤细胞,但较低的杀伤能力而使其抗肿瘤效果不佳;因此,如何提高抗体的靶向性及细胞毒性作用成为目前亟待解决的问题。技术实现要素:本发明的首要目的在于克服现有技术的缺点与不足,提供一种her2单链抗体。本发明的另一目的在于提供一种融合单链抗体。本发明的又一目的在于提供所述的her2单链抗体或所述的融合单链抗体的制备方法。本发明的再一目的在于提供所述的her2单链抗体或所述的融合单链抗体的应用。本发明的目的通过下述技术方案实现:一种her2单链抗体(scfv),包含重链可变区和轻链可变区,编码所述的重链可变区的核苷酸序列如seqidno.1所示;编码所述的轻链可变区的核苷酸序列如seqidno.2所示。所述的重链可变区和轻链可变区指单克隆抗体的重链可变区和轻链可变区;所述的单克隆抗体为曲妥珠单抗。由于单链抗体的生物活性是由抗体轻链和重链可变区中的高变区特异性的基因序列决定的,因此,可通过基因工程方法对如上提供的编码重链可变区和编码轻链可变区的核苷酸序列进行重组,得到不同类型的抗体。所述的her2单链抗体,由重链可变区、连接链和轻链可变区组成,编码所述的her2单链抗体的核苷酸序列如seqidno.3所示。所述的连接链的氨基酸序列如seqidno.4所示。编码所述的连接链的核苷酸序列如seqidno.5所示。一种融合单链抗体,由多肽片段(lp)c端通过接头(linker)与所述的her2单链抗体的n端连接而成;其中,所述的多肽片段为苹果酸脱氢酶(malatedehydrogenase,mdh)的片段(lp1)或细胞色素氧化酶(cytochromeoxidase,cox)的片段(lp2)。所述的苹果酸脱氢酶的片段的氨基酸序列如seqidno.6所示。所述的细胞色素氧化酶的片段的氨基酸序列如seqidno.7所示。编码所述的苹果酸脱氢酶的片段的核苷酸序列如seqidno.8所示。编码所述的细胞色素氧化酶的片段的核苷酸序列如seqidno.9所示。所述的接头的氨基酸序列的长度为2~50个氨基酸,优选为4~20个氨基酸。连接肽长度可以短至多肽与单链抗体之间形成的位阻保持最小;优选g4s最为有利于多肽片段与单链抗体片段之间的相连。所述的融合单链抗体通过生物膜层干涉技术(bli)测定的亲和力与所述的her2单链抗体是相当的;同时,该融合单链抗体对her2阳性细胞bt474具有明显的杀伤作用,对her2阴性细胞mcf-7无影响。所述的her2单链抗体或所述的融合单链抗体的制备方法,包括如下步骤:将编码目标基因的核苷酸序列克隆入表达载体构建重组表达载体;将所述的重组表达载体转入表达系统中,将得到的阳性转化子进行发酵表达,分离纯化后复性得到所述的her2单链抗体或所述的融合单链抗体。所述的目标基因的核苷酸序列为编码所述的her2单链抗体的核苷酸序列或编码所述的融合单链抗体的核苷酸序列。所述的编码所述的融合单链抗体的核苷酸序列通过overlappcr技术扩增得到。当所述的融合单链抗体中的多肽片段为苹果酸脱氢酶的片段,接头为g4s时,所述的overlappcr技术的引物优选为:lp1-scfv-f15-tatttaccacatgatgctgtccgc-3,斜体字体表示酶切位点ndeⅰ;lp1-scfv-r15-agattgtaataattgtacttggcatgcgctgccaccgccaccattgt-3,下划线表示接头g4s;lp1-scfv-f25-acaatggtggcggtggcagcgcatgccaagtacaattattacaa-3,下划线表示接头g4s;lp1-scfv-r25-acgttagatctcctcctaatactgt-3,斜体字体表示bamhi。当所述的融合单链抗体中的多肽片段为细胞色素氧化酶的片段时,所述的over-lappcr技术的引物优选为:lp2-scfv-f15-tatttaccacatgatggccagccg-3,斜体字体表示酶切位点ndeⅰ;lp2-scfv-r15-agattgtaataattgtacttggcatgcagagccgccaccgcccat-3,下划线表示接头g4s;lp2-scfv-f25-catgggcggtggcggctctgcatgccaagtacaattattacaatct-3,下划线表示接头g4s;lp2-scfv-r25-acgttagatctcctcctaatactgt-3,斜体字体表示bamhi。所述的表达载体优选为质粒pet28a;所述的构建重组表达载体的具体步骤为:用限制性内切酶ndeⅰ、bamhⅰ分别酶切质粒pet28a和目标基因的核苷酸序列后,连接构建得到所述的重组表达载体。所述的表达系统优选为大肠杆菌表达系统;进一步优选为大肠杆菌表达菌株bl21(de3)。所述的发酵表达的具体步骤为:将所述的阳性转化子接种到含卡那霉素的lb培养基中,过夜培养后,按1:100转接入含卡那霉素的lb培养基中,培养至od600为0.6~0.8,加入0.8mmiptg,37℃,诱导4~6h,测od600收菌。所述的分离纯化的具体步骤为:适量缓冲液重悬菌体超声波或高压破壁,离心收集沉淀得到包涵体,包涵体变性后得到包涵体溶液,纯化后获得高纯度重组蛋白。所述的缓冲液优选为0.1mtris-hcl缓冲液。所述的纯化优选通过镍柱亲和层析进行纯化。所述的离心的条件优选为10000g离心30min。所述的包涵体变性的具体步骤为:洗涤液洗涤去除粘附的杂蛋白(去污剂的浓度使其能够溶解干扰的细胞蛋白质和膜成分而不溶解包涵体);变性液对包涵体进行溶解(包涵体在变性条件下溶解),离心,得到的上清液即为包涵体溶液。所述的洗涤液优选为含去污剂的尿素溶液,其中尿素的浓度优选为不大于2m。所述的去污剂优选为tritonx-100,浓度优选为0.5%(v/v)。所述的变性液为8m尿素的溶液;还可以含有20mmtris-hcl、5mmedta,20mm咪唑。所述变性液对包涵体的溶解在还原条件下进行。所述的还原条件优选通过在变性液中加入含巯基的还原试剂实现。所述的复性的具体步骤为:通过复性缓冲液缓慢地连续降低尿素浓度至无变性作用或弱变性作用,使所得到的蛋白能够折叠形成可溶的、有生物活性的构象。所述的复性缓冲液中至少含有一种还原和氧化形式的硫醇成分,所述的硫醇成分优选为gsh/gssg,浓度优选为1mm。所述的复性缓冲液的配方优选为:ph7.4~8.5,20mmtris-hcl、6~0m尿素、5mmedta、1mmgsh/gssg。所述的her2单链抗体或所述的融合单链抗体在制备抗癌药物中的应用。所述的抗癌药物优选为抗乳腺癌、胃癌或食管癌药物。本发明相对于现有技术具有如下的优点及效果:(1)本发明针对现有技术存在的问题,在曲妥珠单抗的基础上构建的只含抗体重链v区与轻链v区的单链抗体(scfv)与多肽重组融合(lp1-scfv、lp2-scfv),在保证scfv靶向性的基础上提高细胞毒性作用,将对控制及治疗her2阳性乳腺癌的单克隆抗体药物及抗体偶联药物提供一个新的突破口,该方法也为其他抗体或蛋白的偶联设计提供了参考,体现了巨大的优势和良好的临床应用前景。(2)本发明采用大肠杆菌表达体系表达了scfv单链抗体及lp1-scfv、lp2-scfv融合单链抗体,sds-page鉴定,并采用ni离子亲和层析分离纯化后得到了高纯度的scfv及lp1-scfv、lp2-scfv融合单链抗体,比采用真核细胞或原核表达时间周期短且成本低。(3)本发明的lp1-scfv、lp2-scfv融合单链抗体与scfv抗体能达到同等的亲和力,但对her2阳性乳腺癌的杀伤效果显著提高,可以用于乳腺癌的治疗。本发明为开发多肽-抗体型融合抗体提供了一个新思路,具有很好的临床应用前景。附图说明图1是实施例1的pcr产物的1%(w/v)琼脂糖凝胶电泳图,其中泳道1:scfv的pcr产物,泳道2为lp1-scfv基因的pcr产物,泳道3为lp2-scfv基因的pcr产物,m为dnamarker(1000bp,700bp,500bp,400bp,300bp,200bp,100bp)。图2是重组质粒pet28a-scfv的质粒图谱图。图3是重组质粒pet28a-lp1-scfv的质粒图谱图。图4是重组质粒pet28a-lp2-scfv的质粒图谱图。图5是实施例3的重组质粒pet28a-scfv小量表达中大肠杆菌超声破壁后的sds-page结果图,其中泳道m:蛋白marker;泳道1:未诱导的空菌株;泳道2:诱导上清;泳道3:诱导沉淀。图6是实施例3的重组质粒pet28a-lp1-scfv,pet28a-lp2-scfv小量表达中大肠杆菌超声破壁后的sds-page结果图,其中泳道m:蛋白marker;泳道1:lp2-scfv诱导沉淀;泳道2:lp2-scfv诱导上清;泳道3:未诱导的空菌株;泳道4:未诱导的空菌株;泳道5:lp1-scfv诱导上清;泳道6:lp1-scfv诱导沉淀。图7是实施例3的重组质粒pet28a-scfv、pet28a-lp1-scfv,pet28a-lp2-scfv大量表达及纯化后的sds-page结果图;其中泳道m:蛋白marker;泳道1:scfv;泳道2:lp1-scfv;泳道3:lp2-scfv。图8是实施例4中通过生物膜层干涉技术(bli)测定scfv,lp1-scfv,lp2-scfv与her2抗原结合活性的结果分析图。图9是蛋白scfv,lp1-scfv,lp2-scfv对her2阳性细胞bt474的毒性检测结果分析图;其中,ns表示差异无统计学意义,**表示p<0.01,***代表p<0.001。图10是蛋白scfv,lp1-scfv,lp2-scfv对her2阴性细胞mcf7的毒性检测结果分析图;其中,ns表示差异无统计学意义,**表示p<0.01,***代表p<0.001。图11是通过流式细胞仪分析蛋白scfv,lp1-scfv,lp2-scfv对her2阳性细胞bt474凋亡作用的annexinv/pi双染结果分析图。图12是通过流式细胞仪分析蛋白scfv,lp1-scfv,lp2-scfv对her2阴性细胞mcf-7凋亡作用的annexinv/pi双染结果分析图。具体实施方式下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。实施例1pet28a-scfv载体的构建(1)主要试剂与设备仪器:tetrad2基因扩增仪购于美国bio-rad;gellogic凝胶成像仪购于美国carestream;试剂:primestarhsdnapolymerase购于日本takara;fastdigestndei,fastdigestbamhi,t4dnaligase均购于美国thermofisherscientific;pcomb3hss噬菌体载体购于北京宝科维食安生物技术有限公司;pet-28a载体,e.colidh5α,e.colibl21均购于中国天根生化科技有限公司。(2)扩增引物序列的设计通过噬菌体展示技术筛选得到pcomb3hss-scfv,其中编码scfv的核苷酸序列如seqidno.3所示。设计引物如表1所示。表1(3)pcr反应体系(50μl)表2(4)pcr扩增反应程序表3(5)pcr反应结束后,1%(w/v)琼脂糖凝胶电泳对pcr产物进行鉴定,如图1结果所示,得到大小为774bp的包含酶切位点的scfv基因片段,对pcr产物进行纯化回收,t4dnaligase(thermofisherscientific)与载体pet-28a(天根生化科技有限公司)连接过夜。(6)将连接产物转化到e.colidh5α(天根生化科技有限公司);测序,结果显示与预期核苷酸序列完全一致。构建得到重组质粒pet28a-scfv(图2)。实施例2pet28a-lp1-scfv,pet28a-lp2-scfv重组质粒的构建(1)overlappcr扩增引物序列的设计表4注:下划线为linker:g4s(2)lp1/2pcr反应体系(50μl)表5(3)scfvpcr反应体系(50μl)表6(4)overlappcr反应体系(50μl)表7(5)pcr扩增反应程序表8(6)pcr反应结束后,对产物进行1%(w/v)琼脂糖凝胶电泳鉴定,结果如图1所示,得到大小分别为882bp,903bp的包含酶切位点和linker序列的基因片段lp1-scfv,lp2-scfv;对pcr产物进行纯化回收,置于4℃保存待用。pcr产物及载体pet-28a,37℃分别双酶切2h;利用t4dnaligase16℃连接过夜。(7)将连接产物转化到e.colidh5α;在含卡那霉素的lb平板上,37℃培养14h,菌落pcr及双酶切筛选阳性克隆并进行dna测序,结果显示与预期核苷酸序列完全一致。说明成功构建pet28a-lp1-scfv(图3),pet28a-lp2-scfv重组质粒(图4)。实施例3重组蛋白scfv,lp1-scfv及lp2-scfv表达与鉴定1.scfv,lp1-scfv及lp2-scfv重组蛋白的小量表达将上述实施例1得到的阳性质粒pet28a-scfv和实施例2中得到的阳性质粒pet28a-lp1-scfv,pet28a-lp2-scfv分别转化至大肠杆菌表达菌株感受态细胞bl21(de3)中,挑取单克隆接种至5ml含有50μg/mlkan的lb液体培养基中,37℃过夜培养后二次接种于5ml含有100μg/mlkan的lb液体培养基中扩大培养,于od600为0.6~0.8时加至终浓度为0.8mm的iptg,37℃诱导4h,离心收集菌体,超声裂解,未诱导全液、诱导上清和诱导沉淀分别加入上样缓冲液(上样缓冲液:250mmtris-hcl(ph6.8),10%(w/v)sds,0.5%(w/v)bpb,50%(v/v)甘油,5%(v/v)β-巯基乙醇,100℃煮沸5min。未诱导全液、诱导上清和诱导沉淀分别进行sds-page电泳检测,结束后,考马斯亮蓝染色液染色。结果如图5和图6所示,重组蛋白scfv、lp1-scfv及lp2-scfv成功诱导表达,大小分别为27kda、31kda、32kda,均表达在诱导沉淀中。2.scfv,lp1-scfv及lp2-scfv重组蛋白的大量表达及亲和纯化挑取上述三种阳性质粒的单克隆接种于5mllb培养液,二次接种于400mllb培养液中(1:100转接),当od600为0.6~0.8时加入0.8mmiptg,37℃诱导4h后离心收集菌体。用20mmtris-hcl(ph8.5)裂解缓冲液重悬,高压破碎后,10000g离心30min,收集沉淀,用0.5%(v/v)的tritonx-100,2m尿素)洗涤,离心收集沉淀,用变性液(含有20mmtris-hcl、8m尿素、5mmedta,20mm咪唑,5%(v/v)β-巯基乙醇)重悬变性,离心后收集上清,进行镍柱亲和层析纯化,收集纯化前后及穿过液样品,sds-page检测纯化效果。纯化后蛋白通过降低尿素的浓度(缓慢地连续降低尿素浓度)进行复性,所用的复性缓冲液为:ph8.5~7.4,20mmtris-hcl、x(6~0)m尿素、5mmedta、1mmgsh/gssg。复性后透析至1xpbs中。结果如图7所示,重组蛋白scfv,lp1-scfv及lp2-scfv纯化成功,蛋白分子量大小与前面结论一致,纯化复性后scfv,lp1-scfv及lp2-scfv蛋白浓度分别为:671μg/ml、462μg/ml、299μg/ml。实施例4重组蛋白scfv,lp1-scfv及lp2-scfv活性鉴定将实施例3纯化的重组蛋白scfv,lp1-scfv及lp2-scfv多次透析至ph7.4的pbs缓冲液中,利用生物膜层干涉技术(bli)测定重组蛋白scfv及融合单链抗体与her2抗原(abcam,英国)的平衡解离常数kd。采用octetred96生物分子相互作用分析仪(pall-fortebio,menlopark,ca,usa)测定,反应体积200μl,反应温度25℃。样品制备:以pbst(10mmpbs,0.1%(w/v)bsa,0.05%(v/v)tween20(ph7.4))为稀释液,将her2抗原稀释至10μg/ml,将待测样品稀释至300nm,200nm,100nm。根据octetred96生物分子相互作用分析仪操作说明书进行检测,利用anti-higgfccapturesurface(ahc)(pallfortebio,美国)传感器测定,并利用fortebiodataacquistion和dataanalysis(fortebio,version9.0)软件进行数据收集和分析。结果如图8、表9所示,抗体scfv和融合单链抗体lp1-scfv、lp2-scfv具有生物活性,能与her2抗原特异性结合,且平衡解离常数kd值具有相等的数量级10-8,即lp1-scfv,lp2-scfv与scfv亲和力等同。表9实施例5重组蛋白scfv,lp1-scfv及lp2-scfv细胞毒性检测(1)主要试剂人乳腺导管癌细胞bt474(中科院上海细胞库);人乳腺癌细胞mcf7(中科院上海细胞库);mtt溶液,5mg/ml噻唑蓝(sigma,美国),用10mmpbs配制,-20℃避光保存;二甲基亚砜(dmso,sigma,美国)。dmem培养基(gibco,thermofisherscientific,美国),rpmi1640培养基(gibco,thermofisherscientific,美国);胰酶(gibco,thermofisherscientific,美国);fbs(gibco,thermofisherscientific,美国);青霉素-链霉素(pen-strep,gibco,thermofisherscientific,美国);10mmpbs(gibco,thermofisherscientific,美国)。(2)细胞毒性检测检测分别接种1×104/孔的bt474和mcf-7细胞到96孔板中,每孔100μl培养基,37℃,5%co2培养48h;分别用rpmi1640和dmem完全培养基对重组蛋白scfv、lp1-scfv及lp2-scfv作梯度稀释(0.01、0.1、1、10、100、1000nm),处理细胞72h后。每孔加入20μlmtt溶液,继续培养4h。吸去孔内培养液,每孔加入150μl二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪od490nm处测量各孔的吸光值。计算细胞存活率:细胞存活率=(实验组a490-空白对照a490)/(对照组a490-空白对照组a490)。重复实验三次,取平均值。结果如图9、图10所示,重组蛋白scfv,lp1-scfv及lp2-scfv只对her2阳性细胞bt474表现高毒性,对her2阴性细胞mcf7毒性很低,说明了只特异性杀伤her2阳性细胞。抗体scfv,融合单链抗体lp1-scfv、lp2-scfv均抑制her2阳性细胞bt474生长,并存在浓度依赖性关系,且融合单链抗体明显提高了单链抗体scfv对her2阳性细胞bt474的杀伤能力。实施例6抗体scfv,融合单链抗体lp1-scfv及lp2-scfv的生物活性annexinv-fitc/pi双染法检测,采用流式细胞仪分析抗体scfv,融合单链抗体lp1-scfv及lp2-scfv对her2阳性细胞bt474及her2阴性细胞mcf7的凋亡作用。分别接种5×105/孔的bt474和mcf-7细胞到6孔板中,每孔2ml,37℃,5%co2培养48h;分别用rpmi1640和dmem完全培养基对重组蛋白scfv,lp1-scfv及lp2-scfv稀释至10μg/ml,处理细胞72h。细胞离心,去培养基,用pbs洗涤,取2×105个细胞,根据annexinv-fitcapoptosisdetectionkit(invitrogen,美国)试剂盒染色实验步骤操作。用流式细胞仪检测凋亡细胞的百分比。结果如图11、图12及表10、表11所示,如图11的annexinv/pi双染结果、表10的结果所示,10μg/mlscfv,lp1-scfv及lp2-scfv处理bt474细胞72h,scfv早凋/晚凋分别为5.21%和4.92%,lp1-scfv早凋/晚凋分别为13.8%和13.7%,lp2-scfv早凋/晚凋分别为13.0%和10.8%(表10和图11);显然lp增加了单链抗体对对her2阳性细胞bt474的凋亡效率。10μg/mlscfv,lp1-scfv及lp2-scfv处理mcf-7细胞72h,scfv早凋/晚凋分别为0.79%和3.67%,lp1-scfv早凋/晚凋分别为1.36%和5.21%,lp2-scfv早凋/晚凋分别为1.26%和7.52%(表11和图12),融合多肽的单链抗体与单链抗体相比,对mcf-7细胞凋亡没有明显差异。表10bt474早凋(%)晚凋(%)存活率(%)对照(rpmi1640完全培养基)1.574.3290.2scfv5.214.9284.4lp1-scfv13.813.766.4lp2-scfv13.010.871.0表11mcf-7早凋(%)晚凋(%)存活率(%)对照(dmem完全培养基)0.443.5694.4scfv0.793.6794.7lp1-scfv1.365.2192.2lp2-scfv1.267.5287.6上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。sequencelisting<110>华南理工大学<120>一种her2融合单链抗体、制备方法与应用<130>1<160>19<170>patentinversion3.5<210>1<211>387<212>dna<213>artificialsequence<220><223>编码重链可变区的核苷酸序列<400>1caagtacaattattacaatctggtgctgaattaaaaaaacctggtgaatctcttaaaatt60tcttgtaaaggatctggatattcttttacatcttattggattgcttgggtaagacaaatg120cctggaaaaggattagaatacatgggattaatttatcctggtgattctgatacaaaatat180tctccttcttttcaaggacaagtaacaatttctgtagataaatctgtatctacagcttat240ttacaatggtcatctttaaaaccttcagattctgctgtatatttttgtgctcgtcatgat300gtaggatattgttcttcttctaattgtgctaaatggcctgaatattttcaacattgggga360caaggtacattagtaacagtatcttca387<210>2<211>342<212>dna<213>artificialsequence<220><223>编码轻链可变区的核苷酸序列<400>2caatctgtattaacacaacctccatctgtatctgctgcacctggacaaaaagttacaatt60tcttgttctggatcttcttcaaatattggaaataattatgtatcttggtatcaacaatta120cctggaacagctcctaaattattaatttatggacgtacaaatcgtcctgctggtgtacct180gatcgtttttctggatctaaatctggaacatctgcatctttagctatttctggatttcgt240tctgaagatgaagctgattattattgtgctgcttgggatcattctttatctggatgggta300tttggaggtggaacaaaattaacagtattaggaggagatcta342<210>3<211>774<212>dna<213>artificialsequence<220><223>编码her2单链抗体的核苷酸序列<400>3caagtacaattattacaatctggtgctgaattaaaaaaacctggtgaatctcttaaaatt60tcttgtaaaggatctggatattcttttacatcttattggattgcttgggtaagacaaatg120cctggaaaaggattagaatacatgggattaatttatcctggtgattctgatacaaaatat180tctccttcttttcaaggacaagtaacaatttctgtagataaatctgtatctacagcttat240ttacaatggtcatctttaaaaccttcagattctgctgtatatttttgtgctcgtcatgat300gtaggatattgttcttcttctaattgtgctaaatggcctgaatattttcaacattgggga360caaggtacattagtaacagtatcttcaggtggaggtggatctggtggtggaggatcaggt420ggtggtggttctcaatctgtattaacacaacctccatctgtatctgctgcacctggacaa480aaagttacaatttcttgttctggatcttcttcaaatattggaaataattatgtatcttgg540tatcaacaattacctggaacagctcctaaattattaatttatggacgtacaaatcgtcct600gctggtgtacctgatcgtttttctggatctaaatctggaacatctgcatctttagctatt660tctggatttcgttctgaagatgaagctgattattattgtgctgcttgggatcattcttta720tctggatgggtatttggaggtggaacaaaattaacagtattaggaggagatcta774<210>4<211>15<212>prt<213>artificialsequence<220><223>连接链的氨基酸序列<400>4glyglyglyglyserglyglyglyglyserglyglyglyglyser151015<210>5<211>45<212>dna<213>artificialsequence<220><223>编码连接链的核苷酸序列<400>5ggtggaggtggatctggtggtggaggatcaggtggtggtggttct45<210>6<211>29<212>prt<213>artificialsequence<220><223>苹果酸脱氢酶的片段的氨基酸序列<400>6hismettyrhismetmetleuseralaleualaargproalaserala151015alaleuargargserpheserthrseralaglnasnasn2025<210>7<211>36<212>prt<213>artificialsequence<220><223>细胞色素氧化酶的片段的氨基酸序列<400>7hismettyrhismetmetalaserargleuleuargglyalaglythr151015leualaalaglnalaleuargalaargglyproserglyalaalaala202530metargsermet35<210>8<211>87<212>dna<213>artificialsequence<220><223>编码苹果酸脱氢酶的片段的核苷酸序列<400>8catatgtaccacatgatgctgtccgccctggcacgtccggctagcgcggctctgcgtcgc60tctttctctacctccgcgcagaacaat87<210>9<211>108<212>dna<213>artificialsequence<220><223>编码细胞色素氧化酶的片段的核苷酸序列<400>9catatgtaccacatgatggccagccgcctgctgcgcggcgcgggtaccctggctgctcag60gcactgcgtgcgcgtggtccgtctggtgcagctgcgatgcgttccatg108<210>10<211>34<212>dna<213>artificialsequence<220><223>引物scfv-f<400>10gtctcatatgcaagtacaattattacaatctggt34<210>11<211>31<212>dna<213>artificialsequence<220><223>抗体scfv-r<400>11acgtggatcctagatctcctcctaatactgt31<210>12<211>30<212>dna<213>artificialsequence<220><223>抗体lp1-scfv-f1<400>12tattcatatgtaccacatgatgctgtccgc30<210>13<211>47<212>dna<213>artificialsequence<220><223>抗体lp1-scfv-r1<400>13agattgtaataattgtacttggcatgcgctgccaccgccaccattgt47<210>14<211>44<212>dna<213>artificialsequence<220><223>抗体lp1-scfv-f2<400>14acaatggtggcggtggcagcgcatgccaagtacaattattacaa44<210>15<211>31<212>dna<213>artificialsequence<220><223>抗体lp1-scfv-r2<400>15acgtggatcctagatctcctcctaatactgt31<210>16<211>30<212>dna<213>artificialsequence<220><223>抗体lp2-scfv-f1<400>16tattcatatgtaccacatgatggccagccg30<210>17<211>45<212>dna<213>artificialsequence<220><223>抗体lp2-scfv-r1<400>17agattgtaataattgtacttggcatgcagagccgccaccgcccat45<210>18<211>46<212>dna<213>artificialsequence<220><223>抗体lp2-scfv-f2<400>18catgggcggtggcggctctgcatgccaagtacaattattacaatct46<210>19<211>31<212>dna<213>artificialsequence<220><223>抗体lp2-scfv-r2<400>19acgtggatcctagatctcctcctaatactgt31当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1