一株基因工程菌乳酸乳球菌及其应用的制作方法
本发明涉及一种基因工程菌乳酸乳球菌及其应用,属于微生物基因工程领域。
背景技术:
对羟基苯乳酸(oh-pla),又称3-(4-羟基苯基)乳酸,是一种广泛存在自然界中的小分子天然有机酸;可以抑制多种病原菌的生长,被认为是一种新型生物防腐剂。oh-pla稳定性好,熔点为106~110℃,亲水性比较大,能在食品体系中均匀扩散,在食品防腐领域显现巨大潜力。
对羟基苯乳酸广泛存在于各种传统发酵食品中,是传统发酵食品优势菌群---乳酸菌的一种主要代谢产物。乳酸菌是公认的食品级安全微生物,因其可以定居于人类肠道且有益于人体健康,经常作为益生菌应用于食品、保健品和药品等领域。从分类学上看,乳酸菌包含43个属,约373个种和亚种。植物乳杆菌(lactobacillusplantarum)和乳酸乳球菌(lactococcuslactis)是乳酸菌两个常见种。
目前oh-pla的生产方法主要有化学合成法和微生物发酵法。在微生物发酵法中,改变优化发酵底物和发酵条件以提高oh-pla产量是研究的主流,而通过基因工程手段改变oh-pla生物合成路径的研究只有一例。koma等人(2012)通过在大肠杆菌(escherichiacoli)中导入乳酸脱氢酶基因,使发酵上清中的oh-pla含量显著增加。
本发明利用基因工程手段,从植物乳杆菌l8(分离于豆豉---一种中国传统发酵食品)中克隆预苯酸脱氢酶基因(pdh),将该基因连接到表达质粒pnz8048上,再转化至乳酸乳球菌nz9000中,得到重组表达菌株nz9000/pnz8048-pdh,该基因工程菌经乳酸链球菌素(nisin)诱导,使pdh在乳酸乳球菌中高效表达,可提高oh-pla产量,加强对食源性病原菌抑制性。因pdh来源和异源表达菌株均是食品级微生物以及oh-pla自然存在于各种传统发酵食品中,所以本发明获得的oh-pla是一种天然的、安全无毒的新型食品防腐剂,在食品防腐领域具有广阔的应用前景。经文献检索,未见与本发明相同的公开文献报道。
技术实现要素:
本发明的目的在于提供一种基因工程菌乳酸乳球菌lactococcuslactisnz9000/pnz8048-pdh,该基因工程菌已于2017年8月28日保藏在中国典型培养物保藏中心;保藏单位地址:中国.武汉.武汉大学;保藏号为cctccno:m2017453。
本发明利用pcr技术从食源性乳酸菌中扩增预苯酸脱氢酶基因(pdh),该基因与表达载体pnz8048连接后,将得到的重组表达载体pnz8048-pdh转入乳酸乳球菌nz9000细胞内中,通过氯霉素抗性筛选获得pdh异源表达基因工程菌nz9000/pnz8048-pdh。
本发明基因工程菌乳酸乳球菌lactococcuslactisnz9000/pnz8048-pdh的构建,步骤如下:
(1)pdhpcr扩增:以植物乳杆菌l8基因组dna为模板,利用引物(pdh-f:5’-agcccatggtgacaactgtattgatcaaag-3’,下划线为ncoi酶切位点;pdh-r:5’-tccaagcttttaatgatgatgatgatgatgattcctccttacaatctgata-3’下划线为hindⅲ酶切位点,斜体表示6个his)扩增pdh基因;
(2)表达载体构建:将pcr产物和表达质粒pnz8048分别用ncoi和hindⅲ双酶切,回收后,将pdh和pnz8048以5:1~2:1的摩尔比例,用t4连接酶在16℃连接16h;连接产物经热激转化法导入大肠杆菌dh5α感受态细胞后,在含有25µg/ml氯霉素的lb固体培养基37℃培养16h,筛选转化子;利用pcr验证转化子,提取阳性转化子质粒,测序确定序列正确性,获得表达载体pnz8048-pdh;
(3)乳酸乳球菌转化:在10kv/cm,200ω的电转条件下,将上述表达载体导入乳酸乳球菌nz9000感受态细胞中,用含10µg/ml氯霉素的gm17固体培养基筛选阳性转化子,获得基因工程菌nz9000/pnz8048-pdh。
在上述基因工程菌中,所述预苯酸脱氢酶的核苷酸如序列表序列1(seqidno:1)所示。
本发明另一目的是将基因工程菌乳酸乳球菌应用在表达重组预苯酸脱氢酶(pdh)中。
本发明构建的基因工程菌乳酸乳球菌nz9000/pnz8048-pdh在生产oh-pla中的应用,步骤如下:
(1)乳酸链球菌素诱导pdh基因表达:在乳酸乳球菌nz9000/pnz8048-pdh的od600为1.0的gm17培养基中,分别加入终浓度为0、10和20ng/ml的乳酸链球菌素,30℃诱导3h后,离心收集菌体,用20mlpbs重悬菌体;重悬液用超声波破碎后离心,上清用sds-page和westblotting杂交检测pdh蛋白表达;
(2)oh-pla含量测定:在乳酸乳球菌nz9000/pnz8048-pdhod600为1.0的gm17培养基中,同时加入乳酸链球菌素(终浓度为0或20ng/ml)和pdh直接作用底物(预苯酸钡盐,0、0.1、0.25或0.5mg/ml),30℃诱导反应15min后,离心收集上清,0.45µm滤膜过滤,滤液用高效液相色谱法(hplc)分析。结果显示,乳酸链球菌素诱导下的oh-pla产量显著高于不诱导;加预苯酸钡盐时oh-pla的产量高于不加底物。
本发明基因工程菌乳酸乳球菌经乳酸链球菌素(nisin)诱导发酵后应用在抑制金黄色葡萄球菌(staphylococcusaureus)、单核细胞增生李斯特菌(listeriamonocytogenes)、尖孢镰刀菌(fusariumoxysporum)、扩展青霉(penicilliumexpansum)中。
本发明所述基因工程菌nz9000/pnz8048-pdh在抑制食源性病原菌中的应用,步骤如下:
(1)发酵上清液制备:在乳酸乳球菌nz9000/pnz8048-pdh的od600为1.0的gm17培养基中,加入终浓度为0或20ng/ml乳酸链球菌素或同时加入乳酸链球菌素(终浓度为20ng/ml)和预苯酸钡盐(终浓度为0.1mg/ml),30℃诱导反应15min后,离心收集上清,0.45µm滤膜过滤,滤液即为食源性病原菌抑制用上清液;
(2)nz9000/pnz8048-pdh对食源性病原细菌的抑制:在一次性96孔微量稀释盘costar3375(corningincorporated,usa)的每一个孔中,分别加入75μl上述发酵上清液和1.5μl1.0×107cfu/ml金黄色葡萄球菌(staphylococcusaureus)或单核细胞增生李斯特菌(listeriamonocytogenes)以及23.5μlbhi培养基,37℃培养箱中静置培养16h,用酶标仪读取od600值。结果显示,nz9000/pnz8048-pdh发酵上清液对金黄色葡萄球菌的抑制率为36%(培养物中仅加入乳酸链球菌素)和39%(同时加入乳酸链球菌素和预苯酸钡盐),对单核细胞增生李斯特菌的抑制率为31%(培养物中仅加入乳酸链球菌素)和51%(同时加入乳酸链球菌素和预苯酸钡盐)。
(3)nz9000/pnz8048-pdh对食源性病原真菌的抑制:在一次性96孔微量稀释盘costar3375的每一个孔中,分别加入130μl上述发酵上清液和20μl1.5×105个/ml尖孢镰刀菌(fusariumoxysporum)或扩展青霉(penicilliumexpansum)的孢子悬液(用灭菌生理盐水制成),28℃静置培养72h,用酶标仪读取od600值。结果显示,nz9000/pnz8048-pdh发酵上清液对尖孢镰刀菌的抑制率为17%(培养物中仅加入乳酸链球菌素)和66%(同时加入乳酸链球菌素和底物),对扩展青霉的抑制率为22%(培养物中仅加入乳酸链球菌素)和60%(同时加入乳酸链球菌素和底物)。
本发明中所用到的lb培养基(g/l):胰蛋白胨10、酵母粉5、氯化钠10。
本发明中所用到的gm17培养基(g/l):胰蛋白胨5、大豆蛋白胨5、牛肉粉5、酵母粉2.5、抗坏血酸0.5、mgso40.25、甘油磷酸二钠19、葡萄糖5。
本发明中的lb或gm17固体培养基:在lb或gm17培养基基础上添加1.5-2%琼脂。
本发明中所用到的bhi培养基(g/l):胰蛋白胨10、氰化钠5、磷酸氢二钠2.5、牛肉浸出粉9.8、牛脑浸出粉7.7、葡萄糖2。
本发明中所述pbs:2.7mmkcl,10mmna2hpo4,137mmnacl,2mmkh2po4,ph=7.4。
本发明中所用到的超声波破碎条件为:超声5s,停5s,共超声15min。
本发明中所用到的离心条件为:10000rpm离心10min。
在westblotting杂交中,抗体为anti-hrp-conjugated6×histagantibody(爱博泰克生物,中国)。
本发明中所用到的hplc法条件为:色谱柱:agilenteclipsexdb-c18(4.6×250μm,5μm);流动相:a:0.05%(v/v)三氟乙酸水溶液,b:0.05%(v/v)三氟乙酸甲醇溶液;0~13min,72%a+28%b;13~18min,62%a+38%b;18~20min,a和b分别梯度降低和增加至0和100%,20~30min,0a+100%b;30~40min,a和b分别梯度增加和降低至72%和28%。流速:1ml/min;柱温:30℃;进样量:10μl;检测波长:210nm。
本发明中所述发酵上清液对食源性病原菌抑制率的计算公式为:(对照od600-处理od600)/对照od600×100%;所述对照为:在制备发酵上清液时,乳酸链球菌素和预苯酸钡盐均不添加。
本发明的有益效果在于:(1)本发明提供了一种高效表达重组预苯酸脱氢酶的基因工程菌;(2)本发明构建的基因工程菌经乳酸链球菌素诱导,使pdh在乳酸乳球菌nz9000中高效表达后,oh-pla产量是对照菌株的1.74-2.41倍,对食源性病原菌的抑制率为39-66%。(3)本发明的pdh基因来源和异源表达菌株均是食品级微生物,保证了基因工程菌nz9000/pnz8048-pdh在食品防腐领域使用的安全性。
附图说明
图1为预苯酸脱氢酶基因(pdh)所表达蛋白(pdh)的sds-page和westblotting检测结果;其中泳道m1:marker、泳道s1、s2和s3分别表示基因工程菌nz9000/pnz8048-pdh用0、10、20ng/mlnisin诱导,菌体超声破碎后,上清的sds-page图;泳道w1、w2和w3分别是泳道s1、s2和s3对应的westblotting图;
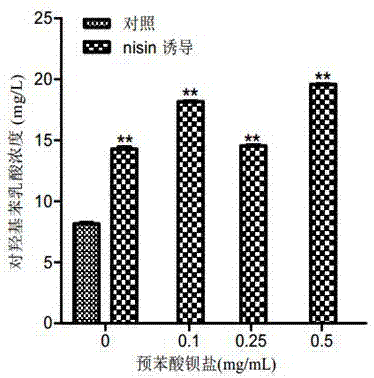
图2为不同浓度预苯酸钡盐对基因工程菌oh-pla产量的影响;**表示相对于对照具有极显著差异(p<0.01);
图3为基因工程菌对食源性病原细菌的抑制率;发酵培养基条件表示,在基因工程菌nz9000/pnz8048-pdh诱导基因表达中,仅仅加入乳酸链球菌素(nisin)或同时加入乳酸链球菌素和预苯酸钡盐;
图4为基因工程菌对食源性病原真菌的抑制率,发酵培养基条件同图3。
具体实施方式
下面通过实施例对本发明的技术方案作进一步详细说明,但本发明的内容并不局限于此,本实施例中方法如无特殊说明均按常规方法操作,所用试剂如无特殊说明采用常规试剂或按常规方法配制。乳酸乳球菌nz9000及质粒pnz8048由中国科学院微生物研究所钟谨研究员惠赠;下述实施例中的结果如无特别说明,均为三次重复的平均值。
实施例1:高效表达重组预苯酸脱氢酶基因工程菌构建与表达
1、重组表达载体构建
1.1pcr扩增pdh基因
使用细菌基因组dna提取试剂盒(百泰克生物技术有限公司,中国)提取植物乳杆菌l8基因组,具体操作按照试剂盒说明书进行;以提取基因组为模板,利用引物pdh-f(5’-agcccatggtgacaactgtattgatcaaag-3’,下划线为ncoi酶切位点)与pdh-r(5’-tccaagcttttaatgatgatgatgatgatgattcctccttacaatctgata-3’,下划线为hindⅲ酶切位点,斜体表示6个his密码子)进行pcr。pcr反应体系及扩增条件如下:
(1)pcr反应体系
(2)pcr扩增条件:
95℃预变性3min;95℃变性15s;53℃退火15s;72℃延伸50s;循环30次;最后72℃延伸5min。反应完成后,取5µl产物,在1%琼脂糖凝胶中进行电泳分析。
1.2连接、转化与筛选
切胶回收预期大小的pcr产物。使用限制性内切酶hindⅲ和ncoi分别对pcr产物和pnz8048载体进行同步双酶切,酶切体系为:ncoi,1.5μl;hindiii,1.5μl;1×k,3μl;bsa,3μl;pcr产物/质粒pnz8048,15-18μl;加去离子水到30μl,37℃酶切4h。回收酶切产物,按照目的基因:载体=5:1~2:1(摩尔比)加样后,加入t4dna连接酶在16℃连接16h。向100μl大肠杆菌dh5α感受态细胞中加入10μl连接产物,采用热激法进行转化。利用氯霉素lb平板(25mg/ml)筛选抗性单菌落。随机选取10~20单菌落进行菌落pcr验证,提取阳性菌落的质粒,经双酶切再次验证后,送测序公司测序,序列正确的重组质粒命名为pnz8048-pdh。制备乳酸乳球菌nz9000感受态细胞,通过电激转化法将pnz8048-pdh转入nz9000中,转化参数:10kv/cm,200ω。阳性转化子采用含10μg/ml氯霉素的gm17平板筛选获得,命名为nz9000/pnz8048-pdh。
2、预苯酸脱氢酶基因的表达
挑取nz9000/pnz8048-pdh单菌落接入含有氯霉素(10μg/ml)的gm17液体培养基中,于30℃静置培养。将过夜培养物按照1/25接种量接种于500ml含有氯霉素(10μg/ml)的gm17培养基,30℃静置培养至培养物的od600值达到1.0,向培养物中加入nisin(终浓度为0、10、20ng/ml),30℃诱导培养3h;10000rpm离心10min,收集菌体,用20ml的pbs(2.7mmkcl,10mmna2hpo4,137mmnacl,2mmkh2po4ph7.4)重悬菌体,超声波破碎(超声5s,停5s,15min)后,离心收集上清;上清液用sds-page和westblotting杂交检测pdh蛋白表达。如图1所示,尽管sds-page不能判断pdh是否表达,但westblotting结果表明,nisin能诱导pdh表达,且nisin浓度为20ng/ml时蛋白表达量最高。
实施例2:高效表达重组预苯酸脱氢酶基因工程菌对oh-pla产量的影响
1、oh-pla标准工作液的配制
准确称取100mgoh-pla标准品,用甲醇溶解定容至100ml,得到浓度为1g/l标准贮备液;吸取标准贮备液,用甲醇溶剂进行稀释,配置浓度分别为0、10、20、30、40、50和60mg/l的oh-pla标准工作液。
2、发酵上清液制备
从冰箱中取出浓度为1.0×106cfu/ml基因工程菌nz9000/pnz8048-pdh种子液,按4‰比例(v/v)接至含有氯霉素(10μg/ml)的gm17液体培养基中,于30℃过夜培养活化。活化菌液按1/25接种量接种于100ml含有氯霉素(10μg/ml)的gm17液体培养基,30℃静置培养,至培养物的od600值达到1.0左右,向培养物中加入终浓度为20ng/ml的nisin和0、0.1、0.25和0.5mg/ml的预苯酸钡盐,对照样品不加nisin和预苯酸钡盐,30℃静置反应15min后,离心收集上清,0.45μm滤膜过滤,滤液用hplc分析oh-pla含量。
3、hplc分析结果
如图2所述,nisin诱导时的oh-pla产量显著高于不诱导,加预苯酸钡盐时的oh-pla产量高于不加底物;当预苯酸钡盐浓度为0.1和0.5mg/ml时,oh-pla产量最高,分别为18.14和19.55mg/l,是对照的2.24和2.41倍。
实施例3:高效表达重组预苯酸脱氢酶基因工程菌对食源性病原细菌的抑制
1、发酵上清液制备
方法同实施例2步骤2,唯一不同点为:预苯酸钡盐浓度为0.1mg/ml。注:尽管0.5mg/ml预苯酸钡盐似乎比0.1mg/ml时产生的oh-pla多,但考虑到成本,抑菌实验采用0.1mg/ml。
2、微量稀释法抑菌细菌实验
将金黄色葡萄球菌和单核细胞增生李斯特在bhi培养基过夜摇床培养后,利用bhi培养基制成浓度为1×107cfu/ml的菌悬液。取1.5μl金黄色葡萄球菌或单核细胞增生李斯特菌菌悬液和75μl上述发酵上清液以及23.5μlbhi培养基,加入一次性96孔微量稀释盘costar3375的小孔中,37℃培养箱中静止培养16h后,用酶标仪读取od600值。按照公式:(对照od600-处理od600)/对照od600×100%计算抑制率。结果表明,当制备发酵上清液时仅仅只有nisin诱导时,对金黄色葡萄球菌和单核细胞增生李斯特菌的抑制率分别为36%和31%;当制备发酵上清液时同时添加nisin和预苯酸钡盐时,对金黄色葡萄球菌和单核细胞增生李斯特菌的抑制率分别为39%和51%(图3)。
实施例4:高效表达重组预苯酸脱氢酶基因工程菌对食源性病原真菌的抑菌
1、发酵上清液制备
同实施例3步骤1。
2、孢子悬液制备
食源性病原真菌在pda斜面上培养10天,将5ml无菌生理盐水滴加到菌落上,并用无菌接种环在斜面上轻轻来回刮。将试管中液体全部导入盛有5ml生理盐水和玻璃珠的三角烧瓶中,充分震荡使细胞分散。利用血球计数板测定孢子浓度,并用灭菌生理盐水调成浓度为1.5×105cfu/ml的孢子悬液,备用。
3、微量稀释法抑菌真菌实验
在一次性96孔微量稀释盘costar3375的小孔中,加入130μl上述发酵上清液和20μl上述扩展青霉或尖孢镰刀菌孢子悬液,28℃培养箱中静止培养72h后,用酶标仪读取od600值。按照公式:(对照od600-处理od600)/对照od600×100%计算抑制率。结果显示,当制备发酵上清液时仅仅只有nisin诱导时,对尖孢镰刀菌和扩展青霉的抑制率分别为17%和22%;当制备发酵上清液时同时添加nisin和预苯酸钡盐时,对尖孢镰刀菌和扩展青霉的抑制率分别为66%和60%(图4)。
序列表
<110>昆明理工大学
<120>一株基因工程菌乳酸乳球菌及其应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>1098
<212>dna
<213>植物乳杆菌l8(lactobacillusplantaruml8)
<400>1
atgacaactgtattgatcaaaggtttggggctaattggcagttcgttggcactaagcatt60
aagcaggcccatcccacggtgcacattattgggattgatcgtgacgatgtcagcctgagt120
tatgcgcgtcaacagggtatgatcgatgctagtggcactgatttggccgcggtcgcgagc180
gacgctgatgtgattattttagcggggccagttgatttgatcgttgctgatttgcaccga240
ctggctatgatgccactcaaggcaggggtgcttgtgacggatgtcgggagtactaaacaa300
gtggtgatgcatgccgcgcttgccatacaacagcacggtgtgactttcatcggcggtcat360
ccaatggcgggttcacataaatcgggtgtgacggctggccgcgccaacttattcgagaac420
gccttttacttgttagtgccgggccggactaatcaagcagccgttcaacggctgcaagca480
ttgttacaagcgactcacgtcaaatggttgacggtcactgcaatacagcatgaccggatt540
gtaggacagttaagtcatttgccacatattgtcgctgcggcattagttgatcagactcag600
gtggctttggcagattcggcactcgggttgcgattagcggctggtgggtttaaaagtatt660
actcggattgccagttcggaccccacgatgtgggcggccatcctgatgactaatgctgaa720
ctaataaccaatcaattgcagggttatattgaccaactgttgcgcatcaagacagccatt780
agggtgcatgatcaagcaacattgtacgaattttttgcgacagctaaggtgacgcgtgat840
cacttgggaccggaacagttgggaggactaccaaacttttatgatttgtttttgaacgtc900
cccgaccgtgttggcgctctcgcggatgtcactcagcggctcgcacaggctcagctgagc960
ttagtcaatattcatattttagagattcgtgaagagattgatggtgtcttgcaactgaca1020
tttagtgatctaaagacgagaacgcaagcatcgtcgttgttagctgatgcgggttatcag1080
attgtaaggaggaattaa1098
<210>2
<211>30
<212>dna
<213>人工序列(artificial)
<400>2
agcccatggtgacaactgtattgatcaaag30
<210>3
<211>51
<212>dna
<213>人工序列(artificial)
<400>3
tccaagcttttaatgatgatgatgatgatgattcctccttacaatctgata51
- 还没有人留言评论。精彩留言会获得点赞!