微电极流控芯片及可调参数单细胞电穿孔装置的制作方法
本发明属于微流控技术和单细胞电穿孔、电转染领域,尤其涉及一种基于微电极流控芯片的可调参数单细胞电穿孔装置。
背景技术:
微流控技术(microfluidics)是使用尺寸在数微米到几百微米的微流道处理或操纵体积为纳升到微升流体的系统所涉及的科学和技术,是一门涉及微纳加工、物理学、微电子学、生物学、化学、新材料等领域的新兴交叉学科。基于微流控技术的芯片以微型化、集成化为特征,通常又被称芯片实验室(labonachip)和微全分析系统(microtas)。微流控技术被认为在生物医学研究中具有巨大的发展潜力和广泛的应用前景。
用微流控芯片进行生物、化学样本的检测分析时,需要施加外界的电学、光学信号激励或者借助输出电学、光学信号来反映待测样本的参数。特别地,对于电学检测分析技术来说,需利用微加工技术在微流控芯片上集成电极,以实现与外界信号的交互,从而在微流控芯片上集成电学检测方法。集成微电极的微流控芯片具备许多优越的性能:在操控检测生物样本的同时,微电极产生的电场可促使细胞产生一些生理反应,如穿孔、裂解等,或将相关电学信息(如电阻抗信号等)反馈给实验系统以实现细胞检测,且具备灵敏度高、响应快等优点以及装置微型化的潜力。
细胞电穿孔技术(electroporation)又称电转染技术,是细胞转染技术中常用的一种途径。由于细胞膜对外界物质具有选择透过性,控制真核细胞基因实验需要向真核细胞输入特定的生物dna、rna片段。在细胞膜两侧施加一定强度的电势差并持续一段时间,细胞膜上就能产生微孔,增强细胞膜的通透性。当细胞膜发生电穿孔时,其通透性和膜电导会瞬时增大,从而使亲水分子、dna、蛋白质、病毒颗粒、药物颗粒等正常情况下不能通过细胞膜的分子得以进入细胞。在短时间内撤除电势差后,细胞膜可自我恢复,重新成为选择性的通透屏障。与传统的化学转染和病毒转染相比,电穿孔更具有广泛的适用性和优越性:适用于质粒和几十kb的基因组片段、无化学病毒污染、无细胞永久性损伤、瞬时转染等优点。因此,电穿孔技术在生物物理学、分子生物学、临床医学等领域有着广阔的应用前景。
传统的细胞电穿孔仪器中电极尺寸大、电极间距仍处于宏观尺寸,在十毫米尺度,而细胞尺寸在微米尺度,因此需施加的电压大,约为几百伏特,并且电场不均匀,每个细胞所处的电场环境不同,造成靠近电极的细胞容易死亡,位于较弱电场处的细胞又不能被穿孔转染,存活率和转染效率都比较低。现有的微流控电穿孔装置电极间距等参数固定,实验的可操作性和电穿孔参数的可调节性受到芯片设计的限制,缺乏通用性。此外,商业化的电转染仪的电信号频率、幅值等关键参数都由厂家设定,客户无法进行优化调节,对于特殊的细胞,如原代细胞、免疫细胞等转染效率不高。
技术实现要素:
发明目的:为了解决现有技术存在的问题,使电穿孔装置通用于各种细胞,本发明提供一种微电极流控芯片及可调参数单细胞电穿孔装置。
技术方案:一种微电极流控芯片,包括透明基板及微流体通道层,微流体通道层位于透明基板上方,所述微流体通道层包括鞘流入口、细胞悬浮液入口、鞘流通道、细胞悬浮液通道、微流控电穿孔通道及细胞出口;鞘流入口与鞘流通道连通,细胞悬浮液入口与细胞悬浮液通道连通,鞘流通道的末端与细胞悬浮液通道末端汇聚并与微流控电穿孔通道的一端连通,微流控电穿孔通道的另一端与细胞出口连通;所述透明基板上集成有微电极,微电极包括叉指电极和平行电极,叉指电极和平行电极分布于微流控电穿孔通道的下方,且叉指电极和平行电极从细胞悬浮液入口到细胞出口依次分布;微电极包括微电极引出端,微电极引出端分布于透明基板两侧。
优选的,所述叉指电极和/或平行电极有多个且均匀间隔分布。可以使电场分布更加均匀,使每个细胞所处的电场环境相近,提高存活率和转染效率。
优选的,所述鞘流通道包括两个通道支流,两个通道支流分别从细胞悬浮液入口两侧绕过细胞悬浮液入口与细胞悬浮液通道连通,两个通道支流的鞘流可以有效地将细胞汇聚在微流通道中央流动,实现对单个细胞依次进行电穿孔处理。
优选的,还包括细胞悬浮液输入管、鞘流输入管、细胞输出管,细胞悬浮液输入管与细胞悬浮液入口连通,鞘流输入管与鞘流入口连通,细胞输出管与细胞输出口连通。
优选的,透明基板上设有键合用十字对准标记,微流体通道层上设有与键合用十字对准标记相配合的键合用四正方形对准标记,键合使透明基板与微流体通道层结合更加准确,以确保电极恰能位于微流控电穿孔通道中。
优选的,叉指电极的指间距为50~80μm;平行电极的电极间距为150~200μm。
一种使用微电极流控芯片的可调参数单细胞电穿孔装置,包括稳压电源模块、函数信号发生模块、pcb控制电路及数显模块、芯片载具及微电极流控芯片,芯片载具上设有芯片槽,所述微电极流控芯片固定在芯片槽中,pcb控制电路及数显模块输出端为弹簧探针,所述弹簧探针与微电极引出端电接触;稳压电源模块用于为函数信号发生模块、pcb控制电路及数显模块及微电极流控芯片供电;函数信号发生模块用于输出供电穿孔所需信号。
优选的,所述pcb控制电路及数显模块包括开关电路和放大器,开关电路将单路输入分成多路输出,放大器用于调节输出信号的幅值;开关电路的输入端连接函数信号发生模块的输出端,开关电路的输出端连接放大器的输入端;放大器的输出端连接微电极引出端。
优选的,放大器为增益可调放大器。
优选的,所述叉指电极的叉指间电场大于平行电极的电极间电场。
有益效果:本发明提供的一种微电极流控芯片,相比较现有技术,微电极流控芯片中的微电极包括叉指电极和平行电极,叉指电极位于微流控电穿孔通道上游,产生强电场,细胞悬浮液通过时受到电场作用,细胞膜发生电穿孔;平行电极位于微流控电穿孔通道下游,施加并保持低电场,可以维持细胞电穿孔状态,加强并提高细胞的转染效率。每个细胞所处电场环境相近,减少了传统电穿孔仪强电场及电场强度差异造成的细胞损伤甚至死亡。
基于微电极流控芯片的可调参数单细胞电穿孔装置,相比较现有技术,1)该装置为完整的单细胞电穿孔实验系统,可方便地进行单细胞电穿孔实验,并置于倒置显微镜上观察细胞电穿孔的动态过程;2)该装置使用微电极流控芯片,电极间间距短,为达到细胞电穿孔的效果而施加的电压在10v量级,细胞死亡率低,操作安全;3)该装置对单个细胞依次进行电穿孔,且每个细胞所处的电场环境相近,减少实验过程中不可控因素造成的细胞损伤;4)该装置的核心微电极流控芯片的电极几何参数可根据实验要求设计,通过pcb控制电路来选择电穿孔所使用的电极的种类与数目并且选择电信号的波形、频率、占空比和幅值,实现电穿孔实验参数的最优化调节;5)该装置的微电极流控芯片在微流体通道下游设计并加工有平行电极,在细胞流经该区域时产生低电场,有效的增强了细胞电转染效率。
附图说明
图1是本发明中微电极流控芯片的三维结构示意图;
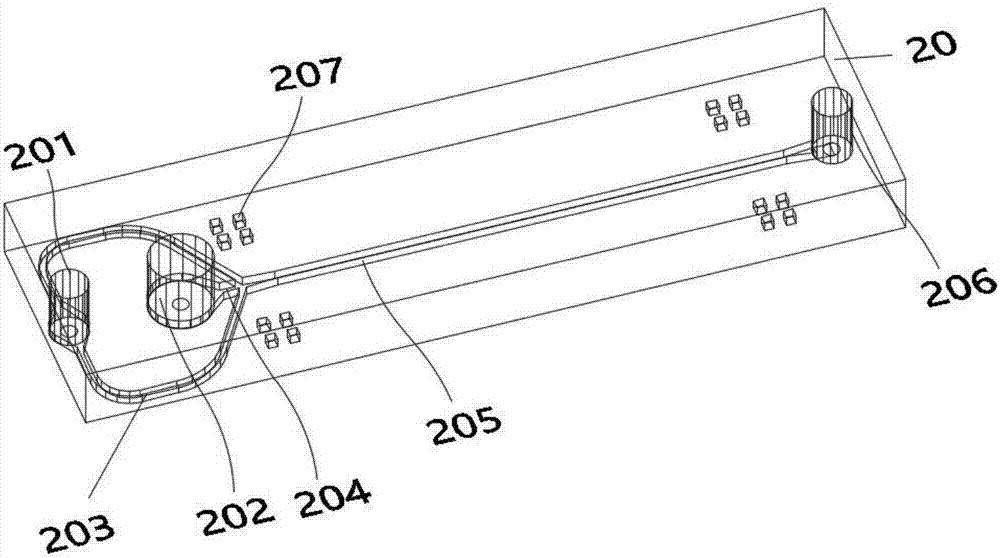
图2是本发明中微电极流控芯片中微流体通道层的三维结构示意图;
图3是本发明中微电极流控芯片中集成微电极的透明基板三维结构示意图;
图4是微电极流控芯片a-a向剖面结构示意图;
图5是本发明的可调参数单细胞电穿孔装置的结构框图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明。
如图1所示,微电极流控芯片包括透明基板10及微流体通道层20,微流体通道层20位于透明基板10上方。如图2所示,所述微流体通道层20包括鞘流入口201、细胞悬浮液入口202、鞘流通道203、细胞悬浮液通道204、微流控电穿孔通道205及细胞出口206;鞘流入口201与鞘流通道203连通,细胞悬浮液入口202与细胞悬浮液通道204连通,鞘流通道203的末端与细胞悬浮液通道204末端汇聚并与微流控电穿孔通道205的一端连通,微流控电穿孔通道205的另一端与细胞出口206连通。如图3所示,所述透明基板10上集成有微电极,微电极包括叉指电极101和平行电极102,叉指电极101和平行电极102分布于微流控电穿孔通道205的下方,从俯视的角度看微流控电穿孔通道205刚好从叉指电极101和平行电极102的中间穿过,电极的两级分别位于微流控电穿孔通道205两端,且叉指电极101和平行电极102从细胞悬浮液入口202到细胞出口206依次分布,即叉指电极101靠近细胞悬浮液入口202,在上游;平行电极102靠近细胞出口206,在下游;微电极包括微电极引出端103,微电极引出端103分布于透明基板10两侧。
本实施例中的叉指电极101有三个,平行电极102有一个,实际可以根据需要设置相应的个数,平行电极102也可以有多个。多个微电极之间间隔均匀分布,根据需要设计相邻微电极的间距,可以使电场分布更加均匀,使每个细胞所处的电场环境相近,提高存活率和转染效率。微电极间距具体体现在制作透明基板10时电极几何尺寸及排布设计上。
所述鞘流通道203包括两个通道支流,两个通道支流分别从细胞悬浮液入口202两侧绕过细胞悬浮液入口202与细胞悬浮液通道204连通,两个通道支流的鞘流可以有效地将细胞汇聚在微流通道中央流动,实现对单个细胞依次进行电穿孔处理。
如图4所示,还包括鞘流输入管301、细胞悬浮液输入管302、细胞输出管303,细胞悬浮液输入管302与细胞悬浮液入口202连通,鞘流输入管301与鞘流入口201连通,细胞输出管303与细胞输出口206连通,以方便细胞悬浮液、鞘流的注入以及混合液体的流出。鞘流输入管301、细胞悬浮液输入管302、细胞输出管303一般使用特氟龙管,也可使用不锈钢管,具体直径可根据所述细胞悬浮液入口202,鞘流入口201,细胞出口206的孔径确定。
透明基板10上设有键合用十字对准标记104,微流体通道层20上设有与键合用十字对准标记104相配合的键合用四正方形对准标记207,即采用“田”字形对准标记,也可以采用其他形状的对准标记,效果一样。透明基板10上还设有鞘流入口201、细胞悬浮液入口202、细胞出口206的加工对准标记105。键合用十字形对准标记104处恰好嵌入键合用四方形对准标记207中,使透明基板10与微流体通道层20结合更加准确,以确保微流控电穿孔通道205恰能位于微电极中。在无需精密对准的场合,亦可不设计键合对准标记。
微电极的两端电极之间的间距可以根据需要进行设计,本实施例的叉指电极101的指间距为50~80μm;平行电极102的电极间距为150~200μm。两者的可变性体现在透明基板10设计时的电极参数设计。
如图5所示,使用该微电极流控芯片的可调参数单细胞电穿孔装置,包括稳压电源模块、函数信号发生模块、pcb控制电路及数显模块、芯片载具及微电极流控芯片,芯片载具上设有芯片槽,所述微电极流控芯片固定在芯片槽中,pcb控制电路及数显模块输出端为弹簧探针,所述弹簧探针与微电极引出端电接触。
稳压电源模块用于为函数信号发生模块、pcb控制电路及数显模块及微电极流控芯片供电。
函数信号发生模块可以控制施加在微电极上电信号的波形、频率、占空比等参数,用于输出供电穿孔所需信号。
pcb控制电路及数显模块可以通过增益可调放大器来调节施加到微电极上电信号的幅值,实现针对不同细胞系的电穿孔参数的最优化调节。所述pcb控制电路及数显模块包括开关电路和放大器,开关电路将单路输入分成多路输出;放大器用于调节输出信号的幅值;开关电路的输入端连接函数信号发生模块的输出端,开关电路的输出端连接放大器的输入端;放大器的输出端连接微电极引出端。因为微电极有多个,所以放大器也有多个,每个从开关电路输出的信号经放大器放大后被接入相应的微电极。放大器为增益可调放大器,可以根据需要对各放大器的增益进行调节,从而可以实现施加到各微电极上的信号幅值不同。
稳压电路模块可使用lm2575、max1715等开关电源稳压芯片,效率高,功耗小,具体的芯片可依据pcb控制电路及数显模块所用芯片的供电电压确定;函数信号发生模块可使用单片集成的函数发生芯片max038完成,可产生高频高精度输出波形,输出波形失真小、漂移小,频率范围宽,可产生正弦波、方波等波形,并且频率、占空比可调;在pcb控制电路上使用开关电路来实现电信号单路输入多路输出,使用增益可调放大器实现增益可调功能。在本实施例中,有三组叉指电极和一组平行电极,因此pcb控制电路为单路输入四路输出,增益分别设置为0倍、1倍、2倍以及3倍。
微电极上电信号的通断是由pcb控制电路模块上的芯片和开关共同控制的,芯片实现单路电信号输入、多路电信号的输出,通过pcb控制电路开关调节接入电极的种类和数量,实现多路电极的选通,改变细胞暴露于电场中的时间,从而控制细胞电穿孔的工作条件。
所述叉指电极101的叉指间电场大于平行电极102的电极间电场,当细胞通过上游时,可以对细胞实施电穿孔;电穿孔后的细胞继续向下游移动,平行电极102的电极间电场较低,可以维持细胞电穿孔状态,加强并提高细胞的转染效率。
微电极流控芯片的制作及安装成可调参数单细胞电穿孔装置的过程如下:
(1)在4寸透明基板上利用lift-off工艺制作金微电极;在4寸硅圆晶上利用基于su-8光刻胶的软光刻工艺制作pdms微流体通道层;透明基板可使用玻璃、(聚甲基丙烯酸甲脂)pmma等透明绝缘材料制作;微电极可使用金、铂等贵金属材料通过电镀或者沉积等工艺制作。透明基板材料保证了在实验过程中可进行光学显微观测;金、铂等材料化学惰性强、导电性好、无生物毒性。
(2)如图1~图4所示,在体视显微镜的观察下,在pdms微流体通道层上进行打孔,以加工细胞悬浮液入口,鞘流入口,细胞出口。
(3)透明基板与pdms微流体通道层分别进行清洗、吹干,然后置于氧等离子体清洗机中进行表面改性处理后实现永久性键合。键合时在体视镜观察下将pdms微流控通道层上的键合用四正方形对准标记与透明基板上的键合用十字对准标记中心重合,以确保电极恰能位于微流控电穿孔通道中。然后如图4所示,在微电极流控芯片上插入细胞悬浮液输入管,鞘流输入管,细胞输出管。
(4)如图5所示,将微电极流控芯片固定在芯片载具中的芯片槽中,将pcb控制电路模块与芯片载具用螺丝紧固,使控制电路的弹簧探针与微电极在压力下实现电接触,然后连接稳压电源模块和函数信号发生模块,构成基于微电极流控芯片的可调参数单细胞电穿孔装置。
- 还没有人留言评论。精彩留言会获得点赞!