联苯核苷氨基磷酸酯化合物的晶型及其制备方法与用途与流程
本发明属于医药化学领域,具体涉及具有肝炎病毒抑制作用的联苯核苷氨基磷酸酯化合物的晶型以及它的制备方法和应用。
背景技术:
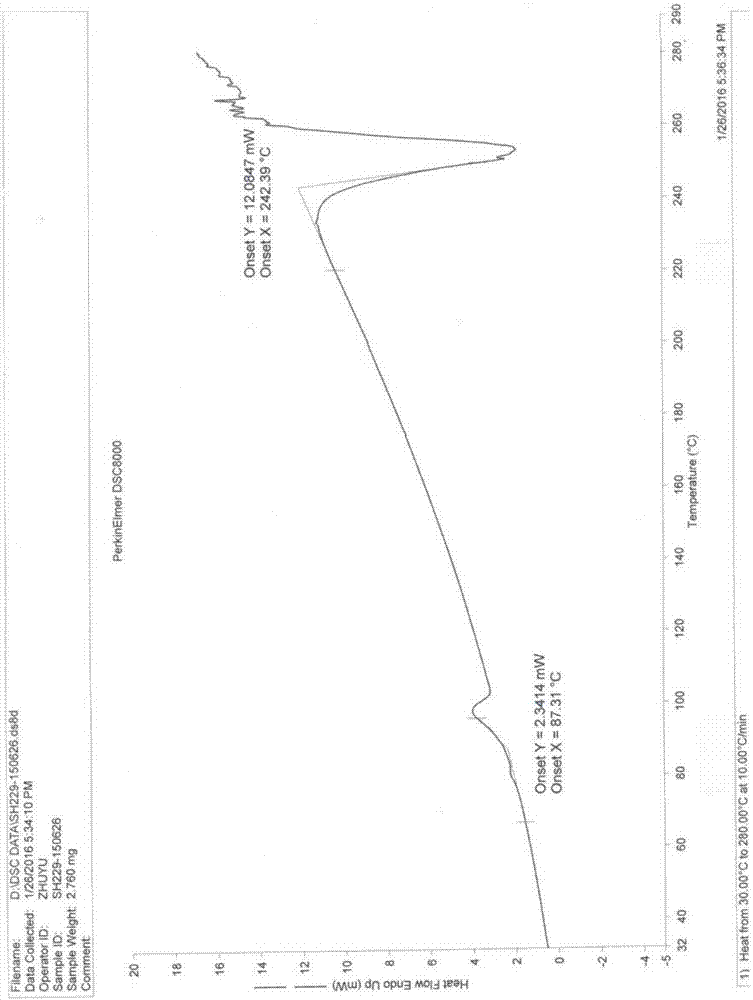
:丙型肝炎病毒(HCV)感染是世界范围内流行的疾病,全球慢性感染者已超过2亿,埃及的慢性感染率为15%,巴基斯坦为4.8%,中国为3.2%,位列世界前三。丙型肝炎病毒感染的临床表现多样,轻至炎症,重至肝硬化、肝癌。慢性丙型肝炎还可以并发某些肝外表现,包括类风湿性关节炎、干燥性结膜角膜炎、扁平苔藓、肾小球肾炎、混合型冷球蛋白血症、B细胞淋巴瘤和迟发性皮肤卟啉症等,可能是机体异常免疫反应所致。且丙肝肝硬化失代偿期时,可以出现各种并发症,如腹水腹腔感染,上消化道出血,肝性脑病,肝肾综合征,肝衰竭等表现。HCV属于黄病毒科肝病毒属病毒,其与黄病毒科中的另外两个属即瘟病毒属和黄病毒属的基因结构相似。目前,治疗HCV感染的标准方法有干扰素以及干扰素和利巴韦林联合疗法。不过,仅50%的治疗者对该方法有反应,且干扰素具有明显的副作用,例如流行性感冒样症状、体重减低以及疲乏无力,而干扰素和利巴韦林联合疗法则产生相当大的副作用,包括溶血、贫血症和疲乏等。另外,已开发的用于治疗HCV感染的药物包括蛋白酶抑制剂、噻唑烷衍生物、噻唑烷和N-苯甲酰苯胺、菲醌、解旋酶抑制剂、核苷聚合酶抑制剂和胶霉毒素、反义硫代磷酸酯寡核苷酸、依赖于IRES的翻译的抑制剂、核酶以及核苷类似物等。目前,核苷磷酸酯类化合物用于治疗黄病毒科病毒尤其是HCV感染是本领域的重要研发方向。CN104031104A公开了一种如式1所示的新型核苷氨基磷酸酯化合物,其化学名称为(2S)-2-((([1,1'-联苯]-4-基氧基)(((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)磷酰基)氨基)丙酸异丙酯,该篇文献以其全部内容引入本文作为参考,CN104031104A报道了(2S)-2-((([1,1'-联苯]-4-基氧基)(((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)磷酰基)氨基)丙酸异丙酯具有优异的抗病毒活性,对细胞的毒性小,可用于治疗黄病毒科病毒,尤其是丙型肝炎病毒感染。结构如式1a所示的化合物为上述式1化合物的立体异构体,化学名称为(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯(以下简称“式1a化合物”),本发明的发明人使用CN104031104A中实验例1的方法测定式1a化合物对HCV1b复制子的EC50,结果显示式1a化合物对HCV病毒具有明显优于式1化合物的抑制活性。本领域技术人员知道,固体以晶体形式或无定型形式存在。相同化学结构的化合物既能形成不同的结晶形态,也能够成为无结晶的形态,即无定型粉末或简称无定型。晶型是结晶物质晶格内分子的排列形成,同一种物质具有两种或两种以上的空间排列和晶胞参数,形成多种晶型的现象称为多晶型现象。无定型是一种微观结构为分子或原子无序集合的形态,其非晶性使其在偏振显微镜下既无晶体的双折射现象,也无晶体的偏振光熄灭现象,很容易与结晶性粉末区别。药物活性成分的晶型结构往往会引起该药物各种理化性质的差异,如溶解度、溶出速率、熔点、密度、硬度、光电学性质、蒸汽压力等,这些差异直接影响药物的处方制剂工艺、储存方法、体内药代动力学表现,进而影响到药物的生物利用度、临床疗效和安全性。因此深入研究(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯的多晶型现象并找到具备良好性质的晶型具有十分重要的意义。技术实现要素:第一方面,本发明提供一种如式1a所示的化合物,其是式1化合物的立体异构体,化学名称为(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯,式1a所示化合物对HCV病毒抑制活性较式1化合物更强,适合用于丙型肝炎病毒感染患者的治疗,第二方面,本发明提供了式1a化合物的制备方法,包括将CN104031104A说明书实施例1步骤1所得物进行构型转换,然后在碱性条件下,将上述得到的异构体与(2'R)-2'-脱氧-2'-氟-2'-甲基尿苷发生亲核反应,得到式1a化合物。本发明人深入研究了式1a化合物的结晶形态。结果发现式1a化合物在不同的结晶条件下得到一系列了不同的结晶产物。第三方面,本发明提供了一种稳定性高的式1a化合物的A0型晶型,该A0型晶型的X-射线粉末衍射图谱如图1所示,使用Cu-Ka辐射,以衍射角2θ表示的X-射线衍射光谱,其中在5.03°±0.2°、5.44°±0.2°、6.99°±0.2°处显示有特征峰。进一步的,本发明提供的A0型晶型的X-射线粉末衍射光谱在衍射角2θ为5.03°±0.2°、5.44°±0.2°、6.99°±0.2°、15.23°±0.2°、18.12±0.2°处显示有特征峰。更进一步的,本发明提供的A0型晶型的X-射线粉末衍射在衍射角2θ为5.03°±0.2°、5.44°±0.2°、6.99°±0.2°、10.18+0.2°、15.23°±0.2°、16.00±0.2°、17.58±0.2°、18.12±0.2°、18.45±0.2°、20.13±0.2°、20.87±0.2°处显示有特征峰。更进一步的,本发明提供的A0型晶型具有如图1所示的X-射线粉末衍射图谱。非限制性的,本发明提供的A0型晶型的DSC图谱(参见图2)显示有一个在约87.31℃(起点温度)的吸热峰。TGA图谱(参见图3)显示此时A0型晶型无重量丢失,在约242.39℃处开始分解。本发明提供的A0型晶型在25℃/60%RH或40℃/75%RH下放置六个月后晶型不变,且纯度没有下降,因此该晶型的稳定性良好,,符合化学药物稳定性研究技术指导原则,能够满足生产运输储存的药用要求,生产工艺稳定可重复可控。第四方面,本发明提供式1a化合物的溶剂合物晶型,根据结晶所用溶剂不同可以含有不同的溶剂分子。例如,所述溶剂分子可以是正庚烷、甲苯、乙酸异丙酯以及二异丙醚等。第五方面,本发明提供了一种式1a化合物溶剂合物的A型晶型,其X-射线粉末衍射图谱如图4所示,使用Cu-Ka辐射,其在衍射角2θ为5.11°±0.2°、6.95°±0.2°、7.38°±0.2°、10.24°±0.2°处显示有特征峰。进一步的,本发明提供的A型晶型的X-射线粉末衍射在衍射角2θ为5.11°±0.2°、6.95°±0.2°、7.38°±0.2°、10.24°±0.2°、15.26°±0.2°、20.87°±0.2°处显示有特征峰。进一步的,本发明提供的A型晶型的X-射线粉末衍射在衍射角2θ为5.11°±0.2°、6.95°±0.2°、7.38°±0.2°、10.24°±0.2°、11.65°±0.2°、15.26°±0.2°、15.96°±0.2°、17.63°±0.2°、18.20°±0.2°、18.50°±0.2°、20.16°±0.2°、20.87°±0.2°、21.75°±0.2°、23.09°±0.2°、25.22°±0.2°、26.54°±0.2°、29.74°±0.2°处显示由特征峰。在一个具体的实施例中,本发明提供的A型晶型具有如图4所示的X-射线粉末衍射图谱。第六方面,本发明提供了一种式1a化合物溶剂合物的F型晶型,其X-射线粉末衍射图谱参见图5,使用Cu-Ka辐射,其在衍射角2θ为5.18°±0.2°、5.35°±0.2°、20.60°±0.2°处显示有特征峰。进一步的,本发明提供的F型晶型的X-射线粉末衍射在衍射角2θ为5.18°±0.2°、5.35°±0.2°、7.62°±0.2°、20.28°±0.2°、20.60°±0.2°、20.79°±0.2°处显示特征峰。更进一步的,本发明提供的F型晶型的X-射线粉末衍射在衍射角2θ为5.18°±0.2°、5.35°±0.2°、6.29°±0.2°、6.81°±0.2°、7.62°±0.2°、10.33°±0.2°、10.73°±0.2°、11.76°±0.2°、15.14°±0.2°、15.44°±0.2°、16.76°±0.2°、17.44°±0.2°、18.11°±0.2°、20.28°±0.2°、20.60°±0.2°、20.79°±0.2°、23.39°±0.2°、25.34°±0.2°、26.58°±0.2°处显示特征峰。在一个具体的实施例中,本发明提供的F型晶型具有如图5所示的X-射线粉末衍射图谱。核磁氢谱、TGA测试以及单晶X-射线衍射测试结果显示上述得到A型晶型或F型晶型为溶剂合物,其中在不同的溶剂体系中结晶分离得到的A型晶型或F型晶型包含不同的溶剂,例如将式1a化合物溶于乙酸异丙酯中重结晶得到的晶型为乙酸异丙酯溶剂合物。在一些实施方案中,根据本发明提供的溶剂合物A型晶型,所述溶剂合物中含有选自醇类、酮类、酯类、芳香烃、卤代烃、脂肪烃类化合物中的一种或多种的溶剂,例如含有正庚烷、丙酮、甲苯、二异丙醚、乙酸乙酯、氯仿、甲基异丁基酮、乙酸异丙酯、1,4-二氧六环、甲苯或正庚烷混合物中一种或多种的溶剂。在一些具体的实施方案中,根据本发明的溶剂合物F型晶型中,所述溶剂合物中含有选自醇类、酮类、酯类、芳香烃、卤代烃、脂肪烃类化合物中的一种或多种的溶剂,例如含有正庚烷、丙酮、甲苯、二异丙醚、乙酸乙酯、氯仿、甲基异丁基酮、乙酸异丙酯、1,4-二氧六环、甲苯混合物或正庚烷混合物中一种或多种的溶剂。在一些优选的实施方案中,对通过上述方法结晶得到的晶体进行单晶X-射线衍射测试,结果显示本发明提供的A型晶型或F型晶型为正庚烷溶剂合物、乙酸异丙酯溶剂合物、二异丙醚溶剂合物、甲基异丁基酮或甲苯溶剂合物等。在一个具体的实施方案中,将通过二氯甲烷/正庚烷的溶剂体系得到的晶体进行单晶X-射线衍射测试,结果发现相邻的式1a化合物分子之间通过分子间氢键相互连接,从而使得在b-轴方向上形成正方形管状孔道,正庚烷溶剂分子填充在孔道中,最终形成了式1a化合物的管道溶剂合物晶体。其不对称结构单元中,包含两个式1a化合物分子和两个正庚烷溶剂分子。第七方面,本发明提供了上述A0型晶型的制备方法,包括以下步骤:1).将式1a化合物(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯加入到选自以下的溶剂体系中:醇类,酮类,酯类,芳香烃,卤代烃,脂肪烃类化合物的单一或它们的混合体系,然后进行结晶;2).过滤、洗涤;和3).干燥。本发明提供的A0型晶型的制备方法中,步骤1)中的溶剂优选为甲醇、乙醇、丙醇、异丙醇、二氯甲烷、氯仿、四氢呋喃、2-甲基四氢呋喃、丙酮、甲基异丁基酮、1,4-二氧六环、甲苯、乙酸乙酯或乙酸异丙酯中的一种或多种。结晶方法采用本领域的常规的重结晶方法,优选为反溶剂添加法、气液渗透法、悬浮搅拌法、缓慢降温法、常温挥发法、气固渗透法或高聚物诱导法等方法。干燥方法优选为60℃~80℃真空干燥。在一些优选的实施方案中,采用反溶剂添加法制备式1a化合物的A0型晶型,包括用良溶剂溶解式1a化合物后,加入反溶剂,分离出析出的沉淀并干燥。在一些实施方案中,所述的良溶剂选自乙醇、丙酮、乙酸乙酯、四氢呋喃、二氯甲烷以及氯仿,所述的反溶剂选自正庚烷和甲苯。在另一些优选的实施方案中,采用气固渗透法制备式1a化合物的A0型晶型,包括将式1a化合物置于装有氯仿或乙酸乙酯的密闭装置中,室温下放置,然后取出固体并干燥。在另一些优选的实施方案中,采用悬浮搅拌法制备式1a化合物的A0型晶型,包括用有机溶剂处理式1a化合物制得悬浮液,分离固体并干燥。在一些具体的实施方案中,所述的有机溶剂优选为甲基异丁基酮、乙酸异丙酯或1,4-二氧六环和甲苯的混合溶液。在另一些优选的实施方案中,采用缓慢降温法制备式1a化合物的A0型晶型,包括用有机溶剂处理式1a化合物,搅拌一段时间后过滤,将滤液缓慢降至低温,固体析出并干燥。在一些具体的实施方案中,所述的有机溶剂优选为甲基异丁基酮或乙酸异丙酯。在另一些优选的实施方案中,采用高聚物诱导法制备式1a化合物的A0型晶型,包括使用良溶剂溶清式1a化合物后,加入混合聚合物,挥发,得到固体并干燥。在一些具体的实施方案中,所述混合聚合物优选为混合的聚乙烯吡咯烷酮、聚乙烯醇、聚氯乙烯、聚乙酸乙烯酯、羟丙基甲基纤维素和甲基纤维素。在另一些优选的实施方案中,采用常温挥发法制备式1a化合物的A0型晶型,包括用有机溶剂溶解式1a化合物,得到澄清溶液,室温下缓慢挥发,分离所得固体,干燥。在一些具体的实施方案中,所述的有机溶剂选自乙酸异丙酯或二氯甲烷正庚烷混合溶液。在另一些优选的实施方案中,采用气液渗透法制备式1a化合物的A0型晶型,包括将用良溶剂处理式1a化合物得到的澄清溶液置于装有反溶剂的密闭装置中,室温下放置,析出固体,干燥。本发明提供的A0型晶型的制备方法中,对使用的式1a化合物的形态种类没有特别限定,可以是任意其他晶型或无定型固体。第八方面,本发明提供了上述A型晶型的制备方法,包括以下步骤:1).将式1a化合物(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯加入到选自以下的溶剂体系中:醇类,酮类,酯类,芳香烃,卤代烃,脂肪烃类化合物的单一或它们的混合体系,然后进行结晶;2).过滤、洗涤;和3).干燥。本发明提供的A型晶型的制备方法中,步骤1)中的溶剂优选为甲醇、乙醇、丙醇、异丙醇、二氯甲烷、氯仿、四氢呋喃、2-甲基四氢呋喃、丙酮、甲基异丁基酮、1,4-二氧六环、甲苯、乙酸乙酯或乙酸异丙酯中的一种或多种。结晶方法采用本领域的常规的重结晶方法,优选为反溶剂添加法、气液渗透法、悬浮搅拌法、缓慢降温法、常温挥发法、气固渗透法。干燥方法为20℃~40℃真空干燥。第九方面,本发明提供了上述F型晶型的制备方法,包括以下步骤:1).将式1a化合物(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯加入到选自以下的溶剂体系中:酮类,芳香烃,卤代烃的单一或它们的混合体系,然后进行结晶;2).过滤、洗涤;和3).干燥。本发明提供的F型晶型的制备方法中,步骤1)中的溶剂优选为丙酮、甲基异丁基酮、二氯甲烷中的一种或多种。结晶方法采用本领域的常规的重结晶方法,干燥方法为20℃~40℃真空干燥。根据本发明提供的A型晶型或F型晶型的制备方法中,其中步骤1)中的式1a化合物可以是式1a化合物的其他晶型或无定型物。本发明提供的A0型晶型的制备方法中,在一些具体的实施方案中,步骤3)中的干燥方法优选为60℃~80℃真空干燥。在另一些优选的实施方案中,将得到的A型晶型在约60℃下真空干燥约24h即得到A0型晶型。在另一些优选的实施方案中,将F型晶型置于室温下静置即可得到A0型晶型。按照本发明的方法制备得到的A0型晶型完全符合药典溶剂残留标准,可以较好的作为医药活性成分使用。第十方面,本发明提供了含有上述任意形态的式1a化合物与至少一种药学上可接受的载体形成的药用组合物。所述任意形态的式1a化合物优选为A0型晶型或A型晶型或F型晶型,更优选为A0型晶型。本发明提供的药物组合物,其包含本发明的晶型以及药学上可接受的载体。例如,式1a化合物的晶型和药学上可接受的载体组成的药物组合物,将式1a化合物的晶型与药学上可接受的载体混合制备成药物制剂,以适合于经口或胃肠外给药。给药方法包括,但不限于皮内、肌内、腹膜内、静脉内、皮下、鼻内和经口途径。所述制剂可以通过任何途径施用,例如通过口服,通过输注或推注,通过经上皮或皮肤粘膜(例如口腔粘膜或直肠等)吸收的途径施用。给药可以是全身的或局部的。经口施用制剂的实例包括固体或液体剂型,具体而言,包括片剂、丸剂、粒剂、粉剂、胶囊剂、糖浆、乳剂、混悬剂等。所述制剂可通过本领域已知的方法制备,且包含药物制剂领域常规使用的载体。第十一方面,本发明提供了一种上述任意形态的式1a化合物或包含上述任意形态的式1a化合物的药物组合物在制备预防和/或治疗病毒感染的药物中的应用。所述任意形态的式1a化合物优选为A0型晶型或A型晶型或F型晶型,更优选为A0型晶型。所述任意形态的式1a化合物的药物组合物优选为包含A0型晶型或A型晶型或F型晶型的组合物,更优选为包含A0型晶型的组合物。在一些具体的实施方案中,所述在制备预防和/或治疗病毒感染的药物中的应用优选为在制备预防和/或治疗黄病毒感染药物中的应用,特别是在制备预防和/或治疗HCV病毒感染药物中的应用,如HCV病毒性肝炎疾病的药物中的应用。该类疾病的实例有急性丙型肝炎、慢性丙型肝炎以及丙型肝炎和乙型肝炎或丁型肝炎的混合感染。为了帮助理解本申请公开的各种实施方案,提供以下说明:“式1a化合物的溶剂合物”,又称“式1a化合物的溶剂化物”,是式1a化合物与有机溶剂或水通过氢键、盐键相互作用而形成的物质。“任意形态的式1a化合物“,包含式1a化合物的无定型、晶型、溶剂合物等式1化合物任意存在的形式。“异构体”是指具有相同分子式但是在其原子的键合性质或键合顺序或其原子空间排列方面有区别的化合物。在其原子空间排列方面不同的异构体被称作“立体异构体”。彼此为非镜象的立体异构体被称作“非对映异构体”,彼此为不重叠镜像的那些被称作“对映异构体”。当化合物具有不对称中心时,例如,如果碳原子与四个不同基团键合时,可能存在一对对映体。对映体可以其不对称中心的绝对构型为特征并且通过Cahn和Prelog的R和S顺序规则进行描述,或通过其中分子使偏振光平面旋转并被指定为右旋或左旋(即,分别为(+)或(-)异构体)的方式进行描述。手性化合物可以单独的对映体存在或作为对映体的混合物存在。包含相等比例的对映体的混合物被称作“外消旋混合物”。手性化合物绝对构型的测定方法,主要有单晶X-射线衍射法、核磁共振法和圆二色谱法。“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。在Remington'sPharmaceuticalSciences(MackPub.Co.,N.J.1991)中可找到关于药学上可接受的赋形剂的充分讨论。在组合物中药学上可接受的载体可包括液体,如水、盐水、甘油和乙醇。另外,这些载体中还可存在辅助性的物质,如崩解剂、润湿剂、乳化剂、pH缓冲物质等。在这里需要特别说明的是,X-射线粉末衍射图谱对于特定的晶型具有特征性。判断是否与已知晶型相同时,应该注意的是峰的相对位置(即2θ)而不是它们的相对强度。这是由于谱图(尤其在低角度)的相对强度会因为晶体条件、粒径和其它测定条件的差异产生的优势取向效果而变化,衍射峰的相对强度对晶型的确定并非是特征性的。另外,本领域知道,用X射线衍射测定化合物的结晶时,由于测定的仪器或测定的条件等的影响,同一个晶型的2θ值可存在一定的测量误差,约为±0.2°,相对强度的测定误差可为±20%。因此,在确定每种结晶结构时,应该将此误差考虑在内。在XRD图谱中通常用2θ角或晶面距d值表示峰位置,两者之间具有简单的换算关系:d=λ/2sinθ,其中d代表晶面间距d值,λ代表入射X射线的波长,θ为衍射角。还应特别指出的是,在混合物的鉴定中,由于含量下降等因素会造成部分衍射线缺失,此时,无需依赖高纯试样中观察到的全部谱带,一条谱带也可能对给定的晶体是特征性的。DSC测定当晶体由于其晶体结构发生变化或晶体熔融而吸收或释放热时的转变温度。对于同种化合物的同种晶型,在连续的分析中,热转变温度和熔点误差典型的在约5℃之内。当我们说一个化合物具有一给定的DSC峰或熔点时,这是指该DSC峰或熔点±5℃。需要指出的是对于混合物而言,其DSC峰或熔点可能会在更大的范围内变动。此外,由于在物质熔化的过程中伴有分解,因此熔化温度与升温速率相关。附图说明图1是(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯A0型晶型的X-射线粉末衍射图。图2是(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯A0型晶型的DSC图。图3是(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯A型晶型的TGA图。图4是(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯A型晶型的X-射线粉末衍射图。图5是(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯F型晶型的X-射线粉末衍射图。图6是(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯正庚烷溶剂合物单晶的不对称结构单元示意图。图7是(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯正庚烷溶剂合物单晶的单胞示意图。具体实施方式以下实施例使用的材料如无特殊说明均为商购获得。实验所用的测试仪器1.单晶X-射线衍射仪器型号:AgilentSuper单晶衍射仪测试条件:铜靶,管压40kv,管流40mA。2.X-射线粉末衍射谱仪器型号:D8AdvanceX-rayDiffractometerX射线:Cu,kα,Kα11.5406;Kα21.54443;X射线光管设定:40kV,40mA发散狭缝:1.0/1.0/Ni/0.2扫描方式:θ-2θ扫描范围:3°-40°2θ步长:0.02°2θ3.DSC谱仪器型号:NETZSCHDSC204型差热分析仪升温速率:10℃/min温度范围:40至230℃保护气体:氮气4.TGA谱仪器型号:NETZSCHTG209型热重分析仪升温速率:10℃/min温度范围:40至230℃保护气体:氮气实施例1:(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯的制备步骤1(S)-2-[[(1,1'-联苯基-4-氧基)(五氟苯氧基)磷酰基]氨基]丙酸异丙酯的合成于50L玻璃反应釜中,氮气保护下,加入三氯氧磷(1.53kg,10mol)和二氯甲烷(10L),搅拌,降温至-30℃以下。滴加三乙胺(1.01kg,10mol)的二氯甲烷(5L)溶液,滴加过程,保持内温低于-30℃。滴加完毕,缓慢滴加4-羟基联苯(1.7kg,10mol)的四氢呋喃(3.4L)溶液,滴毕搅拌30min。控制内温低于-30℃,加入L-丙氨酸异丙酯盐酸盐(1.68kg,10mol),滴加三乙胺(2.02kg,20mol)的二氯甲烷(8.0L)溶液,搅拌30min。升温至0℃左右,滴加五氟苯酚(1.84kg,10mol),三乙胺(1.01kg,10mol)的二氯甲烷(7.0L)溶液,滴加过程中,反应放热升温,滴加完毕,內温升至室温,反应完全后,过滤,滤饼用二氯甲烷2.5L×4洗涤,合并滤液,将滤液用25L纯化水洗涤,分液,有机相减压浓缩,加入庚烷5L×2带溶剂,离心,真空干燥,称重,得类白色固体状标题化合物。步骤2(S)-2-[[(S)-(1,1'-联苯基-4-氧基)(五氟苯氧基)磷酰基]氨基]丙酸异丙酯的合成于30L反应釜中,氮气保护下,加入(S)-2-[[(1,1’-联苯基-4-氧基)(五氟苯氧基)磷酰基]氨基]丙酸异丙酯(3.70kg,7.0mol),甲基叔丁基醚(2.40kg),正庚烷(9.0kg),三乙胺(77g,0.7mol),五氟苯酚(43g,0.21mol),加热至40℃,强力机械搅拌。反应完全后,离心,真空干燥,得标题化合物。步骤3(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯的合成于50L玻璃反应釜中,加入1-[(2R,3R,4R,5R)-3-氟-4-羟基-5-羟甲基-3-甲基四氢呋喃-2-基]嘧啶-2,4-(1H,3H)-二酮成品(1.30kg,5.0mol),四氢呋喃(15.6L),搅拌,氮气保护,降温至-10℃以下。滴加叔丁基氯化镁溶液(8.0L,8.0mol),滴毕,0~5℃继续反应1h。加入(S)-2-[[(S)-(1,1’-联苯基-4-氧基)(五氟苯氧基)磷酰基]氨基]丙酸异丙酯成品(2.12kg,4.0mol),滴加完毕,5~10℃反应,10~11h后取样,HPLC监控,反应完全后,降温至0℃以下,向反应液中加入2N盐酸(4.0L,8.0mol)淬灭反应。淬灭过程控制温度在0~10℃。滴加完毕,搅拌10min。减压浓缩,蒸干得固液残余物,加入乙酸乙酯(40.0L),和纯化水(20.0L),分液。向有机相中加入5%碳酸钠水溶液(10.0L)洗涤,然后水洗,过滤,旋干,再次加入二氯甲烷7.0L,浓缩,得油状发泡物,向油状发泡物中加入乙酸异丙酯(15.0L),溶清后,降温,析出大量白色沉淀。降温,过滤,干燥滤饼。继续用乙酸异丙酯溶解,加热搅拌。加入活性炭,搅拌30min,趁热过滤,降温,过滤,干燥滤饼,得白色固体,纯度大于98%。ESI-MSm/z:604.2[M+H]-1HNMR(300MHz,DMSO-d6)δ:11.48(s,1H),7.67(d,2H),7.64-7.62(m,2H),7.59(d,1H),7.47(t,2H),7.37(t,1H),7.33(d,2H),6.04(d,1H),6.02(d,1H),5.83(d,1H),5.57(d,1H),4.89-4.84(m,1H),4.42-4.39(m,1H),4.29-4.24(m,1H),4.05-4.02(m,1H),3.88-3.82(m,2H),1.29-1.24(m,6H),1.16-1.15(m,6H)。实施例2(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯A型晶型的制备方法1:称取15mg式1a化合物于20mL反应瓶中,加入0.2mL乙醇溶解,然后向该澄清溶液中逐滴加入1.0mL正庚烷,边滴加边搅拌至有固体析出,离心、过滤、洗涤,30℃真空干燥即制得A型晶型。方法2:称取15mg式1a化合物于20mL反应瓶中,加入0.2mL丙酮溶解,然后向该澄清溶液中缓慢滴加1.0mL正庚烷,分离出析出的沉淀,洗涤,30℃真空干燥制得A型晶型。方法3:称取15mg式1a化合物于20mL反应瓶中,加入0.5mL乙酸乙酯溶解,然后向该澄清溶液中缓慢滴加1.0mL正庚烷,分离出析出的沉淀,洗涤,30℃真空干燥制得A型晶型。方法4:称取15mg式1a化合物于20mL反应瓶中,加入0.2mL四氢呋喃溶解,然后向该澄清溶液中缓慢滴加1.0mL正庚烷,分离出析出的沉淀,洗涤,30℃真空干燥制得A型晶型。方法5:称取15mg式1a化合物于20mL反应瓶中,加入0.3mL二氯甲烷溶解,然后向该澄清溶液中缓慢滴加1.0mL正庚烷,分离出析出的沉淀,洗涤,30℃真空干燥制得A型晶型。方法6:取15mg式1a化合物于20mL反应瓶中,加入0.3mL氯仿溶解,然后向该澄清溶液中缓慢滴加1.5mL甲苯,分离出析出的沉淀,洗涤,30℃真空干燥制得A型晶型。方法7:称取10mg式1a化合物于3mL小瓶中,然后将3mL小瓶置于装有3mL乙酸乙酯的20mL玻璃瓶中,密封后室温下静置7天,收集固体,洗涤,30℃真空干燥制得A型晶型。方法8:称取10mg式1a化合物于3mL小瓶中,然后将3mL小瓶置于装有2mL氯仿的20mL玻璃瓶中,密封后室温下静置7天,收集固体,洗涤,30℃真空干燥制得A型晶型。方法9:称取15mg式1a化合物于1.5mL玻璃瓶中,加入0.5mL甲基异丁基酮制得悬浮液,室温下搅拌3天后离心分离固体,洗涤,30℃真空干燥制得A型晶型。方法10:称取15mg式1a化合物于1.5mL玻璃瓶中,加入0.5mL乙酸异丙酯制得悬浮液,室温下搅拌3天后离心分离固体,洗涤,30℃真空干燥制得A型晶型。方法11:称取15mg式1a化合物于1.5mL玻璃瓶中,加入0.5mL体积比为1:5的1,4-二氧六环和甲苯的混合溶液,将得到的悬浮液在50℃下搅拌3天后,离心分离固体,洗涤,30℃真空干燥制得A型晶型。方法12:称取30mg式1a化合物于3mL玻璃瓶中,加入1.0mL甲基异丁基酮,50℃下搅拌2h后过滤,将滤液以0.1℃/min的速度从50℃降温至5℃并在5℃恒温,分离所得固体,洗涤,30℃真空干燥制得A型晶型。方法13:称取30mg式1a化合物于3mL玻璃瓶中,加入3.5mL乙酸异丙酯,50℃下搅拌2h后过滤,将滤液以0.1℃/min的速度从50℃降温至5℃并在5℃恒温,分离所得固体,洗涤,30℃真空干燥制得A型晶型。方法14:称取15mg式1a化合物于3mL小瓶中,加入0.3mL二氯甲烷震荡溶清后加入2mg等质量混合的聚乙烯吡咯烷酮、聚乙烯醇、聚氯乙烯、聚乙酸乙烯酯、羟丙基甲基纤维素和甲基纤维素,使用封口膜盖住小瓶并在上面扎3-4个小孔。置于室温条件下挥发,分离所得固体,洗涤,30℃真空干燥制得A型晶型。方法15:用2.0mL乙酸异丙酯溶清15mg式1a化合物,得到的澄清溶液用扎孔的封口膜盖住,室温下放置14天,分离所得固体,洗涤,30℃真空干燥制得A型晶型。方法16:称取15mg式1a化合物于3mL小瓶中,加入2.5mL体积比为4:1的二氯甲烷/正庚烷的混合溶剂体系中,震荡得到的澄清溶液,用封口膜盖住小瓶并在上面扎孔,室温下放置4天,分离所得固体,洗涤,30℃真空干燥制得A型晶型。方法17:称取15mg式1a化合物于3mL小瓶中,加入5mL体积比为2:1的二氯甲烷/正庚烷的混合溶剂体系中,震荡得到的澄清溶液,用封口膜盖住小瓶并在上面扎孔,室温下放置6天,分离所得固体,洗涤,30℃真空干燥制得A型晶型。方法18:称取15mg式1a化合物于3mL小瓶中,加入0.5mL异丙醇溶清,将3mL小瓶敞口置于装有3mL正庚烷的20mL玻璃瓶中,密封并于室温下静置,3天后分离所得固体,洗涤,30℃真空干燥制得A型晶型。方法19:称取15mg式1a化合物于3mL小瓶中,加入0.4mL氯仿溶清,将3mL小瓶敞口置于装有3mL正庚烷的20mL玻璃瓶中,密封并于室温下静置,3天后分离析出的固体,洗涤,30℃真空干燥制得A型晶型。上述不同方法制备得到的A型晶型为溶剂合物,XRPD图谱一致。在不同的溶剂体系中结晶得到的化合物分子中含有不同的溶剂分子,所述的溶剂分子包含乙酸异丙酯、甲苯、二异丙醚、正庚烷等。式1a化合物的绝对构型通过单晶X-射线衍射测试确定,检测仪器为AgilentSuper单晶衍射仪,测试条件为铜靶、管压40kv、管流40mA,晶体结构解析方法为直接法(SHELXTL和OLEX2)。上述实施例2中方法17得到的产物为质量好的晶体,对其进行单晶X-射线衍射数据收集并解析其单晶结构。表1列出了式1a化合物正庚烷溶剂合物的单晶结构数据和结构精修参数。单晶结构解析确定了式1a化合物中的手性中心的绝对构型,即如图6所示,P1(S),C20(R),C21(R),C22(R)C24(R),C13(S)。其不对称结构单元中,包含两个式1a化合物分子和两个正庚烷分子。图7为晶体的单胞示意图,该晶体的每个单胞包含四个式1a化合物分子和四个正庚烷溶剂分子,相邻的式1a化合物分子之间通过分子间氢键相互连接,从而使得在b-轴方向上形成正方形管状孔道,正庚烷溶剂分子填充在孔道中,最终形成了式1a化合物的管道溶剂合物晶体。表1该A型晶型的X-射线粉末衍射谱图参见图4,使用Cu-Ka辐射,以2θ角度表示X-射线粉末衍射图,在约5.11°、6.95°、7.38°、10.24°、11.65°、15.26°、15.96°、17.63°、18.20°、18.50°、20.16°、20.87°、21.75°、23.09°、25.22°、26.54°、29.74°处显示有特征峰。将图4中的2θ、晶面间距d值以及峰的相对强度列于表2。峰值强度取决于样品形态及粒度,且有所变化,其中低强度峰值(强度小于20%)在某些情况下可能不存在。表2:式1a化合物的A型晶型的XRD图谱详情实施例3(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯F型晶型的制备方法1:称取15mg式1a化合物于3mL小瓶中,加入0.4mL丙酮溶清,将3mL小瓶敞口置于装有3mL甲苯的20mL玻璃瓶中,密封并于室温下静置,3天后离心分离所得固体,洗涤,30℃真空干燥制得F型晶型。方法2:称取15mg式1a化合物于3mL小瓶中,加入0.3mL二氯甲烷溶清,将3mL小瓶敞口置于装有3mL甲苯的20mL玻璃瓶中,密封并于室温下静置,3天后离心分离所得固体,洗涤,30℃真空干燥制得F型晶型。该F型晶型的X-射线粉末衍射谱图参见图5,使用Cu-Ka辐射,以2θ角度表示X-射线粉末衍射图,在约5.18°、5.35°、6.29°、6.81°、7.62°、10.33°、10.73°、11.76°、15.14°、15.44°、16.76°、17.44°、18.11°、20.28°、20.60°、20.79°、23.39°、25.34°、26.58°处显示有特征峰。将图5中的2θ、晶面间距d值以及峰的相对强度列于表3。峰值强度取决于样品形态及粒度,且有所变化,其中低强度峰值(强度小于20%)在某些情况下可能不存在。表3:式1a化合物的F型晶型的XRD图谱详情实施例4:(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯A0型晶型的制备方法1:将按照本发明实施例3中方法1至19任意一种方法制备得到的A型晶型60℃真空干燥24h,即制得A0型晶型。方法2:将本发明实施例4中方法1或2制备得到的F型晶型室温下静置3个月即制得A0型晶型。方法3:按照实施例1方法1至19任意一种重结晶方法进行结晶,将过滤洗涤得到的固体60℃真空干燥24h,即制得A0型晶型。该A0型晶型的X-射线粉末衍射谱图参见图1,使用Cu-Ka辐射,以2θ角度表示X-射线粉末衍射图,在约5.03°、5.44°、6.99°、10.18、15.23°、16.00、17.58、18.12、18.45、20.13、20.87处有特征峰。在将图1中的2θ、晶面间距d值以及峰的相对强度列于表4。峰值强度取决于样品形态及粒度,且有所变化,其中低强度峰值(强度小于20%)在某些情况下可能不存在。表4:式1a化合物的A0型晶型的XRD图谱详情峰序号2θ(°)计数d值强度(%)15.0355217.5710025.4436816.2266.736.9937212.6467.4410.181958.6935.3515.234175.8175.5616.002795.5450.6717.582665.0448.1818.123984.8972.2918.453104.8156.31020.132804.4150.81120.872454.2544.41226.431363.3724.61329.42983.0317.71433.05752.7113.5式1a化合物的A0型晶型的DSC图谱(参见图2)显示样品分解前在87.31℃有一吸热峰,TGA结果(参见图3)显示将样品加热至100℃无重量丢失,在约242.39℃处开始分解。实验例1本发明的式1a化合物化合物的抗HCV-1b复制子活性检测参照中国专利申请CN105985355A公开的方法检测本发明的化合物抗HCV-1b复制子的活性。具体测试步骤见CN105985355A的实施例1,该篇专利申请以其全部内容引入本文作为参考。如CN105985355A中所述,HCV1b复制子细胞,即稳定转入HCV基因型1b复制子的Huh7细胞系,由药明康德(上海)新药开发有限公司提供。以上实施例制备的本发明的化合物,每个化合物用100%DMSO配制成10mM母液后,用含0.5%DMSO的完全培养液稀释至10μM,然后依次3倍稀释,共10个浓度。HCV-1b复制子细胞每孔接种8X103个细胞,在37℃,5%CO2培养箱中培养3天。实验重复三次。实验结果显示,本发明的式1a化合物对HCV1b复制子的EC50值为0.036μM,明显优于式1化合物的EC50值0.120μM。在测定浓度范围内,本发明的式1a化合物没有显示出细胞毒性,CC50值大于最高检测浓度10μM。实验例2本发明的化合物的抗HCV-1a复制子活性检测参照中国专利申请CN105985355A实施例2的方法检测本发明的化合物抗HCV-1a复制子的活性。如CN105985355A中所述,HCV1a复制子细胞,即稳定转入HCV基因型1a复制子的Huh7细胞系,由药明康德(上海)新药开发有限公司提供。以上实施例制备的本发明的化合物,每个化合物用100%DMSO配制成10mM母液后,用含0.5%DMSO的完全培养液稀释至10μM,然后依次3倍稀释,共10个浓度。HCV-1a复制子细胞每孔接种8X103个细胞,在37℃,5%CO2培养箱中培养3天。实验重复三次。实验结果显示,本发明的式1a化合物对HCV1a复制子的EC50值为0.01μM,明显优于式1化合物的EC50值0.05μM。在测定浓度范围内,本发明的式1a化合物没有显示出细胞毒性,其对HCV1a复制子的CC50值>10μM。从以上实验可以看出,本发明的化合物对丙肝病毒1b亚型和1a亚型表现出良好的抑制活性,同时对宿主细胞具有非常低的毒性,有效性高,安全性好,适合用于治疗和/或预防与HCV感染相关的疾病。实验例3(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯的A0型晶型的稳定性研究称取2份0.5gA0型晶型开口平铺于称量瓶中,分别敞口放置于25℃/60%相对湿度(RH)、40℃/75%相对湿度(RH)条件下,并于0天、第1月、第2月、第3个月、第6个月取样,分别通过XRPD和HPLC测试样品晶型和纯度的变化,结果见表5。表5:条件HPLC纯度(area%)晶型变化25℃/60%RH0天99.40%晶型A025℃/60%RH3月99.20%晶型未发生变化25℃/60%RH6月99.20%晶型未发生变化40℃/75%RH0天99.40%晶型A040℃/75%RH1月99.50%晶型未发生变化40℃/75%RH2月99.40%晶型未发生变化40℃/75%RH3月99.80%晶型未发生变化40℃/75%RH6月98.75%晶型未发生变化上述实验结果表明,A0型晶型在25℃/60%RH、40℃/75%RH下放置六个月前后晶型不变,且纯度没有下降,该A0型晶型具有良好物理化学稳定性。尽管以上已经对本发明作了详细描述,但是本领域技术人员理解,在不偏离本发明的精神和范围的前提下可以对本发明进行各种修改和改变。本发明的权利范围并不限于上文所作的详细描述,而应归属于权利要求书。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1