双功能磷酸转酮酶-磷酸转乙酰酶融合多肽的制作方法
本申请要求2016年12月16日提交的美国临时申请序列号62/435,212;2017年6月16日提交的美国临时申请序列号62/520,604;以及2017年9月11日提交的美国临时申请序列号62/556,788的权益,这些临时申请各自通过引用以其全部内容结合在此。本发明的组合物和方法涉及双功能磷酸转酮酶-磷酸转乙酰酶融合多肽及其在淀粉水解过程中用于醇生产的用途。
背景技术:
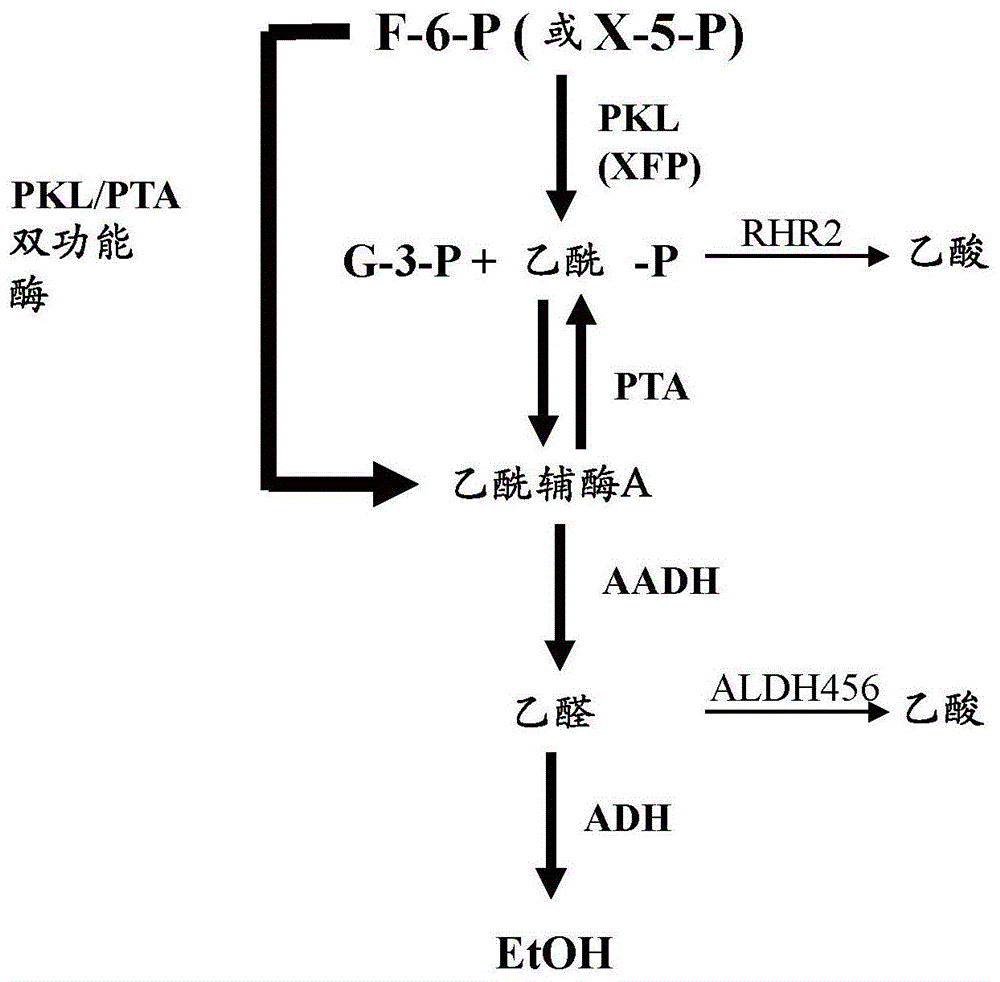
:基于酵母的乙醇生产是基于糖向乙醇的转化。当前通过此方法实现的年燃料乙醇产量在世界范围内为约900亿升。据估计,乙醇生产成本的约70%是原料。因为乙醇生产量如此之大,所以甚至小的产率提升对于该产业也具有巨大的经济影响。一摩尔葡萄糖转化为两摩尔乙醇和两摩尔二氧化碳是氧化还原中性的,其最大理论产率为约51%。当前的工业产率为约45%;因此,存在增加乙醇产量的机会。二氧化碳、甘油和酵母生物质是乙醇发酵的主要副产物。在酵母生长和发酵期间,生成过剩的nadh,其用于产生甘油以用于氧化还原平衡和渗透保护的目的。甘油被认为是低价值产品,并且已采用若干种方法来减少甘油产生。然而,减少甘油合成可能导致其他代谢副产物诸如乙酸的增加。乙酸是不期望的副产物,因为它不利地影响乙醇生产速率、效价和酵母发酵的产率。需要改变酵母代谢途径来最大化乙醇产量,同时不增加不期望的途径副产物诸如乙酸的产生。技术实现要素:本发明的组合物和方法涉及双功能磷酸转酮酶-磷酸转乙酰酶融合多肽及其在淀粉水解过程中用于乙醇生产的用途。所述组合物和方法的方面和实施例描述于以下独立编号的段落中。1.在一方面,提供了一种重组融合多肽,所述重组融合多肽包含与具有磷酸转乙酰酶活性的第二氨基酸序列融合的具有磷酸转酮酶活性的第一氨基酸序列,其中当在细胞中表达时,所述融合多肽能够将果糖-6-p(f-6-p)和/或木酮糖-5-p(x-5-p)转化为乙酰辅酶a。2.在段落1的融合多肽的一些实施例中,所述第一氨基酸序列和所述第二氨基酸序列经由接头肽融合。3.在段落1或2的融合多肽的一些实施例中,所述第一氨基酸序列存在于所述融合多肽的n-末端处,并且第二氨基酸序列存在于所述融合多肽的n-末端处。4.在段落1或2的融合多肽的一些实施例中,所述第二氨基酸序列存在于融合多肽的n-末端处,并且第一氨基酸序列存在于所述融合多肽的n-末端处。5.在前述段落中任一项的融合多肽的一些实施例中,所述第一氨基酸序列是来自阴道加德纳菌(gardnerellavaginalis)的磷酸转酮酶。6.在前述段落中任一项的融合多肽的一些实施例中,所述第二氨基酸序列是来自植物乳杆菌(lactobacillusplantarum)的磷酸转乙酰酶。7.在另一方面,提供了一种质粒,所述质粒包含编码如前述段落中任一项所述的融合多肽的dna序列。8.在另一方面,提供了酵母细胞,所述酵母细胞包含编码如段落1-7中任一项所述的融合多肽的dna序列。9.在另一方面,提供了酵母细胞,所述酵母细胞表达如段落1-7中任一项所述的融合多肽。10.在段落9的酵母细胞的一些实施例中,所述酵母细胞不额外地表达具有磷酸转酮酶和/或磷酸转乙酰酶活性的单独多肽。11.在另一方面,提供了一种用于在发酵期间增加醇生产的方法,所述方法包括将碳水化合物底物与表达重组融合多肽的经修饰的酵母细胞接触,所述重组融合多肽包含与具有磷酸转乙酰酶活性的第二氨基酸序列融合的具有磷酸转酮酶活性的第一氨基酸序列;并且使所述酵母从所述碳水化合物底物产生更多醇;其中,所述酵母比表达相同的第一多肽和相同的第二多肽为单独分子的可比酵母细胞产生更少的乙酸。12.在另一方面,提供了一种用于在醇发酵期间减少乙酸产生的方法,所述方法包括将碳水化合物底物与表达重组融合多肽的经修饰的酵母细胞接触,所述重组融合多肽包含与具有磷酸转乙酰酶活性的第二氨基酸序列融合的具有磷酸转酮酶活性的第一氨基酸序列;并且使所述酵母从所述碳水化合物底物产生醇;其中,所述酵母比表达相同的第一多肽和相同的第二多肽为单独分子的可比酵母细胞产生更少的乙酸。13.在另一方面,提供了一种用于减少具有外源磷酸转酮酶途径的酵母细胞的乙酸产生的方法,所述方法包括在经修饰的酵母细胞中产生重组融合多肽,所述重组融合多肽包含与具有磷酸转乙酰酶活性的第二氨基酸序列融合的具有磷酸转酮酶活性的第一氨基酸序列。14.在段落13的方法的一些实施例中,所述经修饰的酵母细胞比表达相同的第一多肽和相同的第二多肽为单独分子的可比酵母产生更少的乙酸。15.在段落11-14中任一项的方法的一些实施例中,所述经修饰的酵母细胞比表达相同的第一多肽和相同的第二多肽为单独分子的可比酵母产生至少10%更少的乙酸。16.在另一方面,提供了一种用于增加包含编码葡糖淀粉酶的异源基因的酵母中的葡糖淀粉酶表达的方法,所述方法包括在所述酵母中额外地表达重组融合多肽,所述重组融合多肽包含与具有磷酸转乙酰酶活性的第二氨基酸序列融合的具有磷酸转酮酶活性的第一氨基酸序列;其中,所述酵母与产生具有磷酸转酮酶和/或磷酸转乙酰酶活性的单独分子的在其他方面相同的酵母相比在发酵期间产生增加量的葡糖淀粉酶。17.在段落11-16中任一项的方法的一些实施例中,所述经修饰的酵母细胞不产生具有磷酸转酮酶和/或磷酸转乙酰酶活性的单独分子。18.在段落11-17中任一项的方法的一些实施例中,所述经修饰的细胞是如段落8-10中任一项所述的酵母。根据包括附图的说明书,本发明的经修饰的细胞和方法的这些和其他方面以及实施例将是清楚的。附图说明图1是用于由糖产生乙醇和乙酸的工程化的磷酸转酮酶途径的图。图2是磷酸转酮酶和磷酸转乙酰酶融合蛋白1(gvpkl-l1-lppta;seqidno:5)的氨基酸序列。在所述融合蛋白中,gvpkl位于n-末端处,lppta位于c-末端处,并且接头1(l1)位于两者之间,以粗体斜体指示。图3是质粒pzk41w-glaf12的图谱。pzk41w-glaf22是相似的,但具有不同的接头。图4是磷酸转酮酶和磷酸转乙酰酶融合蛋白2(gvpkl-l2-lppta;seqidno:6)的氨基酸序列。在所述融合蛋白中,gvpkl位于n-末端处,lppta位于c-末端处,并且接头2(l2)位于两者之间,以粗体斜体指示。图5是质粒pzk41w-(h3c19)的图谱。图6是质粒ptopoii-bluntura3-loxp-kanmx-loxp-ura3的图谱。图7是来自质粒ptopoii-bluntura3-loxp-kanmx-loxp-ura3的2,018-bpecori片段的图谱。图8是质粒pgal-cre-316的图谱。图9是来自质粒pzk41w-glaf12的swai片段的图谱图10是来自质粒pzk41w-glaf22的swai片段的图谱图11是来自质粒pzk41w-(h3c19)的swai片段的图谱图12a和图12b是示出在32℃和36℃使用液化物作为底物的摇瓶测定中,菌株pol-sc-00675(●)、pol-sc-0692(○)、pol-sc-0696(δ)和pol-sc-00699(▲)的性能比较的图。表达融合的pkl-pta多肽的菌株由实心符号表示,并且表达pka和pta的两种单独多肽的菌株由空心符号表示。图13是示出在32℃和36℃使用非液化的玉米粉作为底物的摇瓶测定中,菌株pol-sc-0696(δ)和pol-sc-00699(▲)的性能比较的图。表达融合的pkl-pta多肽的菌株由实心符号表示,并且表达pka和pta的两种单独多肽的菌株由空心符号表示。具体实施方式i.定义在详细地描述本发明的酵母菌株和方法之前,为了清楚起见定义以下术语。未定义的术语应当符合相关领域中所使用的常规含义。如本文所使用的,“醇”是指其中羟基官能团(-oh)与饱和碳原子键合的有机化合物。如本文所使用的,“酵母细胞”酵母菌株,或简称“酵母”是指来自子囊菌门和担子菌门的生物。示例性酵母是来自酵母目的芽殖酵母。酵母的具体实例是酵母属物种,包括但不限于酿酒酵母(s.cerevisiae)。酵母包括用于生产燃料醇的生物以及用于生产可饮用醇的生物,包括用于制备独特味道的啤酒、葡萄酒、和其他发酵饮料的特种和专有酵母菌株。如本文所使用的,短语“工程化的酵母细胞”、“变体酵母细胞”、“经修饰的酵母细胞”、或相似短语是指包括本文所述的基因修饰和特征的酵母。变体/经修饰的酵母不包括天然存在的酵母。如本文所使用的,术语“多肽”和“蛋白”(以及它们各自的复数形式)可互换地使用,是指包含通过肽键连接的氨基酸残基的任何长度的聚合物。本文所使用的氨基酸残基的常规一字母或三字母代码,并且所有序列均从n-末端到c-末端方向进行呈现。聚合物可以包含经修饰的氨基酸,并且它可以被非氨基酸中断。所述术语还涵盖已经自然地或通过干预被修饰的氨基酸聚合物;所述修饰是例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化、或任何其他操纵或修饰,诸如与标记组分轭合。所述定义中还包括,例如,包含一种或多种氨基酸类似物(包括例如,非天然氨基酸等)以及本领域已知的其他修饰的多肽。如本文所使用的,功能上和/或结构上相似的蛋白质被认为是“相关蛋白”。这类蛋白质可以衍生自不同属和/或物种的生物体,或不同纲的生物体(例如,细菌和真菌),或者是人工设计的蛋白质。相关蛋白还涵盖通过一级序列分析确定的、通过二级或三级结构分析确定的、或者通过免疫交叉反应性确定的同源物。如本文所使用的,术语“同源蛋白”是指与参考蛋白具有相似活性和/或结构的蛋白。这并不旨在意味着同源物必定与进化相关。因此,所述术语旨在涵盖从不同生物体获得的相同、相似、或相应(即,在结构和功能方面)的一种或多种酶。在一些实施例中,希望鉴定与参考蛋白具有相似的三级、二级和/或一级结构的同源物。在一些实施例中,同源蛋白诱导与参考蛋白相似的一种或多种免疫应答。在一些实施例中,将同源蛋白工程化以产生具有一种或多种所需活性的酶。序列之间的同源性程度可以使用本领域已知的任何合适的方法确定(参见,例如,smith和waterman(1981)adv.appl.math.[应用数学进展]2:482;needleman和wunsch(1970)j.mol.biol.[分子生物学杂志],48:443;pearson和lipman(1988)proc.natl.acad.sci.usa[美国科学院院报]85:2444;威斯康星遗传学软件包(wisconsingeneticssoftwarepackage)(威斯康星州麦迪逊遗传学电脑集团(geneticscomputergroup,madison,wi))中的诸如gap、bestfit、fasta、和tfasta等的程序;以及devereux等人(1984)nucleicacidsres.[核酸研究]12:387-95)。例如,pileup是确定序列同源性水平的有用程序。pileup使用渐进的、两两比对创建了来自一组相关序列的多重序列比对。它还可以标绘显示用于创建所述比对的聚类关系的一个树。pileup使用feng和doolittle的渐进比对方法的简化(feng和doolittle(1987)j.mol.evol.[分子进化杂志]35:351-60)。所述方法类似于higgins和sharp描述的方法((1989)cabios5:151-53)。有用的pileup参数包括为3.00的默认空位权重,为0.10的默认空位长度权重,以及加权的末端空位。有用算法的另一个实例是blast算法,由以下描述:altschul等人((1990)j.mol.biol.[分子生物学杂志]215:403-10)以及karlin等人((1993)proc.natl.acad.sci.usa[美国科学院院报]90:5873-87)。一个特别有用的blast程序是wu-blast-2程序(参见,例如,altschul等人(1996)meth.enzymol.[酶学方法]266:460-80)。参数“w”、“t”、以及“x”确定了所述比对的灵敏度与速度。所述blast程序使用字长(w)为11、blosum62得分矩阵(参见,例如,henikoff和henikoff(1989)proc.natl.acad.sci.usa[美国科学院院报]89:10915)比对(b)为50、期望值(e)为10、m’5、n’-4、以及两条链的比较作为默认值。如本文所使用的,在至少两个核酸或多肽的上下文中,短语“基本上相似”和“基本上相同”典型地意指多核苷酸或多肽包含与参考(即,野生型)序列相比具有至少约70%同一性、至少约75%同一性、至少约80%同一性、至少约85%同一性、至少约90%同一性、至少约91%同一性、至少约92%同一性、至少约93%同一性、至少约94%同一性、至少约95%同一性、至少约96%同一性、至少约97%同一性、至少约98%同一性、或甚至至少约99%同一性、或更高同一性的序列。使用具有默认参数的clustalw算法计算序列同一性百分比。参见thompson等人(1994)nucleicacidsres.[核酸研究]22:4673-4680。clustalw算法的默认参数是:空位开放罚分:10.0空位延伸罚分:0.05蛋白质权重矩阵:blosum系列dna权重矩阵:iub延迟发散序列%:40空位分隔距离:8dna转换权重:0.50列表亲水残基:gpsndqekr使用负性矩阵:关切换特殊残基罚分:开切换亲水罚分:开切换结束空位分隔罚分:关两个多肽基本上相同的另一个指示是第一多肽与第二多肽具有免疫交叉反应性。典型地,差别在于保守氨基酸取代的多肽具有免疫交叉反应性。因此,多肽与第二多肽基本上相同,例如,其中两个肽仅相差保守取代。两个核酸序列基本上相同的另一个指示是两个分子在严格条件下(例如,在中等至高严格的范围内)彼此杂交。如本文所使用的,术语“基因”与术语“等位基因”同义,是指编码和指导蛋白或rna表达的核酸。丝状真菌的营养体形式通常是单倍体,因此指定基因的单拷贝(即,单个等位基因)足以赋予指定表型。如本文所使用的,术语“表达多肽”和相似术语是指使用细胞的翻译机器(例如,核糖体)产生多肽的细胞过程。如本文所使用的,关于两个多肽的术语“融合的”和“融合”是指致使多肽变成单个分子的物理键合。如本文所使用的,术语“野生型”和“天然的”可互换使用,并是指天然发现的基因、蛋白质或菌株。如本文所使用的,术语“目的蛋白”是指希望在经修饰的酵母中表达的多肽。这种蛋白质可以是酶、底物结合蛋白、表面活性蛋白、结构蛋白、选择性标记等,并且可以高水平表达。目的蛋白由相对于亲本菌株的经修饰的内源基因或异源基因(即,目的基因)编码。目的蛋白可以在细胞内表达或作为分泌的蛋白质表达。如本文所使用的,“基因缺失”是指所述基因从宿主细胞的基因组中去除。当基因包括与基因编码序列不紧邻的控制元件(例如,增强子元件)时,基因的缺失是指编码序列、以及任选地相邻增强子元件(例如,包括但不限于启动子和/或终止子序列)的缺失,但未要求非相邻控制元件的缺失。如本文所使用的,“基因的破坏”泛指任何基本上阻止宿主细胞中细胞产生功能性基因产物(例如,蛋白质)的基因或化学操作(即,突变)。示例性破坏方法包括基因的任何部分的完全或部分(包括多肽编码序列、启动子、增强子、或另外的调节元件)缺失、或其诱变,其中诱变涵盖取代、插入、缺失、倒位、及其组合和变化,任何这些突变基本上阻止功能基因产物的产生。也可以使用rnai、反义、或任何其他消除基因表达的方法破坏基因。可以通过非相邻控制元件的缺失或基因操作来破坏基因。如本文所使用的,术语“基因操作”和“基因改变”可互换使用,并且是指核酸序列的改变/变化。改变可以包括但不限于核酸序列中至少一种核酸的取代、缺失、插入或化学修饰。如本文所使用的,“功能性多肽/蛋白”是具有活性(诸如酶活性、结合活性、表面活性特性等)的蛋白质,并且其未被诱变、截短、或以其他方式修饰而消除或减少此活性。如所指出的,功能性多肽可以是热稳定的或不耐热的。如本文所使用的,“功能性基因”是能够被细胞组分用于产生活性基因产物(典型地是蛋白质)的基因。功能性基因是破坏的基因的对立体,破坏的基因被修饰使得它们不能被细胞组分用于产生活性基因产物,或者具有降低的被细胞组分用于产生活性基因产物的能力。如本文所使用的,如果已对酵母细胞进行基因或化学改变以防止产生表现出野生型蛋白质的活性特征的功能性蛋白质/多肽,则对所述酵母细胞已经进行了“修饰以防止产生指定蛋白质”。这类修饰包括但不限于编码蛋白质(如本文所述的)的基因的缺失或破坏、使得编码的多肽缺乏前述活性的基因修饰、影响翻译后加工或稳定性的基因修饰、及其组合。如本文所使用的,“途径的减弱”或“通过途径的通量的减弱”(即,生物化学途径),泛指通过代谢途径减少或完全阻止生物化学底物或中间产物的通量的任何基因或化学操作。可以通过各种众所周知的方法实现途径的减弱。这类方法包括但不限于:完全或部分缺失一个或多个基因、用编码具有降低的催化活性或增加的km值的酶的突变体形式替代这些基因的野生型等位基因、修饰启动子或控制一个或多个基因表达的其他调控元件、针对降低的稳定性工程化这些酶或编码这些酶的mrna、将酶错误指导进不太可能与底物和中间产物相互作用的细胞区室、使用干扰rna等。如本文所使用的,“需氧发酵”是指在氧存在下的生长。如本文所使用的,“厌氧发酵”是指在不存在氧的情况下的生长。如本文所使用的,单数冠词“一种(a)”、“一种(an)”以及“所述”涵盖复数个指示物,除非上下文中另外明确指明。本文引用的所有参考文献均通过引用以其全部内容结合在此。除非另有说明,以下缩写/首字母缩略词具有以下含义:ec酶学委员会pkl磷酸转酮酶pta磷酸转乙酰酶xfp木酮糖5-磷酸/果糖6-磷酸磷酸转酮酶aadh乙醛脱氢酶adh醇脱氢酶etoh乙醇aaα-淀粉酶ga葡糖淀粉酶℃摄氏度bp碱基对dna脱氧核糖核酸dp聚合度ds或ds干固体g或gm克g/l克/升gau/gds葡糖淀粉酶单元/克干固体h2o水hplc高效液相色谱hr或h小时kg千克m摩尔mg毫克ml或ml毫升ml/min毫升/分钟mm毫摩尔n正常nm纳米od光密度pcr聚合酶链式反应ppm份/百万份sscu/gds真菌α-淀粉酶单元/克干固体δ与缺失有关μg微克μl和μl微升μm微摩尔ssf同时糖化和发酵mtp微量滴定板ii.产生双功能pkl-pta融合多肽的工程化酵母细胞先前已经描述了具有异源磷酸转酮酶途径的工程化酵母细胞(例如,wo2015148272)。这些细胞表达异源磷酸转酮酶(pkl;ec4.1.2.9)和磷酸转乙酰酶(pta;ec2.3.1.8),任选地具有其他酶,以使碳通量远离甘油途径导向,并且朝向乙酰辅酶a的合成导向,所述乙酰辅酶a然后转化为乙醇(图1)。与在其他方面相同的亲本酵母细胞相比,这些细胞能够在发酵过程中增加乙醇生产。遗憾的是,这种经修饰的细胞也产生增加的乙酸,所述增加的乙酸不利地影响细胞生长并且代表碳“废物”。现在已经发现,通过对酵母细胞进行工程化以产生双功能pkl-pta融合多肽(其包括两种酶的活性部分)可以增加乙醇产率并且减少乙酸产生。与单独的酶的过表达相比,这类双功能融合多肽的过表达使乙醇产率增加、同时使乙酸产生减少多达37%。继续参考图1,并且不限于理论,据信,酵母细胞中单独的异源pkl和pta酶的表达允许产生中间产物甘油醛-3-磷酸(g-3-p)和乙酰-磷酸(乙酰-p),后者通过具有乙酰-磷酸酶活性的内源混杂甘油-3-磷酸酶(gpp1/rhr2)转化为不想要的乙酸。然而,通过表达双功能pkl-pta融合多肽,乙酰-磷酸快速转化为乙酰辅酶a,减少了乙酰-磷酸的积累,从而减少乙酸产生。因此,融合蛋白提供了用于将果糖-6-p(f-6-p)和/或木酮糖-5-p(x-5-p)有效转化为乙酰辅酶a的机制。如本文所述的实验数据证明的,根据前述假设执行pkl-pta融合多肽。这些融合多肽包括在pkl与pta多肽之间的不同接头。完全预期,使用不同的pkl和pta多肽将产生相似的结果。还预期,融合多肽内的pkl和pta多肽的取向不是关键的,并且pkl或多肽可以位于融合多肽的n-末端或c-末端处。已经在本领域中描述了多种pkl和pta酶,并且应当被认为是例示的酶的替代物。进一步预期,pkl-pta融合多肽可以在接头区域内包含另外的功能性和结构特征,包括但不限于荧光蛋白、另外的酶、抗体标签、抗生素抗性标记等,其可以在pkl-pta融合多肽的n-末端和/或c-末端,可以将pkl-pta融合多肽分开,或者可以包含在pkl-pta融合多肽的接头区域内。iii.示例性pkl和pta融合多肽在一些具体实施例中,pkl-pta融合多肽是例示的双功能pkl-pta融合多肽中的一种。所述融合多肽的设计是相对简单的,因为它们包含经由两种不同接头中的一种(即,l1或l2)连接的来自阴道加德纳菌的全长pkl(即,gvpkl)和来自植物乳杆菌的全长pta(即,lppta)。阴道加德纳菌pkl的氨基酸序列如下(seqidno:1)所示:植物乳杆菌pta的氨基酸序列如下(seqidno:2)所示:接头1(l1)的氨基酸序列如下(seqidno:3)所示:接头2(l2)的氨基酸序列如下(seqidno:4)所示:gvpkl-l1-lppta的氨基酸序列如下(seqidno:5)所示,接头以粗体和斜体示出:gvpkl-l2-lppta的氨基酸序列如下(seqidno:6)所示,接头以粗体和斜体示出:如以上建议的,预期其他pkl和pta多肽如所述起作用,包括与pkl和pta具有至少70%、至少80%、至少90%、至少95%、或更高氨基酸序列同一性的那些以及结构和功能同源物。pkl和pta是众所周知的酶,并且已经克隆和表征了大量酶。公共数据库包括许多pkl和pta序列。在一些实施例中,pkl和pta多肽包括基本上不影响多肽的结构和/或功能的取代。示例性取代是保守突变,如表1中总结的。表1.示例性氨基酸取代也预期其他接头如所述起作用,包括与接头1和接头2具有至少70%、至少80%、至少90%、至少95%、或更高氨基酸序列同一性的那些。因为两种测试的接头似乎均产生活性酶,所以认为被连接物的性质并不是关键的。然而,未来的实验可能鉴定使酶活性优化的接头。优选的接头是肽,但是也可以使用更大的接头(包括功能蛋白质)作为接头。这类接头可以例如允许分离酶,提供荧光标签,包括另外的酶活性等。理想地,接头、pkl和pta是可以使用正常翻译机器在细胞中制备的单一连续的氨基酸序列;然而,连接pkl和pta酶的原理包括将合成接头化学添加到pkl和pta多肽的可能性。在一些实施例中,表达双功能pkl-pta融合多肽的酵母比缺乏所述双功能蛋白的酵母从底物产生至少1%、至少2%、至少3%、至少4%、至少5%、或甚至至少6%更多的乙醇。在一些实施例中,表达双功能pkl-pta融合多肽的酵母比表达单独的pkl和pta多肽的酵母从底物产生至少1%、至少2%、至少3%、和甚至至少4%更多的乙醇。在一些实施例中,表达双功能pkl-pta融合多肽的酵母比表达单独的pkl和pta多肽的酵母从底物产生至少10%、至少20%、至少30%、至少40%、至少50%、或甚至至少60%更少的乙酸。在一些实施例中,含有双功能pkl-pta融合多肽的酵母比缺乏所述双功能蛋白的酵母从底物产生至少5%、至少10%、至少15%、或甚至至少20%更少的甘油。在一些实施例中,表达双功能pkl-pta融合多肽的酵母不额外地表达单独的pkl和pta多肽。在其他实施例中,表达双功能pkl-pta融合多肽的酵母也表达单独的pkl和/或pta多肽。iv.pkl-pta融合多肽表达与有益于醇生产的其他基因修饰的组合在一些实施例中,除表达双功能pkl-pta融合多肽之外,本发明的经修饰的酵母细胞包括影响乙醇生产的另外的修饰。本发明的经修饰的细胞可以进一步包括导致天然甘油生物合成途径减弱的突变,已知所述突变可增加醇生产。用于减弱酵母中甘油生物合成途径的方法是已知的,并包括例如通过破坏基因gpd1、gpd2、gpp1和/或gpp2中的一种或多种来降低或消除内源性nad依赖性甘油3-磷酸脱氢酶(gpd)或磷酸甘油磷酸酶(gpp)活性。参见例如美国专利号9,175,270(elke等人)、8,795,998(pronk等人)和8,956,851(argyros等人)。经修饰的酵母的特征可以进一步在于增加的乙酰辅酶a合酶(也称为乙酰辅酶a连接酶)活性(ec6.2.1.1)以清除(即捕获)通过化学或酶水解乙酰-磷酸产生(或出于任何其他原因存在于酵母的培养基中)的乙酸并将其转化为ac-coa。这避免了乙酸对酵母细胞生长的不良影响,并且可以进一步有助于醇产率的提高。增加乙酰辅酶a合酶活性可以通过将异源乙酰辅酶a合酶基因导入细胞、增加内源乙酰辅酶a合酶基因的表达等来实现。用于引入细胞中的特别有用的乙酰辅酶a合酶可以从鬃毛甲烷菌(uniprot/trembl登录号:wp_013718460)获得。所述酶的同源物,包括与上述来自鬃毛甲烷菌的乙酰辅酶a合酶具有至少85%、至少90%、至少92%、至少95%、至少97%、至少98%和甚至至少99%氨基酸序列同一性的酶,也可用于本发明的组合物和方法中。在一些实施例中,所述经修饰的细胞可以进一步包括编码具有nad+依赖性乙酰化乙醛脱氢酶活性的蛋白质的异源基因和/或编码丙酮酸甲酸裂解酶的异源基因。例如,在美国专利号8,795,998(pronk等人)中描述了与甘油途径减弱组合的这类基因的引入。在本发明的组合物和方法的一些实施例中,酵母特意缺乏编码乙酰化乙醛脱氢酶、丙酮酸甲酸裂解酶或两者的一种或多种异源基因。在一些实施例中,本发明的经修饰的酵母细胞可以进一步过表达糖转运蛋白样(stl1)多肽以增加甘油的摄入(参见,例如,ferreira等人,2005;等人,2015和wo2015023989a1)。在一些实施例中,本发明的经修饰的酵母细胞进一步包含丁醇生物合成途径。在一些实施例中,所述丁醇生物合成途径是异丁醇生物合成途径。在一些实施例中,所述异丁醇生物合成途径包括编码多肽的多核苷酸,所述多肽催化选自下组的底物至产物的转化,该组由以下各项组成:(a)丙酮酸至乙酰乳酸;(b)乙酰乳酸至2,3-二羟基异戊酸盐;(c)2,3-二羟基异戊酸盐至2-酮异戊酸盐;(d)2-酮异戊酸盐至异丁醛;以及(e)异丁醛至异丁醇。在一些实施例中,所述异丁醇生物合成途径包括编码具有乙酰乳酸合酶、酮酸还原异构酶、二羟酸脱水酶、酮异戊酸脱羧酶、和醇脱氢酶活性的多肽的多核苷酸。在一些实施例中,包含丁醇生物合成途径的经修饰的酵母细胞进一步包含编码具有丙酮酸脱羧酶活性的多肽的多核苷酸中的修饰。在一些实施例中,酵母细胞在编码具有丙酮酸脱羧酶活性的多肽的内源多核苷酸中包含缺失、突变、和/或取代。在一些实施例中,具有丙酮酸脱羧酶活性的多肽选自下组,该组由以下各项组成:pdc1、pdc5、pdc6、及其组合。在一些实施例中,酵母细胞进一步在编码fra2、ald6、adh1、gpd2、bdh1、和ymr226c的一种或多种内源多核苷酸中包含缺失、突变、和/或取代。v.pkl-pta融合多肽表达与其他有益突变的组合在一些实施例中,除表达双功能pkl-pta融合多肽之外,任选地与有益于醇生产的其他基因修饰组合,本发明的经修饰的酵母细胞进一步包含任何数量的编码目的蛋白质的另外目的基因。可以在基因操作之前、期间或之后引入另外的目的基因,所述基因操作导致融合多肽的表达。目的蛋白包括可选择的标记、碳水化合物加工酶、和其他商业相关多肽,包括但不限于选自下组的酶,该组由以下各项组成:脱氢酶、转酮酶、磷酸转酮酶、转醛醇酶、差向异构酶、植酸酶、木聚糖酶、β-葡聚糖酶、磷酸酶、蛋白酶、α-淀粉酶、β-淀粉酶、葡糖淀粉酶、普鲁兰酶、异淀粉酶、纤维素酶、海藻糖酶、脂肪酶、果胶酶、聚酯酶、角质酶、氧化酶、转移酶、还原酶、半纤维素酶、甘露聚糖酶、酯酶、异构酶、果胶酶、乳糖酶、过氧化物酶以及漆酶。目的蛋白可以被分泌、糖基化和以其他方式修饰。vi.经修饰的酵母用于增加醇生产的用途本发明的组合物和方法包括用于在发酵反应中使用经修饰的酵母增加醇生产的方法。这类方法不限于具体的发酵工艺。预期本发明的工程化酵母是在任何醇发酵工厂中针对常规酵母的“直接”替代。虽然主要旨在用于燃料乙醇生产,但是本发明的酵母也可以用于生产可饮用酒精,包括葡萄酒和啤酒。vii.适合修饰的酵母细胞酵母是被归类为真菌界成员的单细胞真核微生物,并且包括来自子囊菌门和担子菌门的生物。可以用于醇生产的酵母包括但不限于酵母属物种,包括酿酒酵母、以及克鲁维酵母属(kluyveromyces)、克鲁维酵母属(lachancea)和裂殖酵母属(schizosaccharomyces)物种。许多酵母菌株是可商购获得的,其中许多已被选择或基因工程化以获得所需的特征,诸如高乙醇生产、快速生长速率等。一些酵母已经被基因工程化以产生异源酶,诸如葡糖淀粉酶或α-淀粉酶。viii.底物和产物从许多碳水化合物底物(包括但不限于玉米淀粉、甘蔗、木薯和糖蜜)中生产醇是众所周知的,正如酶和化学条件以及机械方法的无数变化和改进也是如此。据信本发明的组合物和方法与这类底物和条件完全相容。鉴于本说明书,本发明的菌株和方法的这些和其他方面以及实施例对于技术人员是清楚的。以下实例旨在进一步说明但不限制菌株和方法。实例实例1材料和方法液化物制备液化物(磨细的玉米浆料)通过添加600ppm尿素、0.124sapu/gdsfermgentm2.5x(酸性真菌蛋白酶)、0.33gau/gds葡糖淀粉酶(木霉(trichoderma)葡糖淀粉酶变体)以及1.46sscu/gdsgc626(曲霉(aspergillus)α-淀粉酶)、调整至ph4.8来制备。非液化的玉米粉底物制备通过将脱盐水添加到通过研磨干燥玉米谷粒获得的玉米粉并且将ph调整至4.8来制备非液化玉米粉。此外,添加600ppm尿素、0.124sapu/gdsfermgentm2.5x(酸性真菌蛋白酶)、0.22mg/gdstrga(木霉葡糖淀粉酶)和0.033mg/gdsacaa(曲霉α-淀粉酶)。血清瓶测定向在24孔板中的2mlypd接种酵母细胞,并且使细胞生长过夜以达到25-30之间的od。将2.5ml液化物等份加入血清瓶(chemglass公司,目录号:cg-4904-01),并且将酵母添加到每个小瓶,达到约0.4-0.6的最终od。旋拧小瓶的盖子,并且用针(bd公司,目录号:305111)刺穿以用于通风(以释放co2),然后在振荡(200rpm,持续65小时)下在32℃孵育。ankom测定将300μl浓缩的酵母过夜培养物添加到填充有30g制备的液化物的多个ankom瓶中的每个,以达到0.3的最终od。然后将所述瓶在振荡(150rpm)下在32℃孵育65小时。摇瓶测定将500μl浓缩的酵母过夜培养物添加到填充有100g制备的液化物或非液化底物的多个摇瓶中的每个,以达到0.1的最终od。将所述瓶在振荡(170rpm)下在32℃或36℃孵育,在用液化物进行ssf的情况下孵育66小时,或者在非液化玉米粉的情况下孵育90小时。hplc分析通过在14,000rpm下离心12分钟在eppendorf管中采集来自血清瓶和ankom实验的样品。将上清液用0.2μmptfe过滤器过滤,并且然后在以下条件下用于hplc(agilenttechnologies1200系列)分析:bio-radaminexhpx-87h柱,运行温度为55℃。0.6ml/min等度流速,0.01nh2so4,2.5μl注射体积。使用校准标准物用于定量乙酸、乙醇、甘油、和葡萄糖。通过在14,000rpm下离心15分钟在eppendorf管中采集来自摇瓶实验的样品。使用5mmh2so4并在95℃下孵育5min来将上清液稀释11倍。在冷却之后,将样品用0.2μmcorningfiltrexcls3505过滤器过滤,并且然后用于hplc分析。将10μl注入配备有折射率检测器的agilent1200系列hplc中。所使用的分离柱是phenomenexrezex-rfqfastacidh+(8%)柱。流动相为5mmh2so4,并且在85℃下流速为1.0ml/min。使用来自bionanalytical的hplc校准标准混合物用于定量乙酸、乙醇、甘油、和葡萄糖。值以g/l表达。生长确定将含有500μlypd的2ml96孔板接种20μl浓缩的酵母过夜培养物以达到0.1的od。将mtp在振荡(150rpm)下在32℃或36℃孵育24小时。将酵母培养物在脱盐水中稀释50倍以在500μl体积平底透明板(greinerbio-one655101)中达到100μl的最终体积。在660nm的波长下测量od。用于酶活性确定的样品制备为了确定在摇瓶测定中由在32℃在ypd培养基上和在液化物上生长的酵母菌株分泌的葡糖淀粉酶的酶活性,将1ml体积的样品在14,000rpm下离心10分钟。将上清液用0.2μmcorningfiltrextmcls3505过滤器过滤,并且用于酶活性测定。酶活性测定为了确定分泌的葡糖淀粉酶的酶活性,将10μl样品与90μl8%(重量/重量)麦芽糖糊精dp4-7(sigma):50mmnacl缓冲液ph4.3(比率5:4)溶液混合并且在32℃孵育30min。根据供应商的说明书使用d-葡萄糖测定试剂盒(gopod形式;megazyme公司)确定释放的葡萄糖。使用木霉葡糖淀粉酶作为标准物。值以ppm表达。实例2具有pkl-pta融合基因1的质粒pzk41w-glaf12合成磷酸转酮酶和磷酸转乙酰酶融合基因1gvpkl-l1-lppta包含用合成接头l1(seqidno:3)接合的针对来自阴道加德纳菌的磷酸转酮酶(gvpkl;seqidno:1)和来自植物乳杆菌的磷酸转乙酰酶(lppta;seqidno:2)的密码子优化的编码区。所得的融合多肽的氨基酸序列在图2中示出(seqidno:5),接头区域以粗体斜体示出:图3所示的质粒pzk41w-glaf12含有三个盒以表达gvpkl-l1-lppta融合多肽、来自desulfospirajoergensenii的乙酰化乙醛脱氢酶(djaadh)和来自鬃毛甲烷菌的乙酰辅酶a合酶(mcacs)。djaadh和mcacs两者均进行密码子优化。gvpkl-l1-lppta的表达在hxt3启动子和fba1终止子的控制下进行。djaadh的表达在tdh3启动子和eno2终止子的控制下进行。mcacs的表达在pdc1启动子和pdc1终止子的控制下进行。将质粒pzk41w-glaf12设计成将三个表达盒整合到yhl041w基因座下游的酵母属染色体中。质粒pzk41w-glaf12的功能和结构组成在表2中描述。表2.质粒pzk41w-glaf12的功能和结构元件实例3具有pkl-pta融合基因2的质粒pzk41w-glaf22合成gvpkl-l2-lppta包含用合成接头2(l2;seqidno4)接合的与实例2中相同的磷酸转酮酶和磷酸转乙酰酶。所得的融合多肽的氨基酸序列在图4中示出(seqidno:6),接头区域以粗体斜体示出。质粒pzk41w-glaf22含有盒以表达gvpkl-l2-lppta。质粒pzk41w-glaf22(未示出)与质粒pzk41w-glaf12相似,但是具有不同的接头。实例4具有作为个体基因的pkl和pta的质粒pzk41w-(h3c19)将pzk41w-(h3c19)(图5)设计为针对以上所述的测试质粒pzk41w-glaf12和pzk41w-glaf22的对照。pzk41w-(h3c19)含有四个表达盒。用于表达djaadh和mcacs的盒与质粒pzk41w-glaf12和pzk41w-glaf22中的相同。然而,个体地控制gvpkl和lppta的表达,而非表达gvpkl-lppta融合多肽。gvpkl的表达在hxt3启动子和fba1终止子的控制下进行,而lppta的表达在pgk1启动子和pgk1终止子的控制下进行。构建体pzk41w-(h3c19)也设计成将四个表达盒整合到yhl041w基因座的下游。实例5生成具有ura3基因型的fg-ura3菌株酿酒酵母菌株fermaxtmgoldlabel(下文中缩写为“fg”)在细粒乙醇工业中是众所周知的,并且用作亲本“野生型”菌株以制备本发明的工程化酵母。将质粒ptopoii-bluntura3-loxp-kanmx-loxp-ura3(图6)设计成用突变的ura3和ura3-loxp-tefp-kanmx-teft-loxp-ura3片段替代菌株fg中的ura3基因。质粒的功能和结构元件在表3中列出。表3.ptopoii-bluntura3-loxp-kanmx-loxp-ura3的功能/结构元件含有ura3-loxp-kanmx-loxp-ura3盒的2,018-bpdna片段(图7)通过ecori消化从质粒topoii-bluntura3-loxp-kanmx-loxp-ura3释放。通过电穿孔使用所述片段转化酿酒酵母fg细胞。能够在含有g418的培养基上生长的转化的菌落在含有20μg/ml尿嘧啶和2mg/ml5-氟乳清酸(5-foa)的合成小型板上划线。通过sd-ura板上表型的生长和通过pcr进一步确认能够在5-foa板上生长的菌落的ura3缺失。ura3缺失转化体不能在sd-ura板上生长。用测试引物获得单个1.98-kbpcr片段。相比之下,使用来自亲本fg菌株的dna,相同的引物对生成1.3-kb片段,从而指示完整ura3基因的存在。ura3缺失菌株命名为fg-kanmx-ura3。为了从菌株fg-kanmx-ura3去除kanmx表达盒,使用质粒pgal-cre-316(图8)通过电穿孔用于转化菌株fg-kanmx-ura3的细胞。使用此质粒的目的是暂时表达cre酶,这样使得loxp夹层kanmx基因将从菌株fg-kanmx-ura3去除以生成菌株fg-ura3。pgal-cre-316是随后从菌株fg-ura3去除的自我复制的环状质粒。来自pgal-cre-316的所有序列元件均不插入到菌株fg-ura3基因座中。质粒pgal-cre-316的功能和结构元件在表4中列出。表4.pgal-cre-316的功能和结构元件。位置(bp)功能/结构元件1-4810酵母-细菌穿梭载体prs316序列440-1059pbr322复制起点2984-4080酿酒酵母ura3基因4355-4454f1起点4813-6603,反向取向galp-cre-adht盒,反向取向将转化的细胞铺板在sd-ura板上。将单个菌落转移到ypg板上,并且在30℃孵育2至3天。然后将菌落转移到新的ypd板,额外持续2天。最后,将来自ypd板的细胞悬浮液点样在以下板上:ypd,g418(150μg/ml),5-foa(2mg/ml)和sd-ura。选择能够在ypd和5-foa上生长并且不能够在g418和sd-ura板上生长的细胞用于如上所述的pcr确认。预期的pcr产物大小是0.4-kb,并且确认衍生自fg-kanmx-ura3的kanmx(遗传霉素)敏感性ura3缺失菌株的身份。此菌株命名为fg-ura3。实例7生成表达pkl和pta为融合多肽或单独多肽的菌株使用fg-ura3菌株作为亲本以引入以上所述的pkl和pta基因。用以下物质转化细胞:(i)含有来自质粒pzk41w-glaf12的gvpkl-l1-lppta表达盒的12,372-bpswai片段(图9),(ii)含有来自质粒pzk41w-glaf22的gvpkl-l2-lppta表达盒的12,324-bpswai片段(图10),或(iii)来自质粒pzk41w-(h3c19)的gvpkl和lppta个体表达盒的13,568-bpswai片段(图11)。如表5所示选择和命名转化体:表5.选择的转化体的名称实例8小瓶测定中表达pkl和pta为融合多肽或单独多肽的菌株的比较将新的fg酵母菌株g177、g320和g376连同亲本菌株fg一起在小瓶培养物中生长,并且其发酵产物如实例1中所述进行分析。关于乙醇、甘油和乙酸生产(以g/l为单位)的性能在表6中示出。表6.小瓶测定中fg相对于g177、g320和g376菌株表达的一种或多种转基因etoh甘油乙酸fg无131.8916.300.60g177gvpkl-l1-lppta融合体139.6113.461.08菌株表达的一种或多种转基因etoh甘油乙酸fg无141.5818.001.04g320gvpkl-l2-lppta融合体146.8115.831.55菌株表达的一种或多种转基因etoh甘油乙酸fg无138.9317.420.63g376个体的gvpkl和lppta141.2814.001.43所有工程化酵母均比fg亲本产生更多乙醇和更少甘油,这是所希望的性能。所有工程化酵母均比fg亲本产生更多乙酸,这是不希望的。然而,将菌株g177、g320、g376的性能进行比较,揭示了与表达单独的蛋白质的g376菌株(1.7%)相比,在表达融合蛋白的g177和g320菌株(分别为5.9%和3.7%)的情况下,乙醇产生的增加远远更多。此外,与g376菌株(127%)相比,g177和g320菌株(分别为80%和49%)中乙酸产生的增加远远更少。这些结果表明,pkl-pta融合多肽比单独表达pkl和pta的多肽将更多糖导向到乙醇中,并且将更少糖导向到乙酸中。实例9ankom测定中表达pkl和pta为融合多肽或单独多肽的菌株的比较为了确认双功能蛋白的有益效果,在ankom测定中更精确地分析菌株g177、g320和g376的性能,如实例1中所述。关于乙醇、甘油和乙酸生产(以g/l为单位)的性能在表7中示出。表7.ankom测定中fg相对于g177、g320和g376菌株表达的一种或多种转基因etoh甘油乙酸fg无134.2617.240.78g177gvpkl-l1-lppta融合体142.3814.501.12g320gvpkl-l2-lppta融合体141.0914.951.22g376个体的gvpkl和lppta139.3913.581.54与g376菌株的仅3.9%相比,g177和g320菌株的乙醇产生增加分别为6.0%和5.1%。与g376菌株的97%相比,g177和g320菌株的乙酸产生的增加分别为44%和56%。实例10生成表达ga以及表达pkl和pta为融合多肽或单独多肽的菌株表达两种不同的葡糖淀粉酶中的任一种以及融合或非融合的pkl和pta基因的酵母菌株通过用含有与酵母fba1启动子和fba1终止子融合的密码子优化的ga基因的dna盒转化各种表达pkl和pta融合体或表达非融合体的菌株来构建。ga表达盒整合到染色体中的转化体如表8中所指示进行鉴定和命名。表8.选择的ga转化体的名称实例11表达ga以及表达pkl和pta为融合多肽或单独多肽的菌株的生长的比较为了确认pkl和pta的融合对于工程化酵母菌株的生长的积极影响,比较表达pkl和pta为融合多肽或单独多肽的数对在其他方面同基因株的生长。在32℃或36℃在ypd中生长24小时之后的od660在表9中示出。表9.菌株gpy10008、gpy10009、pol-sc-00675、pol-sc-0692、pol-sc-0696和pol-sc-00699的生长的比较比较24小时之后的光密度揭示,表达pkl-pta融合蛋白的菌株gpy10009、pol-sc-00675和pol-sc-0699比个体地表达pkl和pta的相应同基因株(分别为菌株gpy10008、pol-sc-00692、pol-sc-00696)生长地更好。实例12ypd液体培养物中由表达pkl和pta为融合多肽或单独多肽的菌株进行的ga分泌的比较为了确认表达pkl和pta为单一多肽对于ga表达的积极影响,比较由表达pkl和pta为融合多肽或单独多肽的数对菌株分泌的葡糖淀粉酶的酶活性。表10示出了在32℃或36℃在ypd上生长之后培养物的上清液中测量的酶活性(以ppmga表达)。表10.由菌株pol-sc-00675、pol-sc-00692、pol-sc-00696和pol-sc-00699分泌的葡糖淀粉酶的酶活性的比较。在表达pkl-pta融合蛋白的菌株pol-sc-00675和pol-sc-00699的上清液中,比在个体地表达pkl和pta的相应同基因株(分别为pol-sc-00692和pol-sc-00696)的上清液中测量到更高的酶活性。这指示表达融合蛋白的菌株表达更高水平的葡糖淀粉酶。实例13使用液化物的摇瓶测定中表达ga以及表达pkl和pta为融合多肽或单独多肽的菌株的比较比较使用液化物作为底物的摇瓶发酵中表达pta、pkl和ga的工程化酵母菌株pol-sc-00675、pol-sc-00692、pol-sc-00696和pol-sc-00699的性能,以便评估pkl和pta的融合对于ssf过程中ga表达的影响。为了使所述影响更易可见,不向所述液化物添加ga。获得的结果在图12a和图12b中示出。图12中的数据显示,与个体地表达pkl和pta的相应同基因株(分别为pol-sc-00692和pol-sc-00696)相比,表达pkl-pta融合蛋白的菌株pol-sc-00675和pol-sc-00699显示更好的发酵动力学。这指示表达融合蛋白的菌株表达更高水平的葡糖淀粉酶对于ssf过程具有积极影响。实例14使用非液化玉米粉底物的表达ga以及表达pkl和pta为融合多肽或单独多肽的菌株的比较也在使用非液化玉米粉底物的摇瓶测定中测试pkl和pta的融合对于发酵过程的有益影响,所述测定需要比常规液化物所使用的更高剂量的葡糖淀粉酶。因此,向所述底物添加外源木霉ga以模拟乙醇工厂中存在的典型条件。获得的结果在图13中示出。与个体地表达pkl和pta的相应同基因株pol-sc-00696相比,表达pkl-pta融合蛋白的菌株pol-sc-00699显示更好的发酵动力学和发酵结束时更高的乙醇水平。这指示具有pkl-pta融合体的菌株表达更高水平的葡糖淀粉酶,以及pkl和pta融合对于ssf中的那些菌株的性能具有积极影响。实例15使用淀粉液化物底物的由表达pkl和pta为融合多肽或单独多肽的菌株进行的ga分泌的比较为了确认摇瓶测定中表达双功能蛋白的菌株的改善性能与更高的ga表达相关,对于从菌株pol-sc-00696和pol-sc-00699的发酵培养物获得的发酵液执行酶活性测量。测量的酶活性在表11中呈现。表11.在32℃使用液化物的摇瓶中生长的菌株pol-sc-00696和pol-sc-00699分泌的ppmga的酶活性的比较。与个体地表达pkl和pta的相应同基因株pol-sc-00696相比,在表达pkl-pta融合蛋白的菌株pol-sc-00699的发酵液中测量到更高的酶促葡糖淀粉酶活性。这确认了,表达pkl和pta为单一多肽的菌株比表达pkl和pta为单独蛋白质的菌株表达更多葡糖淀粉酶。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1