具有降低的与抗药物抗体结合的经修饰的单可变结构域抗体的制作方法
本发明涉及经修饰的蛋白质和肽,其具有降低的与预存抗体结合的能力。此类经修饰的蛋白质/肽分子可以包含C末端添加、延伸或标签和/或某些氨基酸取代。此类经修饰的蛋白质/肽分子(包括其融合物和缀合物)可以包含抗原结合分子,例如抗体、抗体片段和单可变结构域,例如人免疫球蛋白(抗体)单可变结构域,以及来源于非人来源例如美洲驼或骆驼的单可变结构域,例如VHH,包括Nanobody™(尤其例如如WO 94/04678和WO 95/04079中所描述的)。本发明进一步涉及包含此类经修饰的C末端延伸的和/或氨基酸取代的分子的用途、制剂、组合物,以及还涉及这些分子的生产和表达方法。
发明背景
在人中存在可以与蛋白质例如与宿主免疫球蛋白或免疫球蛋白片段结合的天然发生的自身抗体,例如类风湿因子(其结合抗体的Fc区中的表位)、抗独特型自身抗体(其结合抗体可变区/CDR区)和抗铰链自身抗体(其结合Fab片段中的Ig恒定结构域的铰链区)。
这些自身抗体可以是抗免疫球蛋白(Ig)自身抗体的多克隆所有组成成分(repertoire)的部分,并对于遍及存在于人和非人灵长类动物中的Ig分子的表位具有特异性。除结合完整Fc结构域(即类风湿因子(RF))内的表位的抗IgG自身抗体之外,已观察到与IgG的可变CDR区结合的抗独特型自身抗体以及与Fab或F(‘Ab’)2片段的C末端铰链区中的隐藏表位反应的抗铰链抗体的存在。这些不同抗IgG自身抗体的功能作用仍不确定。类风湿因子和抗铰链自身抗体已与某些病理学状况例如自身免疫以及某些感染联系,而抗独特型抗体可以赋予保护免受某些自身免疫疾病中的自身抗体。此外,已提出关于抗IgG自身抗体的免疫调节作用,其中这些自身抗体控制自体反应性B细胞的刺激且调节针对外来抗原的免疫应答。抗铰链抗体是与切割的而不是完整的IgG反应的抗IgG自身抗体。它们在正常人群中的高流行率暗示先前对IgG片段的暴露,可能是作为通过细菌或内源蛋白酶的IgG切割的结果。
除了与内源蛋白质(首次用于实验的个体中存在的)结合,自身抗体还可以与施用于个体用于治疗的蛋白质或肽结合。与施用于个体的分子例如治疗蛋白质和肽结合的预存抗体可以影响其功效,并且通过维持、消除或中和该分子,可以在治疗患者中导致施用反应、超敏反应、改变的临床应答以及改变的生物利用度。然而,在一些情况下,这些抗体的存在在药物治疗过程中可以比在其他情况下更不显著。
结合治疗性蛋白质的自身抗体和响应药物治疗(例如治疗性蛋白质或肽的施用)新近形成的抗体统称为抗药物抗体(ADA)。当ADA在本文件各处描述时,除非另有具体说明,我们指的是预存ADA。
VH和VL域抗体来源于完全人构架序列,并且尽管在计算机芯片上的预测描述了明显低的潜在免疫原性肽的发生率,但可能这些域抗体在人中可以是免疫原性的,即它们可以引发ADA,并且它们可以与预存ADA结合,这取决于序列依赖性和序列不依赖性因子两者。
类似地,来源于骆驼科(Camelid)重链(VHH)的许多单dAb处于临床研究下,并且虽然仍未报道超敏反应或其他免疫介导的不利事件,但与预存ADA结合的可能性依然存在。
因此提供用于治疗的分子可以是有利的,所述分子包含蛋白质或肽,例如抗原结合分子,当施用于个体特别是人个体时,其具有降低的与预存ADA结合的能力)。
发明概述
如本文描述的,我们已证实在来自一些健康的首次用于实验的人个体的血清中,存在可以结合VH域抗体和VHH分子的预存抗VH自身抗体,以及可以结合VL分子的抗VL(例如Vκ(VK))自身抗体。结合VH dAb的预存ADA类似于抗铰链抗体,因为它们结合IgG片段,而不是在完整IgG上原位发现的那些相同序列。
如本文描述的开发了特异性免疫测定,并且验证以在人中检测针对VH dAb DOM1H-131-206(SEQ ID NO 1中所示的氨基酸序列)的抗药物抗体。在测定中筛选一组60个健康人供体血清样品的本底反应性。测定来自这些个体的大约45%血清样品具有可检测的抗体,其能够与DOM1H-131-206结合。这个反应性看起来对于VH dAb构架序列内的一个或多个新表位是特异性的,因为应答与结合多种靶抗原的dAb的VH构架交叉反应,但不与全人IgG交叉反应。针对VL dAb的预存ADA也在来自健康人供体的血清样品中观察到,但程度低于VH。
采取诱变方法,我们测定对VH构架的修饰是否能够降低这些预存ADA的结合。使用这种方法,我们定位到针对VH dAb构架的C末端的表位,并且我们例示了可以用于降低或消除预存抗体与VL、VH和VHH分子结合的许多方法。特别地,我们已显示改变dAb C末端的三维构象的修饰,特别是VH和VHH dAb中的C末端丝氨酸残基(即在Kabat第113位处)的修饰是重要的。另外,通过添加进一步的氨基酸残基(C末端延伸)和/或通过取代在VH dAb中的第14、41、108、110和112位中的一个或多个处存在的氨基酸残基,可以改变dAb C末端的三维构象。
本发明因此提供了经修饰的分子,与未经修饰的分子相比较,其具有降低的与(预存)ADA结合的能力,并且适合于施用于个体例如人个体用于治疗或预防。降低的结合能力意指该分子以降低的亲和力(affinity)或降低的亲合力(avidity)与预存ADA结合。此类分子包含蛋白质或肽例如抗原结合蛋白质,例如抗体、抗体片段和单可变结构域,例如人免疫球蛋白(抗体)单可变结构域(VH或VL),以及来源于非人来源例如美洲驼或骆驼的单可变结构域,例如骆驼科VHH,包括Nanobody™(尤其例如WO 94/04678和WO 95/04079中所述的)。所述分子包含选自下述的一种或多种修饰:(a)C末端添加、延伸、缺失和/或标签,和/或(b)一个或多个氨基酸构架取代。
此外,本文描述的经修饰的分子和包含这些经修饰的分子的药物组合物可以具有增强的安全性概况,和比未经修饰的分子例如未经修饰的dAb更少的副作用,以降低预存ADA结合,所述未经修饰的分子不包含C末端延伸、添加、缺失或标签和/或其他构架修饰。类似地,本文描述的经修饰的分子或包含这些经修饰的分子的药物组合物(其具有降低的与预存ADA结合的能力)的施用可以导致经修饰的免疫原性,并且还可以导致改进的功效和改进的安全性概况,并且例如可以有利地用于给患者重复给药,所述患者可以发生针对未经修饰的分子例如dAb的自身抗体。
因此,在本发明的第一个方面,提供:
单免疫球蛋白可变结构域(dAb),其包含选自下述的一种或多种修饰:(a)C末端延伸,其包含一个氨基酸到5个氨基酸的氨基酸延伸;或(b)一个或多个氨基酸构架取代,其中至少一个取代是选自下述的取代:P14A取代、P41A取代和L108A取代。
在一个实施方案中,提供了从一到4个氨基酸的C末端延伸。在另一个实施方案中,所述C末端延伸包含其为丙氨酸的氨基酸,并且与未经修饰的单免疫球蛋白可变结构域(dAb)相比较,其具有降低的与预存ADA的结合。
在另一个方面,C末端延伸可以是1-15个氨基酸,例如1-8个氨基酸,或1、1-2、1-3、1-4、1-5、1-6、1-7个氨基酸的延伸。特别地,包含丙氨酸残基的1-8个氨基酸,或1、1-2、1-3、1-4、1-5、1-6、1-7个氨基酸的延伸,例如单丙氨酸延伸,或AS、AST、ASTK、ASTKG、ASTKGP延伸。特别地,提供了1-5个氨基酸的延伸,或1-4个氨基酸的延伸。经修饰的单免疫球蛋白可变结构域还可以包含氨基酸缺失。单免疫球蛋白可变结构域(dAb)可以选自人VH、或人VL dAb或骆驼科VHH。C末端延伸可以作为具有dAb的C末端的直接融合物或缀合物存在。
在另一个方面,本发明提供了单免疫球蛋白可变结构域(dAb),其中(i)所述dAb是人VH或骆驼科VHH,并且所述C末端延伸包含选自(a)A(b)AS、(c)AST(d)ASTK、(e)ASTKG(f)AAA或(g)T的氨基酸延伸;并且其中(ii)所述dAb是人VL(例如Vκ),并且所述C末端延伸包含选自(a)AAA、(b)A(c)TV(d)T的氨基酸延伸。
本发明还提供了与靶抗原单价结合的单免疫球蛋白可变结构域(dAb),其包含:
a)对于所述靶抗原特异性的三个互补性决定(CDR)区;使得所述dAb以在5微摩尔到1皮摩尔范围中的KD结合所述抗原
b)四个构架(FW)区;和
c)由序列VTVS(S)nX或VEIKpRqX组成的C末端序列;和任选地
d)与人种系构架序列相比较,在第14、41、108、110或112位处的一个或多个氨基酸取代
其中:
n代表独立地选自0或1的整数;
p和q各自代表0或1,使得当p代表1时,q可以是0或1,并且使得当p代表0时,q也代表0;
X可以存在或不存在,并且如果存在,则代表1-8个氨基酸残基的氨基酸延伸;
另外的条件是如果X不存在;
i)n是0,和/或以VTVS(S)n结尾的dAb包含所述氨基酸取代中的一个或多个;
ii)p和/或q是0,和/或以VEIKpRqX结尾的dAb包含所述氨基酸取代中的一个或多个。
KD指平衡解离常数。技术人员将理解KD数值越小,结合就越强。
在这个方面的一个实施方案中,所述dAb以在约10pM至约50nM范围中的KD结合所述抗原。
在这个方面的一个实施方案中,所述单免疫球蛋白可变结构域(dAb)具有比等价dAb更低的对于抗药物抗体(ADA)的结合亲和力和/或亲合力,其中所述等价dAb具有与所述单免疫球蛋白可变结构域相同的序列,除了X不存在,n、p和q是1,并且不存在氨基酸取代之外。
在进一步的实施方案中,所述单免疫球蛋白可变结构域是其中所述C末端序列由序列VTVSSX组成的结构域。
在另一个实施方案中,所述单免疫球蛋白可变结构域是其中所述C末端序列由序列VEIKRX组成的结构域。
在进一步的实施方案中,所述单免疫球蛋白可变结构域具有选自下述的一个或多个氨基酸取代:P14A取代、P41A取代、L108A取代、T110A取代和S112A取代。
在实施方案中,X是存在的,并且是1-8个氨基酸,或1、1-2、1-3、1-4、1-5、1-6、1-7个氨基酸的延伸,特别是包含丙氨酸残基的1-8个氨基酸,或1、1-2、1-3、1-4、1-5、1-6、1-7个氨基酸的延伸,例如单丙氨酸延伸,或AS、AST、ASTK、ASTKG、ASTKGP延伸。
在进一步的实施方案中,所述dAb是VH或VL dAb或骆驼科VHH。
在仍进一步方面,本发明还提供了氨基酸序列,其为本文描述的未经修饰的单免疫球蛋白可变结构域(dAb)序列中的任何一种(例如SEQ ID NOs 1-6、10-13),其随后如本文所述进行修饰以降低与ADA的结合,例如本文描述的未经修饰的单免疫球蛋白可变结构域序列,其这样进行修饰,使得X是存在的,并且是1-8个氨基酸的延伸,特别是包含丙氨酸残基的1-8个氨基酸的延伸,例如单丙氨酸延伸,或AS、AST、ASTK、ASTKG、ASTKGP延伸,和/或所述单免疫球蛋白可变结构域具有一个或多个氨基酸取代,其中所述一个或多个氨基酸取代选自:P14A取代、P41A取代、L108A取代、T110A取代和S112A取代。
在一个实施方案中,本发明提供了单免疫球蛋白可变结构域,其为人VH或骆驼科VHH,并且所述C末端延伸包含选自下述的氨基酸延伸:(a)AS、(b)AST(c)ASTK、(d)ASTKG(e)AAA或(f)T或(g)ASTKGP,和/或其中存在来自以VTVS(S)n结尾的dAb的氨基酸缺失,并且所述缺失是-S缺失。
在另一个实施方案中,本发明提供了单免疫球蛋白可变结构域,其为人VL例如Vκ,并且其中所述C末端延伸包含选自下述的氨基酸延伸:(a)AAA(b)A(c)TV和(d)T,和/或其中存在来自以VEIKR结尾的dAb的氨基酸缺失,并且所述缺失是-R缺失。
在本发明的先前方面的一个可选实施方案中,当VL dAb的C末端序列是VEIKRAAA或VEIKRT时,排除了包含由抗体的单链Fc区分开的两个dAb的抗原结合构建体,其中每个dAb能够与VEGF结合。
在一个方面,如本文所述进行修饰以降低与ADA的结合的dAb(例如VH、VL例如Vκ和VHH)具有这样的与ADA结合的KD,其为等价但未经修饰的单免疫球蛋白可变结构域(dAb)序列的KD的150%或更多(例如200%、250%、300%、350%、400%、450%、500%、550%、600%、650%或更多)。本发明还提供的是这样的dAb,其如本文所述进行修饰以具有降低的ADA结合,并且如使用如实施例2中所述的证实测定进行测定的,其具有降低的与ADA的结合,并且其中与具有约98%-100%的信号抑制的对照dAb相比较,所述经修饰的dAb具有平均%信号抑制,其小于90%、例如小于80%、例如小于70%、例如小于60%、例如小于50%、例如小于40%、例如小于30%、例如小于20%、例如小于10%,所述对照(未经修饰的)dAb具有相同或相似的序列,但未进行修饰以降低ADA结合。
本发明还提供了用于治疗方法,例如用于防止副作用的方法的本发明的免疫球蛋白单可变结构域(dAb)。当dAb是靶的拮抗剂时,这种用途可以特别有利,所述靶是例如选自TNFα、TNF受体、TNF受体 1(TNFR1)、VEGF、IL-1R、IL-6R、IL-4、IL-5、IL-13、DC-SIGN、ASGPR、白蛋白和TGFβR2的靶。在一个实施方案中,靶是受体,或特别是其为聚合的受体或在激活时二聚化的受体,例如TNF受体。在另一个实施方案中,在涉及重复给药的治疗方案中使用这样的dAb,所述dAb如本文所述进行修饰以使得它具有降低的与ADA的结合。
本发明提供了其中靶是TNFR1的单免疫球蛋白可变结构域(dAb),并且其为选自任何下述氨基酸序列中的dAb,所述氨基酸序列鉴定为:(a)具有在C末端处的单丙氨酸的延伸的DOM1h-131-206 dAb(SEQ ID NO 16);(b)具有在C末端处的单丙氨酸的延伸和P14A构架突变的DOM1h-131-206 dAb(SEQ ID NO 17);(c)具有P14A构架突变的DOM1h-131-206 dAb(SEQ ID NO 18);(d)具有ASTKG C末端延伸的DOM1h-131-206 dAb(SEQ ID NO 19);和(e)具有ASTKG C末端延伸和P14A氨基酸构架突变的DOM1h-131-206 dAb(SEQ ID NO 20)。本发明还提供了(未经修饰的)dAb,其选自与氨基酸序列中的任一种100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同的序列,所述氨基酸序列鉴定为:DOM1h-131-206(SEQ ID NO 1)、DOM 1h-131-511(SEQ ID NO 2)、DOM 1h-131-202(SEQ ID NO 3),并且其进一步包含任何包括例如本文描述的降低与ADA结合的任何修饰,例如单丙氨酸C末端延伸。
本发明的dAb包括本文描述的或其为本文描述的分子的部分(或与此类dAb序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同的氨基酸序列)的dAb氨基酸序列中的任何一种,例如在任何本文实例中所述的dAb中的任一种,和其例如包含本文描述的任何用于降低与ADA的结合的修饰,例如C末端丙氨酸延伸。本发明还包含本文(例如在实例中)描述的分子中的任何一种,所述分子包含如上所述的dAb序列,所述dAb序列包含本文描述的任何用于降低与ADA的结合的修饰,此类分子可以例如是实施例12中的Vh-Vk dAb-Fc-dAb中的任何一种,或本文例如本文实例中描述的任何mAbdAb。
因此,本发明提供了抗IL13 dAb,例如具有这样的氨基酸序列的dAb,所述氨基酸序列与鉴定为下述的氨基酸序列中的任何一种100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同:(a)DOM10h-53-567(SEQ ID NO 13)或(b)DT04-H-033(SEQ ID NO 12);并且所述氨基酸序列进一步包含本文描述的任何降低与ADA的结合的修饰,例如单丙氨酸C末端延伸。
本发明还提供了抗TNFR1dAb,例如具有这样的氨基酸序列的dAb,所述氨基酸序列与鉴定为下述的氨基酸序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同:DOM1h-574-208(SEQ ID NO 10);并且其进一步包含本文描述的任何降低与ADA的结合的修饰,例如单丙氨酸C末端延伸。
本发明还提供了例如具有这样的氨基酸序列的抗TNFR1dAb-VL融合物,所述氨基酸序列与鉴定为下述的氨基酸序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同:DOM1h-574-208-VL融合物(SEQ ID NO 11);并且其进一步包含本文描述的任何降低与ADA的结合的修饰,例如存在于融合分子的C末端处的单(或三个)丙氨酸延伸。
本发明还提供了mAbdAb,其为抗IL13mAb:IL-4 VκdAb,其进一步包含本文描述的任何降低与ADA的结合的修饰;例如,mAbdAb可以包含具有这样的氨基酸序列的重链序列,所述氨基酸序列与鉴定为下述的氨基酸序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同:mAb-VL '735重链分子SEQ ID NO 30;和鉴定为'735轻链序列SEQ ID NO 31的轻链序列;并且其进一步包含本文描述的任何降低与ADA的结合的修饰,例如单(或三个)丙氨酸延伸。
本发明还提供了这样的mAbdAb,其为指定为mAb-VL 15014的抗IL13mAb:IL-4 VκdAb,如本文所述进行修饰以降低与ADA的结合,其中所述mAbdAb包含(a)重链-接头-Vκ序列,其具有与鉴定为SEQ ID NO 32的氨基酸序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同的氨基酸序列;和(b)轻链序列,其具有与鉴定为SEQ ID NO 33的氨基酸序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同的氨基酸序列。
本发明还提供了这样的mAbdAb,其为指定为mAb-VL 15019的抗IL13mAb:IL-4 VκdAb,如本文所述进行修饰以降低与ADA的结合,其中所述mAbdAb包含(a)重链-接头-Vκ序列,其具有与鉴定为SEQ ID NO 34的氨基酸序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同的氨基酸序列;和(b)轻链序列,其具有与鉴定为SEQ ID NO 35的氨基酸序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同的氨基酸序列。
本发明还提供了这样的mAbdAb,其为指定为mAb-VL 15020的抗IL13mAb:IL-4 VκdAb,如本文所述进行修饰以降低与ADA的结合,其中所述mAbdAb包含(a)重链-接头-Vκ序列,其具有与鉴定为SEQ ID NO 36的氨基酸序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同的氨基酸序列;和(b)轻链序列,其具有与鉴定为SEQ ID NO 37的氨基酸序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同的氨基酸序列。
本发明还提供了这样的mAbdAb,其为指定为mAb-VL 15021的抗IL13mAb:IL-4 VκdAb,如本文所述进行修饰以降低与ADA的结合,其中所述mAbdAb包含(a)重链-接头-Vκ序列,其具有与鉴定为SEQ ID NO 38的氨基酸序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同的氨基酸序列;和(b)轻链序列,其具有与鉴定为SEQ ID NO 39的氨基酸序列100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同的氨基酸序列。
本发明还提供了具有本文描述的用于降低与ADA的结合的修饰中的任何一种的VHH序列,例如具有这样的氨基酸序列的VHH,所述氨基酸序列与鉴定为SEQ ID NO 7-9的氨基酸序列中的任何一种100%、99.5%、99%、98%、97%、96%、95%、90%、85%或80%相同。
本发明还提供了编码本发明的dAb中的任何一种的核酸,例如本文描述的核酸中的任何一种,例如图9(SEQ ID NOs 21-23)或 图10(SEQ ID NOs 24-29)中所示的核酸序列中的任何一种。在一个实施方案中,本发明提供了编码具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb的核酸(SEQ ID NO 22),包含该核酸(SEQ ID NO 22)的载体,并且它还提供了表达所述核酸(SEQ ID NO 22)、或表达SEQ ID NO 22的载体例如Pave011(来自Fujifilm Diosynth)的宿主细胞,例如大肠杆菌(E.coli)宿主细胞。还提供的是生产具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb的方法,其包括在适合于表达延伸的dAb的条件下,维持包含编码核酸(SEQ ID NO 22)的载体例如Pave011(或核酸)的宿主细胞例如大肠杆菌,从而生产多肽。
本发明的dAb还可以作为具有其他分子的融合物或缀合物存在。
在整个本公开内容中描述的本发明的其他实施方案中,代替在本发明的融合物中使用“dAb”,考虑技术人员可以使用包含结合其靶的dAb的CDR的结构域,并且所述构架包含如本文描述的用于降低与ADA结合的修饰。
还提供的是包含例如与药学上或生理学上可接受的一种或多种载体、一种或多种赋形剂或一种或多种稀释剂组合的,根据本发明的任何方面或实施方案的dAb的药物组合物。
本发明进一步提供了本发明的dAb用于治疗或药物的用途和治疗或预防疾病或病症的用途。例如,具有降低的ADA结合的抗TNFR1 dAb,例如如本文所述进行修饰以降低ADA结合的DOM1h-131-206 dAb(例如具有图8a-8e:SEQ ID NOS 16-20中所示的氨基酸序列的那些)。
在一个方面,本发明提供了具有C末端丙氨酸延伸(SEQ ID NO 16)的DOM1h-131-206 dAb用于治疗或药物或作为药剂的用途,例如以治疗或预防炎性疾病或病症或者呼吸性或肺疾病或病症,例如急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)及其并发症。
本发明还提供了编码本发明具有降低的ADA结合的dAb的核酸,以及包含这些核酸的载体和宿主细胞。还提供的是生产本发明的dAb的方法,其包括在宿主细胞例如微生物宿主细胞例如大肠杆菌中表达编码载体和核酸。
在进一步方面,本发明提供了包含本发明具有降低的ADA结合的dAb的制剂,例如用于肺递送的可喷雾制剂。还提供的是包含本发明的dAb的喷雾器或吸入器装置,所述dAb例如是抗TNFR1 dAb中的任何一种,例如具有图8a-8e:SEQ ID NOS 16-20中所示的氨基酸序列的那些,例如具有C末端丙氨酸延伸的DOM1h-131-206 dAb(SEQ ID NO 16)。
在另一个方面,本发明提供了未经修饰的DOM1h-131-206 dAb(SEQ ID NO1),或以本文描述的任何方法进行修饰以降低ADA结合的DOM1h-131-206 dAb,例如具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb(SEQ ID NO 16),以治疗炎性皮肤病症例如银屑病。
公开内容的另一个方面是治疗人中的银屑病的方法,其包括步骤a)鉴定患有银屑病的人;和b)对患有银屑病的人上的银屑病斑块施用治疗有效量的域抗体(例如未经修饰的DOM1h-131-206 dAb(SEQ ID NO1),或以本文描述的任何方法进行修饰以降低ADA结合的DOM1h-131-206 dAb,例如具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb(SEQ ID NO 16);由此治疗银屑病。
公开内容的另一个方面是用于银屑病治疗的域抗体,以及关于使用用于银屑病治疗的域抗体的给药方案。域抗体可以是未经修饰的DOM1h-131-206 dAb(SEQ ID NO1),或以本文描述的任何方法进行修饰以降低ADA结合的DOM1h-131-206 dAb,例如具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb(SEQ ID NO 16)。
在进一步方面,本发明还提供了工具mAb(例如如实施例19中所述且具有图6:SEQ ID NOs 14和15中给出的氨基酸序列的工具mAb)。工具mAb使用标准小鼠单克隆抗体技术生成,即小鼠用DOM 1H-131-206(SEQ ID NO1)进行免疫,收集脾并且生成杂交瘤细胞系,随后克隆表达抗体的杂交瘤,并且使用标准技术分离且测序所得到的抗体。工具mAb是与VH dAb构架结合且从而降低VH dAb与ADA结合的mAb。因此,工具mAb看起来结合与人抗VH ADA在VH构架上相似的表位。因此,工具mAb可以是有用的,例如它可以用于测试经修饰的dAb(VH、VHH),并且用于测定对于dAb的哪些修饰阻止或降低dAb与工具mAb的结合。阻止与工具mAb结合的对于VH dAb的修饰还将阻止或降低VH dAb与ADA的结合。因此,本发明提供了任何dAb,其进行修饰(例如通过本文描述的任何修饰)以阻止或降低与工具mAb的结合。本发明还提供了在测定中使用工具mAb(例如实施例19中所述且具有实施例19以及图6:SEQ ID NOs 14和15中给出的氨基酸序列的工具mAb)以测试dAb例如经修饰的dAb(例如(VH、VHH),例如任何本文描述的那些,例如TNFR1 dAb,例如本文描述的那些),并且例如以测定具有降低的与ADA的结合的那些的方法。在一个方面,dAb(例如(VH、VHH)如本文所述进行修饰,以降低与工具mAb的结合,并且具有这样的与工具mAb结合的KD,其为未经修饰的等价dAb序列的KD的150%或更多(例如200%、250%、300%、350%、400%、450%、500%、550%、600%、650%或更多)。本发明还提供通过这种筛选测定鉴定的任何dAb。
在另一方面,本发明还提供了工具mAb(例如实施例19中所述且具有图6:SEQ ID NOs 14和15中给出的氨基酸序列的工具mAb)在测定方法中用以定量在组织样品或血浆样品中存在多少dAb(例如VH、VHH)的用途。
附图简述
图1:显示在健康人个体的实验对象组的血清中预存抗药物抗体的频率。
图2:显示鉴定为下述的未经修饰的抗TNFR1 dAb的氨基酸序列:(a)(未经修饰的)DOM 1H-131-206(SEQ ID NO 1)(b)(未经修饰的)DOM 1H-131-511(SEQ ID NO 2)(c)(未经修饰的)DOM 1H-131-202(SEQ ID NO 3;和鉴定为下述的VHH序列:(d)如WO2010100135中所述,其为双特异性形式,具有通过GGGGSGGGS连接到人血清白蛋白结合模块的IL6R结合模块(SEQ ID NO 4),(e)如WO2010077422中所述,是双特异性形式,具有连接到血清白蛋白结合模块的TNF结合模块,所述血清白蛋白结合模块依次连接到TNF结合模块,使用GGGGSGGGS作为接头(SEQ ID NO 5),(f)如WO2009115614A2中所示,是二价单特异性形式,包含通过Ala-Ala-Ala接头连接的两个相同模块,每个模块是可以结合血管性血友病因子的A1结构域的dAb(SEQ ID NO 6),(g)如WO2010100135中所述,克隆VHH2(d)是双特异性形式,具有通过GGGGSGGGS连接到人血清白蛋白结合模块的IL6R结合模块,具有丙氨酸延伸(SEQ ID NO 7)(h)如WO2010077422中所述,双特异性形式,具有连接到血清白蛋白结合模块的TNF结合模块,所述血清白蛋白结合模块依次连接到TNF结合模块,使用GGGGSGGGS作为接头,具有丙氨酸延伸(SEQ ID NO 8)(i)如WO2009115614A2中所示,二价单特异性形式,包含通过Ala-Ala-Ala接头连接的两个相同模块,每个模块是可以结合血管性血友病因子的A1结构域的dAb,具有丙氨酸延伸(SEQ ID NO 9)(j)DOM 1H-574-208(SEQ ID NO 10)(k)DOM 1H-574-208 - VL融合物(SEQ ID NO 11)(l)DT04-H-033(SEQ ID NO 12);(m)Dom10h-53-567(SEQ ID NO 13)。
图3:显示具有突出显示的残基的DOM1H-131-206的模型晶体结构,所述残基在突变时影响ADA结合。采取表面残基的建模,并且在ADA测定中就与预存ADA的结合筛选所得到的突变体(例如如实施例2中所述)。发现指示为14和“C末端(C term)”的残基在突变时对ADA结合具有强烈影响,发现指示为112、110、108和41的残基在突变时对ADA结合具有中等影响,并且发现指示为13、11、91、43、44、83和84的残基在突变时对ADA结合具有微弱影响。
图4:显示通过向VHH克隆2(d)、2(e)和2(f)添加单丙氨酸氨基酸残基延伸引起的与ADA结合的消除。
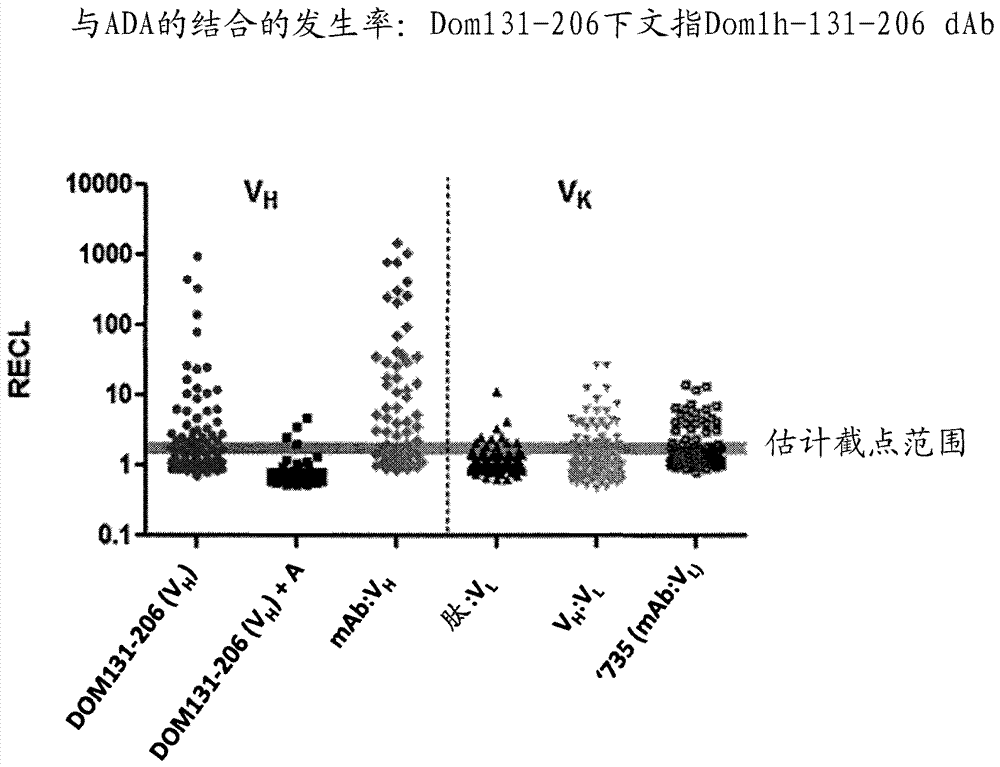
图5:显示VH dAb或VL dAb或包含这些dAb的分子与ADA的结合水平。
图6a和6b:显示工具mAb(M2.3G10.1G06)的氨基酸序列,图6a显示轻链序列(SEQ ID NO 14);并且图6b显示重链序列。CDR在该图中加下划线显示(SEQ ID NO 15)。
图7:显示在来自具有一系列预存抗VH ADA信号的个体的血清样品的存在下的竞争测定信号(x轴)。来自一系列具有预存抗VH ada的人供体的血清与抗VH mAb M2.3G10.1G06竞争结合DOM 1H-131-206,导致竞争测定信号的抑制。
图8:显示鉴定为下述的经修饰的TNFR1 dAb的氨基酸序列:(a)具有单丙氨酸的延伸的DOM1h-131-206 dAb(SEQ ID NO 16);(b)具有单丙氨酸的延伸和P14A构架突变的DOM1h-131-206 dAb(SEQ ID NO 17);(c)具有P14A构架突变的DOM1h-131-206 dAb(SEQ ID NO 18);(d)具有ASTKG C末端延伸的DOM1h-131-206 dAb(SEQ ID NO 19);和(e)具有ASTKG C末端延伸和P14A构架突变的DOM1h-131-206 dAb(SEQ ID NO 20)。
图9:显示下述TNFR1 dAb的核酸序列:(a)DOM1h-131-206 dAb(SEQ ID NO 21)(b)具有在C末端处的单丙氨酸的延伸的DOM1h-131-206 dAb(SEQ ID NO 22)(c)具有ASTKG的C末端延伸的DOM1h-131-206 dAb(SEQ ID NO 23)。
图10:显示编码下述的核酸序列:(a)VHH序列,其具有图2d中所示的氨基酸序列(SEQ ID NO 24)(b)VHH序列,其具有图2e中所示的氨基酸序列(SEQ ID NO 25);(c)VHH序列,其具有图2f中所示的氨基酸序列(SEQ ID NO 26),(d)VHH序列,其为双特异性形式,具有通过GGGGSGGGS连接到人血清白蛋白结合模块的IL6R结合模块,具有单丙氨酸的延伸(SEQ ID NO 27),(e)VHH序列,其具有2e中所示的氨基酸序列,进一步包含单丙氨酸的延伸(SEQ ID NO 28),(f)VHH序列,其具有2f中所示的氨基酸序列,进一步包含单丙氨酸的延伸(SEQ ID NO 29)。
图11:显示mAb:VL dAb(IL-13mAb:IL-4VκdAb分子)的氨基酸序列:(a)mAb-VL '735分子(IL-13mAb:IL-4VκdAb)(SEQ ID NOs 30和31),(b)mAb-VL 150154(SEQ ID NOs 32和33),(c)mAb-VL 15019(SEQ ID NOs 34和35),(d))mAb-VL 15020(SEQ ID NOs 36和37),(e)mAb-VL 15021(SEQ ID NOs 38和39)。
图12:显示下述的氨基酸序列:(a)DMS30045:DOM15-26-597 dAb N-(VEPKSSDK接头)和C末端K-044-085 dAb((TGLDSP)x4)(SEQ ID NO 40),(b)DMS30046:具有C末端K-044-085 dAb((TGLDSP)x4)的DMS1576(SEQ ID NO 41),(c)DMS30047(含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)和C末端K-044-085 dAb减去C末端R((TGLDSP)x4)(SEQ ID NO 42),(d)DMS30048(含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)和C末端K-044-085 dAb +A((TGLDSP)x4)(SEQ ID NO 43),(e)DMS30049(含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)和C末端K-044-085 dAb +AAA((TGLDSP)x4)(SEQ ID NO 44),(f)DMS30050(含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)和C末端K-044-085 dAb +T((TGLDSP)x4)(SEQ ID NO 45),(g)DMS30051(含有经修饰的C末端):具有C末端K-044-085 dAb减去C末端R((TGLDSP)x4)的DMS1576(SEQ ID NO 46),(h)DMS30052(含有经修饰的C末端):具有C末端K-044-085 dAb +A((TGLDSP)x4)的DMS1576(SEQ ID NO 47),(i)DMS30053(含有经修饰的C末端):具有C末端K-044-085 dAb +AAA((TGLDSP)x4)的DMS1576(SEQ ID NO 48),(j)DMS30054(含有经修饰的C末端):具有C末端K-044-085 dAb +T((TGLDSP)x4)的DMS1576(SEQ ID NO 49)。
发明详述
在本说明书内,本发明已参考实施方案以允许撰写清楚且简明的说明书的形式进行描述。预期且应当理解实施方案可以进行不同组合或者分开,而不背离本发明。
除非另有定义,否则本文使用的所有技术和科学术语具有与由本领域普通技术人员通常理解相同的含义(例如在细胞培养、分子遗传学、核酸化学、杂交技术和生物化学中)。标准技术用于分子、遗传和生物化学方法(一般参见通过引用并入本文的Sambrook等人,Molecular Cloning:A Laboratory Manual,第2版(1989)Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.和Ausubel等人,Short Protocols in Molecular Biology(1999)第4版,John Wiley & Sons,Inc.)和化学方法。
亲和力是一种分子例如本发明的抗原结合蛋白质与另一种例如其靶抗原在单个结合位点处的结合强度。抗原结合蛋白质与其靶的结合亲和力可以通过标准平衡方法(例如酶联免疫吸附测定法(ELISA)或放射性免疫测定(RIA))或动力学(例如BIACORETM分析)进行测定。
如本文使用的术语“表位”指与抗原结合蛋白质例如dAb的特定结合结构域接触的抗原部分。表位可以是线性的或构象的/不连续的。构象的或不连续表位包含由其他序列分隔的氨基酸残基,即不在抗原的基本序列中的连续序列中。尽管残基可以来自肽链的不同区,但它们在抗原的三维结构中紧密接近。在多聚抗原的情况下,构象的或不连续表位可以包括来自不同肽链的残基。在表位内包含的特定残基可以通过计算机建模程序或经由通过本领域已知的方法例如X射线晶体学获得的三维结构进行测定。
dAb缀合物指包含另外的分子借助于共价或非共价键优选共价键与之化学缀合的dAb的组合物。此类共价键可以通过肽键或其他方法例如经由经修饰的侧链。非共价键合可以是直接的(例如静电作用、疏水作用)或间接的(例如通过互补结合配偶体(例如生物素和抗生物素蛋白)的非共价结合,其中一个配偶体与药物共价键合,并且互补结合配偶体与dAbTM共价键合)。当采用互补结合配偶体时,结合配偶体之一可以直接或通过合适的接头部分与药物共价键合,并且互补结合配偶体可以直接或通过合适的接头部分与dAbTM共价键合。
如本文使用的,dAb融合物指包含dAb和多肽药物的融合蛋白。dAb和多肽药物可以作为单条连续多肽链的不连续部分(parts)(部分(moieties))存在。
如本文使用的,当在提及多肽中使用时,“片段”是具有这样的氨基酸序列的多肽,所述氨基酸序列与完全天然存在的多肽的氨基酸序列的部分而不是全部相同。片段可以是“独立的(free-standing)”或包含在更大多肽内,它们作为单个更大多肽中的单个连续区形成所述更大多肽的部分或区域。
如本文使用的,术语mAbdAb指连接到进一步的结合结构域特别是单可变结构域的单克隆抗体,例如域抗体。mAbdAb具有至少两个抗原结合位点,其中至少一个来自域抗体,并且至少一个来自配对的VH/VL结构域。此类mAbdAb例如在WO 2009/068649中描述。
如本文使用的,“肽”指经由肽键连接在一起的约二个到约50个氨基酸。如本文使用的,“多肽”或“蛋白质”指经由肽键连接在一起的至少约50个氨基酸。多肽和蛋白质一般包含三级结构且折叠成功能结构域。
如本文使用的,术语“抗体的单链Fc区”指IgG的单重链Fc区,例如IgG1、IgG2、IgG3、iGG4或IgG4PE,或IgA抗体。单重链Fc区可以包含CH1、CH2和CH3恒定区抗体结构域中的一个或多个,例如所有三个恒定区抗体结构域或仅CH2和CH3结构域。除包含CH1、CH2和CH3恒定区抗体结构域中的一个或多个之外,抗体的单重链Fc区可以进一步包含抗体的铰链区(此类区域通常在CH1和CH2结构域之间发现)。
如本文使用的,“功能性的”描述具有生物活性例如特异性结合活性的多肽或肽。例如,术语“功能性多肽”包括通过其抗原结合位点结合靶抗原的抗体或其抗原结合片段。
如本文使用的,“靶配体”指由多肽或肽特异性或选择性结合的配体。例如,当多肽是抗体、其抗原结合片段、或免疫球蛋白单可变结构域时,靶配体可以是任何所需抗原或表位。与靶抗原的结合依赖多肽或肽是功能性的。
如本文使用的,抗体指IgG、IgM、IgA、IgD或IgE或片段(例如Fab、F(ab’)2、Fv、二硫键连接的Fv、scFv、闭合构象多特异性抗体、二硫键连接的scFv、双抗体),无论是否来源于任何天然产生抗体的物种,还是通过重组DNA技术制备;无论是否从血清、B细胞、杂交瘤、转染瘤、酵母还是细菌中分离。
短语“免疫球蛋白单可变结构域”指抗体可变结构域(VH、VHH、VL),其不依赖于其他V区或结构域而特异性结合抗原或表位。免疫球蛋白单可变结构域可以以具有其他可变区或可变结构域的形式(例如同多聚体或异多聚体)存在,其中其他区域或结构域不是通过单免疫球蛋白可变结构域的抗原结合所必需的(即,其中免疫球蛋白单可变结构域不依赖于另外的可变结构域而结合抗原)。当术语在本文中使用时,“域抗体”或“dAb”与“免疫球蛋白单可变结构域”相同。当术语在本文中使用时,“单免疫球蛋白可变结构域”与“免疫球蛋白单可变结构域”相同。当术语在本文中使用时,“单抗体可变结构域”与“免疫球蛋白单可变结构域”相同。免疫球蛋白单可变结构域在一个实施方案中是人抗体可变结构域,还包括来自其他物种的单抗体可变结构域,所述其他物种例如啮齿动物(例如,如WO 00/29004中公开的,其内容以其整体通过引用并入本文)、铰口鲨和骆驼科VHH dAb。骆驼科VHH是免疫球蛋白单可变结构域多肽,其来源于包括骆驼、美洲驼、羊驼、单峰骆驼和原驼的物种,所述物种产生天然缺乏轻链的重链抗体。VHH可以是人源化的。另外在本发明的范围内的是人dAb,其已进行修饰,以便并不完全是人的,例如进行为降低聚集的修饰,包括其为骆驼科基序的相同残基的突变。
未经修饰的免疫球蛋白单可变结构域(即未经修饰的dAb),例如结合靶的dAb,包含在构架结构内的三个互补性决定区(CDR)。鉴于在天然存在的免疫球蛋白链的遗传学中,V区在CDR3的开始处终止,并且CDR3的剩余部分由D和J区提供(导致V-D-J融合物),对于本发明的目的,dAb包括CDR3的全部并且在其C末端处以构架4残基终止。VH dAb在其C末端处以残基LVTVSS终止。VHH dAb在其C末端处以残基VTVSS终止。VL dAb在其C末端处以VEIKR终止。
“经修饰的dAb”是如本文描述的dAb,其另外具有改变dAb C末端的三维构象的修饰。经修饰的dAb包括这样的dAb,其包含如本文公开的C末端添加、延伸或标签和/或某些氨基酸取代。
本发明还提供了如上所述的单免疫球蛋白可变结构域(或包含dAb的分子例如mAbdAb),其具有比等价dAb(或包含dAb的分子)更低的对于抗药物抗体的结合亲和力和/或亲合力(例如其具有这样的与ADA结合的KD,其为等价序列的KD的150%或更多(例如200%、250%、300%、350%、400%、450%、500%、550%、600%、650%或更多),所述等价dAb具有相同序列,除了X不存在,n、p和q是1,并且不存在构架突变之外。这意指在随后进行修饰,使得它延伸以含有X例如C末端单丙氨酸延伸,或进行修饰以去除C末端丝氨酸,或通过在构架中的残基14、41、108、110和/或112中的一个或多个的取代进行修饰(或此类修饰的任何组合)时,dAb例如DOM 1H-131-206(SEQ ID NO 1)以比不含任何此类修饰的DOM 1H-131-206(SEQ ID NO 1)更低的结合亲和力和/或亲合力与抗药物抗体(ADA)结合。这可以使用标准技术使用表面等离子共振例如在Biacore TM上进行测定。技术人员将理解KD值越低,结合就越强。
还由本发明提供的是如本文描述进行修饰以具有降低的ADA结合的dAb,并且如使用如实施例2中所述的证实测定进行测定的,其具有降低的与ADA的结合,并且其中与具有约98%-100%的信号抑制的对照dAb相比较,所述经修饰的dAb具有这样的平均%信号抑制,其小于90%、例如小于80%、例如小于70%、例如小于60%、例如小于50%、例如小于40%、例如小于30%、例如小于20%、例如小于10%,所述对照(未经修饰的)dAb具有相同或相似的序列,但未进行修饰以降低ADA结合。
预存ADA是已存在于药物待向其施用的个体中的ADA。预存ADA可以存在于首次用于实验的个体中(即,药物以前从未向其施用的个体)。
“结构域”是折叠的蛋白质结构,其具有不依赖于蛋白质其余部分的三级结构。一般地,结构域负责蛋白质的不连续功能性质,并且在许多情况下可以添加、去除或转移到其他蛋白质,而不丧失蛋白质和/或结构域的剩余部分的功能。“单抗体可变结构域”是包含抗体可变结构域序列特征的折叠的多肽结构域。它因此包括完整的抗体可变结构域和经修饰的可变结构域,例如其中一个或多个环已替换为并非抗体可变结构域特征的序列,或已截短或包含N或C末端延伸的抗体可变结构域,以及保留全长结构域的至少结合活性和特异性的可变结构域的折叠片段。
如本文使用的,术语“剂量”指一次全部(单位剂量),或经过限定时间间隔在两次或更多次施用中施用于个体的融合物或缀合物的数量。例如,剂量可以指经过一天(24小时)(日剂量)、两天、一周、两周、三周或者一个或多个月的过程,施用于个体的融合物或缀合物的数量(例如通过单次施用,或通过两次或更多次施用)。剂量之间的间隔可以是任何所需时间量。
“单价”意指与一个表位结合。
短语“半衰期”指例如由于通过天然机制的降解和/或清除或隔离,融合物或缀合物的血清或血浆浓度在体内降低50%花费的时间。本发明的组合物在体内稳定,并且它们的半衰期通过与血清白蛋白分子例如人血清白蛋白(HSA)结合而增加,所述血清白蛋白分子抵抗降解和/或清除或隔离。这些血清白蛋白分子是天然存在的蛋白质,其自身在体内具有长半衰期。如果分子的功能活性在体内持续比类似分子更长的时期,则它的半衰期是提高的,所述类似分子对于半衰期增加分子并非特异性的。
如本文使用的,“流体力学大小”指基于分子通过水溶液的扩散,分子(例如蛋白质分子、配体)的表观大小。蛋白质通过溶液的扩散或运动可以进行处理,以衍生蛋白质的表观大小,其中所述大小由蛋白质颗粒的“斯托克斯半径”或“流体力学半径”给出。蛋白质的“流体力学大小”依赖质量和形状(构象),使得具有相同分子量的两种蛋白质可以基于蛋白质的总体构象而具有不同流体力学大小。
在两条序列之间的“同源性”或“同一性”或“相似性”(术语在本文中可互换使用)的计算如下进行。序列为了最佳比较目的进行比对(例如可以在第一和第二氨基酸或核酸序列中的一种或两种中引入缺口用于最佳比对,并且为了比较目的可以忽略非同源序列)。在一个实施方案中,为了比较目的比对的参考序列长度是参考序列长度的至少30%,或至少40%,或至少50%,或至少60%,或至少70%、80%、90%、100%。随后比较在相应氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸。当第一序列中的位置由与第二序列中的相应位置相同的氨基酸残基或核苷酸占据时,则分子在该位置处是相同的(如本文使用的,氨基酸或核酸“同源性”等同于氨基酸或核酸“同一性”)。两条序列之间的同一性百分比是由序列共享的相同位置数目的函数,考虑到缺口数目和每个缺口的长度,其需要被引入用于两条序列的最佳比对。使用算法BLAST 2序列,使用缺省参数(Tatusova,T. A.等人,FEMS Microbiol Lett,174:187-188(1999),可以制备和测定如本文描述的氨基酸和核苷酸序列比对和同源性、相似性或同一性。
本发明涉及编码本文描述的本发明组合物的分离的和/或重组的核酸。
本文被称为“分离的”核酸是已与在其原始环境中(例如在细胞中或在核酸的混合物例如文库中)的其他材料(例如其他核酸,例如基因组DNA、cDNA和/或RNA)分离开的核酸。分离的核酸可以作为载体(例如质粒)的部分进行分离。
本文被称为“重组的”核酸已通过重组DNA方法学产生的核酸和使用聚合酶链反应(PCR)制备的核酸,所述重组DNA方法学包括依赖人工重组的方法,例如使用例如限制酶、同源重组、病毒等等克隆到载体或染色体内。
本发明还涉及重组宿主细胞例如哺乳动物或微生物细胞,其包含(一种或多种)重组核酸或表达构建体,其包含编码如本文描述的本发明组合物的一种或多种核酸,例如进行修饰以降低与ADA的结合的dAb。还提供了制备如本文描述的本发明组合物的方法,其包括在适合于融合多肽表达的条件下,维持本发明的重组宿主细胞例如哺乳动物或微生物细胞。如果需要的话,该方法可以进一步包括分离或回收融合物的方法。
例如,使用对于选择的宿主细胞适当的任何方法(例如转化、转染、电穿孔、感染),可以将编码本发明的分子的核酸分子(即,一种或多种核酸分子)引入合适的宿主细胞内,以产生重组宿主细胞,使得一种或多种核酸分子可操作地连接到一种或多种表达控制元件(例如在载体中,在通过细胞中加工产生的构建体中,整合到宿主细胞基因组内)。所得到的重组宿主细胞可以在适合于表达的条件下(例如在诱导物的存在下,在合适动物中,在合适的补充有适当的盐、生长因子、抗生素、营养补充物等的培养基中)维持,由此生产编码的肽或多肽。如果需要的话,可以分离或回收(例如从动物、宿主细胞、培养基、乳中)编码的肽或多肽。这个过程包括在转基因动物的宿主细胞中的表达(参见例如,WO 92/03918,GenPharm International)。
如本文描述的本发明的分子还可以在合适的体外表达系统中例如通过化学合成或通过任何其他合适方法产生。
如本文描述且例示的,本发明的分子一般以高亲和力与其靶配体结合。
本发明的分子例如具有降低的与ADA结合的经修饰的dAb可以在大肠杆菌或毕赤酵母属(Pichia)物种(例如巴斯德毕赤酵母(P. pastoris))中表达。在一个实施方案中,dAb在大肠杆菌或毕赤酵母属物种(例如巴斯德毕赤酵母);或在哺乳动物细胞培养物(例如CHO或HEK 293细胞)中分泌。尽管本文描述的分子当在大肠杆菌中或在毕赤酵母属物种或哺乳动物细胞中表达时可以是可分泌的,但它们可以使用任何合适的方法进行生产,例如合成化学方法或不采用大肠杆菌或毕赤酵母属物种的生物生产方法。在一个实施方案中,编码本发明的dAb例如本文描述的TNFR1 dAb的核酸可以克隆到合适的表达载体例如Pave011(来自Fujifilm Diosynth)内,并且随后在微生物载体例如大肠杆菌中表达。
在本发明的一个实施方案中,dAb例如VH、VL或VHH可以进行修饰,以阻止与ADA的结合,使得修饰包含在C末端处存在的标签。这种标签可以作为与分子的融合物或缀合物存在。标签可以是本领域已知的任何标签,例如亲和标签例如myc-标签、FLAG 标签、his-标签,化学修饰例如PEG,或蛋白质结构域例如抗体Fc结构域。特别地,本发明提供了用于如本文进一步定义的降低副作用的方法中的延伸有标签、化学修饰或蛋白质结构域的本发明分子。
在另一个实施方案中,本发明还提供了包含降低预存ADA结合的经修饰的构架的分子例如dAb(例如VH或VL或VHH),例如包含在第14、41、108、110或112位的任何一个处的氨基酸取代的dAb(例如VHH、VH或VL)。例如,这些取代可以是选自下述的一种或多种修饰:P14A、P14K、P14Q、P14T、P41A、L108A、L108 Q、 T110A和S112A。
在这个实施方案的一个方面,dAb(例如VHH、VH或VL)包含选自下述的一种或多种修饰:P14A、P14K、P14Q、P14T、P41A、L108A、T110A和S112A;并且可以进一步包含任何如上所述的C末端延伸、添加、缺失或标签。
在一个实施方案中,包含选自P14A、P14K、P14Q、P14T P41A、L108A、T110A和S112A的一种或多种修饰的dAb(例如VHH、VH或VL)还包含在dAb的C末端处的选自下述的氨基酸延伸:(a)丙氨酸,或(b)包含选自下述的延伸或由其组成的氨基酸序列:AS、AST、ASTK、ASTKG或ASTKGP。此外,本文描述的dAb分子和包含这些分子的药物组合物可以用于防止或降低副作用。抗药物抗体由dAb的结合可以导致两个dAb结合在一起。在一些情况下,这可以导致安全性担忧。例如,如果dAb的靶是受体或聚合靶,则两个dAb在一起可以使两个靶在一起。这可以导致意料不到的药理学影响,例如例如经由受体的二聚化的激动而不是拮抗。因此,本发明提供了本发明的分子在防止副作用的方法中的用途。防止意指与未经修饰的等价分子相比较,本发明的分子的使用将预存抗药物抗体的结合消除至完全或部分水平。在ADA的结合中的降低导致不需要的药理学效应水平中的降低。因此,本发明的分子可以具有增强的安全性概况,和比未经修饰的分子例如未经修饰的dAb更少的副作用,以降低预存ADA结合,所述未经修饰的分子不包含C末端延伸、添加、缺失或标签和/或其他构架修饰。类似地,本文描述的经修饰的分子或包含这些经修饰的分子的药物组合物(其具有降低的与预存ADA结合的能力)的施用可以导致改良的免疫原性,这是因为当经修饰的分子与ADA结合时,它们形成免疫复合物,并且此类免疫复合物随后可以生成免疫应答。另外,本文描述的经修饰的分子或包含这些经修饰的分子的药物组合物的施用还可以导致改进的功效和改进的安全性概况,并且例如可以有利地用于给患者重复给药,所述患者可以发生针对未经修饰的分子的自身抗体。另外,本发明的dAb分子能够施用于患者群体,而无需预筛选ADA滴度以去除处于不良反应风险中的个体。在分子用于防止副作用的用途的背景下,本发明还提供了如本文定义的单免疫球蛋白可变结构域的用途,其中X替换为Y,其中Y选自:标签例如亲和标签、myc标签、FLAG 标签或his-标签,化学修饰例如PEG基团,或蛋白质例如抗体的Fc部分。
本发明还提供了通过施用本发明的分子,或如上定义的其中X已替换为Y的本发明的分子,防止或降低治疗方案中的副作用的方法。还提供的是修饰如本文描述的分子以降低其与ADA的结合且降低副作用的方法。
本发明还提供了包含如本文描述的经修饰的分子的组合物,例如包含经修饰的VHH、VH或VL的组合物。此类组合物可以包含作为与其他分子的融合物或缀合物存在的经修饰的分子,所述其他分子例如其他蛋白质、抗体分子或抗体片段。例如,dAb可以作为格式化(formatted)dAb存在(例如dAb可以如例如WO 2008/149148中所述的作为dAb-fc融合物或缀合物存在),或它可以作为mAbdAb存在(如WO 2009/068649中所述的),或dAb可以作为与半衰期延长蛋白质或多肽的融合物或缀合物存在,例如另外的dAb,例如与血清白蛋白结合的dAb(AlbudAb™),或例如作为与聚乙二醇(polyethyleneglygol)PEG或另外的治疗或活性分子的融合物或缀合物存在。在这个实施方案中,当作为与dAb(例如VHH、VH或VL)的融合物或缀合物存在时,一种或多种治疗分子可以连接到dAb的C末端延伸或dAb的N末端。在一个实施方案中,一种或多种治疗分子作为在dAb的N末端处的融合物(或缀合物)存在。
在一个实施方案中,具有降低的结合ADA的能力的本发明dAb(以及包含dAb的分子例如其也为本发明的部分的mAbdAb)以高亲和力与靶配体结合,例如它们可以具有如通过使用Biacore TM的表面等离子共振测量的在下述范围中的KD:5微摩尔至约1 pM ,例如约500 nM至约10 pM,例如约 200nM至约10pM,例如50nM 至约10pM,例如约10nm至约10pM。在一个实施方案中,该分子可以具有约10nM至约10-30pM的KD,例如它可以是TNFR1 dAb,其具有降低的与ADA的结合并且具有约10-30pM 例如约20pM的KD。
在一个实施方案中,具有降低的与ADA结合的能力的本发明dAb(以及包含dAb的分子例如其也为本发明的部分的mAbdAb)可以具有这样的表达水平,其为由未如本文所述进行修饰以降低与ADA的结合的具有相同或相似氨基酸序列的dAb显示的那些的至少3%,例如5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%。在进一步的实施方案中,具有降低的与ADA结合的能力的本发明分子(例如dAb和包含dAb的分子例如mAbdAb)可以具有至少0.1g/升的表达水平。
在一个实施方案中,具有降低的与ADA结合的能力的本发明dAb(以及包含dAb的分子例如其也为本发明的部分的mAbdAb)具有这样的与其靶抗原结合的KD,其比未如本文所述进行修饰以降低与ADA的结合的具有相同或相似氨基酸序列的dAb的KD高约50倍(或更多)(即,dAb的效力是50倍更低),例如高约40倍、高约30倍、高约20倍、高约10倍、高约5倍、高约4倍。在一个实施方案中,具有降低的与ADA结合的能力的本发明dAb(以及包含dAb的分子例如其也为本发明的部分的mAbdAb)具有这样的与其靶抗原的KD,其与未如本文所述进行修饰以降低与ADA的结合的具有相同或相似氨基酸序列的dAb的KD基本上相同(例如大约高2倍至低2倍)或低多于2倍。
本发明进一步涉及包含此类C末端延伸和/或修饰的分子的用途、制剂、组合物,以及还涉及这些分子的生产和表达方法。
在一个实施方案中,本发明提供了这样的dAb(VH、VL或VHH),其具有如上所述的任何C末端修饰,并且其与选自下述的靶结合:TNFα、TNFR1、VEGF、IL-1R、IL-6R、IL-4、IL-5、IL-13、DC-SIGN、ASGPR、白蛋白和TGFβR2。
在一个实施方案中,本发明提供了在下述的任何一个中描述或公开的dAb:WO 2007/049017(例如指定为2H-131-511的抗TNFR1 dAb,或与之至少80%相同(例如85%、90%、95%、96%、97%、98%、99%、100%相同的)dAb,WO 2008/149144(例如选自下述的抗TNFR1 dAb:1h-131-201、1h-131-202、1h-131-203、1h-131-204、1h-131-205,或与之至少80%相同(例如85%、90%、95%、96%、97%、98%、99%、100%相同的)dAb,和WO 2008/149148(其内容明确通过引用并入本文),例如其中的抗TNFR1 dAb中的任何一种;并且所述dAb进一步包含本文描述的修饰中的至少一种,以降低与ADA的结合亲和力和/或亲合力,例如如上所述的C末端修饰中的任何一种和/或如上所述的氨基酸取代和/或缺失中的任何一种。
在另一个实施方案中,本发明提供了未经修饰的dAb,其在WO 2007/049017、WO 2008/149144和WO 2008/149148中的任何一个中描述或公开(例如上文描述的dAb序列中的任何一种),并且所述dAb随后进行修饰,以包含例如选自下述的一种或多种构架修饰:P14A、P14K、P14Q、P14T P41A、L108A、T110A和S112A构架突变,并且其还可以进一步任选包含本文描述的任何C末端修饰。在一个实例中,未经修饰的dAb可以是WO 2007/049017、WO 2008/149144和WO 2008/149148中的任何一个中描述或公开的抗TNFR1dAb序列中的任何一种。在一个实施方案中,未经修饰的抗TNFR1 dAb序列可以是这样的序列,其与鉴定为下述的dAb序列至少80%(例如85%、90%、95%、96%、97%、98%、99%、100%)相同:DOM1h-131-206(公开于WO 2008/149148中)、DOM 1h-131-511(公开于WO 2007/049017和2008/149144中)和DOM 1h-131-202(公开于WO 2008/149144中)。
在另一个实施方案中,本发明提供了在WO 2008/149147中描述或公开的VEGF dAb,例如指定为15-26-593的dAb(WO 2008/149147的图5中所示的氨基酸序列)(其内容明确通过引用并入本文),并且所述dAb进一步包含本文描述的修饰中的任何一种,以降低与ADA的结合亲和力和/或亲合力,例如如上所述的C末端修饰中的任何一种和/或如上所述的氨基酸取代和/或缺失中的任何一种。
未经修饰的dAb氨基酸序列如下:
在另一个实施方案中,本发明提供了选自下述序列的经修饰的VHH dAb:
在另一个实施方案中,本发明提供了经修饰的DOM1h-131-206 dAb,其与TNFR1结合且其选自下述氨基酸序列:
(a) 具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb:
(b) 具有单丙氨酸延伸和P14A构架突变的DOM1h-131-206 dAb:
(c) 具有P14A构架突变的DOM1h-131-206 dAb:
(d) 具有ASTKG C末端延伸的DOM1h-131-206 dAb
(e) 具有ASTKG C末端延伸和P14A构架突变的DOM1h-131-206 dAb
本发明还提供了编码本文描述的分子的核酸,例如编码上文描述的抗TNFR1 dAb的核酸。还提供的是包含这些核酸的宿主细胞,例如非胚胎宿主细胞,例如原核或真核宿主细胞,例如大肠杆菌或酵母宿主细胞或哺乳动物细胞。
本发明另外提供了这样的dAb,其具有降低的与人血清中的ADA的结合(例如不与人血清中的预存ADA结合),并且其中ADA与之结合的dAb上的表位被掩蔽(即,表位不再可用于与ADA结合,因为例如它已由另一种分子覆盖或掩蔽,因此阻止结合,或它的立体构象已改变,因此阻止结合)。在dAb上的表位可以通过本文描述的任何修饰进行掩蔽,以降低ADA结合,例如将化学实体加入dAb的C末端或通过如本文描述的构架取代或缺失。加入dAb的C末端的化学实体可以是延伸(例如氨基酸延伸)或标签,或它可以是化学修饰例如聚乙二醇化或酰胺化。对C末端的修饰可以是直接或间接改变dAb上与ADA结合的表位构象的修饰,从而降低dAb与ADA结合的能力。
技术人员将理解在如本文描述的分子例如dAb产生后,特别取决于使用的细胞系和分子例如dAb的特定氨基酸序列,可以发生翻译后修饰。例如,这可以包括某些前导序列的切割、在多种糖基化和磷酸化模式中的多种糖部分的添加、脱酰胺、氧化、二硫键混杂(disulfide bond scrambling)、异构化、C末端赖氨酸剪切和N末端谷氨酰胺环化。本发明包括已实施或已经历一种或多种翻译后修饰的此类分子例如dAb的用途。因此,本发明的dAb包括已经历例如如下所述的翻译后修饰的dAb:在其恒定区中的保守位置处的抗体糖基化已知对抗体功能特别是效应子功能具有深远作用,参见例如Boyd等人(1996)Mol. Immunol. 32:1311-1318。考虑了本发明的抗原结合蛋白的糖基化变体,其中添加、取代、缺失或修饰一个或多个碳水化合物部分。天冬酰胺-X-丝氨酸或天冬酰胺-X-苏氨酸基序的引入产生用于碳水化合物部分的酶促连接的潜在位点,并且因此可以用于操纵抗体的糖基化。在Raju等人(2001)Biochemistry 40:8868-8876中,通过使用β-1,4-半乳糖转移酶(galactosyltransferace)和/或α,2,3唾液酸转移酶的再半乳糖化(regalactosylation)和/或再唾液酸化(resialylation)处理,增加TNFR-IgG免疫粘附的末端唾液酸化。增加末端唾液酸化被认为增加免疫球蛋白的半衰期。抗体和大多数糖蛋白一样,通常作为糖形混合物产生。当抗体在真核细胞特别是哺乳动物细胞中生产时,这种混合物是特别明显的。已开发了制造确定糖形的多种方法,参见Zhang等人(2004)Science 303:371:Sears等人(2001)Science 291:2344;Wacker等人(2002)Science 298:1790;Davis等人(2002)Chem. Rev. 102:579;Hang等人(2001)Acc. Chem. Res 34:727。如本文描述的抗体(例如IgG同种型,例如IgG1)可以包含确定数目(例如7种或更少,例如5种或更少,例如两种或单一)的糖形。脱酰胺是主要将天冬酰胺(N)转换为以大约3:1比的异天冬氨酸和天冬氨酸(D)的酶促反应。在小得多的程度上,脱酰胺可以以类似方式对谷氨酰胺残基发生。CDR中的脱酰胺导致分子电荷中的改变,但通常不导致抗原结合中的改变,它也不影响PK/PD;氧化可以在产生和贮存过程中(即在氧化条件的存在下)发生,并且导致通过活性氧簇直接诱导或通过与氧化性应激的次级副产物反应间接诱导的蛋白质共价修饰。氧化主要对甲硫氨酸残基发生,但偶然地可以在色氨酸和游离半胱氨酸残基处发生;二硫键混杂可以在产生和碱性贮存条件过程中发生。在某些环境下,二硫键可以不正确地破坏或形成,导致不配对的半胱氨酸残基(-SH)。这些游离的(不配对的)巯基(-SH)可以促进混乱;异构化通常在产生、纯化和贮存(在酸性pH下)过程中发生,并且通常在天冬氨酸通过化学处理转换为异天冬氨酸时发生;重链和/或轻链中的N末端谷氨酰胺可能形成焦谷氨酸(pGlu)。大多数pGlu形成在生产生物反应器中发生,但它可以非酶促形成,这取决于加工和贮存条件的pH和温度。pGlu形成视为关于重组mAb的首要降解途径之一;C末端赖氨酸剪切是由羧肽酶催化的酶促反应,并且通常在重组mAb中被观察到。该处理的变体包括赖氨酸从一条或两条重链中的去除。赖氨酸剪切看起来不影响生物活性,并且对mAb效应子功能没有作用。
本发明进一步提供了用于生产作为直接融合物存在的包含氨基酸延伸的本发明分子的方法,所述方法包括在适合于表达所述重组核酸的条件下,维持包含编码本发明融合物的重组核酸和/或构建体的宿主细胞例如上文描述的那些,由此生产融合物。
本发明还提供了包含本发明的经修饰的分子的药物组合物。本发明进一步提供了本发明的药物组合物,其用于药物,例如用于例如疾病或病况或病症的治疗或预防,并且其包括给所述个人施用治疗有效量的本发明的药物组合物。一般地,本发明的分子将以纯化形式连同药理学上或生理学上适当的载体一起利用。通常,这些载体可以包括水或醇/水溶液、乳状液或悬浮液,任何包括盐水和/或缓冲介质。肠胃外媒介物可以包括氯化钠溶液、林格氏(Ringer's)右旋糖、右旋糖和氯化钠和乳酸林格(lactated Ringer's)。如果需要保持多肽复合物处于悬浮,则合适的生理学上可接受的佐剂可以选自增稠剂例如羧甲基纤维素、聚乙烯吡咯烷酮、明胶和藻酸盐类。静脉内媒介物包括流体和营养补充剂和电解质补充剂,例如基于林格氏右旋糖的那些。还可以存在防腐剂及其他添加剂例如抗微生物剂、抗氧化剂、螯合剂和惰性气体(Mack(1982)Remington's Pharmaceutical Sciences,第16版)。可以使用多种合适制剂,包括延长释放制剂。
本发明还提供了用于治疗(治疗上或预防上)患有疾病或病症例如本文描述的那些的患者或个体的方法,并且其包括给所述个人施用治疗有效量的本发明的药物组合物。
本发明的药物组合物可以单独施用或者与其他分子或部分组合施用,所述其他分子或部分例如多肽、治疗蛋白质和/或分子(例如其他蛋白质(包括抗体)、肽或小分子药物。
本发明还提供了本发明的药物组合物,其包含如本文所述进行修饰的抗TNFR1 VH或VL dAb,例如本文描述的那些抗TNFR1 VH或VL dAb,或如本文所述进行修饰的抗TNFR1 VHH结构域,其用于治疗下述炎性疾病或病症,例如银屑病、关节炎、多发性硬化、炎性肠病(例如)克罗恩氏病和溃疡性结肠炎;或例如呼吸性或肺疾病或病症,例如选自:慢性阻塞性肺疾病、慢性支气管炎、慢性阻塞性支气管炎和肺气肿、肺炎症、慢性阻塞性肺疾病、哮喘、肺炎、过敏性肺炎、肺嗜酸性粒细胞浸润症、环境性肺病、肺炎、支气管扩张、囊性纤维化、间质性肺病、原发性肺动脉高压、肺血栓栓塞、胸膜病症、纵隔病症、横膈膜病症、通气不足、过度通气、睡眠呼吸暂停、急性呼吸窘迫综合征、间皮瘤、肉瘤、移植物排斥、移植物抗宿主病、肺癌、变应性鼻炎、过敏症、石棉沉滞症、曲霉肿、曲霉病、支气管扩张、慢性支气管炎、肺气肿、嗜酸细胞性肺炎、特发性肺纤维化、侵袭性肺炎球菌疾病、流行性感冒、非结核分枝杆菌、胸腔积液、肺尘症、肺孢子虫病、肺炎、肺放线菌病、肺泡蛋白沉着症、肺炭疽、肺水肿、肺栓塞、肺炎症、肺组织细胞增多症X、肺动脉高压、肺奴卡菌病、肺结核、肺静脉闭塞性疾病、类风湿肺病、结节病和韦格纳氏肉芽肿病、以及急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)及其并发症,例如急性肾损伤。
本发明还提供了包含如本文所述进行修饰的抗TNFR1 dAb(VH、VL或VHH)的本发明药物组合物在制造用于治疗上文描述的任何特定疾病或病症的药剂中的用途。
本发明还涉及本文描述的任何组合物用于治疗、诊断或预防如上所述的任何炎性疾病或病症或者呼吸性或肺疾病或病症的用途。本发明还涉及本文描述的任何组合物防止或减轻上文描述的任何炎性疾病或病症或者呼吸性或肺疾病或病症的预防用途。
含有如本文描述的抗TNFR1 dAb,例如具有C末端丙氨酸延伸的DOM 1H-131-206的组合物,可以施用用于预防和/或治疗性处理,并且作为“治疗有效剂量”施用。实现这个剂量所需的量将取决于疾病的严重性和患者自身免疫系统的一般状态,但一般范围为0.005至5.0 mg dAb/千克体重,其中0.05至2.0 mg/kg/剂量的剂量是更常用的。对于预防应用,可以使用相似或略微更低的剂量,以防止、抑制或延迟疾病的发作(例如以维持缓解或静止,或以防止急性期)。熟练的临床医生将能够确定适当的给药间隔,以治疗、压制或防止疾病。当施用如本文描述的抗 TNFR1 dAb以治疗、遏制或防止慢性炎性疾病时,它可以以例如下述的剂量施用高至每天四次、每周两次、每周一次、每两周一次、每月一次、或每两个月一次:约10 μg/kg至约80 mg/kg、约100 μg/kg至约80 mg/kg、约1 mg/kg至约80 mg/kg、约1 mg/kg至约70 mg/kg、约1 mg/kg至约60 mg/kg、约1 mg/kg至约50 mg/kg、约1 mg/kg至约40 mg/kg、约1 mg/kg至约30 mg/kg、约1 mg/kg至约20 mg/kg 、约1 mg/kg至约10 mg/kg、约10 μg/kg至约10 mg/kg、约10 μg/kg至约5 mg/kg、约10 μg/kg至约2.5 mg/kg、约1 mg/kg、约2 mg/kg、约3 mg/kg、约4 mg/kg、约5 mg/kg、约6 mg/kg、约7 mg/kg、约8 mg/kg、约9 mg/kg或约10 mg/kg。在具体实施方案中,抗TNFR1 dAb可以每两周一次或每月一次以下述剂量施用,以治疗、遏制或防止慢性炎性疾病:约10 μg/kg至约10 mg/kg(例如约10 μg/kg、约100 μg/kg、约1 mg/kg、约2 mg/kg、约3 mg/kg、约4 mg/kg、约5 mg/kg、约6 mg/kg、约7 mg/kg、约8 mg/kg、约9 mg/kg或约10 mg/kg)。
如果相对于在治疗前存在的此类症状,或相对于未用此类组合物治疗的个人(人或模型动物)中的此类症状或其他合适对照,一种或多种症状或体征降低或减轻(例如至少10%或在临床评估量表上的至少一个点),则使用本文描述的组合物进行的治疗或疗法视为“有效的”。症状将明显取决于所靶向的疾病或病症的准确性质而不同,但可以由普通临床医生或技术人员进行测量。
类似地,如果相对于未用组合物治疗的类似个人(人或动物模型)中的此类症状,一种或多种症状或体征的发作或严重性延迟、降低或消除,则使用如本文描述的组合物进行的预防是“有效的”。
例如通过连接PEG基团、血清白蛋白、转铁蛋白、转铁蛋白受体或至少其转铁蛋白结合部分、抗体Fc区,或通过与抗体结构域缀合,本发明的分子可以进一步设计以具有更大的流体力学大小,以进一步延长半衰期。例如,结合血清白蛋白的dAb可以设计为抗体的更大的抗原结合片段(例如设计为Fab、Fab’、F(ab)2、F(ab’)2、IgG、scFv)。
在某些实施方案中,本发明提供了包含双特异性配体或多特异性配体的根据本发明的组合物,所述双特异性配体或多特异性配体包含第一dAb,其根据本发明例如通过C末端延伸和/或通过P14A构架突变进行修饰,和第二dAb,其具有与第一dAb相同或不同的结合特异性,和任选的在多特异性配体的情况下的进一步dAb。第二dAb(或进一步dAb)可以任选结合不同靶,并且可以任选还包含根据本发明的C末端延伸和/或P14A构架突变。
在一个方面,本发明提供了用于通过肠胃外施用递送的本发明的分子和组合物,所述肠胃外施用例如通过皮下、肌内或静脉内注射,吸入,鼻递送,经粘膜递送,口服递送,递送至患者的胃肠(GI)道,直肠递送或眼递送。在一个方面,本发明提供了本发明的分子和组合物在制造用于通过下述递送的药剂中的用途:皮下注射、吸入、静脉内递送、鼻递送、经粘膜递送、口服递送、递送至患者的胃肠道、直肠递送、经皮或眼递送。
在一个方面,本发明提供了用于通过下述递送至患者的方法:皮下注射、肺递送、静脉内递送、鼻递送、经粘膜递送、口服递送、递送至患者的胃肠道、直肠或眼递送,其中所述方法包括给患者施用药学上有效量的本发明的分子。
在一个方面,本发明提供了包含本发明的分子的口服、可注射、可吸入、可喷雾制剂。
制剂可以以片剂、丸剂、胶囊、液体或糖浆剂的形式。
术语“个体”或“个人”在本文中定义为包括动物例如哺乳动物,包括但不限于灵长类动物(例如人)、牛、绵羊、山羊、马、犬、猫、兔、豚鼠、大鼠、小鼠或其他牛科、绵羊、马科、犬科、猫科、啮齿类或鼠类物种。
本发明还提供了用于给个体(例如人患者)施用根据本发明的分子和组合物的试剂盒,其包含本发明的分子或组合物、药物递送装置和任选的使用说明书。组合物可以作为制剂例如冷冻干燥制剂或缓慢释放制剂提供。在某些实施方案中,药物递送装置选自注射器、吸入器、鼻内或眼施用装置(例如弥雾器(mister)、滴眼剂或滴鼻剂)、和无针注射装置。
本发明的分子和组合物可以冻干用于贮存且在使用前在合适的载体中重构。可以采用任何合适的冻干法(例如喷雾干燥、滤饼干燥(cake drying))和/或重构技术。本领域技术人员将理解冻干和重构可以导致不同程度的抗体活性损失,并且使用水平可能必须进行调整以补偿。在一个具体的实施方案中,本发明提供了包含如本文描述的冻干(冷冻干燥)组合物的组合物。优选地,当再水合时,冻干(冷冻干燥)组合物损失不多于约20%、或不多于约25%、或不多于约30%、或不多于约35%、或不多于约40%、或不多于约45%、或不多于约50%的其活性(例如血清白蛋白的结合活性)。活性是在组合物冻干前,产生其作用所需的组合物量。组合物的活性可以在冻干前使用任何合适方法进行测定,并且活性可以在再水合后使用相同方法进行测定,以测定损失活性的量。
本发明还提供了包含本发明的分子的持续或缓慢释放制剂,此类持续释放制剂可以包含与例如透明质酸、微球体或脂质体和其他药学上或药理学上(pharmacalogically)可接受的载体、赋形剂和/或稀释剂组合的本发明的分子。
在一个方面,本发明提供了包含本发明的分子和药学上或生理学上可接受的载体、赋形剂或稀释剂的药物组合物。
在一个实施方案中,本发明提供了本发明的经修饰的TNFR1 dAb,其具有降低的与ADA的结合,例如如经修饰的DOM1h-131-206 dAb,其具有如本文描述的修饰以降低与ADA的结合。例如,本发明提供了例如作为药物组合物的具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb(SEQ ID NO 16),例如用于治疗疾病或病症,例如以治疗呼吸性疾病或病症例如COPD、ALI或ARDS。当用于治疗呼吸性疾病或病症例如COPD、ALI或ARDS时,具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb(SEQ ID NO 16)(或包含具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb的药物组合物)可以通过注射(例如通过皮下、静脉内或肌内注射)施用于个体,例如人个体,或者,它可以通过肺施用例如通过使用标准喷雾器的喷雾或通过吸入例如通过使用标准吸入器装置而给予个体,例如人个体。本发明进一步提供了持续释放和/或冷冻干燥制剂,其包含本发明具有降低的ADA结合的经修饰TNFR1 dAb,例如具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb(SEQ ID NO 16)。还提供的是递送装置,例如吸入器或喷雾器装置,其包含本发明的经修饰的TNFR1 dAb,例如具有在C末端核酸处的单丙氨酸延伸的DOM1h-131-206 dAb(SEQ ID NO 22)。
在一个方面,本发明提供了未经修饰的DOM1h-131-206 dAb(SEQ ID NO 1),或以本文描述的任何方法进行修饰以降低ADA结合的DOM1h-131-206 dAb,例如具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb(SEQ ID NO 16),以治疗炎性皮肤病症例如银屑病,并且还提供的是如下文描述的在银屑病治疗中使用域抗体的给药方案中的任何一种。用于银屑病治疗的域抗体选择性靶向作为这个受体的天然的人TNF-α配体的人TNFR1的相同结构域,并且是TNFR1而不是TNFR2的特异性竞争拮抗剂,并且阻止TNF-α与TNFR1的结合和这种配体通过TNFR1的信号传递。此类域抗体可以包含任何抗TNFR1 dAb,其已如本文公开的进行修饰以降低与ADA的结合。特别地,域抗体可以是人域抗体,例如如本文公开的具有SEQ ID NO:1中所示的氨基酸序列的DOM1h-131-206,具有SEQ ID NO:16中所示的氨基酸序列并具有C末端丙氨酸的DOM1h-131-206,或其已如本文所述进行修饰以降低ADA结合(即降低与ADA的结合的任何修饰)的DOM1h-131-206 dAb (SEQ ID NO 1)。域抗体可以在含有例如100 mg或例如40mg域抗体冻干产物的小瓶中提供。冻干产物可以包含蔗糖、甘氨酸、磷酸二氢钠和聚山梨醇酯80。这种域抗体冻干产物可以最初在5 mL无菌水中重构,并且随后用无菌水或另一种药学上可接受的稀释剂稀释,以制备包含20mg/mL、5mg/mL和1mg/mL域抗体的药物组合物。
域抗体可以用于治疗鉴定为患有银屑病的人患者。特别地,域抗体可以用于治疗鉴定为患有慢性轻度、中度或重度、稳定斑块型银屑病并具有一个或两个斑块区域的人患者。根据国家银屑病基金会(National Psoriasis Foundation),轻度斑块型银屑病影响小于3%的人患者体表面积,中度斑块型银屑病影响3%至10%的人患者体表面积,并且重度斑块型银屑病影响多于10%的人患者体表面积。参见例如,Krajacic,6(5)Supplement 6,Biotechnology Healthcare,December 2009和National Psoriasis Foundation,关于银屑病:统计学。作为参考点,人患者的手掌将视为大约1%的患者体表面积。作为替代方案,银屑病的严重性还可以根据银屑病面积和严重性指数(Psoriasis Area and Severity Index)通过使用由Fredrikson描述的分级系统进行测定,所述分级系统基于四个标准:发红、厚度、有鳞屑程度(scaliness)和累及表面积的量。参见例如,Fredrickson,157 Dermatologica 238(1978)。当域抗体首次施用时,如通过超声测量评估的,待治疗的银屑病斑块可以具有至少200 µm相当的浸润厚度(infiltrate thickness)。人患者可以是患有慢性斑块型银屑病的男性或女性个体,其具有在上肢、大腿或躯干上的一个或多个稳定斑块。这些人患者可以是约18岁到约70岁。人患者还可以是14到26岁,以及14岁或更大。
域抗体可以通过注射到银屑病斑块内施用于这些人患者。具体而言,包含20mg/mL、5mg/mL或1mg/mL域抗体的100µL药物组合物可以通过以靶向斑块中的表皮和浅层真皮(superficial dermis)的深度注射到银屑病斑块内进行施用。
域抗体可以根据治疗方案施用于具有银屑病斑块的人患者,其中将包含5mg/mL域抗体的100µL药物组合物在28天治疗期过程中每周一次注射到银屑病斑块内。在此类治疗方案中,患者将施用药物组合物四次,并且将在每次施用过程中接受0.5 mg域抗体,使得在28天治疗期过程中接受2 mg域抗体的总剂量。这意指例如在跨越28天的治疗方案中,患者将在第一天时接受含有0.5 mg域抗体的第一次100µL注射,在第八天时的第二次此类注射,在第十五天时的第三次此类注射,和在第二十二天时的第四次此类注射。在这个治疗方案中的域抗体剂量(例如含有0.5 mg域抗体的100µL注射)在mg/患者的基础上施用。
域抗体还可以根据治疗方案施用于具有银屑病斑块的人患者,其中包含20 mg/mL域抗体的100µL药物组合物可以在28天治疗期过程中每周一次注射到银屑病斑块内。在此类治疗方案中,患者将施用药物组合物四次,并且将在每次施用过程中接受2 mg域抗体,使得在28天治疗期过程中接受8 mg域抗体的总剂量。这意指例如在跨越28天的治疗方案中,患者将在第一天时接受含有2 mg域抗体的第一次100µL注射,在第八天时的第二次此类注射,在第十五天时的第三次此类注射,和在第二十二天时的第四次此类注射。在这个治疗方案中的域抗体剂量(例如含有2 mg域抗体的100µL注射)在mg/患者的基础上施用。
域抗体可以根据治疗方案施用于具有银屑病斑块的人患者,其中包含5 mg/mL域抗体的100µL药物组合物可以在28天治疗期过程中每周两次注射到银屑病斑块内。在此类治疗方案中,患者将施用药物组合物八次,并且将在每次施用过程中接受0.5 mg域抗体,使得在28天治疗期过程中接受4 mg域抗体的总剂量。这意指例如在跨越28天的治疗方案中,患者将在第一天时接受含有0.5 mg域抗体的第一次100µL注射,在第四天时的第二次此类注射,在第八天时的第三次此类注射,在第十一天时的第四次此类注射,在第十五天时的第五次此类注射,在第十八天时的第六次此类注射,在第二十二天时的第七次此类注射,和在第二十五天时的第八次此类注射。在这个治疗方案中的域抗体剂量(例如含有0.5 mg域抗体的100µL注射)在mg/患者的基础上施用。
域抗体还可以根据治疗方案施用于具有银屑病斑块的人患者,其中包含1 mg/mL域抗体的100µL药物组合物可以在28天治疗期过程中每周一次注射到银屑病斑块内。在此类治疗方案中,患者将施用药物组合物四次,并且将在每次施用过程中接受0.1 mg域抗体,使得在28天治疗期过程中接受0.4 mg域抗体的总剂量。这意指例如在跨越28天的治疗方案中,患者将在第一天时接受含有0.1 mg域抗体的第一次100µL注射,在第八天时的第二次此类注射,在第十五天时的第三次此类注射,和在第二十二天时的第四次此类注射。在这个治疗方案中的域抗体剂量(例如含有0.1 mg域抗体的100µL注射)在mg/患者的基础上施用。
WO 2008/149148描述了测试、分离和生产未经修饰的DOM1h-131-206 dAb的方法,并且此类方法适用于本发明具有降低的与ADA结合的经修饰的TNFR1 dAb,例如具有在C末端处的单丙氨酸延伸的DOM1h-131-206 dAb(SEQ ID NO 16),并且该公开内容(包括测试、分离和生产方法)并入本文。
在下文另外的实施方案1-36中,本发明还提供了:
1. 单免疫球蛋白可变结构域(dAb)(例如VH、VL或VHH),例如其与靶结合,其包含选自下述的一种或多种修饰:
(a)C末端添加、延伸或标签
(b)一个或多个氨基酸构架取代,其中至少一个取代是选自下述的取代:P14A取代、P41A取代和L108A取代;
并且与未经修饰的单免疫球蛋白可变结构域(dAb)相比较,其具有降低的与预存ADA的结合。
2. 根据上文1的单免疫球蛋白可变结构域(dAb),其中所述dAb选自人VH、或VL dAb或骆驼科VHH。
3. 根据1或2的单免疫球蛋白可变结构域(dAb),其包含至少一个氨基酸的C末端延伸。
4. 根据3的单免疫球蛋白可变结构域(dAb),其中所述C末端延伸包含从一个氨基酸到约6个氨基酸的氨基酸延伸。
5. 根据3或4的单免疫球蛋白可变结构域(dAb),其中所述C末端延伸包含其为丙氨酸的氨基酸。
6. 根据5的单免疫球蛋白可变结构域(dAb),其中所述C末端延伸由其为丙氨酸的单氨基酸组成。
7. 根据权利要求5的单免疫球蛋白可变结构域(dAb),其中所述C末端延伸包含选自下述的氨基酸延伸:(a)AS、(b)AST(c)ASTK、(d)ASTKG或(e)ASTKGP。
8. 根据1-2中任一项的单免疫球蛋白可变结构域(dAb),其中所述C末端具有选自下述的标签:亲和标签、myc标签、FLAG 标签、his-标签、化学修饰例如PEG、或蛋白质结构域例如抗体Fc结构域。
9. 根据6的单免疫球蛋白可变结构域(dAb),其中所述dAb是VH dAb,并且其进一步包含P14A构架取代。
10. 根据7的单免疫球蛋白可变结构域(dAb),其中所述dAb是VH dAb,并且其进一步包含P14A构架取代。
11. 根据前述权利要求中任一项的单免疫球蛋白可变结构域(dAb),其与靶结合,其中所述选自:TNFα、TNFR1、VEGF、IL-1R、IL-6R、IL-4、IL-5、IL-13、DC-SIGN、ASGPR、白蛋白、TGFβR2。
12. 根据11的单免疫球蛋白可变结构域(dAb),其选自鉴定为下述的以下氨基酸序列:(a)具有单丙氨酸的延伸的DOM1h-131-206 dAb(SEQ ID NO 16)(b)具有单丙氨酸的延伸和P14A构架突变的DOM1h-131-206 dAb(SEQ ID NO 17)(c)具有P14A构架突变的DOM1h-131-206 dAb(SEQ ID NO 18)(d)具有ASTKG C末端延伸的DOM1h-131-206 dAb(SEQ ID NO 19)(e)具有ASTKG C末端延伸和P14A构架突变的DOM1h-131-206 dAb(SEQ ID NO 20)。
13. 根据11或12的单免疫球蛋白可变结构域(dAb),其中所述靶是TNFR1,并且所述未经修饰的dAb选自这样的氨基酸序列,其与鉴定为下述的氨基酸100%、95%、90%、85%或80%相同:DOM1h-131-206(SEQ ID NO 1)、DOM 1h-131-511(SEQ ID NO 2)、DOM 1h-131-202(SEQ ID NO 3)。
14. 根据前述权利要求中任一项的单免疫球蛋白可变结构域(dAb),其中所述dAb作为与另外分子的融合物或缀合物存在。
15. 根据14的单免疫球蛋白可变结构域(dAb),其中所述dAb作为与一种或多种选自下述的另外分子的融合物或缀合物存在:另外的dAb,蛋白质或多肽或其片段,例如其为半衰期延长的或是进一步的治疗或活性分子,PEG分子,抗体或其片段例如Fc区。
16. 根据15的单免疫球蛋白可变结构域(dAb),其中所述dAb作为mAbdAb分子存在。
17. 药物组合物,其包含与药学上或生理学上可接受的载体、赋形剂或稀释剂组合的,根据前述任何的单免疫球蛋白可变结构域(dAb)。
18. 根据17的药物组合物,其包含进一步的治疗剂或活性剂。
19. 根据17或18的药物组合物,其包含抗 TNFR1 dAb。
20. 根据19的药物组合物,其包含根据12-13中任一项的抗TNFR1 dAb。
21. 根据权利要求1-16中任一项的单免疫球蛋白可变结构域(dAb),或根据17-20中任一项的组合物,其用于药物。
22. 治疗或预防选自炎性疾病或病症或者呼吸性或肺疾病或病症的至少一种疾病或病症或病况的方法,其通过给个体施用治疗或预防有效量的根据19-20中任一项的组合物或根据11-13的dAb。
23. 22的方法,其中所述至少一种疾病或病症或病况选自:银屑病、关节炎、多发性硬化、炎性肠病(例如)克罗恩氏病和溃疡性结肠炎;或例如呼吸性或肺疾病或病症,例如选自:慢性阻塞性肺疾病、慢性支气管炎、慢性阻塞性支气管炎和肺气肿、肺炎症、慢性阻塞性肺疾病、哮喘、肺炎、过敏性肺炎、肺嗜酸性粒细胞浸润症、环境性肺病、肺炎、支气管扩张、囊性纤维化、间质性肺病、原发性肺动脉高压、肺血栓栓塞、胸膜病症、纵隔病症、横膈膜病症、通气不足、过度通气、睡眠呼吸暂停、急性呼吸窘迫综合征、间皮瘤、肉瘤、移植物排斥、移植物抗宿主病、肺癌、变应性鼻炎、过敏症、石棉沉滞症、曲霉肿、曲霉病、支气管扩张、慢性支气管炎、肺气肿、嗜酸细胞性肺炎、特发性肺纤维化、侵袭性肺炎球菌疾病、流行性感冒、非结核分枝杆菌、胸腔积液、肺尘症、肺孢子虫病、肺炎、肺放线菌病、肺泡蛋白沉着症、肺炭疽、肺水肿、肺栓塞、肺炎症、肺组织细胞增多症X、肺动脉高压、肺奴卡菌病、肺结核、肺静脉闭塞性疾病、类风湿肺病、结节病和韦格纳氏肉芽肿病、以及急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)及其并发症。
24. 根据23的方法,其中所述疾病是ALI,并且所述dAb是根据权利要求13的dAb或包含根据权利要求13的dAb的所述药物组合物。
25. 根据22-24中任一项的方法,其中所述组合物或dAb通过皮下、静脉内或肌内注射递送至个体。
26. 根据22-24中任一项的方法,其中所述组合物或dAb经由肠胃外、口服、直肠、经粘膜、眼、肺或胃肠道递送而递送至个体。
27. 可注射、口服、可吸入或可喷雾制剂,其包含根据1-20中任一项的组合物或dAb。
28. 持续释放制剂,其包含根据权利要求1-20中任一项的组合物。
29. 冷冻干燥制剂,其包含根据1-20中任一项的组合物。
30. 递送装置,其包含根据1-20中任一项的组合物。
31. 递送装置,其包含根据1-20中任一项的组合物,其中所述装置是喷雾器或吸入器。
32. 分离或重组核酸,其编码根据1-16中任一项的dAb。
33. 分离或重组核酸,其编码根据12-13中任一项的dAb。
34. 载体,其包含32或33的核酸。
35. 宿主细胞,其包含32或33的核酸或者34的载体。
36. 生产包含根据1-16中任一项的dAb的多肽的方法,其中所述方法包括在适合于表达所述核酸或载体的条件下,维持35的宿主细胞,从而生产多肽。
37. 根据1-16的dAb,其中所述dAb以这样的KD与ADA结合,其为未经修饰的dAb的KD的150%或更多(例如200%、250%、300%、350%、400%、450%、500%、550%、600%、650%或更多)。
本发明还提供了作为1b-25b列出的下述实施方案:
1b. 单免疫球蛋白可变结构域(dAb),其不与人血清中的预存人ADA结合(或具有降低的结合),其中ADA与之结合的所述dAb上的表位被掩蔽。
2b. 根据上文1b的dAb,其具有这样的与ADA结合的KD,其为其中所述表位未掩蔽的等价序列的KD的150%或更多(例如200%、250%、300%、350%、400%、450%、500%、550%、600%、650%或更多)。
3b. 根据1 b- 2b的dAb,其中所述表位通过下述进行掩蔽:
a. 化学实体向C末端的添加;和/或
b. 一种或多种构架取代;和/或
c. 一种或多种缺失。
4b. 根据3b的dAb,其中所述化学实体包含一个或多个氨基酸、C末端标签或化学修饰例如聚乙二醇化或酰胺化。
5b. 根据3b或4b的dAb,其中(a)、(b)和/或(c)具有对所述表位的直接构象作用,对所述表位的间接构象作用,和/或立体阻碍所述表位。
6b. 根据前述任何的dAb,其中所述表位:
d. 与在C末端处的Kabat残基113重叠;和/或
e. 与Kabat残基14、41、108、110、112和113重叠;和/或
f. 包含表面暴露的Kabat残基14、41、108、110、112和113,和在这些位置的5埃内的任何其他残基;和/或
g. 包含构架4,以及在构架1和2的β链之间的环。
7b. 根据任何前述实施方案1b-6b的dAb,其包含与人种系构架序列相比较,在Kabat位置14、41、108、110或112处的一个或多个氨基酸取代。
8b. 人源化单免疫球蛋白可变结构域(dAb),其具有在下述残基中的一个或多个处的非人序列:Kabat残基14、41、108、110和/或112。
9b. 根据7b或8b的dAb,其中在所述一个或多个位置处的氨基酸残基是丙氨酸残基。
10b. 根据前述任何实施方案1b-9b的dAb,其中所述掩蔽通过对所述dAb的C末端提供氨基酸延伸来实现。
11b. 根据10b的dAb,其中所述延伸是1-8个氨基酸。
12b. 根据10b或11b的dAb,其中所述延伸包含丙氨酸残基。
13b. 根据12b的dAb,其中所述延伸由单丙氨酸残基组成。
14b. 根据12b的dAb,其中所述延伸选自:AS、AST、ASTK、ASTKG和ASTKGP。
15b. 根据1b-14b中任何的dAb,其中所述dAb是VH或VL或VHH dAb。
16b. 根据1b-15b中任何的dAb,其中所述dAb与之结合的靶是TNFα、TNFR1、VEGF、IL-1R、IL-6R、IL-4、IL-5、IL-13、DC-SIGN、ASGPR、白蛋白和TGFβR2。
17b. 根据16b的单免疫球蛋白可变结构域(dAb),其选自鉴定为下述的以下氨基酸序列:(a)具有单丙氨酸的延伸的DOM1h-131-206 dAb(SEQ ID NO 16);(b)具有单丙氨酸的延伸和P14A构架突变的DOM1h-131-206 dAb(SEQ ID NO 17)(c)具有P14A构架突变的DOM1h-131-206 dAb(SEQ ID NO 18);(d)具有ASTKG C末端延伸的DOM1h-131-206 dAb(SEQ ID NO 19);和(e)具有ASTKG C末端延伸和P14A构架突变的DOM1h-131-206 dAb(SEQ ID NO 20)。
18b. 根据16b或17b的单免疫球蛋白可变结构域(dAb),其中所述靶是TNFR1,并且所述未经修饰的dAb选自与鉴定为下述的氨基酸100%、95%、90%、85%或80%相同的序列:DOM1h-131-206(SEQ ID NO 1)、DOM 1h-131-511(SEQ ID NO 2)、DOM 1h-131-202(SEQ ID NO 3)。
19b. 掩蔽单免疫球蛋白可变结构域(dAb)上的表位的方法,所述表位与人血清中的预存人ADA结合,所述方法包括修饰所述表位的步骤。
20b. 降低单免疫球蛋白可变结构域(dAb)与人血清中的预存人ADA结合的方法,其包括掩蔽ADA与之结合的所述dAb上的表位。
21b. 根据19b或20b的方法,其中所述掩蔽引起与ADA结合中的降低,使得包含掩蔽表位的所述dAb具有这样的KD,其为其中所述表位未掩蔽的dAb的KD的150%或更多。
22b. 根据19b - 21b中任何的方法,其中所述表位通过下述进行掩蔽:
h. 化学实体向C末端的添加;和/或
i. 一种或多种构架取代;和/或
j. 一种或多种缺失。
23b. 根据22b的方法,其中所述化学实体包含一个或多个氨基酸、C末端标签或化学修饰例如聚乙二醇化或酰胺化。
24b. 根据22b或23b的方法,其中(a)、(b)和/或(c)具有对所述表位的直接构象作用,对所述表位的间接构象作用,和/或立体阻碍所述表位。
25b. 根据上文19b-24b中任何的方法,其中所述表位:
k. 与在C末端处的Kabat残基113重叠;
l. 与kabat残基14、41、108、110、112和113重叠;和/或
m. 包含表面暴露的Kabat残基14、41、108、110、112和113,和在这个表面的5埃内的任何其他残基;和/或
n. 包含构架4,以及在构架1和2的β链之间的环。
在下文进一步的实施方案1c-15c中,本发明提供了:
1c. 人源化VHH单免疫球蛋白可变结构域,其保留在Kabat残基14和/或108处的一个或多个骆驼种系残基。
2c. 根据上文1c的单免疫球蛋白可变结构域,其具有这样的与人血清中的人ADA结合的KD,其为其中残基14和/或108已被人源化的等价序列的KD的150%或更多(例如200%、250%、300%、350%、400%、450%、500%、550%、600%、650%或更多)。
3c. 根据1c或2c的单免疫球蛋白可变结构域,其中一个或多个C末端氨基酸已被缺失。
4c. 根据3c的单免疫球蛋白可变结构域,其中一个C末端氨基酸已被缺失。
5c. 根据1c或2c的单免疫球蛋白可变结构域,其包含C末端添加、延伸或标签。
6c. 根据5c的单免疫球蛋白可变结构域,其中所述添加、延伸或标签选自:一个或多个氨基酸延伸、C末端标签或化学修饰例如聚乙二醇化或酰胺化。
7c. 根据5c或6c的单免疫球蛋白可变结构域,其中所述延伸是1-8个氨基酸。
8c. 根据7c的单免疫球蛋白可变结构域,其中所述延伸包含丙氨酸残基。
9c. 根据8c的单免疫球蛋白可变结构域,其中所述延伸由单丙氨酸残基组成。
10c. 根据8c的单免疫球蛋白可变结构域,其中所述延伸选自:AS、AST、ASTK、ASTKG、ASTKGP、ASTKA、ASTKAP和ASTKAPS。
11c. 根据前述实施方案1c-10c中的任何的单免疫球蛋白可变结构域,其另外包含在下述残基中的一个或多个处的非人残基:Kabat残基41、110和/或112。
12c. 根据前述实施方案中的任何的单免疫球蛋白可变结构域,其中所述dAb与之结合的靶是TNFα、TNFR1、VEGF、IL-1R、IL-6R、IL-4、IL-5、IL-13、DC-SIGN、ASGPR、白蛋白和TGFβR2。
13c. 人源化骆驼科VHH单免疫球蛋白可变结构域的方法,其包括保留在Kabat残基:14和/或108处的一个或多个骆驼种系残基。
14c. 降低骆驼科VHH单免疫球蛋白可变结构域(dAb)与预存ADA的结合的方法,其包括保留在Kabat残基:14和/或108处的骆驼种系残基。
15c. 根据13c或14c的方法,其中所述保留引起与ADA的结合中的降低,使得在第14和/或108位处包含骆驼科残基的VHH具有这样的与人血清中的人ADA结合的KD,其为具有其中这些残基已被人源化的等价序列的VHH的KD的150%或更多。
注意如本文使用的术语dAb是注册商标。
实施例:
实施例1:具有针对指定为DOM1H-131-206的dAb的预存ADA的健康个体的频率
DOM1H-131-206(VH)ADA测定程序
DOM1H-131-206(SEQ ID NO 1)以8:1的生物素摩尔攻击比进行生物素化。在标记后,将生物素化的DOM1H-131-206(SEQ ID NO 1)更换缓冲液且贮存于以pH 7.4的配制缓冲液中,所述配制缓冲液含有14mM磷酸钠、8.4%蔗糖、0.35%甘氨酸、0.014%聚山梨醇酯80。
DOM1H-131-206以5:1的Sulfo-Tag摩尔攻击比进行钌标记。在标记后,将Sulfo-TAG标记的DOM1H-131-206更换缓冲液且贮存于以pH 7.4的配制缓冲液中,所述配制缓冲液含有14mM磷酸钠、8.4%蔗糖、0.35%甘氨酸、0.014%聚山梨醇酯80。
抗药物抗体(ADA)测定是在MSD ™ ECL(电化学发光)技术平台上进行的桥接测定(bridging assay)。MSD™技术(可得自Meso scale Discovery,Matyland,USA)利用与置于微量滴定板孔内的碳电极结合的钌金属螯合物作为ECL标记,所述微量滴定板用链霉抗生物素蛋白包被。在测定中使用的结合的Sulfo-Tag™产生化学发光信号,当通过仪器(Meso Scale Discovery Sector™ Imager 6000)施加电压时,触发所述化学发光信号。所得到的发光信号以ECL™单位进行测量。信号强度与样品中检测到的抗体数量成正比。在每块测定板上运行阴性(正常人血清;NHS)和阳性(PC;在正常人血清中掺入的小鼠抗DOM1H-131-206独特型抗体)对照样品(QC)。
测定程序概括在下文描述:
1. 将MSD™链霉抗生物素蛋白板用150μL/孔在PBS(1%)中的封闭酪蛋白在室温(RT)下封闭1-2小时。将封闭剂去除,无需洗涤。
2. 在1小时预温育后,将含有在测定稀释剂(在PBS中的1%酪蛋白)中的0.1μg/mL生物素化的DOM1H-131-206(药物)、0.1μg/mL钌化(ruthenylated)的(“Sulfo-Tag” ™)DOM1H-131-206(药物)和2%血清样品的均匀混合物转移到MSD ™板,并且在RT下温育1小时 ± 5分钟。
3. 随后将MSD板用PBST洗涤3次。
4. 加入150μL/孔读取缓冲液(read buffer),并且读取板。
在这个特异性免疫测定的验证过程中,在测定中筛选一组60个健康人供体血清样品的本底反应性。测定到来自这些个体的大约45%血清样品具有可检测的VH反应性自身抗体,大多数为IgG同种型,其能够与DOM1H-131-206结合(结果显示于图1中)。
游离的未标记的DOM1H-131-206在这个测定中竞争ADA结合,导致降低的信号强度(高%信号抑制)。这个‘证实测定’用于测定修饰形式的DOM1H-131-206及其他基于抗体的分子是否能够与DOM1H-131-206竞争ADA结合。
实施例2:对DOM1h-131-206的VH构架的氨基酸取代
游离的未标记的DOM1H-131-206在如上所述的DOM1H-131-206 ADA测定中竞争ADA结合,且导致降低的信号强度。这个‘证实测定’因此用于测定测试材料例如DOM1H-131-206、修饰形式的DOM1H-131-206、或其他基于抗体的分子(‘测试材料’)是否也能够抑制与DOM1H-131-206的ADA结合。
为了研究ADA与VH构架的结合是否可以被降低,通过标准定点诱变技术对DOM1h-131-206的构架进行多个氨基酸取代及其他修饰。
具有取代的分子(测试材料)使用下述方法(证实测定)进行测定:
DOM1H-131-206证实测定程序(其可以用于对ADA结合筛选VH dAb):
1. 将10μg/mL DOM1H-131-206或其他测试材料例如经修饰的dAb在RT下与在测定稀释剂(在PBS中的1%酪蛋白)中的4%ADA阳性人血清预温育1小时 ± 5分钟。
2. 将MSD™链霉抗生物素蛋白板用150μL/孔在PBS(1%)中的封闭酪蛋白在室温(RT)下封闭1-2小时。将封闭剂去除,无需洗涤。
3. 在微量滴定测定板中,将含有ADA阳性人血清样品和10μg/mL测试材料例如经修饰的dAb的样品加入均匀混合物中,所述均匀混合物具有在测定稀释剂(在PBS中的1%酪蛋白)中的生物素化的DOM1H-131-206(SEQ ID NO 1)(药物)和钌化的(“Sulfo-Tag” ™)DOM1H-131-206(SEQ ID NO 1)(药物),使得终浓度是2%ADA阳性人血清、0.1μg/mL生物素化的DOM1H-131-206(SEQ ID NO 1)(药物)和0.1μg/mL钌化的(“Sulfo-Tag” ™)DOM1H-131-206(SEQ ID NO 1)(药物),并且在RT下温育1小时 ± 5分钟。
4. 在1小时温育后,将测定样品转移到封闭的MSD板,并且将板在RT下在黑暗中温育1小时 ± 5分钟。
5. 随后将MSD™板用PBST洗涤3次。
6. 加入150μL/孔读取缓冲液,并且读取板。
对于使用不同亲本克隆(结果显示于表1中)的每个实验,在上文证实测定中(在实施例2中)测试来自10个ADA阳性个体的人血清样品:结果在表1b中显示为(总体)平均%信号抑制以及具有ADA结合的%个体。%信号抑制越低,经修饰的化合物与ADA结合的能力越低。取在%信号抑制中约40.5%的截止值为显示可忽略不计的ADA结合。
使用证实测定,如使用实施例5c中所示的TNFR1亲和测定程序测定的(结果显示于表1中),测定到在下述位置处的氨基酸取代显著降低预存ADA与DOM1H-131-206的结合,同时保留抗原结合的效力,即与TNFR1结合:P14A、P41A、L108Q。
实施例3:对DOM1H-131-206的VH构架的氨基酸延伸
为了测定VH构架的C末端的修饰是否能够降低ADA结合,通过标准定点诱变技术对构架进行多种C末端修饰。使用如先前在实施例2)中所述的‘证实测定’来测定具有取代的分子(测试材料),并且结果显示于下表1中。
C末端DOM1H-131-206或测试的其他分子的延伸还显著降低预存ADA结合(表1,表2)。表2中所示的结果还使用如先前在实施例2中所述的‘证实测定’来获得。这通过延伸A、AS、AST、ASTK、ASTKG、ASTKGP、AAA以及测试的所有更长的延伸来例示。未人源化的VHH克隆具有一般更低的与ADA的结合水平。
表1:与DOM1H-131-206突变体的ADA结合的评估
%抑制 = ADA结合(当给定蛋白质在ADA桥接测定(证实测定)中竞争时的%信号抑制)。
表2:具有C末端延伸的VHH分子和VH域抗体的ADA结合的评估
%抑制 = ADA结合(当给定蛋白质在ADA桥接测定中竞争时的%信号抑制)。
FLAG标签的序列可以在Nature Biotechnology 1988,第16卷,第1204-1210页中发现。
注意取(平均)40%的信号抑制(或小于40%的信号抑制)为显示可忽略不计的ADA结合。
实施例4:对于DOM1H-131-206的VH构架的氨基酸取代和C末端延伸的组合
为了测定VH构架的氨基酸取代和C末端修饰的组合是否能够降低ADA结合,通过标准定点诱变技术对构架进行多种C末端修饰和/或氨基酸取代。使用先前在实施例2)中所述的‘证实测定’来测定具有取代的分子。结果显示于下表3中:
表3:
实施例5a和5b:DOM1H-131-206 C末端延伸的亲和力
采取进一步研究以测定对DOM1H-131-206降低预存ADA的结合的修饰是否导致这种dAb对于其靶(人TNFR1)的亲和力的任何变化。
实施例5a:通过ELISA评估DOM1H-131-206突变体的TNFR1结合
通过ELISA测定经修饰的DOM 1H-131-206变体(测试dAb)与人TNFR1结合的能力。观察到与亲本DOM1H-131-206 dAb相比较,显示降低预存ADA结合的构架突变和C末端修饰一般具有可比较的与TNFR1的结合。例外是具有ASTKGP的C末端延伸的DOM1H-131-206,与亲本dAb DOM1H-131-206相比较,其具有大约低5倍的对于TNFR1结合的EC50。
TNFR1 ELISA结合测定方案:
1. 将重组人TNFR1-Fc(R&D Systems)以在碳酸盐-碳酸氢盐缓冲液pH9.4(Pierce)中的0.1μg/mL终浓度加入96孔ELISA板。
2. 在4℃下过夜温育后,通过用洗涤缓冲液(洗涤缓冲液 - 0.1% Tween-20/PBS)洗涤三次并用PBS洗涤三次,去除过量TNFR1:Fc。
3. 将板用在PBS中的1% BSA在室温下封闭1小时。通过如上洗涤去除封闭,并且随后将在测定稀释剂(0.1% BSA + 0.05% Tween-20/PBS)中稀释的测试dAb样品加入板中,并且在室温下温育1小时。
4. 在如上洗涤后,加入在测定稀释剂中以1:1000稀释度的多克隆兔抗人Ig(Vh特异性),并且在室温下温育1小时。
5. 在如上洗涤后,加入在测定稀释剂中以1:10,000稀释度的小鼠抗兔HRP缀合物抗体,并且在室温下温育1小时。
6. 在如上洗涤后,将100uL SureBlue TMB底物加入每个孔中。一旦足够的蓝色已显色后,用100μL的1M HCl停止酶促反应,并且将板在450nm处读取板。
7. 通过浓度对吸光度值作图来制备关于每种测试dAb的剂量应答曲线。使用Graphpad Prism测定dAb与TNFR1结合的EC50值。
表4a:DOM1H-131-206突变体与TNFR1结合的评估
表4b:DOM1H-131-206突变体与TNFR1结合的评估
表4c:DOM1H-131-206突变体与TNFR1结合的评估
实施例4b:使用Biacore™的TNFR1亲和力测定程序
通过使用Biacore™ T100的表面等离子共振测定具有C末端A延伸的经修饰的DOM1H-131-206的亲和力。将抗人IgG抗体固定到CM4芯片,并且将人TNFR1:Fc在这个表面上捕获至大约60相对单位的水平。将在缓冲液中稀释至25nM至0.024nM的终浓度(在4倍稀释范围中)的测试材料在TNFR1:Fc上注射。生成的结合曲线使用0nM测试材料曲线进行双重参考,并且数据与1:1结合模型拟合以生成动力学数据。测试材料与食蟹猴TNFR1的结合以相同方式进行测定。结合动力学数据显示于下表4d中。
总之,经修饰的(即具有C末端A的添加)和未经修饰的TNFR1dAb的结合动力学是相似的。
表4d:
(对于上文数据未计算误差)。
实施例6:DOM1H-131-206 C末端延伸的药代动力学
采取进一步研究以测定对DOM1H-131-206降低预存ADA的结合的修饰是否导致这种dAb的药代动力学的任何变化。
药代动力学程序
在食蟹猴中测定DOM 1H-131-206和具有C末端丙氨酸延伸的DOM 1H-131-206的全身暴露。5只食蟹猴的分离组通过30分钟静脉内输注用测试材料进行给药。收集直到给药后48小时的血浆样品,并且通过免疫测定来测定两种测试材料的水平。简言之,将对于测试材料特异性的生物素化抗体加入链霉抗生物素蛋白包被的96孔微量滴定板,这之后加入猴血浆样品。加入地高辛标记的人TNFR1:Fc,这之后加入辣根过氧化物酶缀合的抗地高辛抗体。最后,加入TMB底物(可购自R+D systems)并且通过由测试材料标准曲线反向计算比色信号来测定测试材料的量。
当DOM-1H131-206与DOM-1H131-206 +A在静脉内输注后在食蟹猴中进行比较时,未观察到以性别求平均值的全身暴露参数的值得注意的(>2倍)改变。我们得出结论通过添加C末端延伸(+A)对DOM1H-131-206的修饰不影响dAb的药代动力学(表5中所示)。
表5:在食蟹猴中的单次静脉内剂量后,DOM1H-131-206突变体的药代动力学
实施例7a:DOM1H-131-206变体的表达
为了测定对VH构架的修饰(其降低预存ADA结合)是否对抗TNFR1 dAb的表达具有影响,在1升发酵容器中生长后,比较经修饰的抗TNFR1 DOM1H 131-206 dAb变体的实验对象组与亲本克隆的产率。测试dAb掺入C末端延伸(+A或+ASTKG),具有或不具有构架取代(P14A)。测试dAb在相同大肠杆菌菌株中表达,使用与未经修饰的DOM1H 131-206(SEQ ID NO 1)相同的微生物表达载体(pave011(Avecia))。在小规模表达水平(1L)上,具有C末端延伸 +A或+ASTKG的dAb的总体产率类似于未经修饰的亲本克隆。与未经修饰的亲本克隆相比较,具有P14A取代和C末端延伸(+A或+ASTKG)的dAb的产率降低(表6a)。
表达程序
通过用一小瓶在微生物表达载体中表达dAb构建体的大肠杆菌细胞接种100ml摇瓶完成‘种子扩大’阶段。
在大约10小时生长后,种子瓶用于接种1L发酵罐。生产过程由三个阶段构成:分批(batch)、补料分批(fed-batch)和诱导。最初分批期持续大约13小时,在这个时间过程中,培养物在37℃下(对于最后4小时逐步降至30℃)指数生长,直至主要碳源甘油被耗尽。在甘油耗尽时,出现溶解氧(DO)中的尖峰(spike)并且开始营养物补料(补料分批阶段)。在营养物补料起始后约5小时(在OD600 为75时),培养物用IPTG进行诱导(诱导阶段),并且在这个过程阶段中,产物被制备且释放到培养基内。分批在诱导后大约48小时停止,并且通过HPLC定量上清液中的dAb量。
表6a:DOM1H-131-206变体的滴度表示
来自这个实验的结论如下:
1)DOM1H-131-206 +A、DOM1H-131-206 +ASTKG和野生型突变体显示出极佳dAb表达。
最高滴度为约3000mg/L。
2)DOM1H-131-206 P14 +A和DOM1H-131-206 p14 +ASTKG突变体在过程中不表达dAb。
3)一般而言,DOM1H-131-206 +A和DOM1H-131-206+ASTKG在dAb表达水平方面是与野生型相当的。
实施例7b:具有C末端丙氨酸的DOM1H-131-206的稳定性
使用用于DOM 1H-131-206的经验证的免疫测定(下文描述),在人血清、肺匀浆或肝匀浆中测定DOM 1H-131-206 +A的C末端丙氨酸延伸的稳定性,所述免疫测定检测DOM 1H-131-206,但与DOM 1H-131-206+A是极弱交叉反应的。这是由于下述事实:检测抗体M2.3G10.1G06与DOM 1H-131-206结合强,但与DOM 1H-131-206 +A结合弱。测定形式使用人TNFR1:Fc作为捕获试剂,并且因此视为对于完整的功能性dAb是特异性的。
观察到掺有2 μg/mL的DOM 1H-131-206 +A的血浆在这个测定中给出~6.4ng/mL的读数,而掺有2 μg/mL的GSK2862277的缓冲液给出11.3 ng/mL的读数。因此,DOM 1H-131-206 +A在DOM 1H-131-206测定中的交叉反应性估计为0.25-0.5%之间。
为了研究转变,人全血、人肺匀浆(10mg蛋白质/ml)或人肝匀浆(10mg蛋白质/ml)用1μg/ml DOM 1H-131-206、DOM 1H-131-206 +A或缓冲液(不添加药物)进行掺入。在温育0、3小时、6小时或24小时后,通过离心收集血浆/上清液,并且在使用经验证的免疫测定(0.1至10ng/ml的工作范围)测定DOM 1H-131-206前,将样品冷冻。
经过24小时,在任一基质中不存在DOM 1H-131-206 +A至DOM 1H-131-206的明显转变的证据,其会被免疫测定中的渐增信号来证明(由于DOM 1H-131-206的形成)。这提示额外的C末端丙氨酸不易于被快速蛋白酶解切割。
DOM 11H-131-206经验证的免疫测定的方案
生物素化的抗VH mAb(M2.3G10.1G06)在测定缓冲液中(10 mM Tris、150 mM NaCl、0.1%BSA、0.1%Tween20,pH 7.5)稀释,并且100 mL以10ng/ml的终浓度加入中性抗生物素蛋白包被的板(Pierce)的每个孔中。将板密封且在37℃下温育1小时。
使用板洗涤器,将微量滴定板用300 μL洗涤缓冲液(10 mM Tris、150 mM NaCl、0.1%Tween 20,pH 7.5)洗涤5次。
加入100 μL/孔的在基质中稀释的标准品和样品,并且将板密封且伴随恒定振荡在37℃下温育大约2小时。
将微量滴定板用300 μL洗涤缓冲液洗涤5次。
加入100 μL/孔的地高辛标记的hTNFR1:Fc(1:40,000),并且将板密封且伴随恒定振荡在37℃下温育大约2小时。
将微量滴定板用300 μL洗涤缓冲液洗涤5次。
加入100 μL/孔的HRP标记的小鼠抗地高辛抗体(Abcam)(1:20,000),并且溶液用无菌密封带密封,并且将板密封且伴随恒定振荡在37℃下温育大约2小时。
将微量滴定板用300 μL洗涤缓冲液洗涤5次。
加入100 μL/孔的TMB底物(Thermo),并且将板伴随恒定振荡在室温下温育大约5分钟。
加入100 μL/孔的TMB底物终止液(Sigma),并且使用板读取器读出每个孔在450 nm处的吸光度。使用SMS2000将标准曲线与1/x加权四参数逻辑算法拟合,并且由该曲线内插未知样品。
实施例7c:具有C末端丙氨酸延伸(+A)的DOM1H-131-206抑制TNFR1信号转导的能力:
TNFα通过NFκB途径进行信号传递,并且导致多种细胞因子包括IL-8的分泌。在未受刺激的细胞中,IL-8 mRNA快速降解。然而,在TNFα的存在下,NFκB途径的激活导致IL-8 mRNA的稳定。这种稳定作用导致mRNA中的增加且促成IL-8分泌的诱导。因此,在这个测定中,分泌的IL-8的诱导会测定C末端延伸的添加是否影响DOM1H-131-206或DOM1H-131-206+A(即,C末端丙氨酸延伸)抑制TNFR1信号转导的能力。这些研究在人和食蟹猴细胞系中以及在人和食蟹猴全血中进行。IC50值的比较指示降低预存ADA结合的DOM1H-131-206的C末端延伸不负面影响DOM1H-131-206在人或食蟹猴细胞中抑制经由TNFR1的信号转导的能力(表6b)。
在人肺成纤维细胞中测定TNFα诱导的IL-8的抑制的方案
使用人肺成纤维细胞MRC-5细胞(ATCC)测定DOM1H-131-206或DOM1H-131-206+A阻止人TNFα与人TNFR1结合且抑制IL-8分泌的能力。使MRC-5细胞与测试样品一起温育一小时,这之后加入TNFα(220pg/ml)。在37℃和5%CO2下温育24小时后,收获上清液且贮存于-20℃,直到根据制造商用于组织培养样品的方案进行IL-8的MSD™测定时。在测定前,将上清液在所提供的校准稀释剂(Calibrator Diluent)中1比12稀释。曲线拟合在GraphPad Prism中进行,以便测定IC50。
在A549细胞中测定TNFα诱导的IL-8的抑制的方案
将A549细胞以2 x 104细胞/孔的密度接种到96孔板内,并且在37℃和5% CO2下温育过夜,以允许贴壁。随后在0.01nM-1000nM 范围中的多个浓度的DOM1H-131-206或DOM1H-131-206+A的存在下,将细胞温育一小时。每个浓度在一式两份的孔中进行测试。在37℃和5% CO2下温育24小时后,收获上清液且贮存于-20℃,直到根据制造商用于组织培养样品的方案进行IL-8的MSD™测定时。在测定前,将上清液在所提供的校准稀释剂中1比5稀释。曲线拟合和IC50值使用XLFit进行计算。
在CYNOM-K1细胞中测定TNFα诱导的IL-8的抑制的方案
在以100nM起始的多个浓度的DOM1H-131-206或DOM1H-131-206+A的存在下,将CYNOM-K1细胞温育一小时。这随后为用以1ng/ml终浓度的TNFα刺激。在37℃和5%CO2下温育24小时后,收获上清液且贮存于-20℃,直到根据制造商用于组织培养样品的方案进行IL-8的MSD™测定时。在测定前,将上清液在所提供的校准稀释剂中1比12稀释。曲线拟合在GraphPad Prism中进行,以便测定IC50。
在人全血中测定TNFα诱导的IL-8的抑制的方案
将来自健康志愿者供体(具有服从于UK Human Tissue Act的合适许可)的血液收集到肝素钠中。通过将1%BSA加入RPMI-1640培养基(不含酚红)制备测定培养基。将DOM1H-131-206或DOM1H-131-206+A和VH假dAb(VH dummy dAb)在96孔板中的测定培养基中稀释,使得在血液添加后的终浓度将是800nM,并且1比2连续稀释低至0.01nM。每孔加入130 μl血液,并且将板温育一小时(37℃、5%CO2)以允许与TNFR1结合。血样随后用在测定培养基中稀释的10μl TNFα刺激,使得终浓度为10ng/ml。每种条件一式两份进行测试。在进一步的24小时温育(37℃、5%CO2)后,每孔加入110μl PBS,以增加样品体积,其随后在板振荡器上以500rpm振动10分钟,并且以1500 rpm离心5分钟。将血浆转移到新板,并且贮存于-80℃下,直到根据制造商用于血清和血浆样品的方案进行IL-8 MSD™测定时。曲线拟合和IC50值使用XLFit进行计算。
在来自食蟹猴的全血中测定LPS诱导的IL-8的抑制的方案
将来自4只食蟹猴的12ml血液收集到肝素钠中。通过将1% BSA加入RPMI-1640培养基(不含酚红)制备测定培养基。将DOM1H-131-206或DOM1H-131-206+A和VH假dAb在96孔板中的测定培养基中稀释至15X终浓度。每个浓度一式三份进行测试。每孔加入130 μl血液,并且在用在测定培养基中稀释的10μl LPS刺激以使得终浓度为94ng/ml前,将板温育一小时(37℃、5%CO2)。随后将板进一步温育24小时(37℃、5%CO2)。在温育后,每孔加入110μl PBS,以增加样品体积,其随后在板振荡器上以500rpm振动10分钟,并且以2000 rpm离心5分钟。将血浆转移到新板,并且贮存于-80℃下,直到使用根据制造商用于血清和血浆样品的方案进行的人IL-8的MSD™测定来测定IL-8时时。血浆在测定中是未稀释的。曲线拟合和IC50值使用XLFit进行计算。
表6b:在基于人和猴细胞的测定中,与DOM1H-131-206 +A比较的DOM1H-131-206效力的概括:
实施例7d:DOM1h-131-206域抗体用于治疗银屑病的用途
在这些研究中,利用DOM1h-131-206域抗体(具有SEQ ID NO:1中所示的氨基酸序列)以及这种域抗体的啮齿动物直向同源物。用这些分子获得的数据用于选择本文描述的待用于治疗人患者中的银屑病和银屑病斑块的剂量和治疗方案,所述人患者待施用DOM1h-131-206(具有SEQ ID NO:1中所示的氨基酸序列)、或具有末端丙氨酸的DOM1h-131-206 ADA修复分子(fix molecule)(具有SEQ ID NO:16中所示的氨基酸序列),或包含如本文公开的任何ADA修复(即降低dAb与ADA的结合的任何修饰)的DOM1h131206 ADA修复分子。
例如,来源于使用食蟹猴的体内研究的药代动力学显示DOM1h-131-206域抗体(具有SEQ ID NO:1中所示的氨基酸序列)具有2.4 mL/min/kg的血浆清除率,其接近于猴中的肾小球滤过率(GFR),并且给出大约3小时的清除半衰期。关于这种域抗体的分布容积是0.26 L/kg,这大致等于血管外体积且提示中心/血浆区室外部的分布。当DOM1h-131-206域抗体施用于血管外区室时(例如当吸入肺内时),在观察到的反映吸收率限制动力学的消除半衰期中仅存在小改变。
此外,在啮齿动物直向同源物抗TNFR1 dAb(“Dom1m-15-12”)对小鼠的皮内给药后,观察到甚至更长的吸收滞后。这可能是由于在经由皮内途径给药后的GFR和吸收率清除率之间的更大差异。在小鼠血浆中观察到的终末消除率是大约40分钟,其长于在静脉内递送后的(大约20分钟)。在皮内递送后在血浆中可见的更慢的消除率(Ke)通过皮组织PK确证,所述皮组织PK显示5-7小时(Ke 0.1-0.14 h-1)的终末消除率,尽管估计驱动明显延长的消除率的剂量比例是小的(0.5%)。进入血浆内的皮肤吸收率(Ka)由使用啮齿动物直向同源物dAb的皮内给药的大鼠研究确定,并且是相对快速的(Ka=4.1 h-1),导致在剂量后大约1小时观察到的T最大值。估计10%的域抗体保留在大鼠中的皮肤区室内,具有类似于小鼠的来自皮肤的假定消除率。因此,看起来在皮内注射后,DOM1h-131-206域抗体分布到皮肤(例如真皮)中的血管化组织,其中它被快速提取到血浆内且经由肾滤过而消除。在血浆暴露变得可测量前,通过皮肤组织的初始分布和吸收期反映在吸收滞后时间中。考虑到在啮齿动物和人皮肤之间的构造差异,在人中的吸收率预期更长,这依次导致DOM1h-131-206域抗体的更低/无法测量的血浆暴露。这意指人血浆暴露预测基于来自啮齿动物研究的观察,并且因此充当人中的血浆暴露的保守估计值。
在健康志愿者中经由吸入的进行中的试验中,DOM1h-131-206域抗体(具有SEQ ID NO:1中所示的氨基酸序列)也经由静脉内输注(高至3小时持续时间)对健康志愿者给药高至2 mg/kg。衍生的药代动力学参数一般与食蟹猴中的临床前数据非常良好的一致。在静脉内施用后,清除率在0.6-1.5 mL/min/kg之间(在人中的GFR大约1.8 mL/min/kg),具有所得到的5小时消除半衰期。大约0.3 L/kg的分布容积类似于血管外体积。DOM1h-131-206域抗体快速分布到血管外区室内在静脉内(IV)施用后经由支气管肺泡灌洗测量(肺上皮细胞衬液)加以证实。在3小时输注后肺血管外液中的水平是在从给药起始5小时时测量的血浆水平的大约 4-14%。
在人中的功效预测已基于在皮肤区室和人体外细胞系数据中观察到和预测的暴露估计值进行估计。在这些体外系统(不同的复杂性和细胞类型)中的IC50范围(8-40 ng/mL)已用作皮肤区室内的靶谷水平(target trough levels),并且促进本文描述的用于治疗人患者中的银屑病和银屑病斑块的域抗体剂量和治疗方案的选择。例如,选择0.5 mg的起始剂量以实现(假定最坏情况的全身暴露)低于在FTIH静脉内研究(其中在ADA阳性个体中观察到激动)中实现的那些的血浆暴露。在这个初始起始剂量时,预期TNFR1介导的信号传递在注射部位周围的谨慎区带(discreet zone)(< 2 cm2表面积)内在给药后立即被抑制至≥ 90%的水平。随时间的TNFR1抑制依赖于被递送、保留且随后从皮肤区室消除的药物量。假定最小值(如在大鼠中的10%皮肤保留和Ke 0.1-0.14 h-1),预期在0.5 mg DOM1h-131-206域抗体的皮内注射后,水平将维持≥ IC50(在注射/测试区带内)最少3天。
对于域抗体剂量和治疗方案的选择,进行在DOM1h-131-206域抗体的皮内给药后的人血浆暴露的预测。这些预测假定对于皮内注射可以实现的最大可能暴露。将来自静脉内施用的DOM1h-131-206域抗体的实际人血浆浓度-时间数据用于人皮肤PK模型中,所述模型具有固定的吸收率(由啮齿动物皮肤吸收按比例得到)和100%的生物利用度。随后检查关于本文描述的一种或多种最大结构域剂量和治疗方案(每周2 mg + 每两周0.5 mg)的人血浆浓度-时间概况。这揭示预测的峰血浆浓度在剂量后30分钟内快速达到T最大值,并且水平在24小时内快速下降至低于目前的血浆测定定量下限(0.1 ng/mL)的水平。即使使用这种最大可能暴露预测,也没有预期重复给药时血浆中的累积。然而,这种预测代表最高可能的血浆暴露,并且可能暴露能够显著低于所预测的并且甚至是如此低,以使得血浆暴露可能是无法测量的。使用靶抑制水平(根据基于体外细胞的测定),预测在本文描述的治疗方案中的皮肤中的IC90(剂量后立即)或IC50(谷)水平将分别在30-80 ng/mL或8-40 n/mL的范围中。
基于上文信息,经过28天,对于第一剂量、最大日剂量和累积剂量的预测血浆暴露(C最大值和AUC),连同超过临床前安全性的安全限度一起显示于下文表6b中。
表6b:
经过14天重复剂量,在雄性猴中的食蟹猴良好实验室规范毒理学研究(20 mg/kg/天)基于雄性平均(第1、4和14天)暴露(分别为48.5 ug/mL和249 ug·小时/mL的C最大值和AUC(0-24小时))。
最后,将上文呈现的来自体外研究、体内研究和相关分析的信息用于选择在人患者中治疗银屑病所使用的域抗体剂量和治疗方案。
根据如本文公开的治疗方案的域抗体的施用在银屑病治疗中是有用的。例如在特定治疗方案中用于治疗银屑病的域抗体的功效可以通过用超声检查和/或临床评估测量斑块加以证实。
基于高频超声的超声测量可以使用20 MHz高频声谱仪(DUB USB,Taberna pro Medicum,Lueneburg)进行。系列A扫描可以被组成并在监视器上呈现为皮肤区段。大约 200 μm的横向分辨率和80 μm的轴向分辨率是可能且优选的。取决于回声图形,呈现表皮、真皮和皮下组织的组分,并且皮肤厚度的确切测量是可能的。在银屑病斑块部位处的炎性银屑病浸润作为在进入回声(entrance echo)下的可明确确定的回声透亮带而可见。可以在域抗体施用前和域抗体施用后测定且记录回声透亮银屑病带的厚度。这个厚度可以以μm进行测量。在域抗体施用后的回声透亮银屑病带的厚度中的下降证实域抗体例如根据本文公开的治疗方案的施用已在人患者中的银屑病和银屑病斑块治疗中是有效的。参见例如Bangha等人,9 Skin Pharmacol. 298(1996)。
临床评估可以使用5点评分进行,通过域抗体已注射到其内的治疗的银屑病斑块与在治疗的银屑病斑块附近的至少一块未经治疗的斑块的临床比较进行测定。根据这个比较,指定下述临床评估得分(临床评估得分在域抗体第一次施用前定义为0):
-1 = 恶化
0 = 未改变(无作用)
1 = 轻微改善
2 = 明确改善,但未完全治愈
3 = 完全治愈。
因此,在这个基础上,在根据如本文公开的治疗方案施用域抗体后增加的临床评估得分指示在人患者中的银屑病和银屑病斑块治疗中的功效。
实施例8:对VHH克隆的单丙氨酸延伸。
使用实施例2(用于DOM1H-131-206)中使用的证实测定观察ADA与VHH的结合。为了证实ADA结合的相似抑制可以通过修饰VHH序列来实现,测试具有如图2(d)、(e)和(f)中所示的氨基酸序列的三个VHH克隆:
如WO2010100135中所述,克隆VHH2(d)是双特异性形式,具有通过GGGGSGGGS连接到人血清白蛋白结合模块的IL6R结合模块。(氨基酸序列显示于图2d:SEQ ID NO 4中)
如WO2010077422中所述,克隆VHH2(e)是双特异性形式,具有连接到血清白蛋白结合模块的TNF结合模块,所述血清白蛋白结合模块依次连接到TNF结合模块,使用GGGGSGGGS作为接头。(氨基酸序列显示于图2e:SEQ ID NO 5中)
如WO2009115614A2中所示,克隆VHH2(f)是二价单特异性形式,包含通过Ala-Ala-Ala接头连接的两个相同模块,每个模块是可以结合血管性血友病因子的A1结构域的dAb。(氨基酸序列显示于图2f:SEQ ID NO 6中)
上文所有三个克隆均通过对末端丝氨酸残基添加C末端丙氨酸进行修饰,并且经修饰的和未经修饰的克隆使用实施例2的测定进行比较。如下文表7和图4中可见的,结果显示通过单丙氨酸氨基酸残基的C末端延伸降低ADA结合。
表7:
实施例9:具有针对一系列基于VH和VL dAb的分子的预存ADA的健康个体频率
ADA测定程序
类似于实施例1中对于DOM1H-131-206描述的程序,将测试分子(DOM 1H-131-206(SEQ ID NO 1)、DOM 1H-131-206 + C末端丙氨酸延伸(SEQ ID NO 16)、mAb-VH(SEQ ID NO)、肽-VL序列、VH-VL(SEQ ID NO 11)、'735分子(SEQ ID NO 30和31)生物素化,更换缓冲液且贮存于配制缓冲液中。这些测试分子也进行钌标记且随后更换缓冲液且贮存于配制缓冲液中。
如较早描述的,关于每种分子的抗药物抗体(ADA)是在MSD ™ ECL(电化学发光)技术平台上进行的桥接测定。
在这个实验中使用的测定程序概括在下文描述:
1. 将MSD™链霉抗生物素蛋白板用150μL/孔在PBS(1%)中的封闭酪蛋白在室温(RT)下封闭1-2小时。将封闭剂去除,无需洗涤。
2. 在1小时预温育后,将含有在测定稀释剂(在PBS中的1%酪蛋白)中的0.1μg/mL生物素化的测试分子、0.1μg/mL钌化的(“Sulfo-Tag” ™)测试分子和2%血清样品的均匀混合物转移到MSD ™板,并且在RT下温育1小时 ± 5分钟。
3. MSD板随后用PBST洗涤3次。
4. 加入150μL/孔读取缓冲液,并且读取板。
上述浓度和温育时间用于DOM1H-131-206分子。
技术人员将理解精确浓度和温育时间将进行优化,与例如DOM10H-53-567或肽-VL序列相比较,例如DOM1H-131-206(和经修饰的形式)可以具有略微不同的浓度和温育时间。
在测定中筛选一组100个健康人供体血清样品的反应性。在正常人血清样品中还检测到针对可变轻链(VL)构架的预存抗体(ADA),尽管以低于先前针对VH和VHH结构域观察到的强度和频率(参见图4)。结果显示于图5中,其中Y轴显示与ADA的结合水平,并且VH dAb具有最高的ADA结合发生率。
结论是:图5中所示的结果显示预存ADA与DOM 1H-131-206的结合水平和添加C末端延伸对经修饰的DOM 1H -131-206与ADA结合的作用。由图5还可以观察到与VH dAb结合的预存ADA还在它与mAb融合(mAb-VH)时观察到。图5还显示存在与Vκ(Vk)(VL)dAb结合的预存ADA,并且显示的实例包括肽:VL、VH-VL融合物和mAb-VL融合物。
实施例10:对VL构架的氨基酸延伸
因为在正常人血清样品中还检测到针对VL(Vκ)构架的预存抗体,尽管以一般低于对于VH构架观察到的水平(参见图5),所以测定Vκ dAb的C末端区的修饰是否可以降低预存ADA结合,如同已对于含VH分子证明的。
基于mAb:接头:VL分子(指定为'735 - 这种分子是“mAbdAb” - 它是IL-13mAb:接头:IL-4(v κ)dAb),通过标准定点诱变生成一组测试mAb:接头:VL分子,并且其含有相同的VL dAb序列,但具有对VL dAb的多种C末端修饰。将指定为‘15014’、‘15019’、‘15020’和‘15021’的这些测试材料改造为具有C末端延伸(+AAA、+T或+TV),或具有C末端缺失(-R)(下表8中所示)。
使用如下所述的‘证实测定’(类似于先前对于VH dAb所描述的)来测定测试材料。化合物测试通过评价各个化合物与标记的测定特异性化合物竞争结合预存抗体的能力来进行。测定信号中的任何潜在降低报告为%抑制。大于先前测定的该特定测定的证实截点的百分比抑制水平提示测试化合物与测定特异性化合物竞争结合抗Vκ抗体,并且因此可以与测定特异性化合物共享一个或多个表位。
用于测量针对Vκ的预存ADA频率的'735 ADA证实测定程序
1. 在微量滴定测定板中,将在测定稀释剂(在PBS中的1%酪蛋白)中的2% ADA阳性血清样品与终浓度10μg/mL的'735或其他测试材料例如经修饰的dAb一起在RT下温育1小时 ± 5分钟。
2. 在1小时预温育后,将含有在测定稀释剂(在PBS中的1%酪蛋白)中的0.05μg/mL生物素化的'735和0.05μg/mL钌化的(“Sulfo-Tag” ™)'735的均匀混合物加入测定板,并且在RT下温育过夜。
3. 在温育后,随后将MSD板用PBST洗涤3次,将测定样品转移到MSD板,并且将板在RT下在黑暗中温育1小时 ± 5分钟。
4. 随后将MSD™板用PBST洗涤3次。
5. 加入150μL/孔读取缓冲液,并且读取板。
这些化合物筛选的结果呈现于表8中。测试的所有C末端修饰(+AAA、+T、+TV和-R)均显示在'735证实测定中降低的抑制。这提示对VL dAb的C末端修饰以与VH dAb相似的方式消除预存抗体(ADA)的结合。
表8:mAb:VL '735突变体的ADA结合的评估
实施例11:对DOM10H-53-567(抗IL-13 dAb)的VH构架的氨基酸延伸
因为对于抗TNFR1 VH dAb DOM 1H-131-206的C末端修饰降低预存ADA结合,所以测定C末端的修饰是否能够降低与不同VH分子的ADA结合。通过标准定点诱变技术对DOM10H-53-567的VH构架作出C末端修饰。使用先前描述的‘证实测定’来测定具有取代的分子(测试材料)。
DOM10H-53-567的C末端延伸还显著降低预存ADA结合(结果显示于下表9中)。这通过延伸A、AS、AST、ASTK、ASTKG和ASTKG例示。如通过下文描述的IL-13 dAb活性测定和表9b中所示的结果证实的,这些修饰不负面影响DOM10H-53-567克隆结合且抑制其靶抗原IL-13的能力。
表9a:DOM10H-53-567突变体的ADA结合的评估
IL-13 dAb活性测定方案:
使用生物测定用于测量DOM10H-53-567分子的变体在体外在HEKBlue-STAT6细胞中抑制重组人IL-13刺激的碱性磷酸酶生产的能力。将HEK-STAT6细胞(Invivogen)(其在STAT6依赖性启动子的控制下表达分泌型胚胎碱性磷酸酶(SEAP))铺到96孔板内。以3ng/mL浓度的人IL-13和稀释系列的DOM1-H-53-567分子在室温下预平衡1小时,并且随后在37℃下加入到细胞中24小时。在温育后,通过添加Quanti-Blue(Invivogen )并获得在640nm处的光密度读数,来测定由于IL-13刺激通过细胞产生的SEAP的上清液浓度。使用Graphpad Prism由剂量应答曲线计算IC50值。
表9b:DOM10H-53-567突变体的活性评估
降低预存ADA结合的DOM10H-53-567的C末端延伸不负面影响DOM10H-53-567 dAb结合且抑制其靶抗原(人IL-13)的能力。
实施例12a:具有经修饰的C末端的抗VEGF VH/Vk dAb-Fc-dAb分子的克隆
通过经由PCR生成变体Vk dAb序列,且随后通过分别再克隆到DMS30045(SEQ ID NO 40)和DMS30046(SEQ ID NO 41)内,以生成经修饰的哺乳动物表达载体,来改造具有对Vk dAb部分的C末端作出修饰的Vh-Vk dAb-Fc-dAb:DMS30047-30054。从DMS30045中:(i)去除C末端精氨酸残基,以生成DMS30047(DMS30037 -R),(ii)加入C末端丙氨酸,以生成DMS30048(其为DMS30037 + A)(SEQ ID NO 43),(iii)加入三个C末端丙氨酸,以生成DMS30049(DMS30037 + AAA)(SEQ ID NO 44),并且加入C末端苏氨酸以生成DMS30050(DMS30037 + T)(SEQ ID NO 45)。从DMS30046(SEQ ID NO 41)中:(i)去除C末端精氨酸残基,以生成DMS30051(DMS30038 -R)(SEQ ID NO 46),(ii)加入C末端丙氨酸,以生成DMS30052((DMS30038 + A)(SEQ ID NO 47),(iii)加入三个C末端丙氨酸,以生成DMS30053(DMS30038 + AAA)(SEQ ID NO 48),并且加入C末端苏氨酸以生成DMS30054(DMS30038 + T)(SEQ ID NO 43)。
上文分子的描述如下:
DMS30045:DOM15-26-597 dAb N-(VEPKSSDK接头)和C末端K-044-085 dAb((TGLDSP)x4),DMS30046:具有C末端K-044-085 dAb((TGLDSP)x4)的DMS1576,DMS30047(含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)和C末端K-044-085 dAb减去C末端R((TGLDSP)x4),DMS30048(含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)和C末端K-044-085 dAb + A((TGLDSP)x4),DMS30049(含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)和C末端K-044-085 dAb +AAA((TGLDSP)x4),DMS30050(含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)和C末端K-044-085 dAb +T((TGLDSP)x4),DMS30051(含有经修饰的C末端):具有C末端K-044-085 dAb减去C末端R((TGLDSP)x4)的DMS1576,DMS30052(含有经修饰的C末端):具有C末端K-044-085 dAb +A((TGLDSP)x4)的DMS1576,DMS30053(含有经修饰的C末端):具有C末端K-044-085 dAb +AAA((TGLDSP)x4)的DMS1576,DMS30054(含有经修饰的C末端):具有C末端K-044-085 dAb +T((TGLDSP)x4)的DMS1576(分子的氨基酸序列显示于图12和SEQ ID NO 40-49中)。
实施例12B:对VEGF VK dAb哑铃状分子DMS30037和DMS30038的C末端区的修饰具有降低的与预存抗体的结合
用于测量针对Vκ的预存ADA频率的VκADA证实测定程序:
1. 在微量滴定测定板中,将在测定稀释剂(在PBS中的1%酪蛋白)中的10% ADA阳性血清样品与终浓度10μg/mL的测试材料例如经修饰的dAb一起在RT下温育1小时 ± 5分钟。
2. 在1小时预温育后,将ADA阳性血清/测试材料加入具有均匀混合物的测定板中,所述均匀混合物含有在测定稀释剂(在PBS中的1%酪蛋白)中的生物素化的VκdAb(未经修饰的)和钌化的(“Sulfo-Tag” ™)'VκdAb(未经修饰的),终浓度为约0.025μg/mL生物素化的dAb、约0.0125μg/mL钌化的(“Sulfo-Tag” ™)dAb和5%ADA阳性血清。将板在RT下温育1小时 ± 5分钟。
3. 将MSD™链霉抗生物素蛋白板用150μL/孔在PBS中的封闭酪蛋白(1%)在室温(RT)下封闭1-2小时。将封闭剂去除,无需洗涤。
4. 在1小时预温育后,将均匀混合物加入MSD™链霉抗生物素蛋白测定板中,并且在RT下温育1小时 ± 5分钟。
5. 在1小时温育后,随后将MSD板用PBST洗涤3次,将测定样品转移到MSD板,并且将板在RT下在黑暗中温育1小时 ± 5分钟。
4. 随后将MSD™板用PBST洗涤3次。
5. 加入150μL/孔读取缓冲液,并且读取板。
技术人员将理解证实测定中的精确浓度和温育时间将进行优化,例如与DOM10H-53-567相比较,1H-131-206(和经修饰的形式)可以具有略微不同的浓度和温育时间。
这些化合物筛选的结果呈现于下表9B中。对VκdAb(+T、+A、+AAA和-R)测试的所有C末端修饰在上文'697证实测定中均显示降低的抑制。这提示对这些VκdAb的C末端修饰以与Vh dAb相似的方式降低预存抗体(ADA)的结合。
表9b:DMS3007和DMS3008突变体的ADA结合的评估
实施例13 –具有经修饰的C末端的抗VEGF VH/Vk dAb-Fc-dAb分子(DMS30047-30054)的表达
将编码上文实施例12a中所述的相关抗VEGF dAb-Fc-dAb分子的表达质粒瞬时转染到HEK293 6E细胞内,并且使用下文在这个实施例中所述的方法,在500ml规模上表达以产生抗体片段分子。常规达到>30mg/L上清液的表达水平。
将dAb序列克隆到哺乳动物表达载体中的人IgG1同种型的通用Fc的N或C末端。使用接头序列将dAb连接到Fc:N末端接头是AAAS或TVAAPS,并且C末端接头是((GS(TVAAPSGS)x3)或白蛋白结构域3。
实施例14 具有经修饰的C末端的抗VEGF VH/Vk dAb-Fc-dAb分子的纯化
如对于上文实施例描述的,从上清液中亲和纯化dAb-Fc-dAb分子。
实施例15 具有经修饰的C末端的抗VEGF Vh/Vk dAb-Fc-dAb分子通过尺寸排阻层析(SEC)的分子分析
随后通过SDS-PAGE和分析型尺寸排阻层析(SEC)分析已纯化的抗VEGF dAb-Fc-dAb分子的分子完整性、同质性和%纯度。因此在生物学测定中的进一步分析前,蛋白质通过SDS-PAGE和SEC证实为>95%纯的靶蛋白质。
实施例16 具有经修饰的C末端的抗VEGF Vh/Vk dAb-Fc-dAb分子与VEGF在Biacore上的结合。
某些抗VEGF dAb-Fc-dAb分子(具有小C末端修饰)对于VEGF165的结合亲和力通过使用Biacore T100的表面等离子共振(SPR)进行测定。蛋白A通过伯胺偶联固定到C1芯片上,并且这个表面随后用于捕获抗VEGF构建体。人重组VEGF165(‘内部’源于HEK293细胞的瞬时转染)以在4倍稀释系列中的32nM至0.03125nM用作分析物。所有结合曲线均用缓冲液注射(即0nM)双重参考,并且将数据与T100内带的1:1模型拟合。再生使用50mM NaOH进行。运行在37℃下进行,使用HBS-EP作为运行缓冲液。获得的数据显示于表10A、10B和10C中。根据表10A中的数据,DMS30037和在C末端处修饰的几种变体:DMS30037+A(DMS30048)、DMS30037+AAA(DMS30049)、和DMS30037+T(DMS30050)(关于这些分子的进一步细节参见实施例12a)的行为在Biacore上看起来是可比较的,并且C末端修饰看起来不降低效力超过亲本。
进一步的数据集显示于表10B中,其中比较DMS30037和DMS30038两者与在C末端处修饰的变体:DMS30037-R、(标记为+R(DMS30047)、DMS30037+T(DMS30050)和DMS30038-R、(标记为+R(DMS30051)和贝伐珠单抗(安维汀)在Biacore中的表现。在这个数据集中,所有分子的行为再次在Biacore上看起来是可比较的,并且C末端修饰看起来并不降低效力超过亲本。除了观察安维汀的曲线外,不能捕获有意义的数据。进一步的数据展示在表10C中,其中比较分子DMS30037和DMS30038与在C末端处修饰的变体:DMS30037-R、(DMS30047)、DMS30037+T(DMS30050)、DMS30038-R、(DMS30051)和DMS30038+T(DMS30054)和贝伐珠单抗(安维汀)。再次,所有dAb-Fc-dAb分子的行为在Biacore上看起来是可比较的,并且C末端修饰看起来并不降低效力超过亲本。在这个数据集中,参见表10C,贝伐珠单抗(安维汀)数据由于解离速率太紧而不能合适地测量。
表10A:具有C末端修饰的抗VEGF dAb-Fc-dAb分子:DMS30037与VEGF165的结合和与DMS30037的比较。
表10B:具有C末端修饰的抗VEGF dAb-Fc-dAb分子:DMS30037和DMS30038与VEGF165的结合以及与亲本dAb-Fc-dAb和贝伐珠单抗( 安维汀)的比较。
表10C:具有C末端修饰的抗VEGF dAb-Fc-dAb分子:DMS30037和DMS30038与VEGF165的结合以及与亲本dAb-Fc-dAb和贝伐珠单抗( 安维汀)的比较。
实施例17 具有经修饰的C末端的抗VEGF Vh/Vk dAb-Fc-dAb分子的VEGF R2受体结合测定
如下文在这个实施例中所述的,在使用改良的方法(即无需预温育)的VEGF受体2(R2)结合测定中,基于DMS30037和DMS30038、但具有C末端修饰的抗VEGF_Vh/Vk dAb-Fc-dAb分子的效力与野生型分子和贝伐珠单抗(安维汀)两者比较。数据显示于表11A中,所有测试的dAb-Fc-dAb分子:DMS30037、DMS30037+T(DMS30050)、DMS30037-R(DMS30047)、DMS30038、DMS30038-R(DMS30051),看起来均具有相当的效力并且比贝伐珠单抗(安维汀)效力高的多,表11A。在测定中在通过分子实现的最大抑制百分比中存在很少变化,并且所有分子均实现>93-98%最大抑制(数据未显示)。
在相同测定形式中比较dAb-Fc-dAb:DMS30038、DMS30038+T、(DMS30050)和DMS30038-R、(DMS30051)与贝伐珠单抗(安维汀)生成进一步数据,数据展示在表11B中。根据数据,DMS30038及其C末端变体(表11B)具有在RBA测定中通过EC50值判断的相似效力,并且通过这个标准看起来比贝伐珠单抗(安维汀)效力高得多。在测定中在通过分子实现的最大抑制百分比中存在很少变化,并且所有分子均实现>94%最大抑制(数据未显示)。
VEGF R2受体结合测定:效力在VEGF受体结合测定中与贝伐珠单抗(安维汀)的那种相比较进行分析。这个测定测量VEGF165与VEGF R1或VEGF R2的结合和测试分子阻断这种相互作用的能力。MSD标准结合96孔板(L11XA-3)用在碳酸氢盐缓冲液(50µl/孔)中的0.25µg/ml VEGF R1(R&D Systems 321-FL)或VEGF R2(R&D 357-KD)包被,用板密封物覆盖且在4℃下温育过夜。第二天,将MSD板用Tris洗涤缓冲液洗涤3x 300µl/孔,并且在薄纸垫上吸干,以从孔中去除过量洗涤缓冲液。随后将MSD板用在PBS中的3%BSA(250µl/孔)封闭,并且在室温下振荡(750 RPM)温育1小时。在添加2x浓度的抗VEGF分子(25µl/孔)前,将MSD板再次洗涤,并且在添加2x浓度的rhVEGF,25µl/孔,R&D Systems(293-VE/CF,使用杆状病毒在昆虫细胞中制备)或GSK‘内部’ VEGF来源(由HEK293哺乳动物细胞制备,后者的数据除表3A之外未显示)前,在室温下伴随振荡(750 RPM)温育10分钟。抗VEGF分子和VEGF使用在PBS中的0.1%BSA进行制备。进行初始测定,并具有其中抗VEGF分子与VEGF一起预温育的步骤。预温育通过将相等体积的2x浓度的抗VEGF分子加入等体积的2x浓度的VEGF(R&D,293-VE/CF)中在室温下30分钟进行制备。使用的最终VEGF浓度为10ng/ml。还包括无VEGF对照和单独的VEGF对照。MSD板伴随振荡(750 RPM)在室温下温育2小时,随后,在加入以0.25µg/ml于在PBS中的1%BSA中的检测试剂(50µL/孔,山羊抗人VEGF生物素化的抗体 - R&D Systems BAF293)前,将它再次洗涤,并且伴随振荡(750 RPM)在室温下温育1小时。在添加以2µg/ml于在PBS中的1%BSA中的链霉抗生物素蛋白sulfo-TAG(50µl/孔,MSD R32AD-1)前,将MSD板再次洗涤,并且伴随振荡(750 RPM)在室温下温育30分钟。在MSD Sector Imager 6000中测量电化学发光前,洗涤MSD板,并且加入150µl/孔2x读取缓冲液T(MSD R92TC-1)。使用GraphPad Prism进行曲线拟合和EC50计算。如所述的测定测试抗VEGF分子和贝伐珠单抗(安维汀)抑制VEGF与VEGFR1和VEGFR2结合的能力。
改良的方法:进行第二种测定,由此抗VEGF试剂和VEGF在加入到VEGF受体包被的MSD板之前不进行预温育。进行这种测定并且仅使用源于R&D Systems的VEGF,(293-VE/CF)。如上所述但不使用预温育步骤,测定抗VEGF分子和贝伐珠单抗(安维汀)抑制VEGF与VEGFR1和VEGFR2结合的能力。
表11A:在VEGFR2受体结合测定中,与贝伐珠单抗(安维汀)相比,具有C末端修饰的抗VEGF dAb-Fc-dAb的EC50值:
使用GraphPad Prism进行曲线拟合和EC50计算。
表11B:在VEGFR2受体结合测定中,与贝伐珠单抗(安维汀)相比,具有C末端修饰的抗VEGF dAb-Fc-dAb的EC50值:
使用GraphPad Prism进行曲线拟合和EC50计算。
实施例18 –人脐静脉内皮细胞(HUVEC)增殖测定:用含有C末端修饰的抗VEGF Vh/Vk dAb-Fc-dAb分子的抑制:
使用具有下述差异的下文描述的方法(i)使用整个96孔板而非留下无细胞的外侧孔,和(ii)数据使用GraphPad Prism用S形曲线拟合、可变斜率参照非线性回归(可变斜率)进行分析,来比较基于DMS30037和DMS30038但具有C末端修饰的dAb-Fc-dAb分子:DMS30037-R(DMS30047)和DMS30037+T(DMS30050)、DMS30038-R(DMS30051)和DMS30038+T(DMS30054)与贝伐珠单抗(安维汀)抑制人脐静脉内皮细胞增殖的能力。测试化合物独立地在各个板上针对比较物分子贝伐珠单抗(安维汀)进行评估;测定在至少三个分开的场合下进行,并且每分子贝伐珠单抗(安维汀)的总数据集为:15;DMS30037:7;DMS30038:8;DMS30037-R(DMS30047):3;DMS30037+T(DMS30050):4; DMS30038-R(DMS30051):4和DMS30038+T(DMS30054):4,(数据未显示)。焦点集中于分析与贝伐珠单抗(安维汀)的相比较,在测定中通过某些分子生成的最大抑制程度和相对EC50值。
数据使用GraphPad Prism用S形曲线拟合、可变斜率参照非线性回归(可变斜率)进行分析。对于每种分子和在每一天时拟合各个曲线拟合。由于一些弱拟合,决定对其中在较低浓度时未观察到平台(plateau)的曲线引入约束。尽管存在约束,但由于曲线拟合差,因此将一块板从分析中排除。这个约束将等于在最低浓度时的点的平均值。手动选择数据以决定最小值是否受约束,并且曲线拟合和参数基于这个标准选择自动更新。使用方差加权混合模型分析来分析曲线最大值和标准误差的估计值,使用1/(标准误差)2 ,[SE]2作为加权。分析对于使用随机效应项的板和日期之间的可变性进行调整。根据这个分析,估计预测的平均值,并且对安维汀(对照)进行返回比较(参见表12A)。随后对于IC50在log10比例上进行相同分析,并且将结果回变换。由此生成几何平均值的估计值,并且以与安维汀(对照)的比例的形式即0.5的比例将指示从安维汀的50%下降,对安维汀来进行返回比较(参见表12B)。
人脐带内皮细胞(HUVEC)增殖测定:
测定抗VEGF分子与贝伐珠单抗(安维汀)的相比其抑制人脐静脉内皮细胞增殖的能力。该测定测量由确定浓度的VEGF165诱导的内皮细胞增殖程度和VEGF拮抗剂阻断这种效应的能力。HUVEC以5000个细胞/孔接种到96孔明胶包被的板中,留下外侧孔无细胞,并且温育几小时以允许贴壁。测试分子以等摩尔浓度(最大3.33x10-08M)进行测定,使用2倍连续稀释,每种一式三份。VEGF165在基础培养基中进行制备,以实现75ng/ml终浓度。培养基从细胞单层中手动去除,并且加入50µl基础培养基,以防止细胞变干。适当时加入25µl含VEGF165培养基和25µl基础培养基或含测试抗体培养基。将细胞温育72小时,在这个时间后,使用Cell Titre Glo测定细胞总数目。当与未用VEGF165处理的细胞相比较时,用VEGF165处理HUVEC导致在72小时后细胞总数目中的预期增加(数据未显示)。这种VEGF介导的增加解释为代表VEGF对HUVEC增殖和防止HUVEC细胞死亡两者的累积效应。测试化合物独立地在各个板上针对比较物分子贝伐珠单抗(安维汀)进行评估。
表12A:在HUVEC测定中,与亲本和贝伐珠单抗(安维汀)相比较,C末端修饰的抗VEGF dAb-Fc-dAb的最大百分比抑制的预测几何平均值,具有95%置信区间(CI):
根据这个分析,分子DMS30037、DMS30037+T和DMS30037-R看起来在HUVEC测定中导致大部分最大抑制,并且它们表现超过安维汀组,置信区间与零参考不重叠,因此数据与安维汀的是统计学上显著的,数据未显示(参见表12A)。
表12B:在HUVEC测定中,与亲本和贝伐珠单抗(安维汀)相比较,C末端修饰的抗VEGF dAb-Fc-dAb的IC50的几何平均值,具有95%置信区间(CI):
具有95%置信区间(CI)的IC50值的几何平均值的相似分析显示几乎所有dAb-Fc-dAb分子DMS30037、DMS30037+T、DMS30038、DMS30038+T和DMS30038-R均具有比安维汀统计上显著更低的IC50值,数据未显示(参见表18B)。来自DMS30037-R的数据集高度可变,具有低n数目(3)。
总之,数据提示对两种dAb-Fc-dAb:DMS30037和DMS30038的C末端修饰在HUVEC测定中具有与亲本分子非常相似的IC50值和最大抑制水平,并且看起来在最大百分比抑制和更低IC50方面比贝伐珠单抗(安维汀)效力更高(参见表12A和12B)。
实施例19(工具mAb):抗VH mAb用于确定结合预存抗VH ADA的表位的用途:
单克隆抗体(抗VH mAb M2.3G10.1G06)与DOM1H-131-206的VH构架结合,并且测定这种mAb具有低得多的与DOM1H-131-206 +A的结合;因此,这种抗体看起来结合与预存人抗VH ADA相似的表位。
抗VH mAb M2.3G10.1G06的CDR序列:从杂交瘤细胞系中扩增且测序抗VH mAb M2.3G10.1G06的CDR序列。mAb M2.3G10.1G06的重链和轻链序列显示于[氨基酸序列显示于图6a和6b中]。将序列克隆到人IgG1 mAb表达载体内,并且转染到哺乳动物细胞内,以表达鉴定的mAb。从细胞上清液中纯化所得到的抗体,并且测试其结合VH dAb构架的能力。
抗VH mAb M2.3G10.1G06的特异性:通过在MSD ™平台(关于MSD ™平台的细节参见实施例1)上进行的TNFR1:dAb结合测定中测量mAb M2.3G10.1G06的结合,测定mAb M2.3G10.1G06与VH dAb构架(具有或不具有消除预存ADA结合的修饰)结合的特异性。TNFR1:dAb结合测定在下文详述。证实当C末端通过用丙氨酸延伸进行修饰时(1至15%残留结合),钌化的抗VH mAb M2.3G10.1G06与VH构架的结合降低高至85%(结果显示于表13中)。
预存抗VH ADA和mAb M2.3G10.1G06之间的竞争:为了证实抗VH mAb M2.3G10.1G06结合与预存血清抗VH ADA相同的表位,进行竞争测定。测定到来自一系列具有预存抗VH ADA的人供体的血清可以与抗VH mAb M2.3G10.1G06竞争结合DOM1H-131-206(数据显示于图7中)。我们得出结论预存人抗VH ADA和抗VH mAb M2.3G10.1G06在VH构架上共享重叠表位。
破坏预存ADA结合的表位的对VH dAb的修饰可以基于抗VH mAb M2.3G10.1G06的结合进行预测。抗VH mAb M2.3G10.1G06的结合因此可以用于测定导致降低的预存ADA结合的修饰。
使用的方法:
TNFR1:dAb结合测定方案
1. 在4℃下过夜将TNFR1:Fc捕获到高结合(hi-bind)MSD板上。随后将MSD板用MSD/TRIS洗涤缓冲液洗涤3次。
2. 将板用在PBS中的3%BSA在室温下封闭1.5小时。随后将MSD板用MSD/TRIS洗涤缓冲液洗涤3次。
3. 在RT下加入测试dAb(DOM 1H-131-206(SEQ ID NO 1)或具有C末端丙氨酸延伸的DOM 1H-131-206(SEQ ID NO 16))的稀释系列2小时。随后将MSD板用MSD/TRIS洗涤缓冲液洗涤3次。
4. 在室温下加入以1μg/ml终浓度的钌化mAb M2.3G10.1G06 1小时。随后将MSD板用MSD/TRIS洗涤缓冲液洗涤3次。
5. 加入150μL/孔读取缓冲液,并且读取板。
预存抗VH ADA和mAb M2.3G10.1G06的竞争测定方案
1. 将在测定稀释剂(在PBS中的1%酪蛋白)中的0.2μg/mL生物素化的测试分子(dAb)(其为DOM 1H-131-206(SEQ ID NO 1))和20%血清样品在圆底测定板中在RT下温育1小时±5分钟。
2. 在室温下加入以0.5μg/ml终浓度的钌化抗VH mAb M2.3G10.1G06 1小时。
3. 将MSD™链霉抗生物素蛋白板用150μL/孔在PBS中的封闭酪蛋白(1%)在室温(RT)下封闭1-2小时。
4. 将样品转移到MSD™链霉抗生物素蛋白板,并且在室温(RT)下温育1-2小时。
5. 随后将MSD板用PBST洗涤3次。
6. 加入150μL/孔读取缓冲液,并且读取板。
表13:抗VH mAb与DOM1H-131-206或用C末端延伸修饰的DOM1H-131-206的差异结合
这种mAb结合VH dAb例如DOM 1H-131-206(SEQ ID NO 1)的构架,但结合在具有+A C末端修饰的dAb(例如具有C末端丙氨酸延伸的DOM 1H-131-206(SEQ ID NO 16))中大大降低。H链和L链序列已从保藏于Biocat的杂交瘤中测定。存在仅一条LC序列,但存在两条HC序列:一条有功能的序列(参见下文)和一条包括终止密码子和移码的无功能序列。
mAb的表达和针对上文两种分子(其基于下文的预测的有功能序列)的结合证实将允许我们证实我们具有正确的mAb序列用于提交。pTT5构建体装配的方式意指仅非斜体的序列来自杂交瘤,斜体的是来自它克隆到其中的pTT载体的嵌合部分(这是结合测定不需要的)。
轻链
重链
可变区为正常字体。
CDR为下划线/粗体
Fc的嵌合序列为斜体。
Fc是人IgG1。
工具mAb的序列显示于图6(SEQ ID NOs 14和15)中。
<110> Glaxo Group Limited
Morley, Peter
Lewis, Alan
Sandal, Thomas
Ashman, Claire
Steward, Michael
De Wildt,Rudolf
Holland, Claire
Birchler, Mary
<120> 具有降低的与抗药物抗体结合的经修饰的单可变结构域抗体
<130> PB64743wo
<150> US 61/524,488
<151> 2011-08-17
<150> GB 1121226.3
<151> 2011-12-12
<150> GB 1121233.9
<151> 2011-12-12
<150> GB 1121236.2
<151> 2011-12-12
<150> PCT/EP2012/064632
<151> 2012-07-25
<160> 49
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 未经修饰的dAb DOM 1H-131-206 (抗TNFR1)
<400> 1
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala His Glu
20 25 30
Thr Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser His Ile Pro Pro Asp Gly Gln Asp Pro Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr His Cys
85 90 95
Ala Leu Leu Pro Lys Arg Gly Pro Trp Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 2
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 未经修饰的dAb DOM 1H-131-511 (抗TNFR1)
<400> 2
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala His Glu
20 25 30
Thr Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser His Ile Pro Pro Val Gly Gln Asp Pro Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Leu Leu Pro Lys Arg Gly Pro Trp Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 3
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 未经修饰的dAb DOM 1H-131-202 (抗TNFR1)
<400> 3
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala His Glu
20 25 30
Thr Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser His Ile Pro Pro Asp Gly Gln Asp Pro Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Leu Leu Pro Lys Arg Gly Pro Trp Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 4
<211> 245
<212> PRT
<213> 人工序列
<220>
<223> VHH2
<400> 4
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ser Val Phe Lys Ile Asn
20 25 30
Val Met Ala Trp Tyr Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Gly Ile Ile Ser Gly Gly Ser Thr Ser Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Phe Ile Thr Thr Glu Ser Asp Tyr Asp Leu Gly Arg Arg Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
130 135 140
Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
145 150 155 160
Ser Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
165 170 175
Trp Val Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp
180 185 190
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr
195 200 205
Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr
210 215 220
Tyr Cys Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser
245
<210> 5
<211> 363
<212> PRT
<213> 人工序列
<220>
<223> VHH2
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Trp Met Tyr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Asn Thr Asn Gly Leu Ile Thr Lys Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Ser Gly Phe Asn Arg Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu
115 120 125
Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn Ser Leu Arg Leu
130 135 140
Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe Gly Met Ser Trp
145 150 155 160
Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser Ile Ser
165 170 175
Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn
195 200 205
Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly
210 215 220
Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser Gly
225 230 235 240
Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
245 250 255
Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala
260 265 270
Ser Gly Phe Thr Phe Ser Asp Tyr Trp Met Tyr Trp Val Arg Gln Ala
275 280 285
Pro Gly Lys Gly Leu Glu Trp Val Ser Glu Ile Asn Thr Asn Gly Leu
290 295 300
Ile Thr Lys Tyr Pro Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
305 310 315 320
Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro
325 330 335
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Pro Ser Gly Phe Asn
340 345 350
Arg Gly Gln Gly Thr Leu Val Thr Val Ser Ser
355 360
<210> 6
<211> 259
<212> PRT
<213> 人工序列
<220>
<223> VHH2
<400> 6
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 7
<211> 364
<212> PRT
<213> 人工序列
<220>
<223> VHH2
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Trp Met Tyr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Asn Thr Asn Gly Leu Ile Thr Lys Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Ser Gly Phe Asn Arg Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu
115 120 125
Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn Ser Leu Arg Leu
130 135 140
Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe Gly Met Ser Trp
145 150 155 160
Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser Ile Ser
165 170 175
Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn
195 200 205
Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly
210 215 220
Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser Gly
225 230 235 240
Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
245 250 255
Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala
260 265 270
Ser Gly Phe Thr Phe Ser Asp Tyr Trp Met Tyr Trp Val Arg Gln Ala
275 280 285
Pro Gly Lys Gly Leu Glu Trp Val Ser Glu Ile Asn Thr Asn Gly Leu
290 295 300
Ile Thr Lys Tyr Pro Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
305 310 315 320
Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro
325 330 335
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Pro Ser Gly Phe Asn
340 345 350
Arg Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
355 360
<210> 8
<211> 364
<212> PRT
<213> 人工序列
<220>
<223> VHH2
<400> 8
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Trp Met Tyr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Asn Thr Asn Gly Leu Ile Thr Lys Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Ser Gly Phe Asn Arg Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu
115 120 125
Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn Ser Leu Arg Leu
130 135 140
Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe Gly Met Ser Trp
145 150 155 160
Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser Ile Ser
165 170 175
Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn
195 200 205
Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly
210 215 220
Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser Gly
225 230 235 240
Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
245 250 255
Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala
260 265 270
Ser Gly Phe Thr Phe Ser Asp Tyr Trp Met Tyr Trp Val Arg Gln Ala
275 280 285
Pro Gly Lys Gly Leu Glu Trp Val Ser Glu Ile Asn Thr Asn Gly Leu
290 295 300
Ile Thr Lys Tyr Pro Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
305 310 315 320
Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro
325 330 335
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Pro Ser Gly Phe Asn
340 345 350
Arg Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
355 360
<210> 9
<211> 260
<212> PRT
<213> 人工序列
<220>
<223> VHH2
<400> 9
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser Ala
260
<210> 10
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> Dom 1h-574-208
<400> 10
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Lys Tyr
20 25 30
Ser Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gln Ile Ser Asp Thr Ala Asp Arg Thr Tyr Tyr Ala His Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Tyr Thr Gly Arg Trp Val Pro Phe Glu Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 11
<211> 230
<212> PRT
<213> 人工序列
<220>
<223> Dom 1h-574-208-VL融合物
<400> 11
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Lys Tyr
20 25 30
Ser Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gln Ile Ser Asp Thr Ala Asp Arg Thr Tyr Tyr Ala His Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Tyr Thr Gly Arg Trp Val Pro Phe Glu Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Asp Ile Gln Met Thr Gln
115 120 125
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
130 135 140
Cys Arg Ala Ser Arg Pro Ile Gly Thr Thr Leu Ser Trp Tyr Gln Gln
145 150 155 160
Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Leu Trp Asn Ser Arg Leu
165 170 175
Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
180 185 190
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr
195 200 205
Tyr Cys Ala Gln Ala Gly Thr His Pro Thr Thr Phe Gly Gln Gly Thr
210 215 220
Lys Val Glu Ile Lys Arg
225 230
<210> 12
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> DT04-H-033 (亲本IL-13 dAb)
<400> 12
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala Asp Tyr
20 25 30
Gly Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Tyr Asn Gly Leu Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Tyr Glu Tyr Ser Pro Glu Ser Asp Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 13
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> Dom 10h-53-567
<400> 13
Gly Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ala Trp Tyr
20 25 30
Asp Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asp Trp His Gly Glu Val Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ala Glu Asp Glu Pro Gly Tyr Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 14
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 抗VH mAb M2.3G10.1G06
<400> 14
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Pro Thr Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Gly Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 15
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 抗VH mAb M2.3G10.1G06
<400> 15
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Leu Thr Glu Ser
20 25 30
Tyr Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Gly Ile Tyr Tyr Asp Pro Ser Trp Phe Ala Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 16
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> DOM1h-131-206 dAb
<400> 16
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala His Glu
20 25 30
Thr Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser His Ile Pro Pro Asp Gly Gln Asp Pro Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr His Cys
85 90 95
Ala Leu Leu Pro Lys Arg Gly Pro Trp Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 17
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> DOM1h-131-206 dAb
<400> 17
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala His Glu
20 25 30
Thr Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser His Ile Pro Pro Asp Gly Gln Asp Pro Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr His Cys
85 90 95
Ala Leu Leu Pro Lys Arg Gly Pro Trp Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 18
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> DOM1h-131-206 dAb
<400> 18
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala His Glu
20 25 30
Thr Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser His Ile Pro Pro Asp Gly Gln Asp Pro Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr His Cys
85 90 95
Ala Leu Leu Pro Lys Arg Gly Pro Trp Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 19
<211> 124
<212> PRT
<213> 人工序列
<220>
<223> DOM1h-131-206 dAb
<400> 19
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala His Glu
20 25 30
Thr Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser His Ile Pro Pro Asp Gly Gln Asp Pro Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr His Cys
85 90 95
Ala Leu Leu Pro Lys Arg Gly Pro Trp Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120
<210> 20
<211> 124
<212> PRT
<213> 人工序列
<220>
<223> DOM1h-131-206 dAb
<400> 20
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala His Glu
20 25 30
Thr Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser His Ile Pro Pro Asp Gly Gln Asp Pro Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr His Cys
85 90 95
Ala Leu Leu Pro Lys Arg Gly Pro Trp Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120
<210> 21
<211> 357
<212> DNA
<213> 人工序列
<220>
<223> DOM1h-131-206 dAb
<400> 21
gaagtacaac tgctggagag cggtggcggc ctggttcaac cgggtggttc cctgcgcctg 60
tcctgtgcgg catctggttt caccttcgca cacgaaacga tggtgtgggt tcgccaagct 120
ccgggcaaag gcctggaatg ggtaagccac attcctccag atggccagga cccattctat 180
gcggattccg ttaagggtcg ctttaccatt tctcgtgata actccaaaaa caccctgtac 240
ctgcagatga actccctgcg cgccgaggat actgcggtgt accattgtgc gctgctgcct 300
aaacgtggcc cgtggttcga ttactggggt cagggtactc tggtcaccgt aagcagc 357
<210> 22
<211> 360
<212> DNA
<213> 人工序列
<220>
<223> Dom1h-131-206
<400> 22
gaagtacaac tgctggagag cggtggcggc ctggttcaac cgggtggttc cctgcgcctg 60
tcctgtgcgg catctggttt caccttcgca cacgaaacga tggtgtgggt tcgccaagct 120
ccgggcaaag gcctggaatg ggtaagccac attcctccag atggccagga cccattctat 180
gcggattccg ttaagggtcg ctttaccatt tctcgtgata actccaaaaa caccctgtac 240
ctgcagatga actccctgcg cgccgaggat actgcggtgt accattgtgc gctgctgcct 300
aaacgtggcc cgtggttcga ttactggggt cagggtactc tggtcaccgt aagcagcgcg 360
<210> 23
<211> 372
<212> DNA
<213> 人工序列
<220>
<223> Dom1h-131-206
<400> 23
gaagtacaac tgctggagag cggtggcggc ctggttcaac cgggtggttc cctgcgcctg 60
tcctgtgcgg catctggttt caccttcgca cacgaaacga tggtgtgggt tcgccaagct 120
ccgggcaaag gcctggaatg ggtaagccac attcctccag atggccagga cccattctat 180
gcggattccg ttaagggtcg ctttaccatt tctcgtgata actccaaaaa caccctgtac 240
ctgcagatga actccctgcg cgccgaggat actgcggtgt accattgtgc gctgctgcct 300
aaacgtggcc cgtggttcga ttactggggt cagggtactc tggtcaccgt aagcagcgcg 360
tctaccaaag gt 372
<210> 24
<211> 735
<212> DNA
<213> 人工序列
<220>
<223> 抗IL6 VHH
<400> 24
gaagtgcagc tggttgaatc tggcggtggt ctggttcagc cgggtggttc tctgcgtctg 60
tcttgcgcag cgtctggtag cgttttcaaa atcaacgtga tggcgtggta tcgtcaggct 120
ccgggtaaag gtcgtgaact ggttgcgggt atcatttctg gcggtagcac ttcctacgcg 180
gactccgtta aaggtcgttt caccatcagc cgcgacaacg cgaaaaacac cctgtacctg 240
cagatgaact ctctgcgtcc ggaagatacc gcggtttact attgcgcgtt catcaccacc 300
gaatctgact acgacctggg tcgtcgttat tggggtcagg gtactctggt aaccgtatcc 360
tctggtggtg gtggttctgg tggtggttcc gaagtacagc tggtggaatc tggcggtggt 420
ctggtacagc cgggtaactc tctgcgtctg tcttgtgcgg cttctggttt caccttctcc 480
agcttcggta tgtcttgggt tcgtcaggca ccgggtaaag gtctggaatg ggtgtctagc 540
atctctggca gcggttctga taccctgtac gctgactccg tgaaaggtcg tttcactatc 600
tcccgcgaca acgcgaaaac caccctgtac ctgcagatga actctctgcg tccggaagac 660
accgctgttt actactgcac catcggtggt agcctgtccc gttcttctca gggtaccctg 720
gttactgtga gctct 735
<210> 25
<211> 1089
<212> DNA
<213> 人工序列
<220>
<223> 抗TNFαVHH
<400> 25
gaagtgcagc tggtagaatc tggcggtggt ctggtacagc cgggtggttc tctgcgtctg 60
tcttgcgcag cttctggctt caccttctcc gactactgga tgtattgggt tcgtcaggcg 120
ccgggtaaag gtctggaatg ggtgtctgaa atcaacacca acggcctgat caccaaatac 180
ccggactccg tgaaaggtcg tttcaccatc tcccgcgaca acgcgaaaaa caccctgtac 240
ctgcagatga actctctgcg tccggaagat accgcggttt actattgtgc gcgttctccg 300
tctggtttca accgtggtca gggtactctg gttaccgtaa gctctggtgg tggtggatcc 360
ggcggtggtt ctgaagttca gctggttgaa agcggtggtg gtctggtaca gccgggtaac 420
tctctgcgtc tgtcttgtgc ggcttctggc ttcaccttct cctctttcgg tatgtcttgg 480
gttcgtcagg caccgggtaa aggcctggaa tgggtttcct ctatctctgg tagcggttct 540
gacaccctgt acgctgactc tgttaaaggc cgcttcacca tctcccgtga caacgcgaaa 600
accaccctgt atctgcagat gaactccctg cgtccggaag ataccgctgt atactactgc 660
accatcggtg gctctctgtc tcgttcttct cagggtaccc tggttaccgt atctagcggt 720
ggtggtggat ccggtggcgg tagcgaagtt cagctggttg aatctggcgg tggtctggtt 780
cagccgggtg gttctctgcg tctgtcttgt gcagcgtctg gcttcacctt cagcgattac 840
tggatgtact gggttcgtca ggcaccgggt aaaggtctgg aatgggtgtc tgaaatcaac 900
accaacggtc tgatcaccaa atacccggac agcgtgaaag gtcgtttcac catcagccgt 960
gacaacgcga aaaacaccct gtacctgcag atgaactctc tgcgtccgga agacactgcg 1020
gtttattact gcgcacgttc tccgtctggt ttcaaccgtg gtcagggtac cctggttact 1080
gtatcctct 1089
<210> 26
<211> 777
<212> DNA
<213> 人工序列
<220>
<223> 抗血管性血友病 VHH
<400> 26
gaggtacagc tggtggaaag cggtggtggt ctggttcagc cgggtggttc tctgcgtctg 60
tcttgcgcag cttctggccg taccttcagc tacaacccga tgggttggtt ccgtcaggct 120
ccgggtaaag gtcgtgaact ggttgcggcg atctctcgta ccggtggctc tacctactat 180
ccggactccg tggaaggtcg tttcaccatc tcccgcgaca acgcgaaacg tatggtatac 240
ctgcagatga acagcctgcg cgctgaagac accgcggttt actattgtgc tgcagcgggt 300
gttcgtgctg aagacggtcg tgttcgtacc ctgccgtccg aatacacctt ctggggtcag 360
ggtacccagg ttaccgtttc ttctgcagcg gcggaagtgc agctggttga atctggcggt 420
ggtctggtac agccgggtgg ttctctgcgt ctgtcttgtg ctgcgtctgg tcgcaccttc 480
tcctacaacc cgatgggttg gttccgtcag gcaccgggta aaggtcgtga actggtagcg 540
gcaatctctc gcactggtgg ctctacctac tacccggact ctgttgaagg ccgcttcacc 600
atctctcgtg acaacgcgaa acgtatggtg tacctgcaga tgaactccct gcgtgcggaa 660
gacaccgcag tttattactg cgcggcagct ggtgttcgtg cagaagacgg tcgtgttcgt 720
accctgccga gcgaatacac cttctggggt cagggtaccc aggtaaccgt atcttct 777
<210> 27
<211> 738
<212> DNA
<213> 人工序列
<220>
<223> 抗IL6 VHH
<400> 27
gaagtgcagc tggttgaatc tggcggtggt ctggttcagc cgggtggttc tctgcgtctg 60
tcttgcgcag cgtctggtag cgttttcaaa atcaacgtga tggcgtggta tcgtcaggct 120
ccgggtaaag gtcgtgaact ggttgcgggt atcatttctg gcggtagcac ttcctacgcg 180
gactccgtta aaggtcgttt caccatcagc cgcgacaacg cgaaaaacac cctgtacctg 240
cagatgaact ctctgcgtcc ggaagatacc gcggtttact attgcgcgtt catcaccacc 300
gaatctgact acgacctggg tcgtcgttat tggggtcagg gtactctggt aaccgtatcc 360
tctggtggtg gtggttctgg tggtggttcc gaagtacagc tggtggaatc tggcggtggt 420
ctggtacagc cgggtaactc tctgcgtctg tcttgtgcgg cttctggttt caccttctcc 480
agcttcggta tgtcttgggt tcgtcaggca ccgggtaaag gtctggaatg ggtgtctagc 540
atctctggca gcggttctga taccctgtac gctgactccg tgaaaggtcg tttcactatc 600
tcccgcgaca acgcgaaaac caccctgtac ctgcagatga actctctgcg tccggaagac 660
accgctgttt actactgcac catcggtggt agcctgtccc gttcttctca gggtaccctg 720
gttactgtga gctctgcg 738
<210> 28
<211> 1092
<212> DNA
<213> 人工序列
<220>
<223> 抗TNFαVHH
<400> 28
gaagtgcagc tggtagaatc tggcggtggt ctggtacagc cgggtggttc tctgcgtctg 60
tcttgcgcag cttctggctt caccttctcc gactactgga tgtattgggt tcgtcaggcg 120
ccgggtaaag gtctggaatg ggtgtctgaa atcaacacca acggcctgat caccaaatac 180
ccggactccg tgaaaggtcg tttcaccatc tcccgcgaca acgcgaaaaa caccctgtac 240
ctgcagatga actctctgcg tccggaagat accgcggttt actattgtgc gcgttctccg 300
tctggtttca accgtggtca gggtactctg gttaccgtaa gctctggtgg tggtggatcc 360
ggcggtggtt ctgaagttca gctggttgaa agcggtggtg gtctggtaca gccgggtaac 420
tctctgcgtc tgtcttgtgc ggcttctggc ttcaccttct cctctttcgg tatgtcttgg 480
gttcgtcagg caccgggtaa aggcctggaa tgggtttcct ctatctctgg tagcggttct 540
gacaccctgt acgctgactc tgttaaaggc cgcttcacca tctcccgtga caacgcgaaa 600
accaccctgt atctgcagat gaactccctg cgtccggaag ataccgctgt atactactgc 660
accatcggtg gctctctgtc tcgttcttct cagggtaccc tggttaccgt atctagcggt 720
ggtggtggat ccggtggcgg tagcgaagtt cagctggttg aatctggcgg tggtctggtt 780
cagccgggtg gttctctgcg tctgtcttgt gcagcgtctg gcttcacctt cagcgattac 840
tggatgtact gggttcgtca ggcaccgggt aaaggtctgg aatgggtgtc tgaaatcaac 900
accaacggtc tgatcaccaa atacccggac agcgtgaaag gtcgtttcac catcagccgt 960
gacaacgcga aaaacaccct gtacctgcag atgaactctc tgcgtccgga agacactgcg 1020
gtttattact gcgcacgttc tccgtctggt ttcaaccgtg gtcagggtac cctggttact 1080
gtatcctctg cg 1092
<210> 29
<211> 780
<212> DNA
<213> 人工序列
<220>
<223> 抗血管性血友病 VHH
<400> 29
gaggtacagc tggtggaaag cggtggtggt ctggttcagc cgggtggttc tctgcgtctg 60
tcttgcgcag cttctggccg taccttcagc tacaacccga tgggttggtt ccgtcaggct 120
ccgggtaaag gtcgtgaact ggttgcggcg atctctcgta ccggtggctc tacctactat 180
ccggactccg tggaaggtcg tttcaccatc tcccgcgaca acgcgaaacg tatggtatac 240
ctgcagatga acagcctgcg cgctgaagac accgcggttt actattgtgc tgcagcgggt 300
gttcgtgctg aagacggtcg tgttcgtacc ctgccgtccg aatacacctt ctggggtcag 360
ggtacccagg ttaccgtttc ttctgcagcg gcggaagtgc agctggttga atctggcggt 420
ggtctggtac agccgggtgg ttctctgcgt ctgtcttgtg ctgcgtctgg tcgcaccttc 480
tcctacaacc cgatgggttg gttccgtcag gcaccgggta aaggtcgtga actggtagcg 540
gcaatctctc gcactggtgg ctctacctac tacccggact ctgttgaagg ccgcttcacc 600
atctctcgtg acaacgcgaa acgtatggtg tacctgcaga tgaactccct gcgtgcggaa 660
gacaccgcag tttattactg cgcggcagct ggtgttcgtg cagaagacgg tcgtgttcgt 720
accctgccga gcgaatacac cttctggggt cagggtaccc aggtaaccgt atcttctgcg 780
<210> 30
<211> 581
<212> PRT
<213> 人工序列
<220>
<223> mAb-VL '735分子(IL-13mAb: IL-4VκdAb)
'735分子
<400> 30
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Tyr Ile Lys Asp Thr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Asp Pro Ala Asn Gly Asn Thr Lys Tyr Val Pro Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Ile Tyr Asp Asp Tyr His Val Asp Asp Tyr Tyr Ala Met
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys Gly Ser Thr Val Ala Ala Pro Ser Gly
450 455 460
Ser Thr Val Ala Ala Pro Ser Gly Ser Asp Ile Gln Met Thr Gln Ser
465 470 475 480
Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
485 490 495
Arg Ala Ser Arg Pro Ile Ser Asp Trp Leu His Trp Tyr Gln Gln Lys
500 505 510
Pro Gly Lys Ala Pro Lys Leu Leu Ile Ala Trp Ala Ser Ser Leu Gln
515 520 525
Gly Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
530 535 540
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr
545 550 555 560
Cys Gln Gln Glu Gly Trp Gly Pro Pro Thr Phe Gly Gln Gly Thr Lys
565 570 575
Val Glu Ile Lys Arg
580
<210> 31
<211> 219
<212> PRT
<213> 人工序列
<220>
<223> 735分子
<400> 31
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Asn Ile Val His Ile
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asp Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Asp Asp Val Gly Ile Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 32
<211> 571
<212> PRT
<213> 人工序列
<220>
<223> 15014
<400> 32
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Arg Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Arg Glu Thr Val Phe Tyr Trp Tyr Phe Asp Val Trp Gly
100 105 110
Arg Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys Gly Ser Thr Val Ala Ala Pro Ser Thr Asp Ile Gln Met
450 455 460
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
465 470 475 480
Ile Thr Cys Arg Ala Ser Arg Pro Ile Ser Asp Trp Leu His Trp Tyr
485 490 495
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Ala Trp Ala Ser
500 505 510
Ser Leu Gln Gly Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
515 520 525
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
530 535 540
Thr Tyr Tyr Cys Gln Gln Glu Gly Trp Gly Pro Pro Thr Phe Gly Gln
545 550 555 560
Gly Thr Lys Val Glu Ile Lys Arg Ala Ala Ala
565 570
<210> 33
<211> 218
<212> PRT
<213> 人工序列
<220>
<223> 15014
<400> 33
Asp Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 34
<211> 569
<212> PRT
<213> 人工序列
<220>
<223> mAb-VL 15019
<400> 34
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Arg Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Arg Glu Thr Val Phe Tyr Trp Tyr Phe Asp Val Trp Gly
100 105 110
Arg Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys Gly Ser Thr Val Ala Ala Pro Ser Thr Asp Ile Gln Met
450 455 460
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
465 470 475 480
Ile Thr Cys Arg Ala Ser Arg Pro Ile Ser Asp Trp Leu His Trp Tyr
485 490 495
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Ala Trp Ala Ser
500 505 510
Ser Leu Gln Gly Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
515 520 525
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
530 535 540
Thr Tyr Tyr Cys Gln Gln Glu Gly Trp Gly Pro Pro Thr Phe Gly Gln
545 550 555 560
Gly Thr Lys Val Glu Ile Lys Arg Thr
565
<210> 35
<211> 218
<212> PRT
<213> 人工序列
<220>
<223> mAb-VL 15019
<400> 35
Asp Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 36
<211> 570
<212> PRT
<213> 人工序列
<220>
<223> mAb-VL 15020
<400> 36
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Arg Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Arg Glu Thr Val Phe Tyr Trp Tyr Phe Asp Val Trp Gly
100 105 110
Arg Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys Gly Ser Thr Val Ala Ala Pro Ser Thr Asp Ile Gln Met
450 455 460
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
465 470 475 480
Ile Thr Cys Arg Ala Ser Arg Pro Ile Ser Asp Trp Leu His Trp Tyr
485 490 495
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Ala Trp Ala Ser
500 505 510
Ser Leu Gln Gly Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
515 520 525
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
530 535 540
Thr Tyr Tyr Cys Gln Gln Glu Gly Trp Gly Pro Pro Thr Phe Gly Gln
545 550 555 560
Gly Thr Lys Val Glu Ile Lys Arg Thr Val
565 570
<210> 37
<211> 218
<212> PRT
<213> 人工序列
<220>
<223> mAb-VL 15020
<400> 37
Asp Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 38
<211> 530
<212> PRT
<213> 人工序列
<220>
<223> mAb-VL 15021
<400> 38
Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu Ala His Ile
1 5 10 15
Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser Leu Lys Ser Arg Leu
20 25 30
Thr Ile Ser Lys Asp Thr Ser Arg Asn Gln Val Val Leu Thr Met Thr
35 40 45
Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala Arg Arg Glu
50 55 60
Thr Val Phe Tyr Trp Tyr Phe Asp Val Trp Gly Arg Gly Thr Leu Val
65 70 75 80
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
85 90 95
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
100 105 110
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
115 120 125
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
130 135 140
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
145 150 155 160
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
165 170 175
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
180 185 190
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
195 200 205
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
210 215 220
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
225 230 235 240
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
245 250 255
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
260 265 270
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
275 280 285
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
290 295 300
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
305 310 315 320
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
325 330 335
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
340 345 350
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
355 360 365
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
370 375 380
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
385 390 395 400
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Ser
405 410 415
Thr Val Ala Ala Pro Ser Thr Asp Ile Gln Met Thr Gln Ser Pro Ser
420 425 430
Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
435 440 445
Ser Arg Pro Ile Ser Asp Trp Leu His Trp Tyr Gln Gln Lys Pro Gly
450 455 460
Lys Ala Pro Lys Leu Leu Ile Ala Trp Ala Ser Ser Leu Gln Gly Gly
465 470 475 480
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
485 490 495
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
500 505 510
Gln Glu Gly Trp Gly Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu
515 520 525
Ile Lys
530
<210> 39
<211> 218
<212> PRT
<213> 人工序列
<220>
<223> mAb-VL 15021
<400> 39
Asp Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 40
<211> 481
<212> PRT
<213> 人工序列
<220>
<223> DMS30045: DOM15-26-597 dAb N-(VEPKSSDK接头)和
C末端K-044-085 dAb ((TGLDSP)x4)
<400> 40
Glu Val Gln Leu Leu Val Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Lys Ala Tyr
20 25 30
Pro Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Ser Pro Ser Gly Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Arg Lys Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Val Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys
115 120 125
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
130 135 140
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
145 150 155 160
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
165 170 175
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
180 185 190
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
195 200 205
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
210 215 220
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
225 230 235 240
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
245 250 255
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
260 265 270
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
275 280 285
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
290 295 300
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
305 310 315 320
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
325 330 335
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Thr Gly Leu
340 345 350
Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr
355 360 365
Gly Leu Asp Ser Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu
370 375 380
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
385 390 395 400
Trp Ile Gly Pro Glu Leu Lys Trp Tyr Gln Gln Lys Pro Gly Lys Ala
405 410 415
Pro Lys Leu Leu Ile Tyr His Gly Ser Ile Leu Gln Ser Gly Val Pro
420 425 430
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
435 440 445
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr
450 455 460
Met Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
465 470 475 480
Arg
<210> 41
<211> 475
<212> PRT
<213> 人工序列
<220>
<223> DMS30046: 具有C末端K-044-085 dAb((TGLDSP)x4)的DMS1576
<400> 41
Glu Val Gln Leu Leu Val Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Lys Ala Tyr
20 25 30
Pro Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Ser Pro Ser Gly Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Arg Lys Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr His Thr Cys Pro Pro Cys Pro Ala Pro
115 120 125
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
130 135 140
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
145 150 155 160
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
165 170 175
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
180 185 190
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
195 200 205
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
210 215 220
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
225 230 235 240
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
245 250 255
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
260 265 270
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
275 280 285
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
290 295 300
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
305 310 315 320
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
325 330 335
Leu Ser Leu Ser Pro Gly Lys Thr Gly Leu Asp Ser Pro Thr Gly Leu
340 345 350
Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr Gly Leu Asp Ser Pro Asp
355 360 365
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
370 375 380
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Trp Ile Gly Pro Glu Leu
385 390 395 400
Lys Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
405 410 415
His Gly Ser Ile Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
420 425 430
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
435 440 445
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Met Tyr Tyr Pro His Thr
450 455 460
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
465 470 475
<210> 42
<211> 480
<212> PRT
<213> 人工序列
<220>
<223> DMS30047 (含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)
和C末端K-044-085 dAb减去C末端R ((TGLDSP)x4)
<400> 42
Glu Val Gln Leu Leu Val Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Lys Ala Tyr
20 25 30
Pro Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Ser Pro Ser Gly Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Arg Lys Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Val Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys
115 120 125
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
130 135 140
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
145 150 155 160
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
165 170 175
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
180 185 190
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
195 200 205
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
210 215 220
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
225 230 235 240
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
245 250 255
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
260 265 270
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
275 280 285
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
290 295 300
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
305 310 315 320
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
325 330 335
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Thr Gly Leu
340 345 350
Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr
355 360 365
Gly Leu Asp Ser Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu
370 375 380
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
385 390 395 400
Trp Ile Gly Pro Glu Leu Lys Trp Tyr Gln Gln Lys Pro Gly Lys Ala
405 410 415
Pro Lys Leu Leu Ile Tyr His Gly Ser Ile Leu Gln Ser Gly Val Pro
420 425 430
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
435 440 445
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr
450 455 460
Met Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
465 470 475 480
<210> 43
<211> 482
<212> PRT
<213> 人工序列
<220>
<223> DMS30048 (含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)
和C末端K-044-085 dAb + A ((TGLDSP)x4
<400> 43
Glu Val Gln Leu Leu Val Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Lys Ala Tyr
20 25 30
Pro Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Ser Pro Ser Gly Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Arg Lys Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Val Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys
115 120 125
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
130 135 140
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
145 150 155 160
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
165 170 175
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
180 185 190
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
195 200 205
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
210 215 220
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
225 230 235 240
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
245 250 255
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
260 265 270
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
275 280 285
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
290 295 300
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
305 310 315 320
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
325 330 335
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Thr Gly Leu
340 345 350
Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr
355 360 365
Gly Leu Asp Ser Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu
370 375 380
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
385 390 395 400
Trp Ile Gly Pro Glu Leu Lys Trp Tyr Gln Gln Lys Pro Gly Lys Ala
405 410 415
Pro Lys Leu Leu Ile Tyr His Gly Ser Ile Leu Gln Ser Gly Val Pro
420 425 430
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
435 440 445
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr
450 455 460
Met Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
465 470 475 480
Arg Ala
<210> 44
<211> 484
<212> PRT
<213> 人工序列
<220>
<223> DMS30049 (含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)
和C末端K-044-085 dAb +AAA ((TGLDSP)x4)
<400> 44
Glu Val Gln Leu Leu Val Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Lys Ala Tyr
20 25 30
Pro Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Ser Pro Ser Gly Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Arg Lys Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Val Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys
115 120 125
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
130 135 140
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
145 150 155 160
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
165 170 175
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
180 185 190
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
195 200 205
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
210 215 220
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
225 230 235 240
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
245 250 255
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
260 265 270
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
275 280 285
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
290 295 300
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
305 310 315 320
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
325 330 335
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Thr Gly Leu
340 345 350
Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr
355 360 365
Gly Leu Asp Ser Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu
370 375 380
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
385 390 395 400
Trp Ile Gly Pro Glu Leu Lys Trp Tyr Gln Gln Lys Pro Gly Lys Ala
405 410 415
Pro Lys Leu Leu Ile Tyr His Gly Ser Ile Leu Gln Ser Gly Val Pro
420 425 430
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
435 440 445
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr
450 455 460
Met Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
465 470 475 480
Arg Ala Ala Ala
<210> 45
<211> 482
<212> PRT
<213> 人工序列
<220>
<223> DMS30050 (含有经修饰的C末端):DOM15-26-597 dAb N-(VEPKSSDK接头)
和C末端K-044-085 dAb +T ((TGLDSP)x4)
<400> 45
Glu Val Gln Leu Leu Val Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Lys Ala Tyr
20 25 30
Pro Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Ser Pro Ser Gly Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Arg Lys Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Val Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys
115 120 125
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
130 135 140
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
145 150 155 160
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
165 170 175
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
180 185 190
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
195 200 205
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
210 215 220
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
225 230 235 240
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
245 250 255
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
260 265 270
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
275 280 285
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
290 295 300
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
305 310 315 320
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
325 330 335
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Thr Gly Leu
340 345 350
Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr
355 360 365
Gly Leu Asp Ser Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu
370 375 380
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
385 390 395 400
Trp Ile Gly Pro Glu Leu Lys Trp Tyr Gln Gln Lys Pro Gly Lys Ala
405 410 415
Pro Lys Leu Leu Ile Tyr His Gly Ser Ile Leu Gln Ser Gly Val Pro
420 425 430
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
435 440 445
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr
450 455 460
Met Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
465 470 475 480
Arg Thr
<210> 46
<211> 474
<212> PRT
<213> 人工序列
<220>
<223> DMS30051 (含有经修饰的C末端): 具有C末端K-044-085 dAb减去
C末端R((TGLDSP)x4)的DMS1576
<400> 46
Glu Val Gln Leu Leu Val Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Lys Ala Tyr
20 25 30
Pro Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Ser Pro Ser Gly Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Arg Lys Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr His Thr Cys Pro Pro Cys Pro Ala Pro
115 120 125
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
130 135 140
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
145 150 155 160
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
165 170 175
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
180 185 190
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
195 200 205
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
210 215 220
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
225 230 235 240
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
245 250 255
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
260 265 270
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
275 280 285
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
290 295 300
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
305 310 315 320
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
325 330 335
Leu Ser Leu Ser Pro Gly Lys Thr Gly Leu Asp Ser Pro Thr Gly Leu
340 345 350
Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr Gly Leu Asp Ser Pro Asp
355 360 365
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
370 375 380
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Trp Ile Gly Pro Glu Leu
385 390 395 400
Lys Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
405 410 415
His Gly Ser Ile Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
420 425 430
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
435 440 445
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Met Tyr Tyr Pro His Thr
450 455 460
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
465 470
<210> 47
<211> 476
<212> PRT
<213> 人工序列
<220>
<223> DMS30052 (含有经修饰的C末端): 具有C末端K-044-085 dAb +A
((TGLDSP)x4)的DMS1576
<400> 47
Glu Val Gln Leu Leu Val Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Lys Ala Tyr
20 25 30
Pro Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Ser Pro Ser Gly Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Arg Lys Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr His Thr Cys Pro Pro Cys Pro Ala Pro
115 120 125
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
130 135 140
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
145 150 155 160
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
165 170 175
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
180 185 190
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
195 200 205
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
210 215 220
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
225 230 235 240
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
245 250 255
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
260 265 270
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
275 280 285
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
290 295 300
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
305 310 315 320
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
325 330 335
Leu Ser Leu Ser Pro Gly Lys Thr Gly Leu Asp Ser Pro Thr Gly Leu
340 345 350
Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr Gly Leu Asp Ser Pro Asp
355 360 365
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
370 375 380
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Trp Ile Gly Pro Glu Leu
385 390 395 400
Lys Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
405 410 415
His Gly Ser Ile Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
420 425 430
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
435 440 445
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Met Tyr Tyr Pro His Thr
450 455 460
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Ala
465 470 475
<210> 48
<211> 478
<212> PRT
<213> 人工序列
<220>
<223> DMS30053 (含有经修饰的C末端): 具有C末端K-044-085 dAb +AAA
((TGLDSP)x4)的DMS1576
<400> 48
Glu Val Gln Leu Leu Val Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Lys Ala Tyr
20 25 30
Pro Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Ser Pro Ser Gly Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Arg Lys Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr His Thr Cys Pro Pro Cys Pro Ala Pro
115 120 125
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
130 135 140
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
145 150 155 160
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
165 170 175
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
180 185 190
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
195 200 205
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
210 215 220
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
225 230 235 240
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
245 250 255
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
260 265 270
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
275 280 285
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
290 295 300
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
305 310 315 320
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
325 330 335
Leu Ser Leu Ser Pro Gly Lys Thr Gly Leu Asp Ser Pro Thr Gly Leu
340 345 350
Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr Gly Leu Asp Ser Pro Asp
355 360 365
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
370 375 380
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Trp Ile Gly Pro Glu Leu
385 390 395 400
Lys Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
405 410 415
His Gly Ser Ile Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
420 425 430
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
435 440 445
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Met Tyr Tyr Pro His Thr
450 455 460
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Ala Ala Ala
465 470 475
<210> 49
<211> 476
<212> PRT
<213> 人工序列
<220>
<223> DMS30054 (含有经修饰的C末端): 具有C末端K-044-085 dAb +T
((TGLDSP)x4)的DMS1576
<400> 49
Glu Val Gln Leu Leu Val Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Lys Ala Tyr
20 25 30
Pro Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Ser Pro Ser Gly Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Arg Lys Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr His Thr Cys Pro Pro Cys Pro Ala Pro
115 120 125
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
130 135 140
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
145 150 155 160
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
165 170 175
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
180 185 190
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
195 200 205
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
210 215 220
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
225 230 235 240
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
245 250 255
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
260 265 270
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
275 280 285
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
290 295 300
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
305 310 315 320
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
325 330 335
Leu Ser Leu Ser Pro Gly Lys Thr Gly Leu Asp Ser Pro Thr Gly Leu
340 345 350
Asp Ser Pro Thr Gly Leu Asp Ser Pro Thr Gly Leu Asp Ser Pro Asp
355 360 365
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
370 375 380
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Trp Ile Gly Pro Glu Leu
385 390 395 400
Lys Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
405 410 415
His Gly Ser Ile Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
420 425 430
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
435 440 445
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Met Tyr Tyr Pro His Thr
450 455 460
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr
465 470 475
- 还没有人留言评论。精彩留言会获得点赞!