肿瘤血管及M1型巨噬细胞靶向肽及其用途的制作方法
本发明属于分子生物学技术领域,具体涉及一种肿瘤血管及M1型巨噬细胞靶向肽及其用途。
背景技术:
结肠癌已经成为世界范围内最常见的恶性肿瘤之一,为全球第三高发病率及第二高致死率的恶性肿瘤。结肠癌的发病是一个多因素导致的长期的复杂过程,包括出血性肠炎的产生,到良性腺瘤性息肉,再逐步发展为具有侵袭性和转移性的腺癌。由于结肠癌的早期发病过程中并无明显且特异性症状,而多数患者常在晚期并伴有转移症状时才被确诊,因而失去了根治性手术切除结肠癌病变组织的机会。一期的病人,其术后5年存活率为93.2%,而伴有病灶转移的UICC四期患者,其术后5年存活率仅为8.1%。结肠癌的早期诊断目前仍是预防和治疗结肠癌的最有效方法。
近年来发展的小分子靶向多肽筛选及应用渐渐成为医药工作者的一大研究热点。小分子多肽是指利用细胞或者动物组织器官作为“诱饵”,从噬菌体多肽数据库中“钓”出的一类小于30个氨基酸的环状多肽。与传统大分子靶向载体相比,小分子多肽具备多个优势:其分子量小,稳定性高,易携带药物进入肿瘤组织内部,且毒性小,易合成和搭载影像探针及药物分子,同时也具有与靶组织高度特异性的能力,因而被广泛研究和应用于各种肿瘤的早期诊断和靶向治疗等研究。
肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)是肿瘤微环境中一个重要组成成分,它主要来源于骨髓和外周血,在肿瘤的发生发展中起到了重要作用。TAM具有形态与功能的多样性,主要分为两种表型:抑制肿瘤生长的M1型和促进肿瘤生长的M2型。M1型TAM较多地发现于肿瘤形成的早期,在1型辅助T细胞(Th1)和自然杀伤细胞(NK cells)分泌的IFNγ及IL-12的刺激下,肿瘤组织浸润的巨噬细胞主要向M1型TAM分化,并分泌多种促炎细胞因子(proinflammatory cytokines)如TNFα,IFNγ等,抑制肿瘤的生长。而在肿瘤形成晚期,肿瘤组织中浸润的巨噬细胞主要以M2型TAM为主,它主要分泌抗炎细胞因子(anti-inflammatory cytokines),包括IL-10,转化生长因子(TGF-β),生长因子(EGF),血管内皮生长因子(VEGF)等,促进肿瘤生长,血管的新生,在肿瘤的侵袭、转移和免疫逃逸中发挥重要作用。临床研究发现,病人癌变组织中的TAM表型的分化或M1/M2型细胞比例同样影响肿瘤的预后。实体瘤包括乳腺癌,胰腺癌,肺癌等在内,癌症组织中M1型TAM的数目或M1/M2TAM的比例越大,肿瘤的预后效果越好,并且病人的5年存活率更高。而在结直肠癌中,尽管5年存活率与TAM的分化并无明确关系,但在病人的癌症组织中,提高M1型TAM的数量同样可以改善肿瘤预后。
技术实现要素:
针对上述问题,本发明提供一种靶向肿瘤血管及M1型巨噬细胞的小分子肽,其分子量小,可携带靶向药物,也可制备小分子探针,用于制备诊断或治疗肿瘤的药物。
本发明提供了一种肿瘤血管及M1型巨噬细胞靶向肽TCP-2,其氨基酸序列如Seq ID NO:1所示。
TCP-2的氨基酸序列:CSNSDWSSC Seq ID NO:1。
本发明还提供了一种编码上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2的基因。
其中,上述编码肿瘤血管及M1型巨噬细胞靶向肽TCP-2的核苷酸序列如Seq ID NO:2所示。
编码TCP-2的核苷酸序列:tgttctaattctgattggtcgagttgc Seq ID NO:2。
其中,本发明还提供了一种含有上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2的载体。进一步的,所述载体为表达载体,所述载体为质粒载体或病毒载体。
进一步的,本发明还提供了一种含有上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2的宿主细胞。
本发明还提供了一种上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2的制备方法,包括以下步骤:
采用噬菌体展示技术筛选出特异性结合于结肠癌血管的TCP-2噬菌体,基因测序获得编码该噬菌体展示TCP-2多肽的基因序列,将基因序列翻译得到TCP-2多肽序列,将得到的多肽序列送多肽合成公司合成该TCP-2多肽。
本发明还提供了一种上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2在制备诊断或治疗肿瘤的靶向药物中的用途。
进一步的,所述的肿瘤为消化道系统肿瘤,包括大肠癌,胃癌,食管癌,胰腺癌或肝癌中的一种。
本发明还提供了一种上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2在制备抗炎症反应的药物中的用途。所述炎症包括消化道系统或心血管系统中的炎症,尤其是指慢性结肠炎,慢性胃炎,动脉粥样硬化,风湿或类风湿性关节炎。
本发明的有益效果为:
本发明提供了一种靶向肿瘤血管及M1型巨噬细胞的小分子肽,能够在短时间内(8分钟)迅速靶向小鼠原位结直肠癌组织的肿瘤血管,并能不断在肿瘤血管上累积并浸润肿瘤组织内部,并与抗肿瘤生长的M1型TAM特异性结合。因此,可将其携带靶向药物或制备成小分子探针,可明显延长药物在肿瘤组织中的生物半衰期,并且可促进靶向传输药物的药理活性。
附图说明
图1所示为TCP-2多肽结构图;
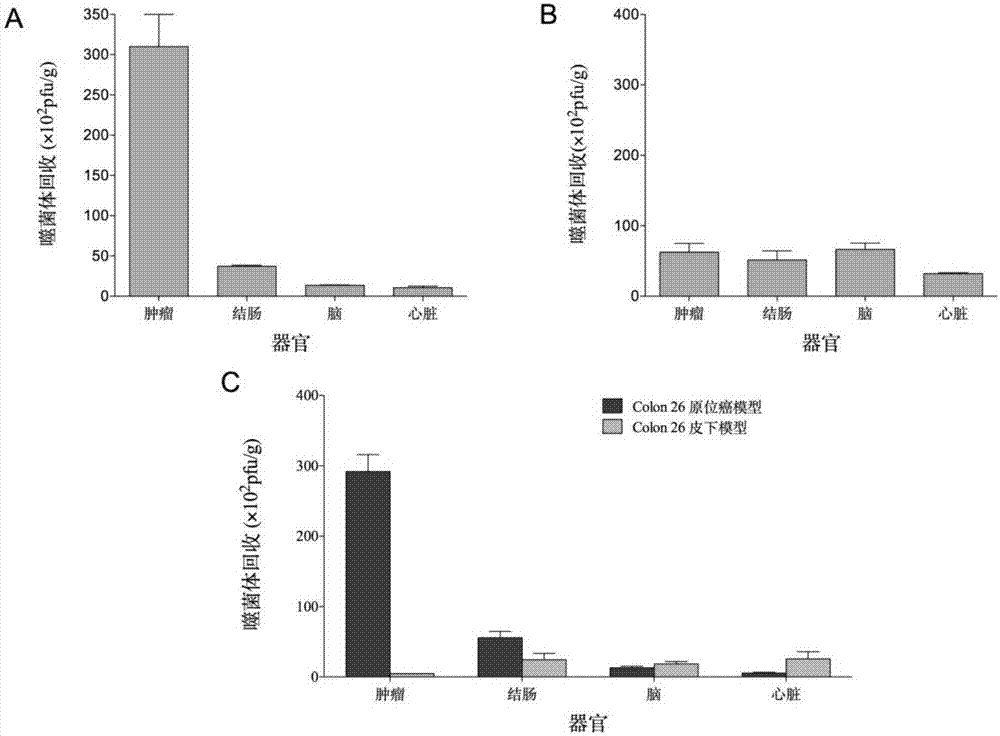
图2所示为TCP-2特异性靶向小鼠结肠癌组织结果图;A为TCP-2噬菌体特异性靶向肿瘤组织;B为无插入噬菌体(对照)无靶向能力;C为TCP-2噬菌体特异性靶向原位结肠癌组织,而非皮下接种的直肠癌瘤块;
图3所示为TCP-2噬菌体靶向小鼠结直肠肿瘤特异性验证结果;A:TCP-2噬菌体特异性靶向小鼠原位结直肠癌组织,而非正常组织(心、脑、肺、结肠);对照噬菌体无靶向结直肠肿瘤能力;B:TCP-2多肽可阻断TCP-2噬菌体靶向结直肠肿瘤的能力;
图4所示为TCP-2噬菌体特异性地与小鼠结直肠肿瘤血管(CD31阳性)结合;
图5所示为绿色荧光素FITC标记的TCP-2(FITC-TCP-2)多肽在各种组织的检测结果;结果显示:合成的FITC-TCP-2多肽特异性地结合于小鼠结直肠肿瘤组织血管,而非其他组织器官;对照多肽对结直肠肿瘤组织血管无靶向能力;FITC-TCP-2多肽靶向小鼠结直肠癌组织血管:小鼠原位结直肠癌模型建立后,尾静脉给予FITC-TCP-2多肽(300μg/鼠),多肽在体循环1小时;小鼠麻醉后,采用PBS灌注去除游离的FITC-TCP-2多肽,收集各器官组织,冰冻切片后,免疫荧光法结合激光共聚焦显微镜检测;TCP-2多肽可以特异性地结合于原位结直肠癌组织中的肿瘤血管(CD31+)而非其他正常组织;而对照多肽(最下行)对肿瘤组织未显示特异性结合能力;
图6所示为绿色荧光素FITC标记的化学合成TCP-2(FITC-TCP-2)多肽在器官中的生物学分布结果;FITC-TCP-2多肽在体循环2小时后,可特异性靶向小鼠原位结直肠癌组织,而非肺、正常结肠、心、肾、脑、肝等其他正常器官组织,如图6右边的图所示,TCP-2多肽靶向小鼠结直肠癌的能力显著强于对照多肽。
图7所示为TCP-2多肽特异性地结合于人结直肠癌组织肿瘤血管(CD31+,最上行),而非正常的结肠组织(最下行);此外,在人结直肠癌组织未检测到对照多肽的信号(第二行),这些结果显示在人结直肠癌组织中的肿瘤血管上高表达TCP-2多肽的靶标蛋白;
图8所示为TCP-2多肽特异性靶向和浸润小鼠结直肠癌组织,并在M1型TAM(CD80+)上累积停留超过24小时的结果;TCP-2多肽可在M1型TAM(CD80+)上累积停留超过24小时,而非M2型TAM(CD68+CD163+);
图9所示为TCP-2多肽靶向人结直肠腺癌组织的结果;TCP-2多肽可以特异性地靶向人结直肠腺癌组织(adenocarcinoma)中具有肿瘤杀伤能力的M1型TAM(CD68+CD80+),而非促肿瘤生长的M2型TAM(CD68+CD163+),TCP-2多肽在人结直肠癌组织中的阳性结合率为66.7%(10/15);
图10所示为TCP-2多肽特异性地靶向人结直肠腺瘤组织中浸润的具有肿瘤杀伤能力的M1型TAM的结果图;TCP-2多肽可以特异性地靶向人结直肠腺瘤组织(adenoma)中浸润的具有肿瘤杀伤能力的M1型TAM(CD68+CD80+),而非促肿瘤生长的M2型TAM(CD68+CD163+),TCP-2多肽在人结直肠腺瘤组织中的阳性结合率为83.3%(5/6);
图11所示为原位胰腺癌荷瘤小鼠,经尾静脉注射罗丹明B耦合TCP-2多肽(10μg/30μl,第二列),在体循环6小时后,收集胰腺癌组织及正常胰腺组织,冰冻切片,进行免疫荧光检测;结果显示,TCP-2多肽可特异性靶向原位胰腺癌组织血管(CD31+),对正常胰腺癌组织血管无明显结合;同时,TCP-2多肽也可特异性地靶向浸润的M1型TAM(CD80+),而非促肿瘤生长的M2型TAM(CD163+);
图12.罗丹明B标记的TCP-2多肽特异性靶向动脉粥样硬化组织中M1型巨噬细胞;A:小鼠动脉粥样硬化斑块切片与biotin标记的TCP-2多肽、巨噬细胞标记物抗体孵育,可见TCP-2多肽(第二列)特异性靶向离体的动脉粥样硬化组织中浸润的M1型巨噬细胞(CD80+,第一行),而非M2型巨噬细胞(CD163+,第二行),而对照多肽也未能靶向动脉粥样硬化组织中浸润的M1型巨噬细胞;B:ApoE-/-小鼠诱导生成的动脉粥样硬化模型后,分别静脉给予10μg/鼠的罗丹明B标记的TCP-2多肽或罗丹明B(阴性对照),成像结果显示TCP-2多肽特异性富集于动脉粥样硬化组织(白色箭头所示);C:离体的小鼠动脉组织显示TCP-2的罗丹明B信号富集于动脉粥样斑块(白色箭头所示)。
具体实施方式
本发明提供了一种肿瘤血管及M1型巨噬细胞靶向肽TCP-2,其氨基酸序列如Seq ID NO:1所示。
TCP-2的氨基酸序列:CSNSDWSSC Seq ID NO:1。
本发明还提供了一种编码上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2的基因。
其中,上述编码肿瘤血管及M1型巨噬细胞靶向肽TCP-2的核苷酸序列如Seq ID NO:2所示。
编码TCP-2的核苷酸序列:tgttctaattctgattggtcgagttgc Seq ID NO:2。
其中,本发明还提供了一种含有上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2的载体。进一步的,所述载体为表达载体,所述载体为质粒载体或病毒载体。
进一步的,本发明还提供了一种含有上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2的宿主细胞。
本发明还提供了一种上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2的制备方法,包括以下步骤:
采用噬菌体展示技术筛选出特异性结合于结肠癌血管的TCP-2噬菌体,基因测序获得编码该噬菌体展示TCP-2多肽的基因序列,将基因序列翻译得到TCP-2多肽序列,将得到的多肽序列送多肽合成公司合成该TCP-2多肽。
本发明还提供了一种上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2在制备诊断或治疗肿瘤的靶向药物中的用途。
进一步的,所述的肿瘤为消化道系统肿瘤,包括大肠癌,胃癌,食管癌,胰腺癌或肝癌中的一种。
本发明还提供了一种上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2在制备抗炎症反应的药物中的用途。所述炎症包括消化道系统或心血管系统中的炎症,尤其是指慢性结肠炎,慢性胃炎,动脉粥样硬化,风湿或类风湿性关节炎。
本发明还提供了一种上述肿瘤血管及M1型巨噬细胞靶向肽TCP-2在制备诊断或治疗细菌或病毒感染疾病药物中的用途。所述感染性疾病包括常见细菌或病毒感染,包括但不限于幽门螺杆菌感染、革兰氏阳性菌感染、革兰氏阴性菌感染等细菌感染,或甲肝病毒、乙肝病毒等病毒感染疾病。
本发明的TCP-2多肽可在短时间内(8分钟)迅速靶向小鼠原位结直肠癌组织的肿瘤血管,而非其他正常器官组织。同时,TCP-2多肽也特异性结合于临床结直肠癌组织血管。此外,组织学分析显示,TCP-2多肽不断在肿瘤血管上累积并浸润肿瘤组织内部,并与抗肿瘤生长的M1型TAM特异性结合,而非促肿瘤生长的M2型TAM。该肽可在M1型TAM上保留超过24小时,提示以TCP-2多肽作为药物载体时,可明显延长药物在肿瘤组织中的生物半衰期,并且可促进靶向传输药物的药理活性。TCP-2多肽靶向M1巨噬细胞的能力同样在ApoE-/-诱导的小鼠动脉粥样硬化模型中得到充分验证,表明TCP-2多肽不仅可以靶向肿瘤浸润的M1型巨噬细胞,同时也可以特异性结合于炎症组织中的M1型巨噬细胞。因此,当机体无肿瘤存在时,注射TCP-2多肽将特异性结合于炎症组织的M1型巨噬细胞,从而使TCP-2有极大的潜力作为药物或者造影剂载体,来治疗或者诊断(包括但不限于)消化化系统和心血管系统的炎症疾病。而且我们的数据已提供证据表明,TCP-2多肽确实可以靶向ApoE-/-小鼠动脉粥样硬化斑块内部的M1型巨噬细胞。
下面将结合实施例对本发明的具体实施方式做进一步的解释说明,但不表示将本发明的保护范围限制在实施例所述范围内。
实施例中所用的结肠26(colon 26)细胞系由日本东北大学的发育、老化和癌症研究所的生物医学研究细胞资源中心(Cell Resource Center for Biomedical Research,Institute of Development,Aging and Cancer,Tohoku University,Sendai,Japan)提供。人结肠癌细胞HCT116和小鼠巨噬细胞RAW264.7购自美国ATCC。
实施例1制备TCP-2
噬菌体展示文库:TCP-2由购自新英格兰生物实验室(New England Biolabs)的Ph.D.TM-C7C噬菌体展示文库中分离(结构如1所示)。该噬菌体文库为基于M13噬菌体的次要衣壳蛋白(pIII)融合的随机七肽的组合文库。随机化的序列的侧翼为一对半胱氨酸残基。非还原条件下,两个半胱氨酸自发形成二硫化物交联,形成环化肽的噬菌体文库。
细胞培养培养基为:含有2g/L碳酸氢钠、100单位/ml青霉素和链霉素和10%胎牛血清的RPMI-1640培养基;培养条件为37℃,5%CO2的湿润空气中。
抗体:兔抗fd噬菌体抗体购自Sigma公司,大鼠抗小鼠CD31单抗、CD68单抗、CD80单抗、CD163单抗及小鼠抗人CD68单抗、CD80单抗、CD163单抗均购自BD Pharmingen和Invitrogen公司。小鼠抗人CD31单抗购自DAKO公司。Alexa Fluor 568山羊抗大鼠IgG(H+L)、Alexa Fluor 568山羊抗小鼠IgG(H+L)、Alexa Fluor 488链亲和素抗体购自Invitrogen。
TCP-2多肽的合成:利用体内生物淘选方法鉴定出TCP-2后,按照我们的规格要求,由吉尔生化,GL Biochem Shanghai合成荧光素(FITC)耦合的CSNSDWSSC、CVQTAQLLC(阴性对照)和生物素(biotin)耦合的CSNSDWSSC、CVQTAQLLC,用于后续实验。荧光素与生物素用来直接显示多肽结合或放大多肽结合信号。
实施例2构建动物模型
实验动物:7-9周龄的雄性BALB/c小鼠(原位结肠癌模型),C57BL/6小鼠(原位胰腺癌模型)和12周龄的ApoE-/-小鼠(动脉粥样硬化模型)饲养在湿度(50±10%)、光照(12/12小时,光照/黑暗循环)和温度(23±2℃)的条件下,所有动物分装在塑料笼子中(四或五只小鼠/笼),自由接触饮用水和食物。
原位结直肠癌模型1:模型的建立采用前期发表的方法进行(参见发明专利CN102471371B“用于肿瘤血管系统的归巢肽”)。雄性BALB/c小鼠经连续饮用含3%葡聚糖硫酸钠(DSS)的自来水,持续8天以诱发结肠炎。小鼠禁食18小时后,采用戊巴比妥钠麻醉。采用微量移液管,经直肠灌注结肠26细胞(3X 106细胞/40μl/鼠)于小鼠肛门内2里面处。肿瘤细胞滴注30分钟后,涂抹凡士林以防泄露。肿瘤细胞灌注2周后,成功的模型用于后续实验。
原位结直肠癌模型2:雄性BALB/c小鼠腹腔注射生理盐水溶解的氧化偶氮甲烷(AOM,12.5mg/kg)以致癌。一周后,小鼠经连续饮用含2.5%葡聚糖硫酸钠(DSS)的自来水,持续5天以诱发结肠炎;连续两周给予正常自来水恢复肠道炎症;连续三个2.5%DSS-自来水的致炎与恢复周期后,模型构建成功并用于后续实验。
使用两种原位结肠癌模型,期望能更广泛地验证TCP-2的靶向能力,模型1中小鼠成瘤后,常规都是单发肿瘤,并且肿瘤位于末端结肠和直肠内。模型2中小鼠往往形成多发肿瘤,而且可以位于整个结直肠的任何位置,更能体现和模拟人大肠癌的复杂性。
原位胰腺癌模型:C57BL/6小鼠采用戊巴比妥钠麻醉后,剃毛,用手术刀于脾脏处开0.5cm长切口。采用微量注射器灌注小鼠胰腺癌Panc02细胞(3X 106细胞/30μl/鼠)于胰腺尾端。肿瘤细胞灌注3分钟后,缝合。三周后,模型构建成功并用于后续实验。
实施例3 TCP-2噬菌体靶向结直肠癌组织的测定
测定方法如下:荷瘤小鼠经麻醉后,通过尾静脉注射1X 109pfu的CSNSDWSSC噬菌体(TCP-2噬菌体)或对照噬菌体。8分钟后,经有心脏给小鼠灌注含1%BSA的DMEM培养液。取出每只小鼠的肿瘤和对照器官,洗脱出噬菌体并滴定。结果如图2A所示,TCP-2噬菌体特异性靶向结肠癌组织,并不聚集于其他对照器官,如心,脑和正常结肠。对照无插入片段的噬菌体不特异性地靶向任何的组织(图2B)。提示TCP-2多肽具有靶向能力,而不是噬菌体。同时进一步发现,TCP-2多肽并不靶向皮下接种形成的结肠癌组织(图2C),提示肿瘤微环境影响TCP-2多肽受体在肿瘤的表达。
对于组织学分析,噬菌体经注射体内1小时后,小鼠采用4%多聚甲醛灌注。手术摘除各组织并经28%蔗糖溶液浸泡过夜脱水。脱水后的组织采用Tissue-Tek OCT(Tissue-Tek,SAKURA,Japan)包埋,制备10μm切片供后续噬菌体免疫染色所用。结果如图3A所示,TCP-2噬菌体在肿瘤血管样组织显阳性染色,但并不在其他对照器官显阳性染色。TCP-2合成多肽可以阻断TCP-2噬菌体的阳性染色(图3B),提示是TCP-2多肽而不是噬菌体具有靶向结肠癌组织的能力。
为进一步明确TCP-2靶向结肠癌组织的具体位置,免疫荧光共定位实验被使用来共染TCP-2噬菌体与血管标记物CD31分子。小鼠原位结直肠癌模型建立后,采用戊巴比妥钠麻醉后,尾静脉给予1X1010pfu TCP-2噬菌体或者等量对照噬菌体,在体循环2小时。小鼠麻醉后,采用PBS灌注去除游离的噬菌体,收集各器官组织,冰冻切片后,血管组织采用大鼠抗小鼠CD31抗体标记,利用兔抗噬菌体的抗体标记噬菌体,山羊抗大鼠Alexa Flour 568和山羊抗兔Alexa Flour 488荧光二抗放大信号,免疫荧光法结合激光共聚焦显微镜检测。结果如图4所示,2小时在体循环后,可见TCP-2噬菌体与CD31阳性血管共定位,而并不与其他器官的CD31阳性血管结合;对照噬菌体并不与肿瘤血管共定位,提示TCP-2噬菌体被注射小鼠体内后,在较短的时间内,TCP-2噬菌体将首先与肿瘤血管结合。
实施例4 TCP-2多肽靶向小鼠原位结直肠癌组织测定
小鼠原位结直肠癌模型建立后,采用戊巴比妥钠麻醉后,尾静脉给予化学合成的绿色荧光素FITC耦合的TCP-2(FITC-TCP-2)多肽(300μg/鼠),在体循环2小时。小鼠麻醉后,采用PBS灌注去除游离的FITC-TCP-2多肽,收集各器官组织,冰冻切片后,血管组织采用小鼠抗人CD31抗体,和山羊抗小鼠Alexa Flour 568荧光二抗染色后,免疫荧光法结合激光共聚焦显微镜检测,结果如图5所示,化学合成的FITC-TCP-2多肽可以与CD31阳性肿瘤血管共定位,但并不结合与其他对照器官心、脑和正常结肠组织;同时对照多肽也不与CD31阳性的肿瘤血管结合。这一结果提示TCP-2多肽可靶向结合于结肠癌血管。
绿色荧光素FITC标记的多肽用于离体肿瘤成像:小鼠原位结直肠癌模型建立后,采用戊巴比妥钠麻醉后,尾静脉给予化学合成的FITC-TCP-2多肽(500μg/鼠),在体循环24小时。小鼠麻醉后,采用PBS灌注去除游离的FITC-TCP-2多肽,收集各器官组织,置于PBS中冲洗2次,将各器官按顺序置于kodak 2000紫外线成像仪上,收集各组织绿色荧光信号,采集成像。如图6所示,FITC-TCP-2多肽可特异性地在肿瘤组织发出明亮信号,而其他组织的信号和对照无明显差异。PBS和FITC标记的对照多肽并不在肿瘤组织显示阳性信号。
人结肠癌组织,小鼠结直肠癌组织冰冻切片的制备:手术摘除的人或小鼠结直肠癌,小鼠胰腺癌组织,采用4%多聚甲醛固定,并经28%蔗糖溶液浸泡过夜脱水。脱水后的组织采用Tissue-Tek OCT(Tissue-Tek,SAKURA,Japan)包埋,制备5μm切片供后续免疫染色所用。
TCP-2多肽靶向人结直肠癌组织血管的鉴定:人结直肠癌组织切片,经PBS洗去多余OCT后,采用10%的山羊血清室温封闭1小时后,孵育FITC-TCP-2多肽生物素(biotin)耦合的TCP-2(biotin-TCP-2)多肽以及小鼠抗人CD31抗体,4℃孵育过夜。PBS洗涤,去除未结合的TCP-2多肽后,加入抗生物素蛋白链菌素Alexa Flour 488和山羊抗小鼠Alexa Flour568二抗,并室温孵育1小时。洗去未结合抗体后,用防淬灭试剂封片,指甲油封固,采用激光共聚焦显微镜检测。结果如图7所示,TCP-2多肽可特异性地结合于人结直肠癌组织CD31标识的肿瘤血管而非正常的结肠组织血管。此外,在人结直肠癌组织血管未检测到对照多肽的信号,这些结果提示在人结直肠癌组织中的肿瘤血管上高表达TCP-2多肽的靶标蛋白,TCP-2多肽有应用于人结肠癌靶向诊断和治疗的潜在价值。
实施例5 TCP-2多肽靶向小鼠结直肠癌组织浸润的M1型巨噬细胞
TCP-2多肽靶向小鼠结直肠癌组织浸润的M1型巨噬细胞的检测:小鼠结直肠癌组织切片经PBS洗去多余OCT液后,加入10%山羊血清,室温封闭1小时后,加入生物素标记的TCP-2(biotin-TCP-2)多肽和山羊抗小鼠CD68或CD80,或兔抗小鼠CD163一抗,4℃孵育过夜。PBS去除未结合的TCP-2多肽和抗体后,加入抗生物素蛋白链菌素Alexa Flour 488和驴抗山羊Alexa Flour 568或小鼠抗兔Alexa Flour 568二抗,并室温孵育1小时。洗去未结合抗体后,用防淬灭试剂封片,指甲油封固,采用激光共聚焦显微镜检测,结果如图8所示,TCP-2多肽除与肿瘤血管结合之外,其也选择性地与肿瘤内的M1型巨噬细胞(CD80+)结合,但并不与M2型巨噬细胞(CD163+)结合。这一结果将大大拓展TCP-2的用途,其可潜在地携带调节巨噬细胞的药物,对巨噬细胞的极化进行选择性地调控,提升抗肿瘤效果。
实施例6 TCP-2多肽靶向人结直肠癌组织浸润的M1型巨噬细胞
TCP-2多肽靶向人结直肠癌组织浸润的M1型巨噬细胞的检测:人结直肠癌或腺瘤组织切片经PBS洗去多余OCT液后,加入10%山羊血清,室温封闭1小时后,加入biotin-TCP-2多肽和小鼠抗人CD68或CD80,或兔抗人CD163一抗,4℃孵育过夜。PBS去除未结合的TCP-2多肽和抗体后,加入抗生物素蛋白链菌素Alexa Flour 488和山羊抗小鼠Alexa Flour 568或山羊抗兔Alexa Flour 568二抗,并室温孵育1小时。洗去未结合抗体后,用防淬灭试剂封片,指甲油封固,采用激光共聚焦显微镜检测。结果如图9、图10所示,TCP-2不仅能与结肠癌组织内的M1型巨噬细胞(CD68+CD80+),也可识别结肠癌癌前病变腺瘤内的M1型巨噬细胞(图10)。在两种组织的M2型巨噬细胞(CD68+CD163+)上均不能检测到TCP-2多肽的结合。TCP-2多肽在人结直肠癌组织中的阳性结合率为66.7%(10/15);在人结直肠腺瘤组织中的阳性结合率为83.3%(5/6)。
实施例7 TCP-2多肽靶向小鼠胰腺癌组织
TCP-2多肽靶向小鼠胰腺癌组织的鉴定:原位胰腺癌荷瘤小鼠模型建立后,戊巴比妥麻醉,并经尾静脉注射红色罗丹明B染料(RhB)标记的TCP-2多肽(10μg/30μl),在体循环6小时后,收集胰腺癌组织及正常胰腺组织,冰冻切片。切片经PBS洗去多余OCT液后,加入10%山羊血清,室温封闭1小时后,加入biotin-TCP-2多肽和山羊抗小鼠CD80或兔抗小鼠CD163,或兔抗小鼠CD31一抗后,4℃孵育过夜。PBS去除未结合的TCP-2多肽和抗体后,加入抗生物素蛋白链菌素Alexa Flour 488和驴抗山羊Alexa Flour 568或小鼠抗兔Alexa Flour 568二抗,并室温孵育1小时。洗去未结合抗体后,用防淬灭试剂封片,指甲油封固,采用激光共聚焦显微镜检测,结果如图11所示,TCP-2多肽可特异性靶向原位胰腺癌组织CD31标记的血管,对正常胰腺癌组织血管无明显结合。同时,TCP-2多肽也可特异性地靶向浸润的M1型巨噬细胞(CD80+),而非促肿瘤生长的M2型巨噬细胞(CD163+)。在该模型中,TCP-2多肽被循环6h,检测结果提示,其可以同时在肿瘤血管和肿瘤内M1型巨噬细胞上结合。这一结果进一步证实TCP-2具有双靶向能力,而TCP-2的受体可能在肿瘤血管和肿瘤相关的巨噬细胞上均有表达。
实施例8 TCP-2多肽靶向小鼠动脉粥样硬化组织中浸润的M1巨噬细胞
TCP-2多肽靶向小鼠动脉粥样硬化组织中浸润的M1巨噬细胞的鉴定:1.体外结合实验:小鼠动脉粥样硬化斑块制成冰冻切片,经PBS洗去多余OCT液后,加入10%山羊血清,室温封闭1小时后,加入biotin-TCP-2多肽或对照多肽,以及山羊抗小鼠CD80或兔抗小鼠CD163一抗后,4℃孵育过夜。PBS去除未结合的TCP-2多肽和抗体后,加入抗生物素蛋白链菌素Alexa Flour 488和驴抗山羊Alexa Flour 568或小鼠抗兔Alexa Flour 568二抗,并室温孵育1小时。洗去未结合抗体后,用防淬灭试剂封片,指甲油封固,采用激光共聚焦显微镜检测。2.体内成像实验:ApoE-/-基因敲除的小鼠经含有21%脂肪和0.15%胆固醇的高脂饲料喂食12周后,构建小鼠原位动脉粥样硬化模型,戊巴比妥麻醉,并经尾静脉注射罗丹明B标记的TCP-2多肽(10μg/30μl),在体循环2小时后,采用小鼠活体成像系统收集数据。
离体结合和组织定位染色(图12A)揭示,TCP-2多肽特异性靶向离体的动脉粥样硬化组织中浸润的M1型巨噬细胞(CD80+),而非M2型巨噬细胞(CD163+),而对照罗丹明B染料本身不能靶向动脉粥样硬化组织中浸润的M1型巨噬细胞。小鼠整体成像结果如图12B所示,TCP-2多肽注射后可特异性富集于动脉粥样硬化组织(箭头所指),与对照单独的罗丹明B染料相比,TCP-2多肽小鼠在主动脉区域产生明显罗丹明B信号富集;离体的小鼠动脉组织同样显示TCP-2注射后产生出较强的罗丹明B信号(图12C);这些结果提示TCP-2多肽不仅能够靶向结肠癌肿瘤血管和肿瘤相关的M1巨噬细胞,其也可靶向炎症相关的M1巨噬细胞;这一发现将极大地拓展TCP-2的使用范围。
由上述实施例可知:TCP-2多肽可与小鼠原位结肠直肠癌组织的肿瘤血管组织特异性地结合,而非皮下接种的结肠直肠癌组织和正常器官组织。该肽也可以特异性地结合于手术摘除的人结直肠癌组织。此外,TCP-2多肽也被发现可与小鼠和人结直肠癌组织中肿瘤浸润的M1型巨噬细胞上累积超过24小鼠。TCP-2多肽在原位胰腺癌的肿瘤血管和M1型巨噬细胞上也显示良好的靶向能力。
TCP-2的M1型巨噬细胞靶向能力,也被在动脉粥样硬化模型中得到证实。TCP-2多肽分子在小鼠体内比较稳定,主要由肝肾代谢后经尿液排除,体外细胞实验和体内动物实验均显示TCP-2多肽是安全的,不会引起细胞和机体生物学不良反应。结果显示,TCP-2多肽可被开发作为消化系统癌症包括结直肠癌和胰腺癌的早期诊断试剂和靶向用药载体以及其它胃肠道癌应用的可能性。由于其靶向M1巨噬细胞的特性,所以TCP-2多肽也可被用于制备慢性炎症的靶向诊断和治疗的药物。
序列表
<110> 西南医科大学
<120> 肿瘤血管及M1型巨噬细胞靶向肽及其用途
<130> A171529K
<141> 2017-12-21
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 9
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 1
Cys Ser Asn Ser Asp Trp Ser Ser Cys
1 5
<210> 2
<211> 27
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
tgttctaatt ctgattggtc gagttgc 27
- 还没有人留言评论。精彩留言会获得点赞!