一种编码β-甘露聚糖酶的基因,以及含该基因的重组质粒和重组菌及其构建方法与流程
本发明涉及β-甘露聚糖酶技术领域,具体地,涉及一种编码β-甘露聚糖酶的基因及以及含该基因的重组质粒和重组菌及其构建方法。
背景技术:
甘露聚糖是植物性饲料原料中除纤维素、木聚糖之外,分布最广泛、含量最高的一类半纤维素,甘露聚糖类物质作为半纤维素的第二大组分,广泛分布于自然界中。β-甘露聚糖是非淀粉多糖(nsp)的一种,是籽实类植物细胞壁的主要组成成分,尤其在棕榈粕、椰子粕、豆粕、芝麻粕中含量最多,在其他植物性饲料原料中含量也很高,如玉米、小麦、菜籽粕、麸皮等。
甘露聚糖是以1,4-β-d-吡喃甘露糖苷键连结而成的线状多糖,如果主链某些残基被葡萄糖取代,或半乳糖通过1,6-α-糖苷键与甘露糖残基相连形成分枝,则称之为异甘露聚糖,主要有半乳甘露聚糖(galactomannan)、葡甘露聚糖(glucomannan)、半乳葡甘露聚糖(galactoglucomannan)(龙健儿等,1998)。豆粕中甘露聚糖属于半乳甘露聚糖(galactomannan)。上述物质构成了植物半纤维素的第二大组份,这些物质的降解主要依靠的酶就是β-甘露聚糖酶(β-mannanase;endo-1,4-β-d-mannanmannohydrolaser,ec3.2.1.78)。
β-甘露聚糖酶是一种新型的工业酶制剂,可广泛应用于食品、医药、造纸、饲料、石油开采及精细化工等行业,对于自然资源的高附加值开发、发展生物技术改造化学工业,满足资源、环境、能源、医药等领域内的需求具有重要意义。β-甘露聚糖酶为一种多功能的促生长剂,可以促进类胰岛素生长因子igf-i的分泌,促进蛋白质的合成,提高瘦肉率,促进生长。其主要原理是:
1、消除饲料中甘露聚糖对葡萄糖吸收的干扰,极大提高豆粕的能量消化率,能给玉米豆粕型日粮提高100-150kcal/kg的代谢能。
2、甘露聚糖分解产生的甘露寡糖,可被动物肠道中的有益菌吸收,改善菌群组成,减少大肠杆菌、沙门氏菌的感染。减少肉鸡球虫病的危害,提高肉鸡均匀度。
3、降低肠道粘度,促进能量、蛋白、纤维素的消化和吸收。
因此,研究β-甘露聚糖酶,优化β-甘露聚糖酶基因的表达和提高β-甘露聚糖酶生产甘露糖的效率具有极大的市场价值。
技术实现要素:
为此,本发明提供了一种编码β-甘露聚糖酶的基因,以及含该基因的重组质粒和重组菌,该重组质粒的构建方法,β-甘露聚糖酶的体外表达方法,以及利用该β-甘露聚糖酶水解生产甘露单糖的应用。
本发明的技术方案如下:一种编码β-甘露聚糖酶的基因,所述基因的核苷酸序列如sequenceno.2所示。
一种重组质粒,包含如seqidno.2所示的基因,所述重组载体为重组ppiczaa质粒,所述基因插入所述ppiczaa质粒的多克隆位点。
一种重组菌,包含上述的重组质粒。
所述的重组菌为重组毕赤酵母gs115菌株。
上述的重组质粒的构建方法,包括如下步骤:
1)密码子偏向性优化:对β-甘露聚糖酶的核苷酸序列seqidno:1根据酵母菌的密码子偏好性进行改造,获得适宜在酵母菌内高效表达的核苷酸序列seqidno:2;
2)ppiczaa表达载体构建:以质粒ppiczaa为载体,将核苷酸序列seqidno:2插入启动子aox1下游,5'端酶切位点为ecori,3'端酶切位点为noti,构建ppiczaa-lrman5b表达载体。
一种β-甘露聚糖酶的体外表达方法,所述β-甘露聚糖酶的核苷酸序列如sequenceno.2所示,包括如下步骤:
1)密码子偏向性优化:对β-甘露聚糖酶的核苷酸序列seqidno:1根据酵母菌的密码子偏好性进行改造,获得适宜在酵母菌内高效表达的核苷酸序列seqidno:2;
2)ppiczaa表达载体构建:以质粒ppiczaa为载体,将核苷酸序列seqidno:2插入启动子aox1下游,5'端酶切位点为ecori,3'端酶切位点为noti,构建ppiczaa-lrman5b表达载体;
3)重组蛋白表达:将所述的ppiczaa-lrman5b表达载体线性化,电转导入处于化学感受态的表达菌株pichiapastorisx33,形成重组表达菌株ppiczaa-lrman5b-pichiapastorisx33,挑选高效表达的阳性克隆进行培养,并利用甲醇诱导重组表达菌分泌表达β-甘露聚糖酶。
用上述的β-甘露聚糖酶水解生产甘露糖的方法,β-甘露聚糖酶和β-甘露糖苷酶协同生产甘露糖。
β-甘露聚糖酶和β-甘露糖苷酶协同生产甘露糖的应用。
本发明的有益效果为:本发明提供了所述编码β-甘露聚糖酶的基因,以及含该基因的重组质粒和重组菌,该重组质粒的构建方法,β-甘露聚糖酶的体外表达方法,以及利用该β-甘露聚糖酶水解生产甘露单糖的应用。在50℃条件下,所述β-甘露聚糖酶的在ph4.5-6.0之间都具有较高的活性,在ph为5.0时,即达到最高酶活;在ph为5.0条件下,β-甘露聚糖酶酶活力在温度为65℃时达到最大值,到75℃时酶活力含具有70以上的相对酶活力。β-甘露聚糖酶在ph为3.0-8.0条件下都具有较好的稳定性,也具有较好的温度耐受性。在最适条件下,β-甘露聚糖酶的km和vmax分别为1.276mg/ml和2266umol/min·mg。本发明中lrman5b基因编码的β-甘露聚糖酶与β-甘露糖苷酶协同分解β-甘露糖苷产生甘露糖,甘露糖的生成量大大提高,这表明lrman5b基因编码的β-甘露聚糖酶在工业上生产甘露糖具有重要的意义。
附图说明:
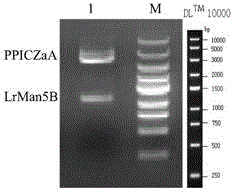
图1为本发明所述质粒ppiczaa-lrman5b的酶切的产物在琼脂糖凝胶上电泳检测结果图。泳道m为dna分子量marker,其条带分子量自上向下依次为10000bp,5000bp,3000bp,2000bp,1500bp,1000bp,700bp,500bp和250bp。泳道1为所述质粒ppiczaa-lrman5b的酶切的产物,其中,5000bp至3000bp之间的条带为质粒ppiczaa的dna片段,1500bp至1000bp之间的条带为lrman5b的dna片段。
图2为质粒ppiczaa-lrman5b图谱。
图3为质粒ppiczaa-lrman5b导入毕赤酵母后,毕赤酵母表达产物的sds-page检测结果图。图3中marker为蛋白质分子量,最左侧数字标示了marker泳道的蛋白质条带的分子量;泳道1为含有lrman5b基因编码的β-甘露聚糖酶的毕赤酵母表达菌株发酵液,泳道2为纯化后的lrman5b基因编码的β-甘露聚糖酶。
图4为在50℃下,缓冲液的ph值对β-甘露聚糖酶的酶活力的影响的检测结果图。横坐标代表ph值,纵坐标代表酶活力。
图5为温度对β-甘露聚糖酶酶活力的影响的检测结果图,横坐标代表温度值,纵坐标代表酶活力。
图6为ph值对β-甘露聚糖酶的稳定性的影响的检测结果图,横坐标代表ph值,纵坐标代表酶活力。
图7为β-甘露聚糖酶温度耐受性的测定的结果图,横坐标代表温度值,纵坐标代表酶活力。
图8为以洋槐豆胶为底物,在不同底物浓度下测定β-甘露聚糖酶比活力的检测结果图。横坐标代表底物浓度值,纵坐标代表酶活力。
具体实施方式
为了使本发明的发明目的,技术方案及技术效果更加清楚明白,下面结合具体实施方式对本发明做进一步的说明。应理解,此处所描述的具体实施例,仅用于解释本发明,并不用于限定本发明。
实施例1β-甘露聚糖酶lrman5b基因的挖掘
本实例通过对genbank中记载的基因组数据挖掘分析,得到编码β-甘露聚糖酶lrman5b的核酸序列,如sequenceidno:1所示。该β-甘露聚糖酶是一种新型糖基水解酶5家族β-甘露聚糖酶,其氨基酸序列由381个氨基酸组成。该β-甘露聚糖酶同源性最高的是rhizomucormiehei(米黑根毛霉)的endo-beta-mannanase(序列号:agc24277.1)两者的一致性为64%。
根据如下表1所示的毕赤酵母密码子频率表,通过基因优化合成获得适合在毕赤酵母中表达的编码β-甘露聚糖酶lrman5b的核酸序列,序列如sequenceidno:2所示。优化前后,核苷酸序列的一致性为66%。
表1毕赤酵母密码子频率表
实例2含编码β-甘露聚糖酶的基因序列的表达载体的构建
根据sequenceidno:2设计pcr引物,在上游pcr引物的5’端和下游pcr引物的3’端分别添加限制性内切酶ecori和noti的酶切位点,pcr引物序列如下:
lrman5b正向引物:5’-ctagaattccaagattcctttgtttccac-3’
lrman5b反向引物:5’-atagcggccgcttagttgttcttagcagcca-3’
通过pcr基因扩增后,将pcr产物和载体质粒ppiczaa通过限制性内切酶ecori和noti分别消化,回收后,在t4连接酶的作用下,连接产物转化大肠杆菌进行增殖。提取质粒,用限制性内切酶ecori和noti进行双酶切,酶切后的产物在琼脂糖凝胶上电泳检测,如图1所示。验证正确质粒即为阳性克隆,命名为质粒ppiczaa-lrman5b,该质粒图谱如图2所示。
实施例3表达lrman5b基因编码的的β-甘露聚糖酶的重组毕赤酵母的构建与验证
挑取生长良好的毕赤酵母gs115单菌落,接种到装20mlypd培养基的100ml三角瓶中,30℃培养24h,然后将培养液以1%的接种量转接到100mlypd培养基的500ml摇瓶中,30℃、250rpm培养至od600=1.2-1.5;将培养液于4℃、1500g离心5min收集菌体,用预冷的无菌水重悬菌体。如上离心,用20ml预冷的1m山梨醇洗酵母细胞两次。用0.25ml预冷的1m山梨醇重悬酵母细胞,即为酵母感受态细胞。取100μl酵母感受态细胞与2μl约1μg线性化质粒ppiczaa-lrman5b混合转入预冷的电转杯中。冰上放置5min。按装置推荐的真核细胞转化参数(电压1.5kv、电阻200ω、电容25μf、电击时间为4~10msec)电击。立刻加入1ml预冷的1m山梨醇,转入灭菌的离心管中取适量菌液涂布ypds平板上,30℃恒温孵育直至2天后单菌落出现。
随机挑取ypds平板上长出的毕赤酵母单菌落,提取总dna,以5’aox和3’aox为引物,进行pcr扩增鉴定重组子,5’aox和3’aox引物序列如下:
5’aox:5’-gactggttccaattgacaagc-3’
3’aox:5’-gcaaatggcattctgacatcc-3’
pcr产物在琼脂糖凝胶上电泳检测,检测结果为阳性,证明线性化质粒ppiczaa-lrman5b成功整合至毕赤酵母x-33基因组上。
实施例4β-甘露聚糖酶的表达与纯化
挑取实施例3中验证后的生长良好的毕赤酵母单菌落x-33,接种至含5mlbmg的指形瓶中,30℃震荡过夜。将培养过夜的菌液转接至含有50mlypdg的500ml三角瓶内,用八层纱布封口,保证良好的透气环境,在28℃、250rpm培养过夜。取培养过夜的菌液1500g,离心3min,用50ml新鲜的bmmy培养基重悬于500ml三角瓶中,用八层纱布封口,在28℃、250rpm振荡培养。每隔6h加入甲醇,至甲醇终浓度为0.5~1.0%。每12h取适量培养液测定od600值以及酶活力,以确定重组蛋白表达的最佳收获时间。将发酵产物6000rpm离心10min,过hitrapqff层析柱层析,通过sds-page检测分析纯化产物。如图3所示,在40kda附近有明显条带,与预期大小相符,表明lrman5b在毕赤酵母中成功表达。实验表明,菌体od600值达到300,酶活力最佳。进行甲醇诱导5天,使重组毕赤酵母生产β-甘露聚糖酶;从发酵液中分离β-甘露聚糖酶液,并通过喷雾干燥制备固体β-甘露聚糖酶制剂。
实施例5lrman5b酶学特性的研究
1、lrman5b酶活测定。
以0.3%洋槐豆胶溶液为底物测定β-甘露聚糖酶活力:
(1)取底物溶液1.8ml于洁净试管中,50℃预热5min,加入适当稀释的待测酶稀释液0.20ml后,置于50℃水浴锅中准确反应5min。
(2)反应结束后加入3mldns试剂终止反应,沸水浴中反应5min。
(3)空白对照组将酶液高温失活后加入,其他操作同步骤(1)、(2)。
(4)以空白组反应液调零,在分光光度计540nm处比色,测定od值。根据甘露糖标准曲线,计算,酶解反应生成的甘露糖当量。
计算公式如下(1)
x——试样β-甘露聚糖酶的活力,u/ml;
a——为与甘露糖相当的还原糖生成量,μmol;
n——稀释倍数(总稀释倍数);
v——加入的酶液体积,ml;
5——5分钟的反应时间。
同一试样三个平行测定值的相对误差不超过8.0%。
酶活力单位(u)的定义为在最适测定条件下,每分钟生成1μmol的甘露糖所需的酶量定义为一个酶活力单位(u)。
2、ph和温度对β-甘露聚糖酶酶活力的影响
测定在50℃下,β-甘露聚糖酶酶在ph3.0~8.0的缓冲液的酶活力。ph3.0~8.0,使用0.2m柠檬酸-磷酸氢二钠缓冲液。
确定最适ph后,在酶最适ph条件下测定不同温度(40~85℃)下的酶活力,确定酶的最适作用温度。
结果如图4所示,在50℃下,该β-甘露聚糖酶在ph4.5-6.0之间都具有较高的活性,在ph为5.0时,即达到最高酶活,随着ph增加酶活力缓慢下降,在ph为6.5时,保留60%以上的酶活力。
如图5所示,在ph为5.0,β-甘露聚糖酶酶活力在温度为65℃时达到最大值,到75℃时酶活力含具有70以上的相对酶活力。超过75℃检测,相对酶活力急剧下降。
3、β-甘露聚糖酶ph耐受性的测定
将酶保存在不同ph值的缓冲液中,室温保存12小时,最适作用ph5.0和最适作用温度65℃条件下测定酶活力,缓冲液为0.2m柠檬酸-磷酸氢二钠缓冲液,反应时间5min。
图6所示该酶在ph3.0-8.0的范围测定β-甘露聚糖酶的ph稳定性,如图5所示,β-甘露聚糖酶在ph为3.0-8.0都具有较好的稳定性。
4、β-甘露聚糖酶温度耐受性的测定
将β-甘露聚糖酶在40~80℃下保存30min,在最适ph5.0和最适温度65℃条件下测定酶活力。
图7表明,β-甘露聚糖酶具有较好的热稳定性,60℃处理0.5h后,残留约90%酶活力。该酶在低于60℃下保温30min,酶活损失极少,该酶热稳定性较好。
实施例6β-甘露聚糖酶动力学常数分析
在最适条件下,以洋槐豆胶为底物,在不同底物浓度下测定β-甘露聚糖酶比活力。用graphpadprism5软件进行分析。
图8表明该酶的km和vmax分别为1.276mg/ml和2266umol/min·mg。
实施例7lrman5b基因编码的β-甘露聚糖酶与β-甘露糖苷酶协同分解洋槐豆胶,其中β-甘露糖苷酶的获取见申请号为cn201710665651.6的中国发明专利文献。
分别取三只5ml的离心管,每个离心管钟装有1.7ml缓冲液,并加入0.05g洋槐豆胶,缓冲液为柠檬酸-磷酸氢二钠缓冲液,ph5.5,震荡均匀。一个离心管钟加入100u的lrman5b基因编码的β-甘露聚糖酶,另一个离心管钟加入0.25u甘露糖苷酶,第三个离心管中同时加入100u的lrman5b基因编码的β-甘露聚糖酶和0.25u甘露糖苷酶。将用缓冲液将三个离心管的最终反应体系调整为2ml。在55℃下作用3h。然后将反应物置于沸水中煮沸10min终止反应,室温冷却,12000rpm离心20min。使用岛津色谱仪进行hplc检测甘露糖的生产量。hplc检测条件:色谱柱为alltimaaminoz氨基柱(4.6×250mm,5μm);流动相为乙腈:水(75:25);流速为1ml/min;柱温为40℃。
表1lrman5b基因编码的β-甘露聚糖酶与β-甘露糖苷酶协同分解洋槐豆胶检测结果
结果如表1,当只添加甘露糖苷酶,甘露糖的生产量为0.94mg,当只添加甘露聚糖酶时,甘露糖的生产量为3.54mg。而当同时添加甘露糖苷酶和β-甘露聚糖酶时,甘露糖的生产量达12.94mg,相比单独添加甘露糖苷酶,甘露糖的生成量提高12.7倍,表明β-甘露聚糖酶协同甘露糖苷酶在工业上生产甘露糖有十分重要的意义。
实施例8lrman5b基因编码的β-甘露聚糖酶与另一β-甘露糖苷酶协同分解棕榈粕,其中β-甘露糖苷酶的获取见申请号为cn201710665651.6的中国发明专利文献。
分别取三只50ml的离心管,每个离心管钟装有7ml缓冲液,并加入0.5g棕榈粕,缓冲液为柠檬酸-磷酸氢二钠缓冲液,ph5.5,震荡均匀。第一只离心管加入900u的lrman5b基因编码的β-甘露聚糖酶lrman5b,第二只离心管加入1.5u甘露糖苷酶,第三只离心管同时添加900u的lrman5b基因编码的β-甘露聚糖酶和1.5uβ-甘露糖苷酶,各离心管最终反应体系为10ml。在55℃作用3h。然后将反应物沸水中煮沸10min终止反应,室温冷却,12000rpm离心20min。使用岛津色谱仪进行hplc检测甘露糖的生产量。hplc检测条件:色谱柱为alltimaaminoz氨基柱(4.6×250mm,5μm);流动相为乙腈:水(75:25);流速为1ml/min;柱温为40℃。
表2lrman5b基因编码的β-甘露聚糖酶与β-甘露糖苷酶协同分解棕榈粕检测结果
结果如表2,当只添加β-甘露糖苷酶,甘露糖的生产量为18.14mg,而当同时添加β-甘露糖苷酶和900u的lrman5b基因编码的β-甘露聚糖酶时,甘露糖的含量达45.35mg,甘露糖的生成量提高1.5倍,表明lrman5b基因编码的β-甘露聚糖酶在工业上生产甘露糖具有重要的意义。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,其架构形式能够灵活多变,可以派生系列产品。只是做出若干简单推演或替换,都应当视为属于本发明由所提交的权利要求书确定的专利保护范围。
- 还没有人留言评论。精彩留言会获得点赞!