miR-216a及其靶基因在血管衰老和动脉粥样硬化性心脏病中的应用的制作方法
本发明涉及检验医学、临床医学、生物技术领域,具体涉及mir-216a及其靶基因在血管衰老和动脉粥样硬化性心脏病中的应用。
背景技术
动脉粥样硬化及其心血管并发症如性心肌梗死、不稳定型心绞痛和缺血性脑卒等严重威胁人类健康。衰老是动脉粥样硬化发生的独立危险因素。血管内皮细胞衰老导致的内皮炎症反应和功能障碍是动脉粥样硬化发生发展的起始阶段。体内研究进一步表明,与正常血管相比,人动脉粥样硬化斑块处的内皮细胞出现显著的衰老表型。然而内皮细胞衰老和功能障碍的分子机制并不完全清楚。遗传、表观遗传及环境因素共同影响血管老化和炎症反应,参与动脉粥样硬化发生发展过程。
微小rnas(micrornas,简称mirnas)是表观遗传因素中重要的调控者之一。mirnas是一类长约22个核苷酸的单链非编码rna分子,可在转录后水平结合靶基因mrna的3’非翻译区(untranslatedregion,utr),引导沉默复合体降解mrna,终止翻译,调控生物体内1/3以上的基因表达。越来越多的体内外研究表明mirnas参与调控血管衰老和炎症反应过程,如mir-217、mir-34a、mir-146a和mir-181b等。
microrna-216a(mir-216a)位于2号染色体非编码基因da73的第二个内含子上,在前体mir-216a加工过程中,mir-216a-3p降解,生成成熟体mir-216a-5p,在人、小鼠、大鼠、斑马鱼等物种间保守表达。mir-216a在血管内皮细胞衰老和内皮炎症反应中的作用尚无报道,mir-216a能否作为动脉粥样硬化斑块稳定性以及冠心病等心血管疾病的血清学标志物尚需阐明。
技术实现要素:
本发明的目的之一在于提供一种用于老年冠状动脉粥样硬化疾病的早期诊断以及用于动脉粥样硬化斑块稳定性的早期预测的血清学循环生物标志物microrna-216a(mir-216a)及其应用;
本发明的目的之二在于提供所述mir-216a调控的靶基因smad3和/或smad7在制备预防、诊断或治疗血管内皮衰老和炎症反应以及老年冠状动脉粥样硬化疾病产品中的应用;或在制备预测个体中动脉粥样硬化斑块稳定性的产品中应用;
本发明目的之三在于提供一种mir-216a抑制剂及其应用。
为实现上述目的,本发明首先提供mir-216a在如下i、ii或iii中的应用:
i、制备预防、早期诊断或治疗血管内皮衰老和炎症反应以及老年动脉粥样硬化产品中的应用;
ii、制备调控基因smad3和/或smad7介导的tgfβ1信号通路的抗炎产品中的应用;
iii、在制备用于预测个体中动脉粥样硬化斑块稳定性产品中的应用。
优选的,所述mir-216a在衰老huvecs和动脉粥样硬化患者样本中表达上调;优选的,所述mir-216a在具有不稳定动脉粥样硬化斑块的人群中特异性高表达。
优选的,所述预测个体中动脉粥样硬化斑块稳定性是通过测定所述个体的血液样本或组织样本中的mir-216a表达情况,与对照相比,mir-216a表达水平是否升高,来预测所述动脉粥样硬化斑块的稳定性。
优选的,所述对照为个体中具有稳定的动脉硬化斑块(钙化斑块)。
优选的,所述对照是指来自例如至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或者例如至少100位个体的一系列样本中的mir-216a表达水平。
优选的,所述提供用于检测mirna的方法也是在本发明的一般范围内。该方法常常涉及样本mirna提取、逆转录反应、pcr扩增。
本发明也可通过监测不同时间点个体中mir-216a表达量情况,可以跟踪动脉粥样硬化斑块的稳定性作用的发展。
进一步地,本发明提供mir-216a调控的靶基因smad3和/或smad7在制备预防、诊断或治疗血管内皮衰老和炎症反应以及老年动脉粥样硬化产品中的应用;或在制备预测个体中动脉粥样硬化斑块稳定性产品中的应用。
本发明所述产品包括试剂、试剂盒、药物或保健品。
优选的,所述mir-216a调控基因smad3和/或smad7是通过mir-216a与所述smad3和/或smad7基因3’端非转录区域靶位点结合。
优选的所述mir-216a与smad3基因3’端非转录区域靶位点结合为与enst00000327367.8所示序列中第790-796位核苷酸结合;所述mir-216a与smad7基因3’端非转录区域靶位点结合为与ensg00000101665所示序列中第1230-1236位核苷酸结合。
进一步,使用双荧光素酶报告系统实验检测mir-216a对smad3和/或smad7的调控作用。
进一步地,本发明提供一种mir-216a抑制剂,所述mir-216a抑制剂的核苷酸序列为seqidno.1;所述抑制剂能抑制mir-216a表达,促进靶基因smad3和/或smad7表达。
更进一步地,本发明提供所述mir-216a抑制剂在如下i或ii中的应用:
i、在预防或治疗血管内皮衰老和内皮炎症反应以及老年冠状动脉粥样硬化疾病药物中的应用;
ii、在制备预防或治疗动脉粥样硬化斑块不稳定试剂或药物中的应用。
优选的,所述mir-216a抑制剂促进smad3和/或smad7的表达,进而通过smad3/iκbα/smad7信号通路介导炎症反应。
优选的,所述炎症反应中的炎症因子包括icam1(intercellularadhesionmolecule1,细胞间粘附分子1)、vcam1(vascularcelladhesionmolecule1,血管细胞粘附分子1)和il1β(interleukin1beta,人白介素1β)。
本发明提供一种治疗老年动脉粥样硬化药物,所述药物组合物包括所述mir-216a抑制剂以及药剂学上能接受的载体。
进一步地,本发明还提供了一种老年冠状动脉粥样硬化疾病早期诊断试剂盒,所述试剂盒包括特异性扩增mir-216a、smad3和smad7引物,所述特异性扩增mir-216a引物为商业购买,所述特异性扩增smad3引物如seqidno.20-21,所述特异性扩增smad7引物如seqidno.30-31。
优选的,所述试剂盒通过实时荧光定量pcr检测冠状动脉粥样硬化疾病患者样本中mir-216a表达情况以及mir-216a调控的smad3和smad7靶基因的表达情况。
优选的,所述冠状动脉粥样硬化疾病患者样本为组织或血液。
优选的,所述试剂盒还包括:提取mirna和rna试剂,逆转录试剂,实时定量荧光pcr试剂,上述试剂均可商业购买。
更进一步,本发明提供一种预测个体中动脉粥样硬化斑块稳定性的试剂盒,所述试剂盒包括提取个体血液样本的mirna试剂、逆转录试剂、实时定量pcr试剂及扩增引物。提取个体血液样本的mirna试剂可以是商业购买如使用mirneasyplasmakit(#217184,qiagen,hilden,germany)。逆转录试剂、实时定量pcr试剂及扩增引物可以是商业购买如miscriptiireversetranscriptionkit(#218161)和miscriptsybrgreenpcrkit(#218073)(qiagen,hilden,germany)配合miscriptprimerarray引物(qiagen,hilden,germany)。
优选的,所述试剂盒还包括对照组,所述对照组分别为无动脉粥硬化斑块和稳定的动脉粥硬化斑块(钙化斑块)个体样本中的mirna。
本发明通过使用上述试剂盒预测个体中动脉粥样硬化斑块稳定性以及监测个体中动脉粥样硬化斑块稳定性进展情况。
本发明的有益效果如下:
1)本发明发现了mir-216a诱导内皮细胞衰老、促进炎症反应和功能障碍的作用;mir-216a抑制剂为改善内皮功能(如抑制炎症、促进增殖、迁移功能)、治疗动脉粥样硬化提供一种新途径;
2)本发明发现了mir-216a调控的靶基因smad3和smad7共同作为生物标记物在预防、诊断或治疗血管内皮衰老和炎症反应以及老年冠状动脉粥样硬化疾病中的应用;或在预测个体中动脉粥样硬化斑块稳定性中的应用。
3)本发明还发现了能够用于早期筛查和预警老年人群冠心病事件的新的血清学生物标志物:mir-216a,循环mir-216a表达水平与年老人群(>50岁)的冠心病(冠状动脉粥样硬化疾病)发生风险显著相关,可以作为评估冠心病发生风险的新的生物标志物;
4)循环mir-216a水平与冠脉不稳定斑块发生风险显著相关,可以作为评估斑块稳定性和冠心病发生风险的新的血清学生物标志物。
本发明公开了一种与血管内皮衰老和炎症反应、老年冠状动脉粥样硬化疾病以及动脉粥样硬化斑块稳定性相关的生物标记物mir-216a以及其靶基因smad3和smad7,并证实mir-216a在动脉粥样硬化患者组织或血液样本中表达上调,也证实mir-216a在具有不稳定动脉粥样硬化斑块的人群中特异性高表达;mir-216a、smad3和smad7可在制备预防、诊断或治疗血管内皮衰老和炎症反应以及老年冠状动脉粥样硬化疾病产品中应用或在制备用于预测个体中动脉粥样硬化斑块稳定性的产品中的应用。利用所述生物标记物可以在老年冠状动脉粥样硬化发生的早期进行评估诊断或对动脉粥样硬化斑块稳定性和进展进行评估预测,不仅对冠状动脉粥样硬化的早期治疗和医疗成本的节约有重要意义,而且为基因治疗、药物治疗等临床应用提供了治疗靶点和重要依据。
附图说明
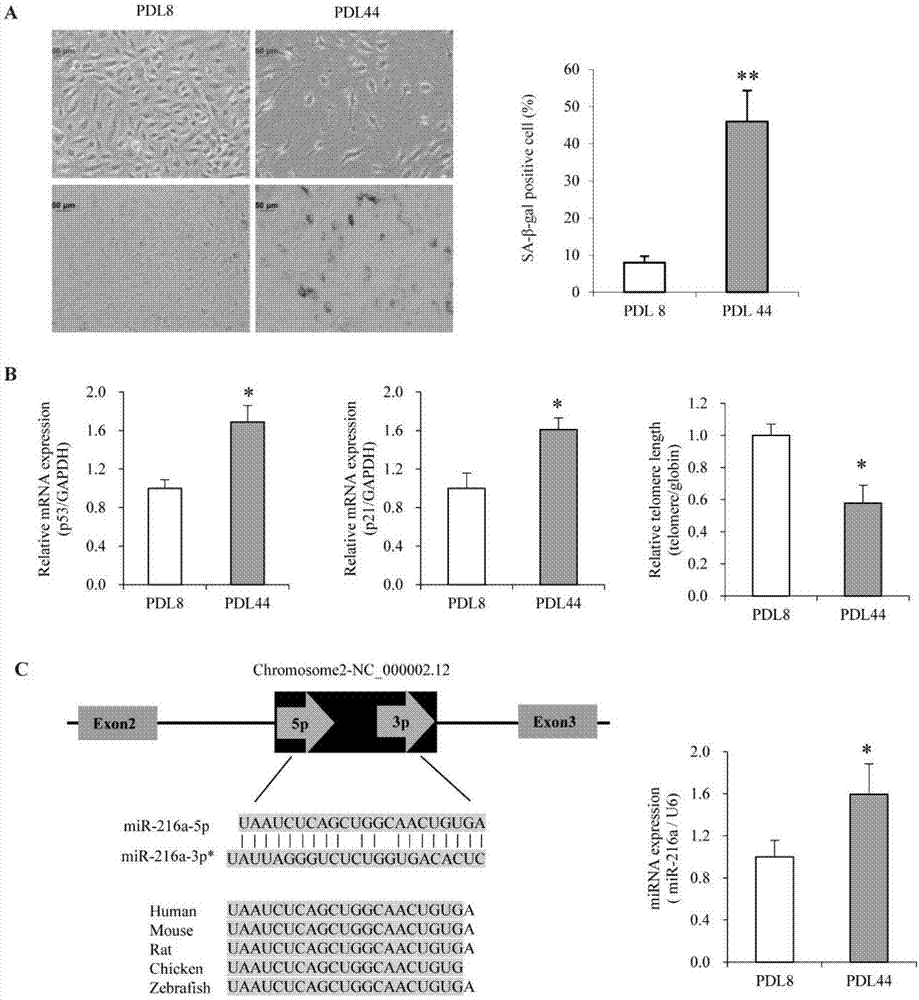
图1apdl8和pdl44huvecs的sa-β-gal染色图,n=5;b衰老相关基因p53、p21的mrna表达水平和端粒长度检测,n=3;cmir-216a基因组结构、保守性和其在衰老内皮细胞中的表达水平,n=3;比例尺:50μm;*p<0.05,**p<0.01;
图2apdl8、pdl12、pdl16和pdl20细胞株的sa-β-gal染色图,n=5;bpdl8和pdl20细胞株中衰老相关基因p53、p21的mrna表达水平、端粒长度和端粒酶活性检测,n=3;比例尺:200μm;*p<0.05,**p<0.001;
图3athp-1单核细胞向pdl8和pdl20稳定过表达mir-216a细胞株的粘附图,n=5;bpdl8和pdl20细胞株中粘附分子icam1和vcam1的mrna表达水平,n=3;cmir-216a抑制剂对pdl44衰老内皮细胞粘附功能的作用,n=5;比例尺:200μm;*p<0.05,**p<0.001;
图4apdl8和pdl20稳定过表达mir-216a细胞株的增殖活性检测,n=8;bmir-216a抑制剂对pdl44衰老内皮细胞增殖活性的作用,n=8;cpdl8和pdl20稳定过表达mir-216a细胞株的迁移能力检测,n=5;dmir-216a抑制剂对pdl44衰老内皮细胞迁移能力的作用,n=5;比例尺:500μm。*p<0.05,**p<0.001;
图5amir-216a与smad33’utr结合位点图;bmir-216a对hek293t细胞中smad33’utr和3’utrmutant荧光素酶报告系统的作用,n=8;cmir-216a对huvecs细胞中smad33’utr和3’utrmutant荧光素酶报告系统的作用,n=8;dmir-216amimics或mir-216ainhibitors对年轻或年老内皮细胞smad3表达水平的作用,n=3;*p<0.05,**p<0.001;
图6a年轻年老内皮细胞中smad3、tgfβ1、smad2和iκbα的mrna表达水平;b年轻pdl8内皮细胞中过表达mir-216a对smad3、smad2蛋白水平,p65、iκbα蛋白和磷酸化水平的影响;c在pdl8细胞中敲低smad3对p65和iκbα蛋白水平,及粘附分子icam1和vcam1的表达的影响;d在pdl8细胞,抑制mir-216a表达对smad3、iκbα蛋白水平和icam1、vcam1mrna水平的影响,每组n=3,*p<0.05,**p<0.001;
图7asmad7在pdl8和pdl44huvecs中的表达,n=3;b生物信息学预测mir-216a与smad73’utr的结合位点;cmir-216a对hek293t细胞中smad73’utr和3’utrmutant荧光素酶报告系统的作用,n=8;d年轻pdl8内皮细胞中过表达mir-216a对smad7蛋白水平的影响,n=3;e在pdl8细胞中敲低smad7对炎症因子il1β和icam1mrna表达水平的影响,n=3;*p<0.05,**p<0.01;
图8a收集人颈动脉动脉粥样硬化斑块组织41例,根据mir-216a水平分为低表达mir-216a组(n=21)和高表达mir-216a组(n=20),与低表达组相比,mir-216a高表达组mir-216a水平增加7.4倍(p<0.001);bsmad7在mir-216a低表达组和高表达组中的表达;cpearson相关分析表明mir-216a与smad7表达的负相关关系;*p<0.05,**p<0.01;
图9cad病人(n=176)和对照组(n=342)按照年龄分层,35-49岁组、50-59岁组和>60岁组,在35-49岁人群中,cad(0.84,iqr,0.43-1.75)和对照人群(0.82,iqr,0.42-1.65)中mir-216a血浆表达水平无显著差异(p=0.8);在50-59岁人群中,与健康对照(0.80,iqr,0.43-1.60)相比,血浆mir-216a水平在年老的cad病人中(1.55,iqr,0.73-4.00)中显著上调(p=0.001);在>60岁人群中,与对照组相比(0.88,iqr,0.36-1.57),血浆mir-216a水平在老年cad病人中(1.38,iqr,0.58-2.68)显著上调(p=0.004);*p<0.05,**p<0.01。
图10血浆mir-216a水平在具有易损斑块的患者中升高;**p<0.01,与无斑块组比较。#p<0.05,与钙化斑块组比较。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用的试剂可以商业购买得到。
本发明的整体实验方案如下:
本发明通过体外培养人脐静脉内皮细胞(humanumbilicalveinendothelialcells,huvecs),建立细胞衰老模型,发现在衰老内皮细胞中mir-216a表达上调;为了研究mir-216a对内皮细胞衰老过程的影响,发明人构建了pre-mir-216a重组慢病毒(lv-mir-216a)细胞株并连续传代,探究mir-216a在内皮细胞衰老和炎症反应中的作用;进一步,本发明通过生物信息学预测(targetscanrelease7.1),发现mir-216a的两个潜在靶点:smad3和smad7,并用双荧光素酶报告系统实验验证靶向关系;smad3和smad7作为tgfβ1信号通路上的重要介导者,可促进nf-κb抑制剂α(nf-κbinhibitorα,iκbα)表达,抑制炎症反应。此外,mir-216a分子量较小,在循环血中稳定存在,可能作为冠状动脉粥样硬化疾病(coronaryarterydisease,cad)的新的生物标志物,本发明运用大型cad病例对照队列,尤其是在年老的人群中,研究循环mir-216a表达与cad发生风险的关系;发现mir-216a可诱导内皮细胞衰老、促进内皮功能障碍,参与动脉粥样硬化性心血管疾病的发生发展过程。进一步为了探讨mir-216a在动脉粥样硬化斑块稳定性中的重要作用,本发明建立了冠脉ct造影患者队列,评估冠心病患者血浆mir-216a水平与斑块稳定性的关系,为寻找冠状动脉粥样硬化不稳定性斑块的预警标志物分子提供新的思路和方法。
本发明涉及的mir-216a核苷酸序列如seqidno.34所示;mir-216a核苷酸序列如所述mir-216a模拟物(mimics)序列如seqidno.32-33所示;所述mir-216a抑制剂(inhibitors)序列如seqidno.1所示。
本发明的thp-1细胞、hek293t细胞购自chinainfrastructureofcelllineresources。
在本发明中冠状动脉粥样硬化疾病与冠状动脉粥样硬化性心脏病(冠心病)所指相同疾病。
本发明涉及的统计学方法:
one-samplekolmogorov-smirnov检验用于评估定量变量的正态性。定量变量用均值±标准差或中位数或四分位间距(interquartileranges,iqrs)表示,分类变量用百分数表示;χ2检验用于比较定性变量,定量变量的组间差异用studentt检验或one-wayanova计算,mann-whitney非参数检验用于比较非正态分布的定量数据,如血浆mir-216a;pearson检验用于评估颈动脉斑块组织mir-216a水平和smad7表达的相关性;logistic回归模型用于评估循环mir-216a水平与cad风险的优势比(oddsratios,ors)和95%置信区间(confidenceintervals,cis);数据分析使用spssstatistics20.0(spssinc,chicago,usa),p<0.05为差异有统计学意义。
实施例1建立huvecs衰老模型及检测mir-216a在内皮细胞衰老过程中表达情况
1、huvecs(人脐静脉内皮细胞)培养
脐带离体后浸泡入4℃生理盐水中,2个小时内处理。取出脐带,pbs灌注脐静脉清洗两次。将0.1%collagenaseisolution(cat#c0130-100mg,sigma-aldrich,saintlouis,mo,usa)的灌注进脐带,两端扎,放入37℃水浴的烧杯中,孵育20分钟。取50ml管回收消化液,pbs洗一次,上下震荡,让细胞脱落,再回收pbs。1000g离心5分钟,去上清,加入含5%fbs的ecm重悬细胞,转移至t25细胞培养瓶。37℃孵育12小时后,去上清培养基,用pbs清洗2次,加入新鲜培养基继续培养。
huvecs用含5%胎牛血清(fetalbovineserum,fbs)的ecm培养基(cat.#1001,sciencell,sandiego,ca,usa)培养,传代并计算细胞群体倍增水平(populationdoublings,pdls),pdl=log2(n2/n1),n2为终末细胞数,n1为初始接种数,pdl数逐代增加,将pdl≤8huvecs定义为年轻细胞,pdl≥44huvecs定义为衰老细胞。
2、衰老相关β-半乳糖苷酶(sa-β-gal)染色
本发明使用原位sa-β-gal染色试剂盒(cat.#c0602,beyotimebiotechnology,shanghai,china)鉴定huvecs细胞衰老状态。12孔板培养的细胞待融合度达90%时,用固定液室温固定细胞15min,pbs洗2次,每次3min。将染色液按说明书配制成β-gal染色工作液,每孔加入1ml。用保鲜膜包裹12孔板,避免接触空气,避光、在37℃、无co2细胞培养箱内培养16小时。每组选取5个不同视野进行拍照,并计算sa-β-gal着色细胞的比例。
3、检测了衰老相关基因p53和p21,端粒长度和端粒酶活性
本发明应用实时荧光定量pcr检测衰老相关基因p53、p21表达水平trizol试剂(cat.#15596-026,invitrogen,carlsbad,ca,usa)提取huvecs的总rna,primescriptreversetranscriptaseassay(cat.#rr036a,takara,dalian,china)将mrna逆转录成cdna,使用sybrgreenqpcrmix(cat.#11202es08,yeasen,shanghai,china)试剂,置于abi7500system(appliedbiosystems,fostercity,ca,usa)检测基因表达水平。以gapdh为内参,δδct法计算基因的相对表达量。
特异性扩增p53、p21引物如下:
p53:上游引物5’-cgtgtggagtatttggatgacaga-3’seqidno.2,下游引物5’-ggagtcttccagtgtgatgatggt-3’seqidno.3;
p21:上游引物5’-gagcaggctgaagggtccccaggt-3’seqidno.4,下游引物5’-gcttcctgtgggcggattagggct-3’seqidno.5。
gapdh:上游引物5’-gaaggtgaaggtcggagtca-3’seqidno.6,下游引物5’-ggaagatggtgatgggatttc-3’seqidno.7。
本发明采用实时荧光定量pcr法检测pdl8和pdl44huvecs的端粒酶活性。计数并收集1×105个细胞,加入100μlchaps裂解液(cat.#11854666910,roche,mannheim,germany)重悬。冰上静置30min,16000g4℃离心30min,将上清液作为荧光定量pcr的模板。pcr反应体系包含:0.5u
本发明采用实时荧光定量pcr法计算相对端粒长度,即通过比较端粒重复拷贝数(t)和单拷贝基因β-globin(s)的比值计算。使用minibestuniversalgenomicdnaextractionkit(cat.#9765,takara,dalian,china)提取基因组dna,使用
端粒长度检测的上游引物:5’-cggtttgtttgggtttgggtttgggtttgggtttgggtt-3’seqidno.10,下游引物:5’-ggcttgccttacccttacccttacccttacccttaccct-3’seqidno.11;
β-globin检测的上游引物:5’-gcttctgacacaactgtgttcactagc-3’seqidno.12,下游引物:5’-caccaacttcatccacgttcacc-3’seqidno.13。
4、检测mir-216a在内皮细胞衰老过程中表达上调
本发明使用mirneasyminikit(cat.#217004,qiagen,hilden,germany)提取huvecs中的mirnas;应用miscriptiireversetranscriptionkit(cat.#218161)和miscriptsybrgreenpcrkit(cat.#218073)(qiagen,hilden,germany)配合miscriptprimerarray引物(qiagen,hilden,germany)进行逆转录和实时荧光定量pcr检测mir-216a基因的表达。u6作为细胞或组织中的内参。
5、结果
在复制衰老的huvecs模型中,与pdl8huvecs相比,pdl44huvecs出现肥大形态、sa-β-gal染色阳性细胞增加4.7倍(p<0.001)(图1a);同时,衰老相关基因p53和p21分别显著上调69%(p=0.003)和61%(p=0.001),端粒长度缩短42%(p=0.01)(图1b)。因此,pdl8和pdl44huvecs分别定义为年轻和年老内皮细胞。
mir-216a位于染色体2p16.1,在前体mir-216a加工过程中,mir-216a-3p降解,生成成熟体mir-216a-5p,其在物种间高度保守。在年轻pdl8内皮细胞中,mir-216a表达较少,随着细胞衰老,mir-216a在衰老的pdl44细胞中上调59%(p=0.03)(图1c)。
实施例2长期稳定过表达mir-216a诱导内皮细胞衰老
为了建立稳定过表达mir-216a的细胞株,pdl4huvecs分别感染pre-mir-216a重组慢病毒(ubi-egfp-mcs-ires-puromycin)和阴性对照(negativecontrol,nc)病毒载体(genechem,shanghai,china)。3天后,给予400ng/ml嘌呤霉素(cat.#8833,sigma-aldrich,saintlouis,mo,usa)进行筛选。当感染效率达到95%以上时(即绿色荧光蛋白表达细胞数超过95%)进行下一步实验。将mir-216和其阴性对照稳定表达细胞株进行连续传代并计算pdls。
随着传代次数的增加,在mir-216a稳定过表达15天后,pdl20huvecs出现明显的肥大和生长阻滞等衰老相关表型(图2a),结果发现,mir-216a显著促进内皮细胞衰老;并使用原位sa-β-gal染色试剂盒鉴定细胞衰老状态,在pdl12、pdl16和pdl20huvecs细胞中,mir-216a细胞株的sa-β-gal染色阳性率分布增加20%(p=0.05)、31%(p=0.004)和61%(p=0.001)(图2a)。
进一步检测了衰老相关基因p53和p21,端粒长度和端粒酶活性;结果:与阴性对照相比,在pdl20huvecs中,稳定过表达mir-216a细胞株显著上调p53和p21mrna表达水平,下调端粒酶活性,然而端粒长度未发生显著变化(图2b)。
实施例3mir-216a对内皮粘附、增殖和迁移功能的影响
本发明使用lipofectamine3000(cat.#l3000c015,invitrogen,carlsbad,ca,usa)瞬时转染试剂转染mir-216a抑制剂以及阴性对照(negativecontrol,nc)(cat.#b01001,genepharma,suzhou,china),转染终浓度为50nm。
3.1单核-内皮细胞粘附实验
本发明应用单核-内皮粘附实验分别检测pdl8、pdl20稳定过表达mir-216a细胞株及转染mir-216ainhibitors的自然衰老pdl44细胞的粘附能力。内皮细胞接种于24孔培养板,待细胞融合度达90%时进行粘附实验。收集thp-1细胞,用rpmi-1640培养基重悬至1×106个/ml,1mlthp-1细胞中加入5μlcelltrackertmcm-dil红色荧光染料(cat.#c7000,invitrogen,carlsbad,ca,usa),37℃培养30分钟。标记后的thp-1细胞用pbs洗两次,随后用rpmi-1640培养基重悬,每孔200μlthp-1加入含内皮细胞的24孔板,37℃培养30分钟后,pbs洗两次。荧光显微镜dmi-4000b(leica,wetzlar,germany)下拍照,选取5个视野,并计算每个视野粘附的thp-1细胞数。
3.2细胞增殖实验(mts法)检测内皮细胞的增殖能力
本发明使用mts法分别检测pdl8、pdl20稳定过表达mir-216a细胞株及转染mir-216a抑制剂的自然衰老pdl44细胞的增殖能力。细胞以1×104cells/well接种于96-well细胞培养板,过夜培养。弃上清,将celltiter
3.3细胞划痕实验(woundhealing法)检测内皮细胞的迁移与修复能力
本发明应用细胞划痕实验分别检测pdl8、pdl20稳定过表达mir-216a细胞株及转染mir-216a抑制剂的自然衰老pdl44细胞的迁移修复能力。细胞接种于12孔板,待融合度为95%时,用200μl移液枪头垂直培养板划线,在dmi-4000b倒置光学显微镜下拍照并计为0小时。用含1.25%fbs的ecm培养基继续培养细胞,12小时后在同一位置再次拍照。根据一次有代表性的实验中5个不同的划痕视野计算迁移率。迁移率为12小时后细胞迁移面积占原划痕面积的百分比。
3.4结果
1、mir-216a在内皮细胞粘附功能中的作用
pdl20稳定过表达mir-216a细胞株(lv-mir-216a代表稳定过表达mir-216a细胞株)表现出显著的衰老表型,如细胞肥大、生长阻滞等,与自然传代的pdl44细胞衰老状态相似,因此本发明使用pdl20稳定过表达细胞株检测mir-216a对内皮细胞功能的影响。结果表明,在pdl8和pdl20细胞株中,与阴性对照相比,mir-216a分别显著增加thp-1单核细胞向huvecs的粘附数量106%(p=0.002)和95%(p=0.001)(图3a);同时,在pdl8稳定过表达mir-216a细胞株中粘附因子icam1和vcam1表达分别上调34%和52%,在pdl20稳定过表达mir-216a细胞株中分别增加30%和1.79倍(图3b)。
另一方面,本发明使用mir-216a抑制剂瞬时转染衰老pdl44内皮细胞,抑制其源性的mir-216a表达,结果发现内皮细胞粘附thp-1单核细胞的能力下降19%(p=0.01)(图3c)。
2、细胞增殖实验和细胞划痕实验结果
本发明中分别使用mts法和划痕实验检测mir-216a对内皮细胞增殖和迁移能力的影响。在mir-216a稳定过表达15天后,mir-216a显著抑制pdl20细胞增殖能力15%(p<0.001),抑制其迁移能力16%(p<0.001)(图4a和4c)。
反之,mir-216a抑制剂瞬时转染自然衰老的pdl44细胞后,内皮细胞的增殖和迁移能力得到改善。与对照相比,抑制mir-216a后,分别增加pdl44细胞增殖能力12%(p=0.02)、迁移能力24%(p=0.03)(图4b和4d)。
上述结果发现mir-216a可以诱导内皮衰老和炎症反应、促进内皮-单核细胞相互作用。
实施例4mir-216a在内皮细胞炎症反应中的新靶点-smad3
本发明使用lipofectamine3000瞬时转染试剂转染smad3sirna(cat.#s8402)及其阴性对照sinc(lifetechnologies,carlsbad,ca,usa),转染终浓度为40nm;转染mir-216amimics和mir-216a抑制剂以及阴性对照(nc),转染终浓度为50nm。
1、mir-216a的新靶点-smad3
通过生物信息学分析(targetscanrelease7.1),我们发现smad33’utr上的790-796bps位置处包含一个潜在的mir-216a结合位点(图5a)。下一步,本发明构建了smad33’utr和3’utrmutant荧光素酶报告载体从而证明mir-216a是否靶向作用于smad3。
以内皮细胞cdna为模板,pcr扩增包含mir-216a结合位点(790-796bps)的smad33’utr序列(enst00000327367.8),全长2,002bps,上游引物5'-ctcaacgcgtgcgtctgctctggtggct-3'seqidno.14,下游引物5'-ggcgcaagcttcacctggagtaagacacgacttc-3'seqidno.15。克隆片段插入pmir-reporttm载体(ambion,austin,tx,usa)中荧光素酶基因的下游;同时构建pmir-smad33’utrmutant载体,突变mir-216a的预测结合位点(图5a)。
进一步使用双荧光素酶报告系统实验检测mir-216a对smad3的调控作用,hek293t细胞(chinainfrastructureofcelllineresources,beijing,china)以1.2×104个/well接种于96孔板,lipofectamine3000共转染100ngpmir3’utr载体、1ng海肾荧光素酶载体prl和50nmmir-216amimics。转染2天后,dual-luciferasereporterassaysystem(cat.#e1910,promega,madison,wi,usa)试剂盒,置于酶标仪uniceldxc800synchronanalyzer(backman,ca,usa)上检测萤火虫荧光素酶活性和海肾荧光素酶活性。以海肾荧光素酶活性作为内参,计算相对荧光强度(relativeluciferaseactivity,rlu)。
在hek293t中共表达mir-216amimics和smad33’utr报告载体,结果显示,与阴性对照相比,mir-216a显著抑制荧光素酶活性40%(p<0.001);此外,过表达mir-216a对于smad33’utrmutant报告载体无显著作用(图5b)。
本发明在pdl8和pdl44huvecs细胞中瞬时共转染mir-216amimics和smad33’utr报告载体,进一步研究mir-216a在内皮细胞中对smad3的调控作用。结果显示,过表达mir-216a可以显著抑制pdl8细胞荧光素酶活性46%(p=0.03),抑制pdl44细胞荧光素酶活性37%(p=0.02)(图5c)。
此外,年轻pdl8和年老pdl44huvecs分别分别转染mir-216amimics和mir-216a抑制剂研究mir-216a对smad3蛋白水平的影响。在转染48小时后,在pdl8内皮细胞中mir-216a过表达显著下调smad3蛋白水平36%(p=0.04),反义,抑制pdl44内皮细胞中内源性mir-216a后smad3蛋白水平增加27%(p=0.02)(图5d)。
所述检测mir-216a对smad3蛋白水平影响的方法-westernblot法:收集huvecs细胞,ripa裂解液(cat.#c3702,beyotimebiotechnology,shanghai,china)裂解细胞,同时加入蛋白酶抑制剂(cat.#04693159001,roche,mannheim,germany),冰上裂解15分钟,离心取上清。使用piercebcaproteinassaykit(cat.#23227,invitrogen,carlsbad,ca,usa)测定样品蛋白浓度。每个样品50μg,使用10%sds-page凝胶进行电泳,随后转移到硝酸纤维素膜上(millipore,ma,usa)。在用5%bsa封闭后,孵育一抗过夜。一抗包括兔多克隆抗体anti-smad3(cat.#12747)(cellsignalingtechnology,danvers,ma,usa)。兔多克隆抗体anti-gapdh(cellsignalingtechnology)作为内参。相应的,二抗为anti-rabbit(1:5000)抗体标记过氧化物辣根酶。用fluorchemr,mandesystems(proteinsimple,ca,usa)进行条带显色,并使用alphaviewsoftware进行灰度扫描并计算相对表达量。
2、mir-216a通过smad3/iκbα信号通路促进内皮细胞炎症反应
smad3是tgfβ1信号通路发挥抗炎作用的主要介导者,本发明进一步研究mir-216a是否通过靶向作用于smad3促进内皮细胞炎症反应。通过rt-pcr或westernblot方法检测年轻年老内皮细胞中tgfβ1抗炎信号通路基因的表达水平,主要包括smad3、smad2、下游iκbα(nf-κbinhibitoralpha)等。
所述rt-pcr方法参照实施例1中步骤,所述引物如下:
icam1:上游引物5'-tctgtgtcccccctcaaaagtc-3'seqidno.16,下游引物5'-gggtctctatgcccaacaa-3'seqidno.17;
vcam1:上游引物5'-gatacaaccgtcttggtcagccc-3'seqidno.18,下游引物5'-cgcatccttcaactggcctt-3'seqidno.19;
smad3:上游引物5'-cgtgcggctctactacatc-3'seqidno.20,下游引物5'-acattcgggtcaactggt-3'seqidno.21;
smad2:上游引物5'-ggatttacagccagttac-3'seqidno.22,下游引物5'-aaagccatctacagtgag-3'seqidno.23;
iκbα:上游引物5'-caccaaccagccagaaat-3'seqidno.24,下游引物5'-atcagcacccaaggacac-3'seqidno.25;
tgfβ1:上游引物5'-tacctgaacccgtgttgct-3'seqidno.26,下游引物5'-cagtgtgttatccctgctgtc-3'seqidno.27。
所述westernblot方法同上,所用一抗包括兔多克隆抗体anti-smad2、anti-smad3(cat.#12747)、anti-p65和鼠单克隆抗体anti-iκbα和其磷酸化抗体(cat.#9936);兔多克隆抗体anti-gapdh(cellsignalingtechnology)作为内参;相应的,二抗为anti-rabbit(1:5000)或anti-mouse(1:5000)抗体标记过氧化物辣根酶;所述抗体均购自cellsignalingtechnology公司。
结果表明,与年轻pdl8细胞相比,衰老pdl44内皮细胞中,tgfβ1、smad3和iκbα的mrna表达水平显著下调,与mir-216a水平呈负相关;此外,smad2mrna与mir-216a水平没有相关性(图6a)。
在pdl8细胞中,mir-216a过表达显著降低smad3和其下游iκbα的蛋白表达水平,但是对smad2、p65及其磷酸化水平无显著影响(图6b)。
进一步,本发明使用smad3sirnas确认smad3对其下游基因iκbα的调控作用。在pdl8细胞中敲低smad3的同时,iκbα蛋白水平显著下调,下游炎症因子icam1和vcam1显著上调(图6c)。相反,抑制衰老pdl44细胞中的内源性mir-216a表达后,smad3、iκbα表达水平上调,且icam1和vcam1显著下调(图6d)。
所述smad3sirna序列如下:
sense5’-aggacgaggucugcgugaaucccua-3’seqidno.35;
antisense5’-uagggauucacgcagaccucguccu-3’seqidno.36。
以上结果表明,mir-216a可以作为内皮细胞中smad3的内源性抑制剂,从而通过smad3/iκbα信号通路介导炎症反应;反之,mir-216a抑制剂可挽救衰老内皮细胞中smad3表达水平,抑制内皮炎症。
实施例5mir-216a在内皮细胞炎症反应中的新靶点-smad7
本发明使用lipofectamine3000瞬时转染试剂转染smad7sirna(cat.#s8413及其阴性对照sinc,转染终浓度为40nm;转染mir-216amimics和mir-216a抑制剂以及阴性对照(nc),转染终浓度为50nm。
本发明通过检测年轻年、老内皮细胞中tgfβ1抗炎信号通路基因的表达水平,还发现smad7基因,tgfβ1/smad2/3通路抑制剂,在衰老pdl44内皮细胞中表达水平显著下调47%(p=0.03),与mir-216a水平呈负相关(图7a);此外,生物信息学分析(targetscanrelease7.1),表明smad73’utr上的1230-1236bps位置处包含一个潜在的mir-216a结合位点(图7b)。
本发明构建了smad73’utr和3’utrmutant荧光素酶报告载体从而证明mir-216a是否靶向作用于smad7。
以内皮细胞cdna为模板pcr扩增smad73’utr(ensg00000101665),扩增长度1134bps,
上游引物为:5’-gccaagctttcttcttctcgtcctcgtt-3’seqidno.28,下游引物为:5’-gccgagctctaggtgataacacccataga-3’seqidno.29;同时构建pmir-smad73’utrmutant载体,突变mir-216a的预测结合位点(图7b)。
进一步,在hek293t细胞中进行荧光素酶活性实验,所述实验方法同实施例4,结果显示mir-216a可抑制pmir-smad73’utr荧光素酶活性91%(p<0.001),而对pmir-smad73’utrmutant报告载体的荧光素酶活性无显著影响(图7c)。
此外,年轻pdl8huvecs分别转染mir-216amimics和mir-216a抑制剂通过所述westernblot检测mir-216a对smad7蛋白水平的影响。在转染48小时后,在年轻pdl8内皮细胞中过表达mir-216a后,smad7蛋白的表达水平下调50%(p=0.02)(图7d)。
进一步,本发明使用sirnas敲低pdl8内皮细胞smad7表达水平后,炎症因子il1β和icam1分别上调29%(p=0.04)和66%(p=0.03)(图7e),与过表达mir-216a的效果一致。以上结果表明smad7是mir-216a介导内皮炎症反应的另一新靶点。
实施例6人颈动脉粥样硬化组织中mir-216a与smad7表达水平的关系
本发明收集了41例行颈动脉粥样硬化剥脱术病人的颈动脉斑块组织,并检测了mir-216a和smad7的mrna表达水平。人血管组织使用经中国医学科学院阜外医院伦理委员会批准。
检测smad7的mrna表达水平:
将组织剪碎,浸泡入rnalatersolution(cat.#am7020,invitrogen,carlsbad,ca,usa)中,保存于-80℃。提取组织rna时,经研钵研碎,trizol试剂提取总rna,primescriptreversetranscriptaseassay(cat.#rr036a,takara,dalian,china)进行逆转录,使用sybrgreenqpcrmix(cat.#11202es08,yeasen,shanghai,china)试剂,后检测smad7的表达水平。所述特异性扩增smad7基因引物:
上游引物:5’-actccagatacccgatggattt-3’seqidno.30
下游引物:5’-cctcccagtatgccaccac-3’seqidno.31
检测mir-216a的mirna表达水平:
本发明使用mirneasyminikit(cat.#217004,qiagen,hilden,germany)提取斑块组织中的mirnas;应用miscriptiireversetranscriptionkit(cat.#218161)和miscriptsybrgreenpcrkit(cat.#218073)(qiagen,hilden,germany)进行逆转录和实时荧光定量pcr检测mir-216a基因的表达。u6作为组织中的内参。
根据mir-216a表达水平中位数,分为mir-216a低表达组(21例)和mir-216a高表达组(20例)(图8a);结果表明,mir-216a高表达组的smad7mrna表达显著下调30%(p=0.02)(图8b)。进一步分析表明,人颈动脉斑块组织中mir-216a与smad7表达水平显著负相关(r=-0.43,p=0.05)(图8c)。
实施例7血浆mir-216a水平与cad发生风险的关系
本发明自2016.05-2017.05连续入选了阜外医院疑为冠状动脉粥样硬化疾病行冠状动脉造影检查(computedtomographycoronaryangiography,cta)的患者,年龄为45-70岁。所有的入选患者均为汉族且已签署知情同意。
本研究已通过阜外医院伦理委员会批准。冠状动脉cta检查显示至少一支主要冠状动脉存在≥50%的狭窄被诊断为冠状动脉粥样硬化疾病。对照组人群入选标准排除冠状动脉粥样硬化疾病,cta检查显示主要冠脉血管狭窄≤20%,且无其他血管疾病。所有入选人群都排除了其他心脏疾病史,包括心肌病、心脏瓣膜病和先天性心脏病。目前本研究纳入176cad和342年龄、性别匹配的对照人群。血样为来自于晨起空腹抽血,在2小时内进行离心分离血浆,血浆经5000rpm,5min再次离心去细胞碎片,分装在无rnaase的ep管中,保存于-80℃。
使用mirneasyplasmakit(cat.#217184,qiagen,hilden,germany)提取冠状动脉粥样硬化疾病-对照病人血浆中的mirnas,c.elegansmir-39(cel-39)作为外参。应用miscriptiireversetranscriptionkit(cat.#218161)和miscriptsybrgreenpcrkit(cat.#218073)配合miscriptprimerarray引物(qiagen,hilden,germany)进行逆转录和实时荧光定量pcr检测mir-216a的表达。
结果表明,与健康对照(0.79,iqr,0.39-1.47)相比,循环mir-216a水平在cad病人中显著上调(1.11,iqr,0.49-2.02)(p=0.002)。进一步按照年龄分层:35-49岁组、50-59岁组和>60岁组,与健康对照(>50岁)相比,血浆mir-216a水平在年老的cad病人中(>50岁)中显著上调,然而在年轻的cad和对照人群中mir-216a血浆表达水平无显著差异(图9)。
在调整了传统危险因素后,包括年龄、性别、bmi、吸烟、饮酒、血压、血糖和脂质水平,在>50岁的人群中,循环mir-216a水平增加cad发生风险31%(or=1.31,95%ci1.03-1.66;p=0.03),而在<50岁人群中,mir-216a水平与cad发生风险没有相关性(or=0.83,95%ci0.42-1.64;p=0.60)。
实施例8mir-216a水平在具有易损冠脉斑块的人群的血浆中显著升高
本发明自2016.05-2017.10连续入选了阜外医院疑为冠心病行冠状动脉造影检查(computedtomographycoronaryangiography,cta)的患者。研究已通过阜外医院伦理委员会批准,所有的入选患者均已签署知情同意。
使用64排螺旋ct(lightspeedvct,gehealthcare,milwaukee,wi)进行冠脉扫描,两名放射科医师分别对冠状动脉图像进行了分析。根据美国心脏协会的分类,冠状动脉被划分为16个部分,然后对这些片段进行分析,进行斑块分类。明显区别于冠脉管腔,且>1mm2的结构被鉴定为动脉粥样硬化斑块。冠脉无>1mm2斑块的人群被分配到对照组。钙化被定义为至少有3个密度>130hu的连续像素。仅有高密度材料>130hu组成的斑块被认为是钙化斑块。混合斑块则包含脂质、纤维和钙化等成分。
根据冠脉ct图像分析结果将入选者(n=518)分为3组,包括无斑块组(对照组,n=264)、钙化斑块组(稳定斑块,n=73,仅有高密度材料>130hu组成)和混合斑块组(易损斑块,n=181)。所有入选人群都排除了其他心脏疾病史,包括心肌病、心脏瓣膜病和先天性心脏病。血样为来自于晨起空腹抽血,在2小时内进行离心分离血浆,血浆经5000rpm,5min再次离心去细胞碎片,分装在无rnaase的ep管中,保存于-80℃。通过实时荧光定量pcr检测各组中mir-216a表达水平。
结果显示,与无斑块组相比(0.72,iqr,0.26-1.47),混合斑块组血浆mir-216a水平显著升高(1.04,iqr,0.49-2.01)(p=0.007),而钙化斑块组无显著变化变化(0.79,iqr,0.43-1.47)(p=0.54)。更重要的是,与钙化斑块组相比,混合斑块组的循环mir-216a水平也显著增加(p=0.03)(图10),提示血浆mir-216a在具有不稳定斑块的人群中特异性高表达。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
sequencelisting
<110>中国医学科学院阜外医院
<120>mir-216a及其靶基因在血管衰老和动脉粥样硬化性心脏病中的应用
<130>p18037
<160>36
<170>patentinversion3.5
<210>1
<211>22
<212>rna
<213>人工序列
<400>1
ucacaguugccagcugagauua22
<210>2
<211>24
<212>dna
<213>人工序列
<400>2
cgtgtggagtatttggatgacaga24
<210>3
<211>24
<212>dna
<213>人工序列
<400>3
ggagtcttccagtgtgatgatggt24
<210>4
<211>24
<212>dna
<213>人工序列
<400>4
gagcaggctgaagggtccccaggt24
<210>5
<211>24
<212>dna
<213>人工序列
<400>5
gcttcctgtgggcggattagggct24
<210>6
<211>20
<212>dna
<213>人工序列
<400>6
gaaggtgaaggtcggagtca20
<210>7
<211>21
<212>dna
<213>人工序列
<400>7
ggaagatggtgatgggatttc21
<210>8
<211>18
<212>dna
<213>人工序列
<400>8
aatccgtcgagaacagtt18
<210>9
<211>21
<212>dna
<213>人工序列
<400>9
gtgtaaccctaaccctaaccc21
<210>10
<211>39
<212>dna
<213>人工序列
<400>10
cggtttgtttgggtttgggtttgggtttgggtttgggtt39
<210>11
<211>39
<212>dna
<213>人工序列
<400>11
ggcttgccttacccttacccttacccttacccttaccct39
<210>12
<211>27
<212>dna
<213>人工序列
<400>12
gcttctgacacaactgtgttcactagc27
<210>13
<211>23
<212>dna
<213>人工序列
<400>13
caccaacttcatccacgttcacc23
<210>14
<211>28
<212>dna
<213>人工序列
<400>14
ctcaacgcgtgcgtctgctctggtggct28
<210>15
<211>34
<212>dna
<213>人工序列
<400>15
ggcgcaagcttcacctggagtaagacacgacttc34
<210>16
<211>22
<212>dna
<213>人工序列
<400>16
tctgtgtcccccctcaaaagtc22
<210>17
<211>19
<212>dna
<213>人工序列
<400>17
gggtctctatgcccaacaa19
<210>18
<211>23
<212>dna
<213>人工序列
<400>18
gatacaaccgtcttggtcagccc23
<210>19
<211>20
<212>dna
<213>人工序列
<400>19
cgcatccttcaactggcctt20
<210>20
<211>19
<212>dna
<213>人工序列
<400>20
cgtgcggctctactacatc19
<210>21
<211>18
<212>dna
<213>人工序列
<400>21
acattcgggtcaactggt18
<210>22
<211>18
<212>dna
<213>人工序列
<400>22
ggatttacagccagttac18
<210>23
<211>18
<212>dna
<213>人工序列
<400>23
aaagccatctacagtgag18
<210>24
<211>18
<212>dna
<213>人工序列
<400>24
caccaaccagccagaaat18
<210>25
<211>18
<212>dna
<213>人工序列
<400>25
atcagcacccaaggacac18
<210>26
<211>19
<212>dna
<213>人工序列
<400>26
tacctgaacccgtgttgct19
<210>27
<211>21
<212>dna
<213>人工序列
<400>27
cagtgtgttatccctgctgtc21
<210>28
<211>28
<212>dna
<213>人工序列
<400>28
gccaagctttcttcttctcgtcctcgtt28
<210>29
<211>29
<212>dna
<213>人工序列
<400>29
gccgagctctaggtgataacacccataga29
<210>30
<211>22
<212>dna
<213>人工序列
<400>30
actccagatacccgatggattt22
<210>31
<211>19
<212>dna
<213>人工序列
<400>31
cctcccagtatgccaccac19
<210>32
<211>22
<212>dna
<213>人工序列
<400>32
uaaucucagcuggcaacuguga22
<210>33
<211>22
<212>rna
<213>人工序列
<400>33
acaguugccagcugagauuauu22
<210>34
<211>22
<212>rna
<213>has-mir-216a
<400>34
uaaucucagcuggcaacuguga22
<210>35
<211>25
<212>dna
<213>人工序列
<400>35
aggacgaggucugcgugaaucccua25
<210>36
<211>25
<212>dna
<213>人工序列
<400>36
uagggauucacgcagaccucguccu25
- 还没有人留言评论。精彩留言会获得点赞!