白背飞虱几丁质合成酶1a(SfCHS1a)基因可变性剪切子及其dsRNA在害虫防治中的应用的制作方法
本发明涉及昆虫基因工程技术领域,尤其是一种白背飞虱几丁质合成酶1a(sfchs1a)基因可变性剪切子及其dsrna在害虫防治中的应用。
背景技术
白背飞虱sogatallafurcifera(horváth)隶属于半翅目hemiptera飞虱科delphacidae,是亚太地区水稻生产上的一种重要害虫。其主要通过成虫、若虫直接刺吸稻株汁液,造成水稻生长缓慢,分蘖延迟,瘪粒增加,受害严重时可引起稻株枯死;此外,白背飞虱还是南方水稻黑条矮缩病病毒(southernriceblack-streakeddwarfvirus,srbsdv)的主要传播媒介,造成的危害更是毁灭性的。当下白背飞虱的防控仍然主要依赖于化学杀虫剂,而化学杀虫剂的大量不合理使用,对生态环境和人类的健康构成了严重的威胁,同时也使得白背飞虱对多种杀虫剂产生了不同程度的抗性,因此,亟待发展一种新型的环境友好型的防治白背飞虱的策略。
rna干扰(rnainterference,rnai)是近年来发现的一种重要基因沉默手段,是通过体外合成一段与靶基因同源的双链rna(double-strandrna,dsrna),导入昆虫体内,使内源性靶基因中同源mrna降解,从而达到阻断基因翻译的目的。rnai是昆虫基因功能研究的有效手段,它的成功应用为发展环境友好型、经济效果好的新型害虫防治策略提供了新思路和新方法。
几丁质是昆虫表皮和中肠围食膜的主要组成部分。昆虫的表皮也由于几丁质和鞣化蛋白的存在而呈刚性结构,这无疑限制了昆虫的生长。在生长发育过程中,昆虫必须经历周期性地蜕去旧表皮和形成新表皮,这一过程依赖于昆虫体内几丁质生物合成和降解的精确控制。几丁质合成酶(chitinsynthase,chs)是昆虫几丁质合成过程中最后一步生化反应的关键酶,调节昆虫的行为、变态发育及繁殖等。通过扰乱或阻断昆虫几丁质合成酶的形成,使得昆虫体内出现了蜕皮障碍、存活率降低、繁殖力下降等现象。由于人类与其它高等动物体内不存在几丁质,所以几丁质合成过程中的关键酶作为害虫防治的靶标相对安全,但是目前针对白背飞虱几丁质合成酶1a的研究未见相关报道,也未见针对白背飞虱几丁质合成酶1a基因的dsrna的报道。
技术实现要素:
本发明的目的是提供一种白背飞虱几丁质合成酶1a(sfchs1a)基因可变性剪切子及其dsrna在害虫防治中的应用,以实现环境友好型的防治白背飞虱。
为实现上述目的,本发明采用如下方案:
一种白背飞虱几丁质合成酶1a(sfchs1a)基因可变性剪切子,其核苷酸序列如seqidno:3所示。其获取方法如下:基于genbank数据库中登录号为ky350143的几丁质合成酶1a的核苷酸序列,利用primerpremier6.0软件设计特异性的上游引物1seqidno:1和下游引物1seqidno:2,通过pcr扩增获得。
本发明还提供了一种dsrna,该dsrna由白背飞虱几丁质合成酶1a(sfchs1a)基因可变性剪切子合成。其合成方法如下:将核苷酸序列seqidno:3的基因片段的pcr产物胶回收与纯化后,以该胶回收的产物为模板按照
与现有技术相比,本发明的优点如下:
利用本发明所述基因片段合成的dsrna能够有效预防白背飞虱,通过体外合成一段与靶基因同源的双链rna(double-strandrna,dsrna),导入昆虫体内,使内源性靶基因中同源mrna降解,从而达到阻断基因翻译的目的,为发展环境友好型、经济效果好的新型害虫防治策略提供了新思路和新方法;其使用时,通过显微注射法将dsrna传递到白背飞虱体内,检测dsrna对sfchs1a基因的mrna表达,并观察dsrna对白背飞虱生长发育的影响。结果表明:注射dsrna可以特异性地沉默白背飞虱几丁质合成酶1a(sfchs1a)基因的mrna表达,同时虫体有明显的蜕皮困难的畸形表型,并最终导致死亡,干扰5天后死亡率达到90%。本发明为未来白背飞虱rna干扰介导的害虫防治策略提供了候选基因,同时本发明为研发新型杀虫剂提供了理论依据。
附图说明
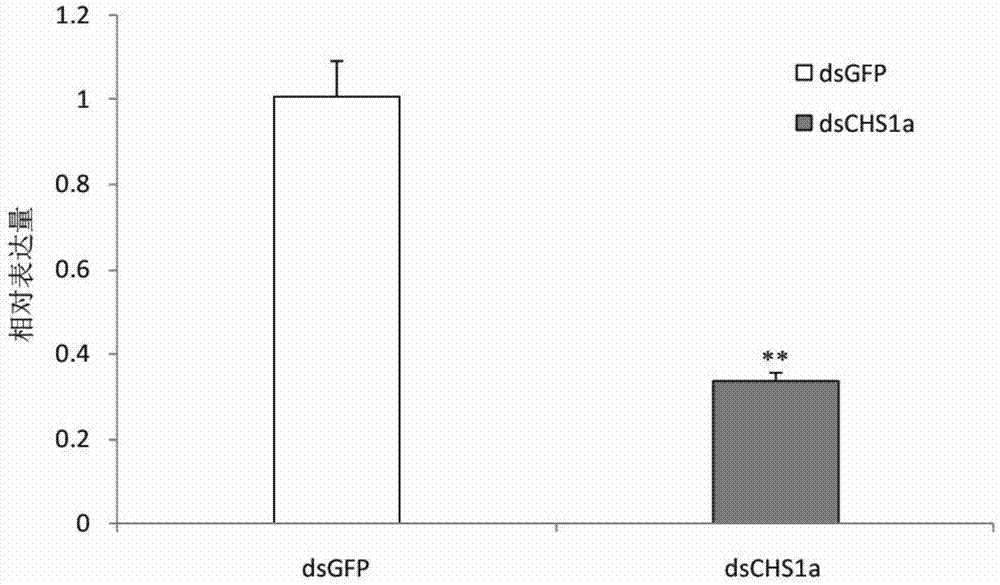
图1为5龄白背飞虱若虫注射sfchs1a基因的dsrna后的sfchs1a基因相对表达量。18srna为内参基因,dsgfp为对照组,dschs1a为实验组。
图2为5龄白背飞虱若虫注射sfchs1a基因的dsrna后的累积存活率。其中dsgfp为对照组,dschs1a为实验组。
具体实施方式
下面通过具体实施例对本发明作进一步说明,具体如下:
实施例:白背飞虱几丁质合成酶1a(sfchs1a)基因可变性剪切子及其dsrna
1.白背飞虱几丁质合成酶1a(sfchs1a)基因可变性剪切子的获得
1)基于genbank数据库中登录号为ky350143的白背飞虱几丁质合成酶1a的核苷酸序列,利用primerpremier6.0软件设计特异性的上游引物1seqidno:1和下游引物1seqidno:2,所有引物均由生工生物工程(上海)股份有限公司合成。
2)选取白背飞虱5龄若虫15头,置于1.5ml无rna酶的离心管中,经液氮冷冻后快速研磨成细粉,用trizol法进行总rna的提取,具体操作步骤参照trizol试剂盒说明书进行。然后按照sangon公司amvfirststrandcdnasynthesiskit试剂盒的说明书合成第一链cdna。
3)以上述合成的cdna为模板,利用上游引物seqidno:1和下游引物seqidno:2进行pcr扩增。pcr反应体系总体积为25μl,包括:上下游引物(10μm)各1μl,10×lapcrbuffer(mg2+plus)2.5μl,dntpmixture(2.5mm)4μl,cdna2μl,taq酶0.25μl和重蒸水14.25μl。pcr反应条件为:94℃预变性3min;94℃变性30s,50℃退火30s,72℃延伸30s,共30个循环;最后72℃延伸10min。
4)pcr产物在1%琼脂糖凝胶中电泳,于凝胶成像仪检测目的条带长度并初步判断是否为预期的目的条带。随后对目的条带切胶,通过
2.白背飞虱几丁质合成酶1a(sfchs1a)基因可变性剪切子的dsrna的合成
1)基于所获得的sfchs1a基因可变性剪切子序列seqidno:3,利用primerpremier6.0软件设计带有t7启动子的上游引物2seqidno:4和下游引物2seqidno:5,所有引物均由生工生物工程(上海)股份有限公司合成。
2)以上述合成的cdna作为模板,利用合成的dsrna引物进行pcr扩增。pcr反应体系总体积为25μl,包括:上下游引物(10μm)各1μl,10×lapcrbuffer(mg2+plus)2.5μl,dntpmixture(2.5mm)4μl,cdna2μl,taq酶0.25μl和重蒸水14.25μl。pcr反应条件为:94℃预变性3min;94℃变性30s,62℃退火30s,72℃延伸30s,共30个循环;最后72℃延伸10min。
3)取1lpcr产物在1%琼脂糖凝胶中电泳,于凝胶成像仪检测所得条带长度并初步判断是否为预期的目的条带,随后对pcr产物进行胶回收与纯化、克隆、菌液pcr验证并测序。
4)经测序验证无误后,取200μl测序菌液加入到20mllb液体培养基(含有氨苄青霉素)中,置于摇床37℃、220rpm震荡培养过夜。利用
5)以抽提的质粒为模板,采用megascript(rnaikit(thermo)试剂盒按照说明书体外转录合成并纯化得到白背飞虱sfchs1a基因可变性剪切子的dsrna。
6)取上述纯化的dsrna产物进行1%琼脂糖凝胶电泳检测其单一性,并用nanodrop2000spectrophotometer(thermofisher)检测其浓度。保存至-80℃冰箱备用。
实验例:白背飞虱几丁质合成酶1a(sfchs1a)基因可变性剪切子的dsrna致死实验
1.白背飞虱几丁质合成酶1a(sfchs1a)基因可变性剪切子的dsrna注射
选取5龄第一天大小均一、健康状况一致的若虫用于注射上述合成的dsrna。首先准备1%的琼脂糖平板,将白背飞虱在co2的处理下腹部向上固定在琼脂糖平板上,利用显微注射仪nanoliter2010injector(worldprecisioninstruments)进行注射,注射时要轻微操作,前胸和中胸相接的位置作为注射点。注射dsrna的量为100ng/头,并以注射dsgfp作为对照组,每组注射50头,设置3个生物学重复。注射完毕后,将试虫放入装有新鲜稻苗的试管中,置于温度(25±1)℃、相对湿度70%±5%、光周期16l:8d的人工气候箱中。
2.白背飞虱几丁质合成酶1a(sfchs1a)基因的沉默效率检测
基于上述注射试验,在注射dsrna或dsgfp72h后,每组收集存活的试虫10头,设置3个生物重复。提取总rna,并反转录为cdna,采用qpcr技术检测rnai后的目的基因表达情况。结果表明,在72h后,与注射dsgfp的对照组相比,白背飞虱注射sfchs1a的dsrna的实验组的相对表达量显著降低,而且降低高达66%左右。结果如图1所示。
3.注射dsrna后白背飞虱死亡情况的观察
5龄第一天若虫注射dsrna或dsgfp后,观察实验组与对照组的白背飞虱死亡情况。结果表明,注射5天后,注射dsrna的实验组白背飞虱死亡率高达90.7%,这与注射dsgfp的对照组(死亡率为8%)相比,致死效果明显。结果如图2所示。
4.注射dsrna后白背飞虱表型的观察
注射dsrna的实验组若虫共150头,42%个体在羽化前死亡,58%可以成功羽化,但其中的48.7%羽化后也相继死亡。
序列表
<110>凯里学院
<120>白背飞虱几丁质合成酶1a(sfchs1a)基因可变性剪切子及其dsrna在害虫防治中
的应用
<160>5
<170>siposequencelisting1.0
<210>1
<211>18
<212>dna
<213>白背飞虱(sogatallafurcifera)
<400>1
gaatagcgtcggatctca18
<210>2
<211>20
<212>dna
<213>白背飞虱(sogatallafurcifera)
<400>2
ctcttgggtaacatcatcat20
<210>3
<211>173
<212>dna
<213>白背飞虱(sogatallafurcifera)
<400>3
gaatagcgtcggatctcaaggagctacgaaactcttcggtgtttggtttcttcatgatca60
atgctctgtttgttatgatcgtgttcttgctccaactgaataaagacgtgttgcacgtca120
aatggccattcggagtgaagactaacatttcctatgatgatgttacccaagag173
<210>4
<211>38
<212>dna
<213>白背飞虱(sogatallafurcifera)
<400>4
taatacgactcactataggggaatagcgtcggatctca38
<210>5
<211>40
<212>dna
<213>白背飞虱(sogatallafurcifera)
<400>5
taatacgactcactatagggctcttgggtaacatcatcat40
- 还没有人留言评论。精彩留言会获得点赞!