一种抗CD47抗体及其应用的制作方法
本发明属于医学领域,具体涉及一种抗体或其抗原结合片段,该抗体或其抗原结合片段特异性识别人分化簇47(cd47),能够作为免疫活化物刺激机体的免疫反应,从而产生抗肿瘤等疾病的效果。
背景技术:
肿瘤是全球第二大导致人类死亡的病因。无论在发达国家还是在发展中国家,肿瘤导致的癌症都是死亡率最高的疾病,并且其死亡率和发病率仍不断增高。全球癌症疾病报告显示:过去十年里,全球癌症发病率升高了33%。仅2015年,就有1520万人被诊断为癌症,并有880万人因此死亡;发展中国家的癌症死亡率高于发达国家,患病人数占到全球的57%,死亡人数高达全球的65%,因此抗肿瘤药物市场的潜力十分巨大。
几乎所有肿瘤细胞都具有通过提高自身cd47蛋白表达,不但使其周围多种免疫细胞正常免疫杀伤功能受到抑制,而且表现出促进肿瘤组织扩增和转移的特性,这种特性能够导致患者病情进一步恶化。相关研究表明,阻断肿瘤细胞cd47相关的信号通路,能够解除肿瘤细胞对免疫细胞的抑制作用,从而激活肿瘤微环境中免疫细胞,尤其是巨噬细胞的杀伤功能,杀伤肿瘤细胞;活化的巨噬细胞通过吞噬靶细胞,发挥其抗原提呈的功能,特异性的活化t细胞,通过活化的t细胞发挥的细胞毒作用,进一步杀伤肿瘤细胞。
利用抗体结合细胞表面蛋白靶点治疗多种肿瘤和类风湿等免疫疾病已取得显著的效果;截至目前,经fda批准上市的相关药物已超过60种。相关研究已经证明,利用抗cd47单克隆抗体,在体内特异性结合肿瘤细胞表面高表达的cd47蛋白,能够有效解除肿瘤细胞对免疫细胞的抑制作用,重新恢复机体免疫细胞功能,达到抑制肿瘤生长的效果。
技术实现要素:
本发明的一个方面在于提供一种能够与cd47分子特异结合的抗cd47抗体或其抗原结合片段,所述抗cd47抗体或其抗原结合片段包含seqidno:3、seqidno:4和seqidno:5所示的重链cdrs;以及seqidno:6、seqidno:7和seqidno:8所示的轻链cdrs。
在本发明的实施方案中,所述抗cd47抗体或其抗原结合片段包含seqidno:1所示的重链可变区和seqidno:2所示的轻链可变区;或包含seqidno:9所示的重链可变区和seqidno:10所示的轻链可变区。
在本发明的实施方案中,所述抗cd47抗体包含seqidno:11所示的重链和seqidno:12所示的轻链。
在本发明的实施方案中,所述抗原结合片段选自fαb、fαb′、fαb′-sh、fv、scfv、f(αb′)2、双抗体和包含cdr的肽,所述抗cd47抗体或其抗原结合片段阻断cd47与sirpα的结合。
在一些实施方式中,所述抗cd47抗体或其抗原结合片段为鼠源或人源化抗cd47单克隆抗体。优选地,所述人源化的抗cd47抗体或其抗原结合片段包含人fc区,更优选为人igg4的fc区。
本发明的一个方面涉及多肽,其包含seqidno:9所示的序列,其中所述多肽是特异性结合cd47的抗体的一部分,并且所述抗体还包含seqidno:10所示的多肽。
本发明的一个方面涉及多肽,其包含seqidno:10所示的序列,其中所述多肽是特异性结合cd47的抗体的一部分,并且所述抗体还包含seqidno:9所示的多肽。
本发明的一个方面涉及多肽,其包含seqidno:1所示的序列,其中所述多肽是特异性结合cd47的抗体的一部分,并且所述抗体还包含seqidno:2所示的多肽。
本发明的一个方面涉及多肽,其包含seqidno:2所示的序列,其中所述多肽是特异性结合cd47的抗体的一部分,并且所述抗体还包含seqidno:1所示的多肽。
本发明的一个方面在于提供编码上述所述抗cd47抗体或其抗原结合片段或上述多肽的分离的多核苷酸。
在本发明的一个方面,涉及分离的多核苷酸,其编码seqidno:9所述的多肽,其中所述多肽是特异性结合cd47的抗体的一部分,并且所述抗体还包含seqidno:10所示的多肽。优选地,所述多核苷酸序列由seqidno:15表示。
在本发明一个方面,涉及分离的多核苷酸,其编码seqidno:10所述的多肽,其中所述多肽是特异性结合cd47的抗体的一部分,并且所述抗体还包含seqidno:9所示的多肽。优选地,所述多核苷酸序列由seqidno:16表示。
在本发明的一个方面,涉及分离的多核苷酸,其编码seqidno:1所述的多肽,其中所述多肽是特异性结合cd47的抗体的一部分,并且所述抗体还包含seqidno:2所示的多肽。优选地,所述多核苷酸序列由seqidno:13表示。
在本发明的一个方面,涉及分离的多核苷酸,其编码seqidno:2所述的多肽,其中所述多肽是特异性结合cd47的抗体的一部分,并且所述抗体还包含seqidno:1所示的多肽。优选地,所述多核苷酸序列由seqidno:14表示。
本发明的一个方面在于提供包含所述多核苷酸的表达载体。
本发明的一个方面在于提供包含上述表达载体的宿主细胞。
本发明的一个方面在于提供制备所述抗cd47抗体或其抗原结合片段的方法,所述方法包括:1)培养所述宿主细胞;2)从所述宿主细胞或培养基中回收多肽。
本发明的一个方面在于提供一种含有所述抗cd47抗体或其抗原结合片段的组合物或缀合物,优选地,所述缀合物进一步包含直接或通过合适长度的间隔物与多肽缀合的另外的分子,例如放射性同位素或放射性核素、毒素或细胞毒性基团,标记基团(标记的多肽),如荧光基团、酶基团、化学发光基团、生物素基团、金属颗粒等。
本发明的一个方面在于提供所述抗cd47抗体或其抗原结合片段在制备用于提高巨噬细胞杀伤水平的药物中的用途,优选所示药物用于治疗肿瘤,特别是癌症,优选所述癌症包括血液肿瘤和实体肿瘤,特别是淋巴瘤。
本发明提供的抗cd47抗体或其抗原片段能够特异性结合cd47分子,结合之后能够阻断cd47与sirpα的结合,并能够产生一系列生物学效应。这些生物学效应包括:能够激活肿瘤病例肿瘤浸润的巨噬细胞吞噬能力,特别是能够抑制小鼠体内肿瘤生长。
cd47作为“别吃我”信号,它通过与巨噬细胞表面的sirpα相互结合抑制巨噬细胞的吞噬作用。因为cd47-sirpα信号通路的存在,肿瘤相关巨噬细胞(tams)失去识别肿瘤细胞的功能,这一信号通路又被称为髓样细胞免疫检查点通路。当cd47与sirpα结合后,其胞内免疫受体酪氨酸抑制基序(itim)发生磷酸化后发生聚集反应,被与其自身相连的细胞溶质性蛋白酪氨酸磷酸酶(shp)激活,shp通过近端底物的去磷酸化,裂解免疫受体酪氨酸活化基序(itam)的磷酸基团,抑制吞噬信号和肌球蛋白轻链的骨架重排,进而导致吞噬细胞失去吞噬功能。肿瘤利用上述机制,细胞通过高表达cd47逃避巨噬细胞对其进行攻击。
而利用抗体特异性阻断cd47与sirpα的相互作用,能够活化处于抑制状态的tams,使得tams的免疫杀伤功能得到释放,恢复tams的功能,从而达到利用机体免疫系统杀伤肿瘤细胞进而进行肿瘤治疗的作用。
本发明基于上述原理,发现的抗cd47抗体或其抗原结合片段通过与cd47分子特异结合,阻断cd47与sirpα的结合,从而使巨噬细胞活化,杀伤肿瘤细胞。
本申请中,抗cd47抗体包括与cd47特异性结合的抗体或衍生物,也包括与原来的抗体显示实质上相同的抗原特异性的抗原结合片段。“抗原结合片段”是指抗体的抗原结合片段及抗体类似物,其通常包括至少部分母体抗体的抗原结合区或可变区,例如一个或多个cdr。抗原结合片段保留母体抗体的至少某些结合特异性。抗原结合片段包括选自fab、fab′、fab′-sh、fv、scfv、f(ab′)2、双抗体、包含cdr的肽等。
“fab片段”由一条轻链和一条重链的ch1及可变区组成。
“fc”区含有包含抗体的ch1和ch2结构域的两个重链片段。两个重链片段由两个或多个二硫键并通过ch3结构域的疏水作用保持在一起。
“fab′片段”含有一条轻链和包含vh结构域和ch1结构域以及ch1和ch2结构域之间区域的一条重链的部分,两个fab′片段的两条重链之间形成链间二硫键以形成f(ab′)2分子。
“f(ab′)2片段”含有两条轻链和两条包含ch1和ch2结构域之间的恒定区的部分的重链,由此在两条重链间形成链间二硫键。因此,f(ab′)2片段由通过两条重链间的二硫键保持在一起的两个fab′片段组成。
“fv区”包含来自重链和轻链二者的可变区,但缺少恒定区。
“单链fv抗体(scfv抗体)”是指包含抗体的vh和vl结构域的抗原结合片段,这些结构域存在于单个多肽链中。一般而言,fv多肽另外在vh和vl结构域之间包含多肽接头,该接头使得scfv能形成用于抗原结合的所需结构。
“双抗体”为具有两个抗原结合位点的小抗原结合片段。所述片段包含在相同的多肽链中与轻链可变结构域(vl)连接的重链可变结构域(vh)(vh-vl或vl-vh)。通过使用短至不能在同一链的两个结构域之间配对的接头,使得所述结构域与另一条链的互补结构域配对并形成两个抗原结合位点。
非人类(例如鼠)抗体的“人源化”形式为含有最小限度的来源于非人类免疫球蛋白序列的嵌合抗体。人源化抗体的大部分为人免疫球蛋白,其中受体抗体的高变区残基被具有所需特异性、亲和力和能力的非人类物种高变区的残基置换,非人类物种例如有小鼠、大鼠、兔或非人类灵长类。在某些情况下,人免疫球蛋白的fv构架区残基被相应的非人类残基取代。此外,人源化抗体可包含不在受体抗体或供体抗体中存在的残基。进行这些修饰以进一步改进抗体性能。
当提及配体/受体、抗体/抗原或其它结合对时,“特异性”结合是指在蛋白和/或其它生物试剂的异质群体中确定是否存在所述蛋白例如cd47的结合反应。因此,在所指定的条件下,特定的配体/抗原与特定的受体/抗体结合,并且并不以显著量与样品中存在的其它蛋白结合。
本发明还提供含有本发明抗cd47抗体或其抗原结合片段的药物组合物。为了制备药物组合物,可以通过使抗体或其抗原结合片段与可药用载体或赋形剂混合,制备成各种所需的剂型。作为本发明的医药组合物的剂型的种类,例如可以列举作为口服剂的片剂、粉末剂、丸剂、散剂、颗粒剂、细粒剂、软/硬胶囊剂、薄膜包衣剂、小丸剂、舌下片、膏剂等,作为非口服剂,可以列举注射剂、栓剂、经皮剂、软膏剂、硬膏剂、外用液剂等,本领域的技术人员能够根据给药途径和给药对象等选择适当的剂型。
本发明的药物组合物的有效成分的给药量,根据给药对象、对象脏器、症状、给药方法等不同而存在差异,可以考虑剂型的种类、给药方法、患者的年龄和体重、患者的症状等,根据医生的判断来确定。
本发明药物组合物还可以含有其它药剂,包括但不限于细胞毒剂、细胞生长抑制剂、抗血管形成药物或抗代谢药物、靶向肿瘤药物、免疫刺激剂或免疫调节剂或与细胞毒剂、细胞生长抑制剂或其它毒性药物结合的抗体。
附图说明
图1是表示cd47-ecto蛋白sds-page纯度检测结果的图。
图2是表示4c1抗体蛋白sds-page纯度检测结果的图。
图3是表示人源化4c1抗体蛋白的表达纯化及sds-page纯度检测结果的图。
图4是表示4c1抗体能够阻断cd47与sirpα的结合的图。
图5是表示4c1抗体能够体外活化小鼠巨噬细胞吞噬raji细胞的图。
图6是表示4c1抗体能够体外活化小鼠巨噬细胞吞噬的量化图。
图7是表示人源化4c1抗体结合cd47-ecto的elisa实验结果的图。
图8是表示spr检测4c1抗体及人源化4c1抗体结合cd47-ecto的亲和力的图。
图9是表示hu5f9抗体蛋白sds-page纯度检测结果的图。
图10是表示人源化4c1抗体在ncg小鼠体内抑制raji细胞生长活体成像的图。
图11是表示人源化4c1抗体在ncg小鼠体内抑制raji细胞生长活体成像检测数据的图。
具体实施方式
以下,通过实施例对本发明进行更具体的说明。但是,本领域技术人员可以理解的是,以下的实施例仅仅是为了说明本发明的目的,而非用于限制本发明。
实施例1.4c1抗体的制备
1.cd47-ecto重组表达质粒的构建
以genbank提供的序列为模板(cej95640.1),全基因合成人cd47胞外区(cd47-ecto)全长编码dna序列并且在3’端添加6his标签序列,通过5’端nsii和3’端xhoi双酶切位点克隆入表达载体pcaggs(addgene公司),建立cd47胞外全长蛋白的重组真核表达质粒,即cd47-ecto重组质粒dna。
2.cd47-ecto重组蛋白的表达与纯化
1)转染hek293t细胞(atcc:crl-11268):hek293t细胞以1∶3传至培养皿中继续培养;取7.5mldmem(gibco:11995500bt,无血清及抗生素)至50ml管中,加入300μl聚醚酰亚胺(pei)(polycience:23966)混匀;加入40μgcd47-ecto重组质粒dna至混匀液中,混匀并静置30分钟;分别取515μl至各培养皿中于37℃5%co2培养箱中培养。转染6小时后,更换无血清dmem培养基。
2)收获上清:转染72小时后,收集细胞培养上清,4℃离心,过滤。
3)histrap亲和层析柱纯化:将上清已1ml/min速度上样histrap亲和层析柱,完成上样后,用5个柱体积的20mmtris-hcl,150mmnaclph8.0平衡液冲洗层析柱;用5个柱体积的20mmtris-hcl,150mmnacl,0-500mm咪唑ph8.0洗脱液冲洗层析柱,收集洗脱峰。纯化后的cd47-ecto蛋白用聚丙烯酰胺凝胶电泳(sds-page)鉴定(图1)。
3.抗cd47单克隆抗体的制备与筛选
将上述纯化的cd47-ecto重组蛋白(以下简称为cd47抗原)用于balb/c小鼠(南京金斯瑞生物科技有限公司)免疫。具体方法如下:
1)动物免疫:经过纯化的cd47抗原以完全弗氏佐剂乳化,采用皮下或腹腔注射方法免疫6-8周龄balb/c小鼠,免疫剂量为50μg/只,间隔两周后进行第二次免疫,以不完全弗氏佐剂乳化,免疫剂量为50μg/只。免疫两次后取尾血以elisa法梯度稀释测定血清效价;根据结果确定是否加强免疫,选取抗体效价最高的小鼠进行细胞融合。
2)细胞融合:骨髓瘤细胞采用balb/c来源的sp2/0,融合时处于对数生长期;取已免疫小鼠脾脏,制成淋巴细胞单细胞悬液;小鼠脾淋巴细胞与骨髓瘤细胞以1∶5-1∶10混合,滴加37℃的50%peg(ph8.0)1ml,加入不完全培养基及其余终止液,离心弃上清后加入hat培养基悬浮混匀,mc定容到50ml,分装到3.5cm培养皿中,放于湿盒中,置于37℃、5%co2恒温培养箱中进行培养。
3)筛选和克隆:融合7-10天内挑选细胞克隆,使用纯化的cd47-ecto重组蛋白进行elisa测试,用ph7.4磷酸盐缓冲液4℃过夜包被每孔100ngcd47-ecto重组蛋白,弃去包被液后用含0.05%吐温20的磷酸盐缓冲液洗elisa板5次,每孔加入细胞克隆培养上清100ul,室温孵育1小时,弃去上清后用含0.05%吐温20的磷酸盐缓冲液洗elisa板5次,每孔加入1∶3000稀释辣根过氧化物酶标记的山羊抗鼠igg抗体(中杉金桥)100ul,室温孵育1小时,弃去二抗后用含0.05%吐温20的磷酸盐缓冲液洗elisa板5次,每孔加入50ulelisa显色液(天根)显色15分钟,每孔加入50ul2mh2so4终止反应,酶标仪读取od450数值。标记阳性细胞株号。对阳性孔细胞进行有限稀释,每次有限稀释后5-6天测定elisa值,挑取od280阳性值较高的单克隆孔进行有限稀释,直至elisa测定96孔板全板结果为阳性。挑取阳性值高的单克隆定株。其对应融合板细胞株为4c1。
4)细胞上清单抗的制备与纯化:将细胞株4c1用含15%血清的dmem培养基培养于10cm培养皿中培养,扩培至约4×107个时,800rpm/min离心5min,弃上清并将细胞转移到2l转瓶中,加入无血清培养基,使细胞密度约为3×105个/ml。继续培养1~2周后,当细胞死亡率达到60%-70%时(此时细胞密度大概为1-2×106个/ml),收取细胞悬液6000rpm/min高速离心20min,取上清,亲和层析法进行上清纯化,根据抗体压型选择相应柱料,单克隆抗体4c1型为igg1,采用proteing进行纯化。纯化后的单抗浓度测定、分装(100ul/管,浓度为1mg/ml)、保存在4-8℃。
4.鼠源抗体的表达纯化
将2×106的细胞株4c1细胞通过腹腔注射6-8周龄的balb/c小鼠(购自维通利华公司),2-3周后收取小鼠腹水,将获得的腹水先经过离心去沉淀后向其中加入等体积的20mmna3po4(ph7.0)混合均匀,再用0.22μm的滤膜过滤腹水,主要是防止腹水中的其它杂质对柱子造成损伤;过滤完成后准备上样纯化。
将proteing(5ml)hp亲和柱(ge公司)连接于aktapurifier/explorer/fplc/start(ge公司)上,在机器上操作下面的过程:先用水将柱中的20%乙醇冲出,再用20mmna3po4,ph7.0的缓冲液平衡柱子,待仪器上显示电导为4.5%后将上述腹水通过5mlloop环上样的方式注入与proteing结合,流速1ml/min;待uv平稳后,在随后的收集管中加入1m的trisph9.0约0.8ml(收集体积为3.2ml),然后在程序上改成100%的0.1mglyph3.0洗脱挂在柱子上的抗体,收集洗脱的样品,制样,凝胶电泳鉴定,判断胶图条带大小正确(图2);若上述鉴定无误,采用浓缩换液的方法,用pbs不断的稀释浓缩的抗体,反复浓缩稀释100倍以上后将样品分装,直接使用或保存于-80℃冰箱。
5.人源化4c1抗体表达纯化
人源化4c1抗体编码序列通过全基因合成方式(金维智)获得,在重链和轻链的5’端ecori和3’端xhoi添加酶切位点,通过双酶切将人源化抗体编码区序列克隆入pcaggs表达载体(addgene公司),利用构建编码seqidno.:11的多肽(编码其的多核苷酸为seqidno:17)和编码seqidno.:12的多肽(编码其的多核苷酸为seqidno:18)的多核苷酸的pcaggs表达载体共同转染293t细胞,表达的抗体经proteina(ge公司)亲和柱层析纯化。具体包括:
1)在转染前的14-16h将细胞密度较大的细胞分盘(如一盘100%铺满细胞的10cm培养皿以1∶3进行传代),14-16h后,细胞密度达到70%上即可进行转染。
2)以10cm培养皿转染贴壁293t细胞为例:转染所需的质粒的量为20μg/盘(轻链∶重链=1∶1,质量比),稀释到100μl/盘的hbs液中,混匀后静置;以pei(μl)∶质粒质量(μg)=1∶4的比例确定pei(1mg/ml)的用量,稀释到100μl/盘的hbs液中,混匀后静置。上述两溶液分别单独静置混合5min,之后将二者混合继续静置20min,最后加入到要转染的细胞培养液中。
3)转染4-6h后,给转染的细胞换液,先用2-3ml的pbs润洗两遍后再换成新鲜的无血清的dmem培养基(按1∶1000加入了青链霉素),在37℃恒温、5%co2的培养箱中培养表达。
将上述转染后的细胞培养液,在培养3天后收取上清,用dmem培养基换液,再到第七天再受一次上清。将2次收集的上清混合,纯化目的蛋白(图3),纯化方法使用本实施例上述步骤4中的proteing鼠源抗体纯化方法。
实施例2.cd47阻断抗体筛选及亲和力分析
通过293t细胞体外表达的cd47-ecto蛋白进行小鼠免疫,获得的单克隆抗体进行cd47与sirpα的阻断实验筛选能够特异性阻断cd47与sirpα相互作用的抗体。
1.sirpα全长表达293t细胞制备
在本实施例中,通过在sirpα全长(seqidno:20)5’端hindiii和3’端bamhi的双酶切位点克隆到pegfp-n1载体-gfp标签质粒(clontech公司),获得带有gfp标签的siprα质粒(sirpα-gfp-p),并转染293t细胞(atcc),获得表达sirpα全长的293t细胞。转染前1天按照0.5~2×105细胞每孔接种于24孔培养板,并加入500μl不含抗生素的dmem完全培养基(gibco公司),以保证转染时细胞汇合达70~80%。1μgsirpα-gfp-p质粒稀释于50μl不含血清和抗生素的培养基中,轻轻混匀。将2μlpei(4mg/ml)稀释于50μl不含血清和抗生素的培养基中,轻轻混匀。5分钟后,将50μlpei稀释液滴加到50μldna稀释液中,轻轻混匀,室温孵育20分钟。将100μlpei/dna复合物滴加到每孔中并轻轻摇动使其与新鲜的培养基均匀混合。将细胞放入培养箱孵育4~6h后,更换含血清培养液去除复合物。将细胞放置在37℃,co2孵箱继续孵育24小时后,通过流式细胞分析仪(bdcalibur)检测gfp表达水平,评价sirpα全长表达293t细胞的表达水平。
2.抗体阻断实验
将4c1抗体和cd47-ecto蛋白(实施例1获得)按照摩尔比10∶1的比例混合后置冰上孵育1小时,之后加入到含2×105的sirpα全长表达293t细胞中,置冰上孵育30分钟。设置小鼠无关同型igg(中国科学院微生物研究所)抗体为阴性对照;之后pbs清洗两次,加入apc标记的抗鼠igg二抗(bd:550874),孵育30分钟后用pbs缓冲液清洗两次,最终用300mlpbs溶液重悬后进行流式细胞分析。结果如图4所示,结果表明,cd47-ecto能够显著结合到sirpα全长表达的293t细胞上,而加入4c1抗体后能够完全抑制cd47与sirpα的结合,从而使得cd47-ecto不能结合到293t细胞表面的sirpα蛋白上。因此,4c1抗体能够在细胞水平显著抑制cd47与sirpα的结合。
实施例3.cd47阻断抗体对巨噬细胞的体外活化能力
cd47阻断抗体的重要应用是其抗肿瘤作用。因为人cd47可以和鼠的sirpα受体结合,发挥生物学功能,所以本实施例利用人burkitt淋巴瘤细胞raji(atcc:ccl-86)如下制备的小鼠原代巨噬细胞作为模型,使用4c1抗体阻断raji细胞表面cd47与小鼠巨噬细胞表面的sirpα受体结合,激活小鼠巨噬细胞的吞噬功能,进而吞噬raji细胞,评价本发明筛选的cd47阻断抗体体外细胞水平的抗肿瘤能力。
1.小鼠原代巨噬细胞制备
(1)复温rpmi1640(gibco公司)培养液(预添加m-csf)至37摄氏度。
(2)处死小鼠,喷洒70%乙醇溶液消毒。拉扯双侧后腿直至听到清脆响声(提示股骨从髋骨脱臼)。
(3)使用干净的剪刀、镊子沿一侧大腿环形剪开皮肤,向爪子方向剥离皮肤。
(4)用镊子将腿部肌肉分开,露出股骨和胫骨(注意不要损伤骨头)。
(5)切断股骨与髋骨间的韧带,切下膝关节以下的骨头。将股骨和胫骨至于冰冷的盐溶液中。
(6)同法处理另一只腿。
(7)用低绒纸巾小心剥除骨骼上附着的组织,将骨头置入70%乙醇溶液中。
(8)20ml无菌注射器吸满预热的培养液,装上27g针头。并准备好50ml离心管。
(9)从膝关节处分离股骨和胫骨,丢弃膝盖骨。一个无菌镊夹住股骨,用一把无菌剪刀剪掉股骨上端。将针头插入骨髓腔,用培养液反复冲洗,将骨髓冲入50ml离心管。冲洗过程中,上下移动针头刮扫骨髓腔。每根骨头使用大约5ml培养液。丢弃骨头。
(10)同法处理胫骨(剪掉上下两端)。
(11)将细胞悬液离心(150g,5分钟)。丢弃上清,加入rpmi1640(gibco公司)培养液(添加m-csf)。混匀细胞悬液。
(12)每根骨头准备两个100mm培养皿。将细胞悬液打入培养皿,添加预热rpmi1640(gibco公司)培养液(添加m-csf)至10ml。
(13)置于37℃、5%二氧化碳培养箱内培养5天。
(14)第5天,使用室温盐溶液5ml冲洗培养皿(巨噬细胞为贴壁生长)。使用细胞刮刀刮下贴壁细胞,转移入离心管,150g离心5分钟。关于m-csf的工作浓度:介于1ng/ml到1μg/ml之间。
2.raji细胞csfe标记
(1)用1mlcfdase细胞标记液(beyotime:c0051)重悬100万至500万raji(atcc:ccl-86)细胞,置于15ml离心管内。
(2)用cfdase细胞标记液稀释cfdase储存液(1000x)至2x。例如取2微升cfdase储存液(1000x)至1mlcfdase细胞标记液中,混匀后即为cfdase储存液(2x)。
(3)把1mlcfdase储存液(2x)加入到步骤2.(1)中含有1ml待标记细胞的15ml离心管内,轻轻混匀。
(4)37℃孵育10分钟。
(5)立即在15ml离心管内加入约10ml完全细胞培养液(含10%血清),室温颠倒数下混匀。
(6)室温离心去上清,再用5-10ml完全细胞培养液洗涤一次。
(7)再加入5-10ml完全细胞培养液,37℃孵育5分钟,以促进cfdase在细胞内的驻留及未反应的cfdase进入完全细胞培养液。离心去上清,完成最后一次洗涤。
(8)随后即可按照细胞的正常培养方法进行培养。可以在荧光显微镜下直接观察标记效果,也可以在培养适当时间后用流式细胞仪检测细胞增殖,或用于特定目的的细胞示踪。标记的细胞也可以用于活体动物的移植,并用荧光进行示踪。标记的细胞呈绿色荧光。
3.巨噬细胞体外培养激活
(1)每孔巨噬细胞中加入10倍量cfdase标记的肿瘤细胞raji,同时加入终浓度为10μg/ml4c1抗体或无关同型igg抗体(中国科学院微生物研究所)阴性抗体,37℃培养箱中孵育2小时。
(2)吸去上清,用pbs洗细胞3次,每孔细胞中加入edta溶液1ml,37℃培养箱中孵育15分钟。
(3)吸去上清,用pbs洗细胞3次,每孔细胞中加入2.5%胰酶溶液1ml,37℃培养箱中孵育15分钟。
(4)每孔细胞中加入2ml含10%血清的1640培养基终止消化。
(5)1000rpm/min离心5分钟,弃去上清,用pbs洗涤细胞一次。
(6)每个细胞样品,加入1∶100稀释apcanti-f4/80抗体(sungene:m110f1),室温避光孵育30分钟。
(7)1000rpm/min离心5分钟,弃去上清,用pbs洗涤细胞三次。
(8)用200μlpbs重悬细胞,转移至流式管中。
(9)进行流式细胞术检测。
4.结果分析
图5中q1象限代表小鼠原代巨噬细胞,q2象限代表小鼠原代巨噬细胞吞噬csfe标记raji细胞后形成的双阳性细胞,q3象限代表csfe标记后的raji细胞,q4象限代表未染色的小鼠原代巨噬细胞和raji细胞。通过对图5中q2象限细胞数比较,阴性对照无关同型igg抗体处理组样品中q2象限双阳性细胞群明显低于4c1处理组;进一步将数据处理后的图6同样证明4c1抗体能够在体外培养条件下有效活化小鼠巨噬细胞的吞噬能力,进而吞噬raji细胞。
实施例4.4c1抗体的人源化及体外重组表达和亲和力初步验证
根据4c1抗体的序列同源性,本发明在保留两个抗体的cdr区基础之上,通过替换人源抗体骨架,获得人源化4c1抗体(h4c1)。
seqidno.:1:4c1鼠源抗体vhchain
seqidno.:2:4c1鼠源抗体vlchain
seqidno.:3:4c1hchaincdr1
seqidno.:4:4c1hchaincdr2
seqidno.:5:4c1hchaincdr3
seqidno.:6:4c1lchaincdr1
seqidno.:7:4c1lchaincdr2
seqidno.:8:4c1lchaincdr3
seqidno.:9:人源化4c1vhchain
seqidno.:10:人源化4c1vlchain
seqidno:11:人源化抗cd47抗体的重链
seqidno:12:人源化抗cd47抗体的轻链
seqidno:13:鼠源抗cd47抗体的vh的编码序列
seqidno:14:鼠源抗cd47抗体的vl的编码序列
seqidno:15:人源化抗cd47抗体的vh的编码序列
seqidno:16:人源化抗cd47抗体的vl的编码序列
seqidno:17:人源化抗cd47抗体的h链的编码序列
seqidno:18:人源化抗cd47抗体的l链的编码序列
seqidno:19:igg4的fc区
本实施例利用实施例1构建的人源化4c1抗体表达克隆,通过瞬时转染293t细胞表达人源化4c1抗体,通过proteina凝胶柱(ge公司)对表达的抗体进行亲和层析。经proteina柱子亲和层析后的抗体纯度达到95%以上(如图3)。通过对表达纯化的人源化4c1抗体进行elisa检测,对其结合cd47-ecto的水平进行初步评价,以4c1鼠源抗体作为阳性对照,无关同型igg抗体(中国科学院微生物研究所)作为阴性对照。结果表明4c1抗体和人源化4c1抗体结合cd47蛋白的od450吸收值在同等水平,提示人源化4c1抗体与cd47-ecto的亲和力接近4c1鼠源抗体(如图7)。
实施例5.4c1抗体及人源化4c1抗体的亲和力验证
本实施例中,通过表面等离子共振技术(spr)对4c1抗体以及人源化4c1抗体进行亲和力鉴定。
将cd47-ecto蛋白、4c1抗体以及人源化4c1抗体换液至spr缓冲液中(10mmhepes-hcl、150mmna-cl、0.005%tween-20、ph7.4)。将cd47-ecto蛋白稀释到20μg/ml固定到cm5芯片(ge公司)上,之后将梯度稀释的抗体分别流过cm5芯片各通道,利用biaevaluation软件(ge公司)分析结合动力学参数,并计算亲和力常数(kd)。
结果表明,4c1抗体与真核293t细胞表达的cd47-ecto亲和力为8.69×10-10m。通过对人源化后的4c1抗体与cd47-ecto亲和力的检测,结果表明,h4c1抗体与cd47-ecto的亲和力为6.64×10-10m。从spr结果可以看出,人源化4c1抗体仍保持10-10m数量级的亲和力(如图8)。
实施例6.人源化4c1抗体抑制ncg免疫缺陷鼠raji肿瘤实验
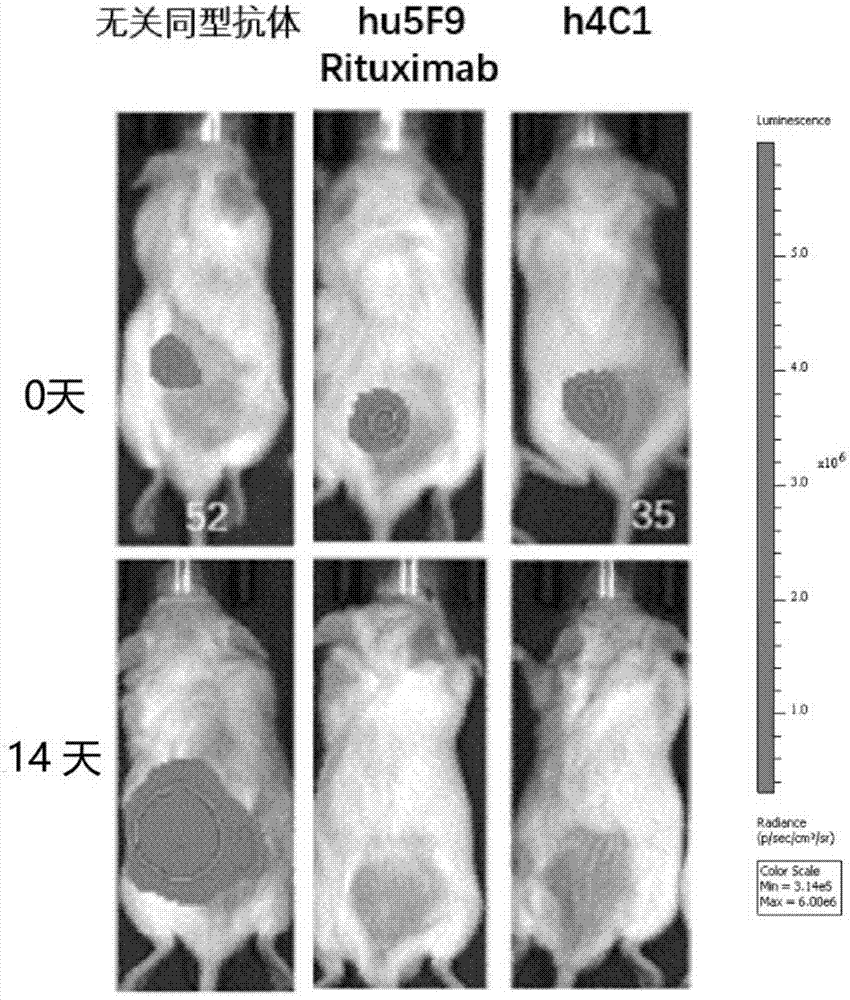
本实施例应用的对照hu5f9抗体制备
hu5f9抗体氨基酸序列及应用来源于专利us9017675b2和文献jieliu等pre-clinicaldevelopmentofahumanizedanti-cd47antibodywithanti-cancertherapeuticpotential,plosone.2015sep21;10(9):e0137345。通过全基因合成方式(金维智)获得hu5f9抗体编码重链序列(seqidno:21)和轻链序列(seqidno:22),在重链和轻链的5’端ecori和3’端xhoi添加酶切位点,通过双酶切将hu5f9抗体编码区序列克隆入pcaggs表达载体(addgene公司),通过瞬时转染293t细胞表达hu5f9抗体,通过proteina凝胶柱(ge公司)对表达的抗体进行亲和层析。经proteina柱子亲和层析后的抗体纯度达到95%以上(如图9)。本实施例应用ncg免疫缺陷小鼠(南京大学模式动物研究所)进行人源化4c1抗体体内抑制raji肿瘤生长能力评价。raji细胞为用luciferase试剂盒标记后的raji-luciferase(中乔新舟)。
4c1抗体的ncg小鼠肿瘤抑制实验步骤包括:
1.raji-luciferase细胞系在ncg小鼠皮下成瘤
a)接种raji-luciferase细胞数量:3×106cell/200μl/只;
b)接种部位:背部皮下;
2.分组及处理:
hu5f9为一种人源化cd47阻断抗体;rituximab为罗氏制药销售的针对cd20靶点的肿瘤治疗抗体药物;根据jieliu等文献报道,联合使用以上两种抗体,能够有效抑制raji细胞在ncg小鼠体内生长;所以把这两种药物联合使用作为本实例的阳性对照。
肿瘤细胞注射后约1周后,利用小动物活体成像ivis对raji-luciferase在ncg小鼠皮下成瘤情况进行检测,根据成像情况分组,之后进行抗体腹腔注射。本实施例以无关同型igg抗体(中国科学院微生物研究所)注射组为阴性对照,hu5f9(如上所述生产)和rituximab抗体(roche)联合给药作为阳性对照,h4c1抗体为处理组进行平行实验,每组5只小鼠。
抗体注射:小鼠成瘤后(7天),每天腹腔注射抗体,连续注射14天(均为200μg/只,阳性对照组为各200μg/只)。
开始注射后,每7天进行一次活体成像检测,评价治疗效果。
4.治疗效果观察:
结果表明,注射无关同型igg抗体的对照组小鼠皮下肿瘤均快速生长;hu5f9和rituximab抗体联合给药注射后肿瘤生长控制良好,肿瘤体积明显减小;h4c1抗体注射组在抗体注射后肿瘤生长迅速得到抑制,肿瘤体积明显减小。本实施例结果表明,h4c1抗体能够有效抑制肿瘤生长,具有潜在的肿瘤治疗价值(如图10、11)。
- 还没有人留言评论。精彩留言会获得点赞!