瞬时过表达编码药物转运蛋白和/或药物代谢酶的基因的可消耗的低温保存的细胞的制作方法
本发明涉及低温保存的重组细胞,所述重组细胞瞬时过表达一种或多种编码药物转运蛋白和/或药物代谢酶的基因以使得所编码的蛋白的活性在从低温保存中解冻后的所述细胞群体中是可检测的。
发明背景
药物开发是昂贵且耗时的尝试,其中药物候选物在获得销售其的监管许可之前必须满足由政府部门例如美国食品和药物管理局和欧洲药品管理局制定的一定标准。重要地,进行了测定来筛选药物候选物以确定是否某些是一种或多种药物转运蛋白和/或药物代谢酶的底物或抑制剂,因为其可对这样的药物的吸收、分布、代谢和消除、它们的毒性以及药物间相互作用具有显著的作用。
虽然稳定表达编码药物转运蛋白或药物代谢酶的基因的细胞系可用于这样的筛选,但产生和维持其冷冻储备物需要大量的时间和资源。并且,所表达的重组蛋白的水平通常是可变的(实验室与实验室之间)并且可在这些细胞的传代下随时间过去而降低和/或变得更加可变。可选择地,可将稳定或瞬时表达编码药物转运蛋白或药物代谢酶的基因的、新鲜平板接种的细胞用于这样的筛选。然而,新鲜平板接种的细胞具有有限的几天的保存期限并且难以以维持其活力的方式进行运送。此外,为了产生稳定细胞系,外来转染的基因实际上被整合至细胞的宿主基因组中并与宿主基因组在细胞分裂周期期间保持在一起。宿主细胞中的染色体整合将导致宿主基因组的永久修饰,这潜在地导致其它基因的异常表达从而引起宿主行为的非期望的改变和不可靠的实验结果。因此,需要减少与药物开发相关的时间和资源投入并且提供可靠结果的、适合用于筛选药物候选物的细胞。
发明概述
本发明提供低温保存的重组细胞,其适合用于筛选药物候选物以确定是否某些是一种或多种药物转运蛋白和/或药物代谢酶的底物或抑制剂,其提供可靠的结果和现成的方便性。期望地,低温保存后的重组细胞群中的活性水平与新鲜转染的细胞的活性水平是相当的。此外,容易将低温保存的重组细胞装入小瓶中并利用干冰或干式运输(dryshipper)进行运送,且在接收后方便地储存在-135℃液氮中,具有数年的保存期限。因此,这样的细胞为最终用户提供了可消耗的“解冻和使用”产品,其提供进行实验的便利并减少产生和/或维持用于筛选药物候选物的细胞储备物的时间和资源的投入。
在一个方面,本发明提供了包含一种或多种瞬时过表达基因的低温保存的重组细胞,所述基因编码选自药物转运蛋白和药物代谢酶或其组合的蛋白,其中所述药物转运蛋白或药物代谢酶或组合的活性在从低温保存中解冻后的所述低温保存的重组细胞群体中是可检测的。
在另一个方面,本发明提供了制备瞬时转染的重组细胞的方法,所述重组细胞瞬时过表达一种或多种编码选自药物转运蛋白和药物代谢酶或其组合的蛋白的基因,所述方法包括用一种或多种编码药物转运蛋白或药物代谢酶的基因瞬时转染细胞和在转染的48小时内低温保存瞬时转染的重组细胞。
本发明的这些和其它特征将通过研究下文的详细描述而被更好地理解。
附图概述
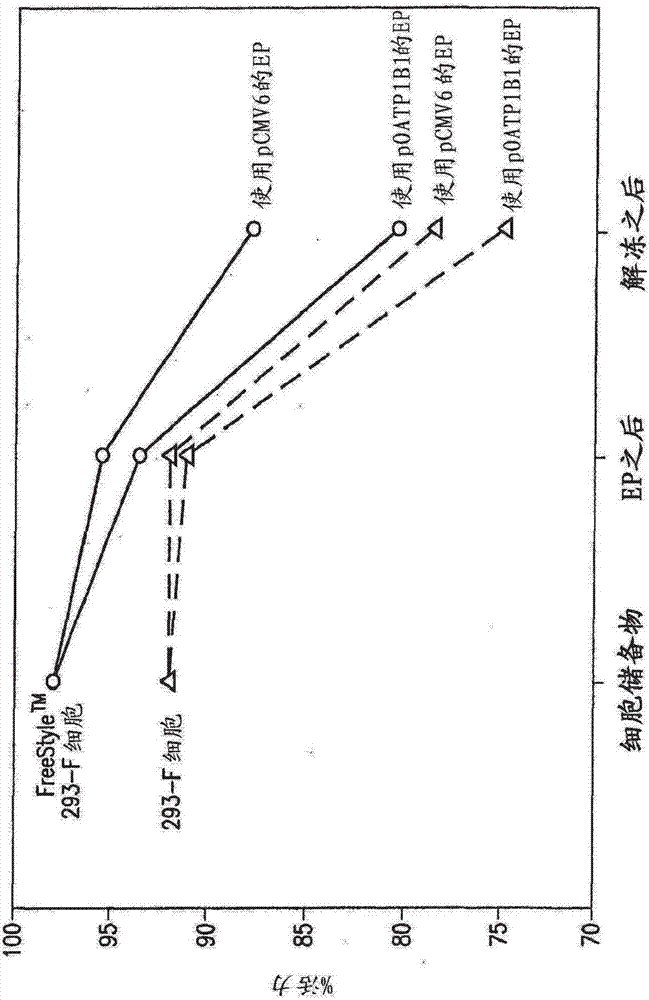
图1是针对悬浮生长的freestyletm293-f(fs293)细胞和293-f细胞的来自细胞储备物、电穿孔(ep)后的细胞和从低温保存中解冻后的细胞的活细胞百分比图。
图2是从低温保存中解冻后的平板接种之后4小时(a)、24小时(b)和48hrs(c),转染的细胞的图像。
图3是以(a)0.4x106个活细胞/孔和(b)0.2x106个活细胞/孔,平板接种于24孔聚-d-赖氨酸涂覆的平板中并在平板接种培养基中培养的、用poatp1b1表达质粒转染的293-f细胞在平板接种(从低温保存中解冻后)后24小时的图像。
图4是以0.4x106个活细胞/孔平板接种于24孔聚-d-赖氨酸涂覆的平板中的,用mate1、mate2koatp1b3、长同种型oat1(具有563个氨基酸的全长cdna;在本文中被称作“长oat1”)、短同种型oat1(缺失c-末端522-534上的13个氨基酸,具有550个氨基酸;在本文中被称作“短oat1”)、oat3和pcmv载体转染的293-f细胞在平板接种(从低温保存中解冻后)后24小时的图像。
图5是用50μg/ml、100μg/ml或200μg/ml绿色荧光蛋白(gfp)转染的贴壁hek293细胞在ep后24小时(a)和48小时(b)的荧光图像。
图6是使用不同量dna对贴壁hek293细胞进行ep后的活细胞百分比图。
图7a是在ep后48小时,用不同量的dna(即0、50μg/ml、100μg/ml、200μg/ml或400μg/ml的oatp2/oatp1b1)转染的贴壁hek293细胞中,在不同的温育时间后的雌二醇-17β-葡糖苷酸(e17βg)吸收活性的图。
图7b是在ep后96小时,用不同量的dna(即0、50μg/ml、100μg/ml、200μg/ml或400μg/ml的oatp2/oatp1b1)转染的贴壁hek293细胞中,在不同的温育时间后的雌二醇-17β-葡糖苷酸(e17βg)吸收活性的图。
图8是在ep后48小时,用不同量的dna(即0、50μg/ml、100μg/ml、200μg/ml或400μg/ml的oatp2/oatp1b1)转染的贴壁hek293细胞中,在不同的温育时间后的雌二醇-17β-葡糖苷酸(e17βg)吸收的信噪比图。
图9是使用小规模ep设备(oc400)用oatp2/oatp1b1、使用大规模ep设备(cl2)用oatp2/oatp1b1或用空载体对照转染的贴壁hek293细胞中,雌二醇-17β-葡糖苷酸(e17βg)吸收活性的图。
图10是使用“对照”(即传统的脂质转染试剂(lipofectamine2000,可获自invitrogen))或stx、maxcyte可扩展ep设备用oatp1b1基因转染的贴壁hek293细胞中,在不同的温育时间后的雌二醇-17β-葡糖苷酸(e17βg)吸收的信噪比的图。
图11是用oatp1b1转染的贴壁hek293细胞中,在不同的温育时间后的雌二醇-17β-葡糖苷酸(e17βg)吸收的信噪比的图,其中所述细胞是新鲜平板接种的或是从低温保存中解冻后平板接种的。
图12是使用maxcyte可扩展ep设备和按比例放大过程用oatp1b1*1a(基因登录号nm_006446.4)、oatp1b1*1b(基因登录号nm_006446.3)、oatp1b3、pcmv载体、长同种型oat1(具有563个氨基酸的全长cdna)、oat3、oct1或oct2转染的hek293细胞在低温保存、解冻、平板接种于聚-d-赖氨酸平板上和在平板接种后温育24小时后的图像。
图13a是描述在用3μm浓度的pah温育不同的时间(即1、2、5、10和15分钟)后,过表达oat1或pcmv载体的hek293细胞中p-氨基马尿酸盐(pah)(oat1的原型底物)吸收的时间依赖性测定的结果的图。
图13b是描述其中测量在温育5分钟后,过表达oat1的hek293细胞对浓度为3至200μm的pah的吸收的动力学测定的结果的图。使用sigma-plot计算的km和vmax在图中显示为插注。
图13c是描述其中使用15μm浓度的pah和0-300μm浓度的丙磺舒(oat1抑制剂)温育过表达oat1的hek293细胞5分钟的抑制测定的结果的图。使用sigma-plot计算的ic50在图中显示为插注。
图14a是描述在用1μm浓度的e3s温育不同的时间(即1、2、5、10和15分钟)后,过表达oat3或pcmv载体的hek293细胞中雌酮-3-硫酸盐(e3s)(oat3的原型底物)吸收的时间依赖性测定的结果的图。
图14b是描述其中测量在温育1分钟后,过表达oat3的hek293细胞对浓度为0.5至32μm的e3s的吸收的动力学测定的结果的图。使用sigma-plot计算的km和vmax在图中显示为插注。
图14c是描述其中使用4μm浓度的e3s和0-300μm浓度的丙磺舒(oat3抑制剂)温育过表达oat3的hek293细胞5分钟的抑制测定的结果的图。使用sigma-plot计算的ic50在图中显示为插注。
图15a是描述在用31μm浓度的tea温育不同的时间(即1、2、5、10和15分钟)后,过表达oct1或pcmv载体的hek293细胞中tea(oct1的原型底物)吸收的时间依赖性测定的结果的图。
图15b是描述在用3.8μm浓度的甲福明温育不同的时间(即1、2、5、10和15分钟)后,过表达oct1或pcmv载体的hek293细胞中甲福明(oct1的原型底物)吸收的时间依赖性测定的结果的图。
图15c是描述其中测量在温育10分钟后,过表达oct1或pcmv载体的hek293细胞对浓度为1、10和100μm的tea的吸收的浓度依赖性测定的结果的图。
图15d是描述其中测量在温育10分钟后,过表达oct1或pcmv载体的hek293细胞对浓度为0.1、1和10μm的甲福明的吸收的浓度依赖性测定的结果的图。
图15e是描述其中使用tea和不同浓度(0.1-500μm)的oct1抑制剂(奎那定、异搏定或decynium-22)温育过表达oct1的hek293细胞10分钟的抑制测定的结果的图。
图15f是描述其中使用3.8μm浓度的甲福明和不同浓度(4μm-3mm)的oct1抑制剂西咪替丁温育过表达oct1的hek293细胞10分钟的抑制测定的结果的图。
图16a是描述在用31μm浓度的tea温育不同的时间(即1、2、5、10和15分钟)后,过表达oct2或pcmv载体的hek293细胞中tea(oct2的原型底物)吸收的时间依赖性测定的结果的图。
图16b是描述在用3.8μm浓度的甲福明温育不同的时间(即1、2、5、10和15分钟)后,过表达oct2或pcmv载体的hek293细胞中甲福明(oct2的原型底物)吸收的时间依赖性测定的结果的图。
图16c是描述其中测量在温育10分钟后,过表达oct2或pcmv载体的hek293细胞对浓度为1、10和100μm的tea的吸收的浓度依赖性测定的结果的图。
图16d是描述其中测量在温育10分钟后,过表达oct2或pcmv载体的hek293细胞对浓度为0.1、1和10μm的甲福明的吸收的浓度依赖性测定的结果的图。
图16e是描述其中使用3.8μm浓度的甲福明和4μm-3mm浓度的oct2抑制剂西咪替丁温育过表达oct2的hek293细胞10分钟的抑制测定的结果的图。使用sigma-plot计算的ic50在图中显示为插注。
图17a是描述在用1μm浓度的e17βg温育不同的时间(即1、2、5、10和15分钟)后,过表达oatp1b1*1a或pcmv载体的hek293细胞中雌二醇-17β-葡糖苷酸(e17βg)吸收的时间依赖性测定的结果的图。
图17b是描述在用1μm浓度的e3s温育不同的时间(即1、2、5、10和15分钟)后,过表达oatp1b1*1a或pcmv载体的hek293细胞中雌酮-3-硫酸盐(e3s)吸收的时间依赖性测定的结果的图。
图17c是描述在用1μm浓度的罗苏伐他汀温育不同的时间(即1、2、5、10和15分钟)后,过表达oatp1b1*1a或pcmv载体的hek293细胞中罗苏伐他汀吸收的时间依赖性测定的结果的图。
图17d是描述其中测量在温育1分钟后,过表达oatp1b1*1a的hek293细胞对浓度为0.25-40μm的e17βg的吸收的浓度依赖性测定的结果的图。使用sigma-plot计算的km和vmax在图中显示为插注。
图17e是描述其中测量在温育5分钟后,过表达oatp1b1*1a的hek293细胞对浓度为0.78-50μm的罗苏伐他汀的吸收的浓度依赖性测定的结果的图。使用sigma-plot计算的km和vmax在图中显示为插注。
图17f是描述其中测量在使用0.04-30μm浓度的抑制剂环孢菌素a温育5分钟后,过表达oatp1b1*1a的hek293细胞对1μm浓度的e17βg的吸收的抑制测定的结果的图。使用sigma-plot计算的ic50在图中显示为插注。
图18a是描述在用1μm浓度的e17βg温育不同的时间(即1、2、5、10和15分钟)后,过表达oatp1b1*1b或pcmv载体的hek293细胞中e17βg吸收的时间依赖性测定的结果的图。
图18b是描述在用1μm浓度的e3s温育不同的时间(即1、2、5、10和15分钟)后,过表达oatp1b1*1b或pcmv载体的hek293细胞中e3s吸收的时间依赖性测定的结果的图。
图18c是描述在用1μm浓度的罗苏伐他汀温育不同的时间(即1、2、5、10和15分钟)后,过表达oatp1b1*1b或pcmv载体的hek293细胞中罗苏伐他汀吸收的时间依赖性测定的结果的图。
图18d是描述其中测量在温育1分钟后,过表达oatp1b1*1b的hek293细胞对浓度为0.25-40μm的e17βg的吸收的浓度依赖性测定的结果的图。使用sigma-plot计算的km和vmax在图中显示为插注。
图18e是描述其中测量在使用0.04-30μm浓度的抑制剂环孢菌素a温育5分钟后,过表达oatp1b1*1b的hek293细胞对浓度为1μm的e17βg的吸收的抑制测定的结果的图。使用sigma-plot计算的ic50在图中显示为插注。
图19a是描述在用1μm浓度的cck-8温育不同的时间(即1、2、5、10和15分钟)后,过表达oatp1b3或pcmv载体的hek293细胞中缩胆囊肽(cck-8)吸收的时间依赖性测定的结果的图。
图19b是描述在用1μm浓度的e17βg温育不同的时间(即1、2、5、10和15分钟)后,过表达oatp1b3或pcmv载体的hek293细胞中e17βg吸收的时间依赖性测定的结果的图。
图19c是描述其中测量在温育1分钟后,过表达oatp1b3的hek293细胞对浓度为0.5-20μm的cck-8的吸收的浓度依赖性测定的结果的图。使用sigma-plot计算的km和vmax在图中显示为插注。
图19d是描述其中测量在温育5分钟后,过表达oatp1b3的hek293细胞对浓度为0.78-50μm的罗苏伐他汀的吸收的浓度依赖性测定的结果的图。使用sigma-plot计算的km和vmax在图中显示为插注。
图19e是描述其中测量在使用0.04-30μm浓度的抑制剂环孢菌素a温育2分钟后,过表达oatp1b3的hek293细胞对浓度为1μm的cck-8的吸收的抑制测定的结果的图。使用sigma-plot计算的ic50在图中显示为插注。
发明详述
如本文中所用的下列术语应当具有示于下文的定义。
如本文中所用,术语“细胞”包括原代细胞以及所建立的细胞系(例如,人胚肾hek293细胞、中国仓鼠卵巢cho、madin-darby犬肾细胞mdck、猪肾上皮细胞llc-pk1、人上皮结直肠腺癌细胞caco-2和中国仓鼠肺成纤维细胞v79细胞)。
如本文中所用,术语“药物转运蛋白”是指膜结合转运蛋白,其包括但不限于atp结合框(abc)转运蛋白和溶质运载体(slc)转运蛋白。
如本文中所用,术语“药物代谢酶”包括但不限于:细胞色素例如细胞色素(cyp)p450;udp-葡萄糖醛酸基转移酶和其它的非cyp药物代谢酶例如醇脱氢酶、单胺氧化酶和醛氧化酶。
如本文中所用,术语“可检测的”意指用药物转运蛋白和/或药物代谢酶转染的细胞中,所选择的探针底物的活性应当比用空载体转染的细胞中的相同的探针底物的活性更高;期望地,活性的差异将为至少5倍。
如本文中所用,转运蛋白命名中大写字母的使用标识人蛋白/基因,即mrp2/abcc2等;小写字母表示转运蛋白来源于临床前(非人哺乳动物)物种,即mrp2/abcc2等。除非另有指明,否则基因来源于任何物种(例如人或其它哺乳动物)。
如本文中所用,术语“oatp1b1”、“oatp2”和“slco1b1”是可互换使用的并且是指对应于非人蛋白/基因oatp2的人蛋白/基因。除非另有指明,否则oatp1b1的使用是指oatp1b1*1b。
如本文中所用,术语“oat1”和“slc22a6”是可互换使用的并且是指有机阴离子转运蛋白1。除非另有指明,否则oat1的使用是指编码563个氨基酸的全长cdna(在本文中也被称作“长oat1”)。
示例性abc转运蛋白包括但不限于列于下表1中的那些。
示例性slc转运蛋白包括但不限于列于下表2中的那些。
*在本实例中,oatp1b1包括oatp1b1*1a和oatp1b1*1b。
所测试的示例性slc转运蛋白不限于列于下表3中的那些。
适合用于本发明的细胞包括哺乳动物细胞,例如来源于人或非人(例如小鼠、大鼠、狗、猴、仓鼠和猪等)的细胞。在某些实施方案中,所述细胞是肝细胞或内皮细胞。
用于将基因引入细胞群中的基因递送系统对于本领域技术人员而言是已知的。可使用基于病毒的基因递送方法但因安全性考虑而需要特殊处理细胞。虽然可使用基于脂质的转染方法,但基于脂质的转染试剂是相对昂贵的并且这样的方法不适用于大规模制造工艺。此外,基于脂质的转染方法导致相对低的基因递送效率和相对延迟的蛋白质表达(通常在转染后72-96小时)(数据未显示)。电穿孔法(ep)是优选的,因为其适用于大规模制造工艺且避免了基于病毒的基因递送方法的安全性问题。此外,ep导致相对高效的基因递送。
在基因递送至细胞群中之后,编码药物转运蛋白和/或药物代谢酶的基因将被过表达以使得从其编码的蛋白的活性在从低温保存中解冻后是可检测的。可测试药物候选物(通过使用其温育重组细胞)以确定是否某些是从过表达的基因编码的蛋白的底物或抑制剂。具体地,如果药物候选物是药物转运蛋白和/或药物代谢酶的底物,则该药物候选物将受到影响。例如,如果药物候选物是药物转运蛋白的底物,则该药物候选物将通过所述药物转运蛋白而被转运到重组细胞之中或之外。然而,如果药物候选物是药物转运蛋白的抑制剂,则该药物候选物将抑制药物转运蛋白的底物至重组细胞之中或之外的转运。
可选择地,可使用全细胞或其亚细胞部分(微粒体/胞质溶胶)来进行测定。
此外,本发明的重组细胞还可利用瞬时过表达基因的rnai或sirna来进行转染以敲低/敲除所述基因的表达,如某些测定所需要的。可利用针对任何abc转运蛋白、slc转运蛋白或任何其它药物代谢酶的rnai或sirna来转染原代细胞(例如肝细胞)以敲低/敲除特定基因的表达。
在一个方面(1),本公开内容提供了包含一种或多种瞬时过表达基因的低温保存的重组细胞,所述基因编码选自药物转运蛋白和药物代谢酶或其组合的蛋白,其中所述药物转运蛋白或药物代谢酶或组合的活性在从低温保存中解冻后的所述低温保存的重组细胞的群体中是可检测的。
在方面(2),本公开内容提供了方面(1)的发明,其中所述一种或多种基因编码药物代谢酶。
在方面(3),本公开内容提供了方面(2)的发明,其中所述药物代谢酶选自细胞色素p450、udp-葡萄糖醛酸基转移酶、醇脱氢酶、单胺氧化酶和醛氧化酶。
在方面(4),本公开内容提供了方面(1)的发明,其瞬时过表达一种或多种编码选自atp结合框转运蛋白和溶质运载体转运蛋白的蛋白的基因。
在方面(5),本公开内容提供了方面(4)的发明,其中所述一种或多种基因选自mdr1/mdr1a/mdr1b、mrp1/mrp1、mrp2/mrp2、mrp3/mrp3、mrp4/mrp4、mrp5/mrp5、mrp6/mrp6、mrp7/mrp7、mrp8/mrp8、bcrp/bcrp、bsep/bsep、oatp2/oatp2、oatp1b3/oatp1b3、oat1/oat1、oat2/oat2、oat3/oat3、oat4/oat4、oct1/oct1、oct2/oct2、oatp1/oatp1、pept1/pept1、pept2/pept2、octn1/octn1、octn2/octn2、mate1/mate1、mate2k/mate2、urat1/urat1、asbt/asbt和ntcp/ntcp。
在方面(6),本公开内容提供了方面(4)的发明,其中所述一种或多种基因编码蛋白,所述蛋白是选自下列的atp结合框转运蛋白:mdr1/mdr1a/mdr1b、mrp1/mrp1、mrp2/mrp2、mrp3/mrp3、mrp4/mrp4、mrp5/mrp5、mrp6/mrp6、mrp7/mrp7、mrp8/mrp8、bcrp/bcrp和bsep/bsep。
在方面(7),本公开内容提供了方面(4)的发明,其中所述一种或多种基因编码蛋白,所述蛋白是选自下列的溶质运载体转运蛋白:oatp2/oatp2、oatp1b3/oatp1b3、oat1/oat1、oat2/oat2、oat3/oat3、oat4/oat4、oct1/oct1、oct2/oct2、oct3/oct3、oatp1/oatp1、pept1/pept1、pept2/pept2、octn1/octn1、octn2/octn2、mate1/mate1、mate2k/mate2、urat1/urat1、asbt/asbt和ntcp/ntcp。
在方面(8),本公开内容提供了方面(4)的发明,其中所述一种或多种基因选自oatp1b1*1a、oatp1b1*1b、oatp1b3、oat1、oat3、oct1、oct2、mate1和mate2k。
在方面(9),本公开内容提供了方面(1)的发明,其中所述一种或多种基因各自来源于人或选自小鼠、大鼠、豚鼠、狗和猴的动物物种。
在方面(10),本公开内容提供了方面(1)的发明,其中所述细胞来源于哺乳动物。
在方面(11),本公开内容提供了方面(10)的发明,其中所述细胞选自hek293、cho、mdck、llc-pk1、caco-2和v79细胞。
在方面(12),本公开内容提供了方面(10)的发明,其中所述哺乳动物选自人、猴、狗、大鼠、小鼠、猪和仓鼠。
在方面(13),本公开内容提供了方面(1)的发明,其中所述细胞包括肝细胞。
在方面(14),本公开内容提供了方面(1)的发明,其中所述细胞包括内皮细胞。
在方面(15),本公开内容提供了方面(1)的发明,其中所述蛋白的活性在从低温保存中解冻后的平板接种之后至少24小时的所述细胞的群体中是可检测的。
在方面(16),本公开内容提供了方面(1)的发明,其中所述蛋白的活性在从低温保存中解冻后的平板接种之后至少48小时的所述细胞的群体中是可检测的。
在方面(17),本公开内容提供了方面(1)的发明,其中所述蛋白的活性在从低温保存中解冻后的平板接种之后至少72小时的所述细胞的群体中是可检测的。
在另一个方面(18),本公开内容提供了制备瞬时转染的重组细胞的方法,其中所述重组细胞瞬时过表达一种或多种编码选自药物转运蛋白和药物代谢酶的蛋白的基因,所述方法包括用一种或多种编码药物转运蛋白或药物代谢酶的基因瞬时转染的细胞和在转染的48小时内低温保存瞬时转染的重组细胞。
在方面(19),本公开内容提供了方面(18)的发明,其中所述瞬时转染步骤包括电穿孔。
实施例
将细胞在用于细胞培养的标准无菌操作下进行培养,并使用ep进行瞬时转染。在ep后,将细胞在冷冻、解冻和平板接种之前以及之后进行蛋白质活性的测定。如下文所详述的,悬浮培养的细胞和贴壁细胞培养物都被成功地瞬时转染并且在从低温保存中解冻后显示出重组蛋白的实质活性。
悬浮培养的细胞
简而言之,将freestyle293细胞和293-f细胞以0.7-1.0x106个细胞/ml的密度,使用cd293补充培养基(即补充有4mml-谷氨酰胺(可获自gibco,cat.no.25030-081,lifetechnologiescorp.,carlsbad,ca)的cd293培养基(可获自gibco,cat.no.11913-019,lifetechnologiescorp.,carlsbad,ca))或补充有6mml-谷氨酰胺的excelltm293无血清补充培养基(可获自sigma,cat.no.14571c,sigma-aldrich,st.louis,mo)各自传代至适当大小的摇瓶中。使用cellometer(可获自nexcelombioscience,lawrence,ma)来测定细胞活力和细胞数量。
在第2天,进行细胞的ep。简而言之,在测定细胞活力和细胞密度之后,通过以100g旋转5分钟来沉淀细胞,随后吸去培养基并将细胞重悬于30mlep缓冲液(可获自maxcyte,cat.no.b201,maxcyteinc.,gaithersburg,md)中。将细胞悬浮液转移至50mlfalcon管,如上所述沉淀下来,并重悬于适当量的ep缓冲液中以达到100x106个细胞/ml,其被用作细胞储备物。将待被用于ep的dna以5mg/ml的终浓度制备于无菌水中。对于每个样品,将0.4ml的细胞储备物和dna置于无菌1.5mleppendorf管中从而得到200μg/ml(表4)或300μg/mldna(表10和表11)的终浓度和40x106个细胞/样品的细胞密度。
按照制造商对于hek细胞的ep的说明书,将样品转移至oc-400加工装置(可获自maxcyte,cat.no.oc-400r,maxcyteinc.,gaithersburg,md)中。在ep后,将细胞小心地吸出并转移至125ml摇瓶的底部,于37℃、8%co2下温育20分钟,随后将预热的40mlcd293培养基添加至摇瓶中以达到1x106个细胞/ml的细胞密度。于37℃和8%co2下温育细胞30分钟。在30分钟的恢复后,测定细胞活力和细胞密度。将一部分细胞(即20x106个细胞)用于平板接种并将剩余的低温保存,或者将所有的细胞低温保存。预期重组细胞可在转染的48小时之内被低温保存并在从低温保存中解冻后显示出由转染基因编码的蛋白的可检测水平的活性。
对于ep后进行平板接种细胞,通过以100g旋转5分钟来将20x106个细胞沉淀下来,随后重悬于20ml预热的平板接种培养基中(补充有0.1mm非必需氨基酸(可获自gibco,cat.no.11140050,lifetechnologiescorp.,carlsbad,ca)、10%fbs(可获自safcbiosciences,cat.no.12016c,sigma,st.louis,mo)的高糖dmem(可获自gibco,cat.no.11965092,lifetechnologiescorp.,carlsbad,ca))(1x106个细胞/ml的细胞密度)。将细胞以0.2x106个细胞/孔和0.4x106个细胞/孔的密度置于24孔组织培养板聚-d-赖氨酸涂覆的corningbiocoattm(可获自corninglifesciences,tewksbury,ma)中,并于37℃、8%co2下温育以测定接种密度对吸收活性的影响。在4小时后更换培养基,随后每24小时更换培养基直到进行测定的那一天为止。在第4天,如下所述测定细胞的oatp1b1活性。
对于低温保存,沉淀细胞并随后以10x106个细胞/ml的密度重悬于新鲜制备的冰冷的冷冻培养基(9份cd293补充培养基和1份dmso,其经注射过滤以进行除菌)中。将1ml的该细胞悬浮液加入cryo小瓶中,并置于冰冷的mrfrosty冷冻容器(可获自thermalscientific)上,将该容器保存在-80℃冰箱中过夜,随后将小瓶转移至液氮中。
如下所述测定低温保存的细胞的oatp1b1活性。简而言之,在第1天,将低温保存的细胞从液氮移出至干冰上,随后在37℃水浴解冻约2分钟。将细胞转移至10ml的如上所述的平板接种培养基(预热至约37℃的温度)中,并测定活力和细胞密度。将细胞沉淀下来并以1x106个活细胞/ml的细胞密度重悬于dmem补充培养基中。以与上文对于ep后进行平板接种细胞(其未被低温保存)所描述的相同的方式平板接种细胞,并在其平板接种后24、48和72小时测定oatp1b1活性。
贴壁细胞培养物
简而言之,使用包含100:1:1:1:10比率的dmem(高糖)(可获自gibcocat.no.11965118,lifetechnologiescorp.,carlsbad,ca)、青霉素-链霉素(10,000单位/ml)(可获自gibcocat.no.15140-122,lifetechnologiescorp.,carlsbad,ca)、l-谷氨酰胺(200mm)(可获自gibcocat.no.25030-081,lifetechnologiescorp.,carlsbad,ca)、丙酮酸钠(可获自gibcocat.no.11360,lifetechnologiescorp.,carlsbad,ca)、fbs(可获自sigma-aldrichcorp.,st.louis,mo)的平板接种培养基,将hek293细胞培养在5layer
在第2天,进行细胞的ep。简而言之,收获细胞,测定细胞活力和细胞数量,随后通过以100g旋转5分钟来将细胞沉淀下来并吸去培养基。将细胞重悬于ep缓冲液中并通过以100g旋转5分钟沉淀下来,随后重悬于适当量的ep缓冲液中以达到50x106个细胞/ml,其被用作为细胞储备物。将待被用于ep的dna以5mg/ml的终浓度制备于无菌水中。对于用于oc-400加工装置的每个样品,将0.4ml的细胞储备物和dna置于无菌1.5mleppendorf管中从而导致如图5-9中指出的50μg/ml、100μg/ml、200μg/ml或400μg/mldna的终浓度和40x106个细胞/样品的细胞密度。对于用于cl-2加工装置的每个样品,将10ml的细胞储备物和dna置于50ml无菌conical管中从而导致100μg/mldna的终浓度。
按照制造商对于hek细胞的ep的说明书,将样品转移至oc-400或cl-2加工装置(可获自maxcyte,cat.no.oc-400r和cl2-r,maxcyteinc.,gaithersburg,md)中。在ep后,将细胞小心地吸出并转移至6孔组织培养板中,并于37℃、5%co2下温育20分钟,随后移出细胞并置于含有预热的平板接种培养基的50mlconical管中。测定细胞活力和细胞密度。将一部分细胞(即20x106个细胞)用于平板接种并将剩余的低温保存。
对于ep后进行平板接种细胞,通过以100g旋转5分钟来将细胞沉淀下来,随后重悬于预热的平板接种培养基中(1x106个细胞/ml的细胞密度)。将细胞以0.4x106个细胞/孔的密度置于24孔组织培养板(聚-d-赖氨酸涂覆的corningbiocoattm(可获自corninglifesciences,tewksbury,ma))中,并于37℃、5%co2下温育。在4小时后更换培养基,随后每24小时更换培养基直到进行测定的那一天为止。在第4天和第6天,测定细胞的oatp1b1活性。
对于低温保存,沉淀细胞并随后以10x106个细胞/ml的密度重悬于新鲜制备的冰冷的冷冻培养基(9份平板接种培养基和1份dmso,将其注射过滤以进行除菌)中。将1ml的该细胞悬浮液加入cryo小瓶中,并置于冰冷的mrfrosty冷冻容器(可获自thermalscientific)上,将该容器保存在-80℃冰箱中过夜,随后将小瓶保存在液氮中。
测定低温保存的细胞的oatp1b1活性。值得注意地,以与上文对于ep后进行平板接种细胞(其未被低温保存)所描述的相同的方式平板接种细胞,并在其平板接种后48小时测定oatp1b1活性。
测定转运蛋白活性
简而言之,对于oatp1b1*1a和oatp1b1*1b使用2μm雌二醇-17β-葡糖苷酸(99%的冷e17βg和1%的[3h]-e17βg);对于oatp1b3使用2μmcck-8(99%的冷cck-8和1%的[3h]-cck-8);对于短oat1使用1μm对-氨基马尿酸盐(pah)(90%的冷pah和10%的[3h]-pah);对于长oat1使用1μm或3μm对-氨基马尿酸盐(pah)(90%的冷pah和10%的[3h]-pah);对于oat3使用1μm或2μm雌酮-3-硫酸盐(99%的冷e3s和1%的[3h]-e3s);对于oct1和oct2使用30μm溴化四乙铵(100%[14c]-tea);对于mate1和mate2k使用10μm甲福明(100%[14c]-甲福明)或10μm溴化四乙铵(100%[14c]-tea),在krebs-henseleit缓冲液ph7.4(可获自sigma,cat.no.k3753,sigma-aldrich,st.louis,mo)中制备底物溶液,并在37℃温育至少20分钟。从待被测定的细胞吸去培养基并用预热的khb缓冲液洗涤细胞三次。随后用吸收缓冲液在37℃温育细胞10分钟。对于mate1和mate2k,用含有20mmnh4cl的khb缓冲液洗涤细胞并预温育细胞10分钟。通过将0.3ml底物溶液添加至每个孔中来开始测定并在37℃温育5分钟,其中针对oct1和oct2的样品温育10分钟。
在温育的时间段之后,通过从细胞吸去底物溶液来迅速终止反应,随后用冷的吸收缓冲液洗涤细胞三次。然后用裂解溶液(dulbeccos磷酸盐缓冲溶液(dpbs)缓冲液中的0.1%sds和0.1%v/v1mnaoh)振动温育细胞15-20分钟。将底物溶液进行研制(triturate)并将0.4ml所得的细胞裂解物与5ml闪烁液置于5ml闪烁管中用于使用闪烁计数器进行分析。
如图1中所显示的,细胞活力在ep之后相对于细胞储备物的细胞活力下降了1-5%。此外,在低温保存后,细胞活力相对于ep后的细胞活力下降了额外的10-15%。尽管如此,即使在ep和从低温保存解冻之后,细胞活力仍然大于75%。
于转染后30分钟的恢复和24小时的恢复之后进行低温保存,随后检查了细胞形态学和吸收活性。表5显示了细胞形态学和吸收活性,其中24小时的恢复相较于30分钟的恢复是降低的。
检查了在以0.4x106个细胞/孔的密度平板接种于24孔聚-d-赖氨酸涂覆的corningbiocoattm板后不同的时间段之后,从低温保存解冻的转染的细胞的细胞形态学和细胞汇合。具体地,图2显示了平板接种后4小时、24小时和72小时的oatp1b1瞬时转染的细胞。此外,这些细胞在平板接种后24小时、48小时和72小时处的细胞汇合记录于下表6中。
期望地,在ep和低温保存之后,细胞在聚-d-赖氨酸涂覆的corningbiocoattm板上形成单层,且在平板接种后24小时达到80-90%的汇合,在平板接种后48小时达到90-100%的汇合。
图4显示了在从低温保存中解冻后的平板接种之后24小时进行培养的、分别瞬时转染了mate1、mate2k、oatp1b3、长oat1、短oat1、oat3和pcmv载体的细胞。
如图5中所显示的,贴壁hek293细胞中绿色荧光蛋白(gfp)的表达随dna浓度的增加而增加。此外,gfp表达在48小时的时间点相对于24小时的时间点是增加的。具体地,通过ep的gfp转染效率在利用200μg/mldna的24小时处达到100%并在利用100μg/mldna的48小时处达到100%的荧光细胞染色。因此,转染的细胞中的gfp蛋白表达水平随着增加的dna浓度而增加并且在48小时处相对于24小时处是增加的。
在ep后的不同时间点,测定了用oatp1b1(poatp1b1)和对照载体(pcmv)转染的悬浮培养293细胞的吸收活性。简而言之,在ep后或在从低温保存中解冻后,将转染的细胞以0.4x106个细胞/孔的密度平板接种于24孔聚-d-赖氨酸涂覆的corningbiocoattm板中。在新鲜平板接种细胞(“新鲜”)和低温保存细胞(“cryo”)在平板接种后不同时间点,使用探针底物雌二醇-17β-葡糖苷酸来测定oatp1b1吸收活性和吸收率,如下表7中详述的。
备注:括号中出现的数字是测定时间处的细胞汇合。
从低温保存中解冻后的转染的细胞中oatp1b1吸收活性和吸收率与新鲜平板接种的转染的细胞中oatp1b1吸收活性和吸收率是一致的。在细胞类型293-f和fs293中,最高的吸收活性和吸收率都在平板接种后24小时被观察到。
从低温保存中解冻后以0.4x106个细胞/孔或0.2x106个细胞/孔的平板接种密度平板接种于24孔聚-d-赖氨酸涂覆的corningbiocoattm板后24小时、48小时和72小时处,检查了转染的细胞(fs293或293-f)的形态学和细胞汇合。平板接种后24小时处的细胞汇合概述于下表8中。48小时和72小时处的细胞汇合与在24小时处达到的细胞汇合是相似的(数据未显示)。此外,图3提供了在从低温保存中解冻后以(a)0.4x106个细胞/孔和(b)0.2x106个细胞/孔进行平板接种的转染的细胞,在平板接种之后24小时处分别为90-95%和60-70%汇合时的图像。
为了最佳的测定表现,以0.4x106的密度进行平板接种细胞优选于0.2x106的密度,因为其达到更高的细胞汇合和更高的吸收活性。
在ep后,使用台盼蓝和血球计数器或细胞计数仪(cellometer)来检查细胞活力。
如图6中所显示的,当使用贴壁hek293细胞时,ep后的细胞活力随ep中使用的dna量的增加而下降。尽管如此,用poatp1b1转染后的细胞活力为89%-77%,用空载体转染后的细胞活力为90%。
如图7中所显示的,当使用贴壁hek293细胞时,新鲜平板接种的瞬时转染的贴壁hek293细胞中的oatp1b1介导的雌二醇-17β-葡糖苷酸的吸收是时间依赖性的。值得注意的是,吸收活性和吸收率随ep中使用的dna量的增加而增加。然而,oatp1b1介导的雌二醇-17β-葡糖苷酸的吸收在96小时时间点相对于48小时时间点是降低的。此外,如图8中所显示的,在ep后48小时,相对于空载体,用oatp1b1转染的贴壁hek293细胞中雌二醇-17β-葡糖苷酸的信噪比(即吸收率)随着dna量和测定温育时间的增加而增加。
如图9中所显示的,当使用贴壁hek293细胞时,使用小规模ep设备和大规模ep设备,oatp1b1瞬时表达的hek293细胞中雌二醇-17β-葡糖苷酸吸收在吸收活性和信噪比(即吸收率)上是一致的。在实验中使用100μg/ml的dna。
如图10中所显示的,当使用贴壁hek293细胞时,比较了在使用传统脂质转染试剂(对照:lipofectamine2000,可获自invitrogen)和使用ep(使用stx,maxcyteinc.,gaithersburg,md)转染的细胞之间的oatp1b1吸收活性。值得注意的是,使用ep转染的细胞相对于用脂质转染试剂转染的那些细胞导致显著更高的信噪比。
如图11中所显示的,当使用贴壁hek293细胞时,新鲜平板接种的ep转染的细胞和从低温保存中解冻后的细胞中的oatp1b1吸收活性都是可检测的。
测定了在从低温保存中解冻后的平板接种后24小时处,用oatp1b1*1a、oatp1b1*1b、oatp1b3、长oat1、短oat1、oat3、oct1、oct2、mate1、mate2k或对照载体(pcmv)转染的悬浮培养293细胞的吸收活性。简而言之,在ep后和在从低温保存中解冻后,将转染的细胞以0.4x106个细胞/孔的密度平板接种于24孔聚-d-赖氨酸涂覆的corningbiocoattm板中。在平板接种后24小时,使用所指出的探针底物测定slc转运蛋白吸收活性和吸收率,如下表10中详述的。
如上表10中所反映的,重组细胞显示出对其特定原型底物的强吸收活性,其每一种都具有高于10的吸收率。值得注意的是,高于5的吸收率表明是成功的过程。
如表11中所反映的,重组低温保存细胞的解冻后活力被测定为高于90%。
这些重组细胞的每一种以及对照载体(pcmv)均在平板接种(低温保存后)后24小时进行检查。这些细胞的每一种在平板接种后24小时的汇合均为85%或更高,如下表12中所反映的。
如图12中所显示的,8种低温保存的重组细胞的每一种均在解冻、平板接种于聚-d-赖氨酸平板和平板接种后温育24小时之后形成汇合的单层。
如图13-19和表13-14中所显示的,表达转运蛋白的低温保存重组细胞中所检查的动力学和抑制谱与所报道的值是一致的。具体地,如图13a-13c中所显示的,表达oat1的重组细胞的pah吸收的动力学和其丙磺舒的抑制谱与所报道的值是一致的。如图14a-14c中所显示的,表达oat3的重组细胞的e3s吸收的动力学和其丙磺舒的抑制谱与所报道的值是一致的。如图15a-15f中所显示的,表达oct1的重组细胞的tea和甲福明吸收的动力学以及其抑制谱与所报道的值是一致的。如图16a-16e中所显示的,表达oct2的重组细胞的tea和甲福明吸收的动力学以及抑制谱与所报道的值是一致的。如图17a-17f中所显示的,表达oatp1b1*1a的重组细胞的e17βg、e3s和罗苏伐他汀吸收的动力学以及环孢菌素a对e17βg吸收的抑制谱与所报道的值是一致的。如图18a-18e中所显示的,表达oatp1b1*1b的重组细胞的e17βg、e3s和罗苏伐他汀吸收的动力学以及环孢菌素a对e17βg吸收的抑制谱与所报道的值是一致的。如图19a-19e和表13-14中所显示的,表达oatp1b3的重组细胞的cck-8、e17βg和罗苏伐他汀吸收的动力学以及环孢菌素a对cck-8吸收的抑制谱与所报道的值是一致的。
本领域技术人员将理解可对上述实施方案进行改变而不背离其广泛的发明概念。因此,应理解本发明不限定于所公开的具体实施方案,而是意欲覆盖在如所附权利要求所定义的本发明的精神和范围之内的修改。
- 还没有人留言评论。精彩留言会获得点赞!