一种可扩展的合成寡核苷酸肽缀合物的操作方法与流程
本发明涉及有机化学、生物化学、分子生物学技术领域,尤其涉及一种可扩展的合成寡核苷酸肽缀合物的操作方法。
背景技术:
寡核苷酸肽缀合物(peptide–oligonucleotideconjugates,opcs)因其同时具备寡核苷酸和多肽的结构与活性而具有其独特的性质,广泛运用于从纳米技术到药物传递和反义技术等各个领域。
多肽能识别蛋白的特殊位点,对细胞有穿透性,这样的特性与寡核苷酸的碱基对识别能力的结合,使得opcs分子能有广泛的应用(leonetti,degolsetal.,1990;soukchareun,tregearetal.,1995)。opcs最初被用于反义技术,即通过将一个小的dna序列杂交到mrna区域使其编码出想要的基因片段。opcs非常适合用于这一类型的研究,因为opcs分子上结合的多肽能够识别特定的细胞类型,并能将寡核苷酸进行跨膜转运,使其能选择性地在细胞内与mrna杂交从而抑制其翻译。
自最初opcs分子被作为反义试剂以来,又出现了很多新的应用,已扩展至生物纳米技术。其中一类工作是在结构dna纳米技术的进步上,该技术利用opcs分子的核酸部分将单个多肽引导到dna纳米结构表面的特定位置。比如,c-myc多肽能与一条长度为二十个碱基的短单链dna分子偶联,所得到的缀合分子与二维dna纳米阵列表面的dna探针序列互补(williams,lundetal.,2007)。杂交完成后,铺瓦式阵列产生一个纳米级的均匀间隔64纳米的平行线图案,当用同源性的anti-c-mys抗体进行探测时,抗体能够特异性地识别出在纳米阵列表面地c-myc肽。这种在dna纳米结构表面显示肽的技术被称为纳米显示。另外一个例子是在dna纳米管上陈列的opcs被用作模板,使得dna纳米管地表面均匀分布纳米金颗粒(williams,lundetal.,2007)。总之,这两个例子证明opcs分子可以在纳米层面上精确的编码生物材料和无机材料。
目前已有几种不同的生产opcs分子的方法被报道(robertsandszostak,1997;venkatesanandkim,2006;moroder,stegeretal.,2009),其中大多数都涉及线性固相合成步骤,即,将多肽和寡核苷酸直接在固相载体上连续偶联合成(grandas,marchanetal.,2007)。多肽序列首先链接到固相载体上,于c端基团上修饰一个羟基,再通过磷酸二酯键偶联第一个核甘单体,然后依次合成余下的寡核苷酸序列。连续合成法需要根据多肽合成仪肽和寡核苷酸合成仪的特点来具体设计,涉及的化学保护基团也必须同时兼容多肽和寡核苷酸的固相化学方法(venkatesanandkim,2006)。
还有片段偶联法,它是比线性的连续合成法更便捷的一种方法。在分别合成多肽和寡核苷酸以后,将两个分子通过共价化学键链接起来成为一个opcs分子,而且共价链接基团在化学结构和性质上可以有多种选择,目前一般是通过点击化学方法生成,比如巯基和马来酰亚胺的加成反应,炔基和叠氮基的加成反应。
不论是片段偶联法还是连续合成法得到的opcs产品,在生产opcs的过程中,保持寡核苷酸的结构完整性是至关重要的。常规的生产设计要求创建一个完全没有dnase/rnase污染的生产环境,但试剂、设备和维护成本相当高。并且生产过程可能要求试剂长时间接触水溶液,会不可避免地增加opcs降解的可能性。进一步地,由于寡核苷酸合成方法本身决定的聚合度不确定性,参与偶联反应的官能团(如叠氮基)的摩尔浓度是不确定的,导致最终产品由于偶联反应不完全而存在严重的低纯度问题。一般需要通过以下一种方法或多种方法组合在一起来纯化:离子对反相色谱、离子交换色谱、凝胶电泳、透析、超滤。这些方法复杂、昂贵且低效,不适于大规模生产。
技术实现要素:
本发明的目的在于,针对现有技术的上述不足,提出一种适合大规模生产、无需进一步纯化、成本低、避免产物降解的可扩展的合成寡核苷酸肽缀合物的操作方法。
本发明解决其技术问题,采用的技术方案是,提出一种可扩展的合成寡核苷酸肽缀合物的操作方法,其包括以下步骤:
a、制备叠氮基寡核苷酸和dbco-肽并高度纯化;
b、反应准备:将dbco-肽溶解在dmso中得到dbco-肽溶液,将叠氮基寡核苷酸溶于水或水与dmso的混合液中得到叠氮基寡核苷酸溶液;
c、偶联反应:(c1)、对叠氮基寡核苷酸进行高效液相色谱分析,其起始峰的面积为a0,取dbco-肽溶液的量为v0添加到叠氮基寡核苷酸溶液中反应得到反应产物,其中dbco-肽与叠氮基寡核苷酸的摩尔比为1:1.00-1.25;(c2)、确定缀合物峰的位置:对反应产物提取样品并进行高效液相色谱分析,确定偶联反应之后反应产物的峰的位置,未反应的叠氮基寡核苷酸的峰的面积为a0;(c3)、逐步叠加反应:(1)第一次叠加反应:往反应产物中添加dbco-肽溶液的量为v1,
本发明应用点击化学来实现片段偶联反应。为了避免重金属元素对寡核苷酸肽缀合物产品下游使用的不利影响,从一开始即必须回避基于铜催化试剂的1,3-偶极[3+2]环加成反应(1,3-dipolarcycloaddition)。本发明主张采用环张力促进的1,3-偶极[3+2]环加成反应,特别是二苯并氮杂环辛炔基(dbco)与叠氮基(n3)通过环加成而得到1,2,3-三唑基团。此方法可确保寡核苷酸肽缀合物产品能够通用于活细胞、生物体以及非活体实验样本中。dbco基团专一地标记含叠氮基的分子。在生理温度和生理酸碱度范围内,dbco基团不会与分子生物中天然存在的活性基团巯基、胺基或者羟基进行反应。
点击化学反应原理如下:
作为优选,所述dbco-肽溶液的浓度在1-10mm,所述叠氮基寡核苷酸溶液的浓度在0.1-1.0mm。
作为优选,所述高效液相色谱使用紫外检测器,所述紫外检测器检测波长设置为210nm。
作为优选,在步骤e之后,对最终产物进行真空冷冻干燥即可直接用于下一步实验。
作为优选,在步骤b中,将叠氮基寡核苷酸溶于水或水与dmso的混合液中得到浓度在0.1mm-100mm的叠氮基寡核苷酸溶液,其中水与dmso混合液中,水与dmso的混合体积比为1:1-5。
作为优选,步骤(c1)中dbco-肽与叠氮基寡核苷酸的摩尔比为1:1。
作为优选,水与dmso混合液中,水与dmso的混合体积比为1:1。
作为优选,步骤(c1)中dbco-肽与叠氮基寡核苷酸的摩尔比为1:1。
本发明具有如下有益效果:
1.寡核苷酸容易被dna酶或者rna酶降解,本发明的方法可以避免外来酶的污染问题。
2.采用点击化学法定量、即时地完成偶联反应。dbco基团专一地标记含叠氮基的分子。在生理温度和生理酸碱度范围内,dbco基团不会与分子生物中天然存在的活性基团巯基、胺基或者羟基进行反应。这种专一性的一对一反应效率高达95%以上。
3.在高效液相色谱分析的引导下,逐步对叠加反应进行操作,并优化。经过少数(一般2次)逐步叠加操作即可达理论上的化学反应计量比1:1,最终达到95-99%的有效叠加反应终点。高效液相色谱分析样品的时间即为每次逐步叠加反应操作的所需时间。因此,利用高效液相色谱分析方法的逐步优化最终反应可以稳步提高生产效率,以及扩大到大规模的反应。
4.有效地减少了opcs反应完成后额外的纯化步骤,由于反应几乎完全进行,反应副产物属于小分子,不会对下游反应产生任何影响,没有必要进行进一步的纯化工作。
5.本发明的叠加反应操作中,寡核苷酸采用了叠氮基团标记,多肽采用了dbco标记。如果寡核苷酸采用dbco标记,多肽采用叠氮基团标记,这样将标记基团对调,本优化方法亦完全适用。
6.该叠加反应操作方法可以将标记基团根据情况放在多肽或者核酸序列上的任意位点,标记基团在任意位点不影响最终的偶联反应效果。与线性合成opcs方法不同,此叠加反应操作方法在溶液中用标准的实验技术就可以完成,不需要专门的设备或者试剂。
7.产量可以规模扩大化。本发明的实施例中展示了此叠加反应操作制备了从微克到几十毫克量级的寡核苷酸肽缀合产品。
附图说明
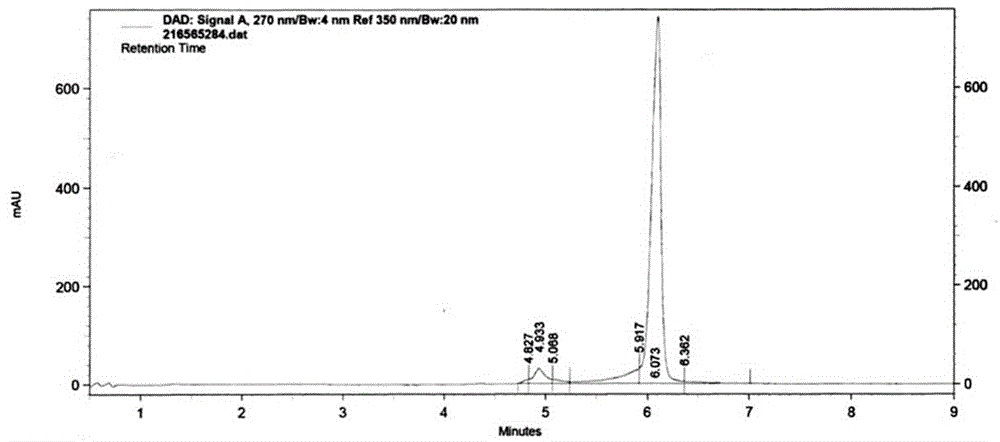
图1为实施例1中高效液相色谱验证叠氮基寡核苷酸的色谱图;
图2为实施例1中高效液相色谱验证纯化后的dbco-肽的色谱图;
图3为实施例1中操作时间点0的高效液相色谱图;
图4为实施例1中操作时间点1的高效液相色谱图;
图5为实施例1中操作时间点2的高效液相色谱图;
图6为实施例1中操作时间点3的高效液相色谱图;
图7为实施例1中操作时间点4的高效液相色谱图;
图8为实施例1中操作时间点5的高效液相色谱图;
图9为实施例2中高效液相色谱验证纯化后的dbco-肽的色谱图;
图10为实施例2中操作时间点1的高效液相色谱图;
图11为实施例2中操作时间点2的高效液相色谱图;
图12为实施例2中操作时间点3的高效液相色谱图;
图13为是实施例3中高效液相色谱验证叠氮基寡核苷酸的双链中的反义链的色谱图;
图14为实施例3中高效液相色谱验证叠氮基寡核苷酸的双链中的正义链的色谱图;
图15为实施例3中高效液相色谱验证纯化后的dbco-肽的色谱图;
图16为实施例3中操作时间点0的高效液相色谱图;
图17为实施例3中操作时间点1的高效液相色谱图;
图18为实施例3中操作时间点2的高效液相色谱图;
图19为实施例3中操作时间点3的高效液相色谱图;
图20为实施例3中操作时间点4的高效液相色谱图;
图21为实施例3中操作时间点5的高效液相色谱图;
图22为实施例3中操作时间点6的高效液相色谱图;
图23为对比例1中反应产物的高效液相色谱图;
图24为对比例2中反应产物的高效液相色谱图。
具体实施方式
以下是本发明的具体实施例并结合附图,对本发明的技术方案作进一步的描述,但本发明并不限于这些实施例。
以下各实施例以及对比例中用到的高效液相色谱(hplc)分析时候用到条件。
色谱柱:ascentisexpressc18,50x2.1mm,2.7μm
流动相:a=10mmteaa水溶液
b=10mmteaa乙腈溶液
流速:0.8ml/min
温度:25℃
检测器:210nm,bw4nm
实施例1:
本实施例中双链rna(dsrna)在专门的高效液相色谱条件下是可能很好地分开的。因为反义链没有用叠氮基进行标记,所以它在反应过程中保持原样,其峰高和色谱保留时间维持不变。该实例用了总共50mg的双链rna与dbco-肽进行了反应,最终产品需要进行退火处理重新变成含有多肽偶联物的双链rna。
一种可扩展的合成寡核苷酸肽缀合物的操作方法,其包括以下步骤:
a、通过将dbco-马来酰亚胺连接到多肽半胱氨酸侧链巯基上制备dbco-肽,叠氮基通过化学方法共价连接到寡核苷酸的5'或3'端制备叠氮基寡核苷酸,dbco-肽和叠氮基寡核苷酸均通过高效液相色谱法进行纯化。
b、反应准备:将dbco-肽29.3mg溶解在1.175ml的dmso中得到dbco-肽溶液,本实施例中dbco-肽溶液的浓度为10mm,将叠氮基寡核苷酸50mg溶于3.63ml的水与dmso的混合液中得到叠氮基寡核苷酸溶液,本实施例中叠氮基寡核苷酸溶液浓度为1.0mm,本实施例中水与dmso的混合液中水与dmso的混合体积比为1:1,且分别测定叠氮基寡核苷酸溶液和dbco-肽溶液的高效液相色谱,本实施例中,高效液相色谱均使用紫外检测器,所述紫外检测器检测波长设置为210nm,如图1所示,高效液相色谱验证叠氮基寡核苷酸,这是一个双链寡核苷酸,纯度为85.4%,叠氮基标记在正义链上,如图2所示,高效液相色谱验证纯化后的dbco-肽,纯度为99.40%;
c、偶联反应:(c1)、取dbco-肽溶液的量为v0添加到叠氮基寡核苷酸溶液中反应得到反应产物,本实施例中v0=364微升,其中dbco-肽与叠氮基寡核苷酸的摩尔比为1:1;(c2)、确定缀合物峰的位置:对反应产物提取样品并进行高效液相色谱分析,确定偶联反应之后反应产物的峰的位置,如表1所示,操作时间点0对应图3,操作时间点1对应图4,操作时间点2对应图5,操作时间点3对应图6,操作时间点4对应图7,操作时间点5对应图8,其中图3即还未加入dbco-肽时的色谱图(即c1步骤开始前对叠氮基管核苷酸进行高效液相色谱测定),图3与图4对比,可以得知反应产物的峰为p3,该峰的面积为4700.5,未反应的叠氮基寡核苷酸正义链的峰为p2,反义链的峰为p1,在操作时间点0时,正义链的峰的面积a0=4807,在时间1时,正义链的峰的面积a1=2959.1,此时a1/a0=0.6156;(c3)、逐步叠加反应:(1)第一次叠加反应:往反应产物中添加dbco-肽溶液的量为v1,
表1:
实施例2:
本实施例中采用一个纯度不确定的单链dna来展示逐步叠加反应的广泛适用性。该单链dna在合成式用硫代磷酸二酯键取代了通常的磷酸二酯键。硫代强化了dna分子的化学稳定性,但同时也对dna分子结构造成重要后果,在所有磷原子上引入手性中心,从而使该叠氮基寡核苷酸成为一个非常复杂的消旋混合物,检测其色谱纯度很困难。虽然无法得到操作时间点0数据,我们采取了近似简化措施,仍然得到比较好的结果。
一种可扩展的合成寡核苷酸肽缀合物的操作方法,其包括以下步骤:
a、通过将dbco-马来酰亚胺连接到多肽半胱氨酸侧链巯基上制备dbco-肽,叠氮基通过化学方法共价连接到寡核苷酸的5'或3'端制备叠氮基寡核苷酸,dbco-肽通过高效液相色谱法进行纯化,叠氮基寡核苷酸分子量11474.3,无法有效纯化。
b、反应准备:将dbco-肽4.5mg溶解在1.32ml的dmso中得到dbco-肽溶液,本实施例中dbco-肽溶液的浓度为1mm,将叠氮基寡核苷酸0.69mg溶于109微升的水中得到叠氮基寡核苷酸溶液,本实施例中叠氮基寡核苷酸溶液浓度为0.5mm,且dbco-肽溶液的高效液相色谱,本实施例中,高效液相色谱均使用紫外检测器,所述紫外检测器检测波长设置为210nm,如图9所示,高效液相色谱验证纯化后的dbco-肽,纯度为98.99%;
c、偶联反应:(c1)、取dbco-肽溶液的量为v0添加到叠氮基寡核苷酸溶液中反应得到反应产物,本实施例中v0=54微升,其中dbco-肽与叠氮基寡核苷酸的摩尔比为1:1;(c2)、确定缀合物峰的位置:对反应产物提取样品并进行高效液相色谱分析,确定偶联反应之后反应产物的峰的位置,如表2所示,操作时间点1对应图10,操作时间点2对应图11,操作时间点3对应图12,反应产物的峰为p2,该峰的面积为3343.5,未反应的叠氮基寡核苷酸的峰为p1,a1=4166.4,本实施例将p1和p2的和值7509.9取为a0的粗略近似,此时a1/a0=0.5548;(c3)、逐步叠加反应:本实施例中产物峰p2纯度预设为95%,(1)第一次叠加反应:往反应产物中添加dbco-肽溶液的量为v1,
表二
实施例3:
本实施例中采用另一个不同于实施例一的双链rna(dsrna)来展示逐步叠加反应适用于溶解度较差且反应缓慢的特殊寡核苷酸,因其反义链和正义链都含有甲基化的碱基,溶解度试验显示其不能形成高浓度溶液。按照本发明的方法最终仍然得到很好的反应产物转化纯度。
一种可扩展的合成寡核苷酸肽缀合物的操作方法,其包括以下步骤:
a、通过将dbco-马来酰亚胺连接到多肽半胱氨酸侧链巯基上制备dbco-肽,叠氮基通过化学方法共价连接到寡核苷酸的5'或3'端制备叠氮基寡核苷酸,dbco-肽和叠氮基寡核苷酸均通过高效液相色谱法进行纯化。如图13所示高效液相色谱验证叠氮基寡核苷酸的双链中的反义链纯度为91.0%,分子量6457.1,如图14所示高效液相色谱验证叠氮基寡核苷酸的双链中的正义链两端各偶联叠氮基和荧光黄基,纯度为87.7%,分子量7444.0,如图14所示高效液相色谱验证纯化后的dbco-肽,纯度为99.30%。
b、反应准备:将dbco-肽9.4mg溶解在0.600ml的dmso中得到dbco-肽溶液,本实施例中dbco-肽溶液的浓度为5.70mm,将叠氮基寡核苷酸10.59mg溶于5ml的水与dmso的混合液中得到叠氮基寡核苷酸溶液,本实施例中叠氮基寡核苷酸溶液浓度为0.15mm,本实施例中水与dmso的混合液中水与dmso的混合体积比为1:5,且分别测定叠氮基寡核苷酸溶液和dbco-肽溶液的高效液相色谱,本实施例中,高效液相色谱均使用紫外检测器,所述紫外检测器检测波长设置为210nm,如图16所示,高效液相色谱测定叠氮基寡核苷酸,即操作时间点0,如图15所示,高效液相色谱验证纯化后的dbco-肽,纯度为99.30%;
c、偶联反应:(c1)、取dbco-肽溶液的量为v0添加到叠氮基寡核苷酸溶液中反应得到反应产物,本实施例中v0=100微升,其中dbco-肽与叠氮基寡核苷酸的摩尔比为1:1.25;(c2)、确定缀合物峰的位置:对反应产物提取样品并进行高效液相色谱分析,确定偶联反应之后反应产物的峰的位置,如表3所示,操作时间点0对应图16,操作时间点1对应图17,操作时间点2对应图18,操作时间点3对应图19,操作时间点4对应图20,操作时间点5对应图21,操作时间点6对应图22,图17与图16对比,可以得知反应产物的峰为p3,该峰的面积为126.8,未反应的叠氮基寡核苷酸正义链的峰为p2,反义链的峰为p1,在操作时间点0时,正义链的峰的面积a0=3099.2,在操作时间点1时,正义链的峰的面积a1=3618.8,表3中可见,本例中的反应相当缓慢,进样量误差带来的影响更明显。我们选择时间点3的面积2490.3作为a1,此时a1/a0=0.8035;(c3)、本实施例中缀合物峰纯度预设为98%,逐步叠加反应:(1)第一次叠加反应:往反应产物中添加dbco-肽溶液的量为v1,
表3:
对比例1:
本对比例中,叠氮基寡核苷酸是一个单链dna(分子量6460.3)0.5毫克,溶于228微升的dmso和水的,其中dmso和水的混合体积比为2:1。将dbco-肽(分子量2492.81)3.2毫克溶于256微升的50%乙腈-水混合溶剂并逐渐加入到叠氮基寡核苷酸溶液中,直至新加入的dbco-肽保持混浊状态,共加入51.6微升。沉淀用离心法除去。
本对比例表示如果没有本发明的叠加反应操作方法描述的逐步优化操作,dbco-肽在投料时按目测估算加入。如图23所示,高效液相色谱结果显示缀合物分子在色谱保留时间3.458被洗出,产物纯度82.97%。最终产品里仍含有显著未偶联的dbco-肽,色谱保留时间5.261。
该结果表示通常的操作方法虽然简便,但是误差较大。
对比例2:
本对比例中,叠氮基寡核苷酸是一个未经高效液相色谱纯化的单链rna(分子量21571),取叠氮基寡核苷酸556微克溶于52微升dmso。将dbco-肽(分子量2661.66)5.6毫克溶于210微升dmso,取4.6微升加入到叠氮基寡核苷酸溶液中。
本对比例中用于合成的rna分子在偶联反应之前未经纯化,直接与dbco-肽进行投料操作,发现能找到产物峰,如图24所示最高的峰就是是产物峰,纯度55.9%。但是由于原料rna不纯,导致其它较小的峰无法确定类型,这种不纯的产品必须在反应完后进一步纯化。因此,反应物在偶联之前,有必要尽可能提高纯度。
本文中所描述的具体实施例仅仅是对本发明精神作举例说明。本发明所属技术领域的技术人员可以对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,但并不会偏离本发明的精神或者超越所附权利要求书所定义的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于DNA酶嵌合引物的核酸筛查生物传感器的制造方法与工艺
- 一种高密度、高稳定性的核酸芯片及其制备方法与流程
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 一种原位杂交探针及其对大麦染色体组鉴定的方法与制造工艺
- 一种大麦亚端粒寡核苷酸探针及其应用的制造方法与工艺
- 一种核酸检测的复合物及其制备方法与核酸检测的方法与制造工艺
- 用于检测人类ROS1融合基因的核酸、试剂盒及方法与制造工艺
- 一种特异性结合GPC3的核酸适配体及其应用的制造方法与工艺
- 一种单链核酸分子、聚合酶活性测定方法及试剂盒与制造工艺