α-L-岩藻糖苷酶及其相关生物材料与应用的制作方法
本发明属于基因工程领域,具体涉及α-l-岩藻糖苷酶及其相关生物材料与应用。
背景技术:
岩藻糖基乳糖由一分子岩藻糖和一分子乳糖构成,岩藻糖残基可通过α(1,2)糖苷键连接到乳糖的半乳糖残基上,或通过α(1,3)糖苷键连接到乳糖还原端的葡萄糖。岩藻糖基乳糖大量存在于人乳中,具有调节肠道菌群、抵抗病原菌的粘附、免疫调节及促进大脑发育等多种功能活性(yvanetal.,humanmilkoligosaccharides:2’-fucosyllactose(2’-fl)andlacto-n-neotetraose(lnnt)ininfantformula.nutrients,2018,10:1161.)。目前,化学合成或生物合成的2’-岩藻糖基乳糖已被欧盟和美国fda批准添加到婴幼儿食品中(bychetal.,productionofhmosusingmicrobialhosts-fromcellengineeringtolargescaleproduction.currentopinioninbiotechnology,2019,56c:130-137.),市场对于岩藻糖基乳糖需求日益增加。因此,开发合成岩藻糖基乳糖的方法具有重要意义。
酶法合成寡糖具有反应条件温和、可控性良好等优势近年来受到广泛关注(bojarováetal.,glycosidasesincarbohydratesynthesis:whenorganicchemistryfallsshort.chimia(aarau),2011,65,65-70.)。糖苷水解酶和糖基转移酶是在寡糖合成中应用较多的两类酶。α-l-岩藻糖苷酶是一类外切糖苷水解酶,能特异性水解岩藻糖基寡糖或岩藻糖基化合物上连接的岩藻糖残基。与岩藻糖基转移酶相比,α-l-岩藻糖苷酶来源广泛、活性高且能使用较为经济的原料作为糖基供体进行寡糖的合成(lezyk,etal.,novelα-l-fucosidasesfromasoilmetagenomeforproductionoffucosylatedhumanmilkoligosaccharides.plosone,2016:1-18.)。目前,α-l-岩藻糖苷酶主要分为4个家族,分别是糖苷水解酶(gh)29、95、141和151家族。根据反应机制,α-l-岩藻糖苷酶可分为保留型和反转型,仅保留型gh29和gh151家族的岩藻糖苷酶具有转糖苷活性(birgitteetal.substratespecificityandtransfucosylationactivityofgh29α-l-fucosidasesforenzymaticproductionofhumanmilkoligosaccharides,newbiotechnology,2018,41:34-45;eliseetal.,synthesisofnewfucose-conta.国际专利:us20140228554a1)。迄今,利用α-l-岩藻糖苷酶的转糖苷活性合成岩藻糖基乳糖的主要限制因素是产物得率低。因此,发掘特性优良、高转糖苷活性的α-l-岩藻糖苷酶具有重要意义。
3’-岩藻糖基乳糖尚无天然存在报道,fuc-α(1,3)-gal糖苷键存在于一种人乳低聚九糖的末端(yamashitaetal.,oligosaccharidesofhumanmilk.isolationandcharacterizationofthreenewdisialylfucosylhexasaccharides.arch.biochem.biophys.,1976,174:582-591)。有研究通过对乳糖的化学修饰经六步反应获得3’-岩藻糖基乳糖,但制备过程中使用大量有毒试剂、步骤繁芜且产物得率低(takamura.etal.,chemicalmodificationoflactose.xv.synthesesofo-α-ando-β-l-fucopyranosyl-(1→3)-o-β-d-galactopyranosyl-(1→4)-d-glucopyranoses(3′-o-a-and3′-o-β-l-fucopyranosyllactoses).carbohydrateresearch,1980:84:53-60)。酶法合成3’-岩藻糖基乳糖的报道很少,仅有alcaligenessp.来源的α-l-岩藻糖苷酶通过其转糖苷活性合成3’-岩藻糖基乳糖,得率为34%(murataetal,.enzymaticsynthesisofalpha-l-fucosyl-n-acetyllac-tosaminesand3′-o-alpha-l-fucosyllactoseutilizingalpha-l-fucosidases.carbohydrateresearch.1999,320:192-199.)。3’-岩藻糖基乳糖功能活性的报道也很少。研究发现3’-岩藻糖基乳糖可作为抗体探针与腺癌和胚胎癌细胞中相应的抗原发生特异性结合(miyauchietal.,anewfucosylantigenexpressedoncolonadenocarcinomaandembryonalcarcinomacells.nature,1982,299:168-169.)。
迄今,尚无3’-岩藻糖基乳糖益生活性的研究报道。
技术实现要素:
本发明所要解决的技术问题为提供一种参与岩藻糖基化合物合成的具有转糖苷活性的蛋白质,以合成或制备3’-岩藻糖基乳糖。
为解决上述问题,本发明首先提供了一种蛋白质,来源于地杆菌(pedobactersp.),为如下a1)-a4)任一所示:
a1)氨基酸序列为seqidno.3的蛋白质;
a2)氨基酸序列为seqidno.4的蛋白质;
a3)将seqidno.3的蛋白质或seqidno.4的蛋白质的n端或/和c端连接蛋白标签得到的融合蛋白;
a4)将seqidno.3的蛋白质或seqidno.4的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与a1)或a2)所示的蛋白质具有90%以上的同一性且功能相同的蛋白质。
其中,a1)所示的蛋白质的命名为α-l-岩藻糖苷酶(pbfuc),seqidno.3由422个氨基酸残基组成。
a2)所示的蛋白质的命名为重组α-l-岩藻糖苷酶(pbfuc-his),其为seqidno.3的pbfuc的n端连接mgsshhhhhhssglvprgshmasmtggqqmgrgsef得到的融合蛋白,seqidno.4由458个氨基酸残基组成。
上述蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
上述蛋白质中,蛋白标签(protein-tag)是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述蛋白标签可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
上述蛋白质中,同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gapexistencecost,perresiduegapcost和lambdaratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
上述蛋白质中,所述90%以上的同一性可为至少91%、92%、95%、96%、98%、99%或100%的同一性。
本发明进一步提供了上述蛋白质的应用。
所述应用如下述任一所述:
d1)上述蛋白质作为α-l-岩藻糖苷酶(pbfuc)的应用;
d2)上述蛋白质在制备或合成岩藻糖基化合物的应用;
d3)上述蛋白质在催化糖基供体和乳糖形成3’-岩藻糖基乳糖的应用。
具体的,所述岩藻糖基化合物可以为含岩藻糖基的寡糖、含岩藻糖基的蛋白质、含岩藻糖基的脂类、其他任意含岩藻糖基的化合物;
所述糖基供体为任何含岩藻糖基的化合物,如含岩藻糖基的任意链长的糖类、醇类、脂类、氨基酸或蛋白,具体可为2-氯-4-硝基苯基-α-l-岩藻糖苷(4-nitrophenyl-α-l-fucopyranoside,简写为pnp-fuc)。
上述蛋白质的相关生物材料也在本发明的保护范围之内。
本发明提供上述蛋白质的相关生物材料为下述c1)至c8)中的任一种:
c1)编码上述蛋白质的核酸分子;
c2)含有c1)所述核酸分子的表达盒;
c3)含有c1)所述核酸分子的重组载体;
c4)含有c2)所述表达盒的重组载体;
c5)含有c1)所述核酸分子的重组微生物;
c6)含有c2)所述表达盒的重组微生物;
c7)含有c3)所述重组载体的重组微生物;
c8)含有c4)所述重组载体的重组微生物。
上述生物材料中,c1)所述核酸分子为如下b1)或b2)或b3)所示:
b1)编码序列为seqidno.1第10-1278位所示的dna分子;
b2)编码序列为seqidno.2所示的dna分子;
b3)在严格条件下与b1)或b2)限定的dna分子杂交,且编码上述蛋白质的dna分子。
其中,seqidno.1由1294个核苷酸组成,其中,第10-1278位命名为α-l-岩藻糖苷酶基因(pbfuc基因),编码seqidno.3的α-l-岩藻糖苷酶(pbfuc)。
seqidno.2由1377个核苷酸组成,命名为重组α-l-岩藻糖苷酶基因(pbfuc-his基因),编码seqidno.4的重组α-l-岩藻糖苷酶(pbfuc-his)。
所述严格条件是在2×ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5×ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次15min。
其中,所述核酸分子可以为dna,如cdna、基因组dna或重组dna,所述核酸分子也可以为rna,如mrna或hnrna。
上述相关生物材料中,c2)所述的含有编码α-l-岩藻糖苷酶的核酸分子的表达盒(pbfuc基因表达盒),是指能够在宿主细胞中表达pbfuc的dna,该dna不但可包括启动pbfuc转录的启动子,还可包括终止pbfuc转录的终止子。进一步,所述表达盒还可包括增强子序列。
上述相关生物材料中,所述载体可为质粒、黏粒、噬菌体或病毒载体。
上述相关生物材料中,所述微生物可为酵母、细菌、藻或真菌,如农杆菌。
本发明进一步还提供了上述相关生物材料的应用。
所述应用如下述任一所述:
e1)上述相关生物材料在制备或合成α-l-岩藻糖苷酶中的应用;
e2)上述相关生物材料在制备或合成岩藻糖基化合物的应用;
e3)上述相关生物材料在催化糖基供体和乳糖形成3’-岩藻糖基乳糖的应用。
具体的,所述岩藻糖基化合物可以为含岩藻糖基的寡糖、含岩藻糖基的蛋白质、含岩藻糖基的脂类、其他任意含岩藻糖基的化合物;
所述糖基供体为任何含岩藻糖基的化合物,如含岩藻糖基的任意链长的糖类、醇类、脂类、氨基酸或蛋白,具体可为2-氯-4-硝基苯基-α-l-岩藻糖苷(4-nitrophenyl-α-l-fucopyranoside,简写为pnp-fuc)。
本发明还提供了制备上述蛋白质(α-l-岩藻糖苷酶)的方法。
本发明制备上述蛋白质的方法,包括将上述蛋白质的基因导入到受体微生物中,得到表达上述蛋白质的重组微生物,培养所述重组微生物,表达得到上述蛋白质(α-l-岩藻糖苷酶)。
上述方法中,所述受体微生物为原核微生物。具体的,所述原核微生物为大肠杆菌。更具体的,所述大肠杆菌为大肠杆菌(escherichiacoli)bl21(de3)。
上述方法中,所述α-l-岩藻糖苷酶的基因可通过重组质粒pet-28a(+)-pbfuc导入到大肠杆菌表达菌株bl21(de3),得到重组菌bl21(de3)-pet-28a(+)-pbfuc中;所述重组质粒pet-28a(+)-pbfuc是将载体pet-28a(+)的nhei和xhoi限制性酶切位点之间的dna小片段替换为核苷酸序列是seqidno.1第10-1278位所示的dna分子,且保持pet-28a(+)载体其他序列不变得到的重组表达载体。其中,重组质粒pet-28a(+)-pbfuc中含有seqidno.2的pbfuc-his基因,编码seqidno.4的融合蛋白pbfuc-his,pbfuc-his是seqidno.3所示的pbfuc的n端连接mgsshhhhhhssglvprgshmasmtggqqmgrgsef得到的融合蛋白。
上述方法中,得到的α-l-岩藻糖苷酶的最适ph为5.0,在ph4.0-11.0范围内保持稳定,残余酶活大于80%,表现出良好的ph稳定性;最适温度为35℃,在40℃以下保持相对稳定,酶活能保持90%以上,超过45℃后酶活力迅速下降,且在35℃、40℃和45℃时的半寿期分别是555、51和2.8min。
本发明进一步提供了一种制备3’-岩藻糖基乳糖的方法。
本发明制备3’-岩藻糖基乳糖的方法,包括利用α-l-岩藻糖苷酶催化pnp-fuc和乳糖的步骤。
上述方法中,所述α-l-岩藻糖苷酶催化反应的ph值可为3.5-11.0,具体可为3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11.0;或上述任两个所述点值间的范围值如3.5-7.0;6.5-9.5;或7-9;或8-10;或8-8.5;或8.5-9内的ph值;
上述方法中,所述α-l-岩藻糖苷酶催化反应的温度为20-50℃;具体可为20℃、25℃、30℃、35℃、40℃、45℃、50℃;或上述任两个所述点值间的范围值如20-35℃;或35-50℃;或25-50℃;或30-40℃内的温度。
上述方法中,所述α-l-岩藻糖苷酶催化反应的时间,可为大于0s,具体可为5、10、15、30、45min;或1、2、3、4、5、6、7、8、9、10、24、48h;或上述两个所述点值间的范围如5~60min,1~48h内的时间。
上述方法中,所述α-l-岩藻糖苷酶催化反应的最适温度为35℃,最适ph为8.5,最适反应时间为3h,乳糖最适浓度为700mm,最适加酶量为0.5u/ml,pnp-fuc浓度为10mm,该条件下可高效合成3’-岩藻糖基乳糖,转化率为85%。
本发明进一步还提供了3’-岩藻糖基乳糖在促进益生菌增殖上的应用。
上述应用中,所述益生菌为德氏乳杆菌、干酪乳杆菌和长双歧杆菌。
具体的,所述德氏乳杆菌为德氏乳杆菌nrrlb-548,所述干酪乳杆菌为干酪乳杆菌as.1.2435和干酪乳杆菌nrrlb-1922,所述长双歧杆菌为长双歧杆菌nrrlb-41409。
本发明利用高效热不对称性交错pcr(hitail-pcr)从地杆菌属(pedobactersp.)扩增得到包含如seqidno.1第10-1278位所示的α-l-岩藻糖苷酶基因(pbfuc),并将其转入至e.colibl21(de3)得到一种重组菌,利用重组菌可制备得到α-l-岩藻糖苷酶(pbfuc)。进一步,本发明利用pbfuc催化pnp-fuc和乳糖合成3’-岩藻糖基乳糖,反应3h转化率为85%,对于大量制备3’-岩藻糖基乳糖具有重要的意义。另外,本发明以合成的3’-岩藻糖基乳糖为碳源体外培养四株益生菌(德氏乳杆菌nrrlb-548、干酪乳杆菌as.1.2435、干酪乳杆菌nrrlb-1922和长双歧杆菌nrrlb-41409),在48h后的生长量(od595)分别为0.467,0.362,0.375,和0.403。相同条件下低聚果糖对这四种益生菌的生长量(od595)分别为0.182,0.320,0.290,和0.333,表明3’-岩藻糖基乳糖对以上四株益生菌的增殖效果优于低聚果糖;另外,3’-岩藻糖基乳糖发酵四株有害菌(包括大肠杆菌atcc11775、鼠伤寒沙门氏菌as1.1552、单增李斯特菌cicc21635和金黄色葡萄球菌as1.1861),发酵24h后的生长量(od595)分别为0.091,0.074,0.086和0.095,接近无糖组;而相同条件下低聚果糖发酵这四株有害菌24h后的生长量(od595)分别为0.179,0.186,0.199和0.109,表明3’-岩藻糖基乳糖对以上四株有害菌的增殖作用低于低聚果糖,表现出优良的益生活性。
本发明提供的α-l-岩藻糖苷酶(pbfuc)可高效合成3’-岩藻糖基乳糖,在寡糖合成中具有良好的应用前景。3’-岩藻糖基乳糖对四株益生菌的增殖作用优于低聚果糖,而对四株有害菌的增长量低于低聚果糖,表现出优良的益生活性。
附图说明
图1为以地杆菌(pedobactersp.)的基因组dna为模板得到的保守序列的琼脂糖凝胶电泳结果图。
图2为以hitail-pcr片段为模板得到的dna片段的琼脂糖凝胶电泳结果图。
图3为pbfuc与29家族α-l-岩藻糖苷酶氨基酸的多重序列比对图。
图4为重组菌培养液的粗酶液的聚丙烯酰胺凝胶电泳(sds-page)结果图;其中,1为不加iptg的对照组粗酶液;2为加iptg实验组粗酶液。
图5为经镍柱纯化前后pbfuc粗酶液(1)和纯酶液(2)的sds-page图谱。
图6为pbfuc的最适ph(a)和ph稳定性(b);其中,柠檬酸-柠檬酸三钠citrate(■)ph3.0-6.0;pb缓冲液(□)ph6.0-8.0;tris-hcl缓冲液(◆)ph6.0-9.0;ches缓冲液ph(δ)8.0-10.0,caps缓冲液(*)ph10.0-11.0,na2hpo4-naoh缓冲液(·)ph11.0-12.0。
图7为pbfuc的最适温度(a)、温度稳定性(b)和半寿期(c)。
图8为pbfuc催化转糖苷反应hplc图。
图9为3’-岩藻糖基乳糖一级质谱图。
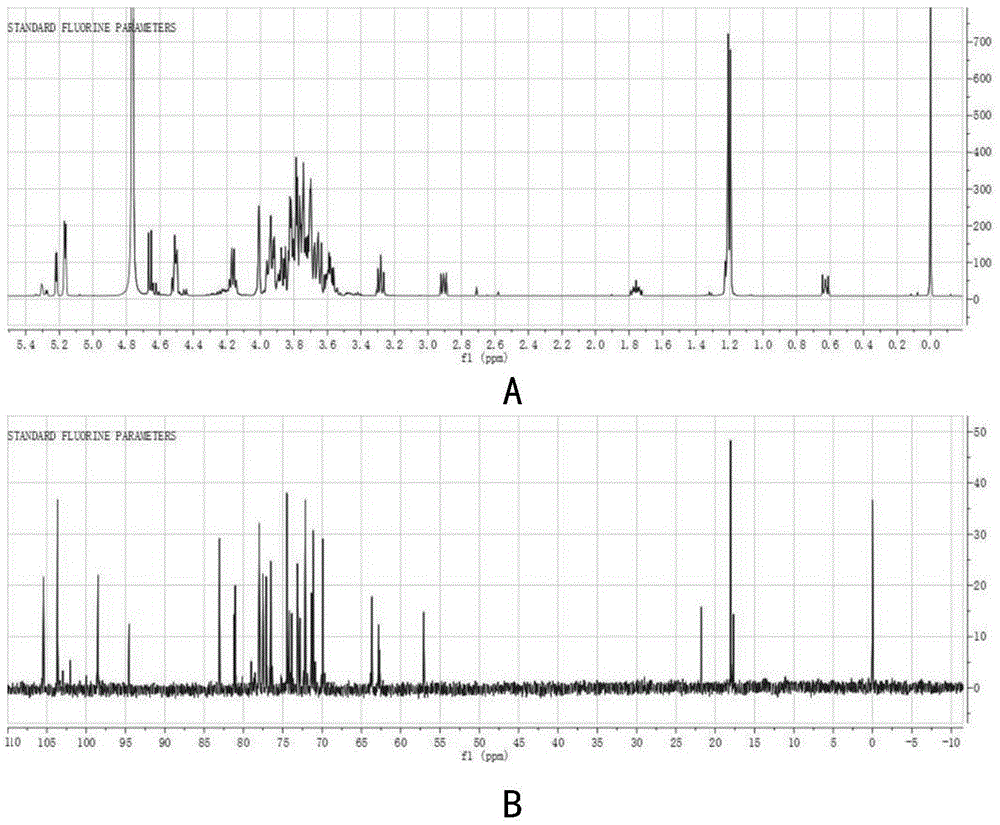
图10为3’-岩藻糖基乳糖nmr一级1h谱(a)和13c谱(b)图。
图11为pbfuc转糖苷活性的最适温度(a)、最适ph(b)、最适加酶量(c)、最适反应时间(d)和最适受体浓度(e)。
图12为以3’-岩藻糖基乳糖唯一碳源培养德氏乳杆菌nrrlb-548(a)、干酪乳杆菌nrrlb-1922(b)、干酪乳杆菌as.1.2435(c)和长双歧杆菌nrrlb-41409(d)的生长曲线。
图13为以3’-岩藻糖基乳糖唯一碳源培养大肠杆菌atcc11775(a)、鼠伤寒沙门氏菌as1.1552(b)、单增李斯特菌cicc21635(c)和金黄色葡萄球菌as1.1861(d)的生长曲线。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:重组a-l-岩藻糖苷酶编码基因表达质粒的构建
1、提取地杆菌(pedobactersp.)的基因组dna并以其作为模板,以人工合成的简并引物fudp-f:5′-acnacnaarcaycaygayggntty-3′和fudp-r:5′-rttnacnarcatrttnccncc-3′为引物,进行梯度pcr扩增(退火温度为40℃~60℃),以1%的琼脂糖凝胶电泳对扩增产物进行检测,得到约700bp的保守序列,结果如图1。
梯度pcr扩增体系为:10×labuffer5.0μl,dntpmix(2.5mmol/1)4.0μl,fudp-f/r(10pmol/μl)各8.0μl,基因组dna1.0μl,lataq(5.0u/pl)0.5μl,ddh2oupto50.0μl;梯度pcr扩增程序为:95℃预变性3min;95℃变性30s,40-60℃退火30s,72℃延伸40s,34个循环;72℃5min。
2、将扩增得到的保守序列连接pmd19-t载体上,经测序得到保守序列的核苷酸序列。
3、根据得到保守序列的核苷酸序列,采用tail-pcr方法扩增基因上游5′端部分未知序列及下游3′端部分未知序列,分别设计基因上游与下游三条特异性引物对sp1(包括fsp1和rsp1),sp2(包括fsp2和rsp2),sp3(包括fsp3和rsp3)。引物为嵌套式,sp2引物对位于sp1的内侧,而sp3引物对位于sp2的内侧,引物对sp1与sp2之间,sp2与sp3之间的距离为200bp左右。同时,根据高效热不对称性交错pcr(hitail-pcr)方法,应用四条lad引物(lad1、lad2、lad3和lad4)及一条嵌套的特异性引物ac通过三轮pcr扩增已知序列片段的侧翼序列。以地杆菌(pedobactersp.)基因组dna为模板,进行第一轮(taili)pcr扩增。taili的pcr产物适当稀释后作为第二轮(tailii)pcr扩增反应的模板,tailii的pcr产物适当稀释后作为第三轮(tailiii)pcr扩增反应的模板,最终得到hitail-pcr片段。tailii与tailiii使用相同的pcr扩增参数。设计的引物序列如表1所示,hitail-pcr反应条件如表2所示。
表1引物序列
表2hitail-pcr反应条件
注:pcrproducta表示上一轮的扩增产物。
4、将hitail-pcr片段通过ncbi数据库orf项目查询编码蛋白的开放阅读框(atg启始,taa或tga终止),并将多个编码蛋白序列在blast项目进行序列比对分析,从中选择一个与已报道α-l-岩藻糖苷酶同源性较高,同时新颖性较好的基因序列进行克隆表达。
5、根据扩增得到的hitail-pcr片段的编码序列设计引物p1:5′-ccggaattccaggattacacacctacagccgc-3′(下划线为限制性内切酶ecori的酶切位点)和p2:5′-ataagaatgcggccgcctatccaatctccaaaacaatcacctg-3′(下划线为限制性内切酶noti的酶切位点),并进行pcr扩增,1%的琼脂糖凝胶电泳对扩增产物进行检测,结果如图2,得到如seqidno.1的1294bp的dna片段。
反应程序为:95℃预变性5min;95℃变性20s,58℃退火20s,72℃延伸30s,35个循环;72℃延伸10min。
6、通过胶回收试剂盒(axygen,america)回收目的片段,并使用限制性内切酶ecori和noti双酶切dna片段,并进行清洁回收酶切产物。同时,用限制性内切酶ecori和noti双酶切载体pet-28a(+)(novagen公司产品,产品目录号为69864-3cn),回收约5300bp的载体片段。
7、将酶切产物与载体片段连接,转化大肠杆菌dh5α得到重组质粒pet-28a(+)-pbfuc。
根据测序结果,对重组质粒pet-28a(+)-pbfuc进行结构描述如下:将载体pet-28a(+)的ecori和noti限制性酶切位点之间的dna小片段替换为核苷酸序列是seqidno.1第10-1278位所示的dna分子,编码seqidno.3的蛋白质。重组质粒pet-28a(+)-pbfuc中,seqidno.1第10-1278位所示的dna分子与载体上的包含his-tag标签(由6个组氨酸残基组成)的编码序列(seqidno.2第1-108)在内的dna分子融合形成seqidno.2的dna分子,最终表达的蛋白为seqidno.4的融合蛋白。
进一步将seqidno.3的蛋白质与pdb数据库中已知结构蛋白序列进行比对,得到seqidno.3的蛋白质与gh29家族的α-l-岩藻糖苷酶的多重序列比对图。结果发现seqidno.3的蛋白质与paenibacillusthiaminolyticus来源的gh29家族α-l-岩藻糖苷酶(pdb登录号:6gn6)序列相似度最高(36.41%),其次为多形拟杆菌(bacteroidesthetaiotaomicron)来源gh29家族α-l-岩藻糖苷酶(btfuc2970,pdb:2wvt,29.6%)。另外,又将seqidno.3的蛋白质与uniprotkb/swiss-prot(swissprot)数据库蛋白序列进行比对,发现seqidno.3的蛋白质与来源于人(homosapiens)的gh29家族α-l-岩藻糖苷酶(登录号:q9bty2)相似性为30.54%。其次为另一个来源于人(homosapiens)的gh29家族α-l-岩藻糖苷酶(31.28%,登录号:p04066)和一个来源于食蟹猕猴(macacafascicularis)的α-l-岩藻糖苷酶(31.08%,登录号:q60hf8)。而与其他蛋白相似度较低(见图3)。
通过blast项目对seqidno.3的蛋白质进行比对分析,结果表明该蛋白与已报道的gh29家族的α-l-岩藻糖苷酶同源性最高,因此,初步将其假定为gh29家族的α-l-岩藻糖苷酶,即将seqidno.3的蛋白质命名为α-l-岩藻糖苷酶(pbfuc),其编码基因为seqidno.1第10-1278位所示,命名为α-l-岩藻糖苷酶基因(pbfuc基因);将seqidno.3的pbfuc的n端连接mgsshhhhhhssglvprgshmasmtggqqmgrgsef得到的seqidno.4的融合蛋白(命名为重组α-l-岩藻糖苷酶,即pbfuc-his),其编码基因为seqidno.2所示,命名为重组α-l-岩藻糖苷酶基因,即pbfuc-his基因。
实施例2:重组a-l-岩藻糖苷酶基因的表达
一、重组菌株的构建及重组α-l-岩藻糖苷酶的表达
将重组质粒pet-28a(+)-pbfuc转化至大肠杆菌bl21(de3)得到重组菌,将该重组菌命名为bl21(de3)-pet-28a(+)-pbfuc。将bl21(de3)-pet-28a(+)-pbfuc接入lb液体培养基中进行种子液培养,培养基含卡那霉素(50μgml-1),种子液接种量为1.5%(w/v),固态培养基为含琼脂的lb固体平板。从固态培养基平板上挑取阳性转化子到液体培养基中,37℃培养12h,以1%的接种量转接到200mllb培养基中,37℃培养,当培养液od600达到0.6-0.8时,加入iptg(以加iptg作为实验组,以不加iptg为对照组)至终浓度1mmoll-1,于20℃诱导16h,离心收集细胞。然后将细胞重悬于缓冲液(20mmoll-1ph8.0tris-hcl缓冲液,0.5moll-1nacl,20mmoll-1咪唑)中,超声破壁离心取上清液即为粗酶液。
聚丙烯酰胺凝胶电泳(sds-page)显示不加iptg的对照组得到的粗酶液无目的蛋白表达,而加iptg的实验组得到的粗酶液中有较高的目的蛋白表达(图4)。进一步通过实验测定实验组粗酶液具有水解pnp-fuc的能力,表明实验组具有较高的α-l-岩藻糖苷酶活性(表3中所示粗酶液有α-l-岩藻糖苷酶活性),但对照组完全没有活性。
二、重组α-l-岩藻糖苷酶的纯化
基于pet-28a(+)质粒中含有编码his-tag标签蛋白的序列,选择使用ni-ida亲和柱纯化重组蛋白。先用平衡缓冲液以1.0mlmin-1流速(20mmoll-1ph8.0tris-hcl缓冲液,0.5moll-1nacl,20mmoll-1咪唑)洗脱10个柱体积(5-10个柱体积均可);将上述步骤一中粗酶液以0.5mlmin-1流速上样;再用平衡缓冲液以1.0mlmin-1流速洗脱至od280小于0.05,洗去杂蛋白;最后用洗脱液乙(20mmoll-1ph8.0tris-hcl缓冲液,0.5moll-1nacl,100mmoll-1咪唑)洗脱,收集洗脱液乙过柱后的溶液,即为纯化的重组蛋白液即为纯酶液。
将纯酶液用sds-page法(laemmliuk.1970.cleavageofstructuralproteinsduringtheassemblyoftheheadofbacteriophaget4.nature227:680-685)检测蛋白纯度,结果如图5所示,其中m为低分子量标准蛋白质;1为粗酶液;2为纯酶液。结果表明,纯酶液得到明显的单一条带,分子量大小为50kda,比酶活为26.3u/ml。重组α-l-岩藻糖苷酶纯化结果见表3。其中蛋白含量测定参照lowry等(lowryoh,rosebroughnj,farral,randallrj.1951.proteinmeasurementwiththefolinphenolreagent.jbiolchem193:265-275)的方法,以牛血清白蛋白作为标准蛋白,酶活力测定方法同下述实施例3中步骤一。
表3地杆菌α-l-岩藻糖苷酶(pbfuc)的纯化表
a代表酶活测定条件:5mmpnp-fuc为底物,在50mmcitrate缓冲液ph5.0、35℃条件下反应20min。
b代表蛋白浓度使用lowry法测定。
实施例3:重组a-l-岩藻糖苷酶(pbfuc)的酶学性质
一、pbfuc酶活力的定义及测定方法
α-l-岩藻糖苷酶活力测定参考janet等的方法(janetetal.,α-fucosidaseswithdifferentsubstratespecificitiesfromtwospeciesoffusarium.applmicrobiolbiotechnol,2013,97:5371-5380.)。反应体系加入100μl10mmpnp-fuc,100μl0.05mph5.0柠檬酸-柠檬酸三钠缓冲液,10μl适当稀释的酶液,在35℃反应20min,最后加入200μlna2co3(1m)终止反应并震荡均匀。取200μl加入96孔板中,在405nm测吸光值。pnp标准品作标准曲线。酶活力定义:每分钟催化pnp-fuc生成1μmolpnp所需要的酶量为一个酶活力单位(u)。
二、pbfuc的酶学性质
(一)pbfuc的最适反应ph及ph稳定性
将pbfuc分别用不同ph值的缓冲体系稀释(citrate,3.0-6.0;pb,6.0-8.0;tris-hcl,6.0-9.0;ches,8.0-10.0),然后在35℃条件下测定α-l-岩藻糖苷酶的酶活力,以酶活力最高点作为100%作图。
pbfucph稳定性测定:使用以上不同ph值的缓冲液和其他两种缓冲液(caps,10.0-11.0;na2hpo4-naoh,11.0-12.0)稀释酶液,将稀释好的酶液在25℃水浴锅中分别处理30min,然后迅速将样品置于冰水浴中冷却30min。处理完毕后,在最适温度下测定残余酶活力,以未经处理的酶液作为对照,最后计算残余酶活力占未处理对照酶活力的百分比。
结果表明,pbfuc的最适ph为5.0(见图6中a),在ph4.0-11.0范围内保持稳定,残余酶活大于80%,表现出良好的ph稳定性(见图6中b)。
(二)最适反应温度、温度稳定性和半寿期
将pbfuc稀释适当倍数于50mmoll-1ph5.0的citrate缓冲液中,然后分别在20-50℃不同温度下按照标准方法测定重组岩藻糖苷酶的酶活力。以酶活力最高点作为100%作图。
pbfuc温度稳定性测定:用50mmoll-1ph5.0的柠檬酸-柠檬酸三钠将纯酶液稀释适当倍数分别在不同的温度下处理30min,然后置于冰水浴中冷却30min,最后按照标准方法测定残余酶活力,以未经处理酶的酶活力作为对照。
半寿期测定:将酶液用50mmoll-1ph5.0的citrate缓冲液适当稀释后,分别置于35,40,45℃下处理0-4h,不同时间间隔取样。以未经处理的酶液作为对照,测定残余酶活力,最后计算残余酶活力占对照酶活力的百分比,计算酶在不同温度下酶活衰变至50%的时间。
结果表明,pbfuc最适温度为35℃(见图7中a),在40℃以下保持相对稳定,酶活能保持90%以上,超过45℃后酶活力迅速下降(见图7中b)。该酶在35℃、40℃和45℃时的半寿期分别是555、51和2.8min(见图7中c)。
实施例4:pbfuc在制备3’-岩藻糖基乳糖中的应用
一、3’-岩藻糖基乳糖的合成及定量
合成条件如下:以pnp-fuc作为岩藻糖基供体,以乳糖为受体,加入适量重组α-l-岩藻糖苷酶,在适当ph的缓冲液中反应适当时间。反应液煮沸10min灭活,经0.22μm微孔滤膜过滤,利用hplc进行分析。定量方法参考birgitte等的方法(birgitteetal.,substratespecificityandtransfucosylationactivityofgh29a-l-fucosidasesforenzymaticproductionofhumanmilkoligosaccharides[j]newbiotechnology,2018,41:34-45.)。产物的定量以纯化后的3’-岩藻糖基乳糖为标准品,建立3’-岩藻糖基乳糖浓度与相应hplc信号峰面积之间的关系曲线。根据标准曲线计算产物中3’-岩藻糖基乳糖的浓度。
产物的摩尔转化率以pnp-fuc初始浓度为100%计算,公式如下:
摩尔转化率(%)=产物物质的量/糖基供体物质的量×100%=岩藻糖基乳糖(mm)/pnp-fuc(mm)×100%
hplc定量分析条件如下:安捷伦1260高相液相色谱仪,配套rid检测器。色谱条件:shodex-ks-802凝胶色谱柱,流动相为超纯水,流速为0.8ml/min,柱温65℃,rid检测器温度35℃。
结果表明,反应体系中加入重组α-l-岩藻糖苷酶(pbfuc)3h后,经hplc分析发现产物中生成了比岩藻糖(单糖)和乳糖(二糖)聚合度更高的糖(图8),表明pbfuc能够以pnp-fuc和乳糖为底物合成聚合度更高的转糖苷产物,证明该酶具有转糖苷活性,进一步对该转糖苷产物进行分离纯化、分子量测定和结构鉴定。
二、3’-岩藻糖基乳糖的纯化和结构鉴定
反应后的产物经真空减压浓缩,过阴阳离子树脂除盐和pnp,再经生物凝胶柱bio-gelp2柱(1.2cm*110cm,超纯水,流速为0.3ml/min),产物以1ml/管收集。收集的产物经tlc分析验证纯度(展层剂为正丁醇∶乙醇∶水=2∶1∶1,显色剂为甲醇∶硫酸=95∶5),冷冻干燥后的样品为白色粉末。
将样品溶解于纯水中,使用thermoscientifictmqexactivetm质谱仪,在esi离子源positive-ion模式下,采集样品的高分辨率一级质谱图,测定该转糖苷产物的分子量。
将样品溶解于d2o中并转移到核磁专用试管中,加入dss(3-(三甲基硅基)-1-丙磺酸钠)作为内标,使用500mhzvarianvnmrsystemtm设备,在298k温度条件下采集信号。在499.9mhz共振频率下获得样品的一维1h谱,在125.7mhz共振频率获得样品的一维13c谱,最终获得以dss的信号为参考的化学位移。
结果表明,纯化后的产物在一级高分辨率质谱图中在质荷比(m/z)[m+na]+为511.1611处呈现单一离子峰(图9),表明该产物的分子量为488.1611,这与岩藻糖基乳糖的分子量(488.44)一致,表明该寡糖为岩藻糖基乳糖。
进一步通过nmr测定该岩藻糖基乳糖的结构,由一维1h及13c图谱可获得该化合物1h质子的化学位移(见图10中a)和13c的化学位移(见图10中b)。经数据比对,该化合物与alcaligenessp.来源的α-l-岩藻糖苷酶转糖苷产物一致(murataetal.,.enzymaticsynthesisofalpha-l-fucosyl-n-acetyllac-tosaminesand3′-o-alpha-l-fucosyllactoseutilizingalpha-l-fucosidases.carbohydrateresearch.1999,320:192-199.),表明该化合物为3’-岩藻糖基乳糖(fucα1,3-galβ1,4-glu)。
三、3’-岩藻糖基乳糖的制备
pbfuc制备3’-岩藻糖基乳糖,首先对反应条件包括温度、ph、加酶量、反应时间及乳糖浓度进行优化。确定了3’-岩藻糖基乳糖的最适制备条件:最适温度为35℃(图11中a),最适ph为8.5(图11中b),最适加酶量为0.5u/ml(图11中c),最适反应时间为3h(图11中d),受体最适浓度为700mm(图11中e)。
在以上条件下制备3’-岩藻糖基乳糖,经hplc定量,产物的摩尔转化率(摩尔转化率(%)=产物物质的量/糖基供体物质的量×100%=岩藻糖基乳糖(mm)/pnp-fuc(mm)×100%)为85%(图11中e)。将以上反应产物经真空减压浓缩,过阴阳离子树脂除盐和pnp,再经生物凝胶柱bio-gelp2柱。收集的产物经薄层层析法(tlc)检验纯度,经冷冻干燥后,最终获得样品为白色粉末。
实施例5:3’-岩藻糖基乳糖的益生活性
分别用添加1%3’-岩藻糖基乳糖的mrs培养基(培养双歧杆菌时需添加0.5g/l的l-半胱氨酸盐)培养十五株益生菌(鼠李糖乳杆菌as1.2466,德氏乳杆菌nrrlb-548,干酪乳杆菌nrrlb-1922,嗜酸乳杆菌nrrlb-4495,短乳杆菌nrrlb-4527,棒状乳杆菌nrrlb-4391,罗伊氏乳杆菌cicc6132,干酪乳杆菌as.1.2435,德氏乳杆菌as.1.2132,两歧双歧杆菌nrrlb-41410,短双歧杆菌nrrlb-41408,婴儿双歧杆菌nrrlb-41661,长双歧杆菌nrrlb-41409,青春双歧杆菌atcc15703)。以商业益生元低聚果糖(fos)为阳性对照。分别用添加1%3’-岩藻糖基乳糖(3’-fl)的m9培养基培养四株有害菌(大肠杆菌atcc11775、单增李斯特菌cicc21635、鼠伤寒沙门氏菌as1.1552和金黄色葡萄球菌as1.1861),以商业益生元低聚果糖(fos)为阳性对照。
使用酶标仪分别检测培养12,24,48和72h后的生长量(od595nm),计算补充3’-岩藻糖基乳糖后菌体的增长量与无糖组od595的差值(δod595)。当δod595>0.1,则认为3’-岩藻糖基乳糖对该菌有增殖作用,当δod595<0.1时,则认为3’-岩藻糖基乳糖对该菌增殖效果不明显。
结果表明,与无糖组相比,合成的3’-岩藻糖基乳糖在体外可显著促进德氏乳杆菌nrrlb-548(l.delbrueckiisubsp.bulgaricusnrrlb-548,burgos-rubioetal.,kineticstudyoftheconversionofdifferentsubstratestolacticacidusinglactobacillusbulgaricus.biotechnol.prog.2000,16,305-314.)、干酪乳杆菌as1.2435(l.caseisubsp.caseias1.2435,zhangetal.,d-tagatoseproductionbylactococcuslactisnz9000cellsharboringlactobacillusplantaruml-arabinoseisomerase.indianjournalofpharmaceuticaleducationandresearch.2017,51(2):288-294.董银苹,等.,乳酸杆菌及嗜热链球菌脉冲场凝胶电泳分子分型方法建立及应用.中华预防医学杂志,2011,45(12):1086-1089.)、干酪乳杆菌nrrlb-1922(l.caseisubsp.caseinrrlb-1922,mani-
而3’-岩藻糖基乳糖对另外十一株益生菌无明显促进增殖的作用(δod595<0.1),包括鼠李糖乳杆菌as1.2466、嗜酸乳杆菌nrrlb-4495、德氏乳杆菌as.1.2132、短乳杆菌nrrlb-4527、罗伊氏乳杆菌cicc6132、婴儿双歧杆菌nrrlb-41661、棒状乳杆菌nrrlb-4391、短双歧杆菌nrrlb-41408、乳双歧杆菌bb-12,两歧双歧杆菌nrrlb-41410和青春双歧杆菌atcc15703(见表5)。
综上所述,pbfuc可高效合成3’-岩藻糖基乳糖,在寡糖合成中具有良好的应用前景。3’岩藻糖基乳糖对四株益生菌的增殖效果优于低聚果糖,而对四株有害菌的增殖作用低于低聚果糖,表现出优良的益生活性。
表4以3’-岩藻糖基乳糖(3’fl)为唯一碳源发酵四株益生菌在不同时间的生长量(od595)
表5以3’-岩藻糖基乳糖(3’fl)为唯一碳源培养四株有害菌在不同时间的生长量(od595)
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
sequencelisting
<110>中国农业大学
<120>α-l-岩藻糖苷酶及其相关生物材料与应用
<130>gncfy191297
<160>4
<170>patentinversion3.5
<210>1
<211>1294
<212>dna
<213>地杆菌(pedobactersp.)
<400>1
ccggaattccaggattacacacctacagccgctaatttaaaacaaagagcatggtttaat60
gatgcacggtttgggttatttatccactggggaccttttagcataccaggcagtggcgaa120
tgggtaatgaacgatagaaagctgactgttcataattataccaaccttaaagattttttt180
aaccctgttgagtttaatgcggaacaatgggtaactatggcaaagaatgccggtatgaaa240
tacattacgttaattaccaggcaccatgatggctttagcatgtgggacactaaatattct300
gatttcaacattatgaataccccatataaaaaagatattgtaaaaatgatggctgaagaa360
tgccataagcaaggtataccattatacttatattactccttactagattggcgaagggaa420
gattatccgcatgaaactggccgtactggacaacattcaggcaggacaggtaaaggcgat480
tatgccagttatttgcagtttatgaaaaaccagttgaccgagttattgactaattacggc540
gaaataggcggcatctggttcgatggacattgggatcaaactgaaccggaaggatcaaaa600
gacagaacctcgcggatagattggaaatataatgagatttatggtttgatccacaaattg660
caaccacagtgtatgattggtaataaccaccacttaactccatttgcaggtgaagatttc720
cagatgtttgaacgcgatcttcccggagaaaataagtcaggtttaagttttcagaaagca780
tcagataagctcccattagaaacctgtgaaaccatttcaaactcctggggatataatctg840
agtgatacctattacaaatcaaataaagaactggttcatatgctggttaaagcagcaagc900
ttaggttccaatcttttactgaacattggtccgatgccaagtggtaaaatccagccggag960
tttcaggatcgtttggcgggtttgggcaattggcttaaaatttacggcgaaagcatttac1020
ggtacaaaggcaggatttattaaaccacaggcctggggaagcattacccaaaaagataat1080
agaatttatatccatattgtagatggaaaaacgacatctcttgagctggagaatgtaccg1140
gtaaagaaaattaaaaaggcatacttactaaaagataaaagccaggtaaattttaccttt1200
aaaaaagcaaaattatcaattaccagcgcagcaagcgcttcagaaccagatcaggtgatt1260
gttttggagattggataggcggccgcattcttat1294
<210>2
<211>1377
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgggcagcagccatcatcatcatcatcacagcagcggcctggtgccgcgcggcagccat60
atggctagcatgactggtggacagcaaatgggtcgcggatccgaattccaggattacaca120
cctacagccgctaatttaaaacaaagagcatggtttaatgatgcacggtttgggttattt180
atccactggggaccttttagcataccaggcagtggcgaatgggtaatgaacgatagaaag240
ctgactgttcataattataccaaccttaaagatttttttaaccctgttgagtttaatgcg300
gaacaatgggtaactatggcaaagaatgccggtatgaaatacattacgttaattaccagg360
caccatgatggctttagcatgtgggacactaaatattctgatttcaacattatgaatacc420
ccatataaaaaagatattgtaaaaatgatggctgaagaatgccataagcaaggtatacca480
ttatacttatattactccttactagattggcgaagggaagattatccgcatgaaactggc540
cgtactggacaacattcaggcaggacaggtaaaggcgattatgccagttatttgcagttt600
atgaaaaaccagttgaccgagttattgactaattacggcgaaataggcggcatctggttc660
gatggacattgggatcaaactgaaccggaaggatcaaaagacagaacctcgcggatagat720
tggaaatataatgagatttatggtttgatccacaaattgcaaccacagtgtatgattggt780
aataaccaccacttaactccatttgcaggtgaagatttccagatgtttgaacgcgatctt840
cccggagaaaataagtcaggtttaagttttcagaaagcatcagataagctcccattagaa900
acctgtgaaaccatttcaaactcctggggatataatctgagtgatacctattacaaatca960
aataaagaactggttcatatgctggttaaagcagcaagcttaggttccaatcttttactg1020
aacattggtccgatgccaagtggtaaaatccagccggagtttcaggatcgtttggcgggt1080
ttgggcaattggcttaaaatttacggcgaaagcatttacggtacaaaggcaggatttatt1140
aaaccacaggcctggggaagcattacccaaaaagataatagaatttatatccatattgta1200
gatggaaaaacgacatctcttgagctggagaatgtaccggtaaagaaaattaaaaaggca1260
tacttactaaaagataaaagccaggtaaattttacctttaaaaaagcaaaattatcaatt1320
accagcgcagcaagcgcttcagaaccagatcaggtgattgttttggagattggatag1377
<210>3
<211>422
<212>prt
<213>地杆菌(pedobactersp.)
<400>3
glnasptyrthrprothralaalaasnleulysglnargalatrpphe
151015
asnaspalaargpheglyleupheilehistrpglypropheserile
202530
proglyserglyglutrpvalmetasnasparglysleuthrvalhis
354045
asntyrthrasnleulysaspphepheasnprovalglupheasnala
505560
gluglntrpvalthrmetalalysasnalaglymetlystyrilethr
65707580
leuilethrarghishisaspglyphesermettrpaspthrlystyr
859095
serasppheasnilemetasnthrprotyrlyslysaspilevallys
100105110
metmetalagluglucyshislysglnglyileproleutyrleutyr
115120125
tyrserleuleuasptrpargarggluasptyrprohisgluthrgly
130135140
argthrglyglnhisserglyargthrglylysglyasptyralaser
145150155160
tyrleuglnphemetlysasnglnleuthrgluleuleuthrasntyr
165170175
glygluileglyglyiletrppheaspglyhistrpaspglnthrglu
180185190
progluglyserlysaspargthrserargileasptrplystyrasn
195200205
gluiletyrglyleuilehislysleuglnproglncysmetilegly
210215220
asnasnhishisleuthrprophealaglygluasppheglnmetphe
225230235240
gluargaspleuproglygluasnlysserglyleuserpheglnlys
245250255
alaserasplysleuproleugluthrcysgluthrileserasnser
260265270
trpglytyrasnleuseraspthrtyrtyrlysserasnlysgluleu
275280285
valhismetleuvallysalaalaserleuglyserasnleuleuleu
290295300
asnileglyprometproserglylysileglnproglupheglnasp
305310315320
argleualaglyleuglyasntrpleulysiletyrglygluserile
325330335
tyrglythrlysalaglypheilelysproglnalatrpglyserile
340345350
thrglnlysaspasnargiletyrilehisilevalaspglylysthr
355360365
thrserleugluleugluasnvalprovallyslysilelyslysala
370375380
tyrleuleulysasplysserglnvalasnphethrphelyslysala
385390395400
lysleuserilethrseralaalaseralasergluproaspglnval
405410415
ilevalleugluilegly
420
<210>4
<211>458
<212>prt
<213>人工序列(artificialsequence)
<400>4
metglyserserhishishishishishisserserglyleuvalpro
151015
argglyserhismetalasermetthrglyglyglnglnmetglyarg
202530
glyserglupheglnasptyrthrprothralaalaasnleulysgln
354045
argalatrppheasnaspalaargpheglyleupheilehistrpgly
505560
propheserileproglyserglyglutrpvalmetasnasparglys
65707580
leuthrvalhisasntyrthrasnleulysaspphepheasnproval
859095
glupheasnalagluglntrpvalthrmetalalysasnalaglymet
100105110
lystyrilethrleuilethrarghishisaspglyphesermettrp
115120125
aspthrlystyrserasppheasnilemetasnthrprotyrlyslys
130135140
aspilevallysmetmetalagluglucyshislysglnglyilepro
145150155160
leutyrleutyrtyrserleuleuasptrpargarggluasptyrpro
165170175
hisgluthrglyargthrglyglnhisserglyargthrglylysgly
180185190
asptyralasertyrleuglnphemetlysasnglnleuthrgluleu
195200205
leuthrasntyrglygluileglyglyiletrppheaspglyhistrp
210215220
aspglnthrgluprogluglyserlysaspargthrserargileasp
225230235240
trplystyrasngluiletyrglyleuilehislysleuglnprogln
245250255
cysmetileglyasnasnhishisleuthrprophealaglygluasp
260265270
pheglnmetphegluargaspleuproglygluasnlysserglyleu
275280285
serpheglnlysalaserasplysleuproleugluthrcysgluthr
290295300
ileserasnsertrpglytyrasnleuseraspthrtyrtyrlysser
305310315320
asnlysgluleuvalhismetleuvallysalaalaserleuglyser
325330335
asnleuleuleuasnileglyprometproserglylysileglnpro
340345350
glupheglnaspargleualaglyleuglyasntrpleulysiletyr
355360365
glygluseriletyrglythrlysalaglypheilelysproglnala
370375380
trpglyserilethrglnlysaspasnargiletyrilehisileval
385390395400
aspglylysthrthrserleugluleugluasnvalprovallyslys
405410415
ilelyslysalatyrleuleulysasplysserglnvalasnphethr
420425430
phelyslysalalysleuserilethrseralaalaseralaserglu
435440445
proaspglnvalilevalleugluilegly
450455
- 还没有人留言评论。精彩留言会获得点赞!