基于在体基因敲除的视网膜色素变性猕猴模型构建方法与流程
本发明涉及分子生物学领域。具体而言,本发明涉及通过基因编辑技术进行基因敲除来实现动物疾病造模。
背景技术:
自2013年麻省理工学院张锋教授研究并开发crispr/cas9基因编辑技术以来(pmid:24157548),此基因编辑技术被广泛应用于哺乳动物基因改造,其中便包括遗传性疾病动物造模。视网膜色素变性(rp)是最广泛的遗传性致盲疾病之一,其致病基因繁多,单基因突变致病也占据很大的比例,如rho、ush2a、rp1、prpf31等基因的突变都会导致显性或隐性rp发病(pmid:23701314)。目前对于rp的研究所使用的动物集中于啮齿类动物疾病模型,如krzysztofpalczewski构建的p23h基因敲入小鼠模型等(pmid:21224384)。然而小鼠与人类进化相距较远,存在明显的视网膜感光细胞分布及生存能力差异,不能很好地模拟人类rp疾病。这使人自然想到利用非人灵长类动物构建rp动物模型。虽然如此,由于极长的繁殖周期及产子数量极少,构建转基因猕猴rp模型仍然存在极大的限制,大量广泛地使用此类猕猴遗传rp模型更是不切实际,严重阻碍rp疾病研究及治疗的发展。那么,在较短的时间和较少的实验成本下,创造能很好模拟人类遗传性视网膜色素变性的猕猴动物模型,成为一个亟待解决的问题。利用crispr基因编辑技术,在成年猕猴感光细胞中实现在体基因敲除,有希望快速制造大量可用的rp模型动物,用于以后rp疾病的病理机制及治疗开发研究。
技术实现要素:
本申请发明人通过长期研究解决了本领域中存在的问题。以最广泛的rp致病基因rho为例,设计并实现了利用crispr基因编辑系统与aav转导系统,直接在成年猕猴视网膜感光细胞中敲除rho基因,以模拟遗传性rho突变引起的视网膜变性退化,在3-6个月的时间构建猕猴视网膜色素变性(rp)动物模型。此模型可以推动人类rp疾病的研究与治疗。采用本发明的方案,同样适用其它rp相关致病基因(如ush2a、rp1、prpf31)的敲除进而构建猕猴视网膜色素变性(rp)动物模型。具体而言,本发明通过如下技术方案解决了本领域的技术问题。
1.一种敲除,优选在体敲除哺乳动物感光细胞中视网膜色素变性致病基因的方法,其包括将一个或多个,例如3个靶向所述致病基因的sgrna的编码序列,优选seqidno:3-5所示的编码序列和crispr酶的编码序列构建在空的病毒表达载体中,用构建的病毒表达载体转染宿主细胞并表达和包装为活性病毒,并用所述活性病毒感染所述感光细胞,从而实现所述感光细胞中所述视网膜色素变性致病基因的敲除,其中所述sgrna的编码序列的每一个与所述致病基因的序列互补;所述视网膜色素变性致病基因为例如,rho、ush2a、rp1、prpf31基因,优选rho基因;所述哺乳动物优选为灵长类动物,更优选猕猴科,还更优选猕猴属,最优选猕猴种;所述病毒表达载体为例如腺相关病毒、腺病毒或慢病毒的表达载体;所述crispr酶为例如cas9或sacas9。
2.项目1所述的方法,其中所述空的病毒表达载体为腺相关病毒病毒载体,并且将所述腺相关病毒表达载体和辅助载体转染到所述宿主细胞中并表达和包装为腺相关病毒,所述腺相关病毒表达载体优选为衍生自aav6的腺相关病毒,更优选为shh10。
3.项目1-2任一项所述的方法,其中所述宿主细胞为293t细胞。
4.一种病毒表达载体,其通过将一个或多个,例如3个靶向视网膜色素变性致病基因,例如,rho、ush2a、rp1、prpf31基因的sgrna的编码序列和crispr酶的编码序列构建在空的病毒表达载体中得到,其中所述sgrna的编码序列的每一个与所述致病基因的序列互补;所述病毒表达载体为例如腺相关病毒、腺病毒或慢病毒的表达载体;所述crispr酶为例如cas9或sacas9。
5.一种病毒,其能够敲除哺乳动物感光细胞中视网膜色素变性致病基因,例如,rho、ush2a、rp1、prpf31基因,其中所述病毒通过将项目4所述的病毒表达载体在宿主细胞中表达并包装得到。
6.项目5所述的病毒,其中所述空的病毒表达载体为腺相关病毒病毒载体,并且将所述腺相关病毒表达载体和辅助载体转染到所述宿主细胞中并表达和包装为腺相关病毒,所述腺相关病毒表达载体优选为衍生自aav6的腺相关病毒,更优选为shh10。
7.项目5-6任一项所述的病毒,其中所述宿主细胞为293t细胞。
8.一种组合物,其包含项目5-7任一项所述的病毒和药学上可接受的载体。
9.一种试剂盒,其包含项目5-7任一项所述的病毒或项目8所述的组合物。
10.项目5-7任一项所述的病毒或项目8所述的组合物或项目9所述的试剂盒在感染哺乳动物感光细胞以敲除,例如在体敲除所述哺乳动物感光细胞中视网膜色素变性致病基因中的用途,其中所述视网膜色素变性致病基因为例如,rho、ush2a、rp1、prpf31基因;所述哺乳动物优选为灵长类动物,更优选猕猴科,还更优选猕猴属,最优选猕猴种。
11.项目5-7任一项所述的病毒或项目8所述的组合物或项目9所述的试剂盒在制备视网膜色素变性的哺乳动物模型中的用途,其中所述哺乳动物优选为非人灵长类动物,更优选猕猴科,还更优选猕猴属,最优选猕猴种。
附图说明
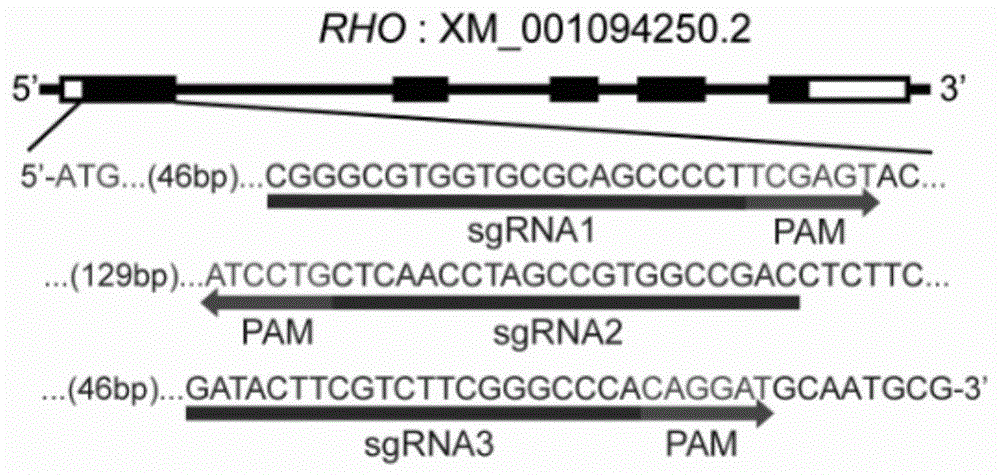
图1.靶向rho基因的sgrnas示意图。
图2.本文所用aav载体示意图。
图3.猕猴视网膜下腔注射示意图。
图4.在体基因编辑形成的indels。
图5.猕猴视网膜免疫荧光染色显微成像。
图6.猕猴视网膜在体光学相干断层扫描(oct)成像。
图7.猕猴视网膜感光细胞透射电子显微镜成像。
图8.猕猴视网膜体外视网膜电图记录。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
本发明为了解决了现有技术的问题。以最广泛的rp致病基因rho为例,设计并实现了利用crispr基因编辑系统与aav转导系统,直接在成年猕猴视网膜感光细胞中敲除rho基因,以模拟遗传性rho突变引起的视网膜变性退化,在3-6个月的时间构建猕猴视网膜色素变性(rp)动物模型。此模型可以推动人类rp疾病的研究与治疗。
具体技术内容为:
首先我们设计了三个靶向rho基因的sgrna,如图1所示,以高效在体敲除猕猴rho基因。
本发明采用sacas9,以使sacas9和sgrna可以构建在同一个表达载体中,此设计非本发明首创,为直接应用张锋px602质粒。(1)中所述三个sgrnas分别构建在px602载体u6启动子之后,如图2所述。三个aav载体被分别与shh10和phelper两个辅助质粒转染293t细胞,包装出三个高滴度的aav病毒(5e12/ml)。此aav病毒为核心产品,可以通过视网膜下腔注射高效感染感光细胞,并敲除rho基因。
(2)中所述病毒通过视网膜下腔注射方式直接用在成年猕猴眼中,三点注射,每点30-50ul。注射方式如图3所示。注射形成的病毒鼓泡可在3周以内完全恢复。
通过aav病毒转导crispr系统在成年猕猴视网膜感光细胞中在体敲除rho基因,可在3-6个月导致感光细胞退化,模拟人类视网膜色素变性(rp)表型,创造了一个基于在体基因敲除的视网膜色素变性猕猴模型。
综上所述,此技术发明包含两个方面。一,通过病毒转导系统,在成年猕猴感光细胞中实现在体基因敲除,上述以rho基因为例,但此技术并不局限于rho基因。二,在成年猕猴感光细胞中在体敲除rho基因,创造了一个能很好模拟人类rp疾病的猕猴rp动物模型,同样此技术可以类推到实现其他致病基因的rp疾病猕猴建模。
本文所述的sgrna的使用可以是单个或多个。cas9的使用不局限于sacas9,一切有核酸切割活性的crispr酶都可以被应用。crispr转导系统不局限于aav病毒,慢病毒,腺病毒等也可以被采用。aav是首要推荐的病毒。视网膜下腔注射不是唯一可以被采用的注射方式,如房水注射、静脉注射通过改造也可以被应用。
本文所述哺乳动物可以是任何哺乳动物,优选为灵长类动物,更优选猕猴科,还更优选猕猴属,最优选猕猴种。
本文所述宿主细胞是适合本文的表达载体表达的任何宿主细胞,如哺乳动物宿主细胞,例如,293t细胞。
在一些实施方案中,本发明提供了包含病毒和药学上可接受的载体的组合物。
在一些实施方案中,本发明提供了包含本文描述的病毒或组合物的试剂盒。
在一些实施方案中,本发明提供了所述本文描述的病毒、组合物或试剂盒在感染哺乳动物感光细胞以敲除,例如在体敲除所述哺乳动物感光细胞中视网膜色素变性致病基因中的用途,其中所述视网膜色素变性致病基因为例如,rho、ush2a、rp1、prpf31基因;所述哺乳动物优选为灵长类动物,更优选猕猴科,还更优选猕猴属,最优选猕猴种。
本文所述试剂盒包括容器和在容器上或与容器一起的标签或包装说明书。在一些实施方案中,适合的容器包括,例如,瓶子、小瓶、注射器等。所述容器可以由各种材料如玻璃或塑料制成。容器装有组合物,所述组合物包含本文所述的腺相关病毒。组合物中至少一种试剂是本文的载体。本发明的试剂盒还可以包括包装说明书,所述包装说明书指明所述组合物可以用于感染乳动物感光细胞以敲除,例如在体敲除所述哺乳动物感光细胞中视网膜色素变性致病基因或者制备视网膜色素变性的哺乳动物模型。所述试剂盒还可以包括其他容器,所述容器包含缓冲剂,如注射用水,磷酸盐缓冲盐水,葡萄糖溶液,还可以包括其他材料,如其他缓冲剂、稀释剂、滤器、针头和注射器。
本发明的优点和有益的技术效果
与背景技术中的啮齿类动物模型相比,本发明所采用的猕猴具有与人类更亲近的进化关系,具有黄斑结构,可以更好模拟人类rp疾病特征。
与背景技术中转基因猕猴动物模型相比,本发明所实现的在体基因敲除技术对猕猴没有选择性,任何普通猕猴都可以被使用,成本低廉,避免了长时间繁殖转基因猕猴的昂贵费用。由于猕猴产子周期长,产子率低,此发明可以快速(3-6个月,转基因猕猴需要3-5年的繁殖周期)获得大量可用的rp模型动物。
此外,此发明可以操作的基因不局限于rho基因,同样可以在视网膜感光细胞中在体敲除其他基因,模拟人类其他基因异常对rp疾病的影响。相较于其他动物模型,此发明只需对病毒载体中sgrnas进行替换即可,可以方便、快速地应用于其他基因敲除动物模型。
实施例
材料和试剂
本申请中所用的主要试剂和材料:
质粒一,其dna序列如seqidno:1所示。
质粒二,其dna序列如seqidno:2所示。
sgrna1,其编码dna序列为gcgggcgtggtgcgcagcccct(seqidno:3)。
sgrna2,其编码dna序列为gtcggccacggctaggttgag(seqidno:4)。
sgrna3,其编码dna序列为gatacttcgtcttcgggccca(seqidno:5)。
shh10质粒,其dna全序列如seqidno:6所示。
phelper质粒,其dna全序列如seqidno:7所示。
实验用猕猴来源于昆明动物研究所(论理号:smkx-2017023)。
体外erg记录仪器:电生理平台(scientifica),digidata1440a(axoncns),muticlamp700b(axoncns),实验用细胞培养基dmem(gibco),胎牛血清fbs(gibco),超声波细胞粉碎机(新芝,scientz-2d),病毒纯化用碘克沙醇(sigma),超速离心机l100-xp(beckman),超速离心管(beckman,344058),病毒浓缩用超滤管(amiconultra-15),光学相干断层扫描仪(海德堡),眼科手术用显微镜(六六),透射电子显微镜(hitachiht7700),激光共聚焦显微镜(leicasp8),冰冻切片仪(leica)。
实施例1.猕猴视网膜感光细胞在体基因转导
在该实施例中,以rho基因为例,我们设计了三个靶向猕猴rho基因的sgrnas,如图1所示,sgrna1-3具体序列分别为seqidno:3,seqidno:4,seqidno:5。随后,三个sgrnas被分别构建在图2质粒一aav载体中的u6启动子之后,使得后续包装的aav可以同时表达cas9基因编辑酶和sgrnas。此载体设计为改造自张锋px602质粒。具体为:addgene质粒#61593(px602)中的tbg启动子经xba1/age1酶切,替换为hsyn启动子,改造后的质粒如图2质粒一所示,其全载体序列为seqidno:1。以sgrna1为例,两个短dna序列caccgcgggcgtggtgcgcagcccct(seqidno:8)和aaacaggggctgcgcaccacgcccgc(seqidno:9)经退火后连接到bsa1消化后的质粒一中,构建成sacas9/sgrna1质粒,同样的方式可构建sacas9/sgrna2和sacas9/sgrna3。质粒二paav-gfp如图2所示,具体序列为seqidno:2,为一表达绿色荧光蛋白(gfp)的aav载体,其可以使被aav病毒感染的细胞发出绿色荧光,达到可视化的目的。质粒一或质粒二,分别与shh10(seqidno:6)和phelper(seqidno:7)组成三质粒病毒包装系统转染到hek293t细胞来产生相应的aav病毒,整个病毒包装及纯化方法可参照文献pmid:17406430。包含aav的细胞核经超声破碎释放出病毒粒子,随后用碘克沙醇密度梯度超速离心的方式(sw32转子,32000rpm,4h,18℃)纯化病毒,位于40%密度中的病毒被吸取,然后用amiconultra-15过滤器(millipore)进行浓缩,以最终获得滴度为5×1012个病毒基因组/ml的shh10aav病毒,用于后续感染猕猴视网膜感光细胞。病毒滴度测定方式为荧光定量pcr,所用引物序列为gfp:
gacaaccactacctgagcac(seqidno:10,正向引物)和
caggaccatgtgatcgcg(seqidno:11,反向引物);sacas9:
aactgaccaatctgaactccg(seqidno:12,正向引物)和
tctggttgtcgttggtgtg(seqidno:13,反向引物)。市场上有些公司可以生产高滴度高质量的aav病毒,亦可满足要求。
在实施例1中我们包装了shh10亚型aav病毒分别为aav-gfp和sacas9/sgrnas,并把aav-gfp,sacas9/sgrna1,sacas9/sgrna2,sacas9/sgrna3四个病毒混合在一起,通过视网膜下腔注射的方式,如图3所示,注射到成年猕猴视网膜下腔,特异感染感光细胞,并敲除rho基因。图3所示视网膜下腔注射具体方式为:成年猕猴通过肌肉注射氯胺酮(10mg/kg)和戊巴比妥钠(40mg/kg)麻醉,在手术期间通过静脉点滴异丙酚(10–12mg·kg-1·h-1)进行持续麻醉。我们在角膜巩膜边缘穿两个孔,以插入改良的汉密尔顿针(38g,40g)和照明光纤,同时在注射aav病毒前,对猕猴的眼睛进行了玻璃体切除术以降低眼压。对于单个注射位点,aav病毒注射量为30-50ul,在三周以内,注射鼓泡可以被完全吸收。
需要指出的是,aav-gfp仅为可视化工具,并不是本方法必需采用的病毒,sgrna的应用可以为单个或者多个,视网膜下腔注射形式不限,注射体积可多可少。
在一些实施例中,我们可以设计靶向某一基因的aav转导系统,即把靶向某一基因的sgrna构建在图2所示载体中,并生产出高滴度、可以实现高效感染猕猴视网膜感光细胞的aav病毒,通过在体注射的方式,实现视网膜感光细胞基因的在体敲除,sgrna数量不限,靶向基因不局限为rho。
实施例2.猕猴视网膜感光细胞rho敲除检测
在实施例2中,我们同实施例1一样,包装了aav病毒,并完成猕猴视网膜下腔注射,同时,我们在猕猴左眼注射了aav-gfp和sacas9,即此组病毒不含有sgrna,故不能实现靶向rho并敲除,称为对照病毒组;而右眼我们注射了aav-gfp和sacas9/sgrnas,此组病毒可有效靶向rho并实现敲除,我们称为实验病毒组。
猕猴注射三月后被牺牲取样,经手术分离,我们获得了猕猴视网膜样本,全视网膜基因组用基因组提取试剂盒(qiagen)提取出来,并利用引物cattcttgggtgggagcaga(seqidno:14)和caaggtagcgttcagagcca(seqidno:15)进行pcr(neb,q5)特异扩增出rho第一个外显子,并对pcr产物进行深度测序(bgi)。如图4所示,在实验病毒组中,sgrna3靶向位置产生大量indels(insertionanddeletion),即sacas9/sgrna3的理论切割位点,第18和第19碱基之间出现了许多种碱基增添或缺失,这会造成rho基因开放阅读框移码(orfshift),从而造成rho蛋白失去功能。相反,对照病毒组未发现indels产生。综上,通过在体注射sacas9/sgrnaaav病毒,我们有效敲除了猕猴视网膜感光细胞rho基因。
实施例3.感光细胞退化情况(注射4个月)
同实施例2一样,我们对病毒注射4个月的猕猴进行了牺牲取样,并对病毒注射后的猕猴视网膜进行了冰冻切片(14微米),用抗体rho(sigma)进行免疫组化染色,并用激光共聚焦显微镜进行显微观察。免疫组化为普通生物实验方法,在此不再累述。
如图5所示,gfp为aav-gfp表达的绿色荧光蛋白,可见其分布在外核层中的感光细胞中,即我们的方法实现了高效地猕猴视网膜感光细胞在体基因转导。同时,在rho免疫组化显示中,可见rho免疫荧光信号明显减少,感光细胞外段、内段结构几乎消失,即,在我们有效敲除感光细胞rho基因后,其编码的蛋白质rho表达量显著降低,感光细胞结构发生明显退化。
上述表型模拟了人类rp情况,说明了此技术创造的猕猴rp模型的有效性。
实施例4.oct活体成像展现感光细胞退化(注射6个月)
在实施例4中,我们对病毒注射6个月的猕猴进行了活体光学相干断层扫描(oct,spectralis,heidelbergengineering,heidelberg,德国)成像。成年猕猴通过肌肉注射氯胺酮(10mg/kg)和戊巴比妥钠(40mg/kg)麻醉,并用阿托品进行扩瞳,于oct仪器进行活体眼底成像。
如图6所示,对照病毒组(左侧)为注射不携带sgrnas的对照病毒,猕猴视网膜基本正常,不受注射、病毒毒性等影响。但是在实验病毒组(右侧)中,感光细胞所在的外核层结构呈现明显退化,感光细胞外段内段等结构几乎消失,即,rho基因敲除后猕猴感光细胞明显退化,模拟了人类rp情况,说明了此技术创造的猕猴rp模型的有效性。
实施例5.感光细胞亚细胞结构发生退化
在实施例5中,我们对病毒注射6个月的猕猴进行了牺牲取样,并对视网膜组织进行了透射电子显微镜成像。剥离的视网膜组织立刻用2.5%戊二醛和2%多聚甲醛室温固定2小时,之后切下约1mm3的带视网膜色素上皮(rpe)的视网膜,用2.5%的戊二醛和2%的多聚甲醛于4℃固定过夜。在二甲砷酸缓冲液洗涤三遍后,添加1.5%(w/v)的亚铁氰化钾,1%(w/v)的四氧化锇进行后固定。2%(w/v)乙酸铀酰用于第一次染色,之后进行乙醇和丙酮中漂洗和脱水。然后将样品用梯度epon浸润,并将试块在60℃下硬化48小时。用超薄切片机(leica)切割切片(70nm),并收集在formvar/碳涂层的铜网上。冲洗网格并滴入2%乙酸铀酰水溶液中,然后用柠檬酸铅进行第二次染色。使用hitachiht7700透射电子显微镜在80kv加速电压下拍摄样品。
如图7所示,对照病毒组(上层)视网膜显示出排列良好的视杆细胞,具有正常的亚细胞形态,即内段中长而密集的线粒体(b),外段中完整的膜盘结构(c)和具有高核质比的规则细胞核(d)。然而,在实验病毒组(下层)视网膜中,我们观察到内部段中的线粒体呈空泡状,甚至破碎的状态(f),外核层(onl)中散布着一些破裂和缩短的外段,并且膜盘无规则排列(g)。同时,实验病毒组视网膜中的感光细胞表现出强烈的细胞凋亡(h)。综上,rho突变猕猴显示典型的rp缺陷亚细胞结构和细胞凋亡,很好的模拟了人类rp疾病状态。
实施例6.rp模型猕猴视觉功能严重受损
在实施例6中,我们对注射病毒4个月的猕猴视网膜进行离体视网膜电图(erg)记录。离体视网膜电图记录装置原理图如图8a所示,简言之,此系统为常规电生理平台(scientifica)记录位于视网膜上下的电极与地线之间的电压信号,信号经muticlamp700b(axoncns)放大后,被digidata1440a(axoncns)读取并可视化。强度为3.8-1515.6光子·μm-2的闪光(20毫秒,波长为535nm)被用来刺激感光细胞。erg信号放大后,进行20hz低通滤波,然后数字化以进行进一步分析。
如图8所示,对照病毒组视网膜(c)和没有病毒感染的视网膜(b)离体erg记录光反应无明显区别;但在实验病毒组视网膜(d)中,感光细胞光反应发生严重损伤。e中统计显示对照病毒组视网膜和实验病毒组视网膜感光细胞存在显著差异(p<0.01,unpairedstudentt-test)。
此结果展现了本rho基因在体敲除rp模型猕猴视觉功能严重受损。此表型模拟了人类rp疾病状态,说明此猕猴rp模型的有效性。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!