一种手性富马酸比索洛尔的制备方法与流程
本发明属于有机合成路线设计及其原料药和中间体制备技术领域,具体涉及一种手性富马酸比索洛尔中间体及手性富马酸比索洛尔的制备方法。
背景技术:
富马酸比索洛尔是新一代选择性β1-肾上腺素能受体阻滞剂,具有高度选择性,目前已成为治疗源发性高血压、心绞痛的首选药物之一。富马酸比索洛尔有一个手性中心,两个对映异构体,分别为r/s构型。目前该药物在临床用药、药理学和毒理学研究的报道中,都是以消旋体形式供给的。据文献报道,富马酸比索洛尔(s)-对映体的β-受体阻断作用是(r)-对映体的80倍,(s)-对映体生物利用度为(r)-对映体的1.5倍。目前文献报道的手性富马酸比索洛尔的合成存在单一构型纯度低。
技术实现要素:
本发明要解决的技术问题是提供一种手性富马酸比索洛尔的制备方法,该制备方法原料易得,工艺简洁,经济环保,特别是单一构型纯度高,利于工业化生产。
为解决上述技术问题,本发明的实施例提供一种手性富马酸比索洛尔的制备方法,包括如下步骤:
步骤一、(s)-富马酸比索洛尔的制备
1.1、对异丙氧基乙氧基甲基苯酚(i),与磺酰氯(ii)反应得到4-((2-异丙氧基乙氧基)甲基)苯基甲磺酸酯(iii),反应式如式(1-1):
1.2、4-((2-异丙氧基乙氧基)甲基)苯基甲磺酸酯(iii)与r-环氧丙醇(iv-1)发生缩合反应得到2-((4-((2-异丙氧基乙氧基)甲基苯氧基)甲基)环氧乙烷(v-1),反应式如式(1-2):
1.3、2-((4-((2-异丙氧基乙氧基)甲基苯氧基)甲基)环氧乙烷(v-1)与异丙胺反应得到s-比索洛尔(vii-1),反应式如式(1-3):
1.4、s-比索洛尔(vii-1)与富马酸成盐等到(s)-富马酸比索洛尔,反应式如式(1-4):
步骤二、(r)-富马酸比索洛尔的制备
2.1、对异丙氧基乙氧基甲基苯酚(i),与磺酰氯(ii)反应得到4-((2-异丙氧基乙氧基)甲基)苯基甲磺酸酯(iii),反应式如式(2-1):
2.2、4-((2-异丙氧基乙氧基)甲基)苯基甲磺酸酯(iii)与s-环氧丙醇(iv-2)发生缩合反应得到2-((4-((2-异丙氧基乙氧基)甲基苯氧基)甲基)环氧乙烷(v-2),反应式如式(2-2):
2.3、2-((4-((2-异丙氧基乙氧基)甲基苯氧基)甲基)环氧乙烷(v-2)与异丙胺反应得到r-比索洛尔(vii-2),反应式如式(2-3):
2.4、r-比索洛尔(vii-2)与富马酸成盐得到r-富马酸比索洛尔,反应式如式(2-4):
其中,所述步骤1.1和步骤2.1中磺酰氯(ii)为甲磺酰氯或对甲苯磺酰氯。
其中,所述步骤1.1和步骤2.1中,对异丙氧基乙氧基甲基苯酚(i)与磺酰氯(ii)的摩尔比为1:1-1:1.5。
其中,步骤1.1和步骤2.1中的反应所用缚酸剂为三乙胺、吡啶、二异丙基乙胺、氢氧化钠、甲醇钠、氢氧化钠、氢氧化钾、碳酸钠、碳酸氢钠或碳酸钾。
其中,步骤1.2中,磺酸酯(iii)与r-环氧丙醇(iv-1)的摩尔比为1:1-1:1.5。步骤2.2中,磺酸酯(iii)与s-环氧丙醇(iv-2)的摩尔比为1:1-1:1.5。
其中,步骤1.2和步骤2.2中的反应溶剂为甲苯、二甲苯、乙酸乙酯、乙酸异丙酯、乙酸丁酯、氯仿、二甲亚砜、n,n-二甲基甲酰胺或乙腈。
优选的,步骤1.2和步骤2.2中的反应温度为0~120℃。
本发明的上述技术方案的有益效果如下:
本发明提供的手性富马酸比索洛尔的制备方法,其通过异丙氧基乙氧基甲基苯酚,与磺酰氯进行酯化化反应生成磺酸酯类化合物,化合物与手性环氧丙醇反应生成手性环氧化合物,该化合物再通过开环反应即可制得手性比索洛尔,手性比索洛尔通过成盐反应得到手性富马酸比索洛尔,得到的产品单一构型纯度高,故而本发明的优点主要是原料易得,工艺简洁,经济环保,利于工业化生产。
附图说明:
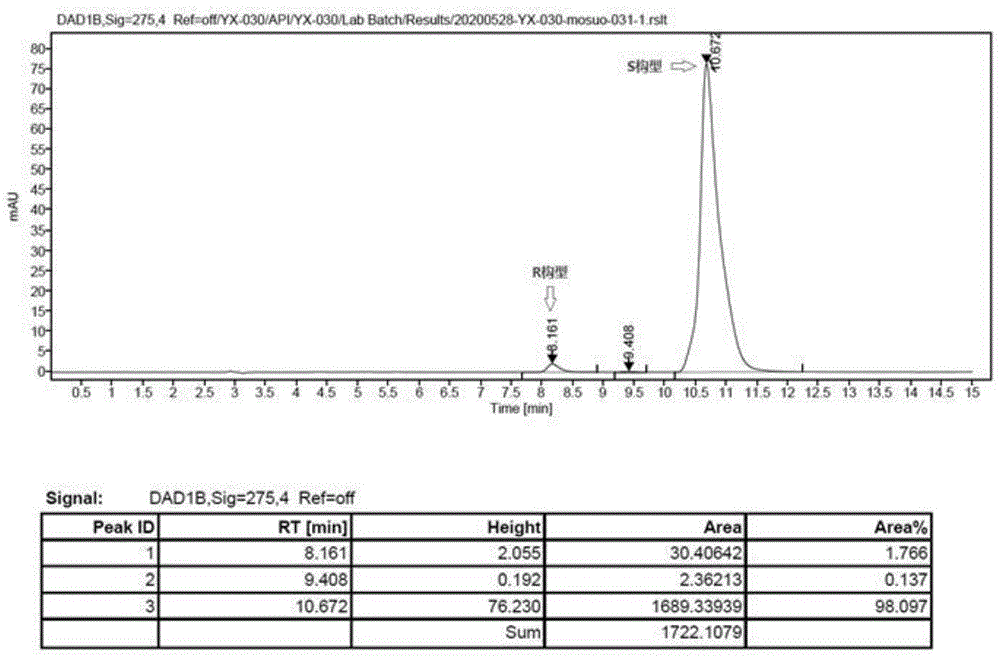
图1为本发明中(s)-富马酸比索洛尔手性纯度hplc图谱;
图2为本发明中(r)-富马酸比索洛尔手性纯度hplc图谱;
图3为本发明中富马酸比索洛尔消旋体手性纯度hplc图谱。
具体实施方式
为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合具体实施例进行详细描述。
实施例1:
4-((2-异丙氧基乙氧基)甲基)苯基甲磺酸酯的制备
向500ml三口瓶中加入对异丙氧基乙氧基甲基苯酚i21.1g(100mmol)、乙腈250ml,搅拌至体系全溶,降至10℃以下,分批加入甲基磺酰氯11.5g(100mmol),升温至60℃,继续反应4小时,tlc检测反应结束。反应液分别用10%碳酸氢钠溶液和水洗涤,无水硫酸钠干燥。减压回收溶剂,得到白色固体4-((2-异丙氧基乙氧基)甲基)苯基甲磺酸酯iii26.4g,收率91.6%。
esi-ms(m/z):[m+h]290.1。
1hnmr(500mhz,dmso-d6,δppm):1.13-1.14(d,6h),3.52-3.56(m,4h),3.58(s,3h),3.67(m,1h),4.82(s,2h),7.06(d,2h),7.32(d,2h)。
实施例2:
(s)-2-((4-((2-异丙氧基乙氧基)甲基)苯氧基)甲基)环氧乙烷的制备
于500ml反应瓶中加入4-((2-异丙氧基乙氧基)甲基)苯基甲磺酸酯14.4g(50mmol)、三乙胺5g(50mmol)和甲苯200ml,搅拌至体系全溶。缓慢加入r-环氧丙醇3.7g(50mmol),70℃继续反应2小时,tlc检测反应结束。反应液倒入50ml冰水中,甲苯提取,有机相干燥,蒸馏。残留物为油状物12.8g,收率96.2%。
esi-ms(m/z):[m+h]267.2
1h-nmr(cdcl3,δppm),δ:1.17-1.78(d,6h,2ch3),2.74-2.75(dd,1h),2.90-2.91(dd,1h),3.35-3.36(m,1h),3.60(s,4h),3.70(s,1h),3.97-3.98(dd,1h),4.20-4.21(dd,1h),4.51(s,2h),6.88and7.28(dd,4h)。
实施例3:
(s)-比索洛尔的制备:
在100ml三口烧瓶中,将5.30g(0.02mol)化合物(s)-2-((4-((2-异丙氧基乙氧基)甲基)苯氧基)甲基)环氧乙烷溶于20ml甲醇,加入20ml异丙胺,在40-45℃下搅拌反应3小时,减压蒸馏至干,水洗,甲苯提取,有机相干燥,蒸馏得6.15g浅黄色油状物(s)-比索洛尔,收率97.2%。
esi-ms(m/z):[m+h]326.3
1h-nmr(cdcl3,δppm),δ:1.15-1.16(d,6h),1.17-1.18(d,6h),2.88-2.90(m,3h),3.61-3.62(m,4h),3.95-3.96(m,2h),3.96(s,2h),4.02-4.03(m,1h,nh),6.87-6.88(d,2h),7.26-.27(d,2h)。
实施例4:
(s)-富马酸比索洛尔的制备
在50ml三口烧瓶中,加入5.60g(0.017mol)(s)-比索洛尔,15ml丙酮,升温至回流,加入0.997g(0.0086mol)的富马酸,搅拌3小时;室温下搅拌1小时,冰浴(0℃-5℃)下搅拌,溶液中有白色固体析出,过滤,即得产物(s)-富马酸比索洛尔,干燥,称重5.57g,收率84.4%。产物(s)-富马酸比索洛尔的ee值为98.1%(hplc)。(s)-富马酸比索洛尔手性纯度hplc图谱如图1所示。
esi-ms(m/z):[m+h]326.3
1h-nmr(cdcl3,δppm),δ:1.15-1.16(d,6h),1.30-1.31(dd,6h),3.00-3.01(dd,1h),3.11-3.12(dd,1h),3.24-3.26(m,1h),3.56(s,4h),3.61-3.63(m,1h),3.96-3.97(m,2h),4.02-4.04(m,1h),4.48(s,2h),6.65(s,1h),6.90-6.91(d,2h),7.22-7.23(d,2h)。
实施例5:
(r)-2-((4-((2-异丙氧基乙氧基)甲基)苯氧基)甲基)环氧乙烷的制备
于500ml反应瓶中加入4-((2-异丙氧基乙氧基)甲基)苯基甲磺酸酯14.4g(50mmol)、三乙胺5g(50mmol)和甲苯200ml,搅拌至体系全溶。缓慢加入s-环氧丙醇3.7g(50mmol),70℃继续反应2小时,tlc检测反应结束。反应液倒入50ml冰水中,甲苯提取,有机相干燥,蒸馏。残留物为油状物12.6g,收率94.7%。
esi-ms(m/z):[m+h]267.4
1h-nmr(cdcl3,δppm),δ:1.13-1.15(d,6h,2ch3),2.71-2.72(dd,1h),2.89-2.90(dd,1h),3.31-3.33(m,1h),3.60(s,4h),3.72(s,1h),3.97-4.02(dd,1h),4.22-4.23(dd,1h),4.54(s,2h),6.88and7.28(dd,4h)。
实施例6:
(r)-比索洛尔的制备
在100ml三口烧瓶中,将5.30g(0.02mol)化合物(r)-2-((4-((2-异丙氧基乙氧基)甲基)苯氧基)甲基)环氧乙烷溶于20ml甲醇,加入20ml异丙胺,在40-45℃下搅拌反应3小时,减压蒸馏至干,水洗,甲苯提取,有机相干燥,蒸馏得6.09g浅黄色油状物(r)-比索洛尔,收率96.3%。
esi-ms(m/z):[m+h]326.2
1h-nmr(cdcl3,δppm),δ:1.12-1.15(d,6h),1.20-1.21(d,6h),2.90-2.93(m,3h),3.58-3.61(m,4h),3.89-3.91(m,2h),3.95(s,2h),3.99-4.01(m,1h,nh),6.90-6.93(d,2h),7.28-7.29(d,2h)。
实施例7:
(r)-富马酸比索洛尔的制备
在50ml三口烧瓶中,加入5.60g(0.017mol)(s)-比索洛尔,15ml丙酮,升温至回流,加入0.997g(0.0086mol)的富马酸,搅拌3小时;室温下搅拌1小时,冰浴(0℃-5℃)下搅拌,溶液中有白色固体析出,过滤,即得产物(r)-富马酸比索洛尔,干燥,称重5.64g,收率85.4%。产物(r)-富马酸比索洛尔的ee值为97.3%(hplc)。(r)-富马酸比索洛尔手性纯度hplc图谱如图2所示。
esi-ms(m/z):[m+h]326.3
1h-nmr(cdcl3,δppm),δ:1.10-1.13(d,6h),1.28-1.30(dd,6h),2.97-2.99(dd,1h),3.05-3.07(dd,1h),3.19-3.22(m,1h),3.49(s,4h),3.60-3.61(m,1h),3.99-4.01(m,2h),4.05-4.09(m,1h),4.52(s,2h),6.62(s,1h),6.88-6.91(d,2h),7.20-7.21(d,2h)。
本发明中富马酸比索洛尔消旋体手性纯度hplc图谱如图3所示。以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!