一种格列美脲原料药的精制方法与流程
本发明涉及制药技术领域,具体涉及一种格列美脲原料药的精制方法。
背景技术:
格列美脲(glimepiride)由德国hoechstmarionroussel公司于1995年首次在瑞典上市,商品名
目前,大多数厂家依据us4379785制备格列美脲:吡咯啉酮(5)先与苯乙基异氰酸酯(6)经加成反应得3-乙基-4-甲基-2-氧代-n-(2-苯乙基)-3-吡咯啉-1-甲酰胺(4),再经氯磺酸磺化得磺酰氯(3),然后与氨水反应得苯磺酰胺(2),最后与反式-4-甲基环己基异氰酸酯(7)经缩合得目标化合物(1)。如下式:
该工艺中,中间体苯磺酰胺(2)纯度不高(约85~88%),与反式-4-甲基环己基异氰酸酯(7)缩合所得的格列美脲,杂质ⅲ含量约0.5~1%,纯度不符合药用要求。
wo2006103690公开的方法,先将苯磺酰胺(2)与酰氯反应得衍生物(2-1),并对衍生物进行纯化后再与(7)缩合,可得目标化合物(1)。如下式:
该工艺对us4379785进行优化,将苯磺酰胺(2)衍生为酯类化合物后再与异氰酸酯(7)缩合,虽然提高了格列美脲纯度,但会产生新的药典(中国药典2015年版二部)杂质ⅰ、杂质ⅱ,导致格列美脲不符合药用要求。
按照us4379785或wo2006103690公开的工艺制备的格列美脲,纯度达不到药用标准,杂质限度超出药典(中国药典2015年版二部)要求。特别是在反应后处理操作中,格列美脲在碱性条件下水解生成杂质ⅲ,导致杂质ⅲ含量为0.5%~1.0%,大大超出了药典限度。
cn101486674b公开了一种格列美脲粗品精制方法,先将格列美脲粗品及碳酸钾的混合物合成液经抽滤,然后抽提物加入纯水中溶解成溶液,经过滤去除杂质,得到格列美脲水溶液;格列美脲水溶液中加入盐酸溶液酸化,析出粗品;格列美脲粗品中加入丙酮精制,抽滤,真空干燥,得到格列美脲纯品。在处理过程中,格列美脲在碱性条件下水解生成杂质ⅲ,导致杂质ⅲ含量增大。此方法只是经过了简单的两次过滤,提纯效率不高。
因此提供一种格列美脲原料药的精制方法,从而获得符合药用标准的格列美脲精制药是格列美脲原料药提纯技术领域中亟需解决的问题。
技术实现要素:
针对现有技术的不足,本发明拟提供一种操作步骤简便,工艺条件温和,更适于规模化生产且提纯效率高的格列美脲原料药的精制方法。
本发明提供了如下的技术方案:
一种格列美脲原料药的精制方法,包括以下步骤:
(1)将格列美脲粗品溶解于纯化水中,过滤,得到滤液;
(2)将滤液酸化,产生浆状物,过滤,得到滤饼,再用纯化水淋洗滤饼至中性;
(3)将滤饼加入溶剂中,搅拌升温至回流,回流条件下保持1~2小时,趁热过滤,丙酮淋洗,抽干,干燥,得到符合药用标准的格列美脲精制药。
优选的是,所述步骤(1)中的格列美脲粗品与纯化水的重量比为1:60~80。
在上述任一方案中优选的是,所述步骤(2)中将滤液酸化过程中所用的酸为盐酸。
在上述任一方案中优选的是,所述格列美脲粗品与步骤(3)中溶剂的重量比为1:8~10。
在上述任一方案中优选的是,所述步骤(2)中酸化温度为20℃~35℃。
在上述任一方案中优选的是,所述步骤(2)中酸化温度为25℃~30℃。
在上述任一方案中优选的是,所述盐酸浓度为1~3mol/l。
在上述任一方案中优选的是,所述盐酸浓度为1~1.2mol/l。
在上述任一方案中优选的是,所述步骤(2)中浆状物的ph为1~5。
在上述任一方案中优选的是,所述步骤(2)中浆状物的ph为2~3。
在上述任一方案中优选的是,所述步骤(2)中滤饼中含水20%~45%。
在上述任一方案中优选的是,所述步骤(2)中滤饼中含水25%~35%。
在上述任一方案中优选的是,所述步骤(3)中溶剂为二氯甲烷、乙酸乙酯、甲苯、甲醇、乙醇、丙酮、四氢呋喃中的任一种或者二种或者三种的混合物。
在上述任一方案中优选的是,所述步骤(3)中溶剂为二氯甲烷和丙酮的混合物,二氯甲烷:丙酮重量比为0.5~1.5:8。
在上述任一方案中优选的是,所述步骤(3)中溶剂为二氯甲烷和丙酮的混合物,二氯甲烷:丙酮重量比为1~1.5:8。
本发明的有益效果体现在:本发明提供一种格列美脲原料药的精制方法,精制过程中在回流条件下保持1~2小时,大大增加了杂质的溶解度,提高了格列美脲粗品的提纯效率,且操作步骤简便,工艺条件温和,降低生产成本,更适于规模化生产。
附图说明
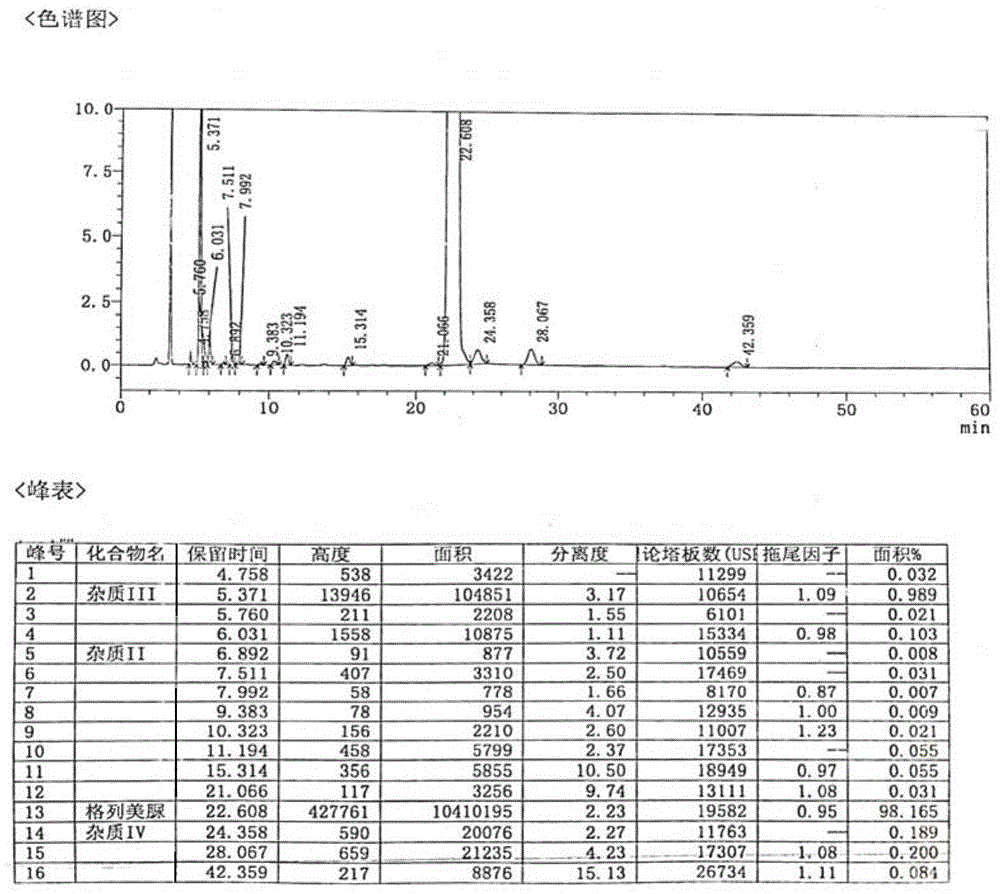
图1为格列美脲粗品的高效液相色谱仪检测结果;
图2为实施例1得到的格列美脲精制药的高效液相色谱仪检测结果;
图3为实施例2得到的格列美脲精制药的高效液相色谱仪检测结果;
图4为实施例3得到的格列美脲精制药的高效液相色谱仪检测结果。
具体实施方式
为了更充分地理解本发明,列举下述具体实施例。应当理解,这些实施例仅仅是用于示例的目的,而不应当被看作是以任何方式限制本发明。本发明的每个方面的所有特征都应用于全部其它方面,可在细节上作必要改动。本发明的实施并不局限于下面的实施例,对本发明所做的任何形式上的变通或改变都落入本发明保护范围;且下述实施例中的方法,如无特别说明,均为本领域的常规方法。
本发明中所述的杂质ⅱ、杂质ⅲ、杂质ⅳ均可以在《中国药典》(2015年版二部)中查到。
本发明中所述的格列美脲粗品为按照us4379785实施例2公开的工艺制备得到格列美脲粗品。通过高效液相色谱仪(仪器型号agilentg1314f1260vwd)测得格列美脲粗品纯度为98.165%,杂质ⅲ为0.989%。具体结果见图1。
可用干燥失重测定法测量本发明所述滤饼含水量。
实施例1
一种格列美脲原料药的精制方法,包括以下步骤:
将10g格列美脲粗品搅拌加入600g纯化水中,升温至65℃搅拌溶解至溶液澄清,趁热过滤。滤液冷却至30℃,用2mol/l盐酸调节ph至2,得浆状物,保温搅拌1小时后离心,过滤,得到滤饼,纯化水淋洗至中性,控制滤饼含水量为25%。
将滤饼加入11g二氯甲烷与89g丙酮的混合溶剂中,搅拌升温至回流,1小时后趁热过滤,滤饼用丙酮淋洗,抽干。60℃条件下干燥得格列美脲精制药9.50g。
用高效液相色谱仪测得格列美脲精制药纯度为99.423%,杂质ⅲ含量为0.237%,如图2。
实施例2
将10g格列美脲粗品搅拌加入800g纯化水中,升温至60℃搅拌溶解至溶液澄清,趁热过滤,滤液冷却至20℃,然后用3mol/l盐酸调节ph至5,得浆状物,保温搅拌1小时后离心,过滤,得到滤饼,纯化水淋洗至中性,控制滤饼含水量为40%。将滤饼加入10g二氯甲烷与70g丙酮的混合溶剂中,搅拌升温至回流,1小时后趁热过滤,滤饼用丙酮淋洗,抽干。65℃条件下干燥得格列美脲9.43g。
用高效液相色谱仪测得格列美脲精制药纯度为99.537%,杂质ⅲ含量为0.280%,如图3。
实施例3
将20g格列美脲粗品搅拌加入1400g纯化水中,升温至70℃搅拌溶解至溶液澄清,趁热过滤,滤液冷却至25℃,用1mol/l盐酸调节ph至3,得浆状物,保温搅拌1小时后离心,过滤,得到滤饼,纯化水淋洗至中性,控制滤饼含水量为30%。
将滤饼加入20g二氯甲烷与160g丙酮的混合溶剂中,搅拌升温至回流,回流2小时后趁热过滤,滤饼用丙酮淋洗,抽干。60℃条件下干燥得格列美脲18.92g。
用高效液相色谱仪测得格列美脲精制药纯度为99.621%,杂质ⅲ含量为0.211%,如图4。
需要说明的是,以上实施例仅用于说明本发明的技术方案,而非对其限制;尽管前述实施例对本发明进行了详细的说明,本领域的技术人员应该理解:其可以对前述实施例记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换,而这些替换,并不使相应技术方案的本质脱离本发明技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!