一种细胞表面人工自组装膜
1.本发明涉及一种细胞表面人工自组装膜,特别是一种含有纳米粒为特征的两亲聚电解质复合水凝胶膜。
背景技术:
2.基于酶和微生物细胞的生物催化技术,由于具有反应温和高效及高选择性特点,能够简化工艺流程,提高产品产量和纯度,已经在工业生产中取得突破性进展,尤其在生产精细化学品和药物的工艺中,一些更加绿色和可持续的生物催化工艺正在或已经取代传统的化学反应路径,成为工业合成光学纯氨基酸、乳酸、燃料乙醇、1,3
‑
丙二醇等手性药物、材料、能源、精细化工产品的重要工具。在上述生物催化反应过程中,常涉及有机溶剂、水
‑
溶剂两相体系、超临界流体、离子液体等非水相介质的应用,以提高疏水性底物和产物溶解性,但高毒性往往不利于生物催化剂的活性保持。为此,很多研究者通过固定化技术与非水相介质结合,包埋微生物于多孔固定化载体内,以避免介质环境对活性的破坏。但常见的水凝胶固定化载体由于多为粒径在300微米
‑
3000微米的微粒,凝胶微粒自身也会造成传质阻力,影响包埋细胞的活性。为此,有人提出在细胞表面形成聚电解质复合膜来解决传统固定化载体的传质阻力问题,但目前公开的细胞表面形成的聚电解质复合膜的稳定性较差,且对于非水相催化体系仍然存在疏水产物滞留在胞内产生细胞毒性问题。
技术实现要素:
3.为了克服现有技术制造的复合膜稳定性较差且容易产生毒性的不足,发明人提出在细胞表面,引入两亲纳米粒,即将带电荷的两亲纳米粒与带有相反电荷的聚电解质,通过静电相互作用,层层自组装到细胞表面形成含有纳米粒结构的两亲聚电解质复合水凝胶膜;本发明中的自组装膜中含有两亲纳米粒,膜成分包括如下组合:
4.组合1:含有两亲壳聚糖纳米粒和聚阴离子,聚阴离子为海藻酸盐分子或海藻酸盐衍生物中的一种或一种以上;其中,壳聚糖纳米粒与聚阴离子的质量比为1:5
‑
5:1,膜厚度在1
‑
50微米;
5.其制备步骤如下:
6.1)离心收集细胞,将细胞重悬,均匀分散在两亲壳聚糖纳米粒溶液中,反应1
‑
20分钟,离心清洗反应后的细胞;
7.2)将步骤1)的反应清洗后的细胞重悬,均匀分散在聚阴离子溶液中,反应1
‑
20分钟,离心清洗反应后的细胞;
8.3)交替重复步骤1)和步骤2)的过程0
‑
5次,即在细胞表面得到含有纳米粒的聚电解质复合水凝胶膜。
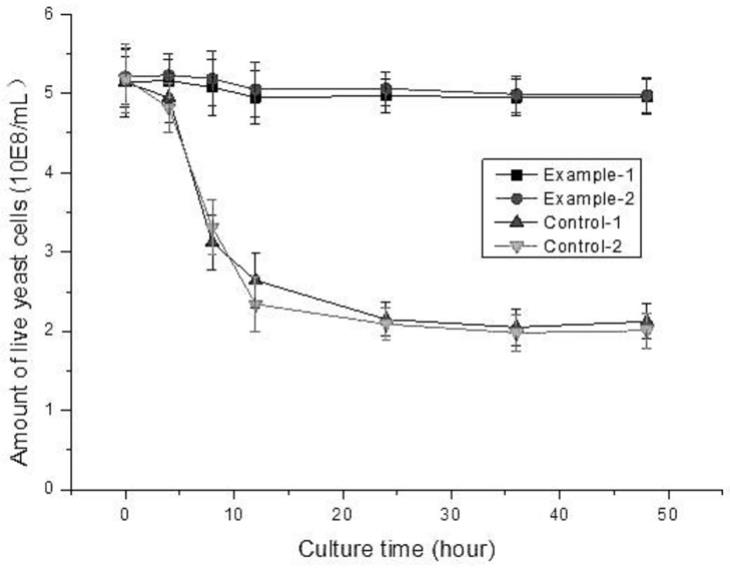
9.其中,所述组合1成分中的两亲壳聚糖纳米粒由两亲改性的壳聚糖衍生物自组装而成纳米粒,或者由两亲改性的壳聚糖衍生物与参与生物催化反应的底物分子(如:氨基酸、葡萄糖等小分子糖、有机酸、醇类等)自组装而成纳米粒,粒径在50
‑
500nm。
10.所述组合1成分中的海藻酸盐包括海藻酸钠或海藻酸钾,分子量在20
‑
400kda。
11.所述组合1成分中的海藻酸盐衍生物为海藻酸盐羧基或羟基修饰的衍生物,分子量在20
‑
500kda,且衍生物能够溶于ph6
‑
7.5的水溶液。
12.组合2:含有两亲海藻酸钠纳米粒和聚阳离子,聚阳离子为聚赖氨酸分子、壳聚糖分子或壳聚糖衍生物中的一种或一种以上;其中,两亲海藻酸钠纳米粒与聚阳离子的质量比为1:5
‑
5:1,膜厚度在1
‑
50微米。其制备步骤如下:
13.1)离心收集细胞,将细胞重悬,均匀分散在聚阳离子溶液中,反应1
‑
20分钟,离心清洗反应后的细胞;
14.2)将步骤1)的反应清洗后的细胞重悬,均匀分散在两亲海藻酸钠纳米粒溶液中,反应1
‑
20分钟,离心清洗反应后的细胞;
15.3)交替重复步骤1)和步骤2)的过程0
‑
5次,即在细胞表面得到含有纳米粒的聚电解质复合水凝胶膜。
16.其中,所述组合2成分中的聚赖氨酸是指α
‑
聚赖氨酸或ε
‑
聚赖氨酸,分子量在10
‑
100kda。
17.所述组合2成分中的壳聚糖,分子量5
‑
200kda,脱乙酰度50
‑
100%。
18.所述组合2成分中的壳聚糖衍生物分子量10
‑
300kda,且衍生物能够溶于ph 5
‑
7.5的水溶液,并带正电荷。
19.所述组合2成分中的两亲海藻酸钠纳米粒,是由两亲改性的海藻酸钠衍生物自组装而成纳米粒,或者由两亲改性的海藻酸钠衍生物与参与生物催化反应的底物分子(如:氨基酸、葡萄糖等小分子糖、有机酸、醇类等)自组装而成纳米粒,粒径在50
‑
500nm。
20.本发明中所述细胞为生物催化常用的微生物细胞,包括真核细胞如酵母菌和原核细胞如大肠杆菌、枯草杆菌、乳酸菌等。
21.本发明所述细胞表面人工自组装膜用于非水相细胞催化体系,比如:2
‑
苯乙醇的发酵生产。本发明中膜的两亲结构允许疏水底物或产物在两亲膜上快速扩散,减少对细胞伤害。
22.本发明与现有技术相比的有益效果是:
23.1.该发明中含有纳米粒结构的水凝胶膜,有类似“混凝土”的效应,起到稳定自组装膜的作用,细胞表面形成的自组装膜不易脱落;
24.2.该发明中的纳米粒为两亲聚电解质形成的两亲纳米粒,因此,在用于非水相细胞催化体系时,利于疏水底物或产物在膜上的快速扩散,从而减少疏水物质对细胞的毒性,提高整体生物催化效率;
25.2.该自组装膜的制备过程条件温和,对细胞没有损伤;
26.3.该自组装膜在细胞表面原位制备,传质阻力大大降低,避免了水凝胶固定化载体的传质阻力。
附图说明
27.图1是酵母菌在转化培养基中的细胞活性图
28.图2.是酵母菌在转化培养基中生产2
‑
苯乙醇(2
‑
pea)情况图
具体实施方式
29.两亲壳聚糖纳米粒制备参考文献:synthesis and characterization of amphiphilic glycidol
‑
chitosan
‑
deoxycholic acid nanoparticles as drug carrier for doxorubicin.biomacromolecules,2010,11:3480
‑
3486;两亲海藻酸钠纳米粒制备参考文献:yu weiting*,zhang demeng*,liu xiudong,wang yunhong,tong jun,zhang mengxue,ma xiaojun.amphiphilic sodium alginate
‑
vinyl acetate microparticles for drug delivery.journal of oceanology and limnology,2019,doi:https://doi.org/10.1007/s00343
‑
019
‑
8127
‑830.实施例1
31.一种细胞表面人工自组装膜
32.1)制备疏水取代度4.5,阳离子型亲水基团取代度为60的两亲壳聚糖材料;
33.2)无菌条件下制备载l
‑
苯丙氨酸的阳离子型两亲壳聚糖纳米粒;
34.3)处于对数生长期末的酵母菌(saccharoinyces cerevisiae)离心收集菌体,将约5
×
108的酵母菌细胞,均匀分散到20ml步骤2)的纳米粒溶液中,反应5分钟,生理盐水离心清洗;
35.4)步骤3)制备的酵母菌再浸入到20ml海藻酸钠(平均分子量200kda,浓度0.8%)溶液中,反应5分钟,生理盐水离心清洗;
36.5)重复步骤3)和步骤4),即在酵母细胞表面获得含有纳米粒结构的水凝胶膜;
37.6)将步骤5)获得的酵母细胞接种到转化培养基中(蔗糖120g/l、酵母膏5g/l、kh2po4 g/l、k2hpo4
·
3h2o、mgso4
·
7h2o 0.5g/l、l
‑
苯丙氨酸10g/l),并向培养基中加入3倍体积的癸二酸二丁酯用于产物萃取,将培养体系于恒温振荡培养箱中,30℃,200r
·
min
‑
1培养4h后、8h、12h、24h后取样;
38.7)采用高效液相色谱法测定步骤6)各样品中的2
‑
苯乙醇浓度。检测条件:色谱柱为c18柱(4.6mm
×
250mm,5μm),流动相为甲醇/水(体积比为50:50)柱温30℃,流速0.8ml/min,检测波长260nm,进样量10μl;
39.8)培养后的酵母菌显微镜观察,发现酵母菌表面复合膜完整。培养过程中酵母细胞活性(附图1
‑
exampl
‑
1)和2
‑
苯乙醇生产结果见附图2
‑
exampl
‑
1。
40.比较例1
41.1)将处于对数生长期末的酵母菌(saccharoinyces cerevisiae)离心收集后,收集酵母菌菌体,约5
×
108的酵母菌细胞;
42.2)将步骤1)中的酵母菌接种到转化培养基中(蔗糖120g/l、酵母膏5g/l、kh2po4 g/l、k2hpo4
·
3h2o、mgso4
·
7h2o 0.5g/l、l
‑
苯丙氨酸10g/l),并向培养基中加入3倍体积的癸二酸二丁酯用于产物萃取,将培养体系于恒温振荡培养箱中,30℃,200r
·
min
‑
1培养4h、8h、12h、24h后取样;
43.3)采用高效液相色谱法测定步骤6)各样品中的2
‑
苯乙醇浓度。检测条件:色谱柱为c18柱(4.6mm
×
250mm,5μm),流动相为甲醇/水(体积比为50:50)柱温30℃,流速0.8ml/min,检测波长260nm,进样量10μl;
44.4)培养过程中酵母细胞活性(附图1
‑
control
‑
1)和2
‑
苯乙醇生产结果见附图2
‑
control
‑
1。
45.比较例2
46.1)处于对数生长期末的酵母菌(saccharoinyces cerevisiae)离心收集菌体,将约5
×
108的酵母菌细胞,均匀分散到20ml壳聚糖(平均分子量30kda,浓度0.2%)溶液中,反应5分钟,生理盐水离心清洗;
47.2)步骤1)制备的酵母菌再浸入到20ml海藻酸钠(平均分子量200kda,浓度0.8%)溶液中,反应5分钟,生理盐水离心清洗;
48.3)重复步骤1)和步骤2),即在酵母细胞表面获得自组装复合水凝胶膜;
49.4)将步骤3)获得的酵母细胞接种到转化培养基中(蔗糖120g/l、酵母膏5g/l、kh2po4 g/l、k2hpo4
·
3h2o、mgso4
·
7h2o 0.5g/l、l
‑
苯丙氨酸10g/l),并向培养基中加入3倍体积的癸二酸二丁酯用于产物萃取,将培养体系于恒温振荡培养箱中,30℃,200r
·
min
‑
1培养4h、8h、12h、24h后取样;
50.5)采用高效液相色谱法测定步骤6)各样品中的2
‑
苯乙醇浓度。检测条件:色谱柱为c18柱(4.6mm
×
250mm,5μm),流动相为甲醇/水(体积比为50:50)柱温30℃,流速0.8ml/min,检测波长260nm,进样量10μl;
51.6)培养后的酵母菌显微镜观察,发现酵母菌表面出现复合膜剥脱漂浮现象。培养过程中酵母细胞活性(附图1
‑
control
‑
2)和2
‑
苯乙醇生产结果见附图2
‑
control
‑
2。
52.实施例2
53.1)参考文献方法,制备疏水改性的两亲海藻酸钠材料;
54.2)无菌条件下制备载l
‑
苯丙氨酸的两亲海藻酸钠纳米粒溶液;
55.3)处于对数生长期末的酵母菌(saccharoinyces cerevisiae)离心收集菌体,将约5
×
108的酵母菌细胞,均匀分散到20ml壳聚糖(平均分子量20kda,浓度0.3%)溶液中,反应5分钟,生理盐水离心清洗;
56.4)步骤3)制备的酵母菌再浸入到20ml步骤2)的纳米粒溶液中,反应5分钟,生理盐水离心清洗;
57.5)重复步骤3)和步骤4),即在酵母细胞表面获得含有纳米粒结构的水凝胶膜;
58.6)将步骤5)获得的酵母细胞接种到转化培养基中(蔗糖120g/l、酵母膏5g/l、kh2po4 g/l、k2hpo4
·
3h2o、mgso4
·
7h2o 0.5g/l、l
‑
苯丙氨酸10g/l),并向培养基中加入3倍体积的癸二酸二丁酯用于产物萃取,将培养体系于恒温振荡培养箱中,30℃,200r
·
min
‑
1培养4h、8h、12h、24h后取样;
59.7)采用高效液相色谱法测定步骤6)各样品中的2
‑
苯乙醇浓度。检测条件:色谱柱为c18柱(4.6mm
×
250mm,5μm),流动相为甲醇/水(体积比为50:50)柱温30℃,流速0.8ml/min,检测波长260nm,进样量10μl;
60.8)培养后的酵母菌显微镜观察,发现酵母菌表面复合膜完整。培养过程中酵母细胞活性(附图1
‑
example
‑
2)和2
‑
苯乙醇生产结果见附图2
‑
example
‑
2。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1