一种依喜替康类似物的结晶形式及其制备方法与流程
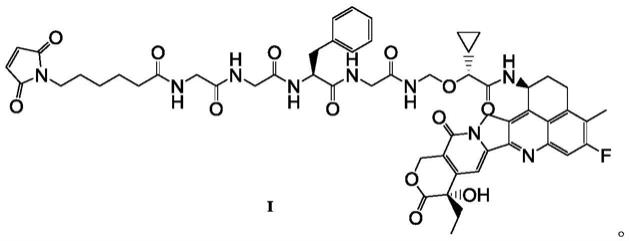
1.本公开涉及一种依喜替康类似物的结晶形式及其制备方法,具体地涉及式i所示化合物的结晶形式及制备方法。
背景技术:
2.化疗依然是包括手术、放疗、以及靶向治疗法在内的最重要的抗癌手段之一。尽管高效细胞毒素的种类很多,但是肿瘤细胞和正常细胞之间差别很小,限制了这些抗肿瘤化合物由于毒副作用在临床上的广泛应用。而抗肿瘤单克隆抗体对于肿瘤细胞表面抗原的特异性,抗体药物已成为抗肿瘤治疗的前线药物,但单独使用抗体作为抗肿瘤药物时,疗效经常不尽人意。
3.抗体药物偶联物(antibody drug conjugate,adc)将单克隆抗体或者抗体片段通过稳定的化学接头化合物与具有生物活性的细胞毒素相连,充分利用了抗体对正常细胞和肿瘤细胞表面抗原结合的特异性和细胞毒素的高效性,同时又避免了前者疗效偏低和后者毒副作用过大等缺陷。这也就意味着,与以往传统的化疗药物相比,抗体药物偶联物能精准地结合肿瘤细胞并降低对正常细胞的影响(mullard a,(2013)nature reviews drug discovery,12:329
–
332;dijoseph jf,armellino dc,(2004)blood,103:1807-1814)。
4.2000年第一个抗体药物偶联物mylotarg(吉妥珠单抗奥唑米星(gemtuzumab ozogamicin),惠氏制药有限公司)被美国fda批准上市,用于治疗急性髓细胞白血病(drugs of the future(2000)25(7):686;us4970198;us 5079233;us 5585089;us 5606040;us 5693762;us 5739116;us 5767285;us 5773001)。
5.2011年8月,adcetris(brentuximab vedotin,西雅图基因遗传公司)通过美国fda快速审评通道,用于治疗霍奇金淋巴瘤以及复发性间变性大细胞淋巴瘤(nat.biotechnol(2003)21(7):778-784;wo2004010957;wo2005001038;us7090843a;us7659241;wo2008025020)。是一种新型靶向adc药物,能使药物直接作用于淋巴瘤细胞上的靶点cd30后发生内吞作用从而诱导肿瘤细胞的凋亡。
6.mylotarg和adcetris都是针对血液肿瘤进行靶向治疗,血液肿瘤和实体肿瘤相比组织结构相对简单。2013年2月,kadcyla(ado-trastuzumab emtansine,t-dm1)获得美国fda批准,用于治疗her2阳性同时对曲妥珠单抗(tratuzumab,商品名:herceptin)和紫杉醇有抗药性的晚期或转移性乳腺癌患者(wo2005037992;us8088387)。kadcyla是美国fda批准的治疗实体肿瘤的第一个adc药物。
7.用于抗体药物偶联物的具有细胞毒性的小分子有几类,其中有一类是喜树碱衍生物,它们通过抑制拓扑异构酶i而具有抗肿瘤作用。报道喜树碱衍生物依喜替康(化学名:(1s,9s)-1-氨基-9-乙基-5-氟-2,3-二氢-9-羟基-4-甲基-1h,12h-苯并[de]吡喃并[3’,4’:6,7]咪唑并[1,2-b]喹啉-10,13(9h,15h)-二酮)应用于抗体偶联药物(adc)的文献有wo2014057687;clinical cancer research(2016)22(20):5097-5108;cancer sci(2016)107:1039-1046。
[0008]
wo2020063676涉及一系列新的配体-药物偶联物,其中一类通式为(pc-l-y-dr)所示的配体-药物偶联物具有良好的抗肿瘤活性,其结构如下所示:
[0009][0010]
其中,pc表示配体,n为1至10,可以为整数,也可以为小数。
[0011]
另外,式i所示化合物可用于制备上述配体-药物偶联物,式i所示化合物的结构如下所示:
[0012][0013]
药用的活性成分及其中间体的晶型结构往往影响到该他们的化学稳定性,结晶条件及储存条件的不同有可能导致化合物的晶型结构的变化,有时还会伴随着产生其他形态的晶型。一般来说,无定型的产品没有规则的晶型结构,往往具有其它缺陷,比如产物稳定性较差,析晶较细,过滤较难,易结块,流动性差等。因此,改善上述产物的各方面性质是很有必要的,我们需要深入研究找到晶型纯度较高并且具备良好化学稳定的新晶型。
技术实现要素:
[0014]
本公开的目的在于提供一种式i所示化合物新的晶型,其具备良好的稳定性。
[0015]
本公开一方面提供了一种式i所示化合物的a晶型,其x-射线粉末衍射图谱在2θ角为6.626和7.572处有特征峰。
[0016][0017]
在某些的实施方案中,本公开提供一种式i所示化合物的a晶型,其x-射线粉末衍射图谱如图2、图4或图5所示。
[0018]
本公开进一步提供一种制备式i所示化合物的a晶型的方法,所述方法包括:将式i
所示化合物与适量的溶剂混合,室温打浆,所述溶剂可以为二氯甲烷。
[0019]
本公开一方面提供了一种式i所示化合物的b晶型,其x-射线粉末衍射图谱在2θ角为9.607、11.064、13.240、14.446、16.255和20.379处有特征峰。
[0020]
在某些的实施方案中,本公开提供一种式i所示化合物的b晶型,其x-射线粉末衍射图谱如图3所示。
[0021]
本公开进一步提供一种制备式i所示化合物的b晶型的方法,所述方法包括:将式i所示化合物与适量的溶剂混合,室温打浆,所述溶剂可以为乙腈。
[0022]
通过x-射线粉末衍射图谱(xrpd)、差示扫描量热分析(dsc)对本公开所得到晶型进行结构测定、晶型研究。
[0023]
本公开中晶型的析晶方法是常规的,例如挥发析晶、降温析晶或室温下析晶。
[0024]
本公开晶型制备方法中所用的起始原料可以是任意形式的式i所示化合物,具体形式包括但不限于:无定形、任意晶型、水合物、溶剂合物等。
[0025]
本公开还提供了一种式ii所示的配体-药物偶联物或其药学上可接受的盐或溶剂合物的制备方法,包括:还原配体后,与本公开所述的式i所示化合物的晶型偶联反应的步骤,
[0026][0027]
其中,pc表示配体,n为1至10,可以为整数,也可以为小数。
[0028]
在某些实施方式中,所述pc为抗体或其抗原结合片段,所述抗体选自嵌合抗体、人源化抗体或全人源抗体;优选为单克隆抗体。
[0029]
在某些实施方式中,其中所述的抗体或其抗原结合片段选自抗her2(erbb2)抗体、抗egfr抗体、抗b7-h3抗体、抗c-met抗体、抗her3(erbb3)抗体、抗her4(erbb4)抗体、抗cd20抗体、抗cd22抗体、抗cd30抗体、抗cd33抗体、抗cd44抗体、抗cd56抗体、抗cd70抗体、抗cd73抗体、抗cd105抗体、抗cea抗体、抗a33抗体、抗cripto抗体、抗epha2抗体、抗g250抗体、抗mucl抗体、抗lewis y抗体、抗vegfr抗体、抗gpnmb抗体、抗integrin抗体、抗psma抗体、抗tenascin-c抗体、抗slc44a4抗体或抗mesothelin抗体或其抗原结合片段。
[0030]
在某些实施方式中,其中所述的抗体或其抗原结合片段选自trastuzumab、pertuzumab、nimotuzumab、enoblituzumab、emibetuzumab、inotuzumab、pinatuzumab、brentuximab、gemtuzumab、bivatuzumab、lorvotuzumab、cbr96和glematumamab,或其抗原结合片段。
[0031]
在本技术的说明书和权利要求书中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。然而,为了更好地理解本公开,下面提供了部分相关术语的定义和解释。另外,当本技术所提供的术语的定义和解释与本领域技术人
员所通常理解的含义不一致时,以本技术所提供的术语的定义和解释为准。
[0032]
本公开所述的“打浆”是指利用物质在溶剂中溶解性差,但杂质在溶剂中溶解性好的特性进行纯化的方法,打浆提纯可以去色、改变晶型或去除少量杂质。
[0033]
本公开所述的“x-射线粉末衍射图谱或xrpd”是指根据布拉格公式2d sinθ=nλ(式中,λ为x射线的波长,衍射的级数n为任何正整数,一般取一级衍射峰,n=1),当x射线以掠角θ(入射角的余角,又称为布拉格角)入射到晶体或部分晶体样品的某一具有d点阵平面间距的原子面上时,就能满足布拉格方程,从而测得了这组x射线粉末衍射图。
[0034]
本公开所述的“x-射线粉末衍射图谱或xrpd”是通过在x-射线粉末衍射仪中使用cu-kα辐射得到的图谱。
[0035]
本公开所述的“差示扫描量热分析或dsc”是指在样品升温或恒温过程中,测量样品与参考物之间的温度差、热流差,以表征所有与热效应有关的物理变化和化学变化,得到样品的相变信息。
[0036]
本公开所述的“2θ或2θ角度”是指衍射角,θ为布拉格角,单位为
°
或度,2θ的误差范围为
±
0.3或
±
0.2或
±
0.1。
[0037]
本公开所述的“晶面间距或晶面间距(d值)”是指空间点阵选择3个不相平行的连结相邻两个点阵点的单位矢量a,b,c,它们将点阵划分成并置的平行六面体单位,称为晶面间距。空间点阵按照确定的平行六面体单位连线划分,获得一套直线网格,称为空间格子或晶格。点阵和晶格是分别用几何的点和线反映晶体结构的周期性,不同的晶面,其面间距(即相邻的两个平行晶面之间的距离)各不相同;单位为或埃。
[0038]
术语“配体-药物偶联物”,指配体通过稳定的连接单元与具有生物活性的药物相连。在本公开中“配体-药物偶联物”优选为抗体-药物偶联物(antibody drug conjugate,adc),指把单克隆抗体或者抗体片段通过稳定的连接单元与具有生物活性的毒性药物相连。
[0039]
本公开所用氨基酸三字母代码和单字母代码如j.biol.chem,243,p3558(1968)中所述。
[0040]
术语“抗体”指免疫球蛋白,是由两条相同的重链和两条相同的轻链通过链间二硫键连接而成的四肽链结构。免疫球蛋白重链恒定区的氨基酸组成和排列顺序不同,故其抗原性也不同。据此,可将免疫球蛋白分为五类,或称为免疫球蛋白的同种型,即igm、igd、igg、iga和ige,其相应的重链分别为μ链、δ链、γ链、α链、和ε链。同一类ig根据其铰链区氨基酸组成和重链二硫键的数目和位置的差别,又可分为不同的亚类,如igg可分为igg1、igg2、igg3、igg4。轻链通过恒定区的不同分为κ链或λ链。五类ig中每类ig都可以有κ链或λ链。本公开所述的抗体优选为针对靶细胞上细胞表面抗原的特异性抗体,非限制性实施例为以下抗体:抗her2(erbb2)抗体、抗egfr抗体、抗b7-h3抗体、抗c-met抗体、抗her3(erbb3)抗体、抗her4(erbb4)抗体、抗cd20抗体、抗cd22抗体、抗cd30抗体、抗cd33抗体、抗cd44抗体、抗cd56抗体、抗cd70抗体、抗cd73抗体、抗cd105抗体、抗cea抗体、抗a33抗体、抗cripto抗体、抗epha2抗体、抗g250抗体、抗mucl抗体、抗lewis y抗体、抗vegfr抗体、抗gpnmb抗体、抗integrin抗体、抗psma抗体、抗tenascin-c抗体、抗slc44a4抗体或抗mesothelin抗体中一个或多个;优选为曲妥珠单抗(trastuzumab,商品名herceptin)、帕妥珠单抗(pertuzumab,也被称作2c4,商品名perjeta)、尼妥珠单抗(nimotuzumab,商品名泰欣生)、
enoblituzumab、emibetuzumab、inotuzumab、pinatuzumab、brentuximab、gemtuzumab、bivatuzumab、lorvotuzumab、cbr96和glematumamab。
[0041]
抗体重链和轻链靠近n端的约110个氨基酸的序列变化很大,为可变区(fv区);靠近c端的其余氨基酸序列相对稳定,为恒定区。可变区包括3个高变区(hvr)和4个序列相对保守的骨架区(fr)。3个高变区决定抗体的特异性,又称为互补性决定区(cdr)。每条轻链可变区(lcvr)和重链可变区(hcvr)由3个cdr区4个fr区组成,从氨基端到羧基端依次排列的顺序为:fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4。轻链的3个cdr区指lcdr1、lcdr2、和lcdr3;重链的3个cdr区指hcdr1、hcdr2和hcdr3。
[0042]
本公开的抗体包括鼠源抗体、嵌合抗体、人源化抗体和全人源抗体,优选人源化抗体和全人源抗体。
[0043]
术语“鼠源抗体”在本公开中为根据本领域知识和技能用鼠制备抗体。制备时用特定抗原注射试验对象,然后分离表达具有所需序列或功能特性的抗体的杂交瘤。
[0044]
术语“嵌合抗体(chimeric antibody)”,是将鼠源性抗体的可变区与人抗体的恒定区融合而成的抗体,可以减轻鼠源性抗体诱发的免疫应答反应。建立嵌合抗体,要先建立分泌鼠源性特异性单抗的杂交瘤,然后从鼠杂交瘤细胞中克隆可变区基因,再根据需要克隆人抗体的恒定区基因,将鼠可变区基因与人恒定区基因连接成嵌合基因后插入表达载体中,最后在真核系统或原核系统中表达嵌合抗体分子。
[0045]
术语“人源化抗体(humanized antibody)”,也称为cdr移植抗体(cdr-grafted antibody),是指将鼠的cdr序列移植到人的抗体可变区框架,即不同类型的人种系抗体框架序列中产生的抗体。可以克服嵌合抗体由于携带大量鼠蛋白成分,从而诱导的异源性反应。此类构架序列可以从包括种系抗体基因序列的公共dna数据库或公开的参考文献获得。如人重链和轻链可变区基因的种系dna序列可以在“vbase”人种系序列数据库(在因特网www.mrccpe.com.ac.uk/vbase可获得),以及在kabat,e.a.等人,1991sequences of proteins of immunological interest,第5版中找到。为避免免疫原性下降的同时,引起的活性下降,可对所述的人抗体可变区框架序列进行最少反向突变或回复突变,以保持活性。本公开的人源化抗体也包括进一步由噬菌体展示对cdr进行亲和力成熟后的人源化抗体。进一步描述参与人源化可使用小鼠抗体的方法的文献包括,例如queen等,proc.,natl.acad.sci.usa,88,2869,1991和winter及其同事的方法[jones等,nature,321,522(1986),riechmann,等,nature,332,323-327(1988),verhoeyen,等,science,239,1534(1988)]。
[0046]
术语“全人源抗体”、“全人抗体”或“完全人源抗体”,也称“全人源单克隆抗体”,其抗体的可变区和恒定区都是人源的,去除免疫原性和毒副作用。单克隆抗体的发展经历了四个阶段,分别为:鼠源性单克隆抗体、嵌合性单克隆抗体、人源化单克隆抗体和全人源单克隆抗体。本公开为全人源单克隆抗体。全人抗体制备的相关技术主要有:人杂交瘤技术、ebv转化b淋巴细胞技术、噬菌体显示技术(phage display)、转基因小鼠抗体制备技术(transgenic mouse)和单个b细胞抗体制备技术等。
[0047]
术语“抗原结合片段”是指抗体的保持特异性结合抗原的能力的一个或多个片段。已显示可利用全长抗体的片段来进行抗体的抗原结合功能。“抗原结合片段”中包含的结合片段的实例包括(i)fab片段,由vl、vh、cl和ch1结构域组成的单价片段;(ii)f(ab')2片段,
iology,第66卷,g.e.morris,ed.(1996)。
[0056]
术语“特异性结合”、“选择性结合”、“选择性地结合”和“特异性地结合”是指抗体对预先确定的抗原上的表位的结合。通常,抗体以大约小于10-7
m,例如大约小于10-8
m、10-9
m或10-10
m或更小的亲和力(kd)结合。
[0057]
术语“核酸分子”是指dna分子和rna分子。核酸分子可以是单链或双链的,但优选是双链dna。当将核酸与另一个核酸序列置于功能关系中时,核酸是“有效连接的”。例如,如果启动子或增强子影响编码序列的转录,那么启动子或增强子有效地连接至所述编码序列。
[0058]
术语“载体”是指能够运输已与其连接的另一个核酸的核酸分子。在一个实施方案中,载体是“质粒”,其是指可将另外的dna区段连接至其中的环状双链dna环。在另一个实施方案中,载体是病毒载体,其中可将另外的dna区段连接至病毒基因组中。本文中公开的载体能够在已引入它们的宿主细胞中自主复制(例如,具有细菌的复制起点的细菌载体和附加型哺乳动物载体)或可在引入宿主细胞后整合入宿主细胞的基因组,从而随宿主基因组一起复制(例如,非附加型哺乳动物载体)。
[0059]
现有技术中熟知生产和纯化抗体和抗原结合片段的方法,如冷泉港的抗体实验技术指南,5-8章和15章。抗原结合片段同样可以用常规方法制备。发明所述的抗体或抗原结合片段用基因工程方法在非人源的cdr区加上一个或多个人源fr区。人fr种系序列可以通过比对imgt人类抗体可变区种系基因数据库和moe软件,从immunogenetics(imgt)的网站http://imgt.cines.fr得到,或者从免疫球蛋白杂志,2001isbn012441351上获得。
[0060]
术语“宿主细胞”是指已向其中引入了表达载体的细胞。宿主细胞可包括细菌、微生物、植物或动物细胞。易于转化的细菌包括肠杆菌科(enterobacteriaceae)的成员,例如大肠杆菌(escherichia coli)或沙门氏菌(salmonella)的菌株;芽孢杆菌科(bacillaceae)例如枯草芽孢杆菌(bacillus subtilis);肺炎球菌(pneumococcus);链球菌(streptococcus)和流感嗜血菌(haemophilus influenzae)。适当的微生物包括酿酒酵母(saccharomyces cerevisiae)和毕赤酵母(pichia pastoris)。适当的动物宿主细胞系包括cho(中国仓鼠卵巢细胞系)和ns0细胞。
[0061]
本公开工程化的抗体或抗原结合片段可用常规方法制备和纯化。比如,编码重链和轻链的cdna序列,可以克隆并重组至gs表达载体。重组的免疫球蛋白表达载体可以稳定地转染cho细胞。作为一种更推荐的现有技术,哺乳动物类表达系统会导致抗体的糖基化,特别是在fc区的高度保守n端位点。阳性的克隆在生物反应器的无血清培养基中扩大培养以生产抗体。分泌了抗体的培养液可以用常规技术纯化。比如,用含调整过的缓冲液的a或g sepharose ff柱进行纯化。洗去非特异性结合的组分。再用ph梯度法洗脱结合的抗体,用sds-page检测抗体片段,收集。抗体可用常规方法进行过滤浓缩。可溶的混合物和多聚体,也可以用常规方法去除,比如分子筛、离子交换。得到的产物需立即冷冻,如-70℃,或者冻干。
[0062]“任选”或“任选地”意味着随后所描述的事件或环境可以但不必发生,该说明包括该事件或环境发生或不发生地场合。例如,“任选被烷基取代的杂环基团”意味着烷基可以但不必须存在,该说明包括杂环基团被烷基取代的情形和杂环基团不被烷基取代的情形。
[0063]
术语“药物组合物”表示含有一种或多种本文所述化合物或其生理学上/可药用的
盐或前体药物与其他化学组分的混合物,以及其他组分例如生理学/可药用的载体和赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
[0064]
术语“药学上可接受的盐”或“可药用盐”是指本公开配体-药物偶联物的盐,或本公开中所述的化合物的盐,这类盐用于哺乳动物体内时具有安全性和有效性,且具有应有的生物活性,本公开抗体-抗体药物偶联化合物至少含有一个氨基,因此可以与酸形成盐,药学上可接受的盐的非限制性实例包括:盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硫酸氢盐、柠檬酸盐、乙酸盐、琥珀酸盐、抗坏血酸盐、草酸盐、硝酸盐、梨酸盐、磷酸氢盐、磷酸二氢盐、水杨酸盐、柠檬酸氢盐、酒石酸盐、马来酸盐、富马酸盐、甲酸盐、苯甲酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐。
[0065]
术语“溶剂化物”或“溶剂化合物”指本公开的配体-药物偶联化合物与一种或多种溶剂分子形成可药用的溶剂化物,溶剂分子的非限制性实例包括水、乙醇、乙腈、异丙醇、dmso、乙酸乙酯。
[0066]
术语“载药量”是指式(i)分子中每个配体上加载的细胞毒性药物平均数量,也可以表示为药物量和抗体量的比值,药物载量的范围可以是每个配体(pc)连接0-12个,优选1-10个细胞毒性药物(d)。在本发明的实施方式中,载药量表示为n,示例性的可以为1,2,3,4,5,6,7,8,9,10的均值。可用常规方法如uv/可见光光谱法,质谱,elisa试验和hplc特征鉴定偶联反应后每个adc分子的药物品均数量。
[0067]
本公开的一个实施方式中,细胞毒性药物通过连接单元偶联在配体的n端氨基和/或赖氨酸残基的ε-氨基上,一般地,偶联反应中能与抗体偶联的药物分子数将小于理论上的最大值。
[0068]
可以用以下非限制性方法控制配体细胞毒性药物偶联物的载量,包括:
[0069]
(1)控制连接试剂和单抗的摩尔比,
[0070]
(2)控制反应时间和温度,
[0071]
(3)选择不同的反应试剂。
[0072]
常规的药物组合物的制备见中国药典。
[0073]
术语“载体”用于本公开的药物,是指能改变药物进入人体的方式和在体内的分布、控制药物的释放速度并将药物输送到靶向器官的体系。药物载体释放和靶向系统能够减少药物降解及损失,降低副作用,提高生物利用度。如可作为载体的高分子表面活性剂由于其独特的两亲性结构,可以进行自组装,形成各种形式的聚集体,优选的实例如胶束、微乳液、凝胶、液晶、囊泡等。这些聚集体具有包载药物分子的能力,同时又对膜有良好的渗透性,可以作为优良的药物载体。
[0074]
发明的有益效果
[0075]
本公开制备的式i所示化合物的a晶型、b晶型纯度高,在光照、高温、高湿的条件下晶型稳定性良好,hplc纯度变化小、物理化学稳定性高,更有利于原料的存储和使用。
附图说明
[0076]
图1为式i所示化合物的无定形的xrpd图谱;
[0077]
图2为实施例2所得的式i所示化合物的a晶型的xrpd图谱;
[0078]
图3为式i所示化合物的b晶型的xrpd图谱;
[0079]
图4为实施例4所得的式i所示化合物的a晶型的xrpd图谱;
[0080]
图5为实施例5所得的式i所示化合物的a晶型的xrpd图谱;
[0081]
图6为式i所示化合物的a晶型经dvs检测前后的xrpd图谱对比;
[0082]
图7为式i所示化合物的b晶型经dvs检测前后的xrpd图谱对比。
具体实施方式
[0083]
以下将结合实施例更详细地解释本公开,本公开的实施例仅用于说明本公开的技术方案,并非限定本公开的实质和范围。
[0084]
试验所用仪器的测试条件:
[0085]
1、差示扫描量热仪(differential scanning calorimeter,dsc)
[0086]
仪器型号:mettler toledo dsc 3+
[0087]
吹扫气:氮气
[0088]
升温速率:10.0℃/min
[0089]
温度范围:25-350℃
[0090]
2、x-射线衍射谱(x-ray powder diffraction,xrpd)
[0091]
仪器型号:bruker d8 discovery x-射线粉末衍射仪
[0092]
射线:单色cu-kα射线(cu-kα1波长为cu-kα2波长为cu-kα波长取kα1与kα2的加权平均值)
[0093]
扫描方式:θ/2θ,扫描范围:3-48
°
,5-48
°
[0094]
电压:40kv,电流:40ma;
[0095]
实施例1
[0096]
根据wo2020063676的实施例9制备式i所示化合物,得到的产品经x-射线粉末衍射检测为无定形。
[0097]
实施例2
[0098]
将式i所示化合物(12.2mg,11μmol)加入到0.4ml二氯甲烷中,室温打浆搅拌,离心,吸走上清,残余固体真空干燥,得到10mg式i所示化合物的a晶型。
[0099]
实施例3
[0100]
将式i所示化合物(13.5mg,13μmol)加入到0.4ml乙腈中,室温打浆搅拌,离心,吸走上清液,残余固体真空干燥,得到式i所示化合物的b晶型12mg,其特征峰位置如下表所示:
[0101]
表1:b晶型的xrd特征峰位置
[0102][0103]
实施例4
[0104]
将式i所示化合物(11.5mg,11μmol)加入到0.4ml二氯甲烷中,加入2mg晶种(实施例2),室温打浆搅拌,离心,吸走上清,残余固体真空干燥,得到式i所示化合物的a晶型12mg。其特征峰位置如下表所示:
[0105]
表2:a晶型的xrd特征峰位置
[0106][0107]
实施例5
[0108]
将式i所示化合物(103.3mg,96μmol)加入到40ml二氯甲烷中,加入5mg晶种(实施例4),室温打浆搅拌,离心,吸走上清,残余固体真空干燥,得到式i所示化合物的a晶型102mg。其特征峰位置如下表所示:
[0109]
表3:a晶型的xrd特征峰位置
[0110][0111]
实施例6
[0112]
将式i所示化合物(11.1mg,10μmol)加入到0.4ml乙腈中,加入2mg晶种(实施例3),室温打浆搅拌,离心,吸走上清,残余固体真空干燥,得到式i所示化合物的b晶型11mg。
[0113]
实施例7
[0114]
将式i所示化合物(90mg,84μmol)加入到4ml乙腈中,加入5mg晶种(实施例6),室温打浆搅拌,离心,吸走上清,残余固体真空干燥,得到式i所示化合物的b晶型88mg。
[0115]
实施例8晶型的引湿性研究
[0116]
采用dvs动态水分吸附分析仪,检测各晶型的引湿性,并对各晶型检测dvs后的样品检测xrpd,对比检测dvs前后晶型的xrpd结果。
[0117]
dvs检测后复测a晶型xrd,晶型未转变,如图6。
[0118]
dvs检测后复测b晶型xrd,发现晶型转变,如图7。
[0119]
实施例9
[0120]
将a、b晶型样品敞口平摊放置,分别考察高温(40℃、60℃)和高湿(rh 75%、rh 92.5%)条件下样品的稳定性,取样考察期为30天。
[0121]
表4:影响因素稳定性研究
[0122][0123]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1