海洋真菌产的苯甲醛类化合物及其制备方法和抗炎用途
1.本发明涉及医药技术领域,尤其涉及一种海洋真菌产的苯甲醛类化合物及其制备方法和抗炎用途。
背景技术:
2.炎症是人体对感染、外界刺激和损伤的自我调节反应过程,是对人体有益的适度应激状态的表现,但也会导致组织损伤,诱发相关疾病。目前临床应用的甾体类和非甾体类抗炎药通常有较强的激素样作用(水钠潴留、虚胖、易感染、骨质疏松等)或胃肠道反应和心血管病风险等副作用,新的抗炎药物研发具有重要的意义。
3.许多研究认为核因子κb(nf-κb)是调节肿瘤坏死因子(tnf-α)、白细胞介素(il-1β、il-6)、一氧化氮(no)等炎症因子的中枢转录因子。在这些介质中,诱导型一氧化氮合酶(inos)产生的no自由基,可能会引起一些负面作用,如no的过量产生可能引起头痛、头晕、低血压和类风湿关节炎等炎症性疾病。此外,大量研究表明,活性氧(ros)引发的氧化应激可能是一系列炎症相关疾病的关键机制,而丝裂原活化蛋白激酶(mapks)包括c-jun氨基末端激酶(jnk)、细胞外信号相关激酶(erk)-1/2和p38,是典型的炎症相关信号。
技术实现要素:
4.本发明所要解决的技术问题在于,提供一种具有药用价值的苯甲醛类化合物及其制备方法和用途,以便为炎症治疗提供更多的药物选择。
5.具体的,本发明提供了下述通式(ⅰ)所式的化合物:
[0006][0007]
其中,r为氢;或如式(ⅱ)所示;或如式(ⅲ)所示。
[0008]
具体的,在本发明的一个实施例中,r为h,上式(ⅰ)为对羟基苯甲醛。
[0009]
在本发明的另一个实施例之中,r如式(ⅱ)所示,则上式(ⅰ)为(r)-3-(2,3
‑ꢀ
二羟基-3-甲基丁基)-4-羟基苯甲醛,具体结构式如式(ⅳ)所示。
[0010][0011]
在本发明的又一个实施例之中,r如式(ⅲ)所示,则上式(ⅰ)为4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛,具体结构式如式(v)所示。
[0012][0013]
优选的,本发明中的化合物如式(ⅳ)或式(v)所示,进一步优选的如式 (ⅳ)所示。
[0014]
此外,按照本发明所述技术领域中的一些通常方法,本发明的上式(ⅰ) 可与碱反应生成药学上可接受的盐。其中,碱可选用有机碱或无机碱,示例性的如氢氧化钠、氢氧化钾、甲醇钠、乙醇钠等,但不限于此。
[0015]
具体的,将本发明中的化合物中加入常规的辅料,按照常规工艺,可以制成药学上可接受的各种剂型,如片剂、胶囊剂、口服液、注射剂、软膏剂、颗粒剂、混悬剂或缓释剂等,但不限于此。其中,辅料可包括药学领域常见的粘合剂、润滑剂、崩解剂、稀释剂、助溶剂、稳定剂、悬浮剂等,但不限于此。
[0016]
发明人在对式(ⅰ)的化合物的研究证明,该化合物在0.1~10μm剂量下能显著降低细胞no和ros的产生的水平及il-6和cox-2的水平;并验证了该苯甲醛类化合物是通过抑制inos活性而显著影响no的产生;此外,鉴定了该苯甲醛类化合物是通过抑制p-jnk、p-erk和p38的表达来阻断mapk信号通路的信号传递而发挥抗炎作用。基于此,本发明提供了下述式(ⅰ)的化合物的几种用途:
[0017]
具体的,在本发明的一个实施例中,本发明提供了式(ⅰ)化合物及其在药学上可接受的盐作为活性组分在制备抗炎药物中的应用。
[0018]
在本发明的另一个实施例中,本发明提供了式(ⅰ)化合物及其在药学上可接受的盐作为活性组分在制备抑制细胞内no和ros生成的药物中的应用。
[0019]
在本发明的另一个实施例中,本发明提供了式(ⅰ)化合物及其在药学上可接受的盐作为活性组分在制备抑制il-6、inos、cox-2的蛋白表达以及erk、 jnk和p38的磷酸化水平的药物中的应用。
[0020]
相应的,本发明还提供了式(ⅰ)化合物的制备方法,具体的包括:将海洋真菌土曲霉aspergillus terreus c23-3接种至培养基,通过发酵、提取、分离后得到;其中,海洋真
菌土曲霉aspergillus terreus c23-3于2018年1月22日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no.60316。
[0021]
具体的,在本发明的一个实施例中,对羟基苯甲醛的制备方法为:
[0022]
(1)将海洋真菌土曲霉接种至培养基中培养发酵,得到第一发酵物;
[0023]
具体的,步骤(1)包括:
[0024]
(1.1)将土曲霉aspergillus terreus c23-3在第一培养基中活化,洗涤得到第一孢子悬液;
[0025]
其中,第一培养基为马铃薯蔗糖蛋白胨琼脂培养基,但不限于此;具体的,马铃薯蔗糖蛋白胨琼脂培养基的组成为:土豆汁50~500ml/l,海盐5~50g/l,蔗糖1~100g/l,蛋白胨0.5~50g/l,琼脂1~50g/l;调节其ph为7~7.4。该培养基在使用前,在120~130℃灭菌10~30min。其中,土豆汁的制备方法为:土豆去皮,洗净切碎,加入去离子水,加热煮沸10~40min,过滤即得,每200g土豆煮200ml土豆汁。
[0026]
其中,土曲霉aspergillus terreus c23-3的接种量为每100ml培养基1~3接种环,优选的为2接种环,但不限于此。
[0027]
所述洗涤为每100ml培养基采用10ml生理盐水洗涤,但不限于此。
[0028]
(1.2)将第一孢子悬液接种至第二培养基中发酵,得到第一发酵物;
[0029]
其中,第二培养基为糙米培养基,但不限于此。糙米培养基的组成为:糙米30~80g/60ml,1~3wt%海盐,但不限于此。
[0030]
其中,第一孢子悬液的接种量为1~10vol%,优选的为5vol%;接种结束后加入亚硫酸氢钠甲萘醌(msb),使得体系中msb的浓度为5~15μmol/l,然后发酵。
[0031]
其中,发酵温度为25~30℃,示例性的为25℃、26℃、27℃、28℃、29℃、 30℃,但不限于此;优选的为28℃。发酵时间为18~30天,示例性的为19天、 20天、22天、24天、26天或28天,但不限于此。
[0032]
(1.3)将第一发酵物粉碎;
[0033]
(2)将粉碎的第一发酵物采用第一溶剂提取,得到第一粗提物;
[0034]
其中,第一溶剂选自甲醇、乙醇、丙酮、二氯甲烷、氯仿或乙酸乙酯中的一种或多种,但不限于此。优选的,第一溶剂选用二氯甲烷和甲醇的混合物;进一步优选的,第一溶剂选用二氯甲烷和甲醇的混合物,其体积比为2:1。具体的,将粉碎的第一发酵物采用第一溶剂浸泡10~30h,然后超声提取10~40min,过滤收集滤液。重复上述提取步骤3~6次,合并滤液,即得到第一粗提物。
[0035]
(3)将第一粗提物在硅胶柱中进行洗脱,得到产物;
[0036]
其中,采用减压硅胶柱、常压硅胶柱和/或反相硅胶柱对第一粗提物进行洗脱,但不限于此。优选的,依次采用减压硅胶柱、常压硅胶柱、反相硅胶柱对第一粗提物进行洗脱。
[0037]
其中,减压硅胶柱所采用的洗脱液选自正己烷、乙酸乙酯、甲醇、二氯甲烷中的一种或多种,但不限于此。优选的,减压硅胶柱所采用的洗脱液选自正己烷、乙酸乙酯、甲醇中的一种或多种。进一步优选的,减压硅胶柱所采用的洗脱液依次为:正己烷相、正己烷:乙酸乙酯=4:1、正己烷:乙酸乙酯=2:1、正己烷:乙酸乙酯=1:1、正己烷:乙酸乙酯=1:2、乙酸乙酯、乙酸乙酯:甲醇=20:1、乙酸乙酯:甲醇=10:1、乙酸乙酯:甲醇=5:1、乙酸乙酯:甲醇=3:1、乙酸乙酯:
[0038]
甲醇=1:1(上述比例均为体积比)和甲醇
[0039]
其中,常压硅胶柱所采用的洗脱液选自正己烷、二氯甲烷、甲醇中的一种或多种。优选的,常压硅胶柱所采用的洗脱液依次为:正己烷相、正己烷:二氯甲烷=1:2、正己烷:二氯甲烷=1:3、正己烷:二氯甲烷=1:4、正己烷:二氯甲烷=1:5、二氯甲烷相、二氯甲烷:甲醇=9:1(上述比例均为体积比)、甲醇相。具体的,常压硅胶柱中填料的粒度为200~300目。
[0040]
其中,反相硅胶柱为c18反相层析柱,其所采用的洗脱液选自甲醇和/或水。优选的,反相硅胶柱所采用的洗脱液依次为60vol%甲醇水溶液、70vol%甲醇水溶液、80vol%甲醇水溶液,洗脱采用等度洗脱方式,流速为0.4~0.8ml/min。
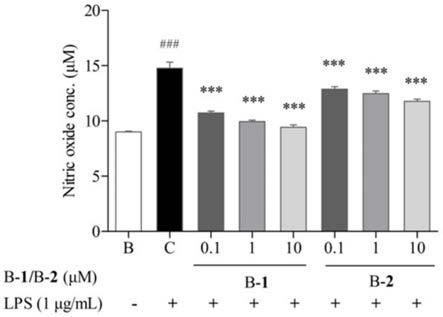
[0041]
优选的,还包括以下步骤:
[0042]
(4)采用分析液相色谱仪对该产物进行检测。
[0043]
具体的,若其保留时间为1.99min的洗脱液,则得到对羟基苯甲醛;
[0044]
在本发明的一个实施例中,分析液相色谱仪为agilent infinity
ꢀⅱꢀ
1260,但不限于此,色谱柱尺寸为4.6mm
×
250mm,填料为ec.c18(4μm),流动相为60% meoh-40%h2o,流速为1ml/min,检测器为dad,检测波长210nm、254nm、 280nm、320nm和365nm。
[0045]
具体的,在本发明的一个实施例中,(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛【式(ⅳ)所示】和4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛【式(v)所示】的制备方法为:
[0046]
(1)将海洋真菌土曲霉接种至培养基中培养发酵,得到发酵液和菌丝体;
[0047]
具体的,步骤(1)包括:
[0048]
(1.1)将土曲霉aspergillus terreus c23-3在第三培养基中活化,洗涤得到第二孢子悬液;
[0049]
其中,第三培养基为马铃薯蔗糖蛋白胨琼脂培养基,但不限于此;具体的,马铃薯蔗糖蛋白胨琼脂培养基的组成为:土豆汁50~500ml/l,海盐5~50g/l,蔗糖1~100g/l,蛋白胨0.5~50g/l,琼脂1~50g/l;调节其ph为7~7.4。该培养基在使用前,在120~130℃灭菌10~30min。其中,土豆汁的制备方法为:土豆去皮,洗净切碎,加入去离子水,加热煮沸10~40min,过滤即得,每200g土豆煮200ml土豆汁。
[0050]
其中,土曲霉aspergillus terreus c23-3的接种量为每100ml培养基1~3接种环,优选的为2接种环,但不限于此。
[0051]
所述洗涤为每100ml培养基采用10ml生理盐水洗涤,但不限于此。
[0052]
(1.2)将第二孢子悬液接种至第四培养基中发酵,得到第二发酵物;
[0053]
其中,第四培养基为马铃薯蔗糖蛋白胨培养基,但不限于此;具体的,马铃薯蔗糖蛋白胨培养基的组成为:土豆汁100~500ml/l,海盐10~50g/l,蔗糖 10~50g/l,蛋白胨1~50g/l,zncl
2 5~20mm;调节其ph为7~7.4。该培养基在使用前,在120~130℃灭菌10~30min。其中,土豆汁的制备方法为:土豆去皮,洗净切碎,加入去离子水,加热煮沸10~40min,过滤即得,每200g土豆煮200 ml土豆汁。
[0054]
其中,第二孢子悬液的接种量为1~10vol%,优选的为5vol%。
[0055]
其中,发酵温度为25~30℃,示例性的为25℃、26℃、27℃、28℃、29℃、 30℃,但不限于此。优选的为28℃。发酵时间为18~30天,示例性的为19天、 20天、22天、24天、26天或28天,但不限于此。
[0056]
(1.3)将第二发酵物固液分离,得到菌丝体和发酵液;
[0057]
其中,可采用离心、过滤等方式进行固液分离,但不限于此。优选的,先在第二发酵物中加入适量硅藻土后过滤,即得到菌丝体和发酵液。
[0058]
(2)将菌丝体采用第二溶剂提取,得到第二提取液;将发酵液采用萃取剂萃取,得到萃取液;将第二提取液与萃取液合并浓缩,得到第二粗提物;
[0059]
其中,第二溶剂选自甲醇、乙醇、丙酮、二氯甲烷、氯仿或乙酸乙酯中的一种或多种,但不限于此。优选的,第二溶剂选用二氯甲烷和甲醇的混合物;进一步优选的,第二溶剂选用二氯甲烷和甲醇的混合物,其体积比为2:1。具体的,将菌丝体采用第二溶剂浸泡0.5~30h,然后超声提取5~60min,过滤收集滤液。重复上述提取步骤3~6次,合并滤液,即得到第二提取液。
[0060]
其中,萃取剂选自乙酸乙酯、二氯甲烷、氯仿、正丁醇中的一种或多种;但不限于此。
[0061]
(3)将第二粗提物在硅胶柱中进行洗脱,得到中间产物;
[0062]
其中,采用减压硅胶柱、常压硅胶柱和/或反相硅胶柱对第二粗提物进行洗脱,但不限于此。优选的,依次采用减压硅胶柱、常压硅胶柱对第二粗提物进行洗脱。
[0063]
其中,减压硅胶柱所采用的洗脱液选自正己烷、乙酸乙酯、甲醇、二氯甲烷中的一种或多种,但不限于此。优选的,减压硅胶柱所采用的洗脱液选自正己烷、乙酸乙酯、甲醇中的一种或多种。进一步优选的,减压硅胶柱所采用的洗脱液依次为:正己烷相、正己烷:乙酸乙酯=4:1、正己烷:乙酸乙酯=2:1、正己烷:乙酸乙酯=1:1、正己烷:乙酸乙酯=1:2、乙酸乙酯、乙酸乙酯:甲醇=20:1、乙酸乙酯:甲醇=10:1、乙酸乙酯:甲醇=5:1、乙酸乙酯:甲醇=3:1、乙酸乙酯:甲醇=1:1(上述比例均为体积比)和甲醇。
[0064]
其中,常压硅胶柱所采用的洗脱液选自正己烷、二氯甲烷、甲醇中的一种或多种。优选的,常压硅胶柱所采用的洗脱液依次为二氯甲烷与甲醇的混合物,两者的体积比为1:1。具体的,常压硅胶柱中填料的粒度为200~300目。
[0065]
(4)将中间产物采用制备液相色谱仪分离,收集特征为分析液相色谱仪测定下保留时间为3.2min的洗脱液,即得到(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛【式(ⅳ)所示】;收集特征为分析液相色谱条件下停留时间为7.99min 的洗脱液,即得到4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛【式(v)所示】。
[0066]
具体的,在本发明的一个实施例中,先采用分析液相色谱仪进行检测,确认产物后,再采用制备液相色谱仪进行分离;在本发明的另一个实施例中,先采用制备液相色谱仪进行分离,然后再采用分析液相色谱仪确定产物。
[0067]
具体的,在本发明的一个实施例中,分析液相色谱仪可选用为agilent infinity
ꢀⅱ
1260,但不限于此,其色谱柱尺寸为4.6mm
×
250mm,填料为ec.c18(4μm),流动相为60%meoh-40%h2o,流速为1ml/min,检测器为dad,检测波长 210nm、254nm、280nm、320nm和365nm。
[0068]
制备液相色谱仪为lisure hp plus 50d,但不限于此;所用层析柱为大连依利特公司生产的sinochrom ods-ap,15μm,20.0mm
×
250mm;流动相为60%甲醇-40%水,流动相的流速为5ml/min,但不限于此。
[0069]
实施本发明,具有如下有益效果:
[0070]
本发明提供的苯甲醛类化合物能显著抑制no和ros的释放,并能有效抑制il-6、inos和cox-2的蛋白表达和erk、jnk、p38磷酸化水平,在制备抗炎药物中具有广泛的应用前景。
附图说明
[0071]
图1是本发明实施例2中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛的核磁共振氢谱;
[0072]
图2为本发明实施例2中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛的核磁共振碳谱;
[0073]
图3为本发明实施例2中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛的高分辨质谱;
[0074]
图4是本发明实施例3中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛细胞毒性实验结果图;其中,b-1为 (r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛,b-2为4-羟基-3-(3-甲基丁基-2-烯
ꢀ‑
1-基)苯甲醛,b为空白组;
[0075]
图5是本发明实施例4中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内no的抑制作用图;其中,b-1为(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛,b-2为4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛,b为空白组,c为对照组;
[0076]
图6是本发明实施例5中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内ros的抑制作用图(细胞荧光图);
[0077]
图7是本发明实施例5中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内ros的抑制作用图(荧光强度图);其中,b-1为(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛,b-2为4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛,b为空白组,c为对照组;
[0078]
图8是本发明实施例6中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内il-6的抑制作用图;其中,b-1为(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛,b-2为4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛,b为空白组,c为对照组;
[0079]
图9是本发明实施例7中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内inos蛋白表达的影响图(免疫印迹图);其中,b-1为(r)-3-(2,3-二羟基-3-甲基丁基)-4
‑ꢀ
羟基苯甲醛,b-2为4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛;
[0080]
图10是本发明实施例7中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内inos蛋白表达的影响图(相对浓度图);其中,b-1为(r)-3-(2,3-二羟基-3-甲基丁基)-4
‑ꢀ
羟基苯甲醛,b-2为4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛,b为空白组,c为对照组;
[0081]
图11是本发明实施例7中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内cox-2蛋白表达的影响图(免疫印迹图);其中,b-1为(r)-3-(2,3-二羟基-3-甲基丁基)-4
‑ꢀ
羟基苯甲醛,b-2为4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛;
[0082]
图12是本发明实施例7中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内cox-2蛋白表达的影响图(相对浓度图);其中,b-1为(r)-3-(2,3-二羟基-3-甲基丁基)-4
‑ꢀ
羟基苯甲醛,b-2为4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛,b为空白组,c为对照组;
[0083]
图13是本发明实施例7中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内erk的磷酸化水平的影响图(免疫印迹图);其中,b-1为(r)-3-(2,3-二羟基-3-甲基丁基)-4
‑ꢀ
羟基苯甲醛,b-2为4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛,p-erk为磷酸化 erk;
[0084]
图14是本发明实施例7中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内erk的磷酸化水平的影响图(相对浓度图);其中,b-1为(r)-3-(2,3-二羟基-3-甲基丁基)-4
‑ꢀ
羟基苯甲醛,b-2为4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛,b为空白组,c为对照组;
[0085]
图15是本发明实施例7中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内jnk的磷酸化水平的影响图(免疫印迹图);其中,b-1为(r)-3-(2,3-二羟基-3-甲基丁基)-4
‑ꢀ
羟基苯甲醛,b-2为4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛,p-jnk为磷酸化 jnk;
[0086]
图16是本发明实施例7中(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4
‑ꢀ
羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对lps诱导的raw264.7细胞内jnk的磷 酸化水平的影响图(相对浓度图);其中,b-1为(r)-3-(2,3-二羟基-3-甲基丁基)-4
‑ꢀ
羟基苯甲醛,b-2为4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛,b为空白组,c为 对照组。
[0087][0088]
具体实施方式
[0089]
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图及具体实施方式对本发明作进一步地详细描述。
[0090]
实施例1对羟基苯甲醛的制备方法
[0091]ⅰ、发酵
[0092]
将土曲霉aspergillus terreus c23-3在马铃薯蔗糖蛋白胨琼脂培养基中活化后接种在糙米培养基中加入终浓度为10μmol/l的亚硫酸氢钠甲萘醌静置培养28 天后收集得到发酵物,并将其粉碎。
[0093]
其中,马铃薯蔗糖蛋白胨琼脂培养基的组成为:土豆汁200ml/l,海盐20g/l,蔗糖20g/l,蛋白胨5g/,琼脂20g/l,ph 7.2
±
0.2。接种量为每100ml培养基接种2接种环。
[0094]
土豆汁的制备方法为:土豆去皮,洗净切碎,加入去离子水,加热至煮沸 30min,过滤,每200g土豆煮200ml土豆汁,冷冻保藏。
[0095]
糙米培养基组成为:糙米50g/60ml,2wt%海盐;经121℃灭菌30min。接种量为
5vol%。
[0096]ⅱ、提取
[0097]
将粉碎的发酵物用甲醇浸泡过夜,超声提取30min(二氯甲烷:甲醇=2:1),过滤收集液,重复3次;合并浓缩,得到粗提物。
[0098]ⅲ、产物分离纯化
[0099]
将粗提物采用常压硅胶柱梯度洗脱(洗脱液依次为使用正己烷相、正己烷:乙酸乙酯=4:1、正己烷:乙酸乙酯=2:1、正己烷:乙酸乙酯=1:1、正己烷:乙酸乙酯=1:2、乙酸乙酯、乙酸乙酯:甲醇=20:1、乙酸乙酯:甲醇=10:1、乙酸乙酯:甲醇=5:1、乙酸乙酯:甲醇=3:1、乙酸乙酯:甲醇=1:1和甲醇),所得洗脱液采用减压硅胶柱进行洗脱(洗脱液依次为正己烷相、正己烷:二氯甲烷=1:2、正己烷:二氯甲烷=1:3、正己烷:二氯甲烷=1:4、正己烷:二氯甲烷=1:5、二氯甲烷相、二氯甲烷:甲醇=9:1、甲醇相);所得洗脱液采用c18反相层析柱洗脱(洗脱液依次为60%甲醇水、70%甲醇水、80%甲醇水等度洗脱,流速0.5ml/min),制备得到符合下述特征的化合物:
[0100]
分析液相色谱分析下,tr=1.99min;其中,分析液相色谱仪为agilent infinity
ꢀⅱ
1260,柱子尺寸为4.6mm
×
250mm,填料ec.c18 4μm,流动相为60% meoh-40%h2o,流速1ml/min,柱温箱常温,检测器为dad,检测波长210nm、 254nm、280nm、320nm和365nm。
[0101]
该对羟基苯甲醛的氢谱:1h nmr(500mhz,meod)δ9.74(1h,s,h-7),7.76 (2h,dt,j=10,5hz,h-2,h-6),6.89(2h,dt,j=10,5hz,h-3,h-5)。
[0102]
该对羟基苯甲醛的碳谱:
13
c nmr(126mhz,meod)δ193.76(c-7),170.29 (c-4),133.49(c-2),133.49(c-6),129.85(c-1),117.11(c-3),116.79(c-5)。
[0103]
实施例2(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛的制备方法
[0104]ⅰ、发酵
[0105]
将土曲霉aspergillus terreus c23-3在马铃薯蔗糖蛋白胨琼脂培养基中活化, 28℃静置培养7天。收集孢子制成悬液,接种到3l的三角瓶中,每个瓶中装有 1l的马铃薯蔗糖蛋白胨培养基,静置发酵28天后收集,过滤分离得到菌丝体和发酵液。
[0106]
其中,马铃薯蔗糖蛋白胨琼脂培养基的组成为:土豆汁200ml/l,海盐20g/l,蔗糖20g/l,蛋白胨5g/,琼脂20g/l,ph 7.2
±
0.2。马铃薯蔗糖蛋白胨琼脂培养基活化时接种量为每100ml培养基接种2接种环。马铃薯蔗糖蛋白胨培养基的组成为:土豆汁200ml/l,海盐20g/l,蔗糖20g/l,蛋白胨5g/l,zncl
2 10mm, ph 7.2
±
0.2。发酵时接种量为5vol%。
[0107]
土豆汁的制备方法为:土豆去皮,洗净切碎,加入去离子水,加热至煮沸 30min,过滤,每200g土豆煮200ml土豆汁,冷冻保藏。
[0108]ⅱ、提取
[0109]
菌丝体用甲醇浸泡过夜,超声提取30min(二氯甲烷:甲醇=2:1),过滤收集液,重复3次;发酵液用乙酸乙酯萃取3次;合并浓缩,得到粗提物。
[0110]ⅲ、产物分离纯化
[0111]
将粗提物采用常压硅胶柱梯度洗脱(洗脱液依次为使用正己烷相、正己烷:乙酸乙酯=4:1、正己烷:乙酸乙酯=2:1、正己烷:乙酸乙酯=1:1、正己烷:乙酸乙酯=1:2、乙酸乙酯、乙酸乙酯:甲醇=20:1、乙酸乙酯:甲醇=10:1、乙酸乙酯:甲醇=5:1、乙酸乙酯:甲醇=
3:1、乙酸乙酯:甲醇=1:1和甲醇),所得洗脱液采用减压硅胶柱进行洗脱(洗脱液为二氯甲烷:甲醇=1:1);所得洗脱液采用液相色谱仪分离(lisurehpplus50d,层析柱为大连依利特公司生产的sinochromods-ap,15μm,20.0mm
×
250mm,流动相为60%甲醇-40%水,流动相的流速为5ml/min),制备得到符合下述特征的化合物:
[0112]
分析液相色谱分析下,tr=3.20min【(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛】,tr=7.99min【4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛】。其中,分析液相色谱仪为agilentinfinityⅱ1260,柱子尺寸为4.6mm
×
250mm,填料ec.c184μm,流动相为60%meoh-40%h2o,流速1ml/min,柱温箱常温,检测器为dad,检测波长210nm、254nm、280nm、320nm和365nm。
[0113]
其中,该(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛的氢谱:1hnmr(700mhz,meod)δ9.78(1h,s,h-7),7.67(1h,d,j=3.0hz,h-2),7.66(1h,dd,j=8.4,2.0hz,h-6),6.89(1h,d,j=8.3hz,h-5),3.82(1h,dd,j=6.9,5.1hz,h-2'),3.11(1h,dd,j=16.7,5.0hz,h
a-1'),2.81(1h,dd,j=16.7,6.9hz,h
b-1'),1.36(3h,s,h-5'),1.32(3h,s,h-4');如图1所示;
[0114]
该(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛的碳谱
13
cnmr(175mhz,meod)δ192.99(c-7),160.50(c-4),134.01(c-2),130.98(c-1),130.43(c-6),122.02(c-3),118.75(c-5),79.70(c-3'),69.70(c-2'),31.83(c-1'),25.86(c-5'),21.73(c-4');如图2所示;
[0115]
该(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛的高分辨质谱:hr-esi
+-ms:实测值m/z383.1486[m+h]
+
(理论计算值:383.1489forc
22h23o6+
),表明吻合很好;如图3所示。
[0116]
该4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛的氢谱:1hnmr(700mhz,meod)δ9.70(1h,s,h-7),7.61(1h,d,j=2.0hz,h-2),7.59(1h,dd,j=8.2,2.1hz,h-6),6.87(1h,d,j=8.2hz,h-5),5.32(1h,m,h-2’),1.75(3h,s,h-4’),1.71(3h,s,h-5’)
[0117]
该4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛的碳谱:
13
cnmr(175mhz,meod)δ193.12(c-7),163.55(c-4),134.01(c-6),132.26(c-3’),131.54(c-1),130.50(c-3),129.94(c-2),122.94(c-2’),116.08(c-5),28.94(c-1’),25.94(c-4’),17.82(c-5’)。
[0118]
实施例3(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛的细胞毒性实验
[0119]
1、实验方法:
[0120]
raw264.7小鼠巨噬细胞系来自中国科学院细胞库(中国,上海),培养基为添加10%胎牛血清和1%青霉素/链霉素的高糖dulbecco改良的eagles培养基(dmem),在37℃的co2浓度为5%的培养箱中培养。通过3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(mtt)法测定(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛对细胞的潜在毒性。
[0121]
空白组:用化合物样品等量的dmem高糖培养基溶液代替样品,其他同样品组测试方法。
[0122]
2、实验结果:
[0123]
上述实施例1获得的(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和2均分别
羟基-3-(3-甲基丁基
ꢀ‑
2-烯-1-基)苯甲醛能显著降低lps刺激raw264.7细胞后ros的产生。
[0138]
实施例6(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛的抑制il-6生成实验
[0139]
1、实验方法:
[0140]
采用elisa试剂盒检测培养细胞上清中il-6水平。将密度为5
×
105个/孔的 raw264.7细胞接种于24孔板中,培养24h。分别用0.1和10μm剂量的 (r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4-羟基-3-(3-甲基丁基-2-烯-1-基) 苯甲醛预处理细胞1h,然后用lps(1μg/ml)刺激24h。收集培养上清液,1000 g离心20min,在450nm处检测吸光度值。
[0141]
空白组:用化合物样品等量的dmem高糖培养基代替样品,但不以lps 刺激,其他同样品组测试方法。
[0142]
对照组:用化合物样品等量的dmem高糖培养基代替样品,其他同样品组测试方法。
[0143]
2、实验结果:
[0144]
该(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4-羟基-3-(3-甲基丁基-2
‑ꢀ
烯-1-基)苯甲醛在0.1μm和10μm剂量下,il-6水平呈剂量依赖性下降,而受 lps刺激的细胞中il-6的产生水平显著升高(图8),由此可见,本发明中的 (r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4-羟基-3-(3-甲基丁基-2-烯-1-基) 苯甲醛能显著降低lps刺激raw264.7细胞后il-6的产生。
[0145]
实施例7(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛抗炎机制的蛋白质印迹实验
[0146]
1、实验方法:
[0147]
将密度为5
×
106个/孔的raw246.7细胞接种于6孔板,分别用0.1和10μm 剂量的(r)-3-(2,3-二羟基-3-甲基丁基)-4-羟基苯甲醛和4-羟基-3-(3-甲基丁基-2
‑ꢀ
烯-1-基)苯甲醛处理1h,然后用lps(1μg/ml)刺激24h。使用含有蛋白酶和磷酸酶抑制剂鸡尾酒的ripa缓冲液获得细胞裂解液,用冷pbs冲洗三次。
[0148]
用pierce bca蛋白测定试剂盒测定蛋白浓度。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)对20~40μg的等长蛋白进行电泳分离,然后转移到硝酸纤维素(nc)滤膜上,在室温下用5%脱脂牛奶溶解tbst封闭膜2h。使用一抗和hrp结合的二抗孵育检测特定蛋白,然后增强化学发光。用印迹法直观获得图像,用化学发光仪进行定量,并用image j软件进行分析。
[0149]
空白组:用化合物样品等量的dmem高糖培养基代替样品,但不以lps 刺激,其他同样品组测试方法。
[0150]
对照组:用化合物样品等量的dmem高糖培养基代替样品,其他同样品组测试方法。
[0151]
2、实验结果:
[0152]
实验结果如图9~图16所示,从图中可以看出,上述的(r)-3-(2,3-二羟基-3
‑ꢀ
甲基丁基)-4-羟基苯甲醛和4-羟基-3-(3-甲基丁基-2-烯-1-基)苯甲醛能够显著降 低inos、cox-2的表达量和erk、jnk和p38的磷酸化水平。
[0153]
综合以上实施例可以看出,本发明提供的苯甲醛类化合物能显著抑制no 和ros的释放,并能有效抑制il-6、inos和cox-2的蛋白表达和erk、jnk、 p38磷酸化水平,在制备抗炎药物中具有广泛的应用前景。
[0154]
以上所述是发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1