一种黑曲霉真菌对多环芳烃菲的生物降解方法与流程
本发明属于有机污染物生物修复技术领域,具体涉及一种多环芳烃的降解方法,特别涉及一种黑曲霉真菌对多环芳烃菲的生物降解方法。
背景技术:
多环芳烃(polycyclic aromatic hydrocarbon,PAHs)是环境中普遍存在的一类由两个或两个以上的苯环结合在一起的化合物,由于这类化合物具有致畸、致癌、致突变的特性而备受关注,菲因具有一个“湾”区(bay region)和一个K区(kregion),使其成为多环芳烃的典型代表物,因此以菲作为底物研究有重要意义,多环芳烃化合物能被单一微生物或微生物群体全部或部分降解,目前已分离出多种具有PAHs降解能力的细菌、真菌和藻类。PAHs能够长期存在于环境中的原因主要有:溶解度低,不易被生物所利用;PAHs降解产物的毒性作用;底物的竞争;PAHs浓度太低不至于诱导产生裂解酶。许多环境因子也可能影响到PAHs的生物降解。因此了解微生物对PAHs的代谢作用,对于有效进行污染环境的生物修复具有重要作用,菲为三环多环芳烃代表物,生物降解是污染环境中菲去除的主要途径,菲的降解已有不少报道,但目前已知的菌株对菲的降解速度不甚理想,降解效率低。
技术实现要素:
本发明的目的在于:提供一种黑曲霉真菌对多环芳烃菲的生物降解方法,该方法是将黑曲霉真菌投放到含有多环芳烃菲的废水中,为多环芳烃的降解提供了一种更有效的方法,该方法降解效率高、降解程度大。
本发明采用的技术方案,包括以下步骤:
1、制备固体生长培养基:将200g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入20g 葡萄糖和20g 琼脂,用水定容至1000mL,分装到试管中,112-125℃灭菌20min,制成固体生长培养基(斜面);
2、制备液体生长培养基:将200g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入20g 葡萄糖,用水定容至1000mL,分装到250mL锥形瓶中,每瓶40mL,112-125℃灭菌20min,制成液体生长培养基;
3、制备液体营养限制培养基:将100g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入10g 葡萄糖,用水定容至1000mL,分装到250mL锥形瓶中,每瓶40mL,制成液体营养限制培养基;
4、降解实验:中科院友情提供的黑曲霉真菌接种到固体生长培养基斜面上,在培养箱中28-30℃培养5-7d,制备斜面菌种;在无菌条件下将斜面菌种接种到液体生长培养基中,放入摇床30℃、150r/min条件下培养24小时,制备黑曲霉降解剂;在液体营养限制培养基中,调节至不同pH值,加入不同浓度的菲(微量丙酮助溶)后112-125℃灭菌20min,在无菌条件下将黑曲霉降解剂接种到液体营养限制培养基中,30℃、150r/min条件下摇床培养,不同时间后取样测定;
5、分析测定:用20mL二氯甲烷或乙酸乙酯超声萃取残留目标污染物3次,合并提取液,并定容到25 mL容量瓶中,用微量移液管取0.1mL于K.D.浓缩器,氮气吹干后,再以甲醇定容到1mL,当菲含量很低时,将合并的提取液用旋转蒸发仪浓缩近干,再以甲醇定容到1mL,移入色谱进样瓶,用高效液相色谱测定。
所述的不同的pH值分别为3、5、7、9。
所述的不同浓度的菲分别为60μg/mL、80μg/mL、100μg/mL、120μg/mL、140μg/mL、160μg/mL。
所述的不同时间分别为0d、2d、4d、6d、8d。
所述的高效液相色谱检测条件:检测波长:254nm;柱温:38℃;流动相:乙腈∶水(90∶10);流速:0.5mL/min;进样量:20μL。
本发明的有益效果:本发明提高了降解速度和效率,在菲的浓度为100μg/mL、pH为7、培养时间为6d的条件时降解效果最好,降解率达到了85%,本发明是处理含菲废水上的一大创新,具有巨大的经济和社会效益。
附图说明
图1为本发明菲初始浓度对降解的影响。
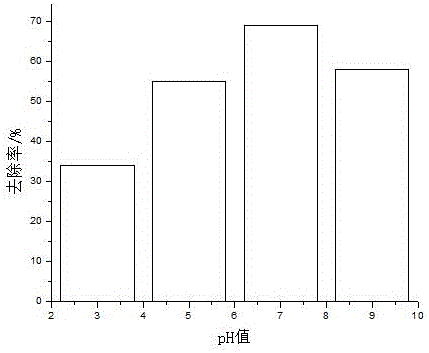
图2为本发明pH值对降解的影响。
图3为本发明降解时间对降解的影响。
具体实施方式
以下结合实施例对本发明的具体实施方式作详细说明。
实施例1:菲初始浓度的选择
1、制备固体生长培养基:将200g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入20g 葡萄糖和20g 琼脂,用水定容至1000mL,分装到试管中,112-125℃灭菌20min,制成固体生长培养基(斜面);
2、制备液体生长培养基:将200g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入20g 葡萄糖,用水定容至1000mL,分装到250mL锥形瓶中,每瓶40mL,112-125℃灭菌20min,制成液体生长培养基;
3、制备液体营养限制培养基:将100g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入10g 葡萄糖,用水定容至1000mL,分装到250mL锥形瓶中,每瓶40mL,制成液体营养限制培养基;
4、降解实验:中科院友情提供的黑曲霉真菌接种到固体生长培养基斜面上,在培养箱中28-30℃培养5-7d,制备斜面菌种;在无菌条件下将斜面菌种接种到液体生长培养基中,放入摇床30℃、150r/min条件下培养24小时,制备黑曲霉降解剂;在液体营养限制培养基中,调节pH值至7,分别加入60μg/mL、80μg/mL、100μg/mL、120μg/mL、140μg/mL、160μg/mL菲(微量丙酮助溶)后112-125℃灭菌20min,在无菌条件下将黑曲霉降解剂接种到液体营养限制培养基中,30℃、150r/min条件下摇床培养,6d后取样测定;
5、分析测定:用20mL二氯甲烷或乙酸乙酯超声萃取残留目标污染物3次,合并提取液,并定容到25 mL容量瓶中,用微量移液管取0.1mL于K.D.浓缩器,氮气吹干后,再以甲醇定容到1mL,当菲含量很低时,将合并的提取液用旋转蒸发仪浓缩近干,再以甲醇定容到1mL,移入色谱进样瓶,用高效液相色谱测定;
在实验条件下,当菲的初始浓度过高或过低,均不利于菲及其代谢产物的降解。当菲的初始浓度过高时,菲及其代谢产物对微生物有很高的毒性,降解速率缓慢;当菲的初始浓度过低时,不利于微生物的利用。从图1可以看出,在此实验条件下,菲的初始浓度在100 μg/mL时,有利于菲的降解。
实施例2:pH值对降解的影响
1、制备固体生长培养基:将200g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入20g 葡萄糖和20g 琼脂,用水定容至1000mL,分装到试管中,112-125℃灭菌20min,制成固体生长培养基(斜面);
2、制备液体生长培养基:将200g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入20g 葡萄糖,用水定容至1000mL,分装到250mL锥形瓶中,每瓶40mL,112-125℃灭菌20min,制成液体生长培养基;
3、制备液体营养限制培养基:将100g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入10g 葡萄糖,用水定容至1000mL,分装到250mL锥形瓶中,每瓶40mL,制成液体营养限制培养基;
4、降解实验:中科院友情提供的黑曲霉真菌接种到固体生长培养基斜面上,在培养箱中28-30℃培养5-7d,制备斜面菌种;在无菌条件下将斜面菌种接种到液体生长培养基中,放入摇床30℃、150r/min条件下培养24小时,制备黑曲霉降解剂;在液体营养限制培养基中,分别调节pH值至3、5、7、9,加入100μg/mL的菲(微量丙酮助溶)后112-125℃灭菌20min,在无菌条件下将黑曲霉降解剂接种到液体营养限制培养基中,30℃、150r/min条件下摇床培养,6d后取样测定;
5、分析测定:用20mL二氯甲烷或乙酸乙酯超声萃取残留目标污染物3次,合并提取液,并定容到25 mL容量瓶中,用微量移液管取0.1mL于K.D.浓缩器,氮气吹干后,再以甲醇定容到1mL,当菲含量很低时,将合并的提取液用旋转蒸发仪浓缩近干,再以甲醇定容到1mL,移入色谱进样瓶,用高效液相色谱测定;
从图2可以看出,随着pH值的增大,降解率出现先增大后减小的趋势,pH=7时菲降解效果最好,本实验均选用pH值等于7。
实施例3:最佳降解时间的确定
1、制备固体生长培养基:将200g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入20g 葡萄糖和20g 琼脂,用水定容至1000mL,分装到试管中,112-125℃灭菌20min,制成固体生长培养基(斜面);
2、制备液体生长培养基:将200g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入20g 葡萄糖,用水定容至1000mL,分装到250mL锥形瓶中,每瓶40mL,112-125℃灭菌20min,制成液体生长培养基;
3、制备液体营养限制培养基:将100g 去皮马铃薯切碎,加入1000mL 水,煮沸30min,双层纱布过滤并收集滤液,滤液中加入10g 葡萄糖,用水定容至1000mL,分装到250mL锥形瓶中,每瓶40mL,制成液体营养限制培养基;
4、降解实验:中科院友情提供的黑曲霉真菌接种到固体生长培养基斜面上,在培养箱中28-30℃培养5-7d,制备斜面菌种;在无菌条件下将斜面菌种接种到液体生长培养基中,放入摇床30℃、150r/min条件下培养24小时,制备黑曲霉降解剂;在液体营养限制培养基中,调节pH值至7,加入100μg/mL的菲(微量丙酮助溶)后112-125℃灭菌20min,在无菌条件下将黑曲霉降解剂接种到液体营养限制培养基中,30℃、150r/min条件下摇床培养,不同时间后取样测定;
5、分析测定:用20mL二氯甲烷或乙酸乙酯超声萃取残留目标污染物3次,合并提取液,并定容到25 mL容量瓶中,用微量移液管取0.1mL于K.D.浓缩器,氮气吹干后,再以甲醇定容到1mL,当菲含量很低时,将合并的提取液用旋转蒸发仪浓缩近干,再以甲醇定容到1mL,移入色谱进样瓶,用高效液相色谱测定;
从图3可以看出,不同的取样时间,菲降解率也会有变化,曲线的总体趋势是随着时间的增长,菲降解率不断的增加,当达到6天左右,曲线趋于平稳,降解率基本维持不变值为80%。所以取样的最佳时间为6天。
- 还没有人留言评论。精彩留言会获得点赞!