微流体设备和用于分析试样的方法与流程
由de102011078770a1已知一种微流体设备。该微流体设备特别地包括相互流体地连接的通道。微流体设备特别地适用于运输和分析流体。
此外,由文件de102010031212a1已知由多个材料层构成的多层系统,以及用于制造这样的多层系统的制造方法。
由此出发说明根据独立权利要求的特征所述的微流体设备连同方法和系统。通过在各个从属权利要求中提及的特征,所述微流体设备的和所述方法的有利的改进方案和改善方案是可能的。
介绍了一种用于分析试样的微流体设备,该微流体设备包括至少两个用于试样容纳的流体路径和至少一个用于用来测量光的探测单元的检测区域,该探测单元被设置用于在检测区域上检测从试样发射到至少两个流体路径中的光。
术语“微流体的”这里主要涉及微流体设备的尺寸布置。微流体设备的特征在于,在布置在其中的流体通道和腔室中,下述物理现象是重要的:所述物理现象通常被归入微技术(mikrotechnik)。例如毛细作用、与流体的表面张力有关的作用(特别地是机械作用)属于所述物理现象。此外例如热泳和电泳的作用也属于所述物理现象。这些现象在微应用流体学中相对于例如重力的作用而言通常占据主导地位。微流体设备的特征还可以在于,其至少部分地利用一层一层的方法来制造并且在层结构的层之间布置有通道。概念“微流体的”也可以通过在设备之内的、用于引导流体的横截面来表征。横截面通常例如在100μm[微米]乘以100μm直至800μm乘以800μm的范围中。
微流体设备特别地可以涉及所谓的“芯片上的实验室”。这样的“芯片上的实验室”被确定和设置用于:执行生化过程。这意味着,宏观的实验室的功能性例如被集成到塑料基底中。微流体设备可以例如具有通道、反应腔室、上游的试剂、阀、泵和/或驱动(aktuation)-、探测-和控制单元。微流体设备可以实现的是,全自动地处理生化过程。由此例如可以执行在液体试样处的测试。这种类型的测试可以例如用于医学中。微流体设备也可以被称为微流体的筒。特别地通过将试样输入到微流体设备中可以在微流体设备中执行生化过程。在此也可以将附加的物质与试样混合,所述附加的物质触发、加速和/或实现生化反应。可以通过探测单元通过如下方式来实现分析:这样地放置微流体设备,使得探测单元可以至少覆盖所述检测区域(也就是说可以特别地接收从检测区域发出的光)。探测单元不是微流体设备的组成部分。微流体设备特别地可以不依赖于探测单元地被填充试样。
微流体设备示例性地借助于分子诊断的探测方法来说明。微流体设备的其它应用领域可以例如在免疫学或临床化学的领域中。微流体设备特别地可以用于体外诊断学。
微流体设备优选地特别地被设置和确定用于:分析核酸。这可以特别地包括dna的分析。微流体设备特别地可以简化多个、特别地不同的分析-和/或探测方法的执行。微流体设备特别地可以实现的是,可以同时(或顺序地)和/或以组合的方式执行多种分析-和/或探测方法。特别地可以在微流体设备的不同区域中或在流体路径的不同区域中执行不同的分析-和/或探测方法。
微流体设备被设置和确定用于:将试样容纳在流体路径中。在此可以将试样划分到多个流体路径上。备选地可以在不同的流体路径中分离地容纳多个不同的试样。微流体设备优选地包括微流体网络(该微流体网络特别地由流体路径所形成)。特别优选地,微流体网络高度集成地来实施。这意味着,在小的空间上实现大的功能性。微流体设备优选地包括泵、阀和控制设备,该微流体设备被确定和设置用于:在流体路径中和/或通过流体路径输送试样。微流体设备特别地可以通过阀的不同的调整来用于不同的应用。
流体路径优选地至少基本上彼此分离。这意味着,在各个流体路径中的液体和其它物质至少直至各个期望的交接区还没有相互触碰和/或相互混合,在所述接口处明确地期望、并且目标明确地引起掺拌。例如可以将多个流体路径在共同的反应腔室中聚集在一起(那么共同的反应腔室由此是在各个流体路径之间的交接区)。在这种情况下,流体路径除了到该共同的反应腔室中的开口之外彼此分离。流体路径也可以完全地彼此分离。在这种情况下,在不同的流体路径之间不存在交接区。
流体路径此外优选地彼此热分离,使得试样(部分)在不同的流体路径中可以具有不同的温度。优选地,各个流体路径的温度可以各自地调整。同样优选的是,在流体路径之间设置辐射屏障。由此可以特别地实现的是,外部的辐射(例如为了激励目的)可以被耦合进入到流体路径上或者局部地受限制地耦合进入。
探测单元优选地包括传感器、特别是光学传感器。光学传感器优选地被设置用于:探测电磁辐射(特别是光)并且转变成电子信号。优选地,探测单元被设置用于执行时间-和位置分辨的测量并且生成时间-和位置分辨的测量信号。
此外,探测单元优选地包括:用于电子地处理所接收的信号的信号处理单元、以及用于可视地展示所接收和处理了的信号的信号再现单元。信号处理单元优选地实施成计算机(特别地具有计算机处理器)。信号再现单元优选地包括屏幕。备选地优选的是,探测单元仅仅具有一接口,所述接口输出电子信号,所述电子信号适合并且确定用于:通过信号处理单元来处理并且接着通过信号再现单元来展示。计算机例如可以联接到所述接口处。
探测单元优选地被设置用于:特别是尤其好地探测这样的波长的光,该光由在微流体设备中的试样发射或者可以预期的是,当利用试样执行一种确定的研究方法时,在微流体设备中被研究的试样就典型地发射该光。所述光可以特别地涉及具有在150至900nm[纳米]的范围中的、特别是在300至700nm的范围中的波长的电磁波。特别地,所述光可以涉及(对于人类而言)可见的光。
光可以由于生化过程而从试样发出。试样也可以通过生化过程至少部分地转化成可以发射光的物质。此外,也可以通过生化过程释放能够发射光的物质。光可以特别地由于荧光被发射。优选地,微流体设备如此地设置,使得对于试样或通过生化过程形成的或释放的物质的外部的激励是可能的。由此可以特别地强烈地激励且特别地良好地测量荧光。
生化过程特别地可以涉及这样的过程:该过程通常被执行用于分析核酸(或dna)。特别地被考虑作为分析方法的是:(实时)放大、熔化曲线分析和微阵列分析。
“放大”特别地可以理解成dna通过酶(例如聚合酶)的扩增。在这种情况下可以释放荧光物质。通过测量发出荧光的光可以获取扩增的程度。也就是说,光强度和/或光信号的空间上的延伸范围可以提供关于dna的扩增程度的情况说明。优选地特别地在试样的整个延伸范围上检测整体的由试样发射的光。备选地可以观察试样的代表性的片段。
“代表性的”意味着,仅仅测量试样的一部分被测量,其中,所测量到的值可以换算到整个试样上。在试样的代表性的片段中,对于非缩放的特性所测量到的值优选地相应于整个试样的平均值。非缩放的特性、例如密度不取决于被观察的试样的量。此外,缩放的特性(例如质量)在试样的代表性的片段处所测量到的值相应于所述片段在整个试样上的比例地小于该特性的对于整个试样能够测量的值。
如果实时地测量光,那么放大也可以被称为实时放大。通过实时放大可以检测放大的时间上的变化曲线。特别地可以借助于(实时)放大来检测dna的定量的扩增程度。实时放大可以例如涉及所谓的“实时聚合酶链式反应(real-timepcr)”。术语“链式反应”(英文“chainreaction”)在此涉及:放大反应的产物又可以是再一次的放大反应的原材料。
因为利用所描述的微流体设备的(实时)放大可以在不同的彼此分离的流体路径中发生,因此还可以提及多井(实时)放大。多井(实时)放大优选地在微流体设备的多井-腔室中执行,在所述多井-腔室中设置有多个凹部(井)。所述多井-腔室优选地具有在5μl至50μl[微升]范围中的、特别是在10μl至25μl范围中的容积。所述凹部优选地分别具有在微微升范围或纳升范围中的容积。
熔化曲线分析特别地可以包括dna的加热。在此,在特征温度的情况中可以发射一种发出荧光的物质。特征温度可以例如实现dna区段的识别。通过测量发出荧光的光相对于(特别是连续地且受控地升高的)温度的强度可以识别dna。正如在(实时)放大的情况中一样,以下情况对于熔化曲线分析而言也是优选的:可以在试样的整个延伸范围上检测从试样发射的光。
对于微阵列分析而言,特别地可以使用由多个测试单元格构成的微阵列(也就是说带有具有在微米范围中的结构的列和行的系统)。特别地可以将几千个测试单元格布置在微阵列中。不同的测试单元格可以特别地通过使用自动化装置设有不同的(已知的)测试物质。通过将试样添加到微阵列上会出现试样的组成部分和测试物质中的不同的测试物质的杂化(也就是说附加)。在这种情况下会出现荧光的光的发射或发出荧光的物质的释放和/或形成。试样也可以设有荧光剂,使得荧光的光的发射表明试样(的组成部分)在确定的测试单元格中的存在。通过测量在测试单元格的哪些测试单元格中(也就是说由于测试物质中的哪些测试物质)出现荧光的光的发射,可以识别试样的组成部分。
微阵列分析也可以以两个或多个试样来同时执行。在此可以例如以第一荧光剂掺入第一试样并且以第二荧光剂掺入第二试样。如果由第一和第二荧光剂发射的光在波长上(也就是说颜色上)不同,则可以通过光的波长选择的测量来同时分析两个试样。具有不同试样的这种类型的微阵列分析可以例如用于比较两种试样、特别是健康的和患病的单元格。利用所描述的微流体设备可以进行在封闭的系统之内(也就是说在微流体设备之内)的比较,由此可以减少误差。
在微阵列分析的情况下,优选的是:特别地以下述分辨率对于发射的光进行位置分辨的测量,所述分辨率使得对于各个测试单元格的分析成为可能(也就是说测量信号的像素至少小于一个测试单元格)。优选地,分辨率至少如此大,使得能够利用至少十个像素来展示一个测试单元格。
所描述的分析方法优选地以彼此组合的方式来执行。例如优选的是,首先(特别是在定量地测量实时的扩增程度的情况下)执行放大并且接着借助于微阵列分析在品质上研究以增大的量存在的dna或者识别在试样中的dna的组成部分。利用所描述的微流体设备可以特别地执行所描述的分析方法。这可以特别地同时或时间上紧挨着地相继地实现。微流体设备特别地优选地如此实施:使得用于探测单元的检测区域包括微流体设备的这样的部分,所述部分被设置和确定用于(并行地)执行不同的分析方法。
利用探测单元特别地能够在检测区域之内检测所发射的光的总强度(它例如对于(实时)放大和熔化曲线分析而言是必须的)。在此,总强度意味着,以总计的方式来检测在试样的检测区域之内发射的所有光。也就是说将在检测区域上的光强度进行积分(integrieren)。也可能的是,不是对于所有检测区域、而是仅仅对于其中的一部分来确定强度。这可以是特别有意义的:用来检测由流体路径(或者由流体路径中的一个流体路径的一部分、特别是例如由反应腔室)所发射的光。在这种情况下例如可能的是,利用探测单元对于两个流体路径分离地且同时地执行(实时)放大,其中,可以获取在各个流体路径中的关于dna的扩增程度的定量的结论。接着例如执行微阵列分析(例如在反应腔室中,该反应腔室可以利用来自两个除此之外分离的流体路径的试样来填充并且该反应腔室同样布置在探测单元的检测区域之内),这样可以对于微阵列分析使用相同的探测单元。对于发射的光的位置分辨的检测对于微阵列分析是优选的。
这意味着,一方面优选地设置用于不同过程的空间(例如用于多个分离的(实时)放大以及用于微阵列分析)。另一方面优选的是,发射的光的位置分辨的检测是可能的。当仅仅实现特别大的检测区域或者仅仅实现特别高的位置分辨率时,那么探测单元可以特别地成本有利地实施。在大的检测区域上的高的位置分辨率可以仅在大的(成本)费用的情况下实现。所描述的微流体设备这里提供了下述优点:在特别小的空间上实施。由此可以在探测单元的检测区域内不仅例如执行多个分离的(实时)放大,而且还执行微阵列分析,其中,位置分辨率特别地对于微阵列分析而言是足够的。这可以特别地节省用于探测单元的成本(因为不需要特别高分辨率的探测单元)或者可以放弃使用多个探测单元。
检测区域优选地具有200至2000mm2[平方毫米]、特别地在500至1500mm2的范围中的面积。检测区域例如可以实施成具有30mm乘以30mm[毫米]的正方形。在微流体设备上的检测区域的位置可以是可变的。这意味着,通过微流体设备相对于探测单元的推移可以推移在微流体设备上的检测区域。
通过划分到多个流体路径中可以彼此分离地执行生化过程。在此特别地可以抑制在不同的试样或试样的组成部分之间的反应并且实现更稳定的过程引导。在不同的流体路径中的试样(的组成部分)之间的这样的反应也可以被称为横向反应(querreaktion)。横向反应在大多应用中是非期望的并且是有妨碍的。例如在多于四个引物对(primer-paaren)(例如特别地6至60个引物对)的高的复合度的情况下或在并行的rna-和dna放大的情况下会出现非期望的反应。
还可以通过划分到流体路径中、特别地还是在没有品质损失的情况下来减少过程时间。这例如在下述实施方式中是这种情况,在所述实施方式中,在流体路径中的第一流体路径中发生rna放大并且在流体路径中的第二流体路径中发生dna放大。通过将试样划分到不同的流体路径中可以减少(化学的或生化的)反应的、特别是复合反应的复杂度。这可以减少反应-和/或过程时间。
此外可以通过划分到流体路径中实现的是,可以在不同的时间执行不同的分析,和/或至少可以在不同的时间实现对于不同分析的分析利用。这样可以特别地将持续不同长时间的分析进行组合。还可以获取事先-或中间结果。试样可以根据事先-或中间结果被继续处理。可选地还可以获取在不同的过程步骤之间的多个事先-或中间结果。
还可以分离地对于分析的参考-和目标分子进行处理。特别地可以在使用(发出荧光)的光的仅仅一个波长的情况下分析参考-和目标分子。
在微流体设备的一种优选的实施方式中,探测单元具有摄像机地实施。
摄像机可以例如实施成ccd-或cmos摄像机或具有ccd-或cmos芯片。优选地,摄像机被设置用于:位置分辨地并且大面积地检测微流体设备的检测区域(也就是说,对于从检测区域、特别地由微流体设备中的试样发出的光进行探测)。摄像机特别优选地被设置用于探测荧光、化学发光和/或生物发光。优选地,摄像机特别地对于具有在150至900nm[纳米]范围中的、特别地在300至700nm范围中的波长的电磁辐射(也就是说特别地对于光)而言是敏感的。
在另一优选的实施方式中,微流体设备具有用于将从激励设备发出的激励耦合进入到试样中的耦合进入区域。
激励设备优选地涉及用于辐射、特别是电磁辐射的源。优选地,激励设备被设置用于:发出具有在150至900nm[纳米]范围中的波长的电磁辐射。
优选地,激励设备涉及热源。激励设备特别优选地包括激光器。激光器优选地被设置用于(特别地在试样之内的)荧光激励。激励设备不是微流体设备的组成部分。
激励设备到试样上的作用在(整个)耦合进入区域上是可能的,其中,不必在耦合进入区域的所有位置处同时产生作用。耦合进入区域是下述区域,在所述区域中产生作用是可能的。优选地,激励设备的耦合进入区域与探测单元的检测区域相重叠。特别优选的是,激励设备的耦合进入区域和探测单元的检测区域(完全)相符合。
在一种实施方式中,激励设备被设置用于:以一个或多个(离散)的波长的电磁辐射作用到微流体设备中的试样上,或者被设置用于:将这样的电磁辐射耦合进入到微流体设备中的试样中。通过这样的作用或耦合进入可以特别地在试样之内产生荧光。
特别地在(实时)放大、多井实时放大(multi-wellechtzeitamplifikation)和熔化曲线分析的情况下优选地实现激发、也就是说对于试样的激励。微阵列分析优选地同样在激励的情况下执行。但是备选地也可以自动荧光地(也就是说没有外部激励的情况下)发生微阵列分析。
同样优选地是,通过激励光以及特别地通过(特别是用于调整激励波长的)滤光器系统来实现激励。
在微流体设备的另一优选的实施方式中,在流体路径的每个流体路径中设置至少一个用于容纳试样的至少一部分的腔室。
所述腔室例如可以涉及:用于执行(生物)化学反应的过程-或反应腔室、用于执行(实时)放大的放大腔室、用于(特别是对于荧光以及特别地借助于探测单元进行)测量的探测腔室、用于将试样与(测试)物质混合的混合腔室和/或用于对于试样、反应(中间)产物或(测试)物质进行(中间)储存的储存腔室。一个腔室也可以同时或依次用于多个不同的目的。所述腔室中的每个腔室可以被分成多个单元格,以便形成用于微阵列分析的微阵列。
在一种实施方式中,用于dna-和/或rna放大的放大腔室(也就是说在其中可以发生放大的腔室)如此布置,使得整个放大腔室或其中至少一个代表性的部分(例如以2mm乘以2mm[毫米]的尺寸)位于探测单元的检测区域中。因此可以直接在放大腔室中执行并且检测熔化曲线分析或(实时)放大。特别地优选的是,至少两个流体路径如此布置,使得所有路径的放大腔室同时布置在探测单元的检测区域中。
同样优选的是如下实施方式,其中探测腔室(在流动技术上地)连接到放大腔室处,以使得可以将试样从放大腔室运送到探测腔室中。特别优选的是,探测腔室位于探测设备的检测区域之内。
优选地,腔室特别地可以在25℃与100℃之间、优选地甚至在15℃与100℃之间进行调温。特别优选的是,腔室可以被单个地带到独立的温度上。为了冷却和/或加热腔室优选地设置了冷却装置和/或加热装置。加热装置例如可以涉及用于产生电阻热量的加热线或者涉及用于产生辐射热量的辐射源。冷却装置例如可以涉及用于冷却介质的冷却管线。
腔室优选地布置在共同的平面之内。备选地优选的是,腔室布置在多个平面中,它们特别地平行于检测区域(或微流体设备的表面)地布置。
在另一优选的实施方式中,微流体设备此外具有端部腔室,所述端部腔室与至少两个流体路径相连接。端部腔室还可以被分成多个单元格,以便于形成用于微阵列分析的微阵列。
端部腔室例如可以涉及:用于执行(生物)化学反应的过程-或反应腔室,用于执行(实时)放大的放大腔室,用于(特别是对于荧光以及特别地借助于探测单元进行)测量的探测腔室,用于将试样与(测试)物质相混合的混合腔室和/或用于对于试样、反应(中间)产物或(测试)物质进行(中间)储存的储存腔室。端部腔室也可以同时或依次用于多个不同目的。同样优选地是,端部腔室实施成以上另外描述的多井-腔室。
端部腔室优选地如此与至少两个流体路径相连接,使得试样可以从流体路径被导引到端部腔室中并且在那里被混合。优选地,除了流体路径通过端部腔室的间接连接之外不存在流体路径之间的连接(它们因此彼此分离)。
在端部腔室中优选地设置微阵列。端部腔室优选地完全位于探测单元的检测区域之内。备选地,微阵列至少(完全)位于检测区域之内。
在一种实施方式中,(例如以实时pcr的形式的)(实时)放大连接在微阵列分析之前。在这种情况下可以在流体路径中的一个或多个流体路径中(特别地彼此分离地)执行(实时)放大,而微阵列分析优选地在端部腔室中执行。为此可以将(实时)放大的反应产物与杂化缓冲物(hybridisierungspuffer)混合,泵吸到端部腔室(这里用作分析腔室)中并且在端部腔室中被杂化(hybridisieren)。该方式具有的优点是,通过(实时)放大,不仅可以生成定量的信息,并且还可以通过在微阵列上的探测来执行复合探测。
在端部腔室中终止的、在流体路径中的微流体转换可以在多个彼此分离的区域中(特别地在不同的腔室之内)特别地在探测单元的检测区域之内实现面密度的转换。
作为另一方面,介绍了一种用于在使用正如所描述的微流体设备的情况下分析试样的方法,至少包括根据至少两种不同的分析方法来分析核酸,其中,分别在设备的不同的流体路径中执行不同的分析方法。
微流体设备的其他的上述的特别的优点和构造特征可以应用且转移到所述方法上,且反之亦然。
该方法至少包括:按照至少两种不同的分析方法来分析核酸,这意味着,执行至少两种分析方法,这可以依次地或(至少部分地)同时进行。至少两种不同的分析方法也可以在微流体设备的不同的位置处或(至少在依次执行的分析方法的情况中)在微流体设备的唯一的位置处执行。此外可以利用相同的试样(或利用试样的相同部分)、也或者利用不同的试样来执行所述至少两种不同的分析方法。在后者的情况中优选的是,在不同的试样之间存在相互作用。这例如可以意味着,两种试样首先彼此分离地分别按照一种分析方法来操作,其中紧接着执行共同的分析,为此将所述两种试样混合。
优选地将试样划分到多个流体路径上。备选地优选的是,将多个不同的试样分离地容纳在不同的流体路径中。同样优选的是,将第一试样划分到第一多个流体路径上并且将第二试样容纳在另一流体路径中或分发到第二多个流体路径上。
通过构造带有两个路径的微流体设备可能的是,利用两个不同的试样、利用一个微流体设备来执行两种分析方法。
在该方法的一优选的实施方式中,从以下群组选出所述至少两种分析方法:
-(实时)放大,
-端点-放大
-熔化曲线分析以及
-微阵列分析。
(实时)放大优选地涉及聚合酶链式反应(pcr)。下述放大特别地可以理解成端点放大:在所述放大的情况下在稍后的阶段中或在放大的端点处发生对于放大进行的测量。作为端点放大优选的是端点pcr。
在该方法的另一优选的实施方式中,在具有不同温度的至少两个腔室之间交替地泵吸试样的至少一部分,使得试样的该部分经历热循环。
特别地优选的是,至少两个试样在端部腔室中聚集在一起,所述端部腔室与设备的至少两个流体路径相连接。特别优选地在端部腔室中将至少两个试样相互混合。此外优选的是,在端部腔室中以混合了的试样执行微阵列分析。
在这样的方法的情况中可以在两个路径中分别以纯净的、没有被混合的试样来执行方法。在端部腔室中然后可以附加地进行对于混合了的试样的最终分析。
反应混合物(也就是说,必要时被添加了其它物质的试样)在该实施方式中优选地在两个(或更多)不同的腔室之间被往复泵吸,也就是说,循环地从第一腔室到第二腔室中,从第二腔室到第一腔室中等等。在此,可以通过如下方式将反应混合物进行热循环:将第一和第二腔室保持在不同的温度上。该方式可以实现特别快速的热循环,因为仅仅改变反应混合物的温度,而周围环境、也就是说微流体设备以及特别地反应腔室可以保持在(不同的)恒定的温度上。如果反应混合物在单个反应腔室中进行热循环,则除了反应混合物的温度之外还必须同样对于反应腔室(也就是说特别地反应腔室的壁)的温度进行循环。这可能意味着更大的时间耗费。
参与热循环的腔室优选地布置在探测单元的检测区域之内。由此可以在各个循环之间通过探测单元进行(中间)测量。(中间)测量还可以在两个热循环之间的读取循环之内发生。优选地,下述腔室至少对于读取循环的持续时间的一部分(例如通过激光器)被外部地激励,在所述腔室中,反应混合物处于读取循环(auslesezyklus)中。由此可以激励荧光信号的发出,该荧光信号可以通过探测单元来检测。
作为另外的方面介绍一种系统,包括正如所描述的那样的微流体设备、探测单元以及优选地另外包括激励设备。
微流体设备的、以及该方法的另外的以上所描述的特别的优点和构造特征可以应用且转移到所述系统上。
以下借助于附图进一步解释本发明和技术范围。附图特别地显示了优选的实施例,然而本发明没有被限制在所述实施例上。特别地需要指出的是,附图以及特别地所示出的尺寸比例仅仅为示意性的。附图示意性地示出了:
图1:用于分析试样的微流体设备以及
图2:特别地包括图1的微流体设备的系统。
图1显示了用于分析试样的微流体设备1的剖面图。微流体设备1包括:用于容纳试样的第一流体路径2和第二流体路径3。此外,微流体设备1包括用于用来测量光的(在图2中示出的)探测单元4的检测区域11,该探测单元被设置用于检测从试样发射到所述两个流体路径2,3中的光。检测区域11通过画成虚线的线来示出。在第一流体路径2中设置有用于容纳试样的至少一部分的第一腔室8。在第二流体路径3中设置有用于容纳试样的至少一部分的第二腔室9。
微流体设备1此外具有一种耦合进入区域12,用于将由(在图2中示出)的激励设备6发出的激励耦合进入到试样中。耦合进入区域12通过点画线示出。耦合进入区域12部分地与检测区域11重叠。
此外,微流体设备1具有端部腔室10,所述端部腔室不仅与第一流体路径2而且与第二流体路径3相连接。
微流体设备1可以例如用于将分别包含待分析的dna的两个不同的试样在第一流体路径2中以及在第二流体路径3中首先彼此分离地处理(prozessieren)。例如可以在第一腔室8中以及在第二腔室9中执行(实时)放大。这可以定量地通过探测单元4来检测,因为检测区域11完全包括第一腔室8和第二腔室9。接着可以将试样在端部腔室10中进一步进行处理。为此可以例如在端部腔室10中设置微阵列。端部腔室10中的微阵列分析同样可以利用探测单元4来执行,因为端部腔室10也位于检测区域11之内。通过激励设备6可以激励试样。在此,激励在第一腔室8中、在第二腔室9中以及在端部腔室10中分别部分地是可能的,因为所述耦合进入区域11分别部分地包括各个腔室。
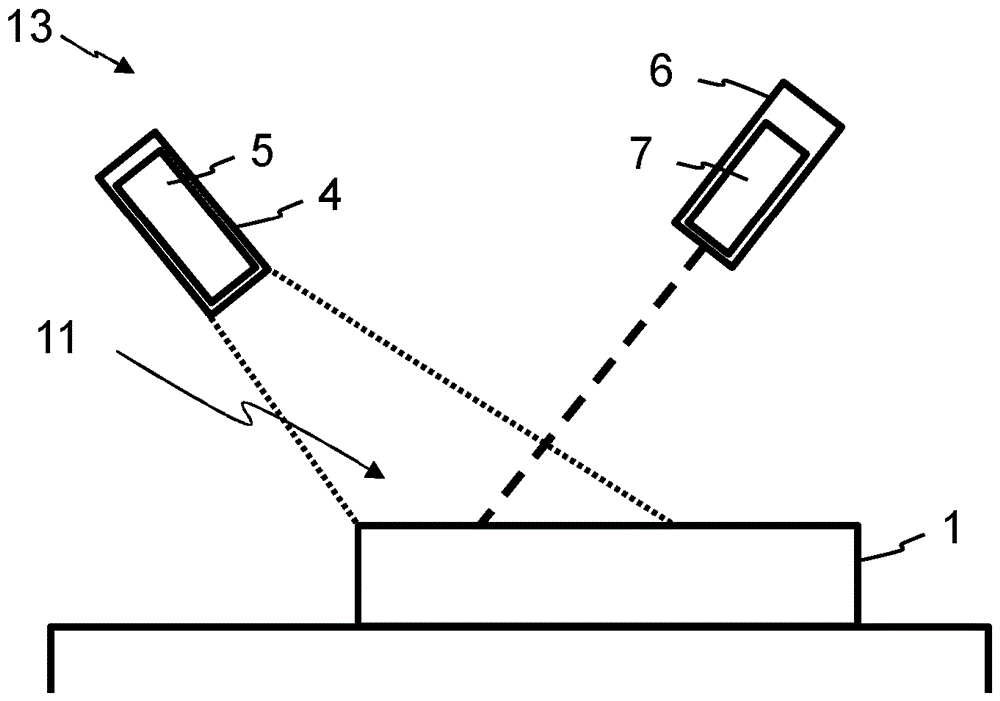
图2显示了系统13,该系统包括图1的微流体设备1、探测单元4和激励设备6。探测单元4具有摄像机5地实施。激励设备6具有激光器7地实施。
借助于探测单元4或借助于摄像机5可以检测光,该光由试样在微流体设备的检测区域11之内发射。通过点画线表明了,摄像机5可以覆盖哪个区域。检测区域11构造在微流体设备1在点画线之间的表面上。
借助于激励设备6或借助于激光器7可以对于微流体设备1或对于位于其中的试样产生影响。这通过画成虚线的线来表明。优选地可以这样地调整所述激励设备6,使得在(特别是整个)检测区域11的每个位置处的激励是可能的。微流体设备1的、利用激光器7能够达到的所有位置共同形成(仅在图1中示出的)所述耦合进入区域12。通过激励设备6的激励可以在时间上受限制地发生。
- 还没有人留言评论。精彩留言会获得点赞!