一种基于疏水基团修饰的蛋白质N-端富集方法与流程
本发明涉及蛋白质n-端富集方法,即一种基于疏水基团修饰的蛋白质n-端富集方法,以实现蛋白n-端的高效高选择性富集。
背景技术:
蛋白质n末端的修饰是生物体内常见的翻译后修饰之一,常见的n端乙酰化与信号肽剪切与蛋白质的稳定性、定位及活性密切相关。此外,生物体内蛋白的降解与剪切加工是体内最常见的翻译后修饰之一,促使蛋白产生新的n末端,此类过程与细胞凋亡、趋化因子加工等众多生物学过程及生理机能密切相关。末端蛋白组学的建立也大大的促进了蛋白水解酶底物鉴定及位点分析等领域的发展。但是,生物样品中蛋白组分复杂,并且含量的动态分布范围宽,经过酶切后其复杂程度进一步增加,因此发展n末端肽段的富集方法,以提高n端肽段鉴定的覆盖度,对于了解生物过程及寻找疾病的生物标志物都起到重要作用。
蛋白质末端的富集主要分为两大类,正向富集与反向富集。正向富集通常在蛋白质末端引入亲和标签,酶解后通过亲和标签实现蛋白质n端富集(cell2008,134,866–876;analyticalchemistry2013,85,6826-6832;proceedingsofthenationalacademyofsciences2009,106,19310-19315),此类方法可实现蛋白质n端肽段的高选择性富集,但是通常在n端引入标签的效率低,限制了方法的富集效率。此外正向富集方法无法获得内源性修饰的n端肽段,而生物样品中,大于50%的蛋白的n端存在內源性的修饰,因此反向富集方法获得了广泛的关注。反相富集通过氨基活性材料或带有标签的氨基活性试剂去除中间肽段从而得到末端肽段(molecular&cellularproteomics2012,11,832-842;naturebiotechnology2010,28,281-288;)。然而由于有限的键合效率和标记效率,非n端肽段难以去除完全,限制了方法的富集选择性;此外,所采用的去除材料存在难以消除的非特异性吸附,造成了末端肽段的丢失。
为克服以上方法所存在的问题,我们选择了效率高且简易快速的标记方法于非n端肽段引入亲和标签,并采用易获取且无显著非特异性吸附的材料对非n端肽段进行去除,以实现蛋白质n末端的高效高选择性无歧视富集。
技术实现要素:
本发明发展了一种蛋白质n-端富集方法,标记效率高,富集效率高,选择性高,对不同性质n端肽段无歧视。
为了实现该目的,本发明的技术方案是:
1)采用氨基活性试剂封闭蛋白质上n端以及侧链的自由氨基
将蛋白质溶解于含2-8m盐酸胍ph为6-10的缓冲液中,加入终浓度10-100mm的二硫苏糖醇,45-90℃孵育30-120min后,加入终浓度20-500mm的丙烯酰胺,反应30-120min后,另加入终浓度10-100mm的二硫苏糖醇,孵育10-30min后,加入终浓度10-4000mm的氨基活性试剂,反应1-48h后,将溶液转移至3000-10000da的超滤膜上,离心去除溶剂并采用ph为6-10的缓冲液清洗残余试剂后,将蛋白溶于ph为6-10的缓冲液中,得到溶液a;
氨基活性试剂为甲醛、乙醛、丙醛、丁醛、乙酸酐、丙酸酐、丁二酸酐、乙酸-n-琥珀酰亚胺酯、丙酸-n-琥珀酰亚胺酯、丁酸-n-琥珀酰亚胺酯中的一种或者两种以上。;当采用甲醛、乙醛、丙醛、丁醛中的一种或者两种以上时,另加入终浓度10-600mm的氰基硼氢化纳;
缓冲液为磷酸氢二钠缓冲液、4-羟乙基哌嗪乙磺酸缓冲液、三乙二胺碳酸盐缓冲液、碳酸氢纳缓冲液中的一种或者两种以上;缓冲液浓度为10-500mm。
2)采用蛋白水解酶酶解蛋白质
于溶液a中加入蛋白水解酶进行酶解,蛋白水解酶酶用量为蛋白质质量的1/5-1/100,25-45℃孵育2-48h,得到溶液b;
酶为胰蛋白酶,蛋白内切酶glu-c,蛋白内肽酶arg-c,金属蛋白内切酶lys-n,胰凝乳蛋白酶,木瓜蛋白酶,弹性蛋白酶,或胃蛋白酶中的一种或二种以上。
3)采用带有碳链的氨基活性试剂标记非n端肽段
于溶液b中加入终浓度10-200mm带有碳链的氨基活性试剂,25-70℃反应1-48h,得到溶液c;
带有碳链的氨基活性试剂,其所带碳链长度为10-20,且含有醛基基团;例如碳链长度为10-20的醛,如己醛、十五醛、十六醛、二十醛等中的一种或者两种以上。
4)采用反相材料吸附标记碳链的非n端肽段
将溶液c的溶剂进行挥发,采用上样溶液溶解后,上样到反相材料上,材料与蛋白质重量比为100-100000,将材料采用上样溶液清洗后,采用洗脱溶液洗脱n端肽段;
反相材料为c18反相材料,c8反相材料,苯基反相材料中的一种或二种以上;
按体积百分浓度计,上样溶液:2%乙腈+0.001%-2%三氟乙酸,其余为水;洗脱溶液:30%-80%乙腈+0.001%-2%三氟乙酸或甲酸,其余为水。
本发明的有益效果为:
1、蛋白水平封闭自由氨基的高效率,避免了n端肽段的共去除,提高了n端肽段的回收率;
2、疏水基团标记的高效率,以及反相材料与疏水基团标记的非n端肽段的强疏水作用,促进非n端肽段的高效去除,从而得到n端的高选择性富集;
3、反相材料对不同性质n端肽段无非特异性吸附,避免了n端肽段的丢失。
4、方法过程中无需额外的样品纯化,有效减少了样品的损失,从而得到高效的富集;
5、方法简易,不仅适用于复杂样品的分析,且适用于简单蛋白样品的分析。
附图说明
图1为蛋白质n-末端富集流程图;
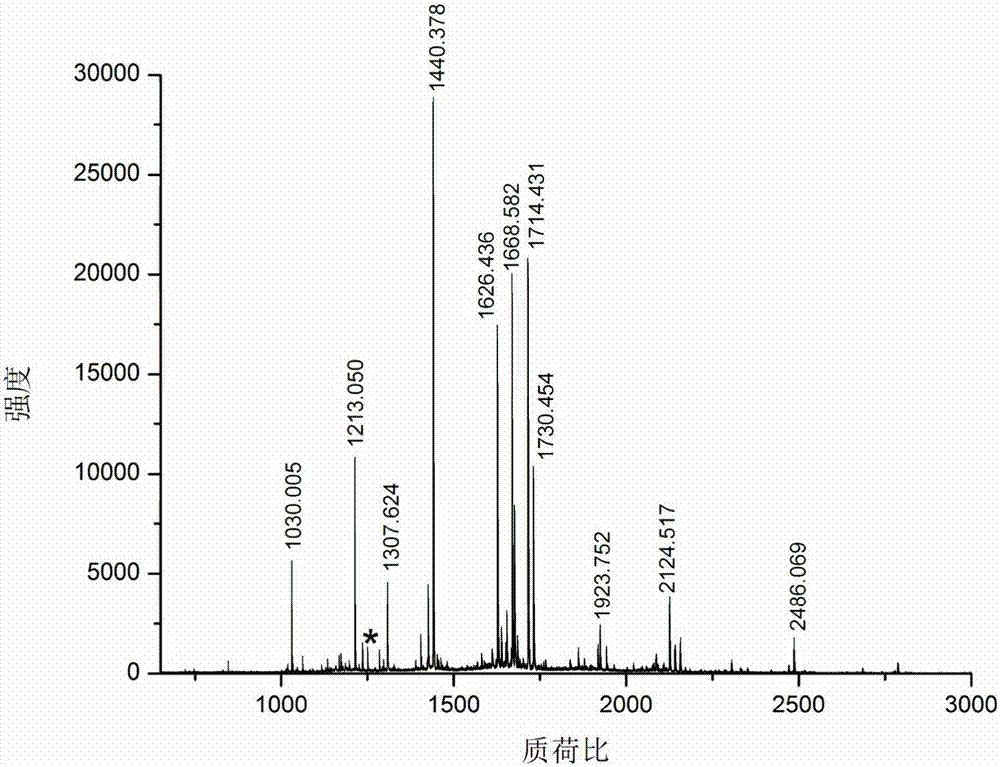
图2富集前二甲基化的牛血清蛋白(bsa)胰蛋白酶酶解产物(a);富集后牛血清蛋白n-端肽段(b);富集前二甲基化的溶菌酶胰蛋白酶酶解产物(c);富集后溶菌酶n-端肽段(d)。*表示蛋白质n-端肽段峰。
具体实施方式
实施例1
如图1所示,蛋白经过变性还原烷基化后,进行自由氨基封闭,然后将标记蛋白进行酶解,酶解产物采用带有长碳链的氨基活性试剂标记,然最后采用反相材料去除非n-端肽段,从而得到蛋白n-端。
以牛血清蛋白和溶菌酶为样品,100μg蛋白溶于100μl含6m盐酸胍的100mmph为8的三乙二胺碳酸盐缓冲液,加入2μl100mm二硫苏糖醇,56℃变性还原1h后,加入2μl300mm丙烯酰胺反应1h后,另加入2μl100mm二硫苏糖醇,孵育10min后,加入终浓度100mm甲醛和氰基硼氢化钠进行二甲基化封闭蛋白自由氨基,室温孵育2h后,将溶液转移至10000da超滤膜上,离心去除溶剂并采用50mmph8的4-羟乙基哌嗪乙磺酸缓冲液清洗残余试剂后,将蛋白溶于200μl50mmph8的4-羟乙基哌嗪乙磺酸缓冲液中。加入胰蛋白酶在超滤膜上进行酶解,其中酶用量为样品质量的1/50(w/w),温度为37℃,酶解12h。将超滤膜进行离心,得到的滤液即为蛋白酶解产物。往酶解产物中加入1ml10mg/ml十六醛(溶于正丙醇),40μl600mm氰基硼氢化钠水溶液,50℃反应过夜。将溶液冻干,随后溶于a相(2%乙腈+0.1%三氟乙酸水溶液),去除沉淀,通入c18捕集柱(4.6mmi.d.×1cm),采用a相冲洗捕集柱后,通入b相(80%乙腈+0.1%三氟乙酸水溶液)洗脱n端肽段,收集流分,冻干。
由图2可以看出蛋白质的n端肽段得到了高效高选择性的富集。
实施例2
以酵母细胞为样品,100μg提取蛋白溶于100μl含6m盐酸胍的100mmph为8的磷酸盐缓冲液,加入2μl100mm二硫苏糖醇,56℃变性还原1h后,加入2μl300mm丙烯酰胺反应1h后,另加入2μl100mm二 硫苏糖醇,孵育10min后,加入终浓度100mm甲醛和氰基硼氢化钠进行二甲基化封闭蛋白自由氨基,室温孵育2h后,将溶液转移至10000da超滤膜上,离心去除溶剂并采用50mmph8的4-羟乙基哌嗪乙磺酸缓冲液清洗残余试剂后,将蛋白溶于200μl50mmph8的4-羟乙基哌嗪乙磺酸缓冲液中。加入胰蛋白酶在超滤膜上进行酶解,其中酶用量为样品质量的1/50(w/w),温度为37℃,酶解12h。将超滤膜进行离心,得到的滤液即为蛋白酶解产物。往酶解产物中加入1ml10mg/ml十六醛(溶于正丙醇),40μl600mm氰基硼氢化钠水溶液,50℃反应过夜。将溶液冻干,随后溶于a相(2%乙腈+0.1%三氟乙酸水溶液),去除沉淀,通入c18捕集柱(4.6mmi.d.×1cm),采用a相冲洗捕集柱后,通入b相(80%乙腈+0.1%三氟乙酸水溶液)洗脱n端肽段,收集流分,冻干。质谱分析证明n端肽段同样得到了高效高选择性的富集。
实施例3
以人血清为样品,100μg蛋白溶于100μl含6m盐酸胍的100mmph为8的磷酸盐缓冲液,加入2μl100mm二硫苏糖醇,56℃变性还原1h后,加入2μl300mm丙烯酰胺反应1h后,另加入2μl100mm二硫苏糖醇,孵育10min后,加入终浓度100mm乙酸酐封闭蛋白自由氨基,室温孵育2h后,将溶液转移至10000da超滤膜上,离心去除溶剂并采用50mmph8的4-羟乙基哌嗪乙磺酸缓冲液清洗残余试剂后,将蛋白溶于200μl50mmph8的4-羟乙基哌嗪乙磺酸缓冲液中。加入胰蛋白酶在超滤膜上进行酶解,其中酶用量为样品质量的1/50(w/w),温度为37℃,酶解12h。将超滤膜进行离心,得到的滤液即为蛋白酶解产物。往酶解产物中加入1ml10mg/ml十六醛(溶于正丙醇),40μl600mm氰基硼氢化钠水溶液,50℃反应过夜。将溶液冻干,随后溶于a相(2%乙腈+0.1%三氟乙酸水溶液),去除沉淀,通入c18捕集柱(4.6mmi.d.×1cm),采用a相冲洗捕集柱后,通入b相(80%乙腈+0.1%三氟乙酸水溶液)洗脱n端肽段,收集流分,冻干。质谱分析证明n端肽段同样得到了高效高选择性的富集。
实施例4
以酵母细胞为样品,100μg提取蛋白溶于100μl含6m盐酸胍的100mmph为8的磷酸盐缓冲液,加入5μl100mm二硫苏糖醇,56℃变性还原1h后,加入5μl300mm丙烯酰胺反应1h后,另加入5μl100mm二硫苏糖醇,孵育10min后,加入终浓度100mm乙酸-n-琥珀酰亚胺酯封闭蛋白自由氨基,室温孵育2h后,将溶液转移至10000da超滤膜上,离心去除溶剂并采用100mmph8的4-羟乙基哌嗪乙磺酸缓冲液清洗残余试剂后,将蛋白溶于200μl50mmph8的4-羟乙基哌嗪乙磺酸缓冲液中。加入蛋白内切酶glu-c在超滤膜上进行酶解,其中酶用量为样品质量的1/25(w/w),温度为37℃,酶解12h。将超滤膜进行离心,得到的滤液即为蛋白酶解产物。往酶解产物中加入1ml5mg/ml十六醛(溶于正丙醇),40μl 300mm氰基硼氢化钠水溶液,50℃反应过夜。将溶液冻干,随后溶于a相(2%乙腈+0.1%三氟乙酸水溶液),去除沉淀,通入c18捕集柱(4.6mmi.d.×1cm),采用a相冲洗捕集柱后,通入b相(60%乙腈+0.1%三氟乙酸水溶液)洗脱n端肽段,收集流分,冻干。质谱分析证明n端肽段同样得到了高效高选择性的富集。
实施例5
以酵母细胞为样品,100μg提取蛋白溶于100μl含6m盐酸胍的100mmph为8的磷酸盐缓冲液,加入5μl100mm二硫苏糖醇,56℃变性还原1h后,加入5μl300mm丙烯酰胺反应1h后,另加入5μl100mm二硫苏糖醇,孵育10min后,加入终浓度100mm乙酸-n-琥珀酰亚胺酯封闭蛋白自由氨基,室温孵育2h后,将溶液转移至10000da超滤膜上,离心去除溶剂并采用100mmph8的4-羟乙基哌嗪乙磺酸缓冲液清洗残余试剂后,将蛋白溶于200μl50mmph8的4-羟乙基哌嗪乙磺酸缓冲液中。加入胰蛋白酶在超滤膜上进行酶解,其中酶用量为样品质量的1/25(w/w),温度为37℃,酶解12h。将超滤膜进行离心,得到的滤液即为蛋白酶解产物。往酶解产物中加入1ml5mg/ml十六醛(溶于正丙醇),40μl300mm氰基硼氢化钠水溶液,50℃反应过夜。将溶液冻干,随后溶于a相(2%乙腈+0.1%三氟乙酸水溶液),去除沉淀,通入c8捕集柱(4.6mmi.d.×1cm),采用a相冲洗捕集柱后,通入b相(30%乙腈+0.1%三氟乙酸水溶液)洗脱n端肽段,收集流分,冻干。质谱分析证明n端肽段同样得到了高效高选择性的富集。
实施例6
以酵母细胞为样品,100μg提取蛋白溶于100μl含4m盐酸胍的100mmph为8的磷酸盐缓冲液,加入5μl50mm二硫苏糖醇,60℃变性还原1h后,加入5μl150mm丙烯酰胺反应1h后,另加入5μl50mm二硫苏糖醇,孵育10min后,加入终浓度200mm乙醛封闭蛋白自由氨基,室温孵育6h后,将溶液转移至10000da超滤膜上,离心去除溶剂并采用50mmph8的4-羟乙基哌嗪乙磺酸缓冲液清洗残余试剂后,将蛋白溶于200μl50mmph8的4-羟乙基哌嗪乙磺酸缓冲液中。加入金属蛋白内切酶lys-n在超滤膜上进行酶解,其中酶用量为样品质量的1/25(w/w),温度为37℃,酶解4h。将超滤膜进行离心,得到的滤液即为蛋白酶解产物。往酶解产物中加入1ml5mg/ml十四醛(溶于正丙醇),40μl300mm氰基硼氢化钠水溶液,45℃反应过夜。将溶液冻干,随后溶于a相(2%乙腈+0.1%三氟乙酸水溶液),去除沉淀,通入c18捕集柱(4.6mmi.d.×1cm),采用a相冲洗捕集柱后,通入b相(60%乙腈+0.1%三氟乙酸水溶液)洗脱n端肽段,收集流分,冻干。质谱分析证明n端肽段同样得到了高效高选择性的富集。
实施例7
以牛血清蛋白为样品,100μg提取蛋白溶于100μl含4m盐酸胍的100mmph为8的磷酸盐缓冲液,加入5μl50mm二硫苏糖醇,60℃变性还 原1h后,加入5μl150mm丙烯酰胺反应1h后,另加入5μl50mm二硫苏糖醇,孵育10min后,加入终浓度200mm甲醛和氰基硼氢化钠封闭蛋白自由氨基,室温孵育6h后,将溶液转移至10000da超滤膜上,离心去除溶剂并采用50mmph8的4-羟乙基哌嗪乙磺酸缓冲液清洗残余试剂后,将蛋白溶于200μl50mmph8的4-羟乙基哌嗪乙磺酸缓冲液中。加入胰凝乳蛋白酶在超滤膜上进行酶解,其中酶用量为样品质量的1/75(w/w),温度为37℃,酶解4h。将超滤膜进行离心,得到的滤液即为蛋白酶解产物。往酶解产物中加入1ml12mg/ml十五醛(溶于正丙醇),40μl400mm氰基硼氢化钠水溶液,55℃反应过夜。将溶液冻干,随后溶于a相(2%乙腈+0.1%三氟乙酸水溶液),去除沉淀,通入c18捕集柱(4.6mmi.d.×1cm),采用a相冲洗捕集柱后,通入b相(60%乙腈+0.1%三氟乙酸水溶液)洗脱n端肽段,收集流分,冻干。质谱分析证明n端肽段同样得到了高效高选择性的富集。
- 还没有人留言评论。精彩留言会获得点赞!