一种快速定量单个微孢子虫孢子海藻糖浓度的方法与流程
本发明定量检测技术领域,具体涉及一种基于单细胞拉曼光谱直接定量分析微孢子虫孢子海藻糖含量的方法。
技术背景
微孢子虫(Microsporidia)是一类细胞内专性寄生单细胞真核生物,目前将其归类为真菌,寄主很广泛,可以感染包括人类在内的无脊椎动物和脊椎动物,目前已发现有150多属,1400余种。微孢子虫对许多极具经济价值的昆虫、鱼类、兔子等都有致病性。其中,家蚕微孢子虫(Nosema bombycis,N.b)是人类最早发现的微孢子虫,主要寄生于家蚕。家蚕微粒子病就是由N.b感染、寄生引起的一种传染性蚕病,可以通过食下传染或胚种传染,是蚕业生产上的毁灭性疫病,家蚕微孢子虫不仅可寄生在家蚕幼虫、蛹、蛾的多种组织内,并能经蚕卵垂直传播给下一代,对蚕业生产尤其是蚕种生产造成严重危害,而且极易导致蚕茧品质和产量的下降,严重影响蚕丝产业链下游经济的发展,被各国列为蚕种生产唯一的检疫病害。
基于微孢子虫对人类社会的影响及其在进化生物学上的重要性,一直是广大学者的研究兴趣。尤其是微孢子虫孢子的发芽机制,因为孢子发芽是微孢子虫侵染寄主的关键起始。而海藻糖在微孢子虫孢子的发芽过程中发挥了重要作用,孢子发芽前期,海藻糖与海藻糖酶因间隔膜的打破而相互接触,在合适的条件下酶活性被激发,催化海藻糖水解为葡萄糖或果糖,孢子内渗透质浓度上升,外界水分在渗透势差的作用下大量进入孢子,极膜层和后极泡吸水膨胀,压迫极丝解螺旋,极帽外翻成衣领状结构支撑着孢子前端极管的弹出。极管弹出刺入寄主细胞后,孢原质开始挤入泡囊形成芽体侵染寄主。有研究表明,有的物种的孢子海藻糖浓度超过1.0 mol L-1,但在发芽的时候仅有70%左右的海藻糖转化为单糖,引起孢内渗透压升高进而触发孢子发芽。海藻糖浓度高低是否影响孢子的发芽力和侵染力呢,目前还不清楚。
海藻糖是真菌孢子中常见的双糖物质,常规的检测方法有层析法、比色法、气相色谱法、高效液相色谱法及酶法分析。层析法(纸层析、薄层层析)以试样组分在固定相和流动相间的溶解、吸附、分配、离子交换或其他亲和作用的差异为依据而建立起来的分离分析方法。这种方法比较费时间,而且检测人员可能接触到有机溶剂。蒽酮比色法是糖类(在硫酸作用下,脱水生成糠醛或羟甲基糠醛,然后蒽酮与糠醛或羟甲基糠醛经脱水缩合,产生蓝绿色糠醛衍生物,通过分光光度计来定量。这种方法是非特异性的,会受到其它可与蒽酮试剂反应的物质的干扰。气相色谱也可 以用于海藻糖的分离与检测,但因为海藻糖不是挥发性物质,必需制成相应的挥发性衍生物才能检测。在定量分析海藻糖的方法中,高效液相色谱法(HPLC)定量的准确度和重现性最好,但需要专业的设备。海藻糖酶法分析是最近发展起来的测定方法,其原理是通过海藻糖酶对海藻糖的特异性水解,产生的葡萄糖再用葡萄糖氧化酶-过氧化物酶系统进行检测,该方法特异性高,分析成本也高,且受酶活力影响。
上述方法都是费时、费试剂且费样品的检测方法,这些方法都需要先破碎孢子壁,把海藻糖从孢子内释放出来,需要较大数量的孢子样品才能达到检测的最小样品要求,因而无法定量微量孢子的海藻糖浓度,更别说单个孢子的海藻糖浓度。而且检测后的孢子样品是被破坏的、没有细胞活性的孢子样品,无法直接分析海藻糖浓度与孢子的发芽力、侵染力相关性。因此,发展一种实时、无损的、快速的测量单个孢子海藻糖浓度的技术方法有非常重要的意义。
参考文献:
1. 汪方炜,鲁兴萌. 微孢子虫发芽机理. 科技通报,2001,17(1): 6-19
2. 赵祖康. 家蚕幼虫血液中海藻糖含量及其酶的活性测定. 蚕业科学, 1983(3):188-189.
3. 葛 宇,袁勤生. 海藻糖的定量分析方法比较. 药物生物技术,2001,8(6):348-351.
4. 何 钢,刘 嵬,邬晓勇,刘坤平,梁 立,彭灵犀,戴 欣,颜 军,苟小军. HPLC-RI法测定食用酵母的海藻糖含量. 食品工业科技,2015,14: 49-52.
5. 马少敏,韦 航,蒙健宗. 酶法生产海藻糖的定量分析方法. 大众科技, 2008, 10:111-112.
6. Albert H. Undeen, Laila M. El Gazzar , Robert K. Vander Meer, Narang S.. Trehalose levels and trehalase activity in germinated and ungerminated spores of Nosema algerae (Microspora: Nosematidae). Journal of Invertebrate Pathology, 1987, 50(3) : 230-237
7. Albert H. Undeen, Robert K. Vander Meer. Conversion of intrasporal trehalose into reducing sugars during germination of Nosema algerae (Protista: Microspora) spores: a quantitative study. Journal of Eukaryotic Microbiology, 1994, 41(2):129 - 132.。
技术实现要素:
现有的测定微孢子虫孢子海藻糖浓度的方法是通过蒽酮反应的比色法或者层析法、气相色谱法,或者高效液相色谱法,是费时或者费试剂的检测方法。需要较大量的孢子样品,无法定量微量孢子或者单个孢子的海藻糖浓度,且破坏检测的孢子的活性。针对现有技术的不足,本发明旨在提供一种无需试剂、操作简便、可靠,且能够快速定量单个具有生理活性的微孢子虫孢子海藻糖浓度的方法。
具体的,本发明的技术方案是:
一种基于单细胞拉曼光谱快速定量微孢子虫孢子海藻糖浓度的方法,包括以下步骤:
(1)含微孢子虫孢子样品与无菌水混匀,吸取100~500 微升含孢子水到检测槽;
(2)采用激光镊子将单个待检样品细胞固定,并通过拉曼光谱仪采集拉曼光谱;
(3)同样的条件采集系列已知浓度的海藻糖溶液的拉曼光谱;
(4)通过拉曼光谱特征峰信号强度实现待检孢子海藻糖浓度的定量计算。
激光镊子,又称光学镊子(英文:Optical tweezers),就是用激光形成的镊子,是一种利用光压原理制造的能够移动或固定单个细胞和其他微小物体的仪器。拉曼光谱仪由激光源、收集系统、分光系统和检测系统构成, 激光源一般采用能量集中、功率密度高的激光, 收集系统由透镜组构成, 分光系统采用光栅或陷波滤光片结合光栅以滤除瑞利散射和杂散光以及分光检测系统低温冷却的电荷藕合器件。通过拉曼光谱技术能够提供快速、简单、可重复、无损伤的定性定量分析。
本发明方法中,通过激光镊子将单个待检样品细胞移动并固定在光束的聚集中心,采集到的拉曼光谱是整个孢子的完整信号,比常规的共焦显微方法得到更强的信号,更好的信噪比。而且,孢子的某些拉曼光谱特征峰的出现与否直接反映了是否含有某些特殊物质,其强度与胞内物质的含量(浓度)呈线性相关。因此,通过对待检样品的特征峰的信号强度,便能简单快速计算出待检样品某类物质的含量(浓度)。
本发明的有益效果是:
(1)本发明方法操作简便,无需染色,无需复杂的样品准备过程,样品直接悬浮在水中进行检测即可。
(2)本发明方法能够快速直观地定量待检样品里单个微孢子虫孢子的海藻糖浓度。
(3)本发明方法能够获知大量孢子中每个孢子间海藻糖浓度的差异。
(4)单个个样品孢子进行光谱采集、数据处理等工序仅需要10~20秒。
(5)本发明方法对检测孢子不造成伤害,检测后的孢子是活的,还可以用于进一步的分析或研究,而且适用于其他含海藻糖的微生物单细胞。
附图说明
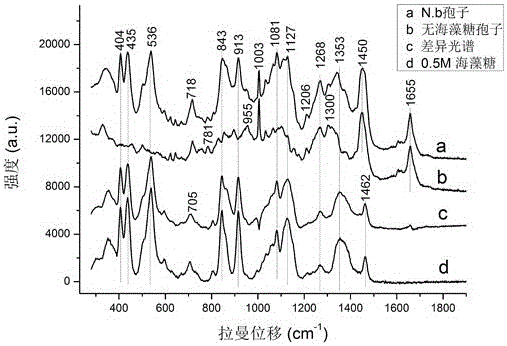
图1是含与不含海藻糖的家蚕微孢子虫孢子的拉曼光谱曲线及其差异光谱,以及0.5 mol L-1海藻糖溶液的拉曼光谱曲线。
图2是不同浓度海藻糖溶液与536 cm-1拉曼峰信号强度相关性曲线。
图3是几种不同来源的家蚕微孢子虫孢子的单个孢子海藻糖浓度分布。
具体实施方式
以下结合附图和实施例对本发明作进一步详细说明,本实施例仅是对本发明作更清楚的说明,而不是对本发明的限制。
一、家蚕微孢子虫孢子海藻糖拉曼光谱分析
1、 实验材料
菌株:分离自感染家蚕微孢子虫病(Nosema bombycis,简称N.b)蚕体的孢子。
2、实验方法
2.1 N.b侵染过程/方法
将供试的微孢子虫孢子液稀释成浓度为1×107 mL-1的悬浮液,取微孢子悬浮液涂抹于桑叶表面,饲喂3龄起蚕,待蚕儿吃尽带毒桑叶后,改饲正常无毒桑叶。
2.2 N.b孢子分离
取感染死亡的蚕体,解剖出家蚕的中肠用研钵研碎,经过过滤,取滤液在离心机上差速离心,获得家蚕微孢子。
2.3 光谱收集
将孢子用无菌水稀释,吸取200 μL置于用石英片密封而成的样品槽中,外加盖玻片密封。100倍油浸物镜寻找目标细胞,光镊随机俘获单个孢子,将目标细胞提升至石英片上方5 μm左右,激光强度调整为50 mW,信号累积时间为10 s,收集目标孢子的拉曼光谱,此时收集到的是带有背景的孢子的拉曼光谱,于孢子附近以相同条件收集背景拉曼光谱,每个样品收集30个左右的孢子的拉曼光谱,3个背景拉曼光谱。同样实验条件下采集0.1、0.2、0.5、0.8、1.0和1.5 mol L-1海藻糖溶液的拉曼光谱。
2.4 数据处理方法
光谱数据先进行背景扣除和响应曲线的校正,其算法为Sact(v)=[Sacq(v)- Sbg(v)]/R(v) [其中Sact(v)为样品的实际光谱,Sacq(v)为带背景的光谱,Sbg(v)为背景光谱,R(v)为实验系统的响应曲线];采用vb 编程对数据进行平滑去噪,其算法是9点Savitzky-Golay 卷积平滑法,以线性本底法(总峰面积法)计算的峰面积作为特征峰的信号强度。
3、结果分析
以拉曼光谱强度为纵坐标,拉曼位移为横坐标,构建成如图1所示的孢子拉曼光谱图。从图1可知,a曲线是成熟的N.b孢子,主要的拉曼峰为406、438、539、843、913、1081、1127和1343 cm-1,是海藻糖溶液的典型特征峰,以及718、785 cm-1(核酸)、1003、1450、1655 cm-1(蛋白质)和1304 cm-1(脂类物质)。把a曲线与基线相似而拉曼峰较弱的不含海藻糖的b类光谱相减,得到的差异光谱与海藻糖溶液的拉曼光谱几乎一致。因此,图1中a类孢子海藻糖峰显著,富含海藻糖;而b类细胞没有海藻糖峰,其胞内主要拉曼峰源自核酸、蛋白质和脂类物质,显然不含有海藻糖溶液。这说明成熟的N.b孢子其孢内主要成分是海藻糖溶液,以及其它生物大分子。
同样条件下采集的系列海藻糖溶液拉曼光谱,分析536 cm-1的拉曼峰的强度与海藻糖浓度的相关性,发现在0.1~1.5 mol L-1范围内,536 cm-1强度与海藻糖浓度成显著的相关性(图2),说明基于光镊的单细胞拉曼光谱可以定量微区域的海藻糖浓度。
二、应用实施例
从桑蚕生产现场收集的死蚕和人为培养感染N.b的死蚕,共10个蚕体的样品。分别解剖出的家蚕中肠用研钵研碎,经过过滤,取滤液在离心机上差数离心,获得家蚕微孢子。
将孢子用无菌水稀释,吸取200 μL置于样品槽中,激光镊子将待检样品的单个孢子固定,并通过拉曼光谱仪采集拉曼光谱。通过待检样品细胞拉曼光谱特征峰强度来定量分析孢子海藻糖、蛋白质和脂类物质的含量。
来自成熟N.b孢子的拉曼光谱峰主要源自海藻糖溶液,以及蛋白质和核酸,脂类物质的峰较弱,说明成熟孢子的主要成分是海藻糖,而脂类物质含量较低。
对出现海藻糖峰的孢子数据进一步的分析显示,不同来源的N.b孢子的785、915和1658 cm-1等峰的平均信号强度有所不同,说明不同蚕体产生的孢子其海藻糖含量、核酸含量和蛋白质含量有差异,而单个孢子的785、915和1658 cm-1峰强度相关性极低。海藻糖浓度分布显示,部分蚕体孢子的海藻糖含量分布比较集中,且多数蚕体呈正态分布,说明不同蚕体间形成的孢子均匀性也存在差异。
图3是三种不同来源的单个N.b孢子的海藻糖浓度分布图,Nb_wild是桑蚕基地收集的死蚕分离的孢子,Nb_last year是低温保存1年后的孢子,Nb_new是实验室人工新繁殖的孢子。图中显示,(1)不同来源的微孢子虫孢子、同一群体内不同孢子间孢内海藻糖浓度存在显著的异质性,平均浓度为0.23~0.37 mol/L;(2)野外采集的虫株孢内海藻糖含量显著低于室内人工繁殖的,可能原因是孢子没有完全成熟,其孢子间的差异极显著;(3)低温保藏一年后孢子的海藻糖含量基本没有变化,但孢子间分布不均匀。
- 还没有人留言评论。精彩留言会获得点赞!