赖氨酸氮连接磷酸化翻译后修饰富集和鉴定的方法与流程
本发明涉及生化分析领域,具体的说,是一种通过化学标记和色谱分级技术,实现赖氨酸氮连接磷酸化翻译后修饰的富集和鉴定。
背景技术:
蛋白的磷酸化修饰是生物体内最常见、最重要的一种翻译后修饰,对蛋白质的结构和功能起到了重要的调节作用。近些年来,在大规模的磷酸化翻译后修饰的研究中,高效的磷酸化蛋白/磷酸化肽富集技术结合多维色谱分离技术以及高分辨的质谱的应用,极大的增强了磷酸化翻译后修饰的动态范围和检测限,越来越多的磷酸化位点和磷酸化蛋白能够被检测。然而,这些磷酸化翻译后修饰位点的主要集中于氧连接的磷酸化氨基酸(如丝氨酸、苏氨酸和酪氨酸),对于氮连接的磷酸化翻译后修饰和生物学功能研究却鲜有报道。
由于赖氨酸氮连接磷酸化不同于其他氧连接磷酸化氨基酸的化学性质,在酸性条件下极不稳定,其在传统的研究方法中容易发生水解去磷酸化,因此尚无针对赖氨酸氮连接磷酸化翻译后修饰富集和鉴定的文献报道。仅有少数文献研究了赖氨酸氮连接磷酸化肽的合成方法(jordibertran-vicente,journaloftheamericanchemicalsociety,2014,136,13622-13628)及其在质谱中的碎裂规则(jordibertran-vicente,analyticalchemistry,2015,6990-6994)。随着现代生物化学与分子生物学技术的不断进步,人们对氮连接磷酸化翻译后的结构和功能的进一步认识,本领域也因此开始迅速发展。基于此,我们提出了一种通过化学标记和色谱分级技术,实现了赖氨酸氮连接磷酸化翻译后修饰的富集和大规模鉴定。
技术实现要素:
本发明利用赖氨酸氮连接磷酸化肽上磷酸基团丢失前、后在色谱分离上的保留差异,采用色谱法对赖氨酸磷酸化肽实现特异性富集,进而通过质谱分析获得鉴定。
为实现上述目的,本发明采用的技术方案步骤如下:
一种赖氨酸氮连接的磷酸化翻译后修饰肽段的富集和鉴定方法:
步骤1)首先对蛋白酶解产物中的赖氨酸进行第一次化学标记;
步骤2)然后对第一次化学标记的蛋白酶解产物进行第一次色谱分级,按照色谱保留时间,等时间间隔(0.5-30min)或不等时间间隔(0.5-30min)分别收集n个级分(n为大于或等于2的正整数);
步骤3)对于步骤(2)中第一次色谱分级的n个级分分别进行去除赖氨酸上磷酸基团的操作;
步骤4)对步骤(3)中除去磷酸基团的n个级分分别进行第二次色谱 分级,并收集与步骤(2)中具有保留差异的组分;
步骤5)对步骤(4)中收集组分的赖氨酸进行第二次化学标记(与第一次的标记基团不同),最后对其进行质谱鉴定。
蛋白酶解产物是胰蛋白酶、丝氨酸蛋白酶以及蛋白内切酶中的一种或二种以上对蛋白进行酶解后的产物。
第一次化学标记是能与肽段n端和赖氨酸侧链的α氨基发生高选择性反应同时生成化学标签的试剂,该试剂包括酸酐类试剂,如0.01-100%(w/w)的乙酸酐、丙酸酐、丁二酸酐;羧基活化类试剂,如0.01-100%(w/w)的n-羟基丁二酰亚胺、4-二甲氨基吡啶;醛类试剂,如0.01-100%(w/w)的甲醛、乙醛、丙醛;以及氨基酸类试剂,如0.01-1m的精氨酸、赖氨酸、组氨酸,反应的缓冲体系为:10-500mm的磷酸缓冲液(ph7-9)、10-500mm的碳酸氢铵缓冲液(ph7-9)、10-500mm的tris-hcl缓冲液(ph6-10)中的一种或多种。
第二次化学标记是能与肽段n端和赖氨酸侧链的α氨基发生高选择性反应同时生成化学标签的试剂,该试剂包括酸酐类试剂,如0.01-100%(w/w)的乙酸酐、丙酸酐、丁二酸酐;羧基活化类试剂,如0.01-100%(w/w)的n-羟基丁二酰亚胺、4-二甲氨基吡啶;醛类试剂,如0.01-100%(w/w)的甲醛、乙醛、丙醛;以及氨基酸类试剂,如0.01-1m的精氨酸、赖氨酸、组氨酸。反应的缓冲体系为:10-500mm的磷酸缓冲液(ph7-9)、10-500mm的碳酸氢铵缓冲液(ph7-9)、10-500mm的tris-hcl缓冲液(ph6-10)中的一种或多种;
第一次化学标记和第二次化学标记所产生的标记集团的分子量不相同。
操作过程中,步骤(2)中的第一次色谱分级与步骤(4)中的第二次色谱分级的分级方法与操作条件保持一致;色谱分级包括反相色谱分级、亲水色谱分级、强阳离子交换色谱分级、强阴离子交换色谱分级、等电聚焦色谱分级、尺寸排阻色谱分级方法中的一种或两种。
去除赖氨酸上磷酸基团的操作运用磷酸酶去除法和酸去除法中的一种或两种;
所述磷酸酶去除法是采用一种或两种赖氨酸磷酸酶去除赖氨酸上的磷酸基团的方法,磷酸酶包括碱性赖氨酸磷酸酶或酸性赖氨酸磷酸酶中的一种或两种;
所述酸去除法是采用酸性物质去除赖氨酸上的磷酸基团的方法,酸性物质是1.0≤ph≤4.0的液体物质。
所述的保留差异是指在两次色谱分级中(步骤(2)和步骤(4)),第一次色谱分级的每一个级分在第二次色谱分级中的保留时间出现偏差且偏差大于或等于2min的组分。
所述质谱是飞行时间类质谱、离子阱类和轨道阱类质谱中的一种或二种。
本发明所述方法应用于蛋白质组学分析。
所述的蛋白酶解、第一次化学标记、色谱分级、除去磷酸基团、第一次化学标记和保留差异详细说明如下:
(1)蛋白酶解:将蛋白进行变性还原烷基化后,利用蛋白酶,如胰蛋白酶、丝氨酸蛋白酶和蛋白内切酶,37℃条件下对蛋白进行酶解1-24h;所述蛋白为标准蛋白或标准蛋白混合物、细胞或组织中提取的全蛋白或部分蛋白。
(2)第一次化学标记:用一种标记试剂对肽段n端和赖氨酸侧链的α氨基发生高选择性标记,其中标记试剂为:酸酐类试剂,如0.01-100%(w/w)的乙酸酐、丙酸酐、丁二酸酐;羧基活化类试剂,如0.01-100%(w/w)的n-羟基丁二酰亚胺、4-二甲氨基吡啶;醛类试剂,如0.01-100%(w/w)的甲醛、乙醛、丙醛;以及氨基酸类试剂,如0.01-1m的精氨酸、赖氨酸、组氨酸。反应的缓冲体系为:10-500mm的磷酸缓冲液(ph7-9)、10-500mm的碳酸氢铵缓冲液(ph7-9)、10-500mm的tris-hcl缓冲液(ph6-10)中的一种或多种。
(3)色谱分级:利用反相色谱分级、亲水色谱分级、强阳离子交换色谱分级、强阴离子交换色谱分级、等电聚焦色谱分级、尺寸排阻色谱分级方法中的一种或两种对肽段进行分级,同时收集不同保留时间的馏出组分。步骤(2)和步骤(4)的两次色谱分级方法一致。
(4)除去磷酸基团:在合适的条件下(ph2-12),加入一定量磷酸酶(如碱性赖氨酸磷酸酶或酸性赖氨酸磷酸酶),在一定温度(4-50℃)下孵育0.01-24h;或加入酸性物质(如甲酸、乙酸、三氟乙酸、盐酸等ph大于或等于1.0,小于或等于4.0的液体),在一定温度(1-100℃)下孵育0.01-24h。
(5)第二次化学标记:用一种标记试剂对肽段n端和赖氨酸侧链的α氨基发生高选择性标记。其中标记试剂为:酸酐类试剂,如0.01-100%(w/w)的乙酸酐、丙酸酐、丁二酸酐;羧基活化类试剂,如0.01-100%(w/w)的n-羟基丁二酰亚胺、4-二甲氨基吡啶;醛类试剂,如0.01-100%(w/w)的甲醛、乙醛、丙醛;以及氨基酸类试剂,如0.01-1m的精氨酸、赖氨酸、组氨酸。反应的缓冲体系为:10-500mm的磷酸缓冲液(ph7-9)、10-500mm的碳酸氢铵缓冲液(ph7-9)、10-500mm的tris-hcl缓冲液(ph6-10)中的一种或多种,且第一次化学标记和第二次化学标记所产生的标记集团的分子量不相同。
(6)保留差异:指在两次色谱分级中(步骤(2)和步骤(4)),第一次色谱分级的每一个级分在第二次色谱分级中的保留时间出现偏差且偏差大于或等于2min的组分。
与传统磷酸化翻译后修饰的富集和鉴定相比,本发明具有以下优点:
(1)该富集策略不需要使用额外的富集材料,仅通过去除磷酸基团前后肽段在色谱中的保留时间差异从而获得高效的富集;
(2)鉴定到的磷酸化肽为赖氨酸氮连接磷酸化肽。
附图说明
图1为本发明的流程图;
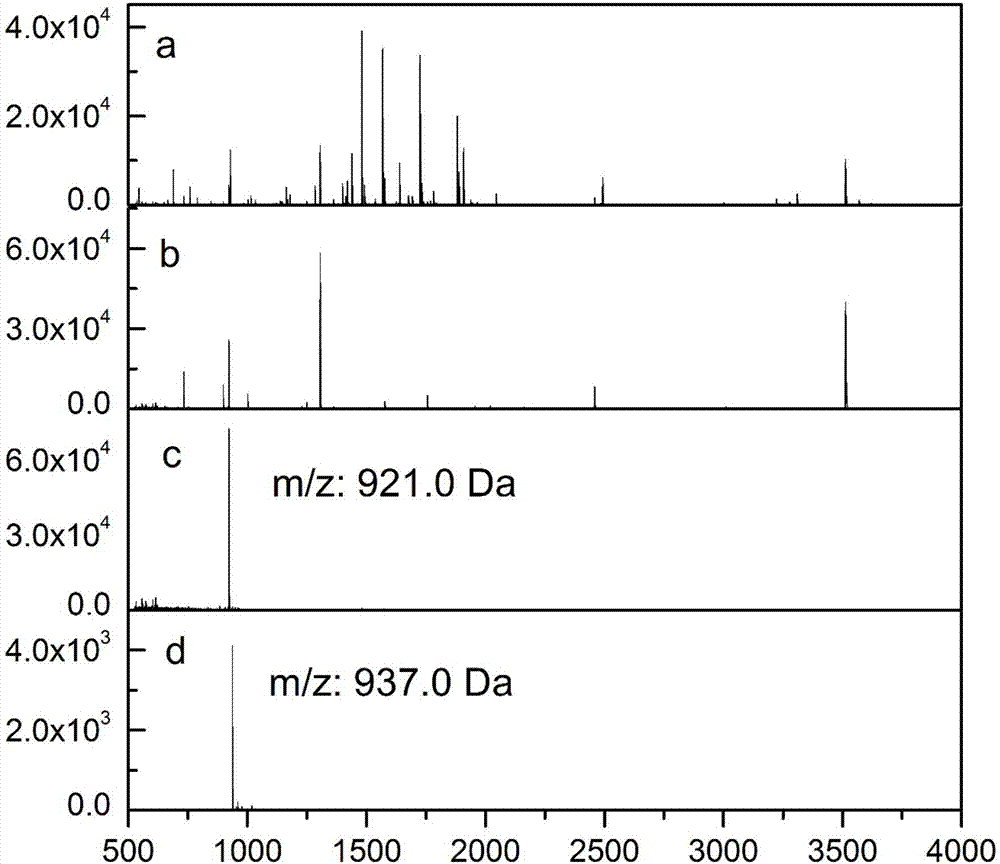
图2为a)标准赖氨酸磷酸化肽a0与牛血清白蛋白(bsa)酶解产物的混合物(1:100,m/m)经过b)高ph反相色谱分级、c)去赖氨酸磷酸基团后第二次高ph反相色谱分级、d)二甲基化重标后的maldi-tof质谱图。
具体实施方式
以下提供本发明简单样品和实际样品中赖氨酸氮连接的磷酸化翻译后修饰富集和鉴定方法的具体实施方式。
实施例1
牛血清白蛋白(bsa)酶解产物中标准赖氨酸磷酸化肽a0(磷酸基团位于赖氨酸侧链的α氨基)的富集和鉴定。
首先利用胰蛋白酶对bsa进行酶解,得到bsa的酶解产物。然后将标准赖氨酸磷酸化肽(a0)与bsa酶解产物以质量比1:100混合(图2a),进行二甲基化轻标(甲化学标记),然后利用高phc18反相色谱柱对混合肽段进行第一次色谱分级,每5min级分合并收集(图2b),共收集16个级分,向收集的每个级分中加入2μl三氟乙酸(tfa),水浴60℃反应1h去除肽段磷酸化修饰,对去磷酸化后每个级分进行高phc18反相的第二次色谱分级,收集相对一维出峰时间有保留时间差异的所有肽段(图2c),此处的保留时间差异为大于等于两分钟,然后对收集的肽段进行二甲基化重标(乙化学标记)。然后进行maldi-tof质谱分析(图2d)。
标准赖氨酸磷酸化肽(a0)氨基酸序列:tgifk(pho)sar
高phc18反相色谱柱(durashellc18):5μm,
色谱条件:
(1)流动相a:10mm醋酸铵,98%水,氨水调ph10;流动相b:10mm醋酸铵,80%乙腈,氨水调ph10。
(2)分离梯度:0-75min:6-45%b;75-80min:45-100%b;80-100min:100%b。
(3)流速:300μl/min。
蛋白酶解条件:将1mgbsa溶于100μl8m的尿素,加入8μl1m的二硫苏糖醇,56℃反应1.5h,再加入20μl1m的碘乙酰胺,避光反应0.5h,加入1.6ml50mm的碳酸氢铵溶液,再加入30μg胰蛋白酶,37℃水浴反应16h,除盐后得到bsa酶解产物。
去磷酸化条件:向收集的肽段中加入2μltfa得到ph为1的溶液,水浴60℃反应1h;
第一次化学标记(甲基化轻标)条件:在100mm的磷酸缓冲液(ph8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)的甲醛,室温反应1h。
第二次化学标记(甲基化重标)条件:在100mm的磷酸缓冲液(ph 8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)氘代甲醛,室温反应1h。
如图2d所示,上述实验实现了标准赖氨酸磷酸化肽(a0)与bsa酶解产物以质量比1:100(m/m)条件下对赖氨酸磷酸化肽的特异性富集。
实施例2
大肠杆菌蛋白酶解产物中赖氨酸磷酸化肽的富集和鉴定。
首先利用胰蛋白酶对大肠杆菌蛋白进行酶解,得到大肠杆菌蛋白的酶解产物。然后将酶解产物进行二甲基化轻标,然后利用高phc18反相色谱柱对混合肽段进行第一次色谱分级,每5min级分合并收集,共收集18个级分,收集的每个级分中加入30000units的碱性磷酸酶,水浴37℃反应1h去除肽段磷酸化修饰,对去磷酸化后每个级分进行高phc18反相的第二次色谱分级,收集相对第一次色谱出峰时间有保留时间差异的所有肽段,此处的保留时间差异为大于等于两分钟,然后对收集的肽段进行二甲基化重标。最后对二甲基化重标后的肽段进行lc-esi-ms/ms分析。一共鉴定到21个赖氨酸磷酸化位点。
高phc18反相色谱柱(durashellc18):5μm,
色谱条件:
(1)流动相a:10mm醋酸铵,98%水,氨水调ph10;流动相b:10mm醋酸铵,80%乙腈,氨水调ph10。
(2)分离梯度:0-75min:6-45%b;75-80min:45-100%b;80-100min:100%b。
(3)流速:300μl/min。
蛋白酶解条件:将1mg大肠杆菌蛋白溶于100μl8m的尿素,加入8μl1m的二硫苏糖醇,56℃反应1.5h,再加入20μl1m的碘乙酰胺,避光反应0.5h,加入1.6ml50mm的碳酸氢铵溶液,再加入30μg胰蛋白酶,37℃水浴反应16h,除盐后得到大肠杆菌蛋白酶解产物。
去磷酸化条件:向收集的肽段中加入30000units的碱性赖氨酸磷酸酶,水浴37℃反应1h;
第一次化学标记(甲基化轻标)条件:在100mm的磷酸缓冲液(ph8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)的甲醛,室温反应1h。
第二次化学标记(甲基化重标)条件:在100mm的磷酸缓冲液(ph8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)氘代甲醛,室温反应1h。
上述实验实现了大肠杆菌蛋白酶解产物中赖氨酸磷酸化肽的特异性富集和鉴定,一共鉴定到21个赖氨酸磷酸化位点。
实施例3
海拉细胞蛋白酶解产物中赖氨酸磷酸化肽的富集和鉴定。
首先利用胰蛋白酶对海拉细胞蛋白进行酶解,得到海拉细胞蛋白的酶解产物。然后将酶解产物进行二甲基化轻标,然后利用强阳离子交换色谱柱对混合肽段进行第一次色谱分级,每5min级分合并收集,向收集的每个级分中加入30000units的酸性赖氨酸磷酸酶,水浴37℃反应1h去除肽段磷酸化修饰,对去磷酸化后每个级分进行高phc18反相的第二次色谱分级,收集相对第一次色谱出峰时间有保留时间差异的所有肽段,此处的保留时间差异为大于等于两分钟,然后对收集的肽段进行二甲基化重标。最后对二甲基化重标后的肽段进行lc-esi-ms/ms分析。一共鉴定到35个赖氨酸磷酸化位点。
强阳离子交换色谱柱(tosoh):7μm,
色谱条件:
(1)流动相a:10mm磷酸二氢钾,10%乙腈,磷酸调ph2.7;流动相b:10mm磷酸二氢钾,1m氯化钠,10%乙腈,磷酸调ph2.7。
(2)分离梯度:0-75min:6-45%b;75-80min:45-100%b;80-100min:100%b。
(3)流速:300μl/min。
蛋白酶解条件:将1mg海拉细胞蛋白溶于100μl8m的尿素,加入8μl1m的二硫苏糖醇,56℃反应1.5h,再加入20μl1m的碘乙酰胺,避光反应0.5h,加入1.6ml50mm的碳酸氢铵溶液,再加入30μg胰蛋白酶,37℃水浴反应16h,除盐后得到海拉细胞蛋白酶解产物。
去磷酸化条件:向收集的肽段中加入30000units的酸性磷酸酶,水浴37℃反应1h;
第一次化学标记(甲基化轻标)条件:在100mm的磷酸缓冲液(ph8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)的甲醛,室温反应1h。
第二次化学标记(甲基化重标)条件:在100mm的磷酸缓冲液(ph8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)氘代甲醛,室温反应1h。
上述实验实现了海拉细胞蛋白酶解产物中赖氨酸磷酸化肽的特异性富集和鉴定,一共鉴定到35个赖氨酸磷酸化位点。
实施例4
大鼠肝组织蛋白酶解产物中赖氨酸磷酸化肽的富集和鉴定。
首先利用胰蛋白酶对大鼠肝组织蛋白进行酶解,得到大大鼠肝组织蛋白的酶解产物。然后将酶解产物进行二甲基化轻标,然后利用高phc18反相色谱柱对混合肽段进行第一次色谱分级,每5min级分合并收集,向收集的每个级分中加入2μl三氟乙酸(tfa),水浴60℃反应1h去除肽段磷酸化修饰,对去磷酸化后每个级分进行高phc18反相的第二次色谱分级,收集相对第一次色谱出峰时间有保留时间差异的所有肽段,此处的保留时间差 异为大于等于两分钟,然后对收集的肽段进行二甲基化重标。最后对二甲基化重标后的肽段进行lc-esi-ms/ms分析。一共鉴定到54个赖氨酸磷酸化位点。
高phc18反相色谱柱(durashellc18):5μm,
色谱条件:
(1)流动相a:10mm醋酸铵,98%水,氨水调ph10;流动相b:10mm醋酸铵,80%乙腈,氨水调ph10。
(2)分离梯度:0-75min:6-45%b;75-80min:45-100%b;80-100min:100%b。
(3)流速:300μl/min。
蛋白酶解条件:将1mg大鼠肝组织蛋白溶于100μl8m的尿素,加入8μl1m的二硫苏糖醇,56℃反应1.5h,再加入20μl1m的碘乙酰胺,避光反应0.5h,加入1.6ml50mm的碳酸氢铵溶液,再加入30μg胰蛋白酶,37℃水浴反应16h,除盐后得到大鼠肝组织蛋白酶解产物。
去磷酸化条件:向收集的肽段中加入2μltfa得到ph为1的溶液,水浴60℃反应1h;
第一次化学标记(甲基化轻标)条件:在100mm的磷酸缓冲液(ph8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)的甲醛,室温反应1h。
第二次化学标记(甲基化重标)条件:在100mm的磷酸缓冲液(ph8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)氘代甲醛,室温反应1h。
上述实验实现了大鼠肝组织蛋白酶解产物中赖氨酸磷酸化肽的特异性富集和鉴定,一共鉴定到54个赖氨酸磷酸化位点。
实施例5
肺癌a549细胞蛋白酶解产物中赖氨酸磷酸化肽的富集和鉴定。
首先利用胰蛋白酶对肺癌a549蛋白进行酶解,得到肺癌a549细胞蛋白的酶解产物。然后将酶解产物进行二甲基化轻标,然后利用强阳离子交换色谱柱对混合肽段进行第一次色谱分级,每5min级分合并收集,向收集的每个级分中加入30000units的酸性赖氨酸磷酸酶,水浴37℃反应1h去除肽段磷酸化修饰,对去磷酸化后每个级分进行高phc18反相的第二次色谱分级,收集相对第一次色谱出峰时间有保留时间差异的所有肽段,此处的保留时间差异为大于等于两分钟,然后对收集的肽段进行二甲基化重标。最后对二甲基化重标后的肽段进行lc-esi-ms/ms分析。一共鉴定到38个赖氨酸磷酸化位点。
强阳离子交换色谱柱(tosoh):7μm,
色谱条件:
(1)流动相a:10mm磷酸二氢钾,10%乙腈,磷酸调ph2.7;流动相b:10mm磷酸二氢钾,1m氯化钠,10%乙腈,磷酸调ph2.7。
(2)分离梯度:0-75min:6-45%b;75-80min:45-100%b;80-100min:100%b。
(3)流速:300μl/min。
蛋白酶解条件:将1mg肺癌a549细胞蛋白溶于100μl8m的尿素,加入8μl1m的二硫苏糖醇,56℃反应1.5h,再加入20μl1m的碘乙酰胺,避光反应0.5h,加入1.6ml50mm的碳酸氢铵溶液,再加入30μg胰蛋白酶,37℃水浴反应16h,除盐后得到肺癌a549细胞蛋白酶解产物。
去磷酸化条件:向收集的肽段中加入30000units的酸性磷酸酶,水浴37℃反应1h;
第一次化学标记(甲基化轻标)条件:在100mm的磷酸缓冲液(ph8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)的甲醛,室温反应1h。
第二次化学标记(甲基化重标)条件:在100mm的磷酸缓冲液(ph8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)氘代甲醛,室温反应1h。
上述实验实现了肺癌a549细胞蛋白酶解产物中赖氨酸磷酸化肽的特异性富集和鉴定,一共鉴定到38个赖氨酸磷酸化位点。
实施例6
smmc7721细胞蛋白酶解产物中赖氨酸磷酸化肽的富集和鉴定。
首先利用胰蛋白酶对smmc7721细胞蛋白进行酶解,得到smmc7721细胞蛋白的酶解产物。然后将酶解产物进行二甲基化轻标,然后利用高phc18反相色谱柱对混合肽段进行第一次色谱分级,每5min级分合并收集,向收集的每个级分中加入30000units的碱性磷酸酶,水浴37℃反应1h去除肽段磷酸化修饰,对去磷酸化后每个级分进行高phc18反相的第二次色谱分级,收集相对第一次色谱出峰时间有保留时间差异的所有肽段,此处的保留时间差异为大于等于两分钟,然后对收集的肽段进行二甲基化重标。最后对二甲基化重标后的肽段进行lc-esi-ms/ms分析。一共鉴定到21个赖氨酸磷酸化位点。
高phc18反相色谱柱(durashellc18):5μm,
色谱条件:
(1)流动相a:10mm醋酸铵,98%水,氨水调ph10;流动相b:10mm醋酸铵,80%乙腈,氨水调ph10。
(2)分离梯度:0-75min:6-45%b;75-80min:45-100%b;80-100min:100%b。
(3)流速:300μl/min。
蛋白酶解条件:将1mgsmmc7721细胞蛋白溶于100μl8m的尿素,加入8μl1m的二硫苏糖醇,56℃反应1.5h,再加入20μl1m的碘乙酰胺,避光反应0.5h,加入1.6ml50mm的碳酸氢铵溶液,再加入30μg胰蛋白酶,37℃水浴反应16h,除盐后得到smmc7721细胞蛋白酶解产物。
去磷酸化条件:向收集的肽段中加入30000units的碱性赖氨酸磷酸酶,水浴37℃反应1h;
第一次化学标记(甲基化轻标)条件:在100mm的磷酸缓冲液(ph8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)的甲醛,室温反应1h。
第二次化学标记(甲基化重标)条件:在100mm的磷酸缓冲液(ph8)中,加入一定体积的0.6m的氰基硼氢化钠和4%(v/v)氘代甲醛,室温反应1h。
上述实验实现了smmc7721细胞蛋白酶解产物中赖氨酸磷酸化肽的特异性富集和鉴定,一共鉴定到21个赖氨酸磷酸化位点。
- 还没有人留言评论。精彩留言会获得点赞!