细菌耐药蛋白ArmA的定性、定量检测方法与流程
本发明涉及膜电喷雾电离质谱的应用,具体地说,涉及一种应用膜电喷雾电离质谱对细菌耐药蛋白ArmA的定性、定量检测方法。
背景技术:
细菌耐药性的产生和传播已成为全球重要的公共卫生问题。[1]细菌依靠可移动元件如插入序列、质粒和“耐药基因组岛”等可快速获得抗生素耐药性。[2]目前,虽有超过15种针对细菌不同生理或代谢功能而设计的抗生素得到广泛应用,但是在细菌的各种耐药机制面前他们无一幸免。[3]面对每种抗生素,细菌都随之进化出了应对策略,而其中的耐药机制则与一系列的耐药基因有关。例如细菌获得qnrA/B/S基因则对氟喹诺酮类抗生素产生耐药性,[3,4]获得blaCTX-M和blaNDM-1基因则对β-内酰胺类和碳青霉烯类抗生素产生耐药性,[5-7]具有mcr-1则耐多黏菌素抗生素,[8]具有armA则耐氨基糖苷类抗生素等等。[9,10]为防止不当和过度使用抗生素,对细菌耐药性进行定性、定量检测成为迫切需求。[11]
可用于对细菌耐药性的检测方法已有一些相关报道。例如,常规微生物学研究中经常采用琼脂稀释法对细菌药物敏感性进行测试;[12,13]聚合酶链式反应(PCR)和实时荧光定量PCR对耐药基因的检测;[11,14]此外近年来也有报道采用质谱(MS)法对β-内酰胺类抗性的检测。 [15,16]
质谱(MS)是强大的分析工具,具有很高的灵敏度和特异性。敞开式电离技术(ambient ionization)的不断发展,缩短或避免了复杂的样本前处理流程,使得质谱法快速检测复杂样本成为可能。这些敞开式电离技术包括:解析电喷雾电离(DESI),[17]实时直接分析质谱(DART),[18]纸喷雾电离(PS)[19]和膜电喷雾电离(MESI)[20]等等。
但是,目前的方法多是样品前处理手段比较复杂,无法满足在保证高灵敏度的前提下快速定性、定量地实现对细菌耐药性的检测。
技术实现要素:
为了解决上述技术问题,本发明提供一种具有极高灵敏度且无需样本前处理的,可实现对ArmA快速定性、定量的检测方法。
为了实现本发明目的,本发明提供一种细菌耐药蛋白ArmA的定性、定量检测方法,其包 括如下步骤:
1)先提取待测样品中的蛋白,得到样品蛋白;
2)将样品蛋白进行酶切;
3)然后采用膜电喷雾质谱法进行ArmA特异性肽段的检测,在肽段水平上定性、定量判定armA基因的存在;其中所述ArmA特异性肽段为3个特异性肽段,其序列分别为IHSSTNER(如SEQ ID NO.1所示)、IIYHAYDIDR(如SEQ ID NO.2所示)和TYDVVFLLK(如SEQ ID NO.3所示)。
其中,为了保证待测样品的细菌量,可以先对待测样品进行增菌培养,培养时间一般在1-10小时,以2-6小时为佳。
步骤1)中提取待测样品中的蛋白采用超声波提取方式,具体为:将待测样品进行超声波提取10-20min,取上清液,即为样品蛋白。
超声波处理可在裂解液或水中处理,便于蛋白的裂解。
所述裂解液可以采用本领域常用的裂解液,比如组成为7M尿素,2M硫脲,4%CHAPS和1%DTT的裂解液,离心(裂解液的离心条件一般控制在12000-18000g)后对蛋白浓度进行测定。步骤2)中所述酶切采用微波法进行酶切,所用酶为胰蛋白酶。
酶切的方式为:所述酶切的方式为:将样品蛋白先在碳酸氢铵溶液中溶解并且加入DTT在高温下反应,然后在IAA存在下在暗处反应。最后加入胰蛋白酶,并且在微波条件下进行酶切而成。
优选的酶切方式为:将样品蛋白在50μL的50mM碳酸氢铵溶液中溶解并且加入5mM DTT在95℃反应5分钟,随后在15mM的IAA存在下在黑暗处反应30分钟。最后使用修饰过的测序级胰蛋白酶按照酶/底物质量比1:50的比例加入胰蛋白酶,并且在700W的微波条件下酶切15min。
步骤3)中采用膜电喷雾质谱法(MESI-MS)进行检测,所用装置为膜电喷雾离子源-质谱仪,所述样品蛋白特异性肽段经膜电喷雾电离装置使样品蛋白特异性肽段形成喷雾并离子化,然后进入质谱仪入口进行检测。
本发明的膜电喷雾电离装置包括至少一层透析膜,所述的膜电喷雾离子源装置可采用申请号为201410528504.0(发明名称为用于质谱分析的膜电喷雾离子源装置、离子化方法及包含该离子源装置的质谱仪)的发明申请中提及的膜电喷雾离子源装置。
所述膜电喷雾离子源装置,包括:吸水部件;至少一层透析膜,位于所述吸水部件上;导电部件,设置于所述透析膜;其中,所述透析膜具有至少一个尖端。
所述透析膜为多层,依次叠置于所述吸水部件上,且各层透析膜的截留分子量依次增大,距离所述吸水部件最远的透析膜的截留分子量最大。
优选的,所述透析膜为两层,包括第一透析膜和第二透析膜,所述第二透析膜位于所述吸水部件上,所述第一透析膜位于所述第二透析膜上,所述第一透析膜的截留分子量大于所述第二透析膜,所述第一透析膜和所述第二透析膜均包括样品承载部和所述尖端,所述第一透析膜的样品承载部与所述第二透析膜的样品承载部重叠,所述第一透析膜的尖端与所述第二透析膜的尖端相互错开。
本发明所述用于质谱分析的膜电喷雾离子化方法,包括:将至少一层透析膜放于吸水部件上,所述透析膜至少具有一个尖端,使所述透析膜的尖端指向质谱仪进样口;将待测样品置于所述透析膜上;静置一等待时间后通过一导电部件向所述透析膜施加高压电;向所述透析膜上添加冲洗溶剂;在高电压及所述冲洗溶剂的作用下,所述待测样品形成喷雾并离子化。
所述等待时间为10-40s。
向所述透析膜施加2-4kV的高压电。
所述冲洗溶剂为醇、水和甲酸的混合物。其中所述醇、水和甲酸的体积比为(50-70):(50-30):(0.1-0.5)。
二级质谱采用碰撞诱导解离(CID)对ArmA特异性肽段进行结构解析。母离子采样的质量范围选取2.0m/z,碰撞能量选取25%。
本发明采用膜电喷雾电离质谱检测ArmA特异性肽段,在肽段水平上间接实现对细菌耐药蛋白ArmA的定性、定量检测。本发明采用BLAST算法筛选出具有典型意义的3个特异性肽段,膜电喷雾电离质谱可有效去除基质效应(去除酶切引入小分子导致),节省了常规质谱分析流程中的脱盐步骤,极大提高了检测灵敏度,从而缩短了细菌分离株样本的增菌时间,总体上实现了极高灵敏度下对ArmA的快速检测。
经考察对于高低不同浓度的上述3个特异性肽段,本发明方法的精密度、准确度、回收率以及线性范围等均令人满意。最终,本发明还将建立的方法对添加了携带或不携带armA基因的不同种细菌(鲍曼不动杆菌、大肠杆菌)的模拟环境样本进行检测,验证方法的灵敏度与准确度。本发明的快速检测方法可以拓展到对其它病原菌的其它耐药基因的检测。
附图说明
图1为本发明膜电喷雾离子源装置的结构示意图;
图2为本发明膜电喷雾电离质谱检测流程示意图;
图3A-图3B分别为PCR方法验证菌株携带/不携带armA基因;
图4A-图4B分别为细菌分离株生长曲线与相应蛋白浓度;
图5为合成标准ArmA特异性肽段(1mM)的MESI-MS/MS分析图谱,其中,图5A:ArmA来源的多肽(IR-8,IHSSTNER)的母子离子对m/z472.0→693.1;
图5B:ArmA来源的多肽(IR-10,IIYHAYDIDR)的母子离子对m/z 639.7→752.1;图5C:ArmA来源的多肽(TK-9,TYDVVFLLK)的母子离子对m/z 549.2→833.2;
图6A-图6B分别为对标准肽段样品和模拟环境样品,采用膜电喷雾质谱法和纸喷雾质谱法对肽段的检测结果;
图7A-图7C分别为模拟环境样本对MESI-MS/MS法快速检测细菌耐药蛋白ArmA的验证,其中图7A为肽段IR-8的质谱图,图7B为肽段IR-10的质谱图,图7C为肽段TK-9的质谱图;
图8A-8B分别为对armA阳性和阴性样本的主成分分析(PCA)结果和偏最小二乘法-判别分析(PLS-DA)法的VIP(变量重要性在投影中的值)数值图;
图9为电压对膜电喷雾电离效果的影响。
具体实施方式
下面参考附图来说明本发明的实施例。在本发明的一个附图或一种实施方式中描述的元素和特征可以与一个或更多个其他附图或实施方式中示出的元素和特征相结合。应当注意,为了清楚的目的,附图和说明中省略了与本发明无关的、本领域普通技术人员已知的部件或处理的表示和描述。
下面结合附图对本发明做进一步描述。
1本发明检测所用菌株与试剂
1.1菌株(表1)
表1菌株列表
1.2试剂(表2)
表2试剂列表
2实验方法
2.1细菌培养
细菌菌株在脑心浸液(BHI)肉汤中37℃持续振荡培养。新鲜BHI肉汤接种了1:1000稀释的指数期培养(OD600=0.6)的菌株。初始培养浓度大约为1×106CFU·mL-1,记录下OD600,并且提取不同培养时间的蛋白。
对模拟环境菌种,通过拭子法从表面采样,每个棉签含有细菌悬液50μL(浓度约为1×106 CFU·mL-1)。将棉签浸在5mL的培养基中富集培养2小时,并且提取蛋白。
2.1PCR检测菌株armA基因
分离菌通过PCR方法来确认携带armA基因,包含引物ArmA-F:5’-ATGGATAAGAATGATGTTGTT-3’(SEQ ID NO.4所示)和ArmA-R:5’-TTTCTGAAATCCACGAGTAATA-3’(SEQ ID NO.5所示)。扩增程序包含以下过程的30个循环,每个过程为:95℃(30秒),55℃(30秒),72℃(45秒),72℃(8分钟的延伸期)。PCR的扩增产物(774bp),通过琼脂糖凝胶电泳检测并通过ABI PRISM 3730XL测序仪(中国北京)测序。
2.3蛋白提取和酶切
细菌细胞的细胞质蛋白由裂解液超声波提取(7M尿素,2M硫脲,4%CHAPS和1%DTT)。悬浊液16,000g离心15min,然后取上清液通过Bradford法测定蛋白浓度。使用微波法进行蛋白酶切。蛋白样品在50μL的50mM碳酸氢铵溶液中溶解并且加入5mM DTT在95℃反应5min,随后在15mM的IAA存在下在黑暗处反应30分钟。最后使用测序级胰酶按照酶/底物1:50(质量比)的比例加入胰酶,并且在700W的微波下酶切15min。
2.4膜电喷雾电离质谱法(MESI-MS)分析
所有的MESI-MS实验通过Bruker HCT质谱仪(德国Bruker Daltonics有限公司)进行。
所采用膜电喷雾电离装置(MESI),如图1所示,包括:吸水部件1;透析膜2,位于吸水部件1上;导电部件3,设置于透析膜2。
导电部件3为向透析膜2施加高压电场的导体,其可以为但不限于金属导电夹子,例如可以为铜导电夹。
透析膜2均具有至少一尖端,即进样端,将该尖端正对质谱仪进样口,并使导电部件3、尖端、质谱仪进样口位于同一直线上,便于在质谱仪进样口实现样品的电喷雾。
透析膜2的尖端可以为一锐角、直角或钝角,其角度优选为40-150°,对透析膜2的具体形状没有限定,其可以为前部具有一尖端,后部呈圆弧形的不规则形状;也可以是规则的三角形,优选为等边三角形,边长可以为5-10mm,优选为7mm。
透析膜2可以为多层,例如两层、三层或更多层,依次叠置于吸水部件1上,且各层透析膜2的截留分子量依次增大,距离吸水部件1最远的透析膜的截留分子量最大。
优选采用包括双层透析膜的电喷雾离子源装置。
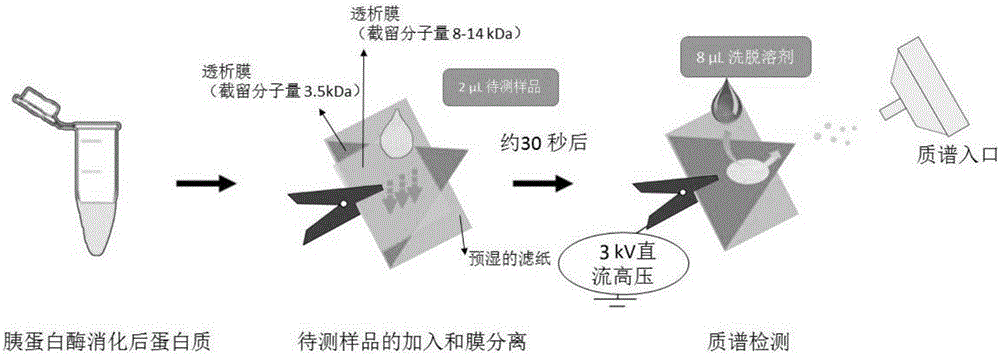
采用氮气为干燥气体(流速10L·min-1;温度150℃)。正离子模式,毛细管电压为-1.5kV。如图2所示,膜电喷雾电离质谱装置(MESI)为在一张预湿的滤纸上设置两层透析膜(第一 层截留分子量为8-14kDa,第二层为3.5kDa)。第二层透析膜的大小约为边长7mm的三角形。用金属夹将滤纸与膜固定于质谱进样口前端,三角形膜的尖端对准质谱入口,并与之保持约5mm的距离。两微升的待测样品溶液加入到膜上。等待约30s,以便待测溶液滤过透析膜,去除第一层膜并在第二层膜上加上3kV的直流电压。随后加入8μL的洗脱溶液(甲醇:水:甲酸体积比为60:40:0.1)。在高压电场及冲洗洗脱溶液的作用下,待测溶液向透析膜的前端运动,在前端的一角产生样品离子并形成喷雾。
3结果
3.1细菌耐药蛋白ArmA特异性肽段的选择
细菌耐药蛋白ArmA的理论酶切肽段通过在Exapasy(http://web.expasy.org/peptide_mass/)检索获得。采用BLAST算法验证理论酶切肽段在细菌中没有同源性。特异性肽段的选择需遵循以下几个原则:1)是ArmA蛋白特有的;2)有很高的质谱强度和离子化效率;3)无不稳定的氨基酸和胰蛋白酶漏切位点。
最后,本发明结果筛选确定,三个ArmA特异性进行了合成用于下一步实验:IHSSTNER(IR-8)、IIYHAYDIDR(IR-10)和TYDVVFLLK(TK-9)。
3.2膜电喷雾电离质谱法(MESI-MS)检测ArmA蛋白特异性肽段
首先,菌株信息需经过验证。其中,菌株携带或不携带armA基因采用PCR方法确认(图3A)。图3B表示表1中的其他10个菌株PCR检测armA基因的结果。图4记录了菌株的生长曲线(图4A)与曲线上各时间点的菌体总蛋白浓度(图4B)。根据目标肽段的最低检出限(LOD)和提取蛋白的浓度,可推测增菌所需的最短时间。在本发明涉及的示例菌株中,2h增菌即可产生足够量的ArmA用于MEIS-MS/MS检测。不同的菌株产生蛋白的能力不同,所以对不同的菌,最少培养时间也可能不同。不排除后续检测菌株增菌时长低于2h的情况。
图5为合成标准ArmA特异性肽段(1mM)的MESI-MS/MS分析:图5A ArmA来源的多肽(IHSSTNER)的母子离子对m/z 472.0→693.1;图5B ArmA来源的多肽(IIYHAYDIDR)的母子离子对m/z 639.7→752.1;图5C ArmA来源的多肽(TYDVVFLLK)的母子离子对m/z 549.2→833.2。这里采用二级质谱(MS/MS)对多肽做进一步的检测,图5A和5B表示,m/z 693.1和m/z 752.1都是肽段IR-8和IR-10通过二级质谱得到的y6+离子,基于此,为了准确检测ArmA蛋白的特异性肽段,选取肽段IR-8(m/z472.0→693.1)和IR-10(m/z 639.7→752.1)的母离子/子离子对作为分析对象。
MESI-MS使得质谱快速分析具有显著去除基质效应的能力,固而在本发明中,脱盐步骤可省略从而缩短了检测时间。将特异性肽段作为检测目标,间接检测ArmA而非直接检测 ArmA本身,使得可以巧妙的运用MESI-MS的透析膜去除样本中干扰分析的因素。其中,样品体系内残余的胰蛋白酶可通过第一层透析膜除去(MWCO 8-14kDa)。在胰蛋白酶消化过程中引入的盐和其他小分子可通过第二层透析膜(MWCO 3.5kDa)除去。
3.3方法学验证
本发明将从不携带armA基因的菌株(Ab-1and BL21)中提取所得蛋白的酶切肽段作为空白基质,用以考察添加该空白基质合成肽段的标准曲线线性度,LOD和LOQ。如表3所示,3个特异性肽段在5-1000,5-1000和1-1000fmol·μL-1的线性范围的相关系数(r2)为0.9939、0.9953和0.9938。肽段IR-8和IR-10的LOD为2fmol·μL-1,LOQ为5fmol·μL-1;肽段TK-9的LOD为1fmol·μL-1,LOQ为2fmol·μL-1。
采用质控样本(浓度10和50fmol·μL-1的合成肽段)考察方法精密度、准确度和回收率方法学的精密度用相对标准偏差(RSD)评价,准确度通过对每个掺入了空白基质的质控样本,评价计算出的浓度和实际浓度的比率来表征,回收率通过空白基质中已知的肽段量来计算。(表4)。
表3三个特异性肽段的线性范围、最低检出限和最低定量限
aLOD:最低检出限,SNR=5;bLOQ:最低定量限,SNR=15
表4MESI-MS/MS方法学精密度、准确度及回收率(n=5)
由此,本发明采用高低不同浓度的上述3个特异性肽段,经测定,本发明方法的精密度、准确度、回收率以及线性范围等均满足要求。
3.4统计分析
通过Matlab软件分析模拟环境样本的质核比m/z和相应离子的丰度数据。并且使用 SIMCA-P软件进行多元统计。使用主成分分析(PCA)和偏最小二乘法-判别分析(PLS-DA)构建了armA阳性和阴性组的模型。而通过PLS-DA的VIP(变量重要性在投影中的值)值的筛选可以表现出armA阳性和阴性的m/z的显著差异。
3.5和纸喷雾电离质谱法的比较
类似的,纸喷雾(PS)是将2μL的待测样品直接加在三角形层析纸上(规格为底部宽度6mm,高度6mm),在纸后端加4.5kV的直流电压,10μL的洗脱溶剂(甲醇/水/甲酸,50:50:0.1,v/v)加在待测样品处进行喷雾。图6A表示,对肽段标准品,膜喷雾和纸喷雾结果类似,然而对模拟环境样品,如图6B所示,膜喷雾的结果要大大优于纸喷雾的结果。
4模拟环境样品的快速测定
添加有鲍曼不动杆菌(MDR-ZJ06和Ab-1)以及大肠杆菌(A839和BL21)的模拟环境样品被用于模拟真实的卫生环境检测。环境样品的获得是在实验室通过拭子法从表面获得。经过2h的增菌培养后,肽段IR-8、IR-10和TK-9在armA阳性的模拟环境样品中均被检测到,而armA阴性的模拟环境样品未检出三个特异性肽段(图7A-7C)。
为进一步验证结论,选取了10组在模拟环境培养的菌株来进一步确定armA基因(表1中5-14号)。14组样本中包含7组ArmA阳性样本和7组ArmA阴性样本,随后将肽段IR-8、肽段IR-10和肽段TK-9的MS/MS信号谱图数据进行多元统计分析。如图8A所示,进过主成分分析(PCA),主成分1阐明了菌株数据的24.0%,主成分2阐明了数据的18.0%,通过主成分1和主成分2,阳性样本的MS/MS数据和阴性样本具有显著的差异性,这种差异性能使阳性和阴性样本显著地区分开来。图8B表示的是偏最小二乘法-判别分析(PLS-DA)法的VIP(变量重要性在投影中的值)数值图。以上的结果表明,m/z 417.8、m/z 639.7和m/z 549.2非常适合作为区分两种样本的变量,同时对模拟环境样本,肽段IR-8是更优的变量。
5对膜电喷雾电离条件的优化
本发明还对膜电喷雾直流电压的选择进行了实验和讨论。电压优化的范围为1~3kV。电压在低于1kV的条件下,难以形成喷雾;高于3kV,在本发明的条件下容易在空气中产生放电无法形成稳定而有效的喷雾。通过对峰强度的考察,在3kV的条件下可以产生高强度且稳定的喷雾(图9)。
由此可见,本发明对添加了携带或不携带armA基因的不同种细菌(鲍曼不动杆菌、大肠杆菌)的模拟环境样本进行检测,发现本发明的方法可达到较高的灵敏度与准确度,而且 本发明快速检测方法还可以拓展到对其它病原菌的其它耐药基因的检测。
虽然已经详细说明了本发明及其优点,但是应当理解在不超出由所附的权利要求所限定的本发明的精神和范围的情况下可以进行各种改变、替代和变换。而且,本申请的范围不仅限于说明书所描述的过程、设备、手段、方法和步骤的具体实施例。本领域内的普通技术人员从本发明的公开内容将容易理解,根据本发明可以使用执行与在此所述的相应实施例基本相同的功能或者获得与其基本相同的结果的、现有和将来要被开发的过程、设备、手段、方法或者步骤。因此,所附的权利要求旨在在它们的范围内包括这样的过程、设备、手段、方法或者步骤。
参考文献:
[1]A.P.Magiorakos,A.Srinivasan,R.B.Carey,Y.Carmeli,M.E.Falagas,C.G.Giske,S.Harbarth,J.F.Hindler,G.Kahlmeter,B.Olsson-Liljequist,D.L.Paterson,L.B.Rice,J.Stelling,M.J.Struelens,A.Vatopoulos,J.T.Weber,D.L.Monnet.Multidrug-resistant,extensively drug-resistant and pandrug-resistant bacteria:an international expert proposal for interim standard definitions for acquired resistance.Clin.Microbiol.Infect.2012,18,268.
[2]A.Y.Peleg,H.Seifert,D.L.Paterson.Acinetobacter baumannii:Emergence of a successful pathogen.Clin.Microbiol.Rev.2008,21,538.
[3]S.B.Levy,B.Marshall.Antibacterial resistance worldwide:causes,challenges and responses.Nat.Med.2004,10,S122.
[4]V.K.Geetha,T.Yugendran,R.Srinivasan,B.N.Harish.Plasmid-mediated quinolone resistance in typhoidal Salmonellae:A preliminary report from South India.Indian.J.Med.Microbiol.2014,32,31.
[5]D.Yong,M.A.Toleman,C.G.Giske,H.S.Cho,K.Sundman,K.Lee,T.R.Walsh.Characterization of a New Metallo-beta-Lactamase Gene,bla(NDM-1),and a Novel Erythromycin Esterase Gene Carried on a Unique Genetic Structure in Klebsiella pneumoniae Sequence Type 14from India.Antimicrob.Agents.Chemother.2009,53,5046.
[6]W.-H.Zhang,S.-Q.Ren,X.-X.Gu,W.Li,L.Yang,Z.-L.Zeng,Y.-H.Liu,H.-X.Jiang.High frequency of virulence genes among Escherichia coli with the bla(CTX-M)genotype from diarrheic piglets in China.Vet.Microbiol.2015,180,260.
[7]J.Bonnedahl,J.Stedt,J.L.Svensson,M.Drobni,B.Olsen.Comparison of Extended-Spectrumβ-Lactamase(ESBL)CTX-M Genotypes in Franklin Gulls from Canada and Chile.PLoS.One.2015,10,e0141315.
[8]Y.-Y.Liu,Y.Wang,T.R.Walsh,L.-X.Yi,R.Zhang,J.Spencer,Y.Doi,G.Tian,B.Dong,X.Huang,L.-F.Yu,D.Gu,H.Ren,X.Chen,L.Lv,D.He,H.Zhou,Z.Liang,J.-H.Liu,J.Shen.Emergence of plasmid-mediated colistin resistance mechanism MCR-1in animals and human beings in China:a microbiological and molecular biological study.Lancet.Infect.Dis.2015.
[9]G.F.Liou,S.Yoshizawa,P.Courvalin,M.Galimand.Aminoglycoside resistance by ArmA-mediated ribosomal 16S methylation in human bacterial pathogens.J.Mol.Biol. 2006,359,358.
[10]S.Shrestha,T.Tada,T.Miyoshi-Akiyama,H.Ohara,K.Shimada,K.Satou,K.Teruya,K.Nakano,A.Shiroma,J.B.Sherchand,B.P.Rijal,T.Hirano,T.Kirikae,B.M.Pokhrel.Molecular epidemiology of multidrug-resistant Acinetobacter baumannii isolates in a university hospital in Nepal reveals the emergence of a novel epidemic clonal lineage.Int.J.Antimicrob.Agents.2015,46,526.
[11]B.Nomanpour,A.Ghodousi,A.Babaei,H.Abtahi,M.Tabrizi,M.Feizabadi.Rapid,cost-effective,sensitive and quantitative detection of Acinetobacter baumannii from pneumoniapatients.Iran.J.Microbiol.2011,3,162.
[12]M.Lehtopolku,P.Kotilainen,P.Puukka,U.-M.Nakari,A.Siitonen,E.Eerola,P.Huovinen,A.J.Hakanen.Inaccuracy of the Disk Diffusion Method Compared with the Agar Dilution Method for Susceptibility Testing of Campylobacter spp.J.Clin.Microbiol.2012,50,52.
[13]S.Z.Xiao,L.Z.Han,H.Q.Chu,L.Zhao,X.Chen,Y.X.Ni.Detection ofaminoglycoside resistance related genes in multidrug-resistant Acinetobacter baumannii isolated from a single institute ofShanghai,China.Panminerva.Med.2015,57,49.
[14]X.Guo,B.B.Dillon,A.N.Ginn,A.M.Wiklendt,S.R.Partridge,J.R.Iredell.Simple multiplex real-time PCR for rapid detection ofcommon 16S rRNA methyltransferase genes.Diagn.Microbiol.Infect.Dis.2014,80,29.
[15]C.-J.Chang,J.-H.Lin,K.-C.Chang,M.-J.Lai,R.Rohini,A.Hu.Diagnosis ofβ-Lactam Resistance in Acinetobacter baumannii Using Shotgun Proteomics and LC-Nano-Electrospray Ionization Ion Trap Mass Spectrometry.Anal.Chem.2013,85,2802.
[16]N.C.e.H.Khennouchi,L.Loucif,N.Boutefnouchet,H.Allag,J.-M.Rolain.MALDI-TOF MS as a Tool To Detect a Nosocomial Outbreak ofExtended-Spectrum-beta-Lactamase-and ArmA Methyltransferase-Producing Enterobacter cloacae Clinical Isolates in Algeria.Antimicrob.Agents.Chemother.2015,59,6477.
[17]Z.Takats,J.M.Wiseman,B.Gologan,R.G.Cooks.Mass spectrometry sampling under ambient conditions with desorption electrospray ionization.Science 2004,306,471.
[18]R.B.Cody,J.A.Laramee,H.D.Durst.Versatile new ion source for the analysis of materials in open air under ambient conditions.Anal.Chem.2005,77,2297.
[19]H.Wang,J.Liu,R.G.Cooks,Z.Ouyang.Paper Spray for Direct Analysis of Complex Mixtures Using Mass Spectrometry.Angew.Chem.Int.Ed.Engl.2010,49,877.
[20]M.Zhang,F.Lin,J.Xu,W.Xu.Membrane Electrospray Ionization for Direct Ultrasensitive Biomarker Quantitation in Biofluids Using Mass Spectrometry.Anal.Chem.2015,87,3123.
序列表
<110> 中国疾病预防控制中心传染病预防控制所、北京理工大学
<120> 细菌耐药蛋白ArmA的定性、定量检测方法
<130> YRI20160019
<160> 5
<170> PatentIn version 3.3
<210> 1
<211> 8
<212> PRT
<213> 人工序列
<400> 1
Ile His Ser Ser Thr Asn Glu Arg
1 5
<210> 2
<211> 10
<212> PRT
<213> 人工序列
<400> 2
Ile Ile Tyr His Ala Tyr Asp Ile Asp Arg
1 5 10
<210> 3
<211> 9
<212> PRT
<213> 人工序列
<400> 3
Thr Tyr Asp Val Val Phe Leu Leu Lys
1 5
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<400> 4
atggataaga atgatgttgt t 21
<210> 5
<211> 22
<212> DNA
<213> 人工序列
<400> 5
tttctgaaat ccacgagtaa ta 22
- 还没有人留言评论。精彩留言会获得点赞!