一种眼镜蛇神经毒素的毛细管电泳体内检测方法与流程
本发明涉及一种眼镜蛇神经毒素的毛细管电泳体内检测方法,具体来说涉及一种采用高选择性、高敏感性的毛细管电泳结合激光诱导荧光检测器检测眼镜蛇神经毒素的方法。
(二)
背景技术:
眼镜蛇神经毒素(Neurotoxin,NT)——-种从中华眼镜蛇(Naja naja atra)毒液中分离得到的水溶性碱性多肽(C.M.Barber.Alpha neurotoxins[J].Toxicon,2013,66:47–58.),主要通过与中枢中脑导水管周围灰质(Periaqueductal Gray,PAG)的胆碱能受体结合,发挥镇痛疗效,其效价强度比同等剂量的吗啡高数十倍,而且无胃肠道不良反应,无耐受性和成瘾性,是一种新型的替代性镇痛药物,主要用于治疗癌痛和各种慢性、顽固性疼痛等,现已有肌内注射剂上市,商品名为科博肽注射液。
NT作为一种有毒药物,为避免发生呼吸抑制等副作用,剂量需要严格控制,NT具有给药量小,血药浓度低和易受内源性物质干扰等特点,使其体内动力学的研究面临很多挑战:由于NT给药量小,体内血药浓度很低,现有技术难以直接检测出血样中的NT浓度,或者即使检测出来,检测灵敏度也很低,难以进行后续药动学研究。因此建立高效敏感的NT体内检测方法具有重要意义。目前,用于NT等蛋白多肽类药物体内检测方法主要有免疫学分析法、同位素标记示踪法、LC-MS/MS,现有的NT检测方法由于安全性、准确性、前处理繁琐等问题,一定程度上不能满足NT体内检测等的需求,应用受到限制(L.Bailly-Chouriberry.Identification ofα-Cobratoxin in Equine Plasma by LC-MS/MS for Doping Control[J].Anal.Chem.,2013,85:5219–5225)。由于毛细管电泳具有灵敏度高、特异性强和准确度高的特点,并且特别适合蛋白多肽类药物的分析,另外,对NT进行衍生化,采用激光诱导荧光检测器(LIF)进行检测,可以极大地提高灵敏度。本实验旨在建立一种高选择性、高敏感性的神经毒素毛细管电泳体内检测方法,并对其进行了考察。
(三)
技术实现要素:
本发明目的是克服上述现有方法存在的缺陷,为避免前处理、检测灵敏度和实验人员安全性问题的影响,提供一种高选择性、高敏感性的神经毒素体内毛细管电泳检测方法,为神经毒素体内药物代谢动力学研究提供准确的数据支持。
本发明采用的技术方案是:
一种眼镜蛇神经毒素的毛细管电泳体内分析方法,所述方法包括以下步骤:
(1)取含有FITC-NT的待测血浆样品,进样进行高效毛细管电泳,激光诱导荧光检测器检测,获得待测样品的电泳图谱;所述高效毛细管电泳的条件为:以CEofixTM MEKC试剂盒为缓冲液,分离电压为20kV,温度为24℃,检测波长为激发波长488nm,发射波长520nm;
(2)建立FITC-NT的标准曲线方程,根据其标准曲线方程以及步骤(1)所得的待测样品的电泳图谱中FITC-NT的峰面积,计算出待测样品中FITC-NT的浓度。
所述FITC-NT代表荧光单标记的眼镜蛇神经毒素,来自浙江中医药大学中药制剂实验室,可根据专利申请号201410566748.8公开的方法制备得到。FITC-NT为NT经过荧光单标记制得,1分子FITC-NT即对应1分子NT,两者的摩尔浓度一致,因此,可用FITC-NT代替NT作为目标进行体内检测,研究神经毒素体内药物代谢动力学。
进一步,所述步骤(1)中,所述高效毛细管电泳中采用的毛细管柱为有效长度为55cm的非涂层毛细管柱,内径75um。
进一步,所述步骤(1)中,所述高效毛细管电泳采用压力进样,6.9kPa,10s。
所述步骤(1)中,进样量优选20μL。
进一步,所述步骤(1)中,所述高效毛细管电泳开机后用0.1mol·L-1氢氧化钠溶液冲洗5min,CEofixTM MEKC试剂盒涂层冲洗5min,每次进样前用CEofixTM MEKC缓冲液冲洗毛细管柱3min,每针运行20min,每针检测后用CEofixTM MEKC试剂盒缓冲液冲洗5min,分析结束后用0.1mol·L-1氢氧化钠溶液和水各冲洗5min。
所述步骤(2)中,所述FITC-NT的标准曲线方程可按以下方法获得:取FITC-NT标准贮备液逐级稀释,配制一系列不同浓度的标准工作溶液,用SD大鼠空白血浆配制成不同FITC-NT浓度的血浆标准添加样品,按照步骤(1)的方法进行检测,获得血浆标准添加样品的电泳图谱,以FITC-NT浓度为横坐标,相应的电泳图谱中的峰面积为纵坐标进行线性回归,绘制标准曲线方程。
本发明提供的眼镜蛇神经毒素的毛细管电泳体内分析方法可用于进行神经毒素的体内药代动力学研究,由于FITC-NT体内检测灵敏度高,检测限很低,在血浆中可以准确定量,且摩尔浓度和NT保持一致,因此可代替NT进行体内药代学研究。具体的,可对大鼠进行FITC-NT的尾静脉和肌肉注射,测定给药后大鼠血浆中FITC-NT的浓度,研究FITC-NT的药代动力学特征。
本发明还提供一种利用FITC-NT进行神经毒素的体内药代动力学参数检测的方法,所述方法包括以下步骤:
(A)对大鼠进行FITC-NT的静脉和/或肌肉注射,注射后在不同时间采血,离心出血浆,血浆样品在-20℃冷冻保存直至测试;
(B)取给药后不同时间的血浆样品,作为待测样品进样进行高效毛细管电泳,激光诱导荧光检测器检测,获得待测样品的电泳图谱;所述高效毛细管电泳的条件为:以CEofixTM MEKC试剂盒为缓冲液,分离电压为20kV,温度为24℃,检测波长为激发波长488nm,发射波长520nm;
(C)建立FITC-NT的标准曲线方程,根据其标准曲线方程以及步骤(B)所得的待测样品的电泳图谱中FITC-NT的峰面积,计算出待测样品中FITC-NT的浓度;
(D)以时间为横坐标,血浆样品中的FITC-NT浓度为纵坐标,绘制FITC-NT的血药时间曲线,获得体内药代学参数。
所述步骤(A)中,注射剂量不得超过半数致死量。
本发明以毛细管电泳结合激光诱导荧光检测器(CE-LIF)对荧光单标记的神经毒素(FITC-NT)进行体内分析方法的建立,从标准曲线、准确度、日内精密度、日间精密度、稳定性、检测限对所述体内分析方法进行方法学的考察,结果为:FITC-NT在0.010~1.0μg·mL-1范围内呈良好的线性关系,检测限为0.8nmol·L-1(S/N=3),日内精密度RSD≤2.2%,日间精密度RSD≤6.1%,准确性RR在93.3%–106.1%之间,稳定性良好,均符合方法学的要求。
本发明提供的荧光单标记的神经毒素(FITC-NT)的体内分析方法,准确度高,精密度高、稳定性好,对体内血样中的神经毒素能够快速准确的检测,检测灵敏度高,检测限很低,能够准确定量检测血样中极其微量的FITC-NT成分,可用于神经毒素的体内药物代谢动力学研究,为其提供准确的数据支持。
附图说明
图1为FITC-NT血浆样品专属性电泳图,图1中,(a)曲线为空白血浆样品,(b)曲线为加入FITC-NT的血浆样品,(c)曲线为收集大鼠给药1h之后的血浆样品。
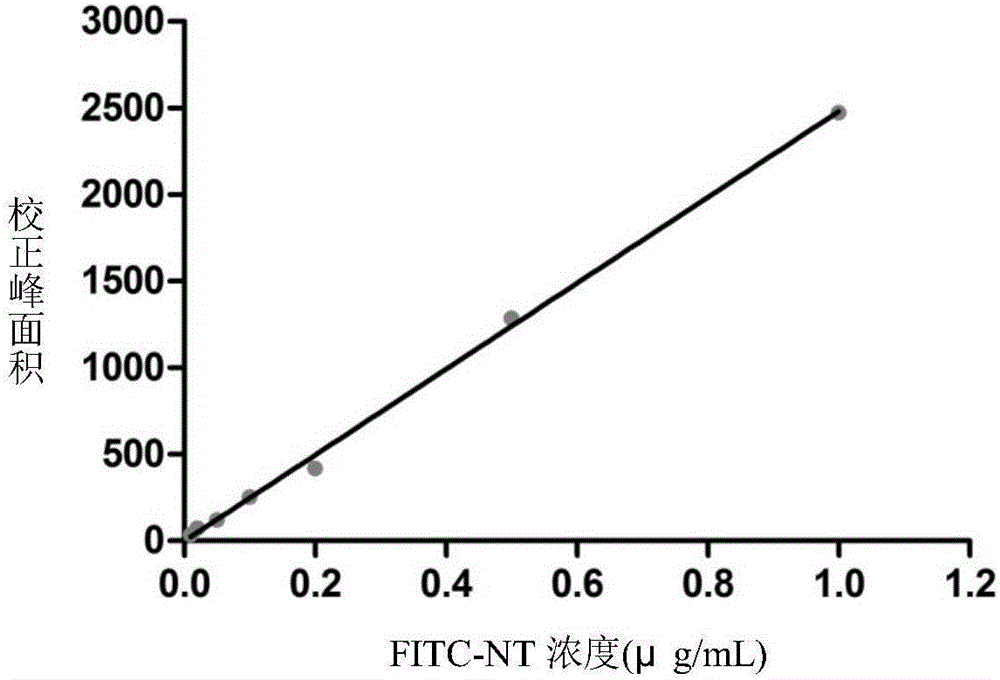
图2为FITC-NT血浆样品标准曲线图。
图3为FITC-NT血浆样品迁移时间重复性散点图。
图4为大鼠分别静脉注射和肌肉注射FITC-NT之后的药时曲线,图中虚线曲线代表静脉注射;实线曲线代表肌肉注射。图中右上角小图为大图的虚线框中的放大图。
(四)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:各参数的优化
1仪器与试药
1.1仪器
BECKMAN P/ACE MDQ型高效毛细管电泳仪(美国Beckman公司);
未涂层石英毛细管柱(75μm×50cm,河北永年锐沣色谱器件有限公司);
Optima Max超速低温离心机(美国Beckman公司);
CP225D型电子分析天平(德国Sartorius公司)。
1.2试剂
荧光单标记的眼镜蛇神经毒素(FITC-NT)(纯度>99.29%),浙江中医药大学中药制剂实验室(专利申请号20140566748.8);
CEofixTM MEKC试剂盒(北京博思雅生化技术研究院)(US Patent no.5,611,903);
其余试剂均为国产分析纯。
2方法与结果
2.1对照品贮备液的配制
精密称取FITC-NT对照品0.50mg,置10.0mL量瓶中,加水溶解并稀释至刻度,摇匀,即得FITC-NT对照品储备液(质量浓度为50μg·mL-1)。2.2样品预处理步骤
取静脉血装样本,置于0.5mL离心管(加肝素抗凝)中,以转速3500r/min离心l0min后,分离血浆。保存于-80℃冰箱。血浆样本置于37℃水浴下解冻后,吸取90ul血浆,加入10ul配制好的FITC-NT溶液(50ug/mL),祸旋混匀后取 20uL进样分析。
2.3电泳条件
缓冲液:CEofixTM MEKC试剂盒;分离电压:20kV;温度:24℃;检测波长:激发波长:488nm,发射波长520nm。进样条件:采用压力进样,6.9kPa,10s。开机后用0.1mol·L-1氢氧化钠溶液冲洗5min,CEofixTM MEKC试剂盒涂层冲洗5min,每次进样前用CEofixTM MEKC缓冲液冲洗毛细管柱3min,每针运行20min,进样检测完成后用CEofixTM MEKC试剂盒缓冲液冲洗5min,最后分析结束后用0.1mol·L-1氢氧化钠溶液和水各冲洗5min。
2.4专属性的考察
图1为FITC-NT血浆样品专属性电泳图,图1中,(a)曲线为空白血浆样品,(b)曲线为加入FITC-NT的血浆样品,(c)曲线为收集大鼠给药1h之后的血浆样品。比较空白血浆和FITC-NT血浆样品电泳图,证实了该体内检测方法的专属性,在电泳图中未检测到其他内源物质或者是代谢物质等干扰物质。
2.5标准曲线绘制及检测限
FITC-NT标准贮备液逐级稀释配制一系列标准工作溶液,精密量取适量,用SD大鼠空白血装配制成FITC-NT的血浆标准添加样品,按前述预处理方法处理后,进行CE-LIF分析,以峰面积(y)对药物浓度(x)进行线性回归,图2为FITC-NT的血浆样品标准曲线图,得FITC-NT标准曲线方程为:y=2481x-0.4254,R2=0.9981,FITC-NT在0.010~1.0μg·mL-1范围内呈良好的线性关系,检测限为0.8nmol·L-1(S/N=3)。
2.6稳定性考察
稳定性考察包括短期稳定性和长期稳定性的考察。其中短期稳定性考察包括SD大鼠血装标准添加样品室温放置稳定性以及冻融循环稳定性,长期稳定性包括在-80℃保存25天的稳定性。配制含FITC-NT低、中、高三种不同浓度的血浆标准添加质量控制样品,每个浓度各6份,按照不同考察项目的要求操作,仪器分析后,计算各生物样品的测定浓度,测得稳定性符合方法学的要求。FITC-NT血浆样品不同储存条件下稳定性试验结果如表1所示。
表1FITC-NT血浆样品不同储存条件下稳定性试验结果(n=6)
2.7精密度和准确度考察
配制含FITC-NT低、中、高三种不同浓度的血浆标准添加生物样品,每个浓度各6份,按前述样品预处理步骤操作,通过标准曲线方程,计算各生物样品的测定浓度。FITC-NT血浆样品精密度和准确度试验结果如表2所示,统计得日内精密度RSD≤2.2%、日间精密度RSD≤6.1%及准确度RR在93.3%–106.1%之间。迁移时间和生物样品的峰面积的重复性证实CEofixTM MEKC涂层的使用优化了毛细管电泳的冲洗过程和电流组成。图3为FITC-NT血浆样品迁移时间重复性散点图,可见在不同进样次数下,检测样品的峰面积数据变化不大,表明检测不受进样次数的干扰,精密度和准确度好。
表2FITC-NT血浆样品精密度和准确度试验结果(n=6)
2.8检测方法的药代动力学应用
应用上述研究中建立的毛细管电泳检测方法分别对大鼠进行FITC-NT的尾静脉和肌肉注射,测定给药后大鼠血浆中FITC-NT的浓度,研究FITC-NT的药代动力学特征。
12只SD雄性大鼠(200-250g)随机分成两组,实验之前至少禁食12h以上,但可以自由饮水。用pH 7.4的PBS缓冲液将FITC-NT溶液稀释,6只SD大鼠尾静脉注射注射剂量为0.06mg/kg。其余 6只SD大鼠肌肉注射注射剂量为0.12mg/kg,注射后第5min、10min、20min、30min、1h、2h、3h、6h、12h、24h从大鼠眼眶采血约0.5mL,置于含有少量肝素钠溶液的离心管中,并立即离心出血浆.血浆样品在-20℃冷冻保存直至测试。注射FITC-NT大鼠的血浆样品,采用毛细管电泳法测定血浆样品中FITC-NT的浓度,并绘制药时曲线。图4为大鼠分别静脉注射和肌肉注射FITC-NT之后的药时曲线,图中虚线曲线代表静脉注射;实线曲线代表肌肉注射。图中右上角小图为大图的虚线框中的放大图。大鼠进行FITC-NT尾静脉和肌肉注射后的药动学参数如表3所示。
表3大鼠进行FITC-NT尾静脉和肌肉注射后的药动学参数(n=6)
- 还没有人留言评论。精彩留言会获得点赞!