一种油佐剂疫苗的快速定性定量检测方法与流程
本发明涉及口蹄疫疫苗检测技术领域,具体涉及一种油佐剂疫苗的快速定性定量检测方法。
背景技术:
现有的疫苗质量标准中规定效力检验必须采用本动物进行检验,由于国家实行100%的强化免疫政策,很难选出易感的检验用动物,而且动物攻毒对实验设施要求高(BSL3级实验室)、耗时长(一个月以上)、资金花费大。如果采用血清中和试验选择易感动物,在技术上难以排除具有细胞免疫的非易感动物,在检验实际中经常发生检验数据不规律的问题,影响检验的准确性。因此口蹄疫疫苗尤其是用于牛的疫苗的质量检测一直困扰着兽药监测部门和相关生产企业。因此需要尽快研制体外检验技术,代替现有的本动物试验。
当前国家对疫苗的检验正逐步过渡到对疫苗内抗原的检测,而当前较为普遍的方法为疫苗破乳后对抗原进行检测,通过将疫苗进行破乳处理,使抗原转移至水相中,继而对其进行后续的检测分析。众所周知,疫苗是由抗原与佐剂以一定比例、按特定程序乳化而成的,然而佐剂却为疫苗破乳检测带来了巨大障碍。
由于疫苗乳化过程中所使用的油佐剂中成分复杂,含有表面活性剂,免疫增强剂等物质存在,破乳后的水相中往往会含有上述杂质和破乳剂,行业内并没有能够去除上述杂质和破乳剂的方法,而杂质及破乳剂等还会大大影响其后的检测过程,造成信号掩盖或干扰,压低了抗原信号的强度,甚至无法有效检测到其中的抗原,由于其中杂质的随机分配性,造成其检测方法的重复性不佳,同时增加了仪器维护成本。在疫苗行业内,如何对油佐剂疫苗进行破乳并对疫苗内成分进行检测和鉴定是业内公认的技术难点,由于油佐剂疫苗成分复杂,其中又含有大量的表面活性剂及免疫增强剂等物质,会对所有检测方法造成干扰,甚至无法检测,不能反映出疫苗内抗原的真实状态。
虽然业内已有破乳方法,但其效率和效果均不佳,传统的破乳方法破乳后会有种种问题,例如破乳不完全、水相和油相分界不清晰、水相中检测不到抗原等问题一直困扰着业界。如何去寻找一种高效的破乳方法成了业内亟待解决的问题。
ZIPTIP方法为一种简易的质谱前除盐的方法,在分析检测中用于盐类物质的去除。现有技术中尚未有将该方法用于抗原纯化的报道。
技术实现要素:
针对现有技术中的缺陷,本发明提供了一种油佐剂疫苗的快速定性定量检测方法。
本发明的目的是通过以下技术方案实现的:
本发明提供了一种油佐剂疫苗的快速定性定量检测方法,包括以下步骤:
将油佐剂疫苗破乳后,所得水相抗原样品进行ZIPTIP纯化,纯化后的样品进行定性定量检测;
所述破乳剂包括有机溶剂与酸的混合物,所述有机溶剂选自乙腈、正丁醇、苯甲醇、丁基二乙二醇、乙醇中的一种,所述酸选自盐酸、乙酸、甲酸、三氟乙酸中的一种。取水相经液相色谱检测,抗原回收率可达90%以上。
优选地,破乳剂中有机溶剂选自乙腈、乙醇中的一种,酸选自三氟乙酸、盐酸中的一种。
优选地,油佐剂疫苗与破乳剂按体积比9:1~5:5进行混合。破乳剂含量过高会增加后续对水相样品冻干或浓缩的处理时间,过低则无法破乳。
优选地,所述破乳剂中酸与有机溶剂的体积比为(0.05~0.5):100。
优选地,所述破乳方法还包括将水相抗原样品进行冻干或浓缩处理,即得抗原样品;所述冻干的条件为:-80~-50℃温度下真空冷冻12~18h。
优选地,所述ZIPTIP纯化的具体步骤如下:
A1.使用50%ACN吸排活化ZIPTIP;
A2.吸取样品吸排数次;
A3.使用0.05%TFA水吸排清洗TIPTIP;
A4.使用含0.05%TFA的ACN洗脱样品,即可。
优选地,所述纯化后的样品进行冻干或浓缩。
优选地,采用电泳后染色的方法进行抗原样品的定量定性检测。
采用本发明的破乳方法,由于抗原回收率高,得到的抗原样品无需进一步纯化,即可直接用于抗原的定量定性检测。
现有技术相比,本发明具有如下的有益效果:
1)本发明提供的破乳方法破乳能力更强,能保证抗原主要分布于水相中,且水相与油相能完全分离,能真实反应出疫苗内有效抗原的含量及质量,抗原回收率可达90%以上。
2)本方法采用ZIPTIP纯化方法,可有效去除抗原样品中的杂质,通过特异性吸附抗原,除去复杂样品中的表面活性剂等杂质,同时其洗脱后得到的样品可以直接用于高精度仪器的分析检测。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
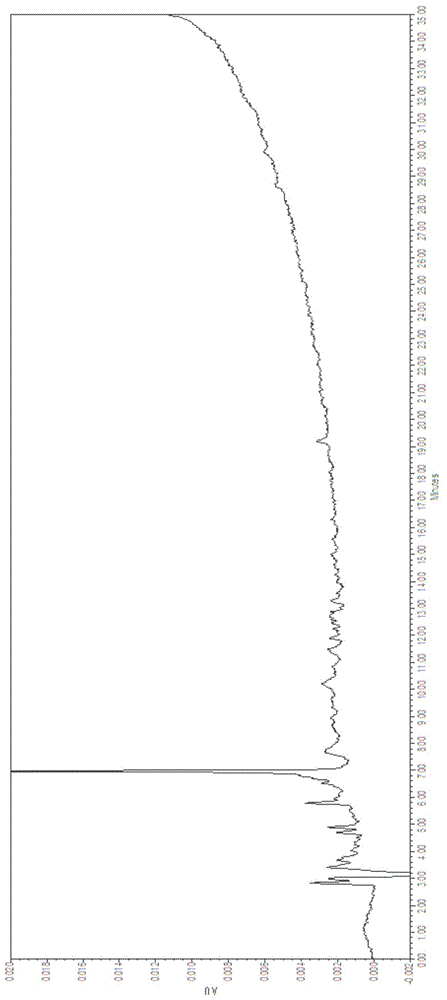
图1为对比例1的方法破乳后水相中抗原浓度HPLC检测图谱。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
实施例1
本实施例提供了一种油佐剂疫苗的快速定性定量检测方法,采用以下步骤:
1)样品破乳将按照如下方法破乳处理:
将待检疫苗(市售的猪口蹄疫疫苗苗,浓度为75ug/ml)与破乳剂混合,所述破乳剂中有机溶剂选用乙腈,酸选用三氟乙酸,乙腈与三氟乙酸的体积比为100:0.05。取8ml待检疫苗置于离心管内,疫苗与破乳剂以体积比8:2混合,震荡混匀,在4℃条件下,以3000G离心15分钟,离心后用10ml注射器小心抽取下层水相。
2)样品的ZIPTIP纯化
2.1将步骤1)制得的水相抗原样品冻干或浓缩,使用ZIPTIP进行纯化,其步骤如下:
1.使用50%ACN吸排活化ZIPTIP;
2.吸取样品吸排数次;
3.使用0.05%TFA水吸排清洗TIPTIP;
4.使用含0.05%TFA的ACN洗脱样品。
3)定性定量检测
将通过步骤2)纯化后的样品体积为破乳后水相的1/10(即0.6ml),即浓度提高10倍,进行电泳后染色,分析其条带,与其理论分子量进行对比,抗原条带出现在理论分子量大小区域,可对其初步定性,由条带灰度值可知其蛋白量约为7-10ug,上样量为10ul样品,其上样样品浓度为0.7-1mg/ml,折算其浓缩倍数(除以10)、破乳后体积变化(除以2)及稀释效应(除以66.67%)其原始浓度约为53-75ug/ml,与液相色谱测得浓度68.78ug/ml结果相符。
本实施例采用市售的猪口蹄疫合成肽疫苗与理论抗原浓度标准进行对照,采用液相色谱进行分析。对疫苗中理论抗原浓度的HPLC检测图谱样品出峰位置进行积分,其积分信息如表1所示,样品中抗原含量以积分峰面积的形式体现,其积分峰面积为2738690。对本实施例破乳方法破乳后得到的水相中抗原样品浓度的HPLC检测图谱样品出峰位置进行积分,其积分信息如表2所示,样品中抗原含量以积分峰面积的形式体现,其积分峰面积为1674252。经对比分析,使用本实施例方法抗原回收率为91.7%,即破乳效率91.7%,相比于现有方法,抗原回收率大大提高。
表1
表2
注:疫苗由佐剂与抗原乳化,其佐剂与抗原的体积比为1:1,因此破乳后得到的水相为待检疫苗体积的50%,由于本实施例中破乳剂与水互溶,因此经本发明方法破乳后其水相体积较疫苗内水相多出破乳剂的体积,即稀释作用,因此本实施例中水相较理论水相(4ml)增多50%(2ml),本实施例中破乳得到的水相检测的积分结果应计算稀释效应,即检测积分结果除以66.67%。
实施例2
本实施例提供了一种油佐剂疫苗的快速定性定量检测方法,采用以下步骤:
1)样品破乳将按照如下方法破乳处理:
将待检疫苗与破乳剂混合,所述破乳剂中有机溶剂选用乙腈,酸选用三氟乙酸,乙腈与三氟乙酸的体积比为100:0.05。取5ml待检疫苗与破乳剂以体积比5:5混合,震荡混匀,在4℃条件下,以3000G离心15分钟,得水相抗原样品。
采用本实施例的方法对口蹄疫疫苗进行破乳,抗原回收率为90.3%。
2)样品的ZIPTIP纯化
2.1将步骤1)制得的水相抗原样品冻干或浓缩,使用ZIPTIP进行纯化,其步骤如下:
1.使用50%ACN吸排活化ZIPTIP;
2.吸取样品吸排数次;
3.使用0.05%TFA水吸排清洗TIPTIP;
4.使用含0.05%TFA的ACN洗脱样品。
3)定性定量检测
将通过步骤2)纯化后的样品体积为破乳后水相的1/10(即0.75ml),即浓度提高10倍,进行电泳后染色,分析其条带,与其理论分子量进行对比,抗原条带出现在理论分子量大小区域,可对其初步定性,由条带灰度值可知其蛋白量约为3-5ug,上样量为10ul样品,其上样样品浓度为0.3-0.5mg/ml,折算其浓缩倍数(除以10)、破乳后体积变化(除以2)及稀释效应(除以33.33%)折算其原始浓度约为45-75ug/ml,与液相色谱测得浓度67.73ug/ml结果相符。
实施例3
本实施例提供了一种油佐剂疫苗的快速定性定量检测方法,采用以下步骤:
1)样品破乳将按照如下方法破乳处理:
将待检疫苗与破乳剂混合,所述破乳剂中有机溶剂选用乙醇,酸选用盐酸,乙醇与盐酸的体积比为100:0.33,取7ml待检疫苗与破乳剂以体积比7:3混合,震荡混匀,在4℃条件下,以3000G离心15分钟,得水相抗原样品。
采用本实施例的方法对口蹄疫疫苗进行破乳,破乳效率为93.5%。
2)样品的ZIPTIP纯化
2.1将步骤1)制得的水相抗原样品冻干或浓缩,使用ZIPTIP进行纯化,其步骤如下:
1.使用50%ACN吸排活化ZIPTIP;
2.吸取样品吸排数次;
3.使用0.05%TFA水吸排清洗TIPTIP;
4.使用含0.05%TFA的ACN洗脱样品。
3)定性定量检测
将通过步骤2)纯化后的样品体积为破乳后水相的1/10(即0.65ml),即浓度提高10倍,进行电泳后染色,分析其条带,与其理论分子量进行对比,抗原条带出现在理论分子量大小区域,可对其初步定性,由条带灰度值可知其蛋白量约为7-10ug,上样量为10ul样品,其上样样品浓度为0.7-1mg/ml,折算其浓缩倍数(除以10)、破乳后体积变化(除以2)及稀释效应(除以53.85%)折算其原始浓度约为65-93ug/ml,与液相色谱测得浓度70.13ug/ml结果相符。
对比例1
本对比例提供了一种口蹄疫疫苗的破乳方法,与实施例1的方法基本相同,不同之处仅在于:本对比例破乳剂采用正丁醇。
采用本对比例的方法对口蹄疫疫苗进行破乳,该对比例采用正丁醇破乳后水相中抗原浓度HPLC检测图谱如图1所示,从该图中可看出,在抗原理论保留时间(23-28min)内并未检出抗原,说明样品中含有的抗原量极低,即本对比例中的抗原回收率基本为零,其破乳效率基本为零,破乳效率为0%。进行ZIPTIP纯化后,进行定性定量检测,无法获得目标蛋白条带。
对比例与实施例的结果说明,合成肽疫苗使用传统的正丁醇破乳方法并不能使得抗原分布于水相中,水相中能检测到的抗原量极低,并不能满足检测要求,而本发明方法破乳后水相中抗原量达到90%以上,足够满足后续纯化检测要求。
本发明具体应用途径很多,以上所述仅是本发明的优选实施方式。应当指出,以上实施例仅用于说明本发明,而并不用于限制本发明的保护范围。对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进,这些改进也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!